Contents
摘要
狂犬病是一种人畜共患病毒性疾病,可通过接种疫苗预防。有效的控制策略应遵循“同一个健康”概念,因为从动物源头针对人畜共患病原体是保护人类健康的最有效和最具成本效益的方法。本研究的目的是开发和评估两种基于非复制病毒载体的第三代抗狂犬病疫苗,MVA 和 Ad5,两者都表达狂犬病病毒 (RABV) 糖蛋白 (MVA-RG 和 Ad-RG)。MVA-RG 是使用我们实验室开发的平台生产的,而 Ad-RG 是使用商业试剂盒生产的。在小鼠脑内 (IC) RABV 攻击模型中评估了对狂犬病的保护作用。我们的结果表明,两种载体都提供了对 RABV 的保护。以两种同源剂量给药的 MVA-RG 和 Ad-RG 分别对 RABV 攻击提供 60% 和 60-100% 的保护。存活率受病毒载体、剂量和免疫方案的影响。值得注意的是,据我们所知,我们的研究首次报告了在同源免疫方案中使用非复制性 Ad5 对 IC RABV 攻击具有 100% 的保护作用。这些有希望的结果支持未来在目标动物中对这种候选疫苗的评估。
1. 引言
狂犬病病毒 (RABV) 是导致哺乳动物急性脑炎和死亡的严重人畜共患病的病原体。该病毒属于弹状病毒科(Rhabdoviridae)的丽沙病毒属(Lyssavirus),该科是一组具有单链负链RNA基因组的包膜病毒[1]。病毒基因组长度约为 12,000 bp,编码五种结构蛋白:跨膜糖蛋白 (G),病毒的主要抗原;基质蛋白 (M),位于病毒粒子的内侧;核蛋白 (N),与 M 和基因组 RNA 结合;磷蛋白(P 或 NS);和聚合酶 (L) [1]。跨膜糖蛋白是病毒表面唯一存在的蛋白质,包含 CD4+ 和 CD8+ T 细胞识别的表位,是中和抗体 (NA) 的主要靶标 [2,3]。
狂犬病可以通过疫苗接种来预防,其控制应遵循“同一个健康”的概念。从陆生动物源头针对这种人畜共患病原体是保护人类的最有效和最具成本效益的策略。RABV 灭活疫苗广泛用于人类、伴侣动物和牲畜,具有安全性和有效性。然而,它们需要定期应用以预防性方式维持保护性免疫力,这既昂贵又耗时。另一方面,在一些国家,含有 RABV 减毒毒株的诱饵用于野生动物的疫苗接种(在 [4] 中综述)。在这些情况下,有必要证明这些毒株不会对目标物种或非目标物种造成任何不利影响。为了克服这些不便,已经开发了几种重组病毒载体疫苗,并针对伴侣动物、野生动物和牲畜进行了评估,这些疫苗的功效水平各不相同。然而,只有少数获得了许可(在 [4,5] 中进行了审查)。
两种复制性病毒载体狂犬病疫苗已上市。第一个是 30 多年前获得的,基于表达 RABV ERA 毒株糖蛋白的痘苗病毒 (VACV) 哥本哈根毒株 [6]。该疫苗目前作为 Raboral V-RG®(勃林格殷格翰动物保健公司,德国莱茵河畔殷格翰)商业化,用于预防北美和欧洲的野生动物狂犬病(http://www.raboral.com/,于 2024 年 12 月 20 日访问)。此外,一种获得许可的野生动物腺病毒载体疫苗 ONRAB®(安大略狂犬病疫苗诱饵,Artemis Technologies Inc.,加拿大安大略省圭尔夫)由携带 ERA 毒株 RABV G 蛋白基因的复制病毒载体 5 型腺病毒组成(AdRG1.3,[7])。这种疫苗目前在加拿大用于控制狐狸、浣熊和臭鼬的狂犬病(https://www.ontario.ca/page/wildlife-rabies-outbreaks-and-control-operations,于 2024 年 12 月 20 日访问)。此外,PUREVAX® (Boehringer Ingelheim) 是一种基于金丝雀痘病毒的非复制性狂犬病疫苗,可用于猫。
选择非复制性病毒载体疫苗来开发用于人类、伴侣动物和牲畜的生物技术疫苗,以确保人类的安全。改良牛痘安卡拉病毒 (MVA) 由于其安全性、诱导体液和细胞免疫反应的能力以及内在的佐剂特性,构成了开发合理设计的病毒载体疫苗的绝佳平台 [8,9]。研究人员已广泛使用 MVA 作为人用和兽用疫苗的病毒载体 [10]。同样,非复制性腺病毒 (Ad) 是有效的疫苗平台,因为它们会诱导有效的先天性和适应性免疫反应,包括抗体和 CD8+ T 细胞反应。它们的优点包括构建重组腺病毒的成熟和简单的技术,以及在体外实现高病毒滴度的能力[11,12]。虽然 MVA 和 Ad 载体在临床前和临床试验中被广泛评估为疫苗,但第一种获准在人类中广泛使用的病毒载体疫苗是在 COVID-19 大流行期间。这些疫苗基于非复制性腺病毒 26 (Ad26)、复制缺陷型人腺病毒 5 型 (Ad5) 或改良黑猩猩腺病毒 (ChAdOx1) [13]。
为了获得安全有效的第三代狂犬病疫苗,在本研究中,我们基于表达 RABV 糖蛋白 (RG) 的 MVA 和 Ad5 生成了两种非复制性病毒载体。在小鼠脑内攻击模型中评估了重组病毒 MVA-RG 和 Ad-RG 抵御 RABV 的能力。
2. 材料和方法
2.1. 细胞系和病毒储液
改良的安卡拉痘苗病毒 (MVA) 在原代鸡胚成纤维细胞 (CEF) 培养物中以低感染复数 (MOI: 0.01) 培养。感染后 5 d 冷冻细胞和上清液。人腺病毒 5 型 ΔE (Ad5) 病毒在用人腺病毒 5 型 (HEK293A) 的 E1 区转化的人胚胎肾细胞中繁殖。这些细胞和上清液在感染 2 天后被冷冻。经过两次冻融循环后,澄清病毒储液以去除细胞碎片,然后超速离心以浓缩病毒。将病毒沉淀重悬并通过 25% v/v 蔗糖垫进行超速离心。如其他处所述,使用 CEF 或 HEK293A 细胞中的噬菌斑测定进行病毒滴定 [14]。携带编码绿色荧光蛋白 (GFP, MVA-GFP) 和表达 Ad 的 GFP (Ad-GFP) 基因的重组 MVA 分别由 M. Gherardi 博士 (Facultad de Medicina, Universidad de Buenos Aires) 和 M. Pérez Filgueira 博士 (Instituto de Virología, IVIT, UEDD INTA-CONICET) 提供。
狂犬病病毒株攻击病毒标准品 (RABV CVS) 适用于在 Vero 细胞培养中增殖,由 Servicio de Vacuna Antirrábica (SVAR) ANLIS “Dr. Carlos G. Malbrán” 提供。通过将 10 倍稀释的病毒悬浮液 (30 μL) 脑内 (IC) 接种到 14-16 g NIH 小鼠中,在体内进行病毒滴定。每天监测动物存活率,持续两周,并在出现临床狂犬病体征时实施安乐死。攻击后前 4 天内发生的死亡被认为是非特异性的。使用 Reed 和 Muench 方法测定病毒滴度,表示为 50% 致死剂量/mL (LD50/mL)。
2.2. 重组 MVA-RG 的构建
如前所述生成 MVA-RG [14]。简而言之,在我们实验室提供的质粒 [15] 中获得来自 RABV 毒株 CVS 的 RABV 糖蛋白(以下简称 RG)在 pE/L 合成痘病毒启动子的调节下的完整编码序列,并亚克隆到转移载体 (TV) TV-MTK-GUS-EL [14] 中。该质粒还编码了 β-葡萄糖醛酸酶 (GUS),该酶通过使用其底物以及 MVA086R 基因的病毒基因组区域 [编码胸苷激酶 (TK) 酶] 促进了重组 MVA 的筛选和噬菌斑裂解纯化。将 TV-RG 转染到先前感染 MVA 的 CEF 中 (MOI: 0.01)。经过 15 轮噬菌斑纯化后获得纯重组病毒 (100% 蓝色病毒噬菌斑)。使用引物 RG1-RG4 和 MVA 或 MVA-RG 感染细胞的总 DNA 作为模板,通过 PCR 确认 RG 序列的存在 [15]。
通过 RT-PCR 在转录水平评估 RG 序列的表达。使用 TRIzolTM (ThermoFisher Scientific, Waltham, MA, USA) 从 MVA 或 MVA-RG 感染的细胞中提取总 RNA,然后用逆转录酶 M-MLVRT (200 U, Promega, Madison, WI, USA) 和随机六聚体逆转录。使用所得 cDNA 通过 PCR 和 RG1 和 RG2 引物扩增 ~1600 bp 的产物 [15]。
2.3. 重组腺病毒的生成
使用 ViraPowerTM 腺病毒网关表达试剂盒TM (ThermoFisher Scientific) 生成重组腺病毒。使用 RG1 和 RG2 引物 [15] 通过 PCR 从 TV-RG 中扩增 RG 的完整序列,并克隆到入门载体中(pCR8TM/GW/TOPOTM TA 克隆)。按照制造商的说明,使用获得的质粒和目的载体 pAd/CMV/V5-DESTTM (含有复制缺陷的 Ad5 基因组 ∆E1/E3) 的质粒)进行体外重组测定。使用阳离子脂质 Lipofectamine 2000 (ThermoFisher Scientific) 用 pAd/CMV/V5-DESTTM-RG 转染HEK293A细胞,并孵育直至出现特征性腺病毒细胞病变效应(转染后 ~10-13 天)。
使用通用引物 T7 启动子 (5’TAATACGACTCACTATAGGG) 和 V5 反向 (5’ACCGAGGAGAGGGTTAGGGAT) 通过 PCR 确定 RG 序列的存在,它们在目标质粒中存在的序列中杂交,并以从 Ad-RG 感染细胞中提取的总 DNA 为模板。如上所述,通过 RT-PCR 在转录水平评估 RG 序列的表达。使用 TRIzolTM 提取未感染或 Ad-RG 感染细胞的总 RNA,并使用随机六聚体用 M-MLVRT 逆转录。获得的 cDNA 用于通过 RG1 和 RG4 引物的 PCR 扩增 ~900 bp 的产物 [15]。
2.4. 动物
经认证为无特异性病原体的雌性 BALB/c (H-2d) 小鼠(6-8 周龄)购自 Fundación Facultad de Ciencias Veterinarias(UNLP,阿根廷拉普拉塔)或 SVAR。免疫接种在 Instituto de Biotecnología (IABIMO, INTA-CONICET) 的动物设施中进行,随后将动物转移到 SVAR 进行 IC RABV 攻击。所有实验均遵循国际福利准则,并已获得阿根廷 CICUAE-CNIA 委员会的批准,或符合阿根廷国家药品、食品和卫生产品管理局(阿根廷 ANMAT)的第 6344/96 号规定。分别使用异氟醚和 CO2 吸入作为麻醉剂和处死方法,将小鼠的痛苦降至最低。
2.5. 重组病毒载体在同源和异源免疫方案中的疗效评价
在第 0 天和第 21 天用相应的免疫原(MVA-RG 或 Ad-RG)对 5-10 只小鼠组进行免疫免疫。此外,对照组接受编码无关蛋白 (MVA-GFP 或 Ad-GFP)、PBS 或商业狂犬病疫苗 VeroRab® (Sanofi Pasteur, Swiftwater, PA, USA) 的重组病毒。使用 27G 针头腹膜内 (IP, 0.8 mL) 给予 MVA,同时使用胰岛素注射器 (29G) 将重组 Ad5 肌肉注射 (IM) 到股四头肌 (每条腿 50 μL;总共 100 μL)。使用 27G 针头对市售狂犬病疫苗 (0.25 mL) 和 PBS (0.8 mL) 进行 IP 给药。按照制造商的建议,将商业疫苗 Verorab® (Sanofi Pasteur) 重悬于 0.5 mL 的 0.4% 氯化钠溶液中。全剂量 (0.5 mL) 的效力> 2.5 IU。小鼠通过 IP 途径接受 0.25 mL。
在接种疫苗后第 28-30 天,将动物转移到 SVAR 进行 IC RABV 攻击(见下文)。
2.6. 脑内 RABV 攻击
加强剂后 14 天,所有动物均用 30 μL RABV CVS 毒株 (12.5–50 LD50/0.03 mL) 进行 IC 攻击。连续两周每天记录临床体征和生存率,并在出现狂犬病临床症状时实施安乐死。攻击后前 4 天内发生的死亡被认为是非特异性的。保护计算为受攻击动物总数中幸存的动物数量。
3. 结果
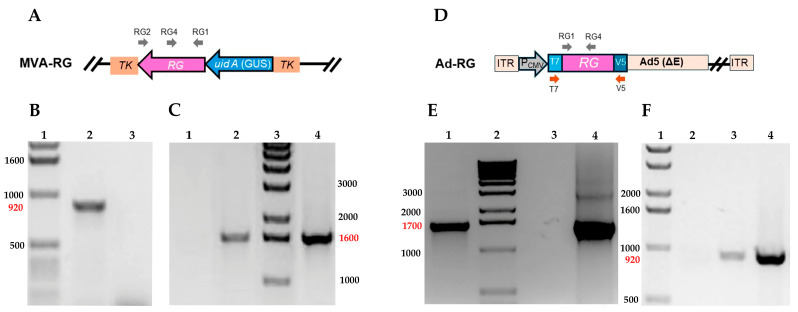
3.1. 表达狂犬病糖蛋白 (RG) 的重组 MVA 和 Ad5 的构建和分子表征
通过 TV-RG 和 MVA 基因组之间的体内同源重组,获得含有中断 MVA086R 病毒基因 (TK) 的 RABV 糖蛋白完整编码序列的重组 MVA(图 1A)。重组病毒(以下简称 MVA-RG)通过噬菌斑纯化分离,基于它们在 X-Gluc(GUS 标志酶的底物,Inalco Pharmaceuthicals,San Luis Obispo,CA,USA)存在下产生蓝色裂解噬斑的能力。通过 922 bp 片段的 PCR 扩增证实了 MVA-RG 中 RG 序列的存在(图 1B)。
图 1.
携带 RG 序列的重组 Ad5 是使用 ViraPowerTM 腺病毒网关表达试剂盒TM (ThermoFisher Scientific) 生成的(图 1D)。使用 T7 启动子和 V5 反向引物通过 PCR 确认插入的核苷酸序列,这些引物扩增了大约 1700 bp 的片段(图 1E)。
分别使用 RG1/RG2 或 RG1/RG4 引物通过 RT-PCR 测定在转录水平上测定 MVA-RG 和 Ad-RG 序列的表达。事实上,仅在感染重组病毒的细胞样本中观察到大约 1600 和 900 bp 的扩增片段(图 1C、F)。
3.2. MVA-RG 和 Ad-RG 诱导的对脑内 RABV 攻击的保护
为了评估重组病毒在 RABV 攻击模型中诱导的保护水平,我们按照同源或异源免疫方案,用相应剂量的病毒载体对小鼠进行两次免疫,加强针后 14 天,我们进行了狂犬病病毒的脑内 (IC) 攻击。
首先,我们通过 IP 途径(同源方案)施用 MVA-RG 的 4 ×10 7 PFU 两次或通过 de IM 途径施用 Ad-RG 的 1 × 108 PFU,然后用 MVA-RG 的 4 ×10 7 PFU (或 MVA-GFP) 进行增强(异源方案)。用 MVA-GFP、PBS 或商业抗狂犬病疫苗免疫的对照组被纳入测定(表 1)。
表 1.免疫原和剂量在 MVA-RG 同源和异源方案中给予小鼠。
| 初免 | 加强 | |
|---|---|---|
| 第 1 组 | MVA-RG(4 × 107 PFU,IP) | MVA-RG(4 × 107 PFU,IP) |
| 第 2 组 | MVA-GFP(1 × 107 PFU,IP) | MVA-GFP(1 × 107 PFU,IP) |
| 第 3 组 | Ad-RG(1 × 108 PFU,IM) | MVA-RG(4 × 107 PFU,IP) |
| 第 4 组 | Ad-RG(1 × 108 PFU,IM) | MVA-GFP(1 × 107 PFU,IP) |
| 第 5 组 | 市售疫苗 (0.25 mL, IP) | 市售疫苗 (0.25 mL, IP) |
| 第 6 组 | PBS (0.8 mL, IP) | PBS (0.8 mL, IP) |
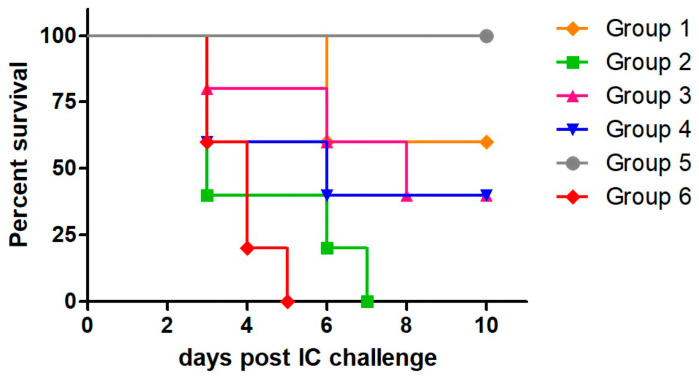
如表 2 和图 2 所示,同源 MVA-RG 方案诱导了 60% 的针对 IC RABV 攻击的保护,而异源方案提供了 40% 的保护。由于无论使用 MVA-RG 还是 MVA-GFP 作为加强剂,用 Ad-RG 引发的两组都显示出相同的存活率,因此我们认为存活率主要是由于 Ad-RG 免疫。正如预期的那样,所有用 PBS 或 MVA-GFP 免疫的动物在攻击后第 7 天死亡,而接种商业疫苗的动物存活下来。
表 2. 在同源和异源方案中用 MVA-RG 免疫的组中 RABV 攻击后存活的动物数量和保护。
| 群 | 幸存动物数/动物总数 | 攻击后的保护 (%) |
|---|---|---|
| 1 | 3/5 | 60 |
| 2 | 0/5 | 0 |
| 3 | 2/5 | 40 |
| 4 | 2/5 | 40 |
| 5 | 10/10 | 100 |
| 6 | 0/10 | 0 |
图 2.
其次,我们评估了 Ad-RG 在同源引物-增强方案中诱导的保护作用,施用不同剂量的重组病毒载体(表 3)。对照组接受 PBS(一种商业抗狂犬病疫苗)或 Ad-GFP(一种编码不相关蛋白质的重组腺病毒)。
表 3.在初次和加强期给予小鼠的 Ad-RG 剂量。
| 初免 | 加强 | |
|---|---|---|
| 第 1 组 | Ad-RG 1 × 106 PFU (IM) | Ad-RG 1 × 106 PFU (IM) |
| 第 2 组 | AD-RG 1 × 107 PFU (IM) | AD-RG 1 × 107 PFU (IM) |
| 第 3 组 | Ad-RG 1 × 106 PFU (IM) | AD-RG 1 × 107 PFU (IM) |
| 第 4 组 | Ad-GFP 1 × 106 PFU (IM) | Ad-GFP 1 × 106 PFU (IM) |
| 第 5 组 | 市售疫苗 (0.25 mL, IP) | 市售疫苗 (0.25 mL, IP) |
| 第 6 组 | PBS (0.8 mL, IP) | PBS (0.8 mL, IP) |
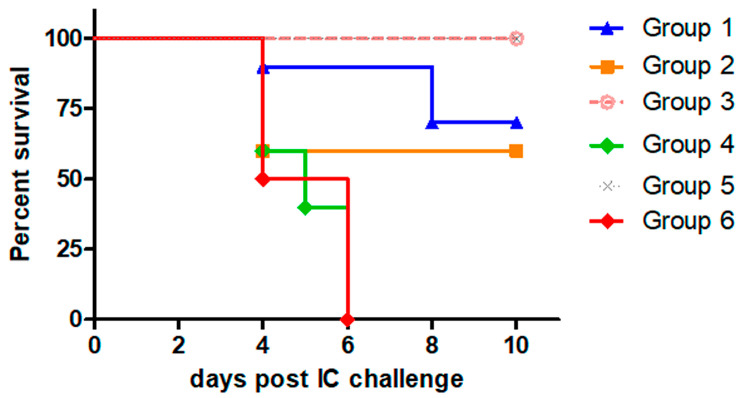
如表 4 和图 3 所示,使用 Ad-RG 的 1 × 106(第 1 组)或 1 × 107 PFU(第 2 组)的两次免疫分别提供 70% 和 60% 的保护。相比之下,在注射 1 × 106 PFU 作为初免和 1 × 107 PFU 作为加强剂的小鼠中观察到 100% 的存活率(第 3 组)。对照组的反应如预期:PBS 和 Ad-GFP 组的所有小鼠都死亡,而接种商业疫苗的小鼠则显示出 100% 的存活率。
表 4.用不同剂量的 Ad-RG 免疫的组中 RABV 攻击后存活的动物数量和保护。
| 群 | 幸存动物数/动物总数 | 攻击后的保护 (%) |
|---|---|---|
| 1 | 7/10 | 70 |
| 2 | 3/5 * | 60 |
| 3 | 10/10 | 100 |
| 4 | 0/5 | 0 |
| 5 | 10/10 | 100 |
| 6 | 10/10 | 0 |
* 该组最初包括用于免疫方案的 6 只动物;然而,1 例在激发后 2 天死亡,其死亡被认为是非特异性的。
图 3.
这些结果表明,MVA-RG 和 Ad-RG 病毒载体诱导对 RABV 的保护。存活率取决于病毒载体类型、给药剂量和免疫方案。
4. 讨论
世界范围内主要使用的狂犬病疫苗是基于灭活狂犬病病毒的。此外,市面上有两种病毒载体疫苗可用于野生动物,利用牛痘病毒和人腺病毒 5 的复制毒株,以及一种基于金丝雀痘病毒的非猫复制疫苗 [5]。虽然灭活疫苗有效,但它们需要多剂疫苗来维持保护性免疫,以及持续的抗狂犬病疫苗接种策略,此外还需要专门的生产设施。相比之下,病毒载体疫苗对狂犬病也有效,刺激免疫反应的两个分支,并且在生产过程中不涉及对活狂犬病病毒的纵。
改良的牛痘安卡拉病毒 (MVA) 和人 5 型腺病毒 ∆E (Ad5) 在哺乳动物中不可复制,并已被广泛评估为疫苗开发的病毒平台 [16]。
在这项研究中,我们获得了两种表达狂犬病糖蛋白的非复制性病毒载体:MVA-RG 和 Ad-RG。虽然糖蛋白表达仅在转录水平得到证实,但体内蛋白表达是从小鼠免疫和攻击结果推断出来的。本研究使用同源和异源免疫方案评估了这些候选疫苗在小鼠脑内 RABV 攻击模型中诱导的保护作用。
在注射两次 4 × 107 PFU 的 MVA-RG (同源免疫方案) 后,我们观察到对 RABV 攻击的保护率为 60%。为了提高这些保护水平,有三种可能的策略:增加免疫原剂量、延长免疫接种之间的时间间隔或应用异源疫苗接种方案。
关于第一种选择,Weyer等[17]报道,使用1 ×10 8 PFU 的MVA-RG进行单次免疫,对小鼠的保护作用为10%,而给予1 ×10 9 PFU的存活率为70-80%。然而,在小鼠模型中使用高剂量的重组病毒为扩大目标动物(如狗、猫或牲畜)的大规模疫苗接种生产带来了攻击。
另一种方法涉及修改 priming 和 boosting 之间的时间间隔。在免疫反应的收缩阶段接种加强针可以防止观察到的任何反应增加。几项使用基于痘病毒的疫苗的研究表明,延长初免剂量和加强剂量之间的时间间隔可以提高疫苗诱导的免疫力[8,18,19,20]。在这种情况下,测试增加 MVA-RG 免疫间隔是否能提高对 RABV 攻击的保护水平会很有趣。然而,最近一项关于 MVA-SARS-2-ST 和 MVA-SARS-2-S 候选疫苗的研究显示,在比较两剂之间 21 天和 56 天的间隔时,免疫反应水平相似 [21]。此外,本研究中应用的脑内 RABV 攻击引入了技术困难,因为刺穿动物的头骨可能会增加动物的痛苦和接种物输送的可变性。
异源疫苗接种方案通过在初免-加强方案中结合腺病毒和痘病毒,在人类和动物模型中显示出增强的免疫原性和有效性 [22,23,24,25,26,27,28]
在这项研究中,用 Ad-RG 引发和用 MVA-RG 加强的异源免疫方案对 IC RABV 攻击提供了 40% 的保护。在评估条件下,与同源方案相比,这种策略未能提高保护。一种可能的解释是 Ad-RG 启动剂量 (1 × 108 PFU) 引起的强烈免疫反应可能抑制了 MVA-RG 的作用。此外,如上所述,增加免疫接种之间的时间间隔可以增强特异性反应。例如,Bruña-Romero等[25]报道,在实验中,通过减少启动剂量(从1 × 109 PFU到1 × 108 PFU)和延长加强剂的时间间隔(从2周到8周),可以完全预防疟疾并改善细胞和体液免疫反应水平。在他们的研究中,引物和增强物分别由表达约氏疟原虫的环子孢子 (CS) 蛋白的复制缺陷型重组腺病毒和表达相同疟疾抗原 VacPyCS 的减毒重组痘苗病毒组成。遗憾的是,这种策略并不容易应用于 IC 质询模型。
在异源免疫方案中观察到的 IC RABV 攻击后 40% 的保护可能归因于单剂量 1 × 108 PFU 的 Ad-RG,因为在使用编码狂犬病糖蛋白或不相关蛋白 (GFP) 的 MVA 加强后观察到相同水平的保护。这一保护水平低于 Zhao 等 [29] 和 Yan 等 [30] 报道的保护水平。他们的研究表明,单次注射 1 ×10 8 GFU(绿色荧光单位)的重组 Ad5,同时表达狂犬病糖蛋白和犬瘟热病毒血凝素或伴有血小板减少综合征病毒的严重发热,可诱导 100% 保护 IM RABV 攻击。
另一方面,Kim 等人 [2] 报道,IM 攻击后 1 ×10 8 PFU 的 Ad5 表达 RABV 糖蛋白的全长或截短版本,IM 免疫后 100% 保护,但在 IC 攻击后,观察到 0% 至 40% 的保护。这些结果强调了仔细分析疗效结果的重要性。
继续我们的研究并考虑到单剂量 Ad-RG 诱导了 40% 的保护,因此评估 Ad-RG 在同源初免-增强方案中的疗效非常有趣。两次注射 1 × 106 和 1 × 107 PFU 产生了类似的保护(分别为 70% 和 60%),超过了单次 1 × 108 PFU 剂量诱导的保护。值得注意的是,1 × 106 PFU 的初免剂量,然后是 1 × 107 PFU 的加强剂量导致 100% 的生存率。虽然这项研究没有评估 Ad-RG 引发的免疫反应谱,但这些结果表明,用 1 × 107 PFU 引发可能会诱导抗载体反应,从而抑制对抗 RABV 特异性反应的增强作用。
从这个意义上说,基于 Ad 的疫苗的一个局限性是诱导抗载体免疫反应,它抑制细胞转导,限制转基因表达,并最终降低疫苗的整体有效性。这种“抑制”作用可能因腺病毒类型、剂量和给药途径而异。Pandey等[31]分析了在初免-加强方案中使用不同剂量的野生型人腺病毒血清型5通过鼻内(IN)途径(腺病毒的自然感染途径)或IM途径(常用于基于Ad的疫苗)的BALB/c小鼠中抗载体免疫反应与抗原特异性反应的干扰。4 周后,小鼠接受不同量 HAd-HA-NP 的加强剂量 (HAd 表达 A/越南/1203/04 的血凝素 (HA) 和核蛋白 (NP),H5N1 流感病毒),随后用非致命性重排流感病毒攻击。作者观察到,较高的初免剂量会导致 Ad 中和抗体反应增加,从而影响加强剂量的疗效。低初免剂量 (1 × 107 PFU) 和较高加强剂量 (1 × 108 PFU) 可实现最佳保护。在另一项研究中,通过 IN 或 IM 途径施用不同剂量的 GFP 重组 HAd5V (Ad5GFP) 来诱导抗 Ad5 免疫。随后,用 1 × 109 PFU/动物的 HAd5VCMV 皮下 (SC) 免疫小鼠。作者发现,只有通过 IM 途径给药的最高剂量的 Ad5GFP(1 ×10 7 PFU)才能将针对异源抗原 (CMV) 的 CD8+ T 细胞特异性反应降低 50% [32]。
鉴于针对 Ad5 的中和抗体 (NA) 在降低其对人类疫苗开发的有效性方面的重要性,研究人员专注于基于动物腺病毒的载体的生成,特别是黑猩猩衍生的 Ad 载体 (ChAd)。虽然预先存在的针对猿猴 Ad 载体的 NA 相对罕见,但不应忽视针对 Ad 的潜在交叉反应性细胞免疫(由 [33] 综述)。几种基于 ChAd 的狂犬病候选疫苗已在小鼠和非人灵长类动物中显示出对 RABV 的疗效 [34,35]。近年来,其中两种候选疫苗 ChAdOx2-RG 和 ChAd155-RG 已进入 I 期人体临床试验,它们诱导了可接受的抗 RABV NA 滴度,但与标准灭活狂犬病病毒疫苗相比,其滴度更低,持续时间更短 [36,37]。
总体而言,我们的结果表明,不应将与 Ad5 进行同源初免-加强方案视为针对 RABV 的可行疫苗策略,因为抗原特异性反应的诱导(或缺乏)将取决于先前疫苗接种引起的抗载体反应水平。
在这项研究中,我们介绍了使用哺乳动物中的非复制病毒载体 MVA 和 Ad5 生成两种第三代狂犬病候选疫苗。两种候选药物在以同源疫苗接种方案给药时,均诱导对 IC RABV 攻击的保护。未来的研究应探讨增加 MVA-RG 接种之间的时间间隔是否能增强保护。此外,Ad-RG 同源引物 (1 × 106 PFU) – 增强 (1 ×10 7 PFU) 方案的有希望的结果鼓励在目标动物中进一步评估该候选疫苗。
5. 结论
在开发第三代疫苗的背景下,将狂犬病病毒排除在配方之外,同时诱导保护性免疫反应,病毒载体提供了一种极好的替代方案。此外,它们实施同源疫苗接种方案的能力简化了它们在工业系统中的生产。此外,它们的安全性使其适用于人类和动物(包括伴侣动物和生产动物),确保高水平的保护,而不会传播传染源或病毒载体。
确认
作者要感谢 Silvio Diaz、Elena Scarel 和 Guillermo Fernandez 在处理和照顾动物方面的支持,以及 Diego Compaired、Yesica Gonzalez 和 Osvaldo Zabal 准备原代鸡胚胎成纤维细胞和维持细胞系。我们感谢 Julia Sabio y García 审阅手稿的英文语言。
作者贡献
概念化:G.C.、O.P. 和 M.P.D.M.Z.;方法:D.P.G.、G.C.、M.A.M. 和 O.P.;形式分析:DPG 和 M.A.M.;调查:D.P.G.、M.A.M. 和 A.T.L.;资源:G.C.、M.P.D.M.Z. 和 O.P.;写作 — 初稿准备:D.P.G. 和 M.P.D.M.Z.;写作 — 审阅和编辑:G.C. 和 M.P.D.M.Z.;可视化:G.C. 和 M.P.D.M.Z.;监护:O.P.、G.C. 和 M.P.D.M.Z.;项目管理:G.C. 和 M.P.D.M.Z.;资金获取:G.C. 和 M.P.D.M.Z.所有作者均已阅读并同意手稿的已发表版本。
机构审查委员会声明
动物研究方案得到了阿根廷 INTA 实验动物福利伦理委员会的批准。协议代码:38/2017(批准日期 2017 年 7 月 12 日);57/2017 (批准日期 2017 年 10 月 18 日);37/2021 (批准日期 2022 年 5 月 18 日);32/2022 (批准日期 2023 年 3 月 15 日);20/2023(批准日期 2023 年 7 月 19 日)。
知情同意书
不適用。
数据可用性声明
数据包含在文章中。
利益冲突
作者声明没有利益冲突。资助者在研究设计、手稿撰写或发表结果的决定中没有作用。
资助声明
这项研究由国家技术研究所 (INTA)(资助号 PNBIO 1131032,PD i116)和 Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT)(资助号 PICT 2013-535 和 PICT 2020-1713)资助。A.T.L. 拥有 CONICET 的博士奖学金。
脚注
免责声明/出版商注:所有出版物中包含的声明、意见和数据仅代表个人作者和贡献者的声明、意见和数据,与 MDPI 和/或编辑无关。MDPI 和/或编辑不对因内容中提及的任何想法、方法、说明或产品而造成的任何人员或财产伤害负责。
Hits: 316
- 狂犬病(2025年6月更新)
- 狂犬病 你应该知道的
- 预防和治疗狂犬病的狂犬病疫苗
- 狂犬病可能成为历史
- 看看每种疫苗:狂犬病疫苗
- 阿拉巴马州妇女在从车上卸下杂货时被狂犬病狐狸咬伤:“公共卫生威胁”
- 应对狂犬病
- 全球疫苗免疫联盟将促进全球疫苗免疫联盟、世卫组织和阿联酋50多个国家获得拯救生命的人类狂犬病疫苗
- 美国CDC发布了将狗带入美国的新规定,旨在防止狂犬病
- 全国狂犬病监测方案
- 2024年东帝汶首例狂犬病确诊病例
- WHO实况报道 狂犬病
- 狂犬病
- 狂犬病疫苗接种:给医疗保健提供者的信息
- 特定感染的流行病学和控制:狂犬病
- 狂犬病疫苗接种的注意事项或禁忌症
- ACIP 使用减少(4剂)疫苗计划进行暴露后预防以预防人类狂犬病
- 实施良好的狂犬病暴露后预防方案
- ACIP 使用修改后的暴露前预防疫苗接种计划预防人类狂犬病,美国,2022年
- 西班牙犬类狂犬病免疫保护的影响因素
- 减少犬的进口等待期-对狂犬病恐惧科学合理的变化
- 老年人对狂犬病暴露后预防无应答:挑战和方法
- 狂犬病疫苗的效力、免疫原性和有效性:体外和体内方法
- 狂犬病人免疫球蛋白 (HRIG)
- “震惊”的妇女,超过6,000美元的救命狂犬病治疗账单
- 负鼠感染狂犬病毒对这种病毒在城市环境中的传播敲响了警钟
- 索马里蜜獾感染未报告的首例疑似人狂犬病病例研究
- 两名狂犬病研究人员解释如何保护自己免受这种疾病的侵害
- 临床医生常见的狂犬病问题
- 狂犬病疫苗
- 世界卫生组织关于狂犬病的常见问题
- 狂犬病实况报道
- 狂犬病
- 狂犬病是一种古老的、不可预测的、可能致命的疾病——两位狂犬病研究人员解释了如何保护自己
- 狂犬病疫苗短缺:给卫生专业人员的建议
- 7例被狂犬咬伤者接种狂犬病疫苗的效果观察
- 全球狂犬病风险:狂犬病疫苗短缺期间的实用建议
- 巴西一个土著村庄被蝙蝠掠夺的高风险:警告狂犬病在马卡利人中重新出现
- 评估在澳大利亚蝙蝠狂犬病病毒和狂犬病暴露后预防中血清学的益处
- 蝙蝠处理者的狂犬病暴露前预防
- 基于狂犬病中和抗体水平的狂犬病加强剂时机指南
- 施用狂犬病疫苗和免疫球蛋白
- 为狂犬病暴露后预防开发的单克隆抗体鸡尾酒疗法
- 狂犬病预防处置常见问题解答(成大生物)
- 世界卫生组织狂犬病专家磋商会 第三版报告
- 世卫组织对狂犬病的看法
- 新型狂犬病疫苗
- 狂犬病病毒可以抗强大的天然免疫
- 狂犬病的被动免疫
- 亚洲狂犬病预防
- 秘鲁高风险人群的大规模狂犬病暴露前预防
- 人用狂犬病疫苗
- 野生动物狂犬病疫苗
- 狂犬病和狂犬病疫苗的历史
- 狂犬病的生命周期、传播和发病机制
- 狂犬病暴露后管理指南(英国 2023年1月)
- 2022年印度马哈拉施特拉邦一名幼儿出现临床狂犬病症状后存活
- 第27章:狂犬病
- 狂犬病:问题和答案
- 《狂犬病暴露预防处置工作规范(2023年版)》解读问答
- 狂犬病暴露预防处置工作规范(2023年版)
- 狂犬病
- 狂犬病相关问题解答
- 疾病控制中心加强了对进口狗的狂犬病管理,原因如下
- 关于狂犬病
- 一名加州艺术教师在教室遭遇蝙蝠后死于狂犬病
- WHO 实况报道 动物咬伤 2024年1月
- 疫苗接种和免疫 狂犬病
- 世卫组织推荐皮内途径用于狂犬病暴露后预防
- 狂犬病疫苗:世卫组织立场文件–2018年4月
- WHO实况报道 狂犬病 2024年6月
- 狂犬病-结束忽视, 实现可持续发展目标 被忽视的热带病路线图 2021-2030
- 动物狂犬病
- 宠物主人对疫苗的犹豫越来越多——一位公共卫生专家解释了为什么这很重要
- 兽用狂犬病疫苗
- 何时寻求狂犬病医疗护理
- 猫
- 关于获得人类狂犬病疫苗的社会正义观点
- 评估新的狂犬病暴露后预防(PEP)方案或疫苗
- 卫生和福利部-狂犬病
- 狂犬病暴露后预防用单克隆抗体开发的最新进展:临床开发管线现状综述
- 世卫组织对狂犬病免疫接种的立场 – 2018 年最新情况
- 恐水症:1874 年的狂犬病和改变一切的救命疫苗
- 新的人类狂犬病疫苗正在研发中
- 为什么消除狂犬病?
- 为什么现在要根除狂犬病?
- 狂犬病-NFID
- 为狗接种疫苗 – 它们不会因接种疫苗而患上自闭症
- 宠物主人版 狗的狂犬病
- 猫的狂犬病
- 狂犬病-国际脑炎协会
- 器官移植后如何感染狂犬病?
- 器官移植患者感染狂犬病后死亡
- 人类狂犬病疾病负担:Rabipur®疫苗的潜在预防作用
- 印度东北部农村的狂犬病:强调同一健康方法紧迫性的病例报告
- 狂犬病毒糖蛋白的深度突变扫描确定了突变限制和抗体逃逸突变
- 人类狂犬病:一种治疗方法
- 通过受感染狗唾液污染的隐形眼镜传播狂犬病病毒(病例报告)
- 越南暴露前预防计划中基于灭活 vero 细胞的狂犬病疫苗 (Rabivax-S) 的安全性和免疫原性
- 狂犬病生物制剂在 III 类动物暴露儿科患者中的安全性和临床疗效的前瞻性研究
- 重复狂犬病疫苗接种揭示人类中和抗体的分子趋同
- 狂犬病病毒的感染和预防
- 关于 Zagreb 或 Essen 方案后加强疫苗接种的免疫原性和安全性的 3 期临床试验
- 通过 RABV-G 结构域筛选和异源初免-加强免疫优化狂犬病 mRNA 疫苗功效
- 狂犬病实验室诊断的最新情况
- 三色蝠相关狂犬病毒引起的一例人狂犬病的报道
- 一种核苷修饰的狂犬病mRNA疫苗在小鼠和非人灵长类动物中诱导出持久而全面的免疫反应
- 狂犬病的识别和治疗:病例报告和讨论
- 人类狂犬病的诊断困难:病例报告和文献回顾
- 狂犬病感染的边缘系统症状
- 狂犬病脑炎的生存率
- 人类狂犬病:2016年更新
- 突尼斯一名狂犬病幸存儿童:病例报告
- 肯尼亚蝙蝠携带的Duvenhage病毒导致人类狂犬病死亡:昏迷诱导、氯胺酮和抗病毒药物治疗无效
- 病例报告:狂犬病幸存者长期随访中的神经功能恢复与血清学反应
- 蝙蝠和食肉动物中狂犬病的比较病理学及其对人类溢出影响
- 病例报告:狂犬病生存者:印度病例系列
- 评估人类抗狂犬病疫苗的反应:一种快速、高通量适应性、基于假病毒的中和试验,作为快速荧光病灶抑制试验 (RFFIT) 的替代方案
- 病例报告:狂犬病幸存者长期随访中的神经功能恢复与血清学反应
- 巴西巴伊亚州狂犬病爆发的流行病学与分子分析
- 俄罗斯下诺夫哥罗德地区动物狂犬病(2012-2024年):描述性与预测性流行病学分析
- 巴西东南部一只黑鼠耳蝠(黑鼠耳蝠属物种Myotis nigricans)感染狂犬病病毒、科勒巴尔通体菌以及婴儿利什曼原虫的混合感染情况
- 2013-2023 年悉尼大都会居民狂犬病暴露后治疗:回顾性病例系列分析
- 用肌肉靶向脂质纳米颗粒配制的狂犬病病毒 G 蛋白 mRNA 在小鼠体内的免疫原性
- 关于狂犬病的 One Health Lens:马拉维利隆圭农村狂犬病病毒的人类-蝙蝠相互作用和基因组见解
- 阿根廷低地貘 (Tapirus terrestris) 麻痹狂犬病的首次报告
- 由表达狂犬病糖蛋白的非复制型病毒载体痘苗病毒天坛株改良株(MVA)和腺病毒5型(Ad5)所诱导产生的对狂犬病的保护作用
- 印度野生猫科动物中狂犬病毒的免疫病理与分子筛查:揭示从野外到城市的溢出效应
- 韩国貉 (Nyctereutes procynoide koreensis) 接种了含有 ERAGS-GFP 毒株的新型狂犬病诱饵疫苗的保护性抗体反应
- 宠物护理 疫苗
- 为您的宠物接种疫苗
- 狂犬病感染:如何保护您的孩子
- 新型狂犬病暴露后预防单克隆抗体鸡尾酒疗法的安全性和耐受性
- “愤怒的狂犬病”人类图画案例
- 蝙蝠咬伤
- 研究蝙蝠病毒如何帮助预防人畜共患疾病
- 狂犬病:症状繁多、宿主广泛的恶魔病毒——罗德尼·罗德解读
- 狂犬病的同一健康:不仅适用于动物
- 狂犬病和蛔虫:浣熊相关传染病
- 丽莎病毒 很罕见,但致命。如果蝙蝠咬你怎么办?
- 海地在四个省开展新的疫苗接种运动,加强防治犬类狂犬病
- 家养及其他动物狂犬病病毒感染的挑战:病毒学层面的困惑、惊愕、懊恼与好奇交织
- 双重战斗:狂犬病和蛇咬伤在东南亚的毒害
- 狂犬病在城市无人管理的猫群中爆发 — 马里兰州,2024 年 8 月
- 尼泊尔正力争在2030年前消灭狂犬病,但领导人表示,现在是加大疫苗投资的时候了。
- 现代狂犬病疫苗的诞生历程
- 一种基于mRNA的新型狂犬病病毒多表位疫苗:通过反向疫苗学和免疫信息学进行计算机设计
- 快速荧光灶抑制试验(RFFIT)的验证与评价 —— 作为狂犬病疫苗相对效价间接检测方法的中和抗体定量检测:NIH 试验的替代方案
- 暴露后狂犬病预防失败案例研究
- 2021年明尼苏达州一起经确认的人畜共患病暴露后,疑似因宿主介导导致暴露后预防失败的致命人类狂犬病感染病例
- 给野生动物投喂疫苗:口服狂犬病疫苗的故事
- 降低肯尼亚西部臭名昭著的狗市狂犬病风险
- 印度的狂犬病
- 海地的狂犬病
- 2024年10月至2025年2月,美国发生通过实体器官移植传播狂犬病的病例,该器官移植供体未确诊患有狂犬病
- 两例死亡与狂犬病感染的肾移植有关
- 明尼苏达州一家奶牛场的牛群中爆发狂犬病聚集性疫情——2024年
- 摩洛哥的狂犬病
- 2024年肯塔基州和俄亥俄州输入性人类狂犬病病例
- 2024年明尼苏达州和加利福尼亚州人类狂犬病死亡人数
- 反疫苗人士对宠物狂犬病 RNA 疫苗的虚假宣传
- 新型口服狂犬疫苗能否帮助我们最终终结这种疾病?
- NACI 2026 年 1 月 30 日发布的声明摘要:狂犬疫苗用于暴露前预防 (PrEP) 的最新指南
- 狂犬疫苗的给药途径:数据比较
- 猫会得狂犬病吗?
- 2022-2024年中欧狂犬病疫情再度出现

尊敬的孟博士,您好!最近一直有一些疑问,想要请教您,如果您肯抽空回复,非常感谢。
1.如果说轻微的暴露(隔着裤子没看到明显划痕和伤口的),延迟了今天,后面只打了前两针,当天和第三天,首针过去一个月了,已经安全了吗?
2.只打两针的话,一般来说疫苗的保护期能有多久呢?
孟博士,可以帮我解答一下吗,非常感谢。我看到评论审核过了,但是好像没有回复
尊敬的孟博士
您好!
我前段时间也咨询过您几次,我由于太恐狂了,(想过后面去看心理医生)我现在还想再问您一下我于2021年10月22日接种完5针狂犬疫苗,2024年10月10日接种了2针狂犬疫苗,2025年2月25日接种2针狂犬疫苗,2025年3月30日测得狂犬疫苗抗体39.13IU/ml
1.假如我在2025年5月4日暴露还需要再接种狂犬疫苗吗?
假设是我面临如此情况,我不打;你需要自己决定同时参考你的医生的建议
我咨询过感染科医生的,他们都说在保护期内不需要再打,但是我这个恐狂症心里过不去,始终害怕,就算我去打了,下次还是会这样,哎,我每天这样过的好累,应该我有强迫症焦虑症等,不仅恐狂还恐破伤风之类的,谢谢您了……
尊敬的孟博士您好,有两个疑问咨询一下,麻烦您百忙之中回复,多谢!1晚上能被牵出去正常遛的狗会不会是疯狗?2在白天活蹦乱跳的流浪狗,能正常行走,而且能停下来注视人而不攻击人,这种不像是疯狗吧?
这个我真不知道,我要有这个本事,那就是神仙;中国估计只有阜阳疾控老主任 明贺田 老师有这个本事,除他之外,我估计都没有这个能力。