Contents
Deep mutational scanning of rabies glycoprotein defines mutational constraint and antibody-escape mutations
摘要
狂犬病病毒每年导致近60,000人死亡。针对狂犬病糖蛋白(G)的抗体正被开发为暴露后预防药物,但G的突变会使这种抗体无效。在这里,我们使用假病毒深度突变扫描来测量G的所有单个氨基酸突变如何影响细胞进入和一组抗体的中和。这些测量确定了狂犬病病毒G功能的关键位点,并确定了对临床抗体有吸引力的表位的限制区域,包括蛋白质的顶端和底部。我们提供了八种单克隆抗体的逃逸突变的完整图谱,包括一些临床使用或开发中的抗体。大多数抗体的逃逸突变存在于一些天然狂犬病毒株中。总体而言,这项工作提供了关于G突变的功能和抗原效应的全面信息,有助于开发稳定的疫苗抗原和抗体,对狂犬病遗传变异具有弹性。
介绍
狂犬病是一种导致脑炎的狂犬病病毒,在人类和大多数其他哺乳动物物种中出现症状时是致命的1。这种病毒在几种哺乳动物中很常见2–4,人畜共患传染病每年导致约60,000人死亡,其中非洲和亚洲死亡人数最多5。暴露于狂犬病需要立即进行暴露后预防,包括人或马血清衍生的狂犬病免疫球蛋白(RIG)注射、单克隆抗体或重复疫苗接种7。尽管预防有效率超过99%,但在一些狂犬病流行地区,费用和供应短缺导致无法获得治疗8–10。因此,正在努力开发更好的狂犬病疫苗11–15和单克隆抗体治疗16–19。
狂犬病疫苗和抗体的主要目标是其糖蛋白G,它介导受体结合20–22和与宿主细胞的病毒融合23,24。融合前G是病毒表面的三聚体复合物12,25,并经历pH驱动的构象变化来介导膜融合26,27。至于其他III类病毒融合蛋白28–30狂犬病G是构象动态的,在其融合前和融合后构象之间可逆地交换24,31。G蛋白的构象动态对疫苗设计提出了挑战:最有效的中和抗体靶向融合前的构象,但许多用未修饰的G蛋白免疫诱导的抗体与其他构象结合12,25。因此,正在努力稳定融合前狂犬病病毒G,以创造改进的疫苗抗原12,25以及鉴定有效中和的抗G单克隆抗体19,32。
另一个挑战是G是相当多样的,在天然狂犬病毒株之间具有> 10%的蛋白质序列差异。这种遗传多样性使单克隆抗体的开发变得复杂,因为已经鉴定出天然毒株对抗体具有抗性,包括临床使用或开发中的抗体19,26,33–35。正在尝试开发具有增加的中和广度和抗逃逸性的单克隆抗体或抗体鸡尾酒19,34。
这里我们使用伪病毒深度变异扫描36,37通过一组八种单克隆抗体来测量G胞外域突变如何影响细胞进入和中和。我们的实验量化了G上的突变限制,并提供了对突变如何影响G的构象动力学和功能的见解。我们还提供了各种重要抗体的逃逸突变的完整图谱,使我们能够更好地定义它们的表位,并评估每种抗体的逃逸突变在天然狂犬病序列中的存在程度。总的来说,我们的深层突变扫描阐明了突变如何影响G的功能和抗原性,并提供了有助于指导疫苗抗原和抗体治疗设计的信息。
结果
狂犬病病毒深层突变扫描
为了测量狂犬病病毒G基因突变的影响,我们使用了之前描述的假病毒深度突变扫描平台36,37。该平台能够创建基因型-表型关联的慢病毒颗粒文库,每种颗粒在其表面展示独特的G突变体,并在其基因组中编码识别性核苷酸条形码(图S1A,B)。这些慢病毒颗粒(或“假病毒”)仅编码一种病毒基因(狂犬病病毒G),因此只能经历一个细胞感染周期,从而能够研究G突变体而不需要产生复制型致病病毒。汇集的假病毒文库可用于在各种实验条件下感染细胞,并且每种G突变体在每种条件下使细胞感染的能力可通过对感染细胞的条形码进行测序来定量(图1A)。这种方法使得在一次实验中测量成千上万个不同突变对G的影响成为可能。
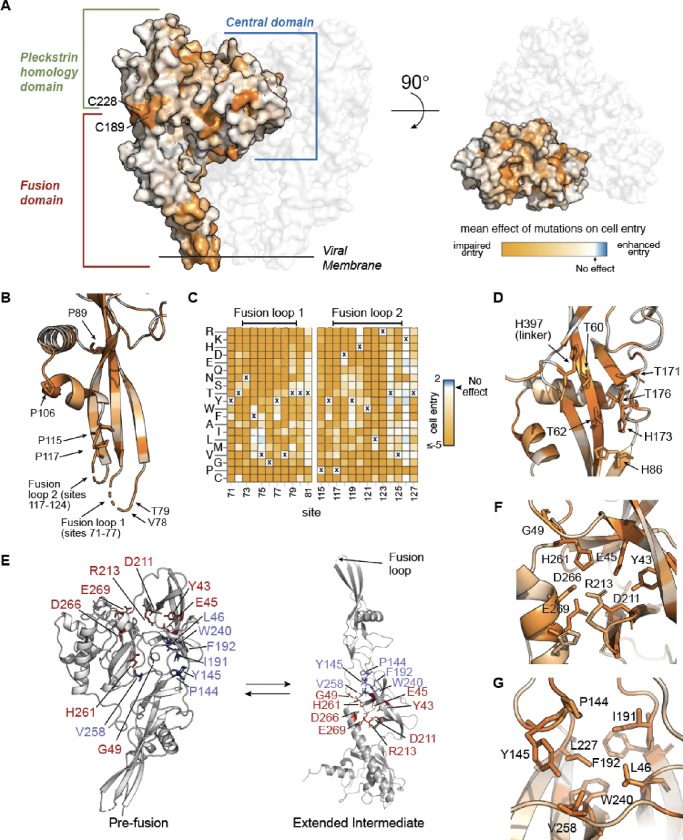
图1.狂犬病基因深层突变扫描。
(A)我们建立了假病毒文库,这些假病毒在其表面表达不同的G突变体,并在其基因组中编码识别核苷酸条形码。这些文库用于在各种条件下感染细胞,并对成功感染的病毒的条形码进行深度测序,以量化突变的影响。
(B)显示在我们的文库中被诱变的狂犬病G区域的示意图。我们使用传统的编号方案,其中站点1被分配给胞外域的第一个站点。在这个编号方案中,我们从2号位点突变到431号位点。
(C)突变对G-介导的细胞进入的影响。热图的每一列显示了该位点不同氨基酸对细胞进入的影响,未突变巴斯德毒株G中的氨基酸同一性用“X”表示。损害细胞进入的突变为橙色,不影响细胞进入的突变为白色,增强细胞进入的突变为蓝色。灰色表示在深度突变扫描中不能可靠测量的突变。重叠条表示g的区域。请参阅https://dms-vep。org/RABV_Pasteur_G_DMS/cell_entry。html互动版的热图。
(D)验证对细胞进入的突变效应的深度突变扫描测量。对于16个突变中的每一个(其被选择为跨越一系列细胞进入效应),x轴显示了在深度突变扫描(DMS)中测量的效应,而y轴显示了用该G蛋白突变体产生的单个假病毒相对于未突变亲本的滴度。对每个突变进行了两次独立的滴度验证测量,因此图中每个突变有两个点。这r表示皮尔逊相关。
我们使用狂犬病病毒巴斯德株(一种疫苗株)的G蛋白进行了深度突变扫描15最近用低温电子显微镜测定了它的融合前G值12,25。我们设计的突变体库包含G中433个位点的所有单个氨基酸突变,从胞外域N端的两个残基(在信号肽的末端)开始,一直到整个结构解析12,25胞外域的区域并进入其C-末端区域(图1B)。因此,文库靶向433 × 19 = 8,227个不同的氨基酸突变。我们还设计了20个位点的终止密码子突变作为细胞进入的阴性对照。在整篇论文中,我们利用编号方案,其中一个被分配给胞外结构域中的第一个位点,与过去狂犬病G研究的编号惯例一致12,25,26。
我们使用先前描述的方法(图S1B)36,37。每个文库包含约80,000个G的条形码变体,每个文库覆盖了8227个预期胞外域氨基酸突变的> 99%图S1C)。大多数条形码变体仅包含一个G氨基酸突变(~64%),尽管一些变体不包含突变(~12%)或包含多个突变(~24%)(图S1D)。
突变对G-介导的细胞进入的影响
我们首先测量了所有G突变如何影响蛋白质介导假病毒进入293T细胞的能力。我们通过用表达狂犬病G突变体的条形码假病毒颗粒的集合文库感染293T细胞,并将感染的293T细胞中每个条形码的频率与感染了显示未突变VSV-G的条形码假病毒的对照组细胞进行比较(图1A, S1B, S2A)。为了使显示狂犬病g病毒的假病毒滴度最大化,我们在补充了4 μg/mL凝聚胺的培养基中用g病毒进行感染38并调节至pH值为7.139 (图S2B)。当用VSV-G进行假型时,所有假病毒都能够进入293T细胞,而不管狂犬病G功能如何,从而为文库中的每个条形码提供基线频率。然后将这些基线频率与假病毒依赖其狂犬病G突变体感染细胞的条件下每个条形码的频率进行比较。我们将每种G变体感染细胞的能力量化为其条形码计数相对于狂犬病-G和VSV-G介导的感染条件之间的未突变G的条形码计数的对数(图S2A)。大于零的细胞进入分数表明相对于亲代G蛋白的感染改善,而小于零的值表明进入受损。由于一小部分条形码变异包含多个突变,我们采用了一个全局上位模型去卷积单个突变的影响40。突变如何影响细胞进入的测量在不同天用相同文库进行的重复之间以及在两个独立的G突变体文库(图S2C–D)。
G突变对细胞进入的影响见图1C;查看互动显示https://dms-vep。org/RABV_Pasteur_G_DMS/cell_entry。html来最好地检查数据。正如所料,终止密码子的突变对细胞进入都是有害的。氨基酸突变的影响在不同位点有很大差异,在某些情况下,在同一位点的不同突变之间也有差异。例如,融合结构域中的160-168位点、第三接头中的181-189位点、pleckstrin同源结构域中的201-206和244-250位点都耐受大多数氨基酸突变。但其他位点受到高度限制:例如,几乎所有的突变在两个融合环中都是有害的,这两个融合环跨越位点73-79和117-12526。在下一小节中,我们将在G的结构中更详细地讨论这些约束模式。
为了验证突变对细胞进入影响的深度突变扫描测量,我们克隆了15个被测量具有一系列影响的单个G突变,并测定了编码这些突变的单个假病毒的滴度。来自深度突变扫描的突变对细胞进入的影响与在这些验证试验中测量的单个假病毒滴度高度相关(r = 0.91; 图1D)。深度突变扫描也与先前的实验一致,这些实验描述了G的单个突变对其融合活性的影响12,26 (图S2E)。
G的结构和功能背景下的突变约束
突变对G细胞进入功能的影响在整个蛋白质中变化很大,在中心结构域、pleckstrin同源结构域和融合结构域(图1C, 2A)。这种限制的一部分可以相对简单地用G正确折叠才能发挥作用的要求来解释。例如,G表面上最受限制的区域之一涉及连接位点C189和C228的二硫键,其中任一位置的任何非半胱氨酸氨基酸的突变对细胞进入都是高度有害的(图2A)。在G的融合前结构中隐藏的位点,非疏水性氨基酸的突变往往是有害的,可能是因为它们破坏了蛋白质疏水核心的折叠(图S3)。
图2.狂犬病病毒G结构中的功能约束。
(A)融合前G结构(PDB: 7U9G ),具有两个透明的原聚体和一个根据每个位点所有突变对细胞进入的平均影响而着色的原聚体。当突变损害细胞进入时,位点显示为橙色,当它们没有影响时,显示为白色。看见https://DMS-VEP 。 org/RABV _ Pasteur _ G _ DMS/cell _ entry 。 html # mutation-effects-on-structure-of-G突变效应的交互式结构可视化。
(B)融合前G的单个原聚体的融合结构域的放大视图,其位点用突变对细胞进入的平均效应着色。融合循环在结构中未被解析,并被建模为虚线卡通循环。
(C)显示融合环和侧翼位点中所有突变对细胞进入的影响的热图。巴斯德毒株G中亲本氨基酸的同一性用“x”表示
(D)融合前G的单个原聚体的放大视图,突出了组氨酸簇和结构上相邻的苏氨酸,它们可以作为pH传感器。如(A)所示,位点通过细胞进入的平均效应突变来着色。
(E)在融合前原体和延伸的中间构象(PDB 6LGW)中都显示的G的单个启动子,在图F中突出显示的位点用红色显示,在图G中突出显示的位点用蓝色显示。
(F)延伸的中间构象的放大视图,显示了在该构象中形成极性相互作用的位点。如(A)所示,根据突变对细胞进入的平均影响对位点进行着色。
(G)延伸的中间构象的放大视图,显示了在该构象中形成疏水相互作用的位点。如(A)所示,根据突变对细胞进入的平均影响对位点进行着色。
其他的限制位点为G的功能提供了更细微的见解。融合环对G的细胞进入机制至关重要,并被认为稳定狂犬病G的三聚体融合前构象25。融合环在G的可用三维结构中仅被部分解析,但是我们的结果显示环和侧翼β链中的许多位点都被高度限制(图2B–C)。先前的工作已经测试了融合环中F74、Y77、Y119和W121位点的丙氨酸突变对三聚体G稳定性的影响,并且发现只有Y119A没有强烈的副作用25。与先前的工作一致,我们的深度突变扫描显示,在Y119突变为丙氨酸对细胞进入是合理耐受的,但在F74、Y77或W121(图2C)。然而,除了W121之外,所有这些位点都耐受一些氨基酸的突变,这些突变保持疏水性或芳香性(例如,F74L和Y77F被合理耐受) (图2C)。融合环附近的脯氨酸残基(位点89、106、115和117)很大程度上不能耐受突变(图1C, 2B),可能是因为这些脯氨酸对于确保正确的融合环方向很重要。
深度突变扫描也有助于描绘可能在触发细胞进入所必需的G构象变化中起重要作用的位点。推测在一个接头和融合结构域之间的界面上的位点86、173和397的一簇组氨酸有助于控制狂犬病病毒G12,41 (图2D)。与这种假设一致,即这些组氨酸作为“pH传感器”对G的细胞进入功能至关重要,我们的深度突变扫描显示,将这三个位点中的任何一个突变为任何非组氨酸氨基酸都会损害细胞进入(图1C, 2D)。我们的深度突变扫描还显示结构上邻近组氨酸(T60、T62、T171和T176)的苏氨酸残基仅容许丝氨酸突变(图1C, 2D),表明这些残基的羟基部分可能对G功能很重要。这一发现与这些残基与组氨酸簇相互作用的可能性相一致,正如对相关VSV-G融合蛋白中组氨酸簇附近的丝氨酸所作的假设41。
我们的深度突变扫描确定了一些位点,突变限制似乎是由于延伸的中间构象的相互作用,它与融合前三聚体处于平衡状态24,27,31 (图2E)。包括E45、D211、R213、H261、D266和E269的位点簇在延伸的中间体中形成极性和范德华相互作用12 (图2F),我们的深层突变扫描显示,这些位点的几乎所有突变都对细胞进入有害(图1C, 2F)。另一组位点(L46、P144、Y145、I191、F192、L227、W240和V258)在延伸的中间体(图2E,F),我们的深度突变扫描显示,在这些位点只容许疏水性突变(或者在Y145的情况下,没有突变)图1C, 2F)。在融合前构象三聚体中,这些位点中的一些(例如Y145和V258)远离其他位点,并且大量暴露于溶剂(图2E),表明突变限制源于延伸中间体的相互作用,而不是融合前的构象。这些稳定延伸中间体但可能耐受融合前构象突变的位点代表了稳定突变的额外候选位点,这些突变可能使狂犬病G的构象平衡向融合前状态转变。
先前的工作已经通过引入脯氨酸(H270P)突变稳定了融合前构象中的狂犬病G,该突变在融合前构象中是容许的,但在延伸的中间构象中是不利的12,13。类似的基于脯氨酸的稳定策略已被用于稳定I类融合蛋白(例如冠状病毒刺突)的疫苗免疫原42,43)和VSV-G44。与狂犬病病毒G中270位点的脯氨酸独特地阻断融合前三聚体向延伸中间体的转化的想法一致,我们的深度突变扫描显示H270P强烈损害细胞进入,但该位点的大多数其他氨基酸突变被很好地耐受(图S4)。我们使用我们的深度突变扫描来识别发生大构象变化的区域中脯氨酸特别不受欢迎的额外位点(例如,K47、Q256、N259、L260和S265)(图S4)。这些位点代表融合前稳定脯氨酸突变的额外潜在候选位点。
深度突变扫描全面描绘抗体逃逸突变
为了实验测量所有狂犬病G突变如何影响抗体中和,我们将假病毒文库与不同浓度的抗体一起孵育,并使用深度测序来量化每个G变体在每个抗体浓度下感染293T细胞的能力(图3A)。为了将深度测序计数转换为中和值,我们将它们标准化为“未中和标准”的计数,该“未中和标准”由未被抗狂犬病抗体中和的VSV-G假病毒组成36 (图3A)。我们使用之前描述的生物物理模型分析了这些数据45以获得与IC50的对数倍数变化成比例的每个突变的逃逸值。
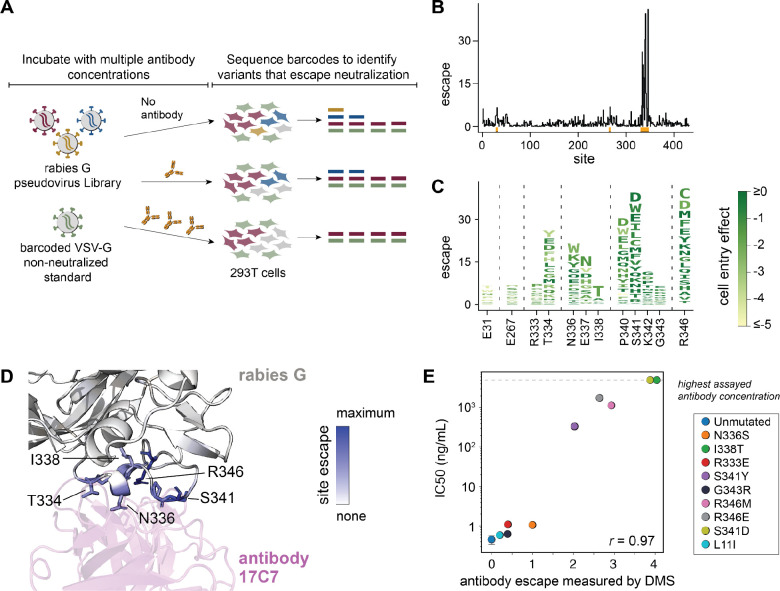
图3.G突变如何影响抗体中和的深度突变扫描,如应用于抗体17C7。
(A)绘制突变对抗体中和作用的影响的工作流程。将狂犬病G假病毒文库与由条形码VSV-G假病毒组成的“未中和标准”混合,然后将该库与不同浓度的抗体一起孵育,并用于感染293T细胞。从被感染的细胞中回收条形码并进行深度测序,以量化每种抗体浓度下每种变体感染细胞的能力。VSV-G未中和的标准假病毒不受抗狂犬病G抗体的影响,因此用于将测序计数转化为在每个抗体浓度下被中和的每个变体的分数。
(B)显示抗体17C7在G中每个位点突变引起的总逃逸的线图。看见https://dms-vep。org/RABV_Pasteur_G_DMS/escape。html逃生的互动视觉化。x轴附近的橙色标记表示在面板(C)的徽标图中放大的站点。
(C)标识图,每个字母的高度与抗体17C7的关键逃逸位点的氨基酸突变引起的逃逸成比例。根据每个突变对细胞进入的影响,字母被涂上颜色。
(17C7和狂犬病G (PDB: 8A1E)的结构,其中G由每个位点突变引起的总逃逸量着色(蓝色表示突变引起最多逃逸的位点)。抗体显示为紫色。
(E)比较深度突变扫描(DMS)中测量的逃逸与标准假病毒中和试验中测量的针对17C7抗体的IC50s的验证试验。原始中和曲线在图S5。选择这些验证试验中测试的突变,以跨越深度突变扫描中测量的逃逸值范围。对具有未突变狂犬病G的假病毒进行三次测量,并绘制平均标准偏差。
我们首先将这种方法应用于单克隆抗体17C7,它是Rabishield暴露后预防剂的活性成分16,33,46并通过冷冻电镜确定了其与G的复合结构12。我们的深层突变扫描显示,逃避17C7中和的突变主要发生在位点334、336–338、340–342和346(图3B,C和交互式可视化https://dms-vep。org/RABV_Pasteur_G_DMS/escape。html)。就G细胞进入功能而言,这些逃逸突变中的许多都具有良好的耐受性(如中字母的颜色所示)图3C)。逃逸突变都发生在17C7和G的结合界面附近(图3D)。一个逃逸突变,I338T,不直接接触抗体,但在N336上产生一个N-连接的糖基化基序,已知它影响G的抗原性47,48。I338S不像I338T那样表现为逃逸突变,因为它对巴斯德毒株G(图1C)。
为了验证抗体逃逸的深度突变扫描测量,我们创建了编码9种不同突变的单个假病毒,这些假病毒在深度突变扫描中对抗体17C7的中和有一系列影响。在用这些假病毒进行的传统中和试验中测量的这些突变的效果与在深度突变扫描中测量的逃逸值高度相关(r = 0。97; 图3E, S5A),验证了该方法的准确性。
八种单克隆抗体的综合逃逸图
我们使用深度突变扫描对八种靶向G(表1)。这些抗体与G上的不同抗原区域结合:两个靶抗原区域I(抗体CR5748,49和RVC2034,50),四个目标区域III (17C716,CR409849,RVA12225,34、和RVC5817,34),两个结合在先前描述的抗原区域之外(CTB01218和RVC6834)。自2017年以来,抗体17C7已在印度进行临床部署19,51和CTB01218是SYN023鸡尾酒的两种活性成分之一52,53最近结束了三期临床试验54。所有八种抗体中和具有未突变狂犬病G的假病毒,尽管具有不同的效力(表1, 图S5B)。
表1.本研究绘制了带有逃逸突变的抗体。
| 抗体 | 发展状况 | 抗原区域 | PDB身份证 | 泛狂犬病病毒活性34 | 半数有效浓度(纳克/毫升) |
|---|---|---|---|---|---|
| 17C716 | 截至2017年,已在印度进行临床部署19,51 | 罗马数字334 | 8A1E12 | 不 | 0。35 |
| CR409849 | CL184鸡尾酒的一部分49,80;二期试验后开发停止19,32 | 罗马数字381 | 不适用的 | 不 | 3。8 |
| RVA12234 | 不适用的 | 罗马数字334 | 7U9G25 | 是 | 0。31 |
| RVC5834 | RVC20鸡尾酒动物试验73 | 罗马数字334 | 不适用的 | 是 | 0。22 |
| RVC2034 | RVC58鸡尾酒动物试验73 | I34 | 6头50 | 是 | 0。36 |
| CR5782 | CL184鸡尾酒的一部分(II期试验后停止开发)19,32;应变面板测试中的部分鸡尾酒19,33 | 182 | 8R4061 | 是 | 0。55 |
| CTB01218 | SYN023鸡尾酒的一部分;临床试验正在进行52,53(第三阶段完成54) | 不适用的18,35 | 不适用的 | 未试验的 | 0。47 |
| RVC6834 | 不适用的 | 不适用的34 | 不适用的 | 是 | 7。6 |
深度突变扫描显示,每种抗体通过在G(图4和交互式可视化https://dms-vep。org/RABV_Pasteur_G_DMS/escape。html)。对于已经通过实验确定其结构与G复合的四种抗体,主要的逃逸突变都发生在抗体结合界面附近的G位点(图5A,B)。然而,只有一小部分接触位点的突变强烈逃避抗体中和(图5A,B),这一结果与先前对其它病毒的抗体逃逸的研究一致55–58。在某些情况下,某些接触位点没有逃逸突变,仅仅是因为所有突变对G细胞进入功能都太有害(例如,抗体RVC20的C228位点)图5B),但在其他情况下,接触位点容许许多突变,但没有一个引起明显的中和逃逸(例如,抗体RVA122的E33位点)图5A,B)。
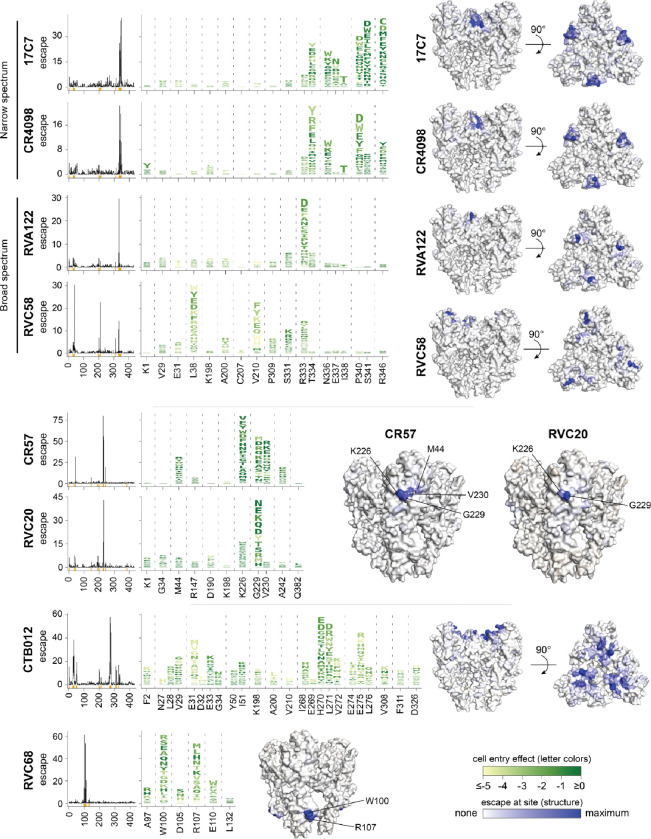
图4.八种单克隆抗体逃逸突变的综合图谱。
对于每种抗体,线图显示了该位点所有突变导致的总逃逸量;x轴附近的橙色标记表示在徽标图中放大的站点。徽标图显示了由关键位点的单个突变引起的逃逸,字母高度与该氨基酸突变的逃逸值成比例,字母根据突变对细胞进入的影响而着色(见图右下方的色标)。该结构显示融合前狂犬病病毒G (PDB: 7U9G ),其残基被每个位点突变引起的总逃逸着色(见图右下方的色标)。看见图5关于抗体的其他结构图,以及与g 。的复合物中实验解决的结构,参见https://dms-vep。org/RABV_Pasteur_G_DMS/escape。html互动热图和基于结构的逃生可视化。
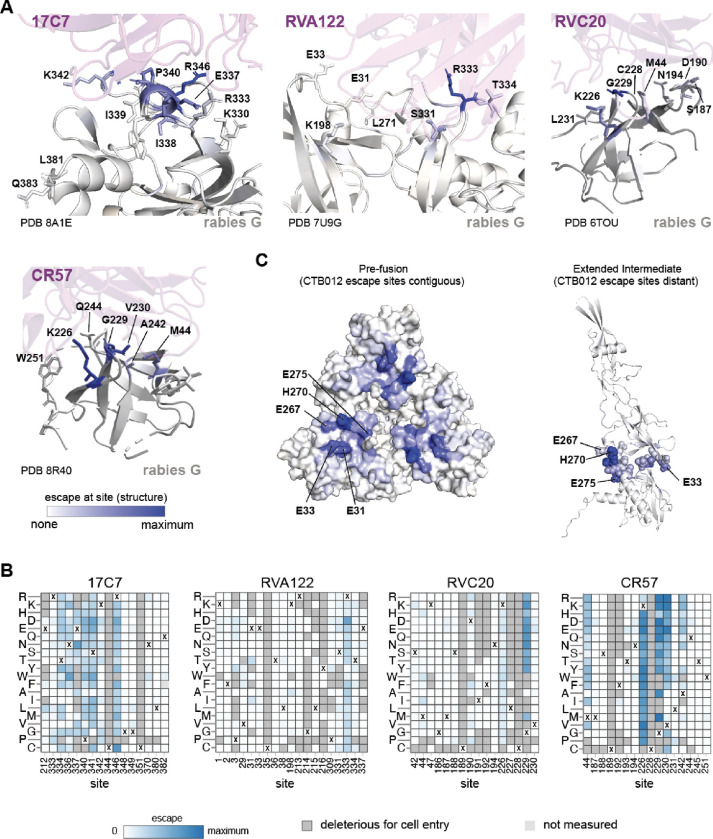
图5.G中只有部分抗体接触位点的突变介导了逃逸。
(A) G通过在深度突变扫描中测量的每个位点的抗体逃逸程度来着色,所述深度突变扫描用于具有与G复合的实验确定的结构的四种抗体(PDB 8A1E、7U9G、6TOU和8R40)。抗体以洋红色显示。G的色标定义在面板的左下方:白色表示在该位置没有逸出,蓝色表示在该位置有强逸出。
(B)接触实验确定的结构复合物中每种抗体的G中所有位点的每种突变的逃逸值。G中的一个位点被定义为接触,如果任何一个原子在抗体的4以内。基于深度突变扫描中测量的逃逸值,突变被着色为白色到蓝色。对细胞进入太有害而不能可靠测量其对抗体中和作用的突变以深灰色显示。少量浅灰色突变(如Q382F和K226H)由于文库覆盖范围不足,没有可测量的逃逸。在未突变的巴斯德G中,每个位点的氨基酸同一性用“X”表示。
(C)狂犬病G在融合前(PDB 7U9G)和延伸中间体(PDB6LGW)构象中的结构,用从CTB012抗体的完全逃逸着色的位点着色。逃逸位点在融合前狂犬病G中是连续的,但在延伸的中间构象中更远。为了便于查看,关键站点显示在扩展中间的球体中。色阶与(A)相同。
靶向G的相同抗原区域的抗体可以在它们的逃逸突变上有很大不同。例如,17C7、CR4098、RVA122和RVC58都与G34。然而,尽管17C7和CR4098通过非常相似的位点组的突变而逃逸,但是RVA122和RVC58的逃逸突变的位点更加不同(图4)。即使抗体共享逃逸位点,个体突变的影响也可能不同。例如,N336S35和R346K59,60逃避17C7但不逃避CR4098,尽管在位点336和346的一些其它突变逃避两种抗体(图4)。同样,RVC20和CR57都与抗原区I结合34在那里它们被认为阻断α7烟碱乙酰胆碱受体的结合位点22,61,62并防止pH驱动构象变化50,61。尽管它们的表位相似,但这两种抗体的逃逸突变仅部分重叠(图4, 5A,B)。例如,两种抗体都受到K226和G229突变的影响,但V230和A242的突变仅强烈逃避CR57。
逃逸图还提供了为什么一些抗体比其他抗体具有更大的抗狂犬病病毒的广度的见解。例如,在靶向抗原区域III的抗体中,17C7和CR4098仅中和狂犬病,而RVA122和RVC58也广泛中和非狂犬病的狂犬病病毒(例如,Duvenhage狂犬病病毒、欧洲蝙蝠1型狂犬病病毒和澳大利亚蝙蝠狂犬病病毒)34。与窄谱抗体(17C7和CR4098)不同,广谱抗体(RVA122和RVC58)通过在较少位点或具有较低突变耐受性的位点突变而逃脱。具体来说,RVA122主要是通过仅一个位点的突变而逃脱的:R333(图4, 5A,B),这是疫苗株中常见的突变位点63–65但是突变通常会削弱致病性66,67。RVC58通过几个位点的突变得以逃脱,但这些突变中的许多,如L38和V210位点的突变,对G的细胞进入功能有害(图4请参见徽标图中字母的颜色)。
两种抗体(CTB102和RVC68)缺乏与G复合的结构,并且不结合先前确定的抗原区域,尽管CTB102的表位已经通过丙氨酸诱变和逃逸研究得到部分确定18。我们的深度突变扫描显示,CTB102与融合前狂犬病病毒G上空间聚集的G顶点上的位点结合,主要在涉及V29-E33和I268-L275的环中(图4, 5C)。这些环在G的延伸中间构象中经历了实质性的重排24,27,31这意味着CTB102的表位仅在G(图5C)。RVC68对狂犬病病毒具有非常广泛的中和活性34,但对狂犬病G的中和效力相对较差(表1)。我们的深度突变扫描显示,RVC68靶向狂犬病G融合结构域的碱基(图4)。这种抗体对不同的狂犬病病毒的广泛活性可能源于先前测试的病毒中靶位点的保守性34。
抗体逃逸突变存在于自然发生的狂犬病毒株中
G蛋白在天然狂犬病毒株中各不相同,并且已经鉴定出一些毒株对特定抗体具有抗性,包括临床相关抗体33,34,48,59。我们的深度突变扫描能够系统地识别抗体耐药毒株。我们首先检查了自然发生的G序列中每个氨基酸突变的频率与我们的深度突变扫描中测量的抗体逃逸(图6A和交互式绘图https://dms-vep。org/RABV_Pasteur_G_DMS/natural_seqs。html)。在所有抗体的天然G序列中,至少会引起一些逃逸的突变都存在,但是这些突变的频率和它们引起的逃逸的程度在抗体之间有明显的不同。例如,许多来自抗体17C7的强逃逸突变在天然序列中出现频率可观(图6A)。相比之下,抗体如RVC20在天然序列中仅具有几个频率可观的中等效应逃逸突变(图6A)。
图6.狂犬病中自然发生的抗体逃逸突变。
(A)在巴斯德毒株G的深度突变扫描中,天然发生的狂犬病序列中每个G氨基酸突变的频率与该突变引起的逃逸相对比。每个图显示了不同抗体的逃逸。垂直虚线表示在天然毒株中观察到至少两次的突变;浅灰色的点表示罕见的突变。在天然毒株中没有观察到的突变被指定为频率10−5启用对数比例绘图。看见https://dms-vep。org/RABV_Pasteur_G_DMS/natural_seqs。html该图的交互式版本允许鼠标悬停在单个点上以查看突变身份。
(B)所有公开可得的7,122个狂犬病G序列的系统发生树,通过对所有相对于巴斯德毒株的突变的实验测量的效果求和来预测,通过抗体17C7的逃逸而着色。白色表示无逃逸,蓝色表示强逃逸。看见https://nextstrain。org/groups/jbloomlab/dms/rabies-G交互式next毒株系统发育,显示每种抗体的所有毒株的预测逃逸。该树由Gannoruwa bat lyssavirus(登录号:NC_031988。1),这是一种非狂犬病的狂犬病病毒,也属于I类。在验证中和试验中经过实验测试的毒株被标记。标记了不同进化枝的共同宿主。交互式Nextstrain系统发育提供了按宿主标记所有毒株的选项。
(C)对于验证中和试验,我们鉴定了预计会被两种不同的天然毒株逃脱或中和的抗体。该表总结了验证分析中使用的毒株和抗体。最后两列中抗体名称和突变后括号中的数字是深度突变扫描的逃逸值。
(D)来自巴斯德、NY-2011–12012 o或A12_2718毒株的表达G的假病毒对指定抗体的中和曲线。点表示技术复制品的平均标准误差。
我们预测了每种狂犬病毒株对每种抗体的逃逸,方法是将其所有组成G突变相对于巴斯德毒株的实验测量效果相加。我们通过Nextstrain可视化了这些预测68系统发育树,其中序列可以通过它们的预测逃逸来着色(https://nextstrain。org/groups/jbloomlab/dms/rabies-G)。作为一个例子,所有7,122个公开可得的G序列的树的静态视图显示于图6B。尽管大多数毒株缺乏来自17C7的逃逸突变(白色在图6B),有一些毒株预计会强烈逃避这种抗体(蓝色在图6B)。这些毒株中的大多数在位点336或346处含有突变(图S6A),两者都是在深度突变扫描中测量到突变强烈逃逸17C7的位点(图4, 6A,C)。注意,许多被预测最强逃脱17C7的测序毒株来源于被感染的蝙蝠或野生动物,而不是狗(图6B),这是人类感染的最常见来源69。
作为验证,我们确定了两个预测强烈逃避抗体17C7的天然毒株,NY-2011–1202 o和A12_2718(图6C)。这两个毒株的G蛋白都与巴斯德毒株G有至少35个氨基酸突变。我们从这些毒株中的每一个产生了表达G的假病毒,并通过17C7以及另一种预测不会被每个毒株逃脱的抗体(图6C,D)。如深度突变扫描所预测的,两种毒株都强烈逃避了17C7的中和作用,但保留了与巴斯德毒株相似水平的对照抗体的中和作用(图6D)。
为了测试深度突变扫描中确定的顶端逃逸突变在多大程度上解释了逃逸,我们从A12_2718毒株G中去除了两个顶端逃逸突变(I338T或R346S ),或者将它们引入巴斯德毒株G中。与深度突变扫描一致,从A12_2718 G中去除顶端逃逸突变I338T部分恢复了17C7的中和作用,同时将这一单个突变添加到巴斯德毒株G中,使其完全抵抗17C7的中和作用(图S6B)。将较弱的逃逸突变R346S引入巴斯德毒株减少但没有消除17C7的中和作用,这也与深度突变扫描一致(图S6B)。虽然这些测量验证了深度突变扫描预测此处测试的抗体的基本上不同的毒株的逃逸的能力,但是当将深度突变扫描外推至序列不同的毒株时,应该始终小心谨慎。在某些情况下,上位性可能导致在其他病毒蛋白中观察到的突变效应的改变70–72。
讨论
在这里,我们使用深度突变扫描来测量狂犬病病毒G的突变如何影响细胞进入和抗体中和。对突变如何影响G细胞进入功能的全面测量定义了蛋白质中哪些位点最有能力进行进化改变,并阐明了突变如何影响G的构象动力学,从而可以为疫苗抗原的设计提供信息。突变如何影响抗体中和的测量描绘了关键的表位。这一信息可以指导抗体和抗体鸡尾酒的开发,这些抗体和抗体鸡尾酒对G的天然遗传多样性是鲁棒的,并且可以定义在疫苗设计中保留的关键表位。
关于突变如何影响G的细胞进入功能,我们发现G的一些区域(如融合结构域的碱基和部分三聚体顶点)不能耐受大多数突变,但其他区域可以耐受突变而不会显著损害细胞进入。在某些情况下,我们可以确定突变限制似乎来自融合前或延伸中间构象之一中形成的蛋白质接触的位点。对这两种构象产生不同影响的突变有助于疫苗免疫原的设计。狂犬病毒G的构象动力学被假设阻碍了中和抗体对未修饰的G疫苗的反应,因为一些有效的中和抗体仅靶向融合前的G13,25,26。因此,一些研究试图通过引入阻断构象变化的脯氨酸突变来稳定融合前G12,13类似于对其他病毒融合蛋白所做的42–44。我们的工作提出了融合前稳定的另一种机制,即通过识别突变可能使延伸的中间体不稳定的位点。
我们的工作更好地定义了中和抗体如何靶向G,以及这些抗体如何受到病毒突变的影响。描述哪些病毒突变逃避抗G抗体是重要的,因为单克隆抗体正被开发用于暴露后预防,其中一些已经用于临床。我们全面绘制了八种抗体的逃逸突变,包括Rabishield中的抗体和其他几种正在开发中的用于抗狂犬病的抗体16–18,73。这些抗体中的一些已经预先确定了它们与G的复合结构,我们的工作表明只有抗体-G界面上的一些突变导致了逃逸。我们绘制的其他抗体尚未进行结构表征,对于这些抗体,我们的工作定义了它们的表位。此外,我们的测量有助于合理解释为什么抗体针对狂犬病病毒的宽度不同:最宽的抗体倾向于靶向G中大多数突变对G的细胞进入功能有害的位点。
我们的深度突变扫描可以帮助识别哪些天然狂犬病毒株可能逃脱特定的抗体。引人注目的是,我们发现我们检测的所有八种抗体的逃逸突变都存在于天然狂犬病毒株中——但逃逸突变在某些抗体中比在其他抗体中更常见。我们提供了交互式系统发生树,根据我们实验中测量的组成突变的影响,预测公开可用的狂犬病G序列的逃逸。这些预测是近似的,因为突变组合之间可能存在上位性70–72(参见研究的局限性下一节)。然而,我们确实通过实验验证了几个例子,表明我们的数据可以预测自然毒株对特定抗体的易感性或抗性。展望未来,深层突变扫描数据提供了一种强有力的方法来识别可能隐藏抗性突变的天然毒株,尽管考虑到上位性的可能性,这种预测应该总是被独立验证。
总的来说,我们的工作首次提供了对狂犬病病毒G突变的功能和抗原效应的大规模测量。我们的数据可以通过我们公开提供的交互式可视化工具(https://dms-vep。org/RABV_Pasteur_G_DMS/),这将有助于它们在基础研究、疫苗和抗体开发以及狂犬病病毒进化监测中的应用。
研究的局限性
我们的测量是使用用狂犬病病毒G假型化的慢病毒颗粒和293T细胞感染进行的。该假病毒系统消除了与制造实际致病狂犬病病毒突变体相关的生物安全顾虑;然而,需要注意的是,293T细胞的假病毒感染不能概括实际狂犬病病毒感染的所有方面在活生物体内3,74,75。因此,尽管我们的实验确实捕捉到了G-介导的细胞进入和抗体中和的核心过程,但它们可能没有真实地反映真实病毒感染的一些更微妙的方面,例如特异性受体的不同使用20,62,76。
我们的深度突变扫描使用了来自实验室适应的巴斯德疫苗株的G,该疫苗株已经在动物和细胞系中广泛传代77。这种传代中的一些突变增强了假病毒的产生78,79但可能会改变G相对于自然毒株的一些特性。此外,突变之间总是存在上位性的可能性70–72,使得巴斯德G中的突变对糖蛋白的影响可能不同于具有多个突变的其他毒株。当使用深度突变扫描来预测其他狂犬病毒株的抗体逃逸时,这种限制尤其重要(的最后一节结果)。虽然这种预测在我们这里测试的例子中得到了很好的验证,但是当从巴斯德g。
最后,像所有高通量实验一样,深度突变扫描会受到实验噪声的影响。我们使用独立生成的假病毒库进行了所有重复实验,但在本文的大部分内容中,我们仅报告了这些重复的平均值。对于特别感兴趣的突变,我们还建议查看交互式热图,网址为https://dms-vep。org/RABV_Pasteur_G_DMS/在这里,您可以将鼠标悬停在点上,以查看每个单独复制的测量结果,并查看其他质量控制指标(如观察到的每个突变的独特变异的数量)。
方法略
参考
https://pmc。ncbi。nlm。nih。gov/articles/PMC11702696/
Hits: 188
- 狂犬病(2025年6月更新)
- 狂犬病 你应该知道的
- 预防和治疗狂犬病的狂犬病疫苗
- 狂犬病可能成为历史
- 看看每种疫苗:狂犬病疫苗
- 阿拉巴马州妇女在从车上卸下杂货时被狂犬病狐狸咬伤:“公共卫生威胁”
- 应对狂犬病
- 全球疫苗免疫联盟将促进全球疫苗免疫联盟、世卫组织和阿联酋50多个国家获得拯救生命的人类狂犬病疫苗
- 美国CDC发布了将狗带入美国的新规定,旨在防止狂犬病
- 全国狂犬病监测方案
- 2024年东帝汶首例狂犬病确诊病例
- WHO实况报道 狂犬病
- 狂犬病
- 狂犬病疫苗接种:给医疗保健提供者的信息
- 特定感染的流行病学和控制:狂犬病
- 狂犬病疫苗接种的注意事项或禁忌症
- ACIP 使用减少(4剂)疫苗计划进行暴露后预防以预防人类狂犬病
- 实施良好的狂犬病暴露后预防方案
- ACIP 使用修改后的暴露前预防疫苗接种计划预防人类狂犬病,美国,2022年
- 西班牙犬类狂犬病免疫保护的影响因素
- 减少犬的进口等待期-对狂犬病恐惧科学合理的变化
- 老年人对狂犬病暴露后预防无应答:挑战和方法
- 狂犬病疫苗的效力、免疫原性和有效性:体外和体内方法
- 狂犬病人免疫球蛋白 (HRIG)
- “震惊”的妇女,超过6,000美元的救命狂犬病治疗账单
- 负鼠感染狂犬病毒对这种病毒在城市环境中的传播敲响了警钟
- 索马里蜜獾感染未报告的首例疑似人狂犬病病例研究
- 两名狂犬病研究人员解释如何保护自己免受这种疾病的侵害
- 临床医生常见的狂犬病问题
- 狂犬病疫苗
- 世界卫生组织关于狂犬病的常见问题
- 狂犬病实况报道
- 狂犬病
- 狂犬病是一种古老的、不可预测的、可能致命的疾病——两位狂犬病研究人员解释了如何保护自己
- 狂犬病疫苗短缺:给卫生专业人员的建议
- 7例被狂犬咬伤者接种狂犬病疫苗的效果观察
- 全球狂犬病风险:狂犬病疫苗短缺期间的实用建议
- 巴西一个土著村庄被蝙蝠掠夺的高风险:警告狂犬病在马卡利人中重新出现
- 评估在澳大利亚蝙蝠狂犬病病毒和狂犬病暴露后预防中血清学的益处
- 蝙蝠处理者的狂犬病暴露前预防
- 基于狂犬病中和抗体水平的狂犬病加强剂时机指南
- 施用狂犬病疫苗和免疫球蛋白
- 为狂犬病暴露后预防开发的单克隆抗体鸡尾酒疗法
- 狂犬病预防处置常见问题解答(成大生物)
- 世界卫生组织狂犬病专家磋商会 第三版报告
- 世卫组织对狂犬病的看法
- 新型狂犬病疫苗
- 狂犬病病毒可以抗强大的天然免疫
- 狂犬病的被动免疫
- 亚洲狂犬病预防
- 秘鲁高风险人群的大规模狂犬病暴露前预防
- 人用狂犬病疫苗
- 野生动物狂犬病疫苗
- 狂犬病和狂犬病疫苗的历史
- 狂犬病的生命周期、传播和发病机制
- 狂犬病暴露后管理指南(英国 2023年1月)
- 2022年印度马哈拉施特拉邦一名幼儿出现临床狂犬病症状后存活
- 第27章:狂犬病
- 狂犬病:问题和答案
- 《狂犬病暴露预防处置工作规范(2023年版)》解读问答
- 狂犬病暴露预防处置工作规范(2023年版)
- 狂犬病
- 狂犬病相关问题解答
- 疾病控制中心加强了对进口狗的狂犬病管理,原因如下
- 关于狂犬病
- 一名加州艺术教师在教室遭遇蝙蝠后死于狂犬病
- WHO 实况报道 动物咬伤 2024年1月
- 疫苗接种和免疫 狂犬病
- 世卫组织推荐皮内途径用于狂犬病暴露后预防
- 狂犬病疫苗:世卫组织立场文件–2018年4月
- WHO实况报道 狂犬病 2024年6月
- 狂犬病-结束忽视, 实现可持续发展目标 被忽视的热带病路线图 2021-2030
- 动物狂犬病
- 宠物主人对疫苗的犹豫越来越多——一位公共卫生专家解释了为什么这很重要
- 兽用狂犬病疫苗
- 何时寻求狂犬病医疗护理
- 猫
- 关于获得人类狂犬病疫苗的社会正义观点
- 评估新的狂犬病暴露后预防(PEP)方案或疫苗
- 卫生和福利部-狂犬病
- 狂犬病暴露后预防用单克隆抗体开发的最新进展:临床开发管线现状综述
- 世卫组织对狂犬病免疫接种的立场 – 2018 年最新情况
- 恐水症:1874 年的狂犬病和改变一切的救命疫苗
- 新的人类狂犬病疫苗正在研发中
- 为什么消除狂犬病?
- 为什么现在要根除狂犬病?
- 狂犬病-NFID
- 为狗接种疫苗 – 它们不会因接种疫苗而患上自闭症
- 宠物主人版 狗的狂犬病
- 猫的狂犬病
- 狂犬病-国际脑炎协会
- 器官移植后如何感染狂犬病?
- 器官移植患者感染狂犬病后死亡
- 人类狂犬病疾病负担:Rabipur®疫苗的潜在预防作用
- 印度东北部农村的狂犬病:强调同一健康方法紧迫性的病例报告
- 狂犬病毒糖蛋白的深度突变扫描确定了突变限制和抗体逃逸突变
- 人类狂犬病:一种治疗方法
- 通过受感染狗唾液污染的隐形眼镜传播狂犬病病毒(病例报告)
- 越南暴露前预防计划中基于灭活 vero 细胞的狂犬病疫苗 (Rabivax-S) 的安全性和免疫原性
- 狂犬病生物制剂在 III 类动物暴露儿科患者中的安全性和临床疗效的前瞻性研究
- 重复狂犬病疫苗接种揭示人类中和抗体的分子趋同
- 狂犬病病毒的感染和预防
- 关于 Zagreb 或 Essen 方案后加强疫苗接种的免疫原性和安全性的 3 期临床试验
- 通过 RABV-G 结构域筛选和异源初免-加强免疫优化狂犬病 mRNA 疫苗功效
- 狂犬病实验室诊断的最新情况
- 三色蝠相关狂犬病毒引起的一例人狂犬病的报道
- 一种核苷修饰的狂犬病mRNA疫苗在小鼠和非人灵长类动物中诱导出持久而全面的免疫反应
- 狂犬病的识别和治疗:病例报告和讨论
- 人类狂犬病的诊断困难:病例报告和文献回顾
- 狂犬病感染的边缘系统症状
- 狂犬病脑炎的生存率
- 人类狂犬病:2016年更新
- 突尼斯一名狂犬病幸存儿童:病例报告
- 肯尼亚蝙蝠携带的Duvenhage病毒导致人类狂犬病死亡:昏迷诱导、氯胺酮和抗病毒药物治疗无效
- 病例报告:狂犬病幸存者长期随访中的神经功能恢复与血清学反应
- 蝙蝠和食肉动物中狂犬病的比较病理学及其对人类溢出影响
- 病例报告:狂犬病生存者:印度病例系列
- 评估人类抗狂犬病疫苗的反应:一种快速、高通量适应性、基于假病毒的中和试验,作为快速荧光病灶抑制试验 (RFFIT) 的替代方案
- 病例报告:狂犬病幸存者长期随访中的神经功能恢复与血清学反应
- 巴西巴伊亚州狂犬病爆发的流行病学与分子分析
- 俄罗斯下诺夫哥罗德地区动物狂犬病(2012-2024年):描述性与预测性流行病学分析
- 巴西东南部一只黑鼠耳蝠(黑鼠耳蝠属物种Myotis nigricans)感染狂犬病病毒、科勒巴尔通体菌以及婴儿利什曼原虫的混合感染情况
- 2013-2023 年悉尼大都会居民狂犬病暴露后治疗:回顾性病例系列分析
- 用肌肉靶向脂质纳米颗粒配制的狂犬病病毒 G 蛋白 mRNA 在小鼠体内的免疫原性
- 关于狂犬病的 One Health Lens:马拉维利隆圭农村狂犬病病毒的人类-蝙蝠相互作用和基因组见解
- 阿根廷低地貘 (Tapirus terrestris) 麻痹狂犬病的首次报告
- 由表达狂犬病糖蛋白的非复制型病毒载体痘苗病毒天坛株改良株(MVA)和腺病毒5型(Ad5)所诱导产生的对狂犬病的保护作用
- 印度野生猫科动物中狂犬病毒的免疫病理与分子筛查:揭示从野外到城市的溢出效应
- 韩国貉 (Nyctereutes procynoide koreensis) 接种了含有 ERAGS-GFP 毒株的新型狂犬病诱饵疫苗的保护性抗体反应
- 宠物护理 疫苗
- 为您的宠物接种疫苗
- 狂犬病感染:如何保护您的孩子
- 新型狂犬病暴露后预防单克隆抗体鸡尾酒疗法的安全性和耐受性
- “愤怒的狂犬病”人类图画案例
- 蝙蝠咬伤
- 研究蝙蝠病毒如何帮助预防人畜共患疾病
- 狂犬病:症状繁多、宿主广泛的恶魔病毒——罗德尼·罗德解读
- 狂犬病的同一健康:不仅适用于动物
- 狂犬病和蛔虫:浣熊相关传染病
- 丽莎病毒 很罕见,但致命。如果蝙蝠咬你怎么办?
- 海地在四个省开展新的疫苗接种运动,加强防治犬类狂犬病
- 家养及其他动物狂犬病病毒感染的挑战:病毒学层面的困惑、惊愕、懊恼与好奇交织
- 双重战斗:狂犬病和蛇咬伤在东南亚的毒害
- 狂犬病在城市无人管理的猫群中爆发 — 马里兰州,2024 年 8 月
- 尼泊尔正力争在2030年前消灭狂犬病,但领导人表示,现在是加大疫苗投资的时候了。
- 现代狂犬病疫苗的诞生历程
- 一种基于mRNA的新型狂犬病病毒多表位疫苗:通过反向疫苗学和免疫信息学进行计算机设计
- 快速荧光灶抑制试验(RFFIT)的验证与评价 —— 作为狂犬病疫苗相对效价间接检测方法的中和抗体定量检测:NIH 试验的替代方案
- 暴露后狂犬病预防失败案例研究
- 2021年明尼苏达州一起经确认的人畜共患病暴露后,疑似因宿主介导导致暴露后预防失败的致命人类狂犬病感染病例
- 给野生动物投喂疫苗:口服狂犬病疫苗的故事
- 降低肯尼亚西部臭名昭著的狗市狂犬病风险
- 印度的狂犬病
- 海地的狂犬病
- 2024年10月至2025年2月,美国发生通过实体器官移植传播狂犬病的病例,该器官移植供体未确诊患有狂犬病
- 两例死亡与狂犬病感染的肾移植有关
- 明尼苏达州一家奶牛场的牛群中爆发狂犬病聚集性疫情——2024年
- 摩洛哥的狂犬病
- 2024年肯塔基州和俄亥俄州输入性人类狂犬病病例
- 2024年明尼苏达州和加利福尼亚州人类狂犬病死亡人数
- 反疫苗人士对宠物狂犬病 RNA 疫苗的虚假宣传
- 新型口服狂犬疫苗能否帮助我们最终终结这种疾病?
- NACI 2026 年 1 月 30 日发布的声明摘要:狂犬疫苗用于暴露前预防 (PrEP) 的最新指南
- 狂犬疫苗的给药途径:数据比较
- 猫会得狂犬病吗?
- 2022-2024年中欧狂犬病疫情再度出现
- 研讨会报告:改进狂犬病血清学方法和程序的标准化


孟博士您好 刚才问题落下一句话 我今天下楼 碰到一个车库住的人倒猫砂盆 他家还养狗 一个狗一个猫 猫天天在外面跑 狗如果也在猫砂盆里上厕所或者里面有狗的口水啥的 外面风很大 我迷眼睛了 要是猫砂盆里面的东西刮进眼睛 有无风险?末针加强在24年10月初。
孟博士您好 我今天下楼 碰到一个人倒猫砂盆 外面风很大 我迷眼睛了 如果猫砂盆里面的东西刮进眼睛 有无风险?末针加强在24年10月初。
尊敬的孟博士您好:
本人极度恐狂,有几个问题想咨询下您,还望您解答,谢谢!
1.我家三岁多的小孩两周前在小区游乐园被另一个小朋友用玩具划伤脸部,有出血。当时附近有其他人带的一条小狗,两个小孩都没有和小狗直接接触过,但是弄伤我家小孩的这个小孩于一两分钟前有在小狗刚刚呆过的地方呆过。假如小狗有唾液滴到地上,这个小孩的玩具有沾到这个唾液,然后这个玩具又划伤了我家小孩的脸部出血(整个过程大概三分钟),这样是否有感染风险。伤口不算深,但是有破皮出血,当时只是用湿纸巾擦拭了一下。
2.现在已经过去两周了,再打疫苗是否已经晚了,这种情况现在还有打疫苗的必要吗。
3.对于三岁多小孩,又是伤的脸部,潜伏期是否会短很多,大概观察多久可以放心。
现在很焦虑,希望得到您的解答,谢谢。
你这太复杂,建议咨询医生