Contents
摘要
Zagreb 和 Essen 方案在免疫原性方面具有相似性;然而,这些方案如何影响加强疫苗接种的免疫原性仍不清楚。我们进行了一项临床试验,以评估在初次接种 Zagreb 或 Essen 方案后使用纯化的 Vero 细胞狂犬病疫苗加强免疫的免疫原性。这项随机、开放标签、对照的 3 期试验在中国浙江省上虞市和嵊州市进行,分为初级疫苗接种和加强疫苗接种阶段。筛选后,所有符合条件的参与者被分配到 A、B、C、D、E 或 F 组。A、B 和 C 组Zagreb方案方案作为主要疫苗,而 D、E 和 F 组Essen 方案方案。加强疫苗接种在初次疫苗接种后 6 个月进行。B 组和 E 组接受了一剂加强剂,而 C 组和 F 组接受了两剂加强剂。在加强针前、加强针后 14 天和加强针后约 6 个月采集血样。评估从第一次加强剂量到最后一次剂量后 6 个月的安全性。共有 718 名参与者完成了加强疫苗接种。加强后 B、C、E 和 F 组的抗体阳性率 (APR) 为 100%。即使在一次加强后,抗体滴度也显着升高,B 组 (48.80 IU/ml) 和 C 组 (64.38 IU/ml) (Zagreb方案) 远高于 E 组 (34.25 IU/ml) 和 F 组 (42.89 IU/ml) (Essen 方案)。虽然 B 组 (11.22%) 和 C 组 (15.79%) 的 ARs 发生率高于 E 组 (3.68%) 和 F 组 (10.87%),但它们都是轻微且短暂的。未报告与疫苗接种相关的严重不良事件 (SAE)。Zagreb 方案后加强疫苗接种的免疫原性显著高于 Essen 方案后。一次加强针可能足以将抗体滴度提高到 0.5 IU/mL 以上。
临床试验注册:此试用版于 2021 年 8 月 3 日在 http://www.chinadrugtrials.org.cn/index.html 注册,注册号为 CTR20210426。
补充资料
在线版本包含补充材料,可在 10.1038/s41598-025-88361-1 上获得。
介绍
根据世界卫生组织 (WHO) 的数据,狂犬病是一种由狂犬病病毒引起的致命人畜共患疾病,每年导致全球 59,000 人死亡1-3。在接触狂犬病病毒后预防性接种狂犬病疫苗是控制和预防狂犬病的唯一有效措施。自 2010 年以来,WHO 建议采用两种肌内暴露后预防 (PEP) 方案:Essen 方案和Zagreb方案4。应在第 0、3、7、14 和 28 天接种一剂 Essen 方案,而应在第 0 天接种两剂 Zagreb 方案,然后在第 7 天和第 21 天接种一剂4。Zagreb方案于 1984 年在克罗地亚Zagreb开发,已在全球范围内使用超过 20 年。来自临床研究和荟萃分析的数据表明,Zagreb方案在免疫原性方面并不劣于Essen 方案,并且具有良好的安全性 5-11。
为已完成初级狂犬病疫苗接种过程的狂犬病暴露者提供疫苗加强剂。疫苗加强剂的剂量通常低于初级疫苗;其目的是快速提高抗体滴度并保护暴露的个体免受病毒侵害。但是,不同国家/地区的加强疫苗接种时间表有所不同。大多数发达国家,如美国、英国和加拿大,建议在暴露后第 0 天和第 3 天肌肉注射两次加强剂,无论暴露和初次疫苗接种之间的间隔如何12-14。同时,如果狂犬病暴露发生在初次疫苗接种后 >3 个月,中国仅建议肌肉注射两次加强剂15。由于皮内注射的成本效益,许多发展中国家都在使用它,例如泰国和菲律宾。如果在初次接种后的 6 个月内发生暴露,泰国建议在第 0 天皮内注射 0.1 毫升疫苗;如果在初次接种后超过 6 个月发生暴露,则在第 0 天和第 3 天进行皮内注射。16。菲律宾建议在第 0 天和第 3 天向狂犬病病毒暴露风险高的人群接种 0.1 毫升疫苗17 。各国加强疫苗接种计划的差异可能与初次疫苗接种后抗体反应的有限持久性(“免疫持久性”)有关。狂犬病 PEP 后引发的抗体反应相对较短18。此外,加强疫苗接种时的抗体滴度极大地影响了加强疫苗接种的免疫原性19-22。因此,有必要评估加强疫苗接种是否可以增加疫苗的免疫原性,即使在初次疫苗接种后很长时间接种。与使用 Essen 方案接种疫苗相比,使用 Zagreb 方案接种疫苗涉及在更短的时间内接种较低剂量的疫苗;因此,Zagreb方案的依从率高于Essen 方案,并且更实惠23。尽管Zagreb方案得到了广泛应用,但接种该方案后接种的疫苗加强剂的免疫原性和安全性尚未得到全面评估。因此,我们进行了一项随机临床试验,以比较纯化的 Vero 细胞狂犬病 (Speeda) 疫苗在初次接种按照Zagreb和Essen 方案后 6 个月用作加强剂时的免疫原性和安全性。
结果
参与者
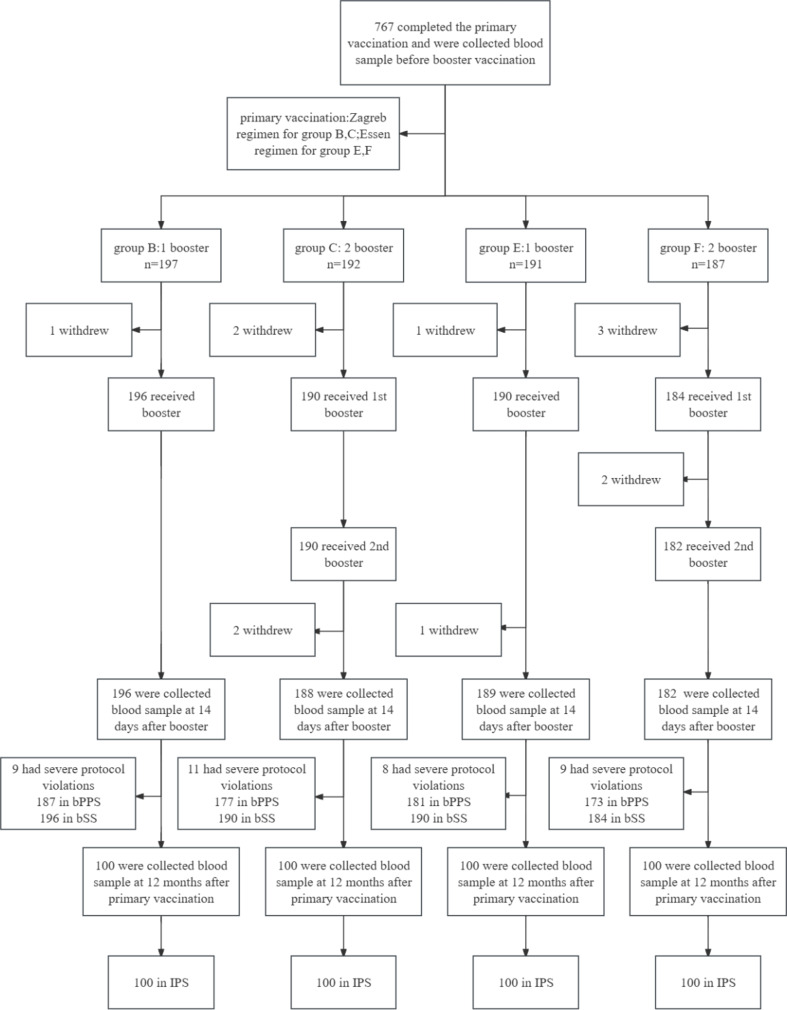
在第 0 天(加强前),共有 767 名完成 B、C、E 和 F 组初次疫苗接种的参与者提供了血液样本。在加强疫苗接种阶段,12 名参与者退出试验(B、C、E 和 F 组分别为 1、4、2 和 5),37 名参与者严重违反方案(B、C、E 和 F 组分别为 9、11、8 和 9)。最后,718 名参与者被纳入 bPPS(B、C、E 和 F 组分别为 187、177、181 和 173 名),bSS 包括 760 名参与者(B、C、E 和 F 组分别为 196、190、190 和 184 名)(图 D)。1). 在第 6 个月,从每组 100 名参与者身上采集血样并纳入 IPS。bPPS 的人口统计特征如表 1 所示。所有变量在四组之间均均衡(即 B、C、E、F;P > 0.05)。
图 1.
表 1.bPPS 中的基线患者特征。
| B 组 | C 组 | E 组 | F 组 | *P 值 | |
|---|---|---|---|---|---|
| 参与者人数 | 187 | 177 | 181 | 173 | |
| 年龄 | |||||
| 平均值 (SD) | 35.7 (13.2) | 34.5 (13.3) | 34.9 (13.1) | 36.2 (13.6) | 0.5997 |
| 中位数 (范围) | 37.0 (10,59) | 34.0 (10,59) | 36.0 (10,59) | 40.0 (10,59) | |
| 性别 | |||||
| 男性 n (%) | 86 (45.99) | 86 (48.59) | 69 (38.12) | 85 (49.13) | 0.1332 |
| 女性 n (%) | 101 (54.01) | 91 (51.41) | 112 (61.88) | 88 (50.87) | |
| 民族 | |||||
| 汉族人口 n (%) | 187 (100.00) | 176 (99.44) | 180 (99.45) | 172 (99.42) | 0.7140 |
| 其它 | 0 | 1 (0.56) | 1 (0.55) | 1 (0.58) | |
| 高度 (cm) | |||||
| 平均值 (SD) | 163.1 (7.5) | 162.5 (8.1) | 162.1 (8.1) | 163.3 (8.4) | 0.4724 |
| 重量 (kg) | |||||
| 平均值 (SD) | 63.41 (11.43) | 62.88 (12.60) | 61.97 (11.84) | 63.29 (13.01) | 0.6679 |
| 严重疾病史 | |||||
| 是 n (%) | 4 (2.14) | 2 (1.13) | 4 (2.21) | 4 (2.31) | 0.8520 |
| 无 n (%) | 183 (97.86) | 175 (98.87) | 177 (97.79) | 169 (97.69) | |
每个方案集的加强剂 (bPPS) 包括完成加强疫苗接种、在接受加强剂之前和之后 14 天提供血样且没有严重违反方案的参与者。
*所有四组比较的 P 值。
免疫原性
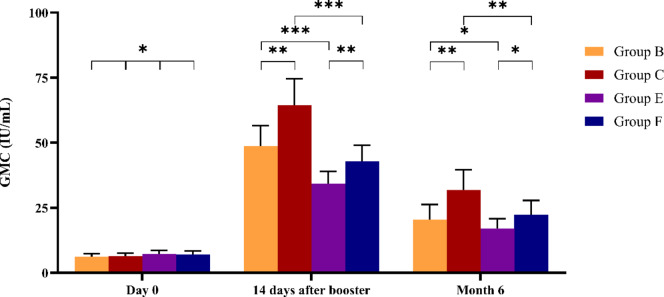
在第 0 天 (加强前),每组的 APR 为 100%,B 、 C 、 E 和 F 组的 GMC 分别为 6.61 、 6.74 、 7.29 和 7.02 IU/mL(表 2)。四组 APR (P = 1.0000) 和 GMC (P = 0.5124) 差异无统计学意义。
表 2. bPPS 中加强疫苗接种的免疫原性。
| B 组 | C 组 | E 组 | F 组 | |
|---|---|---|---|---|
| 第 0 天 | ||||
| 参与者 n | 187 | 177 | 181 | 173 |
| 抗体阳转率 (95%CI) | 100.00 (98.05, 100.00) | 100.00 (97.94 100.00) | 100.00 (97.98, 100.00) | 100.00 (97.89, 100.00) |
| GMC (95% CI) | 6.16 (5.14, 7.39) | 6.47 (5.49, 7.61) | 7.29 (6.14, 8.67) | 7.02 (5.89, 8.35) |
| 加强针后 14 天 | ||||
| 参与者 n | 187 | 177 | 181 | 173 |
| 抗体阳转率 (95%CI) | 100.0 (98.05, 100.00) | 100.0 (97.94, 100.00) | 100.0 (97.98, 100.00) | 100.0 (97.89, 100.00) |
| GMC (95% CI) | 48.80 (42.10,56.56) | 64.38 (55.55,74.61) | 34.25 (30.17,38.90) | 42.89 (37.51,49.03) |
| GMFIR (95% CI) | 70.05% (62.94%,76.52%) | 74.01% (66.90%,80.30%) | 56.35% (48.80%,63.70%) | 63.58% (55.94%,70.75%) |
| 第 6 个月 | ||||
| 参与者 n | 100 | 100 | 100 | 100 |
| 抗体阳转率 (95%CI) | 100.0 (96.38,100.00) | 100.0 (96.38,100.00) | 100.0 (96.38,100.00) | 100.0 (96.34,100.00) |
| GMC (95% CI) | 20.51 (15.99,26.31) | 31.85 (25.64,39.58) | 17.00 (13.88,20.82) | 22.32 (17.92,27.81) |
每个方案集的加强剂 (bPPS) 包括完成加强疫苗接种、在接受加强剂之前和之后 14 天提供血样且没有严重违反方案的参与者。抗体阳性率 (APR) 定义为接种疫苗后抗体滴度≥ 0.5 IU/mL 的参与者比例。几何平均浓度 (GMC) 是通过 log10 转换抗体滴度得出的。几何平均 4 倍增长率 (GMFIR) 定义为加强前抗体阳性且加强后抗体滴度升高 4 倍的参与者比例。
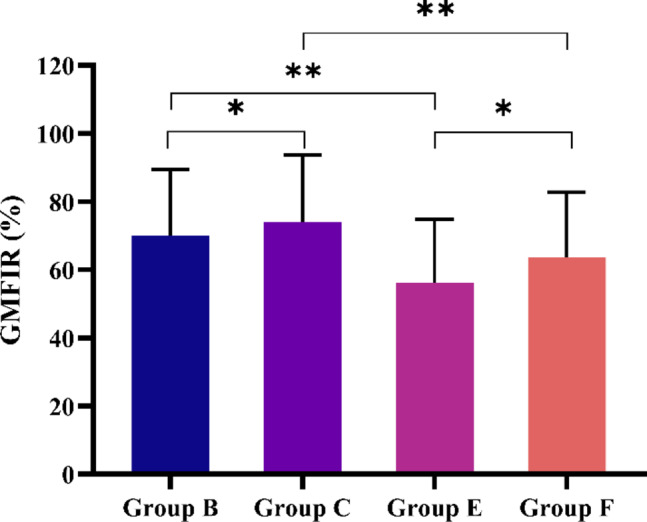
加强剂给药后 14 天,抗体滴度急剧升高 (B、C、E 和 F 组 GMC = 48.80、64.38、34.25 和 42.89 IU/mL,相应的 GMFIR 值分别为 70.05% 、 74.01% 、 56.35% 和 63.58%)。我们发现,双加强方案的 GMC 显著高于单加强方案 (B 组与 C 组的 P = 0.0092;E 组与 F 组的 P = 0.0004)(图然而,B 组和 C 组之间以及 E 组和 F 组之间 (P = 0.1653) 的 GMFIR 相似(图 D)。此外,无论加强剂量如何,Zagreb方案的 GMC 均显著高于Essen 方案(B 组与 E 组的 P = 0.0004;C 组与 F 组的 P < 0.0001)(图2);GMFIR 也是如此(B 组与 E 组的 P = 0.0024;C 组和 F 组的 P = 0.0352)(图3).
图 2.
图 3.
在第 6 个月,每组的 APR 保持在 100%,但抗体滴度随着时间的推移而下降,B、C、E 和 F 组的 GMC 分别为 20.51、31.85、17.00 和 22.32 IU/mL。我们发现 B 组和 C 组之间 (P = 0.0088) 或 C 组和 F 组之间 (P = 0.0235) 的 GMC 存在显著差异;这种差异在 B 组和 E 组之间 (P = 0.2464) 或 E 组和 F 组之间 (P = 0.0719) 不显著。
安全
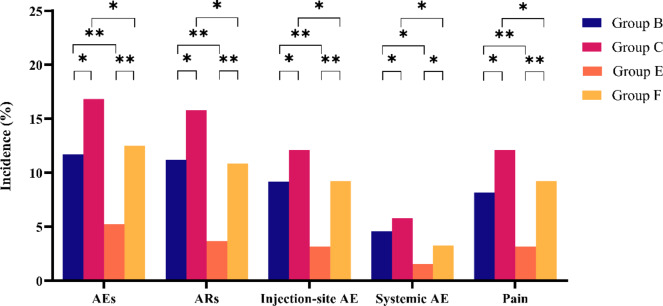
B 、 C 、 E 和 F 组从第一次加强剂量到最后一次给药后 30 天的 AR 总发生率分别为 11.22%、15.79%、3.68% 和 10.87%(表 3)。E 组 ARs 的发生率显著低于其他 3 组(图4).
表 3. bSS 每组中不良事件的频率。
| n (%) | B 组 N = 196 | C 组 N = 190 | E 组 N = 190 | F 组 N = 184 | *P 值 |
|---|---|---|---|---|---|
| AE | 23 (11.73%) | 32 (16.84%) | 10 (5.26%) | 23 (12.5%) | 0.0035 |
| AR | 22 (11.22%) | 30 (15.79%) | 7 (3.68%) | 20 (10.87%) | 0.0007 |
| 注射部位 AE | 18 (9.18%) | 23 (12.11%) | 6 (3.16%) | 17 (9.24%) | 0.0080 |
| 疼痛 | 16 (8.16%) | 23 (12.11%) | 6 (3.16%) | 17 (9.24%) | |
| 硬化 | 0 | 1 (0.53%) | 0 | 0 | |
| 红色 | 1 (0.51%) | 2 (1.05%) | 1 (0.53%) | 0 | |
| 肿胀 | 0 | 2 (1.05%) | 1 (0.53%) | 4 (2.17%) | |
| 痒 | 3 (1.53%) | 0 | 1 (0.53%) | 1 (0.54%) | |
| 皮疹 | 0 | 0 | 0 | 0 | |
| 系统性 AE | 9 (4.59%) | 11 (5.79%) | 3 (1.58%) | 6 (3.26%) | 0.1461 |
| 发烧 | 5 (2.55%) | 6 (3.16%) | 2 (1.05%) | 3 (1.63%) | |
| 疲劳 | 3 (1.53%) | 5 (2.63%) | 0 | 2 (1.09%) | |
| 头痛 | 1 (0.51%) | 1 (0.53%) | 1 (0.53%) | 2 (1.09%) | |
| 头晕 | 1 (0.51%) | 3 (1.58%) | 0 | 2 (1.09%) | |
| 呕吐 | 0 | 1(0.53%) | 0 | 0 | |
| 腹痛 | 0 | 2 (1.05%) | 0 | 0 | |
| 腹泻 | 0 | 1 (0.53%) | 0 | 0 | |
| 肌痛 | 2 (1.02%) | 1 (0.53%) | 0 | 0 | |
| 关节痛 | 0 | 0 | 0 | 0 | |
| 急性过敏反应 | 0 | 0 | 0 | 0 |
加强剂安全套装 (bSS) 包括接受至少一剂加强剂的参与者。
*所有四组比较的 P 值。
根据专业调查人员的判断,本研究中所有引发的不良事件 (AE),包括注射部位相关 AE 和全身 AE,均被定义为不良反应 (AR)。
图 4.
在本研究中,根据研究调查人员的判断,所有请求的 AE 都是 AR 类别。这些 AR 中的大多数发生在接种疫苗后 3 天内,并且是轻微和短暂的。最常见的注射部位 AE 是疼痛,B 组、 C 组、 E 组和 F 组的发生率分别为 8.16% 、 12.11% 、 3.16% 和 1.63%。同时,最常见的全身性 AE 是发热,B、C、E 和 F 组的发生率分别为 2.55% 、 3.16% 、 1.05% 和 1.63%。
无论加强剂量如何,埃森组的注射部位不良事件和全身不良事件的发生率在数量上均低于萨格勒布组。但仅在 B 组和 E 组(P = 0.0062)或 E 组和 F 组(P = 0.0140)之间,注射部位不良事件的发生率差异显著(表 3;图 4)。此外,除疼痛外,B 组和 C 组之间或 E 组和 F 组之间其他注射部位和全身不良事件的发生率没有显著差异,E 组的疼痛发生率显著较低(图 4)。没有报告与疫苗接种相关或导致患者退出试验的严重不良事件。
讨论
与 Essen 方案相比,Zagreb 方案提供更高的依从率和更好的成本效益。Zagreb方案的这些特点在过去 20 年中在全球范围内普及了它;然而,该方案直到 2010 年才在中国获得批准。Speeda 疫苗已在中国使用了几十年,是获准与Zagreb方案一起使用的纯化 Vero 细胞狂犬病疫苗。因此,评估接种Zagreb方案疫苗后接种加强剂的免疫原性和安全性非常重要。在本研究中,我们表明Zagreb方案后的加强疫苗接种既有效又安全。具体来说,我们观察到加强疫苗接种后 GMC 值显着升高,并且所有 ARs 都是轻微且短暂的。
接种 Zagreb 方案的组在接种疫苗后 14 天的抗狂犬病病毒抗体滴度比接种 Essen 方案的组上升得更明显,无论他们是接受 1 剂还是 2 剂加强剂。我们的研究结果与评估Zagreb方案后加强疫苗接种免疫原性的其他研究结果一致22,24,25。然而,很少有研究比较 Zagreb 方案后与 Essen 方案后加强免疫的免疫原性。加强疫苗接种的免疫原性取决于加强接种前的抗体滴度。在设计研究时,我们担心 Zagreb 方案是否引发了足够长寿命的抗体反应,以实现有效的加强疫苗接种。加强疫苗接种前的抗体滴度也可能因各种基础疫苗接种方案而异。先前的研究报告称,Zagreb 方案和 Essen 方案的 Speeda 在免疫持久性方面具有可比性;在某些情况下,Zagreb方案的表现优于Essen 方案26-28。在我们的研究中,Zagreb组在接受加强针之前的 GMC 低于 Essen 组(尽管不显着),但高于接受加强针后的 Essen 组。这一发现表明,Zagreb方案引发的抗体的免疫持久性对加强疫苗接种的 GMC 影响很小,并且Zagreb方案后加强疫苗接种的免疫原性足够高。然而,先前的几项研究报告称,男性疫苗接种者的 GMC 值< 0.5 IU/mL,即使在他们接受了加强剂之后也是如此29-31。Perrine 等人发现,男性与抗体滴度不足无关31,这一发现得到了其他人的赞同32-35。因此,增加狂犬病疫苗的效力或剂量可用于提高 GMC 低的疫苗接种者的 GMC36;然而,最佳疫苗效力和剂量仍在争论中。
在我们的研究中,接种 1 剂加强剂比接种 2 剂加强剂引起的抗体滴度更低。然而,即使是单加强方案引起的 GMC 也显著高于 0.5 IU/mL,组间 GMFIR 没有显著差异(即 B 组与 C 组或 E 组与 F)。这些发现表明,一剂加强针可能足以保护暴露者免受狂犬病感染。鉴于狂犬病是一种与社会经济剥夺相关的传染病,最具成本效益的疫苗接种方案有利于狂犬病控制。值得注意的是,提供一个加强剂而不是两个加强剂,不仅将 GMC 迅速提高到 0.5 IU/mL 以上,而且对于疫苗接种者来说也是更实惠的选择。
Speeda 疫苗已在中国使用了几十年,在许多患者群体(例如健康受试者、年轻人和老年人、孕妇)中显示出良好的安全性27,37,38。在我们的研究中,Zagreb组的 AR 发生率高于埃森组,无论他们是接受一次还是两次加强针;然而,所有这些 AR 都是轻微的 (大多数为 1 级) 且生存期短。既往报道的与 PVRV 给药相关的 SAEs,例如急性播散性脑脊髓炎39 和严重的过敏性 Schönlein 紫癜40,在我们的研究中未报告。
我们研究的一个局限性是,我们只在Zagreb方案给药后 6 个月评估了加强剂的免疫原性。接种疫苗和加强针之间的间隔时间与其他疫苗制造商建议的间隔时间不同。例如,在另一项研究中,在接种 Essen 方案 10 年后使用人二倍体细胞狂犬病疫苗 (HDCV) 加强接种,引起了高水平的免疫原性19。相应地,延长 Zagreb 方案疫苗接种和 Speeda 加强之间的间隔是否会增加免疫原性还有待观察。
总之,我们的研究表明,在 Zagreb 方案后 6 个月给药时,加强剂的免疫原性高于在 Essen 方案后 6 个月给药。此外,一次加强针可能足以诱导足够的抗体水平,以保护暴露的个体免受狂犬病的侵害。
方法
研究设计和受试者
本研究是一项随机、开放标签、对照、非劣效性的 3 期临床试验,于 2021 年 7 月至 2022 年 12 月在上虞市和嵊州市(中国浙江省)进行。所有志愿者在接受初次疫苗接种前都经过了筛选。符合条件的参与者是 10-60 岁的健康志愿者,在接种疫苗前 6 个月没有被能够携带狂犬病的哺乳动物咬伤或抓伤的历史,没有狂犬病疫苗接种史或狂犬病免疫球蛋白给药史,也没有急性过敏反应史。基础疫苗接种的纳入和排除标准的详细信息在补充材料(补充第 1 页)中提供。在研究筛选之前,参与者(如果年龄在 18-60 岁之间)或参与者(如果年龄在 10-17 岁之间)及其监护人提供了书面知情同意书。此外,B、C、E 和 F 组完成初次免疫接种并在初次免疫接种后 6 个月提供血样的参与者有资格进行加强免疫。
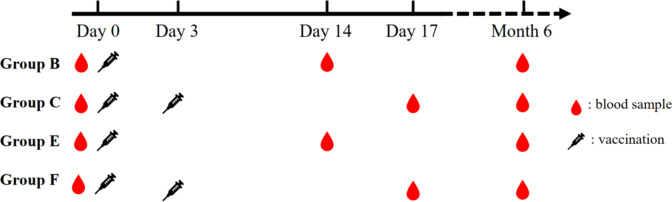
该 3 期临床试验包括两个阶段:初级疫苗接种阶段和加强疫苗接种阶段。筛选后,所有符合条件的参与者被随机分配 (1:1:1:1:1:1) 到 6 组。随机化过程的详细信息在补充材料(补充第 3 页)中提供。A、B 或 C 组(Zagreb组)的参与者接受了Zagreb方案的初级疫苗接种,而 D、E 或 F 组(埃森组)的参与者接受了Essen 方案的初级疫苗接种。加强疫苗接种在初次疫苗接种后 6 个月进行。B 组和 E 组的参与者在第 0 天接受了一剂加强剂,而 C 组和 F 组的参与者在第 0 天和第 3 天接受了两剂加强剂(图 D)。5). 由于疫苗接种时间表不同,本研究的研究人员和参与者没有被施盲。
图 5.
该临床试验经浙江省疾病预防控制中心机构审查委员会 (IRB) 批准(批准号:2021-001-01),并遵守良好临床规范 (GCP)、赫尔辛基宣言和中国监管要求。该方案于 2021 年 8 月 3 日在 www.chinadrugtrials.org.cn/index.html 注册,注册号为 CTR20210426。
疫苗
研究疫苗 (Speeda) 是一种冻干、纯化的人狂犬病疫苗 (PVRV),由辽宁诚达股份有限公司(中国沈阳)在 Vero 细胞中产生。该疫苗于 2004 年获得中国国家药品监督管理局 (NMPA) 的批准。Speeda 疫苗的免疫原性成分是灭活的狂犬病病毒株 PV2061。研究疫苗的效力为 5.4 IU/剂,大大超过了 WHO 的要求41。将疫苗溶于 0.5 mL 无菌水中,然后肌肉注射到上臂三角肌中。在初级疫苗接种阶段,参与者根据分配的组(即 A 、 B 和 C 组的Zagreb方案;D 、 E 和 F 组的Essen 方案)进行疫苗接种。在加强疫苗接种阶段(初次疫苗接种后 ~ 6 个月),B 组和 E 组在第 0 天接受一剂加强剂,而 C 组和 F 组在第 0 天和第 3 天接受两剂加强剂。A 组和 D 组没有接种加强针。
免疫原性评估
在加强疫苗接种阶段,在初次疫苗接种后 6 个月、加强接种前(第 0 天)和加强接种后 14 天采集血样。此外,在初次疫苗接种后 12 个月(初次接种疫苗后 6 个月,即初次接种疫苗后 12 个月,相当于加强疫苗接种后约 6 个月)收集了 100 份血样(每组总样本量的前半部分),以评估加强疫苗接种引发的抗体反应的持久性(图 D)。5)。使用国家食品和药物控制研究所 (NIFDC;中国北京);数据以几何平均浓度 (GMC) 值报告。在这项研究中,≥ 0.5 IU/mL 的 GMC 被定义为阳性结果。根据 GMC 值、几何平均 4 倍增长率 (GMFIR) 和加强后 14 天的 APR 评估免疫原性。加强后 6 个月通过 GMC 和 APR 评估免疫持久性。
安全监控
所有参与者在接种疫苗后 30 分钟内观察任何不良事件 (AE),并在接种疫苗后随访 7 天以收集有关请求的 AE 的数据,包括注射部位 AE(例如,疼痛、硬结、发红、肿胀、瘙痒或皮疹)和全身性 AE(例如,发烧、疲劳、头痛、头晕、呕吐、腹痛、腹泻、肌痛、关节痛或急性过敏反应)。从第一次加强剂量到最后一次给药后 30 天收集非请求 AE。从第一次加强剂量到最后一次剂量后 6 个月收集 SAE。所有 AE 均由专业研究者进行评估,根据 NMPA42 发布的要求进行分级,并记录在《监管活动医学词典》(26.1 版)中。通过从第一次加强剂量到最后一次给药后 30 天的 AE 发生率和从第一次加强剂量到最后一次给药后 6 个月的 SAE 发生率来评估安全性。
样本量和统计分析
初级疫苗接种的样本量为 A、B、C、D、E 和 F 组每组 200 名参与者;B、C、E 和 F 组在加强疫苗接种阶段使用相同的样本量。样本量计算的详细信息在补充材料(补充第 3 页)中提供。此外,在第 6 个月时评估加强疫苗接种组免疫持久性的样本量为每组 100 名参与者(每组样本量的一半)。
对加强剂安全套装 (bSS) 进行安全性分析,其中包括至少接受一次加强剂的参与者。报告了接种疫苗后发生不良反应 (ARs) 的参与者的数量和比例,定义为与疫苗接种相关的 AE(由专业研究人员评估)。对每个方案集的加强剂 (bPPS) 进行免疫原性分析,其中包括完成加强疫苗接种、在加强免疫前和加强后 14 天提供血样且没有严重违反方案的参与者。GMC 是通过 log10 转化抗体滴度得出的。APR 定义为接种疫苗后抗体滴度≥ 0.5 IU/mL 的参与者比例。GMFIR 定义为加强针前抗体阳性且加强针后抗体滴度升高 4 倍的参与者比例。免疫持久性分析对免疫持久性集 (IPS) 进行,其中包括完成加强疫苗接种、在 6 个月提供血样并拥有可用 GMC 和 APR 数据的参与者。学生的 t 分布用于计算 GMC 的 95% 置信区间 (CI)。采用 Clopper-Pearson 方法计算 APR 和 GMFIR 的 95% CI。学生 t 检验和方差分析 (ANOVA) 用于分析连续数据,而 Pearson χ2 检验和 Fisher 精确检验用于分析分类数据。非劣效性研究设计仅用于初级疫苗接种阶段。在加强疫苗接种阶段,在所有统计比较中,双侧 alpha 值都设置为 0.05。使用 SAS 软件(版本 9.4,Cary,USA)进行所有统计分析。
资助
数据可用性
由于本研究期间生成的个人数据的敏感性,该数据集不公开;但是,应合理要求,可以从通讯作者处获得匿名数据。
声明
道德宣言
该临床试验经浙江省疾病预防控制中心机构审查委员会 (IRB) 批准(批准号:2021-001-01),并遵守良好临床规范 (GCP)、赫尔辛基宣言和中国监管要求。所有参与者及其监护人(针对 10-17 岁的参与者)在筛选前都得到了充分通知。在研究筛选之前,已获得参与者(如果年龄在 18-60 岁之间)或参与者(如果年龄在 10-17 岁之间)及其监护人的书面知情同意书。
利益争夺
刘淼淼、王燕和毛宇是辽宁成达生物股份有限公司的员工,其他作者没有利益冲突需要申报。
脚注
出版商注
施普林格·自然 (Springer Nature) 对已发布的地图和机构隶属关系中的管辖权主张保持中立。
华坤吕和徐晨对这项工作做出了同等贡献。
贡献者信息
华-Kun Lv, Email: hklv@cdc.zj.cn.
Zhen-Zhen Liang, 电子邮件: zzliang@cdc.zj.cn.
Yu 毛,电子邮件:maoyu0516@Sina.com。
引用
Zagreb或Essen 方案后加强疫苗接种的免疫原性和安全性的 3 期临床试验 – PMChttps://pmc.ncbi.nlm.nih.gov/articles/PMC11868620/
Hits: 102
- 狂犬病(2025年6月更新)
- 狂犬病 你应该知道的
- 预防和治疗狂犬病的狂犬病疫苗
- 狂犬病可能成为历史
- 看看每种疫苗:狂犬病疫苗
- 阿拉巴马州妇女在从车上卸下杂货时被狂犬病狐狸咬伤:“公共卫生威胁”
- 应对狂犬病
- 全球疫苗免疫联盟将促进全球疫苗免疫联盟、世卫组织和阿联酋50多个国家获得拯救生命的人类狂犬病疫苗
- 美国CDC发布了将狗带入美国的新规定,旨在防止狂犬病
- 全国狂犬病监测方案
- 2024年东帝汶首例狂犬病确诊病例
- WHO实况报道 狂犬病
- 狂犬病
- 狂犬病疫苗接种:给医疗保健提供者的信息
- 特定感染的流行病学和控制:狂犬病
- 狂犬病疫苗接种的注意事项或禁忌症
- ACIP 使用减少(4剂)疫苗计划进行暴露后预防以预防人类狂犬病
- 实施良好的狂犬病暴露后预防方案
- ACIP 使用修改后的暴露前预防疫苗接种计划预防人类狂犬病,美国,2022年
- 西班牙犬类狂犬病免疫保护的影响因素
- 减少犬的进口等待期-对狂犬病恐惧科学合理的变化
- 老年人对狂犬病暴露后预防无应答:挑战和方法
- 狂犬病疫苗的效力、免疫原性和有效性:体外和体内方法
- 狂犬病人免疫球蛋白 (HRIG)
- “震惊”的妇女,超过6,000美元的救命狂犬病治疗账单
- 负鼠感染狂犬病毒对这种病毒在城市环境中的传播敲响了警钟
- 索马里蜜獾感染未报告的首例疑似人狂犬病病例研究
- 两名狂犬病研究人员解释如何保护自己免受这种疾病的侵害
- 临床医生常见的狂犬病问题
- 狂犬病疫苗
- 世界卫生组织关于狂犬病的常见问题
- 狂犬病实况报道
- 狂犬病
- 狂犬病是一种古老的、不可预测的、可能致命的疾病——两位狂犬病研究人员解释了如何保护自己
- 狂犬病疫苗短缺:给卫生专业人员的建议
- 7例被狂犬咬伤者接种狂犬病疫苗的效果观察
- 全球狂犬病风险:狂犬病疫苗短缺期间的实用建议
- 巴西一个土著村庄被蝙蝠掠夺的高风险:警告狂犬病在马卡利人中重新出现
- 评估在澳大利亚蝙蝠狂犬病病毒和狂犬病暴露后预防中血清学的益处
- 蝙蝠处理者的狂犬病暴露前预防
- 基于狂犬病中和抗体水平的狂犬病加强剂时机指南
- 施用狂犬病疫苗和免疫球蛋白
- 为狂犬病暴露后预防开发的单克隆抗体鸡尾酒疗法
- 狂犬病预防处置常见问题解答(成大生物)
- 世界卫生组织狂犬病专家磋商会 第三版报告
- 世卫组织对狂犬病的看法
- 新型狂犬病疫苗
- 狂犬病病毒可以抗强大的天然免疫
- 狂犬病的被动免疫
- 亚洲狂犬病预防
- 秘鲁高风险人群的大规模狂犬病暴露前预防
- 人用狂犬病疫苗
- 野生动物狂犬病疫苗
- 狂犬病和狂犬病疫苗的历史
- 狂犬病的生命周期、传播和发病机制
- 狂犬病暴露后管理指南(英国 2023年1月)
- 2022年印度马哈拉施特拉邦一名幼儿出现临床狂犬病症状后存活
- 第27章:狂犬病
- 狂犬病:问题和答案
- 《狂犬病暴露预防处置工作规范(2023年版)》解读问答
- 狂犬病暴露预防处置工作规范(2023年版)
- 狂犬病
- 狂犬病相关问题解答
- 疾病控制中心加强了对进口狗的狂犬病管理,原因如下
- 关于狂犬病
- 一名加州艺术教师在教室遭遇蝙蝠后死于狂犬病
- WHO 实况报道 动物咬伤 2024年1月
- 疫苗接种和免疫 狂犬病
- 世卫组织推荐皮内途径用于狂犬病暴露后预防
- 狂犬病疫苗:世卫组织立场文件–2018年4月
- WHO实况报道 狂犬病 2024年6月
- 狂犬病-结束忽视, 实现可持续发展目标 被忽视的热带病路线图 2021-2030
- 动物狂犬病
- 宠物主人对疫苗的犹豫越来越多——一位公共卫生专家解释了为什么这很重要
- 兽用狂犬病疫苗
- 何时寻求狂犬病医疗护理
- 猫
- 关于获得人类狂犬病疫苗的社会正义观点
- 评估新的狂犬病暴露后预防(PEP)方案或疫苗
- 卫生和福利部-狂犬病
- 狂犬病暴露后预防用单克隆抗体开发的最新进展:临床开发管线现状综述
- 世卫组织对狂犬病免疫接种的立场 – 2018 年最新情况
- 恐水症:1874 年的狂犬病和改变一切的救命疫苗
- 新的人类狂犬病疫苗正在研发中
- 为什么消除狂犬病?
- 为什么现在要根除狂犬病?
- 狂犬病-NFID
- 为狗接种疫苗 – 它们不会因接种疫苗而患上自闭症
- 宠物主人版 狗的狂犬病
- 猫的狂犬病
- 狂犬病-国际脑炎协会
- 器官移植后如何感染狂犬病?
- 器官移植患者感染狂犬病后死亡
- 人类狂犬病疾病负担:Rabipur®疫苗的潜在预防作用
- 印度东北部农村的狂犬病:强调同一健康方法紧迫性的病例报告
- 狂犬病毒糖蛋白的深度突变扫描确定了突变限制和抗体逃逸突变
- 人类狂犬病:一种治疗方法
- 通过受感染狗唾液污染的隐形眼镜传播狂犬病病毒(病例报告)
- 越南暴露前预防计划中基于灭活 vero 细胞的狂犬病疫苗 (Rabivax-S) 的安全性和免疫原性
- 狂犬病生物制剂在 III 类动物暴露儿科患者中的安全性和临床疗效的前瞻性研究
- 重复狂犬病疫苗接种揭示人类中和抗体的分子趋同
- 狂犬病病毒的感染和预防
- 关于 Zagreb 或 Essen 方案后加强疫苗接种的免疫原性和安全性的 3 期临床试验
- 通过 RABV-G 结构域筛选和异源初免-加强免疫优化狂犬病 mRNA 疫苗功效
- 狂犬病实验室诊断的最新情况
- 三色蝠相关狂犬病毒引起的一例人狂犬病的报道
- 一种核苷修饰的狂犬病mRNA疫苗在小鼠和非人灵长类动物中诱导出持久而全面的免疫反应
- 狂犬病的识别和治疗:病例报告和讨论
- 人类狂犬病的诊断困难:病例报告和文献回顾
- 狂犬病感染的边缘系统症状
- 狂犬病脑炎的生存率
- 人类狂犬病:2016年更新
- 突尼斯一名狂犬病幸存儿童:病例报告
- 肯尼亚蝙蝠携带的Duvenhage病毒导致人类狂犬病死亡:昏迷诱导、氯胺酮和抗病毒药物治疗无效
- 病例报告:狂犬病幸存者长期随访中的神经功能恢复与血清学反应
- 蝙蝠和食肉动物中狂犬病的比较病理学及其对人类溢出影响
- 病例报告:狂犬病生存者:印度病例系列
- 评估人类抗狂犬病疫苗的反应:一种快速、高通量适应性、基于假病毒的中和试验,作为快速荧光病灶抑制试验 (RFFIT) 的替代方案
- 病例报告:狂犬病幸存者长期随访中的神经功能恢复与血清学反应
- 巴西巴伊亚州狂犬病爆发的流行病学与分子分析
- 俄罗斯下诺夫哥罗德地区动物狂犬病(2012-2024年):描述性与预测性流行病学分析
- 巴西东南部一只黑鼠耳蝠(黑鼠耳蝠属物种Myotis nigricans)感染狂犬病病毒、科勒巴尔通体菌以及婴儿利什曼原虫的混合感染情况
- 2013-2023 年悉尼大都会居民狂犬病暴露后治疗:回顾性病例系列分析
- 用肌肉靶向脂质纳米颗粒配制的狂犬病病毒 G 蛋白 mRNA 在小鼠体内的免疫原性
- 关于狂犬病的 One Health Lens:马拉维利隆圭农村狂犬病病毒的人类-蝙蝠相互作用和基因组见解
- 阿根廷低地貘 (Tapirus terrestris) 麻痹狂犬病的首次报告
- 由表达狂犬病糖蛋白的非复制型病毒载体痘苗病毒天坛株改良株(MVA)和腺病毒5型(Ad5)所诱导产生的对狂犬病的保护作用
- 印度野生猫科动物中狂犬病毒的免疫病理与分子筛查:揭示从野外到城市的溢出效应
- 韩国貉 (Nyctereutes procynoide koreensis) 接种了含有 ERAGS-GFP 毒株的新型狂犬病诱饵疫苗的保护性抗体反应
- 宠物护理 疫苗
- 为您的宠物接种疫苗
- 狂犬病感染:如何保护您的孩子
- 新型狂犬病暴露后预防单克隆抗体鸡尾酒疗法的安全性和耐受性
- “愤怒的狂犬病”人类图画案例
- 蝙蝠咬伤
- 研究蝙蝠病毒如何帮助预防人畜共患疾病
- 狂犬病:症状繁多、宿主广泛的恶魔病毒——罗德尼·罗德解读
- 狂犬病的同一健康:不仅适用于动物
- 狂犬病和蛔虫:浣熊相关传染病
- 丽莎病毒 很罕见,但致命。如果蝙蝠咬你怎么办?
- 海地在四个省开展新的疫苗接种运动,加强防治犬类狂犬病
- 家养及其他动物狂犬病病毒感染的挑战:病毒学层面的困惑、惊愕、懊恼与好奇交织
- 双重战斗:狂犬病和蛇咬伤在东南亚的毒害
- 狂犬病在城市无人管理的猫群中爆发 — 马里兰州,2024 年 8 月
- 尼泊尔正力争在2030年前消灭狂犬病,但领导人表示,现在是加大疫苗投资的时候了。
- 现代狂犬病疫苗的诞生历程
- 一种基于mRNA的新型狂犬病病毒多表位疫苗:通过反向疫苗学和免疫信息学进行计算机设计
- 快速荧光灶抑制试验(RFFIT)的验证与评价 —— 作为狂犬病疫苗相对效价间接检测方法的中和抗体定量检测:NIH 试验的替代方案
- 暴露后狂犬病预防失败案例研究
- 2021年明尼苏达州一起经确认的人畜共患病暴露后,疑似因宿主介导导致暴露后预防失败的致命人类狂犬病感染病例
- 给野生动物投喂疫苗:口服狂犬病疫苗的故事
- 降低肯尼亚西部臭名昭著的狗市狂犬病风险
- 印度的狂犬病
- 海地的狂犬病
- 2024年10月至2025年2月,美国发生通过实体器官移植传播狂犬病的病例,该器官移植供体未确诊患有狂犬病
- 两例死亡与狂犬病感染的肾移植有关
- 明尼苏达州一家奶牛场的牛群中爆发狂犬病聚集性疫情——2024年
- 摩洛哥的狂犬病
- 2024年肯塔基州和俄亥俄州输入性人类狂犬病病例
- 2024年明尼苏达州和加利福尼亚州人类狂犬病死亡人数
- 反疫苗人士对宠物狂犬病 RNA 疫苗的虚假宣传
- 新型口服狂犬疫苗能否帮助我们最终终结这种疾病?
- NACI 2026 年 1 月 30 日发布的声明摘要:狂犬疫苗用于暴露前预防 (PrEP) 的最新指南
- 狂犬疫苗的给药途径:数据比较
- 猫会得狂犬病吗?
- 2022-2024年中欧狂犬病疫情再度出现
- 研讨会报告:改进狂犬病血清学方法和程序的标准化