Contents
Epidemiological and molecular analysis of a rabies outbreak in the state of bahia, Brazil.
Acta Trop.2025V265N:107617(P40246220)

在ScienceDirect上可用的目录列表
《热带病志》
期刊主页:http://www.elsevier.com/locate/actatropica
Aroldo J.Borges Carneiro ,José Eduardo Ungar de Sa ,Jan Felix Drexler ,Andreas Stcker ,Flavia dos Santos a,f, Rafaela de Sousa Gonçalves a, Dinah R.Dantas Becerra a,
Rogerio de Magalhaes Cunhaa,Evandro Moraes-Silva, Paulo Santana
Caio Graco Zeppelini ,Ricardo Lustosa ,Carlos Roberto Franke
a 巴西巴伊亚联邦大学,兽医与动物繁殖学院,萨尔瓦多,巴伊亚,巴西
b 巴西卫生部,卫生与环境监督秘书处,公共卫生紧急情况司,巴西利亚,巴西联邦区
c 巴西公共卫生中央实验室(LACEN/BA),萨尔瓦多,巴伊亚,巴西
d 德国波恩大学病毒学研究所,波恩,德国
e 巴伊亚联邦大学埃德加尔·桑托斯教授医院感染病研究中心(HUPES/UFBA),萨尔瓦多,巴伊亚,巴西
f 巴伊亚州西部联邦大学,巴伊亚州巴腊多学科中心,兽医院,地理信息系统与One Health实验室,巴腊,巴伊亚,巴西
g 巴伊亚州农业保护机构(ADAB),萨尔瓦多,巴伊亚,巴西
h 巴西巴伊亚联邦大学,集体健康研究所,萨尔瓦多,巴伊亚,巴西
瑞典农业大学的动物福利、渔业与农业学院,于默奥,瑞典
文章信息
关键词:
地理处理
狂犬病病毒
分子生物学
系统发育学
人畜共患病
狂犬病
摘要
本研究旨在对2007-2009年间在巴伊亚州爆发期间,从55只实验室确诊的狂犬病阳性动物生物样本中检测到的狂犬病病毒株进行基因特征分析。提交进行狂犬病诊断的样本包括一头驴子、一只小刺鼻蝠(叶鼻蝠属)、两只食蟹狐(犬浣熊属)、八只普通吸血蝠(吸血蝠属)和43头牛。所有样本在直接免疫荧光试验(DAFT)、小鼠接种试验(MIT)和逆转录聚合酶链反应(RT-PCR)中均呈阳性,随后进行核苷酸测序和系统发育分析。系统发育学展示了两个病毒进化枝,一个是特定于蝙蝠的,另一个是特定于食肉动物的,存在九个与吸血蝠属相关的亚簇,以及食肉动物特定病毒株感染牛的情况。系统发育分析揭示了一个复杂的流行病学情况,需要进一步阐明以改进狂犬病控制措施。
1. 引言
狂犬病是一种急性病毒性脑炎,可以影响所有哺乳动物物种,在人类中的致死率接近100%。全球估计每年有5.9万人死于由狗传播的狂犬病,总体经济成本约为86亿美元(世界卫生组织,2018年)。狂犬病是由一种单株、不分节、负极性RNA病毒引起的,属于弹状病毒科,狂犬病病毒属,该属包含14个物种(库津等人)。2011年;Marston等人,2012年)。狂犬病病毒物种,即经典的狂犬病病毒,是唯一具有全球分布的物种,也是在美洲检测到的唯一物种。该物种呈现多种毒株,主要通过食肉动物和蝙蝠传播(Rupprecht等人,2022年)。
在巴西,至少有七个与食肉动物、蝙蝠和非人灵长类动物相关的毒株记录(Caraballo等人,2024年;Rupprecht等人,2022年)。分子研究表明,在巴西野生犬科物种中出现了新的病毒株(Carnieli等人,2008年)。证据还表明,在蟋蟀食性蝙蝠中,从Myotis、Eptesicus、Nyctinomops、Molos sus、Tadarida、Histiotus和Lasiurus属中存在属特异性的谱系(Oliveira等人,2010年)。
巴西狂犬病病毒的遗传多样性(小林、井上等人,2007年,2007年)以及世界范围内的(Pinero等人,2012年),表明病毒适应其宿主的能力,并强调了诊断和病毒株的系统发育鉴定对于支持适当的流行病学推断的必要性,这一成就现在可以通过现代分子技术的发展来实现(Silva等人,2013年)。
本研究的目的是对2007年至2009年间发生疫情期间的巴伊亚州动物宿主体内的狂犬病病毒进行遗传特征分析,以及分析检测到的毒株的遗传地理分布,并描述分子数据。
2. 材料与方法
2.1. 样本
在这项研究中分析了55份脑组织样本:驴(Equus asinus)1份;小刺鼻蝠(Phyllostomus elongatus)1份;野生食蟹狐(Cerdocyon thous)2份;普通吸血蝠(Desmodus rotundus)8份,以及牛43份。样本来自巴伊亚州不同市的区域(表1)。普通吸血蝠的样本是在之前的研究中获得的(Carneiro等人,2010年),并储存在巴西巴伊亚州立大学兽医学与动物技术学院兽医传染病实验室(LIVE/UFBA)。其他物种的样本由公共卫生教授Gonzalo Moniz的中央实验室(LACEN/BA)获得。所有样本在研究中都通过直接免疫荧光法(DAFT)和鼠接种试验(MIT)检测出狂犬病毒阳性,并储存在-80°C下。
使用RNeasy Mini Kit(QIAGEN®)进行RNA提取,使用30毫克脑组织置于Lysis tube P(Analytik-Jena®)中,在垂直涡旋Speedmill(Analytik-Jena®)中进行组织裂解。操作遵循制造商的建议。提取物储存在-80°C下。
2.2. 逆转录聚合酶链反应(RT-PCR)
按照Heaton等人(1997年)描述的方法,应用了半套式逆转录聚合酶链反应(RT-PCR)协议,针对核蛋白基因(N),并进行了一些修改。使用OneStep RT-PCR kit(QIAGEN®)进行cDNA合成和首次扩增,在23.5微升的混合物中进行,首次扩增引物的最终浓度为1.5微升提取的RNA。在单个步骤中,热循环仪被编程为55°C持续30分钟、95°C持续15分钟,接着进行25个循环,每个循环包括94°C持续20秒、53°C持续30秒和72°C持续30秒。第二个步骤使用Platinum Tag试剂盒(Invitrogen®)进行,取第一步的产物2μL和混合物23μL,引物的最终浓度为0.6μM。反应从95°C开始,持续2分钟,然后进行30个循环,每个循环包括94°C持续20秒、54°C持续30秒和72°C持续30秒。所用引物列表及其相应序列列于表2中。
半巢式RT-PCR的产物在2%的琼脂糖凝胶上可视化,用SYBR Safe DNA凝胶染料染色,并使用带有蓝光的Transilluminator Save Imager(Invitrogen®)观察。
2.3. 核苷酸测序
通过半巢式RT-PCR获得的扩增子使用Ampure试剂盒(Agencourt®)进行纯化。按照制造商的说明,使用Big Dye Terminator 3.1试剂盒(Applied Biosystems®)标记纯化后的产物。使用Cleanseq试剂盒(Agencourt®)进行第二次纯化后,使用System 3100(Applied Biosystems®)确定核酸序列。
获得的序列与GenBank中的其他序列(表3)进行比对,使用MEGA 5.2中的ClustalW算法。采用最大复合似然法并执行1000次自助法迭代,进行邻接系统发育分析。包含不确定碱基缺失的对齐位置被删除(完全删除选项)。系统发育树在MEGA 5.2中构建。
2.4. 地理分析
D. rotundus栖息地的GPS坐标和农村物业。
表1 本研究中进行测序的狂犬病阳性组织样本列表。
| 宿主物种 | 序列编号 | 来源城市 / 年份 |
|---|---|---|
| 圆叶吸血蝠(Desmodus rotundus) | RabV/BR/25/Des rot/ 2008 | 坦基尼奥(Tanquinho)/2008 年 |
| 圆叶吸血蝠(Desmodus rotundus) | RabV/BR/27/Des rot/ 2008 | S(此处信息不完整)/2008 年 |
| 圆叶吸血蝠(Desmodus rotundus) | RabV/BR/39/Des rot/ 2008 | (未提及城市) |
| 圆叶吸血蝠(Desmodus rotundus) | RabV/BR/40/Des rot/ 2008 | (未提及城市) |
| 圆叶吸血蝠(Desmodus rotundus) | RabV/BR/41/Des rot/ 2008 | (未提及城市) |
| 圆叶吸血蝠(Desmodus rotundus) | RabV/BR/88 | 圣阿马鲁(Santo Amaro)/2008 年 |
| 圆叶吸血蝠(Desmodus rotundus) | RabV/BR/221 | 阿尔托阿莱格里礼拜堂(Capela do Alto Alegre) |
| 圆叶吸血蝠(Desmodus rotundus) | RabV/BR/222 | 阿尔托阿莱格里礼拜堂(Capela do Alto Alegre) |
| 长吻叶口蝠(Phyllostomus elongatus) | RabV/BR/81 | 劳罗德弗雷塔斯(Lauro de Freitas) |
| 食蟹狐(Cerdocyon thous) | RabV/BR/o01/Cer tho/ 2007 | 圣特雷济尼亚(Santa Terezinha)/2007 年 |
| 食蟹狐(Cerdocyon thous) | RabV/BR/o02/Cer tho/ 2007 | 新韦尔泽亚(Vrzea Nova)/2007 年 |
| 牛(Cattle) | RabV/BR/o03/Bos tau/ 2008 | 伊比库伊(Ibicuí)/2008 年 |
| 牛(Cattle) | RabV/BR/o04/Equ asi/ 2008 | 瓦伦萨(Valença)/2008 年 |
| 牛(Cattle) | RabV/BR/o05/Bos tau/ 2008 | 伊比库伊(Ibicuí)/2008 年 |
| 牛(Cattle) | RabV/BR/o06/Bos tau/ 2008 | 波茹卡(Pojuca)/2008 年 |
| 牛(Cattle) | RabV/BR/o07/Bos tau/ 2008 | 圣弗朗西斯科 – 德萨桑塔纳(Feira de Santana)/2008 年 |
| 牛(Cattle) | RabV/BR/o08/Bos tau/ 2008 | 拉热(Laje)/2008 年 |
| 牛(Cattle) | RabV/BR/o09/Bos tau/ 2008 | 圣弗朗西斯科 – 德萨桑塔纳(Feira de Santana)/2008 年 |
| 牛(Cattle) | RabV/BR/o10/Bos tau/ 2008 | 圣安东尼奥 – 德热苏斯(Santo Antonio de Jesus)/2008 年 |
| 牛(Cattle) | RabV/BR/o11/Bos tau/ 2008 | 圣弗朗西斯科 – 德萨桑塔纳(Feira de Santana)/2008 年 |
| 牛(Cattle) | Bov186 | 圣阿马鲁(Santo Amaro)/2009 年 |
| 牛(Cattle) | Bov 251 | S(此处信息不完整)/2009 年 |
| 牛(Cattle) | Bov 264 | (未提及城市) |
| 牛(Cattle) | Bov 292 | 圣阿马鲁(Santo Amaro)/2009 年 |
| 牛(Cattle) | Bov 317 | 卡舒埃拉(Cachoeira)/2009 年 |
| 牛(Cattle) | Bov 320 | 圣阿马鲁(Santo Amaro)/2009 年 |
| 牛(Cattle) | Bov 347 | 坎迪亚斯(Candeias)/2009 年 |
| 牛(Cattle) | Bov 374 | 圣阿马鲁(Santo Amaro)/2009 年 |
| 牛(Cattle) | Bov 382 | 圣阿马鲁(Santo Amaro)/2009 年 |
| 牛(Cattle) | Bov 395 | 圣阿马鲁(Santo Amaro)/2009 年 |
| 牛(Cattle) | Bov 401 | 索巴拉(Saubara)/2009 年 |
| 牛(Cattle) | Bov 405 | 圣阿马鲁(Santo Amaro)/2009 年 |
| 牛(Cattle) | Bov 445 | 圣阿马鲁(Santo Amaro)/2009 年 |
| 牛(Cattle) | Bov 473 | 圣阿马鲁(Santo Amaro)/2009 年 |
| 牛(Cattle) | Bov 474 | 卡舒埃拉(Cachoeira)/2009 年 |
| 牛(Cattle) | Bov 483 | 坦基尼奥(Tanquinho)/2008 年 |
| 牛(Cattle) | Bov 485 | 圣阿马鲁(Santo Amaro)/2008 年 |
| 牛(Cattle) | Bov 506 | 圣阿马鲁(Santo Amaro)/2009 年 |
| 牛(Cattle) | Bov 532 | (未提及城市) |
| 牛(Cattle) | Bov 549 | 圣阿马鲁(Santo Amaro)/2009 年 |
| 牛(Cattle) | Bov 558 | 伊塔马拉茹(Itamaraju)/2009 年 |
| 牛(Cattle) | Bov 570 | S(此处信息不完整)/2009 年 |
| 牛(Cattle) | Bov 575 | 圣阿马鲁(Santo Amaro)/2009 年 |
| 牛(Cattle) | Bov 576 | 圣阿马鲁(Santo Amaro)/2009 年 |
| 牛(Cattle) | Bov 596 | 伊柳斯(Ilhus)/2008 年 |
| 牛(Cattle) | Bov 703 | S(此处信息不完整)/2009 年 |
| 牛(Cattle) | Bov 705 | 圣阿马鲁(Santo Amaro)/2009 年 |
| 牛(Cattle) | Bov 743 | 伊塔布纳(Itabuna)/2009 年 |
| 牛(Cattle) | Bov 772 | 圣阿马鲁(Santo Amaro)/2009 年 |
| 牛(Cattle) | Bov 783 | 坎迪亚斯(Candeias)/2008 年 |
| 牛(Cattle) | Bov 952 | S(此处信息不完整)/2009 年 |
| 牛(Cattle) | Bov 958 | S(此处信息不完整)/2009 年 |
| 牛(Cattle) | Bov 1058 | 圣阿马鲁(Santo Amaro)/2009 年 |
| 牛(Cattle) | Bov 1061 | 圣阿马鲁(Santo Amaro)/2009 年 |
表2 用于半巢式逆转录聚合酶链式反应(RT-PCR)检测狂犬病病毒N基因的引物列表。
| Primer | Sequence(5′-3′) | Sense | Position in genome |
|---|---|---|---|
| JW12 | ATGTAACACC(C/T) CTACAAATTG | M(1st and 2nd steps) | 55-73 |
| JW6(DPL) | CAATTCGCACACATTTTGTG | G(1st step) | 660-641 |
| JW6(E) | CAGTTGGCACACATCTTGTG | G(1st step) | 660-641 |
| JW6(M) | CAGTTAGCGCACATCTITATG | G(1st step) | 660-641 |
| JW10 (DLE2) | GTCATCAAAGTGTG(A/G) TGCTC | G(2nd step) | 636-617 |
| JW10 (ME1) | GTCATCAATGTGTG(A/G) TGTTC | G(2nd step) | 636-617 |
| JW10(P) | GTCATTAGAGTATGGTGTTC | G(2nd step) | 636-617 |
括号中的字母表示与引物相对应的基因型。DPL:DUVV、PV(狂犬病病毒)和LBV;E:EBL 1和2;M:MOKV;DLE2:DUVV、LBV和EBL2;ME1:MOKV和EBL1;P:PV(狂犬病病毒)。
b M:信使;G:基因组。
c 核苷酸的位置根据PV序列进行编号。改编自Heaton等人(1997年)。
采集样本的地点由国家农业防御机构(ADAB)提供。这些坐标使用QGIS 2.18进行空间分析。通过核密度分析评估狂犬病病例的浓度,从而识别高风险区域。基于估计的D. rotundus夜间觅食半径(约12公里)(农业部,2009年),使用缓冲区分析划定集群。
用于制作地图的其他空间数据,包括道路、水系、环境特征、铁路以及官方行政边界,均从巴西地理统计局(IBGE)提供的官方制图数据库获取,网址为https://www.ibge.gov.br/geociencias/organizacao-do-territorio/malhas-territoriais.html。
3. 结果
研究中使用的55份样本的DAFT和MIT阳性结果通过半巢式RT-PCR得到确认。系统发育分析表明,所有序列都属于狂犬病病毒裂谷病毒基因型1,并形成两个主要分支:一个由蝙蝠菌株组成,另一个由犬菌株组成(图1)。
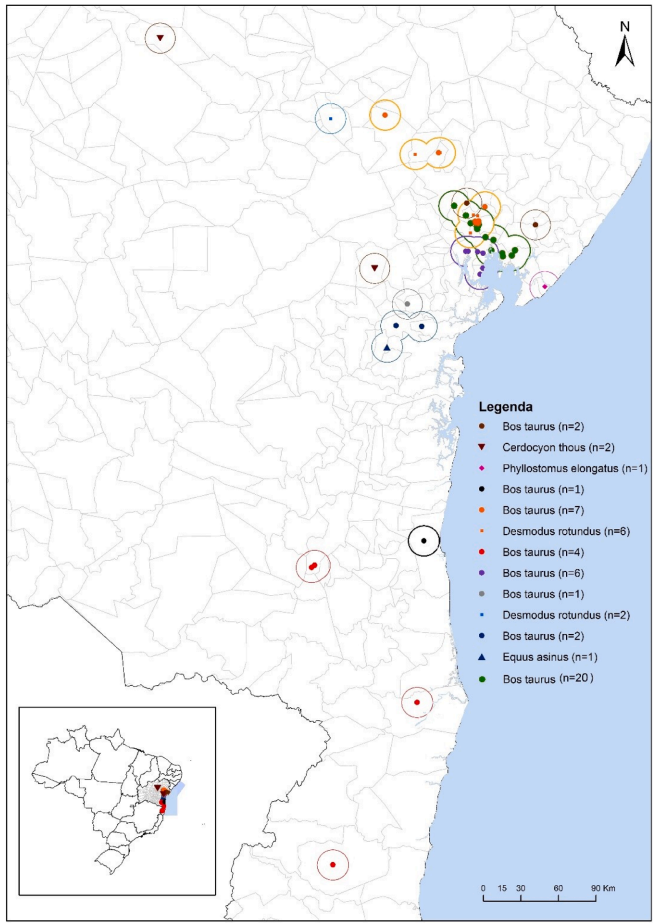
样本的地理分布及其相应的遗传分类显示在图2中。图1和图2中以绿色标记的亚支系由来自巴伊亚州五个市的牛样本中的20个病毒序列组成:圣冈萨尔科斯杜坎普斯(n=1)、坎德亚斯(n=2)、费拉德桑塔(n=2)、圣弗朗西斯科杜孔(n=3)和圣阿马罗(n=12)。该亚支系中的序列与分析中包含的、已存入基因库的序列没有相似性。
图1和图2中以橙色标记的亚支系包括来自圣阿马罗(4头牛,1只蝙蝠)、孔塔热尤斯杜卡普斯(1头牛,2只蝙蝠)、坦基尼奥(1头牛,1只蝙蝠)、里查乌杜杜卡普斯(1头牛,1只蝙蝠)和圣冈萨尔科斯杜坎普斯(1只蝙蝠)市的7个牛序列和6个来自巴西蝠的序列。该亚支系还包括来自基因库的三个序列:两个来自巴伊亚州帕拉塔市的牛序列和一个来自伯南布哥州一头牛的序列(图1)(望月等人,2012年)。
我们的55个样本中有43个是牛,其中28个来自一个地区,包括圣阿马罗、索布拉尔、卡瓜伊尔、圣弗朗西斯科杜孔、孔塔热尤斯杜卡普斯、圣冈萨尔科斯杜坎普斯和圣方济各德圣塔市(图3)。在该地区,农业防御服务处在2008年至2009年间诊断出58头牛患有狂犬病,占同期巴伊亚州发现的牛狂犬病例的36.7%(58/158)。可以观察到病毒在该地区的三个亚支系的主导地位。(图3),其中两个(绿色和橙色)在发生范围上有部分重叠。第三亚属(紫罗兰色),由六个来自牛科的序列组成,限定在圣冈萨尔科斯杜斯坎普斯市(n=1)、索布拉尔市(n=1)、圣阿马罗市(n=2)和卡瓜伊尔市(n=2)的行政区划内,与其他亚属没有空间重叠。
序列RabV/BR/81/Phy elo/2008(图1中的粉红色菱形),在一个非食血蝙蝠(小矛鼻蝠Phyllostomus elongatus)中检测到,来自大都会萨尔瓦多地区市区,与来自圣保罗的序列聚集在一起,这些序列来自其他食果蝠,如Artibeus lituratus和A. planirostris(Shoji等人,2004年),然而仍在包含有在圣保罗鉴定的D. rotundus序列的亚属内(Heinemann等人,2002年)。
来自巴伊亚州南部三个市的牛科动物的四条序列,来自伊库伊市(n=2)、伊塔布纳市(n=1)和伊塔马拉朱市(n=1),用红色标记,未与该州检测到的其他变异相关联,聚集在来自戈亚斯州的D. rotundus序列的同一亚属内(Kobayashi、Sato等人,2007年)。来自巴伊亚州南部伊列乌斯的牛的一条序列也没有与巴伊亚州的其他序列聚集在一起,与来自里约热内卢州和圣保罗州的D. rotundus序列处于同一亚属(Ito等人,2003年;Vieira等人,2010年)。观察到的聚类模式可能表明病毒存在长距离传播,超出了州界,这暗示了需要在国家级别上进行协调行动,以监测野生动物狂犬病。
从野生犬科动物中分离出的病毒变种没有显示出显著的遗传差异,与GenBank中四个其他序列聚类在一起,其中三个来自巴伊亚州,一个来自皮奥夫州(Carnieli等人,2008年)。然而,它们与经典的犬狂犬病病毒(PV-M13215)无关,这表明在巴伊亚州传播的Cerdocyon thous的狂犬病病毒已经适应了这个野生宿主,并与犬类变种有所不同。在牛中检测到的两个序列(RabV/BR/o06/Bos tau/2008和……)
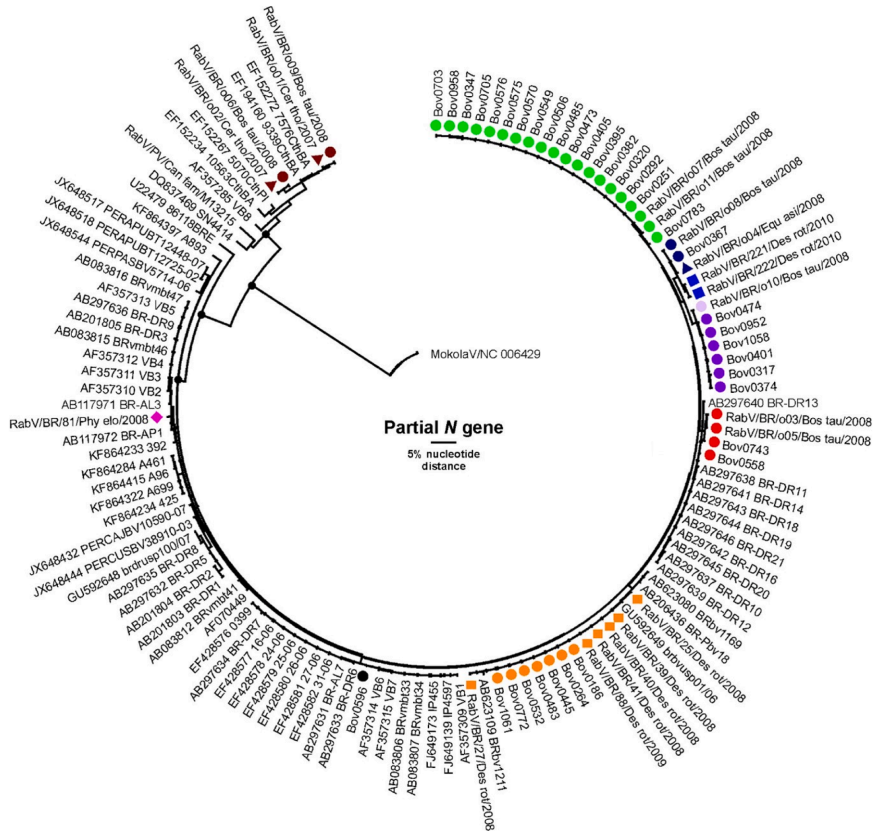
(狂犬病毒/巴西/o09/博茨瓦纳/2008)与C.thous(狂犬病毒/巴西/o01/塞尔斯托/2007和狂犬病毒/巴西/o02/塞尔斯托/2007)的序列聚类在同一亚分支中,这表明在巴伊亚州可能存在狐狸到牛的狂犬病传播,这在食草动物的典型狂犬病流行病学中是不常见的,通常与D. rotundus相关。
4. 讨论
对巴伊亚州样本的系统发育分析证实了翼手目和食肉目在维持和传播狂犬病病毒中的重要性,与其他巴西州的发现一致(Kanitz等人,2014年;Mochizuki等人,2012年;Schaefer等人,2005年)。蝙蝠相关序列分为九个亚分支(图1),突显了巴伊亚州内流通的狂犬病病毒的遗传多样性。
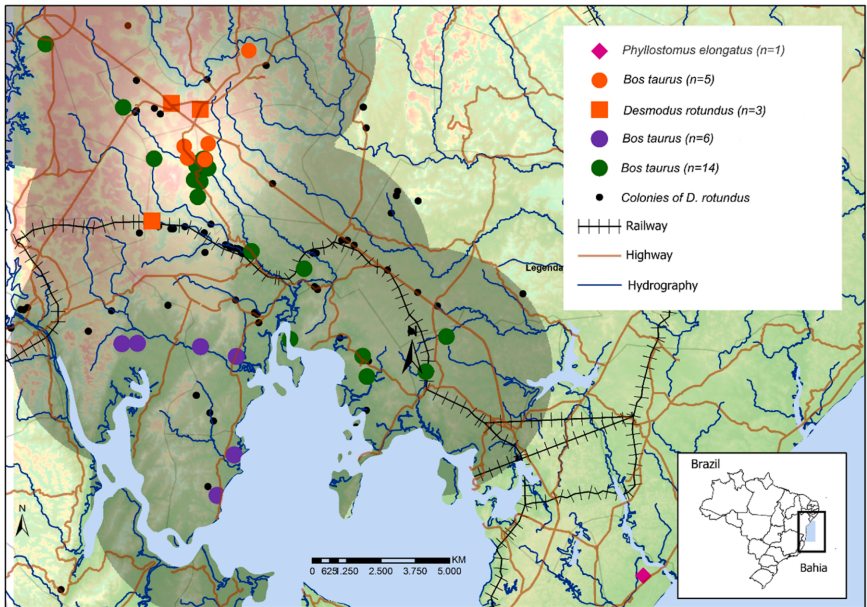
热点分布(图3)提供了牛群狂犬病阳性与D. rotundus存在以及提供蝙蝠栖息地环境之间的关系证据。这些环境包括有裂缝和小洞穴的山丘地形,以及有井盖和人行道下通道的道路和铁路轨道。这样的地形和基础设施特征常用作蝙蝠栖息地(小林等人,2008年;加西亚等人,2014年)并有助于牛群狂犬病病例的聚集。在之前的ADAB调查期间,在巴伊亚州识别出了D. rotundus(黑点)群落,其分布与岩洞、铁路轨道和道路的位置一致。
这些信息对于降低狂犬病传播风险和有效指导控制穿山甲种群的活动非常重要。更有针对性的方法可以帮助减少时间和成本,同时降低影响非目标物种的风险。此外,负责维护和监控道路及铁路的公司可以作为有关地下通道分布的宝贵信息来源,帮助识别不同狂犬病疫区内的潜在管理关注区域。
靠近水体的集群可能表明牛群活动集中在它们的边缘,牲畜在那里获取饮用水。该地区的特点是水体岸边有纤毛森林,这些森林通常作为吸血蝙蝠的栖息地。由于这些地区对狂犬病的主要野生媒介——普通吸血蝠——具有高度的环境适应性,农业防御部门应优先考虑对这些区域进行流行病学监测(农业部,2009年)。
### 5. 结论
系统发育分析表明,巴伊亚州野生和家畜中狂犬病的流行病学涉及至少10种狂犬病病毒株,其中9种与蝙蝠相关,1种与野生犬科动物相关,后者存在于牛群中。我们的发现突显了狂犬病复杂的流行病学网络,有助于理解狂犬病的生态流行病学模式,并为设计并实施人畜共患病控制计划提供信息。
贡献者声明
Aroldo J.Borges Carneiro:撰写-审核与编辑,撰写-初稿,方法论,调查,形式分析,数据整理,概念化。Jose Eduardo Ungar de Sa:撰写-审核与编辑,撰写-初稿,形式分析,数据整理。Jan Felix Drexler:撰写-审核与编辑,撰写-初稿,调查,形式分析,数据整理。Andreas Stocker:撰写-审核与编辑,撰写-初稿,方法论。Flavia dos Santos:撰写-审核与编辑,撰写-初稿,验证,概念化。Rafaela de Sousa Gonçalves:撰写-审核与编辑,撰写-初稿,验证,数据整理。Dinah R. Dantas Becerra:撰写-审核与编辑,撰写-初稿,形式分析,数据整理。Rogerio de Magalhães Cunha:撰写-审核与编辑,撰写-初稿,形式分析,数据整理。Evandro Moraes-Silva:撰写-审核与编辑,撰写-初稿,验证,概念化。保罗·桑塔纳:撰写-审核与编辑,撰写-初稿,验证,监督。卡伊欧·格拉科·泽佩利尼:撰写-审核与编辑,撰写-初稿,软件,调查。里卡多·卢斯托沙:撰写-审核与编辑,撰写-初稿,验证,监督,概念化。卡洛斯·罗伯托·弗兰克:撰写-审核与编辑,撰写-初稿,验证,形式分析,概念化。
### 作者利益冲突声明
作者声明他们没有已知的可能影响到本文报告工作的财务利益或个人关系。
Hits: 107
- 狂犬病(2025年6月更新)
- 狂犬病 你应该知道的
- 预防和治疗狂犬病的狂犬病疫苗
- 狂犬病可能成为历史
- 看看每种疫苗:狂犬病疫苗
- 阿拉巴马州妇女在从车上卸下杂货时被狂犬病狐狸咬伤:“公共卫生威胁”
- 应对狂犬病
- 全球疫苗免疫联盟将促进全球疫苗免疫联盟、世卫组织和阿联酋50多个国家获得拯救生命的人类狂犬病疫苗
- 美国CDC发布了将狗带入美国的新规定,旨在防止狂犬病
- 全国狂犬病监测方案
- 2024年东帝汶首例狂犬病确诊病例
- WHO实况报道 狂犬病
- 狂犬病
- 狂犬病疫苗接种:给医疗保健提供者的信息
- 特定感染的流行病学和控制:狂犬病
- 狂犬病疫苗接种的注意事项或禁忌症
- ACIP 使用减少(4剂)疫苗计划进行暴露后预防以预防人类狂犬病
- 实施良好的狂犬病暴露后预防方案
- ACIP 使用修改后的暴露前预防疫苗接种计划预防人类狂犬病,美国,2022年
- 西班牙犬类狂犬病免疫保护的影响因素
- 减少犬的进口等待期-对狂犬病恐惧科学合理的变化
- 老年人对狂犬病暴露后预防无应答:挑战和方法
- 狂犬病疫苗的效力、免疫原性和有效性:体外和体内方法
- 狂犬病人免疫球蛋白 (HRIG)
- “震惊”的妇女,超过6,000美元的救命狂犬病治疗账单
- 负鼠感染狂犬病毒对这种病毒在城市环境中的传播敲响了警钟
- 索马里蜜獾感染未报告的首例疑似人狂犬病病例研究
- 两名狂犬病研究人员解释如何保护自己免受这种疾病的侵害
- 临床医生常见的狂犬病问题
- 狂犬病疫苗
- 世界卫生组织关于狂犬病的常见问题
- 狂犬病实况报道
- 狂犬病
- 狂犬病是一种古老的、不可预测的、可能致命的疾病——两位狂犬病研究人员解释了如何保护自己
- 狂犬病疫苗短缺:给卫生专业人员的建议
- 7例被狂犬咬伤者接种狂犬病疫苗的效果观察
- 全球狂犬病风险:狂犬病疫苗短缺期间的实用建议
- 巴西一个土著村庄被蝙蝠掠夺的高风险:警告狂犬病在马卡利人中重新出现
- 评估在澳大利亚蝙蝠狂犬病病毒和狂犬病暴露后预防中血清学的益处
- 蝙蝠处理者的狂犬病暴露前预防
- 基于狂犬病中和抗体水平的狂犬病加强剂时机指南
- 施用狂犬病疫苗和免疫球蛋白
- 为狂犬病暴露后预防开发的单克隆抗体鸡尾酒疗法
- 狂犬病预防处置常见问题解答(成大生物)
- 世界卫生组织狂犬病专家磋商会 第三版报告
- 世卫组织对狂犬病的看法
- 新型狂犬病疫苗
- 狂犬病病毒可以抗强大的天然免疫
- 狂犬病的被动免疫
- 亚洲狂犬病预防
- 秘鲁高风险人群的大规模狂犬病暴露前预防
- 人用狂犬病疫苗
- 野生动物狂犬病疫苗
- 狂犬病和狂犬病疫苗的历史
- 狂犬病的生命周期、传播和发病机制
- 狂犬病暴露后管理指南(英国 2023年1月)
- 2022年印度马哈拉施特拉邦一名幼儿出现临床狂犬病症状后存活
- 第27章:狂犬病
- 狂犬病:问题和答案
- 《狂犬病暴露预防处置工作规范(2023年版)》解读问答
- 狂犬病暴露预防处置工作规范(2023年版)
- 狂犬病
- 狂犬病相关问题解答
- 疾病控制中心加强了对进口狗的狂犬病管理,原因如下
- 关于狂犬病
- 一名加州艺术教师在教室遭遇蝙蝠后死于狂犬病
- WHO 实况报道 动物咬伤 2024年1月
- 疫苗接种和免疫 狂犬病
- 世卫组织推荐皮内途径用于狂犬病暴露后预防
- 狂犬病疫苗:世卫组织立场文件–2018年4月
- WHO实况报道 狂犬病 2024年6月
- 狂犬病-结束忽视, 实现可持续发展目标 被忽视的热带病路线图 2021-2030
- 动物狂犬病
- 宠物主人对疫苗的犹豫越来越多——一位公共卫生专家解释了为什么这很重要
- 兽用狂犬病疫苗
- 何时寻求狂犬病医疗护理
- 猫
- 关于获得人类狂犬病疫苗的社会正义观点
- 评估新的狂犬病暴露后预防(PEP)方案或疫苗
- 卫生和福利部-狂犬病
- 狂犬病暴露后预防用单克隆抗体开发的最新进展:临床开发管线现状综述
- 世卫组织对狂犬病免疫接种的立场 – 2018 年最新情况
- 恐水症:1874 年的狂犬病和改变一切的救命疫苗
- 新的人类狂犬病疫苗正在研发中
- 为什么消除狂犬病?
- 为什么现在要根除狂犬病?
- 狂犬病-NFID
- 为狗接种疫苗 – 它们不会因接种疫苗而患上自闭症
- 宠物主人版 狗的狂犬病
- 猫的狂犬病
- 狂犬病-国际脑炎协会
- 器官移植后如何感染狂犬病?
- 器官移植患者感染狂犬病后死亡
- 人类狂犬病疾病负担:Rabipur®疫苗的潜在预防作用
- 印度东北部农村的狂犬病:强调同一健康方法紧迫性的病例报告
- 狂犬病毒糖蛋白的深度突变扫描确定了突变限制和抗体逃逸突变
- 人类狂犬病:一种治疗方法
- 通过受感染狗唾液污染的隐形眼镜传播狂犬病病毒(病例报告)
- 越南暴露前预防计划中基于灭活 vero 细胞的狂犬病疫苗 (Rabivax-S) 的安全性和免疫原性
- 狂犬病生物制剂在 III 类动物暴露儿科患者中的安全性和临床疗效的前瞻性研究
- 重复狂犬病疫苗接种揭示人类中和抗体的分子趋同
- 狂犬病病毒的感染和预防
- 关于 Zagreb 或 Essen 方案后加强疫苗接种的免疫原性和安全性的 3 期临床试验
- 通过 RABV-G 结构域筛选和异源初免-加强免疫优化狂犬病 mRNA 疫苗功效
- 狂犬病实验室诊断的最新情况
- 三色蝠相关狂犬病毒引起的一例人狂犬病的报道
- 一种核苷修饰的狂犬病mRNA疫苗在小鼠和非人灵长类动物中诱导出持久而全面的免疫反应
- 狂犬病的识别和治疗:病例报告和讨论
- 人类狂犬病的诊断困难:病例报告和文献回顾
- 狂犬病感染的边缘系统症状
- 狂犬病脑炎的生存率
- 人类狂犬病:2016年更新
- 突尼斯一名狂犬病幸存儿童:病例报告
- 肯尼亚蝙蝠携带的Duvenhage病毒导致人类狂犬病死亡:昏迷诱导、氯胺酮和抗病毒药物治疗无效
- 病例报告:狂犬病幸存者长期随访中的神经功能恢复与血清学反应
- 蝙蝠和食肉动物中狂犬病的比较病理学及其对人类溢出影响
- 病例报告:狂犬病生存者:印度病例系列
- 评估人类抗狂犬病疫苗的反应:一种快速、高通量适应性、基于假病毒的中和试验,作为快速荧光病灶抑制试验 (RFFIT) 的替代方案
- 病例报告:狂犬病幸存者长期随访中的神经功能恢复与血清学反应
- 巴西巴伊亚州狂犬病爆发的流行病学与分子分析
- 俄罗斯下诺夫哥罗德地区动物狂犬病(2012-2024年):描述性与预测性流行病学分析
- 巴西东南部一只黑鼠耳蝠(黑鼠耳蝠属物种Myotis nigricans)感染狂犬病病毒、科勒巴尔通体菌以及婴儿利什曼原虫的混合感染情况
- 2013-2023 年悉尼大都会居民狂犬病暴露后治疗:回顾性病例系列分析
- 用肌肉靶向脂质纳米颗粒配制的狂犬病病毒 G 蛋白 mRNA 在小鼠体内的免疫原性
- 关于狂犬病的 One Health Lens:马拉维利隆圭农村狂犬病病毒的人类-蝙蝠相互作用和基因组见解
- 阿根廷低地貘 (Tapirus terrestris) 麻痹狂犬病的首次报告
- 由表达狂犬病糖蛋白的非复制型病毒载体痘苗病毒天坛株改良株(MVA)和腺病毒5型(Ad5)所诱导产生的对狂犬病的保护作用
- 印度野生猫科动物中狂犬病毒的免疫病理与分子筛查:揭示从野外到城市的溢出效应
- 韩国貉 (Nyctereutes procynoide koreensis) 接种了含有 ERAGS-GFP 毒株的新型狂犬病诱饵疫苗的保护性抗体反应
- 宠物护理 疫苗
- 为您的宠物接种疫苗
- 狂犬病感染:如何保护您的孩子
- 新型狂犬病暴露后预防单克隆抗体鸡尾酒疗法的安全性和耐受性
- “愤怒的狂犬病”人类图画案例
- 蝙蝠咬伤
- 研究蝙蝠病毒如何帮助预防人畜共患疾病
- 狂犬病:症状繁多、宿主广泛的恶魔病毒——罗德尼·罗德解读
- 狂犬病的同一健康:不仅适用于动物
- 狂犬病和蛔虫:浣熊相关传染病
- 丽莎病毒 很罕见,但致命。如果蝙蝠咬你怎么办?
- 海地在四个省开展新的疫苗接种运动,加强防治犬类狂犬病
- 家养及其他动物狂犬病病毒感染的挑战:病毒学层面的困惑、惊愕、懊恼与好奇交织
- 双重战斗:狂犬病和蛇咬伤在东南亚的毒害
- 狂犬病在城市无人管理的猫群中爆发 — 马里兰州,2024 年 8 月
- 尼泊尔正力争在2030年前消灭狂犬病,但领导人表示,现在是加大疫苗投资的时候了。
- 现代狂犬病疫苗的诞生历程
- 一种基于mRNA的新型狂犬病病毒多表位疫苗:通过反向疫苗学和免疫信息学进行计算机设计
- 快速荧光灶抑制试验(RFFIT)的验证与评价 —— 作为狂犬病疫苗相对效价间接检测方法的中和抗体定量检测:NIH 试验的替代方案
- 暴露后狂犬病预防失败案例研究
- 2021年明尼苏达州一起经确认的人畜共患病暴露后,疑似因宿主介导导致暴露后预防失败的致命人类狂犬病感染病例
- 给野生动物投喂疫苗:口服狂犬病疫苗的故事
- 降低肯尼亚西部臭名昭著的狗市狂犬病风险
- 印度的狂犬病
- 海地的狂犬病
- 2024年10月至2025年2月,美国发生通过实体器官移植传播狂犬病的病例,该器官移植供体未确诊患有狂犬病
- 两例死亡与狂犬病感染的肾移植有关
- 明尼苏达州一家奶牛场的牛群中爆发狂犬病聚集性疫情——2024年
- 摩洛哥的狂犬病
- 2024年肯塔基州和俄亥俄州输入性人类狂犬病病例
- 2024年明尼苏达州和加利福尼亚州人类狂犬病死亡人数
- 反疫苗人士对宠物狂犬病 RNA 疫苗的虚假宣传
- 新型口服狂犬疫苗能否帮助我们最终终结这种疾病?
- NACI 2026 年 1 月 30 日发布的声明摘要:狂犬疫苗用于暴露前预防 (PrEP) 的最新指南
- 狂犬疫苗的给药途径:数据比较

孟博士您好,请问打生物制剂的胳膊 针眼,在3.4天后别人摸我针眼的部位,隔着衣服,有结痂但是没掉应该是还没彻底愈合吧,请问这种伤口会进入病毒吗?他每天接触很多养猫狗的人又不爱洗手,请问有没有狂犬风险?
这是高度敏感性格,想太多累
尊敬的孟博士,您好,有几个问题想请教您。
1.现在世卫组织已经把狂犬疫苗暴露前预防改成了第0天和第7天两针了。但是如果暴露前是第0天和第3天打的两针,和0,7两针会有什么不同,会影响一年后再接种的免疫记忆吗?2.严家新教授说以前接种过疫苗(哪怕只有一针)再次接种就算加强,是否可以认为,只要打过疫苗,哪怕一针,产生过抗体大于0.5,以后再打就算加强了吗?
非常感谢孟博士可以回答我这个问题
1.我估计,改成0,3可能免疫效果没有0,7好 ,同时这也方便记忆;2认可严老师的观点
孟博士,那是不是可以认为,以前在第0天第3天接种过的话,一年之后再次接种也算加强针呢
是的