Molecular convergence of neutralizing antibodies in human revealed by repeated rabies vaccination
npj 疫苗 volume10, 文章编号: 39 (2025)
抽象
狂犬病疫苗需要反复免疫,才能强烈地产生预防致命疾病的中和抗体。在这里,我们分析了重复疫苗接种后多克隆和单克隆水平的狂犬病糖蛋白抗体库。加强疫苗接种显著提高了召回抗体的中和活性,主要针对具有亲水性和坚固结构的免疫显性位点 III 表位。引人注目的是,召回响应中的大多数位点 III 定向抗体都使用收敛 VH基因 (IGHV3-30),并且它们比非位点 III 抗体表现出更多的亲水性和更短的旁位,为与位点 III 结合提供了物理化学优势。此外,重链 CDR3 上的几个氨基酸被确定为通过位点 III 结合获得超强中和活性的关键位点。我们对抗体库的深入分析揭示了重复狂犬病疫苗接种产生的中和抗体的分子特征,这可能是适应性收敛的结果。
介绍
狂犬病是由狂犬病病毒引起的一种高度致死性的人畜共患传染病,其中狂犬病病毒 (RABV) 是人类狂犬病最常见的致病病毒1。根据世界卫生组织 (WHO) 的数据2,据估计,狂犬病每年造成 59,000 人死亡,其中 95% 的病例发生在非洲和亚洲3,4。尽管症状出现后的死亡率极高(接近 100%),但在暴露前和暴露后环境中,狂犬病感染都可以通过接种疫苗来预防5、6、7。目前,灭活疫苗平台是人类应用最广泛的平台,目前需要重复接种才能将中和抗体滴度提高到 0.5 IU/mL 以上2,这是抗体介导保护所需的全局临界值。尽管中和抗体滴度在初次 PrEP 或 PEP 疫苗接种后持续数年8,9,加强疫苗接种在更长时间内保持足够的中和抗体滴度方面更有效10。因此,当血清抗体滴度降至国际公认的保护阈值以下时,建议进行加强疫苗接种以获得持续保护。
RABV 是一种单链 RNA 病毒,属于弹状病毒科和 狂犬病毒属11。RABV 基因组编码五种蛋白质:核蛋白 (N)、磷蛋白 (P)、基质蛋白 (M)、糖蛋白 (G) 和 RNA 依赖性 RNA 聚合酶 (L)12。RABV 糖蛋白 (RABV-G) 是一种存在于病毒表面的三聚体 III 类蛋白,以 pH 依赖性方式在融合前和融合后构象之间发生可逆转变。融合前 RABV-G 介导病毒与细胞受体的附着,由酸性 pH 触发的融合后构象促进融合以进入宿主细胞13,14 。凭借这些抗原特性,RABV-G 已被确定为迄今为止中和抗体靶向的唯一抗原。RABV-G 的抗原结构已得到广泛研究,抗原位点 I、II 和 III 已被证明在四个主要抗原位点(I、II、III 和 IV)的病毒中和中起重要作用15、16、17、18 。抗原位点 I 和 III 通常由针对系统群 I 溶血病毒(包括狂犬病病毒)的中和抗体靶向,而针对抗原位点 II 的中和抗体(由不连续的两个区域组成)似乎在系统群 II 中和作用更主要16,19 。
尽管三聚体预融合 RABV-G 与少量中和抗体复合物的结构数据为抗体中和提供了机制见解,但对疫苗接种引发的中和抗体库的综合分析仍然主要限于血清学分析。在这项研究中,我们通过从记忆 B (Bmem) 细胞。抗体库分析基于以下参数:中和活性、表位特异性、结合特性、可变区基因使用和水肿。我们发现分泌抗体的中和活性以及 B 细胞抗原受体对 Bmem 的中和活性都有显着改善加强疫苗接种后的细胞。中和抗体通过特定的 V 广泛集中在免疫原性位点 III 表位上H基因 (IGHV3-30) 经常用于携带亲水性 CDR 的人抗体库中。我们的结果表明,通过收敛的 IGHV3-30 编码抗体进行表位识别为人类免疫提供了固有的优势,可以在广泛的人群中迅速引发狂犬病中和抗体。
结果
研究队列
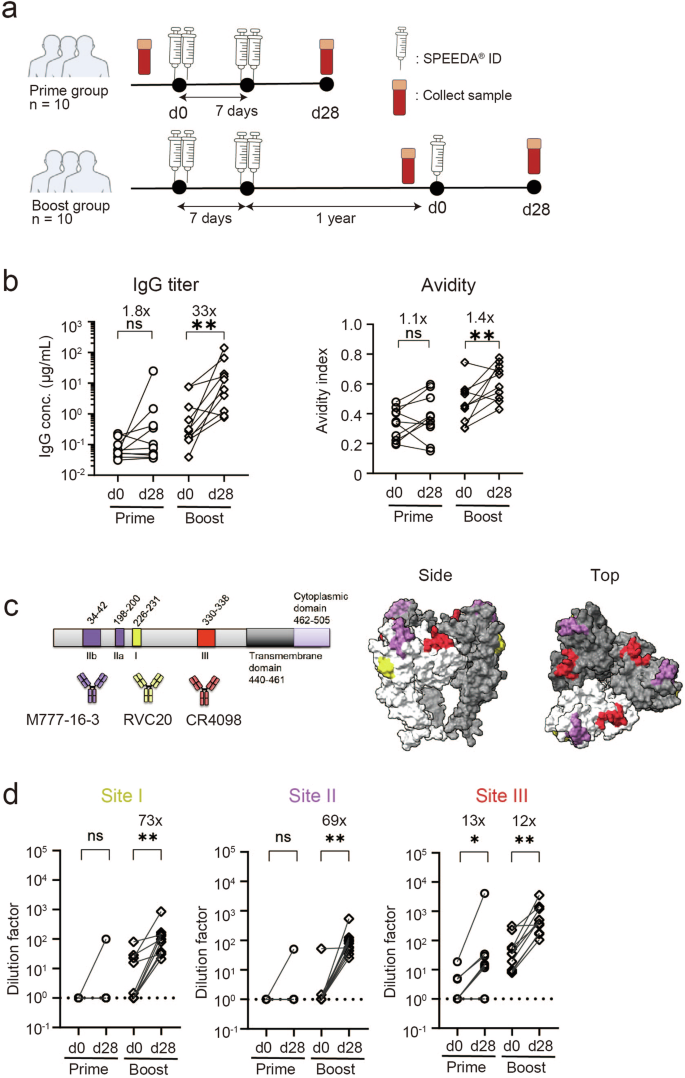
我们自愿招募了 20 名接受灭活狂犬病疫苗 (PVRV、SPEEDA®) 并纵向提供血液样本的医护人员。疫苗组分为初次组 (n = 10) 和加强组 (n = 10) (图 D).1a)。 循环抗体和 Bmem通过多个参数分析外周血中的细胞。初次组和加强组的中位年龄分别为 56.5 (33-70) 和 61.0 (37-66) 岁。大多数参与者(20 人中有 19 人)是男性。在我们之前的研究中调查了所有参与者的基线疫苗接种史和中和抗体状态20。在初免方案之前,没有参与者有狂犬病疫苗接种史或抗狂犬病抗体产生史。
样本集合的示意图。未接种灭活狂犬病疫苗 (SPEEDA) 的受试者(Prime 组;n = 10,中位年龄 56.5 岁,从 33 岁到 70 岁不等)和一年前接受过治疗的患者(加强组;n = 10,中位年龄 61.0 岁,年龄从 37 岁到 66 岁不等)。在接种疫苗之前 (第 0 天) 和之后 (第 28 天) 收集血浆和 PBMC。b 通过 ELISA 纵向定量血浆中 RABV-G 结合 IgG 滴度和亲和力。通过使用 3。5 M 尿素评估亲和力,这有助于低亲和力抗体的分离。数据来自两个独立的实验。弃牌率变化如上所示。每个点代表来自每个人的数据,用线条连接的点表示来自同一个人的数据。c RABV-G 示意图显示了 RVC20(抗原位点 I,黄色)、M777-16-3(抗原位点 II,紫色)和 CR4098(抗原位点 III,红色)的非重叠抗原位点位置。编号对应于从其分泌信号肽(左)切割后的成熟蛋白质。RABV-G 三聚体 (PDB: 7U9G) 的 3D 结构上的位置以相同的颜色突出显示(右)。d 通过 CEE-cELISA 纵向定量血浆中的位点特异性 IgG 滴度。使用具有已知抗原位点 (RVC20 、 M777-16-3 和 CR4098) 的单克隆抗体来定量位点特异性 IgG 滴度。截止值设置 30% 的抑制。数据来自两个独立的实验。弃牌率变化如上所示。每个点代表来自每个人的数据,用线条连接的点表示来自同一个人的数据。使用 Wilcoxon 检验进行统计分析 (ns: p > 0.05;p < 0.05;p < 0.01;p < 0.001;p < 0.0001) (b, d)。**********
RABV-G 位点 III 是疫苗诱导的中和抗体的免疫显性表位
狂犬病疫苗在短时间内分多剂接种,以将中和抗体滴度提高到保护临界值以上。根据 WHO 指南 2017,在该疫苗接种队列中,在第 0 天和第 7 天对双臂皮内注射灭活狂犬病疫苗(每只手臂 0.1 mL)以进行启动。21。4 周后,启动组捐献了外周血。加强组在启动后约 1 年以每组 0.1 mL 的速度在任一组接受进一步的皮内疫苗接种。在接种疫苗后第 0 天和第 28 天收集两组的外周血(图 D)。1a)。 血浆抗体进行 ELISA 以量化 RABV-G 结合 IgG 滴度的量,并评估基于尿素处理分离板结合 IgG 的亲和力指数。虽然 RABV-G IgG 滴度在引发后第 28 天适度增加,但每隔一年的额外加强剂强烈地召回 IgG 滴度,导致增加 33 倍(图 D)。尽管加强针后有显著的召回反应,但亲和力指数的总体增长仍然相当温和(1.4 倍)。
RABV-G 有三个主要位点作为中和表位:位点 I、II 和 III(图 I)。1c)22。已在小鼠和人类中鉴定出针对每个抗原位点的单克隆抗体,但目前尚不清楚在该方案中接种疫苗后哪些位点在引发中和抗体方面具有免疫显性。在这里,我们根据血浆中循环抗体与针对单个表位的参考单克隆抗体之间的竞争创建了 RABV-G 抗体的表位图谱。由于位点 I 和位点 III 被认为是 RABV-G 的主要中和表位,因此已经使用位点 I (RVC20) 和位点 III (CR4098) 单克隆抗体进行了竞争测定23,24 。此外,使用 site II 抗体 (M777-16-3) 对血浆样品进行竞争测定25。虽然位点 I 和位点 II 抗体在引发组中仍然无法检测到,但位点 III 抗体在许多(但不是全部)个体中被诱导出高于可检测水平(图 D)。在加强组中还观察到更大量的位点 III 抗体,揭示了疫苗诱导的 RABV-G 抗体中位点 III 表位的免疫显性。
RABV-G 结合 Bmem 的诱导和再刺激接种疫苗后的细胞
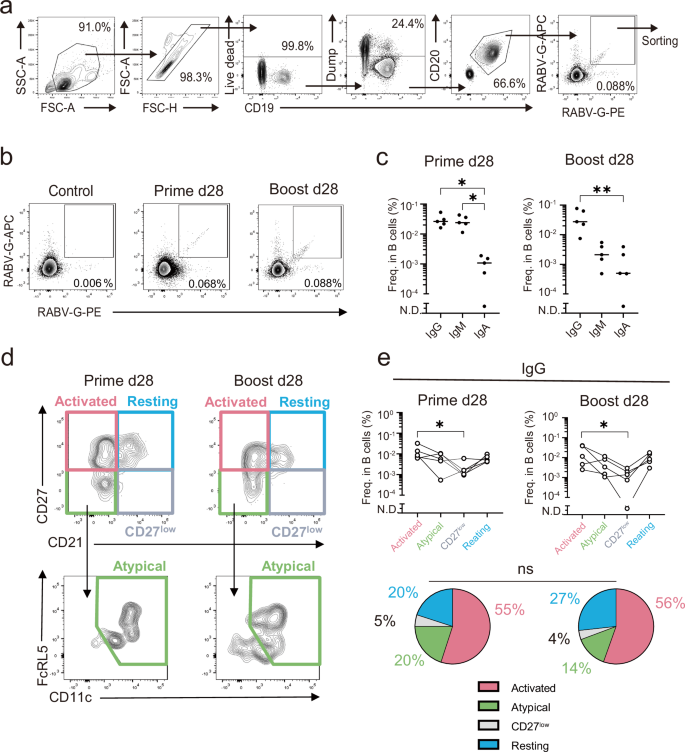
然后,我们通过流式细胞术追踪了外周血中结合狂犬病毒糖蛋白(RABV-G)的记忆B细胞的频率和表型。使用荧光偶联的 RABV-G 诱饵检测 RABV-G 结合 B 细胞(图 D)。使用两种类型的 RABV-G 诱饵与不同的染料偶联来排除与染料结合的细胞,而不是 RABV-G 本身。RABV-G Bmem在门控死细胞和主要由非 B 细胞组成的 Dump 细胞后选择细胞 (CD19CD20RABV-G)。RABV-G 结合 B++++mem与疫苗接种前的对照标本 (5。5 ⨯10 相比),PRIME (0.068%) 和 BOOST (0.088%) 组检测到细胞水平升高−3%)(图对于引物组,IgM 和 IgG 组分在 RABV-G 结合 B 中相同存在++mem群体,而 IgG 分数在增强组中占主导地位(图 D)。然后,IgG B++mem根据 CD21/CD27/CD11c/FcRL5 表达将细胞进一步分为四个亚群(图 D)。2d);静息或经典亚群 (CD21CD27)、活化亚群 (CD21)++−CD27)、CD27+低子集 (CD21CD27+低/−)和非典型亚群 (CD21−CD27型低/−CD11cFcRL5++)26,27 。每个 B 的百分比mem在接种疫苗后第 28 天,比较 Prime 组和 BOOST 组之间的子集(图 D)。在 Prime 和 boost 组中,activated 子集,通常是稳态下的次要群体28,29 ,占据了 RABV-G 结合 IgG B 的一半左右+mem群体,表明通过皮内疫苗接种的启动和增强有效刺激 B 细胞。
a RABV-G 结合记忆 B 细胞 FACS 分选的门控策略。b 幼稚组和接种疫苗组的 PBMC 中 RABV-G 结合 B 细胞的代表性 FACS 图(初免和加强疫苗接种后第 28 天)。c 绘制了初免和加强疫苗接种后表达 IgG、IgM 和 IgA 的 RABV-G 结合 B 细胞的频率 (n = 5)。每个点代表每个人的数据。使用 Kruskal-Wallis 检验进行统计分析 (p < 0.05;p < 0.01)。d 将 RABV-G 结合 IgG B 细胞(CD19CD20 个 RABV-GIgG 细胞)细分为 4 个 B***+++++mem亚群,包括活化的 (CD21−CD27型高)、非典型 CD21(−CD27型低CD11cFcRL5)、CD27++低(CD21CD27升+低) 和休息 (CD21CD27+高) Bmem细胞。e 四个 B 的频率mem亚群被确定为 (d) 中的门控。每个点代表来自每个个体的数据,用线条连接的点表示来自同一个体的数据 (n = 5)。使用 Wilcoxon 检验 (p < 0.05) (上) 进行统计分析。显示 4 个 Bmem 的百分比的饼图*描述了 RABV-G 结合 IgG B 细胞中的亚群。使用 Friedman 检验和卡方检验 (ns: p > 0.05) (下) 进行统计分析。+
Bmem 的中和效力大幅增加加强疫苗接种后的细胞库
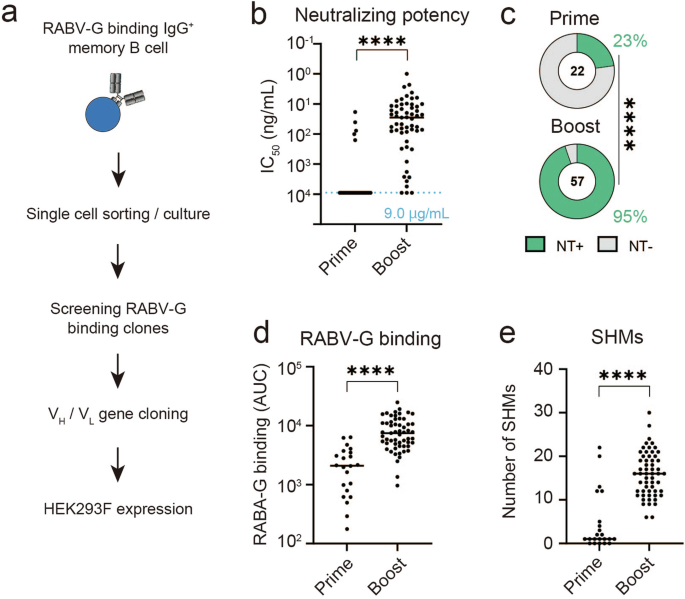
表征 IgG 中保存的抗体的中和效力、表位和免疫球蛋白基因B+mem细胞中,我们对 RABV-G 结合 IgG 进行了分选B +mem来自引物组和增强组的细胞,用于单细胞 Nojima 培养分析(图 D)。3a)30。然后,我们在培养上清液中筛选产生 RABV-G 结合 IgG 的 B 细胞,并获得 107 个抗体阳性克隆(prime:37,boost:70),反映 数量较高 BmemBOOST 组每个供体的细胞数(PRIME:每个供体 52 个细胞,BOOST:每个供体 114 个细胞)。最后,79 VH/VL成功收集序列数据集以生产重组单克隆抗体 (prime:22, boost:59)。这些 IgG 抗体被重建,并使用携带报告基因的具有复制能力的 RABV 检查它们的中和效力31。来自起始组的 IgG 克隆中只有 23% 显示出可检测到的中和活性水平 (<9 μg/mL)(图3b,c),可能反映了由于亲和力成熟不足,引发的 RABV-G 结合较低(图 D)。相比之下,在 95% 的具有高中和效力 (IC50:31。0 ng/mL),比 prime 组高 100 倍以上。此外,体细胞超突变的数量存在显著差异,增强组中体细胞超突变的积累显著(图 D)。3e)。
a 分析保存在 B 中的 RABV-G 结合抗体的实验工作流程示意图mem单克隆水平的细胞。RABV-G 结合 IgG B+mem对细胞进行 FACS 分选并在单细胞水平上培养,并使用培养上清液测定产生 RABV-G 抗体的克隆。b 比较了从 建立的抗狂犬病病毒的中和抗体滴度 (CVS-AcGFP)mB em素数组 (n = 22) 和增强组 (n = 57) 的电池。每个点代表来自每个单克隆抗体的数据。集成电路50< 9 μg/mL 被认为是 NT。c 饼图显示了引物组和增强组的 NT 克隆的百分比。d 比较初免组 (n = 22) 和增强组 (n = 57) 之间每种抗 RABV-G 单克隆抗体的曲线下面积 (AUC)。每个点代表来自每个单克隆抗体的数据。e 每种单克隆抗体的体细胞超突变 (SHM) 分布。使用双尾 Mann-Whitney 检验 (b、d 和 e) 和卡方检验 (c) (p < 0.0001) 进行统计分析。++****
对显性位点 III 的识别B mem加强疫苗接种后的细胞库
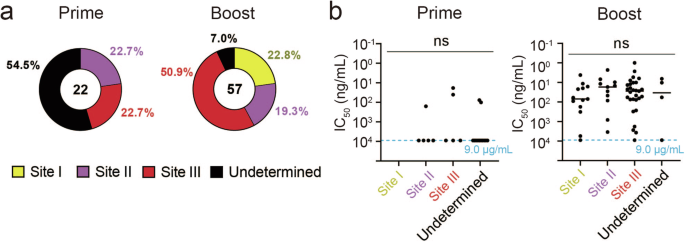
重复接种 COVID-19 和其他疫苗有时会改变血浆和 B mem中存在的抗体的表位偏好随着疫苗剂量数量的增加,细胞从免疫显性表位转变为次显性表位32,33 。为了检查重复接种狂犬病疫苗后是否发生表位偏移,我们确定了 B mem-的结合表位如上所述,通过竞争性 ELISA 衍生的 IgG 克隆。首先,使用位点 I 和位点 III 参比抗体进行竞争性 ELISA,因为这些位点主要以 RABV 中和抗体为靶点。此后,使用 M777-16-3 克隆对不与位点 I 和位点 III 抗体竞争的 IgG 克隆进行位点 II 竞争测定,以将它们分为位点 II 或未确定组。比赛的门槛设定为 75%(补充图 1)。1)。 由于高亲和力参比抗体分离了预结合的 IgG 克隆,高亲和力 IgG 克隆的竞争有时会阻碍低亲和力 IgG 克隆的定位。事实上,超过一半的引物组 IgG 克隆没有与参考 IgG 克隆的任何位点竞争,导致一半的 IgG 克隆被归类为未确定组(图 D)。4a)。 来自引物组的其余克隆被归类为位点 II 或 III 表位,没有一个被归入位点 I 表位。相比之下,大多数增强组克隆被分为位点 I、II 或 III,只有 7。0% 的 IgG 克隆的表位仍未确定,这可能反映了与主基因克隆相比,它们具有更高的亲和力结合。与循环抗体中位点 III 表位的免疫显性性质一致(图 D)。1d),位点 III IgG 克隆最常出现在加强组中,占据了 IgG 克隆的一半左右。尽管位点 III 抗体在数量上占主导地位,但位点 III 定向抗体的中和效力与靶向位点 I 和位点 II 的抗体相当(图 D)。总的来说,RABV 加强疫苗接种回顾了集中在 RABV-G 上 III 位点表位的强效中和抗体,RABV-G 是针对 RABV 的中和抗体的主要靶标。
位点 III 导向的记忆 B 细胞的趋同 V 基因使用情况。
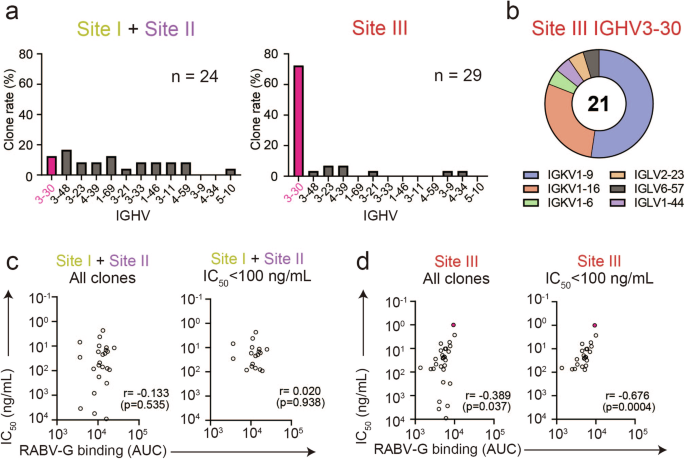
加强疫苗接种后的 III 位点免疫优势是一个有趣的现象,可能与旨在迅速将中和抗体滴度提高到保护性临界值以上的疫苗接种方案相关。为了深入了解该表位聚焦的潜在机制,我们确定了 VH/VL基因在 Bmem 中的使用加强疫苗接种后的细胞库。虽然位点 I 和 II 抗体使用广泛的 VH对特定 V 没有明显偏倚的基因H基因中,约 72。4% 的位点 III 抗体由单个 V 编码H基因 IGHV3-30 (图 。IGHV3-30 克隆的轻链分析也显示对 IGKV1-9 和 IGKV1-16 的偏倚(图 5)。5b),表明位点 III 抗体对 V 基因的使用高度趋同。+
a 显示了每种位点特异性抗体的 IGHV 基因用途。加强组中位点 I + 位点 II (n = 24) 和位点 III 抗体 (n = 29) 中 IGHV 基因使用的百分比。使用 IgBLAST (https://www。ncbi。nlm。nih。gov/igblast/) 为每种抗体分配 IGHV。位点 III 抗体中最常用的 IGHV3-30 以红色突出显示。b IGLV 基因在位点 III 抗体中拥有克隆的 IGHV3-30 中的用途。c、d Spearman 的 IC 相关分析50与所有抗体(左图)和强效中和抗体(右图,IC)的 RABV-G 结合活性 (AUC)50< 100 ng/mL) 表示位点 I + 位点 II (c) 或位点 III (d) 抗体。每个点代表每种单克隆抗体。最有效的中和克隆 4G9 用红色 (d) 绘制。将显示 Spearman r 值和 p 值。
为了评估这种趋同位点 III 抗体反应的生物学影响,我们检查了抗体对位点 III 和非位点 III 表位的结合能力与中和效力之间的相关性(图 D)。5c、d)。在非 III 位点抗体中,两个抗体参数之间没有相关性;然而,位点 III 抗体的中和效力与其结合能力 (r = 0。389,p = 0.037) 和高效抗体 (IC 50< 100 ng/mL),例如 4G9 克隆(红点)显示出更强的相关性 (r = 0。676,p = 0.0004)。 由于趋同 V 基因使用引起的同源抗体反应可能会增强结合和中和之间的联系,从而以与亲和力成熟相关的方式导致中和效力的强劲增加,这在加强疫苗接种后很明显。
通过趋同抗体中的亲水性和短旁位识别位点 III
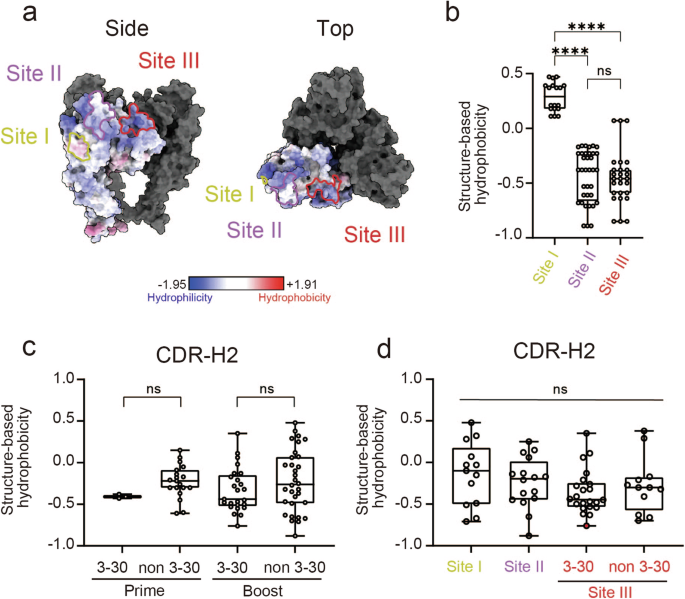
接下来,我们研究了优先使用 IGHV3-30 对位点 III 表位的潜在优势。IGHV3-30 在初始 IgM 库中的普遍存在导致其频繁参与针对各种抗原的抗体反应34,从而增加了疫苗诱导的抗体使用 IGHV3-30 的可能性。此外,水病是抗体-抗原结合和抗原反应性 B 细胞选择的关键生化决定因素之一35、36、37 ,如在 SARS-CoV-2 中和抗体中观察到的那样,与受体结合域中的疏水表位结合37。为了深入了解 IGHV3-30 对位点 III 的主要使用的潜在物理化学机制,我们使用空间聚集倾向计算了水疗法38对于三聚体 RABV-G(PDB:7U9G,链 A、B 和 C)。该计算表明,位点 II 和 III 是亲水性表位,评分相当,而位点 I 相对疏水性更强(图 I)。6a、b)。
a RABV-G 3D 结构(PDB:7U9G,链 A-C)表面的水病分布。亲水性(蓝色)和疏水性(红色)的趋势在比例尺中指示。每个抗原位点都用线条描绘,位点 I 为黄色,位点 II 为紫色,位点 III 为红色。b RABV-G 表位位点的水pathy评估。每个点代表一个包含每个表位的氨基酸。数据表示为 SD ±中值。c、d Prime 组 (n = 22) 和增强组 (n = 57) 中所有抗体的 CDR-H2 水病评估。比较 IGHV3-30 和其他 V 之间的分数HPrime 和 Boost 组中的基因 (C) 以及每个位点之间的基因 (D)。根据 IGVH3-30 或其他 V 的使用情况,将 Site III 抗体细分为两组H基因 (D)。最有效的中和克隆 4G9 用红色 (d) 绘制。数据以 SD ±中位数表示。使用 Kruskal-Wallis 检验 (b) 和双尾 Mann-Whitney 检验 (c, d) 进行统计分析(ns: p > 0.05;p < 0.0001)。****
我们还计算了来自引物组和增强组的抗体中 CDRs 的水解。使用 Ig-Fold 预测抗体的结构39。为了探索 IGHV3-30 基因的潜在优势,我们进一步将每组细分为 IGHV3-30 编码和非编码抗体(图 D)。6c 和补充图。2a 和 3a)。来自IGHV3-30编码抗体的CDR-H2往往比来自非IGHV3-30抗体的CDR-H2更亲水性,这表明IGHV3-30 CDR-H2具有固有的亲水性。在升压组中观察到类似的趋势。另一方面,来自 IGHV3-30 编码抗体的 CDR-L2 比来自非 IGHV3-30 抗体的 CDR-L2 更疏水;这在很大程度上归因于 IGHV3-30 编码的抗体优先使用疏水性 kappa 轻链(IGKV1-9 和 IGKV1-16)(图 D)。5b)。
然后,我们按每个表位位点对这些水病评分进行了重新分类(图 D)。6d 和补充图。2b 和 3b)。同样,CDR-H2 水病变在位点 III 抗体中往往比在非位点 III 抗体中更亲水,这种差异在 IGHV3-30 编码的抗体中更为明显(图 D)。因此,这些数据表明 CDR-H2 亲水性在加强疫苗接种后 IGVH3-30 编码的抗体的主要召回中具有潜在作用。有趣的是,最有效的中和位点 III 克隆 4G9(图 1 中的红点)。6d),在针对位点 III 的 IGHV3-30 编码抗体中表现出最低的 CDR-H2 疏水性(图 D)。6d),进一步强调了 CDR-H2 亲水性对于结合位点 III 和增强中和效力的重要性。一般来说,CDR-L2 对抗原识别的贡献非常有限,CDR-H2 的作用要重要得多40。因此,虽然 IGHV3-30 基因的选择性优势可能源于 CDR-H2 对亲水位点 III 表位的亲水性,但从 IGKV1-9 和 IGKV1-16 基因中选择疏水性 CDR-L2 可能是由于其他因素,这将在下面进一步讨论。
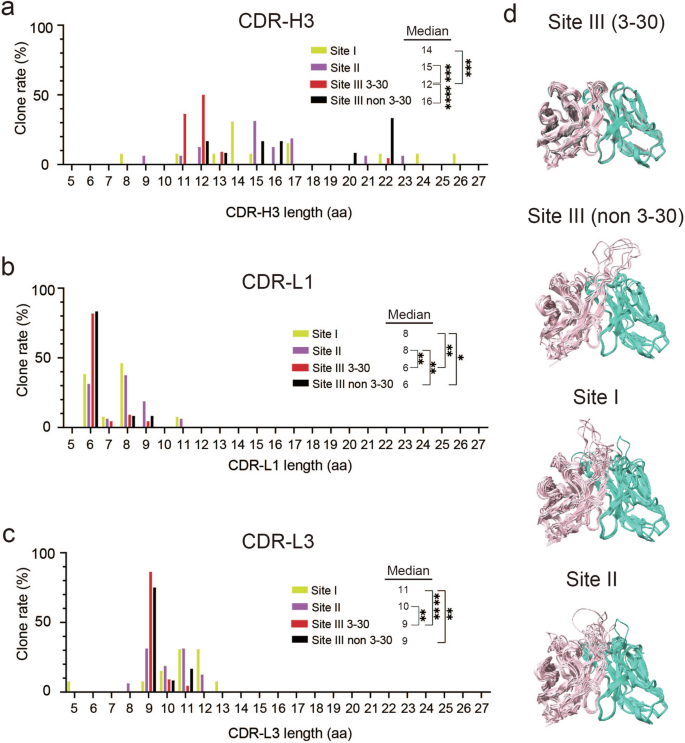
除了水疗法之外,界面的形状互补性是驱动抗体-抗原相互作用的另一个重要因素41。尽管对这种互补性的精确分析需要抗体-抗原复合物的 3D 结构,但基于 3D 结构或准确预测的库规模分析是不可行的。相反,我们利用了 CDR 的长度显着影响旁位形状的概念42。因此,我们分析了中和抗体中每个 CDR 的长度。有趣的是,位点 III 抗体中的 CDR-L1、L3 和 H3 短于位点 I/II 抗体中的CDR-L1、L3和H3(图。7 和补充图4)。 具体来说,较短的 CDR-L1 和 L3 长度归因于在位点 III 抗体中优先使用 kappa 轻链;这些抗体中有 79% (27/34) 与 κ 轻链配对,而分别只有 23% (3/13) 和 44% (7/16) 的位点 I 和 II 抗体使用 κ 轻链。预测的 Fv 模型结构与 PDB 中 IGHV3-30 编码的抗体(PDB:8A1E,链 D、E)的实验确定的结构的比较清楚地表明,以 6 个残基 CDR-L1 和一个 9 个残基 CDR-L3 为特征的较短的旁位有助于位点 III 抗体中的旁位更平坦。值得注意的是,与表现出更多样化 CDR 长度的其他表位的抗体不同,IGHV3-30 编码的 23 个位点 III 抗体克隆中有 19 个具有 11 或 12 个残基的 CDR-H3,导致更平坦的旁位(图 D)。尽管它们的 CDR-H3 长度较短,但这些旁位表现出 CDR-H3 的不同构象,包括各种侧链,与位点 I/II 抗体中发现的旁位相比,可能有助于形成更平坦但崎岖的旁位。位点 III 表位位于 RABV-G 的上侧,位于包括位点 II 在内的突出区域脚下,使分子表面崎岖不平(图 D)。1c),归因于在位点 III 处突出到溶剂中的 Arg 残基。因此,针对位点 III 的 IGHV3-30 编码抗体的这些较短的 CDR 长度主要是由于偏好由 IGKV1-9 和 IGKV1-16 编码的 kappa 轻链,并且可能选择适应位点 III 表面的崎岖平面性质。
a–c 每种位点特异性抗体的 CDR 长度分布。显示了 CDR-H3 长度分布 (a)、CDR-L1 长度分布 (b) 和 CDR-L3 长度分布 (c)(对于其他 CDR,请参见补充图 1)。4)。 使用双尾 Mann-Whitney 检验进行统计分析 (p < 0.05;p < 0.01;p < 0.001;p < 0.0001)。d 靶向每个位点的抗体的结构比较,从上到下排列:来自 IGHV3-30 的 19 个位点 III 抗体,具有 6 个残基的 CDR-L1、一个 9 个残基的 CDR-L3 和一个 11 或 12 个残基的 CDR-H3。冷冻电镜结构(8A1E,链 D、E)以灰色显示;来自其他基因的 9 个位点 III 抗体,具有 6 个残基 CDR-L1 和一个 9 个残基 CDR-L3;12 个位点 I 抗体;和 14 个位点 II 抗体。使用 ChimeraX 的 Matchmaker 工具将所有抗体叠加到位点 I 抗体 1D7 上**********68。重链和轻链分别以粉红色和绿色显示。
通过趋同抗体中的静电互补性识别位点 III
决定抗体-抗原相互作用的另一个重要因素是在界面处形成氢键,或者更广泛地说,是静电相互作用。这些静电特性通常通过计算静电电位来量化,这涉及使用蛋白质结构求解连续静电方程43由于抗体-抗原复合物的结构不可用,我们仅根据抗体或抗原结构计算静电电位,从而专注于分子表面的静电特性。
我们使用了 APBS 软件44计算分子表面的静电势。平均而言,RABV-G 表面上每个表位位点的静电势几乎是中性的,但表现出一些变化,位点 III 比其他表位位点更负(补充图 D)。5)。 当将静电电位映射到抗体表面时,我们观察到 IGHV3-30 抗体的一些 CDR-H1 和 CDR-H2 往往比其他抗体表现出更多的阳性特性(补充图 D)。这可能表明 IGHV3-30 基因在抗体-抗原界面的静电互补性方面的另一个优势,尽管这些静电效应并不像水疗法相互作用那样被很好地定义(补充图5 和 6)。
CDR-H3 中用于超强中和抗体结合位点 III 的关键氨基酸
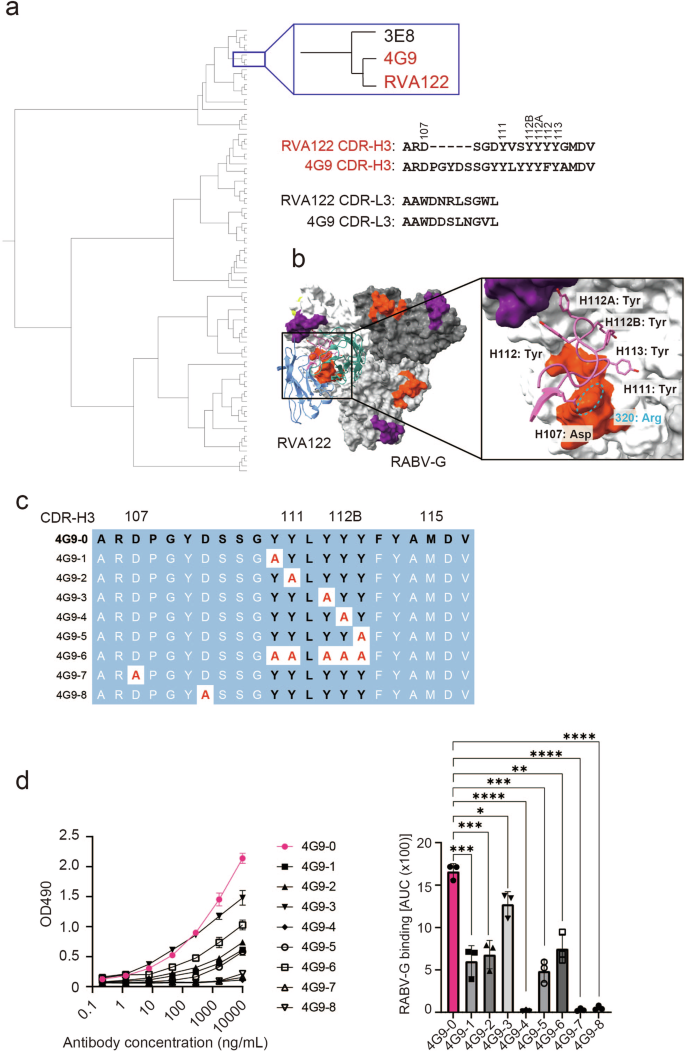
之前的一项研究表明,针对 SARS-CoV-2 的强效中和抗体往往在 CDR-H3 中表现出更多的疏水特性37。事实上,与其他 CDR 相比,本研究中针对 RABV-G 的中和抗体在 CDR-H3 中也显示出更大的疏水性(补充图 1)。尽管 CDR-L1、L3 和 H3 在收敛的 IGHV3-30 编码的位点 III 抗体中往往更短(图 D)。7),而高效的 4G9 克隆具有亲水性 CDR-H2(图 D)。6d 和补充图2b),位点 III 抗体仍有可能利用 CDR-H3 中的疏水性来结合和中和效力。首先,我们将本研究中所有抗狂犬病中和抗体(包括 4G9)的 CDR-H3 序列与蛋白质数据库 (PDB) 中保存的抗体进行了比较。我们鉴定了 RVA122,它具有一个 17 个残基的 CDR-H3,其中包含 5 个 Tyr 残基,与 RABV-G (PDB: 7U9G) 形成复合物(图 D)。有趣的是,RVA122 也来源于接种疫苗的个体,但来自不同的种系来源,战略性地将其 CDR-H3 定位在位点 II 和 III 表位之间,所有 Tyr 残基都与抗原相互作用(图 D)。值得注意的是,RVA122 在 CDR-H3 的 107 位(IMGT 编号)具有 Asp 残基,它在 RABV-G 的 III 位点表位上与 Arg 残基形成盐桥。在 4G9 中 CDR-H3 的相应位置发现一个带类似电荷的残基,表明其在抗原识别中的重要性。此外,4G9 和 RVA122 的 CDR-L3 均来源于 lambda 轻链,显示出高序列同一性(11 个残基中为 64%),并且它们的不同氨基酸具有相似的物理化学性质(图 D)。这些观察结果表明 4G9 和 RVA122 与 RABV-G 之间存在类似的、可能在功能上趋同的结合机制。为了测试 4G9 和 RVA122 之间共享的 CDR-H3 Tyr 残基的作用,我们对 4G9 的 CDR-H3 进行了突变分析,用丙氨酸取代 Tyr 和其他带电氨基酸(图 D)。该分析显示,8 个突变体中有 7 个表现出结合减少,突出了这些 Tyr 和带电的 Asp 残基在位点 III 识别中的关键作用(图 D)。综上所述,表位特异性、中和效力、V 基因使用和结构比较表明 RABV 中和抗体的趋同进化趋势,这可能是由于适应了具有亲水性和崎岖特征的免疫显性位点 III 表位。
来自引物组和增强组的成簇 CDR-H3 序列的系统发育树。使用 CDR-H3 氨基酸序列的同源性验证表明,在所有克隆中,4G9 和 RVA122 的 CDR-H3 序列最接近。b RVA122 和 RABV-G 之间结合模式的结构图 (PDB: 7U9G)。c 突变 4G9 中 CDR-H3 的氨基酸序列比对,用于丙氨酸扫描。d 每个克隆与 RABV-G 的结合。根据此图计算 AUC 以评估结合活性。数据来自三个独立实验。条形代表 SD ±平均值。使用未配对的 t 检验 (ns: p > 0.05;p < 0.05;p < 0.01;p < 0.001;p < 0.0001)。**********
讨论
迅速而有力地诱导高于保护阈值的中和抗体是重复接种灭活狂犬病疫苗的主要目标。尽管灭活疫苗的免疫原性可能低于 mRNA 疫苗45,46 ,该队列中间隔一年的加强疫苗接种强烈地召回了中和抗体,结合亲和力和中和效力均显着增加,这可能是由于体液免疫记忆的时间成熟28,47 。正如我们之前的研究所证明的那样,这种方法涉及特定的免疫计划和剂量,已被证明可以有效地诱导强大的免疫反应20,48 。在这里,我们确定了 RABV 中和抗体反应的一个以前未被重视的特征,该特征仅在加强疫苗接种后主要靶向 III 位点表位。重复接种疫苗有时会诱导抗体反馈,因此启动后产生的抗体会导致加强剂后 B 细胞的选择出现至少两种类型的偏差。一种是优先选择识别相同表位的高亲和力抗体49,另一种是抗体表位从显性表位转变为次显性表位,如 SARS-CoV-2 mRNA 疫苗所观察到的那样33。初免和加强疫苗接种后血浆中 III 位点抗体的优势出现降低了重复狂犬病疫苗接种后表位转移的可能性。相反,这种狂犬病疫苗方案中的抗体反馈更有可能增加针对免疫显性 III 位点表位的中和抗体的效力,如加强疫苗接种后 III 位点定向抗体的中和效力显着增加所代表的(图 D)。4b)。
位点 III 定向抗体非常趋同,主要由单个 V 组成H基因 IGHV3-30 中,通常在广泛的人群中表达。这些数据表明,人抗体库对 RABV-G 位点 III 表位以及 SARS-CoV-2 刺突或流感血凝素表位具有固有的适应性50、51、52 ,这导致 IGHV3-30 基因在针对这些病毒的中和抗体中频繁使用。应该强调的是,IGHV3-30 在 RABV 中和抗体中的使用频率 (72。4%) 高于 I B 细胞 (约 6%) 和对其他病毒抗原的特异性细胞53,支持此 V 的附加选择HRABV-G 的基因。与我们的研究结果一致,之前一项使用噬菌体展示方法的研究确定了 IGHV3-30 编码的抗体在 RABV-G 结合组分中频率最高23,进一步强化了此 VHRABV-G 结合基因。
偏好 IGHV3-30 的可能分子基础是其亲水性极性 CDR-H2,这可能增强了对亲水性位点 III 表位的识别。IGHV3-30 编码的 III 位点抗体的另一个显着特征是其较短的旁位。较长的 CDR-L1 有助于形成口袋状的旁位,而较短的 CDR-L1 则表明旁位更平坦42,可能使抗体更适合识别较平坦的表位,包括 RABV-G 位点 III。此外,位于抗原结合位点中心的几何 CDR-L3 和 H3 表明这些 CDR3 的较短长度有利于适应平面位点 III 表位。根据每个表位的几何特征,位点 I 位于 RABV-G 的一侧,位点 II 位于 RABV-G 上部边缘,位点 III 位于包括位点 II 的突出区域脚下的上侧。因此,人们很容易推测,尽管抗体可能倾向于位点 II,因为它通过暴露于溶剂增加了可及性,但它们更热衷于与位点 III 的结合,因为它更宽、更平坦、更坚固。为了适应位点 III 的这些分子特征,可以优先选择具有较短旁位的抗体,例如由 IGHV3-30 编码的抗体。
IGHV3 – 30 编码抗体的这种分子差异如何仅在加强疫苗接种后而非初次疫苗接种后导致其作为位点 III 结合剂的显著选择,这个问题仍然存在。亲水性 CDR – H2 和短互补决定区在天然抗体库中 IGHV3 – 30 编码的抗体中已经存在,这可能在初次免疫后增加了与非 IGHV3 – 30 编码抗体相比的选择优势。解释仅在加强疫苗接种后观察到的 IGHV3 – 30 偏好的一种可能情况是,在初次免疫后,基于 BCR 亲和力从初始 B 细胞中招募 B 记忆细胞的选择不太严格。已知不太严格的选择允许具有对选择抗原低亲和力 BCR 的 B 记忆细胞发展,从而降低了亲和力差异不大的 B 细胞之间的竞争优势。相比之下,加强型抗原仅重新刺激数量有限的具有较高亲和力的 B 记忆细胞,这些细胞相对于其他 B 记忆细胞具有竞争优势,这可能会提高 B 记忆细胞重新刺激的亲和力阈值。因此,我们推测 IGHV3 – 30 编码抗体的亲水性、较短的互补决定区以及其他物理性质(如静电性质)所提供的轻微优势最终有助于在加强免疫后携带该 VH 基因的 B 记忆细胞的显著选择。
超强中和抗体 4G9 的丙氨酸扫描显示,CDR-H3 中的连续 Tyr 残基参与与位点 III 的结合。CDR-H3 Tyr 在位点 III 结合中的作用得到了另一种超能中和抗体克隆 RVA122 的结构分析的进一步支持。尽管 4G9 和 RABV-G 复合物的结构分析对于更深入地了解 CDR-H3 Tyr 的可能作用至关重要,但重要的是要注意 Tyr 在抗体中天然丰富,通常对抗原识别至关重要58。尽管在我们的计算中被归类为疏水性氨基酸,但 Tyr 也表现出亲水性,因为它能够通过其羟基与周围的残基或水分子形成氢键。这种两亲性使 Tyr 非常适合抗原识别。
在这项研究中,这种疫苗接种计划已被证明可以维持体内有效的中和抗体滴度,即使与传统的多剂量计划相比,剂量数量有所减少。减少剂量有助于降低疫苗接种成本并促进更广泛的疫苗可及性,尤其是在发展中国家。此外,加强疫苗接种产生了识别其他表位位点的抗体,我们假设这可以提供增强的感染保护。鉴于这些发现,这项研究对未来的狂犬病预防工作具有重要意义,因为它阐明了灭活狂犬病疫苗中和抗体产生的机制,并表明即使减少疫苗接种计划也可以产生有效的中和抗体。
针对狂犬病的中和抗体的作用机制仍在争论中59。位点 III 定向抗体可以阻断融合前后形式之间的构象转换以及感染所需的受体相互作用。本研究强调了靶向位点 III 表位的中和抗体对未来疫苗设计的重要性。我们的研究结果表明,位点 III 是中和抗体的关键靶点,专注于该表位可以提高疫苗功效。合理设计免疫原以稳定位点 III 或以优化配置呈现它,可以推动更强、更集中的抗体反应。了解位点 III 结合抗体的结构特征可以进一步指导表位模拟物的工程设计,以优先引发此类抗体。
由于根据 WHO 指南更新了疫苗接种计划,该研究的队列规模受到限制21。此外,在我们的研究队列中,20 名参与者中有 19 名是男性,这反映了泰国一个村庄的村庄或畜牧志愿者 (VLV) 的人口特征。这种性别失衡代表了我们研究的局限性,因为由于荷尔蒙、遗传和环境因素,男性和女性之间的免疫反应可能不同。尽管与同一主要组中的男性参与者相比,单个女性参与者的循环抗体滴度没有观察到显着偏差,但单个女性受试者不足以稳健地评估疫苗反应中基于性别的潜在差异。未来的研究应旨在招募一个更平衡的队列,以调查对狂犬病疫苗接种免疫反应的潜在性别特异性差异,并提高研究结果的普遍性。
此外,需要通过生化和结构方法评估亲水性极性 CDR-H2 在 IGHV3-30 编码的抗体中的确切贡献。同样重要的是要记住,在接种 COVID-19 mRNA 和其他疫苗后观察到的 IGHV3-30 使用情况可能具有不同的机制基础。
方法
人类样本
健康的成年志愿者 (n = 20) 接种灭活狂犬病疫苗 (PVRV, SPEEDA®),该疫苗是在 Vero 细胞中生长的色谱纯化的巴斯德乳杆菌 PV206 菌株。根据 WHO 指南,针对因职业而处于较高风险的个体或偏远狂犬病流行环境中的亚群的 PrEP 建议已更新,以考虑:(i) 及时获得狂犬病生物制剂;(ii) 获得狂犬病血清学检测;(iii) 加强疫苗接种的要求;以及 (iv) 野生动物水库中存在狂犬病。根据这些标准,20 个村庄或畜牧志愿者 (VLV) 被纳入研究,他们协助为本村的猫和狗提供狂犬病疫苗接种。研究参与者有暴露风险,尤其是来自 Mae Kha 分区、San Pa Tong 区、Doi Lor 分区、Doi Lor 独特区和清迈省的 VLV。所有参与者均年龄匹配,入组前 3 个月内无急性传染病迹象。参与者被分为主要组 (n = 10,中位年龄 56。5 (33-70))和加强组 (n = 10,中位年龄 61。0 (37-66)),并在第 0 天和第 7 天皮内注射双组疫苗(每组 0.1 mL)。对于加强组,参与者在每组启动大约 1 年后接受加强疫苗接种,每组 0.1 mL。在初免 (初免组) 和加强 (加强组) 后第 0 天和第 28 天接受疫苗接种前纵向采集血样。该研究得到了清迈大学相关医学科学学院伦理委员会 (AMSEC-63FB-005) 和国家传染病研究所机构审查委员会 (#1263) 的批准。它们是根据赫尔辛基宣言进行的。所有志愿者在入组前都提供了书面知情同意书。
血液样本制备
通过离心分离血浆样品,并在 -80 °C 下冷冻直至检测。通过 ficoll 密度梯度离心从肝素化血液中分离外周血单核细胞 (PBMC)。用磷酸盐缓冲盐水洗涤分离的 PBMC 两次,浓度调节至 1 × 107cells/mL 并冷冻保存。
重组 RABV-G
商业合成了编码狂犬病病毒 RABV-G 的人密码子优化 DNA 片段 (GeneBank: BAA03837) (GenScript)。该序列与信号肽(氨基酸 1-19;MVPQALLLVPILGFSLCFG),包括 T4 折叠三聚体化基序、组氨酸标签和 Strep 标签被克隆到哺乳动物表达载体 pCMV 中。根据制造商的说明(ExpiFectamine™ 293 转染试剂盒,Thermo Fisher Scientific),使用 Expi293F 细胞生产重组蛋白。转染后第 5 天收获转染细胞的上清液,并使用 Ni-NTA 琼脂糖 (QIAGEN) 纯化重组蛋白。为了制备 RABV-G 荧光探针,将 Strep 标记的 RABV-G 与 PE 或 APC 标记的 Strep-Tactin (IBA Lifesciences) 在 4 °C 下以 1:4 的比例孵育过夜,然后用于 FACS 分析。
重组抗体
如前所述生产重组单克隆抗体和 Fab37,60 。简而言之,来自单细胞培养物或已发表的单克隆抗体 (RVC2061、M777-16-325和 CR409823) 被克隆到人 IgG1 重链、重链 CH1、kappa 或 lambda 轻链的表达载体中。重链和轻链载体对在 HEK293F 系统 (Thermo Fisher Scientific) 上共表达,IgG1 用蛋白 G 柱 (Thermo Fisher Scientific) 纯化,Fab 用 Talon 柱 (Clontech) 纯化。
流式细胞术
将 PBMC 在 37 °C 下解冻,并立即用补充有 2% FBS 的 DMEM 洗涤,然后在室温下用补充有 2% FBS 的 DMEM 中的 RABV G 蛋白探针染色 30 分钟。用培养基洗涤细胞,并使用 Brilliant Stain Buffer Plus (BD Biosciences) 在室温下用后续抗体/试剂染色 30 分钟:抗 IgA FITC [多克隆兔 F(ab′)2,Dako]、抗 IgG-BV421(G18-145,BD Biosciences)、抗人 CD2-BV510(RPA-2。10,BioLegend)、抗人 CD4-BV510(RPA-T4,BioLegend)、抗人 CD10-BV510(HI10a,BioLegend)、抗人 CD14-BV510(M5E2,BioLegend)、LIVE/DEAD 可固定黄色死细胞染色试剂盒(Thermo Fisher)科学)、抗 CD27-BV605(O323,BD Biosciences)、抗 FcRL5-BV650(509F6,BD Biosciences)、抗 CD19-BUV395(HIB19,BD Biosciences)、抗 CD20-BUV496(2H7,BD Biosciences)、抗 IgM-BUV563(UCH-B1,BD Biosciences)、抗 CD11c-BUV615(3。9,BD Biosciences)和抗 CD21-BUV737(B-ly4,BD Biosciences)。用补充有 2% FBS 的 DMEM 洗涤细胞,然后在培养基中重悬,并使用 FACS Symphony S6 (BD Biosciences) 进行分析。使用 FlowJo 软件 (BD Biosciences) 分析数据。
单 B 细胞培养
如前所述进行单个 B 细胞培养62。简而言之,CD19 CD2 CD4 CD10+––−CD14的−IgD 抗体−将 CD27 IgG RABV-G B 细胞分选到预培养的 MS40L 低饲养层细胞中,该细胞在含有补充有 10% FBS、55 μM 2-巯基乙醇 (2-ME)、青霉素 (100 U/mL)、链霉素 (100 μg/mL)、10 mM HEPES、1 mM 丙酮酸钠、1% 最低必需培养基非必需氨基酸、重组人白细胞介素-2 (IL-2;50 ng/mL;PeproTech)、重组人 IL-4 (10 ng/ml;PeproTech)、重组人 IL-21 (10 ng/mL;PeproTech)、属于 TNF 家族的重组人 B 细胞活化因子 (BAFF, 10 ng/mL;PeproTech) 用于 FACS Symphony S6 (BD Biosciences)。将板在 37 °C 和 5% CO 的潮湿环境中孵育+++2。培养基在第 4 、 8 、 12 、 15 和 21 天补充一半。在第 24 天收获上清液,并使用 Direct-zol RNA 小量制备 (Zymo 研究) 从细胞中提取 RNA,用于免疫球蛋白基因克隆和测序。免疫球蛋白基因(重链和轻链基因)使用已建立的引物和方法通过两轮巢式 PCR 扩增37,60,63 。使用 IgBlast IMGT 鉴定 V(D)J 重排和体细胞超突变的数量。
ELISA 抗体
为了定量血浆或单细胞培养上清液中的 RABV-G 结合 IgG 滴度,将 MaxiSorp 96 或 384 孔 ELISA 板 (Thermo Fisher Scientific) 在 4 °C 下用 1 μg/mL RABV-G 包被过夜。用 ChonBlock™ 封闭/样品稀释缓冲液 (Chondrex) 封闭后,将连续稀释的血浆样品或单细胞培养上清液上加入板并在室温下孵育 2 小时。用含有 0。1% Tween-20 的 PBS 洗涤后,加入用 Can Get Signal #2 (TOYOBO) 稀释的 1/5000 抗人 IgG-HRP (SouthenBiotech),并用邻苯二胺 (OPD, Sigma-Aldrich) 观察 HRP 活性。用 2 N H 终止反应后2所以4,在酶标仪 (Epoch 2, BioTek) 中测量 OD490。使用对照抗体 (mAb15-1364) 并计算每个血浆样本中抗 RABV-G 抗体的浓度。
如前所述,使用参考单克隆抗体(位点 I:RVC20、位点 II:M777-16-3 和位点 III:CR4098)通过 CEE-cELISA 定量血浆样品中的位点特异性 IgG 滴度。65。血浆样品相对于参考抗体的抑制百分比计算为 (1 − OD血浆/OD参比单克隆抗体) × 100,稀释因子显示65测定 30% 的抑制作用。同样,使用相同参比单克隆抗体的 Fab 通过竞争 ELISA 测定重组抗体的结合位点,并将对每种参比抗体抑制< 75% 的抗体分类到每个位点。
病毒感染性中和 (NT) 测定
用携带荧光 AcGFP 基因的具有复制能力的 RABV 攻击病毒标准品菌株 (CVS-AcGFP) 通过 NT 法检测重组抗体的中和活性。如前所述,通过将 AcGFP 基因插入 N/P 基因间区域产生 CVS-AcGFP31。简而言之,将重组抗体在含有 2% FBS 的 MEM 中连续稀释 3 倍,并在 50 μL 中与 100 个病灶形成单位 (ffu) 的 CVS-AcGFP 混合。在 37 °C 下孵育 30 分钟后,将抗体 – 病毒混合物添加到 96 孔板中的 BHK-21 C13 细胞 (JCRB, JCRB9020) 中。培养 4 天后,用 4% 多聚甲醛磷酸盐缓冲溶液固定细胞,并用 Hoechst 33342 染色以观察细胞核。使用荧光显微镜 IX73 (Olympus) 或自动显微镜 IN Cell Analyzer 2500 HS (Cytiva) 捕获荧光图像。集成电路50值是使用 GraphPad Prism 9 (GraphPad) 计算的。
亲水性计算和结构预测
使用空间聚集倾向 (SAP) 评分评估每种抗体和 RABV-G 的 CDRs 的水病变38,使用 CHARMM 程序计算66。使用 APBS 软件计算静电势44,其中所有计算均在 1:1 盐中以 0。15 M 的离子强度进行,蛋白质介电常数为 2,溶剂介电常数为 78。54,温度为 298。15 K。这些分析基于 RABV-G 的冷冻电镜结构(7U9G,链 A、B 和 C)和使用 Ig-Fold 生成的抗体的预测模型39。为了适应冷冻电镜结构和预测模型的不确定性,SAP 半径设置为 10 Å,从而能够识别更宽、低分辨率的斑块。本研究中的 CDR 定义基于 IMGT 方案67。
数据分析
使用 GraphPad Prism 9 软件 (GraphPad) 对数值数据进行统计分析和可视化。进行 Wilcoxon 检验、 Mann-Whitney 检验、 Kruskal-Wallis 检验、 Friedman 检验、卡方检验和 Dann 多重比较检验。p 值小于 0.05 的差异被认为是显著的:∗P < 0.05,∗∗p < 0.01,∗∗∗p < 0.001,∗∗∗∗p < 0.0001。
数据可用性
几种抗 RABV-G 单克隆抗体的序列数据已存入 GenBank,登录号为 LC812179–LC812257 (VH) 和 LC812292–LC812370 (VL)。截至发布之日,数据已公开提供。支持本文结论的原始数据将由作者提供,不得无故保留。
引用
Hits: 139
- 狂犬病(2025年6月更新)
- 狂犬病 你应该知道的
- 预防和治疗狂犬病的狂犬病疫苗
- 狂犬病可能成为历史
- 看看每种疫苗:狂犬病疫苗
- 阿拉巴马州妇女在从车上卸下杂货时被狂犬病狐狸咬伤:“公共卫生威胁”
- 应对狂犬病
- 全球疫苗免疫联盟将促进全球疫苗免疫联盟、世卫组织和阿联酋50多个国家获得拯救生命的人类狂犬病疫苗
- 美国CDC发布了将狗带入美国的新规定,旨在防止狂犬病
- 全国狂犬病监测方案
- 2024年东帝汶首例狂犬病确诊病例
- WHO实况报道 狂犬病
- 狂犬病
- 狂犬病疫苗接种:给医疗保健提供者的信息
- 特定感染的流行病学和控制:狂犬病
- 狂犬病疫苗接种的注意事项或禁忌症
- ACIP 使用减少(4剂)疫苗计划进行暴露后预防以预防人类狂犬病
- 实施良好的狂犬病暴露后预防方案
- ACIP 使用修改后的暴露前预防疫苗接种计划预防人类狂犬病,美国,2022年
- 西班牙犬类狂犬病免疫保护的影响因素
- 减少犬的进口等待期-对狂犬病恐惧科学合理的变化
- 老年人对狂犬病暴露后预防无应答:挑战和方法
- 狂犬病疫苗的效力、免疫原性和有效性:体外和体内方法
- 狂犬病人免疫球蛋白 (HRIG)
- “震惊”的妇女,超过6,000美元的救命狂犬病治疗账单
- 负鼠感染狂犬病毒对这种病毒在城市环境中的传播敲响了警钟
- 索马里蜜獾感染未报告的首例疑似人狂犬病病例研究
- 两名狂犬病研究人员解释如何保护自己免受这种疾病的侵害
- 临床医生常见的狂犬病问题
- 狂犬病疫苗
- 世界卫生组织关于狂犬病的常见问题
- 狂犬病实况报道
- 狂犬病
- 狂犬病是一种古老的、不可预测的、可能致命的疾病——两位狂犬病研究人员解释了如何保护自己
- 狂犬病疫苗短缺:给卫生专业人员的建议
- 7例被狂犬咬伤者接种狂犬病疫苗的效果观察
- 全球狂犬病风险:狂犬病疫苗短缺期间的实用建议
- 巴西一个土著村庄被蝙蝠掠夺的高风险:警告狂犬病在马卡利人中重新出现
- 评估在澳大利亚蝙蝠狂犬病病毒和狂犬病暴露后预防中血清学的益处
- 蝙蝠处理者的狂犬病暴露前预防
- 基于狂犬病中和抗体水平的狂犬病加强剂时机指南
- 施用狂犬病疫苗和免疫球蛋白
- 为狂犬病暴露后预防开发的单克隆抗体鸡尾酒疗法
- 狂犬病预防处置常见问题解答(成大生物)
- 世界卫生组织狂犬病专家磋商会 第三版报告
- 世卫组织对狂犬病的看法
- 新型狂犬病疫苗
- 狂犬病病毒可以抗强大的天然免疫
- 狂犬病的被动免疫
- 亚洲狂犬病预防
- 秘鲁高风险人群的大规模狂犬病暴露前预防
- 人用狂犬病疫苗
- 野生动物狂犬病疫苗
- 狂犬病和狂犬病疫苗的历史
- 狂犬病的生命周期、传播和发病机制
- 狂犬病暴露后管理指南(英国 2023年1月)
- 2022年印度马哈拉施特拉邦一名幼儿出现临床狂犬病症状后存活
- 第27章:狂犬病
- 狂犬病:问题和答案
- 《狂犬病暴露预防处置工作规范(2023年版)》解读问答
- 狂犬病暴露预防处置工作规范(2023年版)
- 狂犬病
- 狂犬病相关问题解答
- 疾病控制中心加强了对进口狗的狂犬病管理,原因如下
- 关于狂犬病
- 一名加州艺术教师在教室遭遇蝙蝠后死于狂犬病
- WHO 实况报道 动物咬伤 2024年1月
- 疫苗接种和免疫 狂犬病
- 世卫组织推荐皮内途径用于狂犬病暴露后预防
- 狂犬病疫苗:世卫组织立场文件–2018年4月
- WHO实况报道 狂犬病 2024年6月
- 狂犬病-结束忽视, 实现可持续发展目标 被忽视的热带病路线图 2021-2030
- 动物狂犬病
- 宠物主人对疫苗的犹豫越来越多——一位公共卫生专家解释了为什么这很重要
- 兽用狂犬病疫苗
- 何时寻求狂犬病医疗护理
- 猫
- 关于获得人类狂犬病疫苗的社会正义观点
- 评估新的狂犬病暴露后预防(PEP)方案或疫苗
- 卫生和福利部-狂犬病
- 狂犬病暴露后预防用单克隆抗体开发的最新进展:临床开发管线现状综述
- 世卫组织对狂犬病免疫接种的立场 – 2018 年最新情况
- 恐水症:1874 年的狂犬病和改变一切的救命疫苗
- 新的人类狂犬病疫苗正在研发中
- 为什么消除狂犬病?
- 为什么现在要根除狂犬病?
- 狂犬病-NFID
- 为狗接种疫苗 – 它们不会因接种疫苗而患上自闭症
- 宠物主人版 狗的狂犬病
- 猫的狂犬病
- 狂犬病-国际脑炎协会
- 器官移植后如何感染狂犬病?
- 器官移植患者感染狂犬病后死亡
- 人类狂犬病疾病负担:Rabipur®疫苗的潜在预防作用
- 印度东北部农村的狂犬病:强调同一健康方法紧迫性的病例报告
- 狂犬病毒糖蛋白的深度突变扫描确定了突变限制和抗体逃逸突变
- 人类狂犬病:一种治疗方法
- 通过受感染狗唾液污染的隐形眼镜传播狂犬病病毒(病例报告)
- 越南暴露前预防计划中基于灭活 vero 细胞的狂犬病疫苗 (Rabivax-S) 的安全性和免疫原性
- 狂犬病生物制剂在 III 类动物暴露儿科患者中的安全性和临床疗效的前瞻性研究
- 重复狂犬病疫苗接种揭示人类中和抗体的分子趋同
- 狂犬病病毒的感染和预防
- 关于 Zagreb 或 Essen 方案后加强疫苗接种的免疫原性和安全性的 3 期临床试验
- 通过 RABV-G 结构域筛选和异源初免-加强免疫优化狂犬病 mRNA 疫苗功效
- 狂犬病实验室诊断的最新情况
- 三色蝠相关狂犬病毒引起的一例人狂犬病的报道
- 一种核苷修饰的狂犬病mRNA疫苗在小鼠和非人灵长类动物中诱导出持久而全面的免疫反应
- 狂犬病的识别和治疗:病例报告和讨论
- 人类狂犬病的诊断困难:病例报告和文献回顾
- 狂犬病感染的边缘系统症状
- 狂犬病脑炎的生存率
- 人类狂犬病:2016年更新
- 突尼斯一名狂犬病幸存儿童:病例报告
- 肯尼亚蝙蝠携带的Duvenhage病毒导致人类狂犬病死亡:昏迷诱导、氯胺酮和抗病毒药物治疗无效
- 病例报告:狂犬病幸存者长期随访中的神经功能恢复与血清学反应
- 蝙蝠和食肉动物中狂犬病的比较病理学及其对人类溢出影响
- 病例报告:狂犬病生存者:印度病例系列
- 评估人类抗狂犬病疫苗的反应:一种快速、高通量适应性、基于假病毒的中和试验,作为快速荧光病灶抑制试验 (RFFIT) 的替代方案
- 病例报告:狂犬病幸存者长期随访中的神经功能恢复与血清学反应
- 巴西巴伊亚州狂犬病爆发的流行病学与分子分析
- 俄罗斯下诺夫哥罗德地区动物狂犬病(2012-2024年):描述性与预测性流行病学分析
- 巴西东南部一只黑鼠耳蝠(黑鼠耳蝠属物种Myotis nigricans)感染狂犬病病毒、科勒巴尔通体菌以及婴儿利什曼原虫的混合感染情况
- 2013-2023 年悉尼大都会居民狂犬病暴露后治疗:回顾性病例系列分析
- 用肌肉靶向脂质纳米颗粒配制的狂犬病病毒 G 蛋白 mRNA 在小鼠体内的免疫原性
- 关于狂犬病的 One Health Lens:马拉维利隆圭农村狂犬病病毒的人类-蝙蝠相互作用和基因组见解
- 阿根廷低地貘 (Tapirus terrestris) 麻痹狂犬病的首次报告
- 由表达狂犬病糖蛋白的非复制型病毒载体痘苗病毒天坛株改良株(MVA)和腺病毒5型(Ad5)所诱导产生的对狂犬病的保护作用
- 印度野生猫科动物中狂犬病毒的免疫病理与分子筛查:揭示从野外到城市的溢出效应
- 韩国貉 (Nyctereutes procynoide koreensis) 接种了含有 ERAGS-GFP 毒株的新型狂犬病诱饵疫苗的保护性抗体反应
- 宠物护理 疫苗
- 为您的宠物接种疫苗
- 狂犬病感染:如何保护您的孩子
- 新型狂犬病暴露后预防单克隆抗体鸡尾酒疗法的安全性和耐受性
- “愤怒的狂犬病”人类图画案例
- 蝙蝠咬伤
- 研究蝙蝠病毒如何帮助预防人畜共患疾病
- 狂犬病:症状繁多、宿主广泛的恶魔病毒——罗德尼·罗德解读
- 狂犬病的同一健康:不仅适用于动物
- 狂犬病和蛔虫:浣熊相关传染病
- 丽莎病毒 很罕见,但致命。如果蝙蝠咬你怎么办?
- 海地在四个省开展新的疫苗接种运动,加强防治犬类狂犬病
- 家养及其他动物狂犬病病毒感染的挑战:病毒学层面的困惑、惊愕、懊恼与好奇交织
- 双重战斗:狂犬病和蛇咬伤在东南亚的毒害
- 狂犬病在城市无人管理的猫群中爆发 — 马里兰州,2024 年 8 月
- 尼泊尔正力争在2030年前消灭狂犬病,但领导人表示,现在是加大疫苗投资的时候了。
- 现代狂犬病疫苗的诞生历程
- 一种基于mRNA的新型狂犬病病毒多表位疫苗:通过反向疫苗学和免疫信息学进行计算机设计
- 快速荧光灶抑制试验(RFFIT)的验证与评价 —— 作为狂犬病疫苗相对效价间接检测方法的中和抗体定量检测:NIH 试验的替代方案
- 暴露后狂犬病预防失败案例研究
- 2021年明尼苏达州一起经确认的人畜共患病暴露后,疑似因宿主介导导致暴露后预防失败的致命人类狂犬病感染病例
- 给野生动物投喂疫苗:口服狂犬病疫苗的故事
- 降低肯尼亚西部臭名昭著的狗市狂犬病风险
- 印度的狂犬病
- 海地的狂犬病
- 2024年10月至2025年2月,美国发生通过实体器官移植传播狂犬病的病例,该器官移植供体未确诊患有狂犬病
- 两例死亡与狂犬病感染的肾移植有关
- 明尼苏达州一家奶牛场的牛群中爆发狂犬病聚集性疫情——2024年
- 摩洛哥的狂犬病
- 2024年肯塔基州和俄亥俄州输入性人类狂犬病病例
- 2024年明尼苏达州和加利福尼亚州人类狂犬病死亡人数
- 反疫苗人士对宠物狂犬病 RNA 疫苗的虚假宣传
- 新型口服狂犬疫苗能否帮助我们最终终结这种疾病?
- NACI 2026 年 1 月 30 日发布的声明摘要:狂犬疫苗用于暴露前预防 (PrEP) 的最新指南
- 狂犬疫苗的给药途径:数据比较
- 猫会得狂犬病吗?
- 2022-2024年中欧狂犬病疫情再度出现
- 研讨会报告:改进狂犬病血清学方法和程序的标准化