Contents
辉瑞五价脑膜炎球菌疫苗在 ≥10 岁人群中的使用:免疫实践咨询委员会的建议——美国,2023 年
每周/ 四月 18, 2024 / 73(15);345–350
Use of the Pfizer Pentavalent Meningococcal Vaccine Among Persons Aged ≥10 Years: Recommendations of the Advisory Committee on Immunization Practices ― United States, 2023
詹妮弗·柯林斯(Jennifer P. Collins),医学博士1;塞缪尔·克劳(Samuel J. Crowe)博士1;伊斯梅尔·奥尔特加-桑切斯(Ismael R. Ortega-Sanchez)博士2;林恩·巴塔(Lynn Bahta),公共卫生硕士3;道格·坎波斯-奥特卡特,医学博士4;杰米·洛尔,医学博士5;Rebecca L. Morgan,博士6;凯瑟琳 A. 波林,医学博士7;露西·麦克纳马拉(Lucy A. McNamara)博士1(查看作者隶属关系)
总结
关于这个话题已经知道什么?
脑膜炎球菌病是由脑膜炎奈瑟菌引起的一种危及生命的侵袭性感染。五价脑膜炎球菌疫苗(MenACWY-TT/MenB-FHbp [Penbraya, Pfizer Inc.])可预防脑膜炎奈瑟菌血清型 A、B、C、W 和 Y,并获准用于 10-25 岁的人群。
这份报告增加了什么?
2023 年 10 月 25 日,免疫实践咨询委员会建议,如果同时需要接种四价脑膜炎球菌结合疫苗 (MenACWY) 和脑膜炎球菌 B 疫苗 (MenB),则 ≥10 岁的人可以接种 MenACWY-TT/MenB-FHbp。
对公共卫生实践有何影响?
MenACWY-TT/MenB-FHbp 是第一个被批准用于预防血清型 A、B、C、W 和 Y 的五价脑膜炎球菌疫苗。当施用MenACWY-TT/MenB-FHbp时,后续剂量的MenB应来自同一制造商(辉瑞公司)。
摘要
脑膜炎球菌病是由脑膜炎奈瑟菌引起的一种危及生命的侵袭性感染。两种四价(血清型 A、C、W 和 Y)脑膜炎球菌结合疫苗 (MenACWY)(MenACWY-CRM [Menveo, GSK] 和 MenACWY-TT [MenQuadfi, Sanofi Pasteur])和两种血清型 B 脑膜炎球菌疫苗 (MenB)(MenB-4C [Bexsero, GSK] 和 MenB-FHbp [Trumenba, Pfizer Inc.]),已在美国获得许可和供应,并已获得 CDC 免疫实践咨询委员会 (ACIP) 的推荐。2023 年 10 月 20 日,美国食品和药物管理局批准使用五价脑膜炎球菌疫苗 (MenACWY-TT/MenB-FHbp [Penbraya, Pfizer Inc.]) 预防 10-25 岁人群中由 A、B、C、W 和 Y 型脑膜炎奈瑟菌血清型引起的侵袭性疾病。2023 年 10 月 25 日,ACIP 建议,当 MenACWY 和 MenB 同时就诊时,可以使用 MenACWY-TT/MenB-FHbp 治疗以下人群:1) 16-23 岁的健康人(常规时间表),当共同的临床决策有利于接种 MenB 疫苗时,以及 2) ≥10 岁脑膜炎球菌病风险增加的人(例如 由于持续的补体缺乏,补体抑制剂的使用,或功能性或解剖性无脾)。不同制造商的含血清群B的疫苗不可互换;因此,当使用 MenACWY-TT/MenB-FHbp 时,后续剂量的 MenB 应来自同一制造商(辉瑞公司)。本报告总结了这些建议所考虑的证据,并为使用 MenACWY-TT/MenB-FHbp 提供了临床指导。
介绍
脑膜炎球菌病是由脑膜炎奈瑟菌引起的一种危及生命的侵袭性感染。CDC免疫实践咨询委员会(ACIP)建议,11岁或12岁的人群应常规接种单剂四价(血清型A、C、W和Y型)脑膜炎球菌结合疫苗(MenACWY),并在16岁时接种加强剂。ACIP 建议 16-23 岁人群接种 2 剂血清 B 群脑膜炎球菌疫苗 (MenB) 系列,基于共同的临床决策,以提供短期保护,预防大多数血清型 B 菌株引起的脑膜炎球菌病 (1)。ACIP还建议常规接种MenACWY(适用于≥2个月)和MenB(≥10岁)疫苗,这些人群因每种疫苗所涵盖的血清型而患脑膜炎球菌病的风险增加(1)。
2023 年 10 月,五价脑膜炎球菌疫苗 (MenACWY-TT/MenB-FHbp [Penbraya, Pfizer Inc.]) 获准用于 10-25 岁人群 (2)。MenACWY-TT/MenB-FHbp 含有与两种现有脑膜炎球菌疫苗相同的成分:1) 与破伤风类毒素载体蛋白偶联的脑膜炎奈瑟菌多糖组 A、C、W 和 Y 组(MenACWY-TT* [Nimenrix, Pfizer Inc.],一种非美国许可的疫苗),以及 2) 两种来自脑膜炎奈瑟菌的重组脂质因子 H 结合蛋白 (FHbp) 变体血清型B(MenB-FHbp [Trumenba,Pfizer Inc.])。本报告总结了这些建议所考虑的证据,并为使用 MenACWY-TT/MenB-FHbp 提供了临床指导。
方法
在 2022 年 6 月至 2023 年 10 月期间,ACIP 脑膜炎球菌疫苗工作组每月举行一次电话会议,以审查脑膜炎球菌病流行病学和证据,这些流行病学和证据涉及目前建议接受 MenACWY 和 MenB(政策问题 1)、仅接受 MenACWY(政策问题 2)或仅接受 MenB(政策问题 3)的人。为了指导审议,ACIP使用了“从证据到建议”框架,并考虑了脑膜炎球菌病作为公共卫生问题的重要性、MenACWY-TT/MenB-FHbp的益处和危害、目标人群的价值观、可接受性、资源利用、公平性和可行性。†ACIP使用建议、评估、开发和评估分级(GRADE)方法(3)评估了以下预先指定的益处和危害(每个都有重要性排序)的现有证据:由血清型A、B、C、W和Y引起的疾病(危重);短期免疫力(关键);持续免疫力(重要);严重不良事件(危重);非严重不良事件(重要);以及干扰同时接种的其他推荐疫苗(重要)。§
在 ≥10 岁人群中使用 MenACWY-TT/MenB-FHbp 的证据摘要
安全性和免疫原性
证据包括来自三项随机、四盲多中心临床试验的数据,这些试验评估了 10-25 岁健康参与者的免疫原性和安全性**。参与者被随机分配到 1) 五价组(2 剂 MenACWY-TT/MenB-FHbp,间隔 6 或 12 个月给药¶††) 或 2) 对照组 (MenACWY-CRM [Menveo, GSK, 1 剂] + MenB-FHbp [2 剂间隔 6 个月]) (4)。这些试验包括ACWY初治和ACWY引发的受试者;所有研究参与者均未接受过 MenB-naïve。GRADE评估的重点是免疫结局的6个月五价给药间隔;评估了 6 个月和 12 个月五价给药间隔的数据的安全性结局。
短期免疫力
在初治 MenACWY 和 MenACWY 启动的参与者中,五价组在首次试验剂量含 ACWY 疫苗后 1 个月对血清组 A、C、W 和 Y 的血清反应与对照组一样多或更频繁。根据综合测量,五价组在接种第二剂含血清型 B 疫苗后 1 个月对血清组 B 的血清反应比对照组更常见。所有血清组的关键结局短期免疫力的总体确定性在健康人群中为中等,而对于因基础疾病而风险增加的人则较低。§§
持续免疫力
在 ACWY 初治和 ACWY 引发的参与者中,与对照组(1 剂 MenACWY-CRM 后 54 个月)相比,五价组(接受 2 剂 MenACWY-TT/MenB-FHbp 后 48 个月)脑膜炎球菌血清型 A、C、W 和 Y 的血清保护发生频率相同或更频繁。与接受 2 剂 MenB-FHbp + 1 剂 MenACWY-CRM 后 48 个月相比,在接受 2 剂五价疫苗后 48 个月观察到的血清群 B 菌株特异性血清保护*** 的频率几乎没有差异。健康人血清型A、C、W和Y的总体确定性水平为低,健康人血清B型的总体确定性为中等,所有血清型因基础疾病而风险增加的患者的总体确定性水平较低。¶¶
不良事件
经历过严重不良事件的参与者比例†††五价组(0.6%)和对照组(0.5%;p = 0.7)相似。研究调查人员认为没有与疫苗相关的严重不良事件。五价组的非严重不良事件(24.6%)明显少于对照组(32.5%;p<0.001)。在接受任一试验剂量的MenACWY-TT/MenB-FHbp后7天内最常见的不良事件是注射部位疼痛(84.4%-89.3%;多为轻度或中度)、疲劳(47.6%-52.1%;多为轻度或中度)和头痛(39.8%-46.8%;多为轻度或中度)(5)。对于严重和非严重不良事件,健康人的确定性水平较低,而因基础疾病而风险增加的人的确定性水平非常低。§§§
与其他疫苗共同接种
没有关于MenACWY-TT/MenB-FHbp与其他疫苗联合给药的数据。对成分疫苗 Nimenrix (MenACWY-TT) 和 Trumenba (MenB-FHbp) 的包装说明书的相互作用部分进行审查,未发现与其他疫苗共同给药的任何问题 (6,7)。
资源使用
ACIP考虑了两种经济模型(CDC模型和辉瑞公司模型)的结果,这些模型评估了MenACWY-TT/MenB-FHbp在常规时间表中每个政策问题的健康益处和成本效益(8)。根据 CDC 模型,可能节省社会成本的策略将使用五价疫苗 1) 在两者都有指征时替换单剂 MenACWY 和 MenB,或 2) 在两者都有指征时替换 MenACWY 和 MenB,然后用第二剂五价疫苗完成 2 剂 MenB 系列。CDC模型还表明,当没有针对血清群B脑膜炎球菌病的免疫接种时,用五价疫苗代替两剂MenACWY的成本效益会逐渐降低。尽管输入值和假设存在差异,但辉瑞公司的模型也报告了类似的结论。
MenACWY-TT/MenB-FHbp 的使用建议
ACIP建议,当MenACWY和MenB同时就诊时,可以使用MenACWY-TT/MenB-FHbp:16-23岁的健康人(常规时间表),当共同的临床决策有利于接种MenB疫苗时,以及2)年龄≥10岁的人,他们患脑膜炎球菌病的风险增加(例如,由于持续的补体缺乏, 补体抑制剂的使用,或功能性或解剖性无脾)(表)(图)。MenACWY 和 MenB 疫苗接种的适应症自之前发表以来没有变化 (1)。
临床指导
MenB 的共享临床决策
对于健康人,使用MenACWY-TT/MenB-FHbp不应取代是否使用共同临床决策来给予MenB的讨论(表)。临床医生应参考先前发表的关于共同临床决策和 MenB 给药时机的注意事项 (1)。
疫苗产品的可互换性
MenACWY产品是可互换的;建议所有剂量都使用相同的疫苗产品,但不是必需的(1)。不同制造商的 MenB 产品不可互换;接种 B 组分疫苗(单价或五价)要求所有后续 B 组分疫苗剂量(包括加强剂量)均来自同一制造商。如果接种了一剂 MenB 疫苗,但疫苗制造商未知,则必须使用任何许可产品重新开始该系列,以确保使用单一制造商的产品完成 MenB 系列。
如果在仅指征一种(即 MenACWY 或 MenB)时无意中服用 MenACWY-TT/MenB-FHbp 代替 MenACWY 或 MenB,则如果该剂量本来是 MenACWY 或 MenB 的有效剂量(即,根据适应症、患者年龄和给药间隔),则可以认为该剂量有效。
给药间隔
MenACWY-TT/MenB-FHbp 的许可给药间隔为 6 个月。没有关于给药间隔超过 12 个月的 MenACWY-TT/MenB-FHbp 的安全性或免疫原性的数据。16-23岁的健康青少年和年轻人在共同临床决策的基础上接受1剂MenACWY-TT/MenB-FHbp,应在接种五价疫苗后6个月完成MenB系列接种一剂MenB-FHbp(表)。
接受一剂 MenACWY-TT/MenB-FHbp 并建议在接种五价脑膜炎球菌疫苗后 6 个月<额外剂量的脑膜炎球菌病风险增加的人应分别接种 MenACWY 和 MenB-FHbp 疫苗,而不是 MenACWY-TT/MenB-FHbp(图)。如果在同一次就诊时同时需要 MenACWY 和 MenB 的加强剂量,则 MenACWY-TT/MenB-FHbp 可用于风险增加的患者的加强剂量。如果时间对 MenACWY 或 MenB 有效,则偏离许可的 6 个月间隔的 MenACWY-TT/MenB-FHbp 剂量可被视为对 MenACWY 或 MenB 有效。
禁忌症和注意事项
严重过敏。MenACWY-TT/MenB-FHbp 禁用于对疫苗的任何成分或含破伤风类毒素的疫苗有严重过敏反应史(如过敏反应)的人。
怀孕和哺乳。没有关于在怀孕期间或哺乳期间使用MenACWY-TT/MenB-FHbp的数据。由于妊娠期接种 MenB 疫苗的数据有限,因此应推迟接种 MenB 疫苗,除非孕妇罹患脑膜炎球菌病的风险增加,并且在与医务人员协商后,认为接种疫苗的益处大于潜在风险。当需要MenACWY时,孕妇或哺乳期妇女应接受MenACWY-CRM或MenACWY-TT(MenQuadfi,赛诺菲巴斯德)。
疫苗不良事件报告
患者接种脑膜炎球菌疫苗后发生的不良事件应报告给疫苗不良事件报告系统 (VAERS),即使不确定疫苗是否导致了该事件。有关向VAERS报告的说明,请访问以下网址:https://vaers.hhs.gov/reportevent.html或致电 (800-822-7967)。
致谢
艾莉森·阿尔伯特、伊莎·贝瑞、加布里埃尔·库珀、莉安妮·福克斯、苏珊·哈里里、安吉拉·吉尔斯、谢尔比·米勒、诺埃尔·纳尔逊、艾米·鲁比斯、耶利米·威廉姆斯,疾病预防控制中心国家免疫和呼吸系统疾病中心细菌疾病科;乔纳森·达菲(Jonathan Duffy),坦尼娅·迈尔斯(Tanya Myers),美国疾病预防控制中心(CDC)国家新兴和人畜共患传染病中心医疗保健质量促进司;Andrew Leidner、Elisabeth Velazquez、JoEllen Wolicki,CDC国家免疫和呼吸系统疾病中心免疫服务部;杰西卡·麦克尼尔(Jessica MacNeil),梅琳达·沃顿(Melinda Wharton),美国疾病预防控制中心(CDC)国家免疫和呼吸系统疾病中心主任办公室主任。免疫实践咨询委员会现任和前任成员的名册可在https://www.cdc.gov/vaccines/acip/members/index.html 上查阅。
通讯作者: Jennifer P. Collins,JCollins3@cdc.gov.
1美国疾病预防控制中心国家免疫与呼吸系统疾病中心细菌性疾病科;2美国疾病预防控制中心国家免疫和呼吸系统疾病中心冠状病毒和其他呼吸道病毒司;3明尼苏达州卫生部;4亚利桑那大学医学与公共卫生学院,亚利桑那州凤凰城;5纽约州伊萨卡市卡尤加家庭医学;6加拿大安大略省汉密尔顿麦克马斯特大学卫生研究方法、证据和影响系;7维克森林大学医学院,北卡罗来纳州温斯顿-塞勒姆。
所有作者均已填写并提交了国际医学期刊编辑委员会表格,以披露潜在的利益冲突。杰米·洛尔(Jamie Loehr)报告说,在全国家庭医学会议和弗吉尼亚州疫苗小组会议上,就ACIP的一般建议进行了演讲,并收到了付款。Katherine A. Poehling报告说,她收到了北卡罗来纳州浸信会基金会、Optum社会责任、Atrium Health、维克森林浸信会临床和转化科学研究所以及Kate B. Reynolds基金会的赠款支持。没有披露其他潜在的利益冲突。
* Nimenrix 和 MenQuadfi(均缩写为 MenACWY-TT)是含有不同数量的破伤风类毒素结合物的不同疫苗。
†https://www.cdc.gov/vaccines/acip/recs/grade/mening-MenACWY-TT-MenB-FHbp-etr.html
§https://www.cdc.gov/vaccines/acip/recs/grade/mening-MenACWY-TT-MenB-FHbp.html
¶临床试验在捷克、丹麦、芬兰、匈牙利、波兰和美国进行。
** 没有数据可用于评估由血清型 A、B、C、W 和 Y 引起的疾病结局,或同时接种的疫苗受到干扰。
††两项试验评估了间隔6个月的2剂MenACWY-TT/MenB-FHbp。一项试验评估了间隔12或36个月接种的2剂MenACWY-TT/MenB-FHbp;在 2023 年 10 月 ACIP 投票之前的 36 个月间隔内,没有结果。
§§血清反应基于使用人补体 (hSBA) 的血清杀菌抗体测定。对于基线 hSBA 滴度为 <1:4 的参与者,血清反应定义为滴度 ≥1:16。对于基线 hSBA 滴度为 ≥1:4 和 <1:8(FHbp A22 型为 <1:16)的患者,血清反应定义为滴度≥1:32(A22 为 ≥1:64)。对于基线 hSBA 滴度为 ≥1:8(A22 为 ≥1:16)的患者,血清反应定义为滴度≥基线滴度的 4 倍。
¶¶血清保护基于使用 hSBA 的血清杀菌抗体测定,定义为血清型 A、C、W 和 Y 的 hSBA 滴度达到 ≥1:8。
血清保护基于使用 hSBA 的血清杀菌抗体测定,定义为血清 B 组的 hSBA 滴度≥1:8(菌株 A22 的滴度为 ≥1:16)。
†††https://www.fda.gov/safety/reporting-serious-problems-fda/what-serious-adverse-event
§§§对于GRADE,非严重不良事件包括疫苗接种阶段除严重不良事件外的所有不良事件。根据辉瑞公司的定义,所有不良事件包括严重不良事件、非严重不良事件、就医事件(导致在医疗机构进行评估的非严重不良事件)和新诊断的慢性疾病(一种疾病或医疗状况,以前未被发现,预计会持续存在或影响是持久的)。疫苗接种阶段定义为从接受第一次研究疫苗接种到第二次研究疫苗接种后 1 个月的时间。
引用
1.Mbaeyi SA、Bozio CH、Duffy J 等人。脑膜炎球菌疫苗接种:免疫实践咨询委员会的建议,美国,2020 年。MMWR Recomm 代表 2020;69(编号。RR-9):1-41。https://doi.org/10.15585/mmwr.rr6909a1PMID:33417592
2.美国食品和药物管理局。BLA 批准 [信函]。马里兰州银泉市:美国卫生与公众服务部,食品和药物管理局;2023.https://www.fda.gov/media/173225/download?attachment
3.Ahmed F. 美国免疫实践咨询委员会 (ACIP) 制定循证建议手册,第 1.2 版。佐治亚州亚特兰大:美国卫生与公众服务部,疾病预防控制中心;2013.https://www.cdc.gov/vaccines/acip/recs/grade/downloads/handbook.pdf
4.马奎尔JD。MenABCWY 脑膜炎球菌疫苗 [演示幻灯片]。在佐治亚州亚特兰大举行的免疫实践咨询委员会会议上发表;2月 23, 2023.佐治亚州亚特兰大:美国卫生与公众服务部,疾病预防控制中心;2023.https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2023-02/slides-02-23/mening-03-maguire-508.pdf
5.美国食品和药物管理局。包装说明书:Penbraya。马里兰州银泉市:美国卫生与公众服务部,食品和药物管理局;2023.https://www.fda.gov/media/173223/download?attachment
6.辉瑞公司包装说明书:Nimenrix。纽约州纽约市:辉瑞公司;2022.https://labeling.pfizer.com/ShowLabeling.aspx?id=15187
7.美国食品和药物管理局。包装说明书:Trumenba。银泉,医学博士。美国卫生与公众服务部,食品和药物管理局;2014.https://www.fda.gov/media/89936/download
8.奥尔特加-桑切斯 IR。潜在的五价脑膜炎球菌结合疫苗 (MenABCWY) 与美国青少年当前 MenACWY 和 MenB 疫苗的经济学:比较辉瑞和 CDC 模型的总结报告 [演示幻灯片]。在佐治亚州亚特兰大举行的免疫实践咨询委员会会议上发表;10月 25, 2023.佐治亚州亚特兰大:美国卫生与公众服务部,疾病预防控制中心;2023.https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2023-10-25-26/03-Meningococcal-Ortega-Sanchez-508.pdf
盒子.现有的脑膜炎球菌疫苗接种建议* — 免疫实践咨询委员会,美国,2024年
ACIP建议以下人群接种MenACWY疫苗:
11 岁或 12 岁人群常规接种疫苗,16 岁时接种加强剂
对 ≥2 个月大且脑膜炎球菌病风险增加的人进行常规和加强疫苗接种(给药方案因年龄和适应症而异,加强剂量的间隔因先前疫苗接种时的年龄而异):
o患有某些疾病的人,包括解剖学或功能性无脾、补体成分缺乏症(例如 C3、C5-C9、丙培丁、H 因子或 D 因子)、补体抑制剂(例如依库珠单抗 [Soliris] 或 ravulizumab [Ultomiris])使用或 HIV 感染
o常规接触脑膜炎奈瑟菌分离株的微生物学家
o疫情期间风险增加的人群(例如,在社区或组织环境中,以及男男性行为者中)
o前往或居住在脑膜炎球菌病高度流行或流行的国家的人
o住在宿舍的未接种疫苗或疫苗接种不足的大学一年级学生
o新兵
ACIP建议以下人群接种MenB疫苗:
对≥10岁、脑膜炎球菌病风险增加的人进行常规和加强疫苗接种(给药方案因疫苗品牌而异;加强针应在初次系列接种完成后1年接种,此后每2-3年接种一次,对于风险增加的人):
o患有某些疾病的人,例如解剖学或功能性无脾、补体成分缺乏症或使用补体抑制剂
o常规接触脑膜炎奈瑟菌分离株的微生物学家
o疫情期间风险增加的人群(例如,在社区或组织环境中,以及男男性行为者中)
在共同临床决策的基础上,为 16-23 岁的青少年和年轻人接种 2 剂 MenB 系列疫苗。接种 MenB 疫苗的首选年龄是 16-18 岁
缩写:ACIP = 免疫实践咨询委员会;MenACWY = 四价(血清型 A、C、W 和 Y)脑膜炎球菌疫苗;MenB = 血清群 B 脑膜炎球菌疫苗。
*https://pubmed.ncbi.nlm.nih.gov/33417592/
表.脑膜炎球菌疫苗剂量的推荐时间*,†在常规时间表内,基于关于脑膜炎球菌 B 疫苗的共同临床决策结果——美国,2023 年§
| 接种者年龄组,岁 | 基于 MenB 临床决策的推荐 | ||
|---|---|---|---|
| MenB 不被看好 | MenB 在 16 岁时受到推荐 | MenB 在 >16 岁时受到青睐 | |
| 11–12 | MenACWY 剂量 #1 | MenACWY 剂量 #1 | MenACWY 剂量 #1 |
| 16 | MenACWY 剂量 #2 | MenACWY 剂量 #2 + MenB-4Cor MenACWY 剂量 #2 + MenB-FHbp**或 MenACWY-TT/MenB-FHbp,然后是 MenB-FHbp 6 个月后¶ | MenACWY 剂量 #2 |
| 17–23 | NA | NA | MenB -4Cor MenB -FHbp**¶ |
缩写:MenACWY = 四价(血清型 A、C、W 和 Y)脑膜炎球菌结合疫苗;MenACWY-TT/MenB-FHbp = Penbraya (Pfizer Inc.) 五价(血清型 A、B、C、W 和 Y)脑膜炎球菌疫苗;MenB-FHbp = Trumenba (Pfizer Inc.) 血清群 B 脑膜炎球菌疫苗;MenB-4C = Bexsero (GSK) 血清群 B 脑膜炎球菌疫苗;NA = 不适用。
* 假设一个人以前没有接种过 MenACWY 或 MenB 疫苗。
†MenACWY疫苗是可以互换的;建议所有剂量都使用相同的疫苗产品,但不是必需的。不同制造商的 MenB 疫苗不可互换。https://pubmed.ncbi.nlm.nih.gov/33417592/
§为了确定 MenACWY 和 MenB 的补种疫苗接种建议,临床医生应查看先前发表的建议。https://pubmed.ncbi.nlm.nih.gov/33417592/
¶两剂系列,剂量间隔 ≥1 个月。
** 两剂系列,剂量间隔 6 个月。
图.推荐的脑膜炎球菌疫苗适用于血清型 A、B、C、W 或 Y 型脑膜炎球菌病风险增加且需接种 A、C、W 和 Y 型脑膜炎球菌疫苗*和B型脑膜炎球菌疫苗的人†,§,¶,** — 美国, 2023
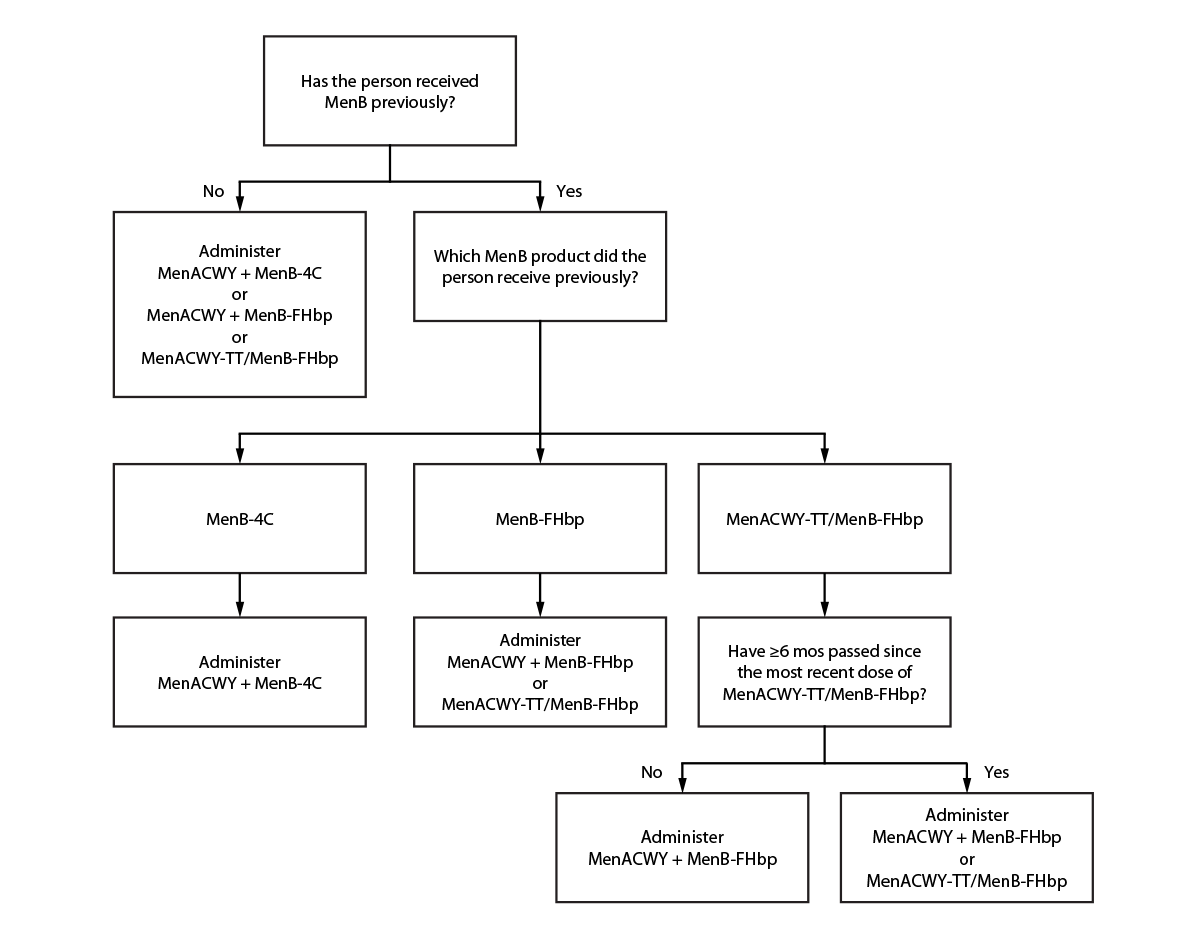
缩写:MenACWY = 四价(血清型 A、C、W 和 Y)脑膜炎球菌结合疫苗;MenACWY-TT/MenB-FHbp = Penbraya (Pfizer Inc.) 五价(血清型 A、B、C、W 和 Y)脑膜炎球菌疫苗;MenB-FHbp = Trumenba (Pfizer Inc.) 血清群 B 脑膜炎球菌疫苗;MenB-4C = Bexsero (GSK) 血清群 B 脑膜炎球菌疫苗。
* MenACWY产品是可互换的;建议所有剂量都使用相同的疫苗产品,但不是必需的。
†不同制造商的 MenB 疫苗不可互换。
§为了确定是否根据一个人的危险因素和任何既往脑膜炎球菌疫苗的接种时间来判断 MenACWY 和 MenB,临床医生应查看先前发表的建议。https://pubmed.ncbi.nlm.nih.gov/33417592/
¶如果之前收到过 MenB,但疫苗制造商未知,则必须使用任何许可产品重新开始该系列,以确保使用来自单一制造商的产品完成该系列。如需更多指导,临床医生应查看之前发表的建议。https://pubmed.ncbi.nlm.nih.gov/33417592/
** 如果之前接受过 MenB-FHbp,则可以使用 MenACWY-TT/MenB-FHbp,前提是该人之前没有接受过 MenACWY-TT/MenB-FHbp 或自上次服用 MenACWY-TT/MenB-FHbp 以来已经过去了 ≥6 个月。
建议引用本文:柯林斯 JP、克劳 SJ、奥尔特加-桑切斯 IR 等。辉瑞五价脑膜炎球菌疫苗在 ≥10 岁人群中的使用:免疫实践咨询委员会的建议——美国,2023 年。MMWR Morb Mortal Wkly 代表 2024;73:345–350.DOI:http://dx.doi.org/10.15585/mmwr.mm7315a4.
上次审核日期:2024 年 4 月 18 日
资料来源:美国疾病控制与预防中心
Hits: 110
- 年龄≥60岁的成人使用呼吸道合胞病毒疫苗:美国免疫实践咨询委员会的最新建议,2024年
- JYNNEOS(活的、非复制的天花和猴痘疫苗)用于正痘病毒职业暴露危险人群的暴露前疫苗接种:美国免疫实践咨询委员会的建议,2022
- 黄热病疫苗:免疫实践咨询委员会(ACIP)的建议
- 美国成人中15价肺炎球菌结合疫苗和20价肺炎球菌结合疫苗的使用:美国免疫实践咨询委员会的最新建议,2022年
- ACIP建议:新冠肺炎疫苗
- 用疫苗预防和控制季节性流感:美国免疫实践咨询委员会的建议,2024-25流感季节
- ACIP建议:水痘疫苗
- 19岁以上免疫功能低下成年人使用重组带状疱疹疫苗的ACIP证据推荐框架
- ACIP建议:麻疹、腮腺炎和风疹疫苗
- ACIP建议:麻疹、腮腺炎、风疹和水痘疫苗
- ≥6月龄的人使用新冠肺炎疫苗:美国免疫实践咨询委员会的建议,2024–2025
- ACIP建议:白喉、破伤风和百日咳(DTaP/Tdap/Td)疫苗
- 19-59岁成年人普遍接种乙肝疫苗的最新建议——美国,2024年
- 对年龄≥65岁的成人和年龄≥6个月的中度或重度免疫缺陷者使用额外剂量的2024-2025新冠肺炎疫苗:美国免疫实践咨询委员会的建议,2024
- Bexsero MenB-4C疫苗的新接种间隔和时间表:美国免疫实践咨询委员会的最新建议,2024年10月
- 更新:免疫实践咨询委员会关于甲型肝炎疫苗用于国际旅行暴露后预防和暴露前预防的建议
- ACIP建议:甲肝疫苗
- ACIP:50岁以上成人使用肺炎球菌结合疫苗的扩展建议
- ACIP建议:人类乳头瘤病毒(HPV)疫苗
- 免疫接种实践咨询委员会推荐 18 岁或以下儿童和青少年的免疫接种计划 — 美国,2025 年
- 免疫接种实践咨询委员会建议 19 岁或以上成人的免疫接种计划 — 美国,2025 年
- ACIP关于常规脊髓灰质炎病毒免疫接种的最新建议
- 使用 23 价肺炎球菌多糖疫苗 (PPSV23) 预防成人侵袭性肺炎球菌疾病的最新建议
- 21价肺炎球菌结合疫苗在美国成人中的使用:美国免疫实践咨询委员会的建议,2024年
- ACIP 对 ≥65 岁成年人使用额外更新的 2023-2024 年 COVID-19 疫苗剂量 2024年
- ACIP 辉瑞五价脑膜炎球菌疫苗在 ≥10 岁人群中的使用,美国,2023 年
- ACIP美国成人使用灭活脊髓灰质炎疫苗的最新建议,2023年
- 蜱传脑炎疫苗(森林脑炎灭活疫苗):美国免疫实践咨询委员会的建议,2023年
- 妊娠期使用辉瑞呼吸道合胞病毒疫苗预防婴儿呼吸道合胞病毒相关下呼吸道疾病:美国免疫实践咨询委员会的建议,2023
- ACIP 演示幻灯片:2025 年 4 月 15 日至 16 日会议
- 在猴痘爆发期间,≥18 岁有猴痘风险的人使用 JYNNEOS(天花和猴痘疫苗,活疫苗,非复制性):免疫实践咨询委员会的建议 — 美国,2023 年
- ACIP建议:肺炎球菌疫苗
- 用于流感治疗和化学预防的抗病毒药物:免疫实践咨询委员会(ACIP)的建议
- ACIP建议:轮状病毒疫苗
- ACIP 建议:炭疽疫苗
- ACIP 疫苗建议和指南
- 美国免疫实践咨询委员会关于 10 岁及以上人群使用葛兰素史克 MenACWY-CRM/MenB-4C 五价脑膜炎球菌疫苗的建议——2025 年
- ACIP 建议:带状疱疹疫苗
- ACIP关于水痘预防的建议
