Contents
- 1 完整的处方信息
- 1.1 1适应症和用法
- 1.2 2剂量和用法
- 1.3 3剂型和强度
- 1.4 4禁忌症
- 1.5 5警告和注意事项
- 1.6 6不良反应
- 1.7 7药物相互作用
- 1.8 8在特定人群中使用
- 1.9 11描述
- 1.10 12临床药理学
- 1.11 13非临床毒理学
- 1.12 14项临床研究
- 1.12.1 14.1白喉
- 1.12.2 14.2破伤风
- 1.12.3 表3:研究P3T06在2、4、6和15-16月龄大的美国儿童中接种第3剂和第4剂潘太欣或DAPTACEL+ IPOL + ActHIB疫苗后一月龄的白喉抗毒素和破伤风抗毒素反应
- 1.12.4 14.3百日咳
- 1.12.5 表4:在瑞典I功效试验中,在2、4和6月龄大的婴儿亚组中接种第3剂DAPTACEL1个月后的FHA、PRN和FIM抗体反应,以及在美国研究494-01中,在2、4、6和15-16月龄大的婴儿亚组中接种第3剂和第4剂潘太欣1个月后的抗体反应
- 1.12.6 14.4脊髓灰质炎
- 1.12.7 14.5以下原因导致的侵入性疾病b型流感嗜血杆菌
- 1.12.8 14.6同时接种疫苗
- 1.13 15参考文献
- 1.14 16如何供应/储存和搬运
- 1.15 17患者咨询信息
潘太欣说明书(FDA)
处方信息的重点
这些亮点并不包括安全有效使用Pentacel所需的所有信息。请参阅Pentacel的完整处方信息。
潘太欣(白喉和破伤风类毒素和无细胞百日咳吸附、灭活脊髓灰质炎病毒和b型流感嗜血杆菌结合物 破伤风类毒素结合物疫苗 肌肉注射用混悬液
美国首次批准日期:2008年
————最近的主要变化————
剂量和接种(2.1)
xx/202x xx/202x
警告和注意事项(5.8)
————适应症和用法————
•Pentacel是一种疫苗,用于主动免疫预防白喉、破伤风、百日咳、脊髓灰质炎和以下侵袭性疾病b型流感嗜血杆菌。潘太欣已被批准用于6周至4岁儿童(5岁生日前)的四个剂量系列。(1)
————剂量和用法————
•4剂免疫系列包括在2月龄、4月龄、6月龄和15- 18月龄大时进行0.5毫升肌肉注射(复溶后)。(2.1)
•Pentacel由液体疫苗成分(DTaP-IPV成分)和冻干疫苗成分(ActHIB疫苗)组成。在接种前立即用DTaP-IPV组分复溶ActHIB疫苗组分。(2.2)
————剂型和强度————
•注射用混悬剂(0.5 mL剂量)作为液体疫苗成分提供,通过与冻干疫苗成分复溶而结合在一起,均装在单剂量小瓶中。(3)
————禁忌症————
•在前1剂潘太欣、潘太欣的任何成分或任何其他白喉类毒素、破伤风类毒素、百日咳疫苗、灭活脊髓灰质炎疫苗后出现严重过敏反应(如过敏反应),或b型流感嗜血杆菌结合疫苗。(4.1)
•在接种含百日咳疫苗后7天内出现脑病,且无其他可识别的原因。(4.2)
•进行性神经障碍,直至治疗方案确立且病情稳定。(4.3)
| ————警告和注意事项———— •对有以下病史的人使用Pentacel前,请仔细考虑其益处和风险: –接种含百日咳疫苗后48小时内出现发烧≥40.5℃(≥105℉)、低渗低反应性发作(HHE)或持续3小时以上的持续、伤心过度的哭闹。(5.2) –接种含百日咳疫苗后3天内癫痫发作。(5.2) •如果吉兰-巴雷综合征发生在之前接种破伤风类毒素疫苗后的6周内,使用Pentacel后吉兰-巴雷综合征的风险可能会增加。(5.3) •对于既往有癫痫发作史的婴儿和儿童,可在接种潘太欣疫苗时和接下来的24小时内接种退烧药(按照处方信息中推荐的剂量)。(5.4) •在一些早产婴儿中观察到肌肉注射疫苗后出现呼吸暂停。关于何时对早产婴儿进行肌肉注射疫苗(包括Pentacel)的决定应基于对婴儿个人医疗状况以及疫苗接种的潜在益处和可能风险的考虑。(5.7) ————不良反应————— •不良反应的发生率因剂量而异。超过50%的参与者在接种任何剂量后出现全身反应,包括烦躁/易怒和伤心过度的哭泣。6- 16%的参与者出现发热≥38.0℃,具体取决于剂量编号。超过30%的参与者在注射任何剂量后出现注射部位反应,包括触痛和臂围增加。(6.1) 要报告可疑的不良反应,请联系 赛诺菲巴斯德公司药物警戒部 宾夕法尼亚州斯威夫特沃特市开车,邮编18370,电话号码为1-800-822-2463(1-800-疫苗)或VAERS,电话号码为1-800-822-7967和http://vaers.hhs.gov。 ————药物相互作用————- •请勿将Pentacel或其任何成分与任何其他疫苗或稀释剂混合。(7.1) •免疫抑制疗法可能会降低对潘太欣的免疫反应。(7.2) •尿尿液抗原检测在后一周内对疑似b型流感嗜血杆菌疾病可能没有明确的诊断价值。(7.3) |
| 有关患者咨询信息,请参见第17节。 修订:xx/202x |
完整的处方信息
1适应症和用法
Pentacel是一种疫苗,用于预防白喉、破伤风、百日咳、脊髓灰质炎和侵袭性疾病b型流感嗜血杆菌。潘太欣已被批准用于6周到4岁的儿童(五岁生日前)的四个剂量系列。
2剂量和用法
仅用于肌肉注射
2.1免疫系列
在婴儿2、4、6和15-18月龄大时,以4个剂量系列的方式接种潘太欣。第1剂可在6周龄时接种。4剂潘太欣构成了针对百日咳的初级免疫过程。3剂潘太欣构成了针对白喉、破伤风,b型流感嗜血杆菌侵袭性疾病和脊髓灰质炎;第4剂是白喉、破伤风、b型流感嗜血杆菌侵袭性疾病和脊髓灰质炎免疫接种。[参见14项临床研究(14.1、14.2、14.3、14.4、14.5)。]
潘太欣和其他含DTaP疫苗的混合系列
Pentacel、DAPTACEL(吸附白喉和破伤风类毒素和无细胞百日咳疫苗)、Quadracel(吸附白喉和破伤风类毒素和无细胞百日咳和灭活脊髓灰质炎疫苗)和VAXELIS(吸附白喉和破伤风类毒素和无细胞百日咳、灭活脊髓灰质炎病毒、b型流感嗜血杆菌结合物和乙型肝炎疫苗)含有由相同工艺生产的相同百日咳抗原。每种百日咳抗原的量在潘太欣、Quadracel和VAXELIS中是相同的。Pentacel含有两倍于DAPTACEL的解毒百日咳毒素(PT)和四倍于DAPTACEL的丝状血凝素(FHA)。
在接种 了3剂系列VAXELIS的儿童中,潘太欣酚可用作五剂DTaP系列的第4剂【参见临床研究(14)】。
对于已接种 1剂或多剂DAPTACEL治疗并计划接种 其他五氯酚抗原治疗的婴儿和儿童,五氯酚可用于完成5剂DTaP系列的前4剂治疗。
已完成4剂潘太欣系列疫苗接种的儿童应在4-6岁时使用DAPTACEL或Quadracel接种第五剂DTaP疫苗。(1) (2)
没有关于使用不同制造商生产的潘太欣和DTaP疫苗混合系列的安全性和有效性的数据。
潘太欣和IPV疫苗的混合系列
Pentacel可用于已接种1剂或多剂另一种已获许可的IPV疫苗并计划接种Pentacel抗原的婴儿和儿童。然而,目前尚无关于潘太欣在此类婴儿和儿童中的安全性和免疫原性的数据。
免疫实践咨询委员会(ACIP)建议4剂IPV系列疫苗的最后1剂应在≥4岁时接种。(3)当在2、4、6和15-18月龄大时施用并潘太欣时,应在4-6岁时再施用一次加强剂量的IPV疫苗,形成5剂IPV系列疫苗。(3)
Pentacel和b型流感嗜血杆菌结合疫苗的混合系列
Pentacel可用于完成之前接种了1剂或多剂b型流感嗜血杆菌结合疫苗(单独接种或作为另一种组合疫苗的一部分)的婴儿和儿童的疫苗接种系列,这些婴儿和儿童还计划接种 Pentacel的其他抗原。然而,目前尚无关于潘太欣在此类婴儿和儿童中的安全性和免疫原性的数据。如果使用不同品牌的b型流感嗜血杆菌结合疫苗来完成系列接种,则需要三次初级免疫接种,然后是加强接种。
2.2接种
该包装包含一瓶DTaP-IPV成分和一瓶冻干的ActHIB疫苗成分。
使用前,彻底但轻轻摇动DTaP-IPV成分的小瓶,取出全部液体内容物并注入冻干ActHIB疫苗成分的小瓶中。轻轻旋转现在含有并潘太欣的小瓶,直到产生混浊、均匀、白色至米白色(黄色)的悬浮液。
只要溶液和容器允许,注射用药品在接种前应目视检查是否有颗粒物质和变色。如果存在这些情况,则不应使用潘太欣。
抽出并肌肉注射单次0.5 mL剂量的潘太欣。并潘太欣应在复溶后立即使用。丢弃未使用的部分。参见图1、2、3、4和5。
Pentacel:用DTaP-IPV成分重组ActHIB疫苗成分的说明
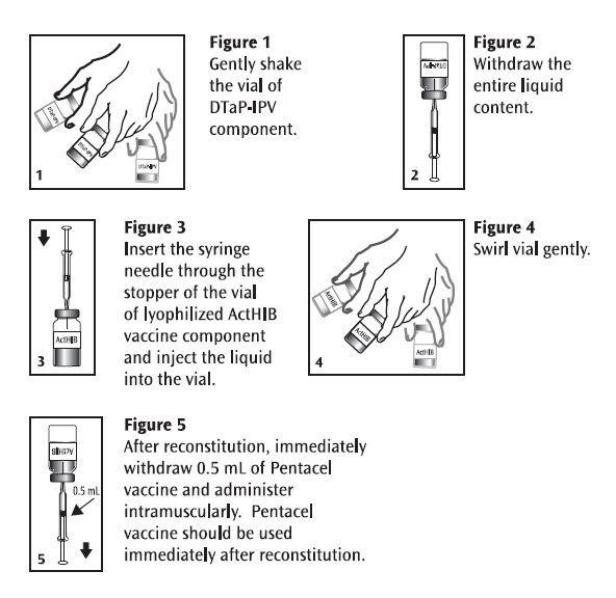
对于小于1岁的婴儿,大腿的前外侧提供最大的肌肉,是首选的注射部位。在较大的儿童中,三角肌通常足够大,可以进行注射。疫苗不应注射到臀部或可能有主要神经干的区域。
不要静脉或皮下注射本品。
潘太欣不应与其他注射用产品在同一注射器中混合。
3剂型和强度
Pentacel是一种注射用混悬剂(0.5 mL剂量),以液体疫苗成分的形式提供,通过与冻干疫苗成分复溶而结合在一起,两者均装在单剂量小瓶中。【参见剂量和接种(2.2)和如何供应/储存和搬运(16).]
4禁忌症
4.1过敏
前1剂潘太欣或任何其他白喉类毒素、破伤风类毒素或百日咳疫苗、灭活脊髓灰质炎疫苗后出现严重过敏反应(如过敏反应),或b型流感嗜血杆菌结合疫苗或该疫苗的任何成分是施用潘太欣的禁忌症。【参见描述(11)。]
4.2脑病
前1剂含百日咳疫苗接种后7天内出现脑病(如昏迷、意识水平下降、癫痫持续发作),且该脑病不是由其他可识别的原因引起的,是使用任何含百日咳疫苗(包括潘太欣)的禁忌症。
4.3进行性神经疾病
进行性神经系统疾病(包括婴儿痉挛、未控制的癫痫或进行性脑病)是任何含百日咳疫苗(包括Pentacel)的禁忌症。在确定治疗方案和病情稳定之前,不应给患有此类疾病的患者接种百日咳疫苗。
5警告和注意事项
5.1急性过敏反应的管理
必须准备好盐酸肾上腺素溶液(1:1,000)和其他合适的药剂和设备,以便在发生过敏或急性超敏反应时立即使用。
5.2既往百日咳疫苗接种后的不良反应
如果在接种百日咳疫苗后的规定时间内出现以下任何事件,则应在仔细考虑潜在益处和可能风险的基础上决定是否使用Pentacel。
•体温≥40.5℃(≥105℉),不属于另一个可识别的原因。
•48小时内,出现虚脱或休克样状态(低渗低反应性发作(HHE))。
•48小时内,持续、伤心欲绝的哭泣≥3小时。
•3天内癫痫发作,伴有或不伴有发热。
5.3格林-巴利综合征和臂神经炎
医学研究所(IOM)的一项审查发现了破伤风类毒素与臂神经炎和格林-巴利综合征之间因果关系的证据。(4)如果吉兰-巴雷综合征发生在接种 含破伤风类毒素的疫苗后6周内,则使用Pentacel后吉兰-巴雷综合征的风险可能会增加。
5.4既往有癫痫发作史的婴儿和儿童
对于既往有癫痫发作史的婴儿或儿童,可在接种含无细胞百日咳抗原(包括并潘太欣)的疫苗时和接下来的24小时内接种适当的退烧药(按照其处方信息中推荐的剂量),以降低接种后发烧的可能性。
5.5疫苗有效性的局限性
接种潘太欣疫苗可能无法保护所有人。
5.6免疫活性改变
如果对免疫功能低下的人(包括接种 免疫抑制治疗的人)施用潘太欣,可能无法获得预期的免疫反应。【参见药物相互作用(7.2)。]
5.7早产儿呼吸暂停
在一些早产婴儿中观察到肌肉注射疫苗后出现呼吸暂停。关于何时对早产婴儿进行肌肉注射疫苗(包括Pentacel)的决定应基于对婴儿个人医疗状况以及疫苗接种的潜在益处和可能风险的考虑。
5.8晕厥
晕厥(昏厥)可能与注射疫苗(包括Pentacel)有关。程序应到位,以避免因昏厥而受伤。
6不良反应
不良反应率因剂量数而异。任何剂量接种后最常见的(>50%的参与者)全身反应是烦躁/易怒和伤心过度的哭泣。任何剂量后最常见的(超过30%的参与者)注射部位反应是注射手臂的压痛和周长增加。
6.1临床研究数据
由于临床试验是在差异很大的条件下进行的,因此在一种疫苗的临床试验中观察到的不良反应率不能直接与另一种疫苗的临床试验中的不良反应率进行比较,并且可能无法反映实际观察到的不良反应率。然而,来自临床试验的不良反应信息确实为识别似乎与疫苗使用有关的不良事件和估计这些事件的发生率提供了基础。
潘太欣的安全性在四项临床研究中进行了评估,共有5,980名参与者接种 了至少1剂潘太欣。在美国进行的其中三项研究中,共有4198名参与者连续接种 了4剂潘太欣。在加拿大进行的第四项研究中,1782名先前接种了3剂潘太欣疫苗的参与者接种了第4剂。表1提供了这些研究中使用的潘太欣、对照疫苗和同时施用的疫苗的接种时间表。
在这四项研究中,50.8%的参与者是女性。在这三项美国研究的参与者中,64.5%是高加索人,9.2%是黑人,12.9%是西班牙人,3.9%是亚洲人,9.5%是其他种族/族裔群体。在这两项对照研究中,接种Pentacel疫苗和对照疫苗的参与者的种族/民族分布相似。在加拿大第四次剂量研究中,86.0%的参与者为高加索人,1.9%为黑人,0.8%为西班牙裔,4.3%为亚洲人,2.0%为东印度人,0.5%为印第安原住民,4.5%为其他种族/民族。
表1:潘太欣的临床安全性研究:疫苗接种时间表
| 研究 | 潘太欣 | 对照疫苗 | 同时接种的疫苗 |
| 494-01 | 2、4、6和15月龄 | 2、4、6和15月龄接种HCPDT +脊灰疫苗+ ActHIB | 2、4和6月龄接种7价肺炎球菌结合疫苗*(PCV7)† 2和6月龄时接种乙肝疫苗‡ |
| P3T06 | 2、4、6和15- 16月龄 | 在2、4和6月龄接种DAPTACEL+IPOL+ActHIB;和15- 16月龄接种DAPTACEL + ActHIB | 2、4和6月龄接种PCV7* 2和6月龄时接种乙肝疫苗‡ |
| 494-03 | 2、4、6和15- 16月龄 | / | 2、4和6月龄接种PCV7*;在15月龄的时候,在随机分组的参与者中 2和6月龄时接种乙肝疫苗(如果之前接种过疫苗)或2、4和6月龄时接种乙肝疫苗(如果之前没有接种过疫苗) 随机分组的参与者在12或15月龄时接种麻疹、腮腺炎、风疹疫苗(MMR)和水痘疫苗 |
| 5A9908 | 15- 18月龄¶ | / | / |
HCPDT:非美国许可的DTaP疫苗,与Pentacel的DTaP成分相同。
脊髓灰质炎疫苗:美国许可的脊髓灰质炎灭活疫苗,赛诺菲巴斯德有限公司。IPOL:美国许可的脊髓灰质炎灭活疫苗,赛诺菲巴斯德公司。
* Wyeth实验室生产的PCV7。
† PCV7是在研究开始后引入的,因此在一部分参与者中与Pentacel疫苗同时施用。
‡第1剂乙肝疫苗(制造商未指定)是在研究开始前接种的,从出生到21日龄。随后的剂量是由默克公司生产的乙肝疫苗。。
§MMR和水痘疫苗均由默克公司生产。
¶研究参与者此前在8月龄大时已经接种了3剂Pentacel疫苗。
引发的不良反应
表2显示了研究P3T06中每剂Pentacel疫苗或对照疫苗接种后3天内发生的选定请求注射部位和全身不良反应的发生率和严重程度。父母或监护人每天在日记卡上记录这些反应的信息。在表2中,报告了Pentacel和DAPTACEL注射部位的注射部位反应。
表2:在P3T06研究中,接种潘太欣或对照疫苗后0-3天内出现所选不良反应的儿童人数(百分比)
| 注射部位反应 | 潘太欣 剂量1 N=465- 467% | 潘太欣 剂量2 N = 451 % | 潘太欣 剂量3 N = 438- 440 % | 潘太欣 剂量4 N = 387- 396 % | DAPTACEL剂量1 n = 1400-1404 % | DAPTACEL剂量2 n = 1358-1359 % | DAPTACEL剂量3 n = 1311-1312 % | DAPTACEL剂量4 N = 376-380 % |
| 红色> 5mm | 7.1 | 8.4 | 8.7 | 17.3 | 6.2 | 7.1 | 9.6 | 16.4 |
| 红色> 25mm | 2.8 | 1.8 | 1.8 | 9.2 | 1.0 | 0.6 | 1.9 | 7.9 |
| 红色> 50mm | 0.6 | 0.2 | 0.0 | 2.3 | 0.4 | 0.1 | 0.0 | 2.4 |
| 膨胀> 5mm | 7.5 | 7.3 | 5.0 | 9.7 | 4.0 | 4.0 | 6.5 | 10.3 |
| 膨胀> 25mm | 3.0 | 2.0 | 1.6 | 3.8 | 1.6 | 0.7 | 1.1 | 4.0 |
| 膨胀> 50mm | 0.9 | 0.0 | 0.0 | 0.8 | 0.4 | 0.1 | 0.1 | 1.3 |
| 压痛* 任何的 | 47.5 | 39.2 | 42.7 | 56.1 | 48.8 | 38.2 | 40.9 | 51.1 |
| 压痛* 中度或重度 | 19.6 | 10.6 | 11.6 | 16.7 | 20.7 | 12.2 | 12.3 | 15.8 |
| 压痛* 严重的 | 5.4 | 1.6 | 1.4 | 3.3 | 4.1 | 2.3 | 1.7 | 2.4 |
| 手臂周长增加> 5mm | – | – | – | 33.6 | – | – | – | 30.6 |
| 手臂周长增加>20mm | – | – | – | 4.7 | – | – | – | 6.9 |
| 手臂周长增加> 40mm | – | – | – | 0.5 | – | – | – | 0.8 |
| 发烧†‡≥38.0℃ | 5.8 | 10.9 | 16.3 | 13.4 | 9.3 | 16.1 | 15.8 | 8.7 |
| 发烧†‡> 38.5℃ | 1.3 | 2.4 | 4.4 | 5.1 | 1.6 | 4.3 | 5.1 | 3.2 |
| 发烧†‡> 39.5℃ | 0.4 | 0.0 | 0.7 | 0.3 | 0.1 | 0.4 | 0.3 | 0.8 |
| 活动减少/嗜睡§任何的 | 45.8 | 32.7 | 32.5 | 24.1 | 51.1 | 37.4 | 33.2 | 24.1 |
| 活动减少/嗜睡§ 中度或重度 | 22.9 | 12.4 | 12.7 | 9.8 | 24.3 | 15.8 | 12.7 | 9.2 |
| 活动减少/嗜睡§ 严重的 | 2.1 | 0.7 | 0.2 | 2.5 | 1.2 | 1.4 | 0.6 | 0.3 |
| 伤心欲绝的哭泣 任何的 | 59.3 | 49.8 | 47.3 | 35.9 | 58.5 | 51.4 | 47.9 | 36.2 |
| 伤心欲绝的哭泣 ≥1小时 | 19.7 | 10.6 | 13.6 | 11.8 | 16.4 | 16.0 | 12.2 | 10.5 |
| 伤心欲绝的哭泣 >3小时 | 1.9 | 0.9 | 1.1 | 2.3 | 2.2 | 3.4 | 1.4 | 1.8 |
| 烦躁/易怒 任何的 | 76.9 | 71.2 | 68.0 | 53.5 | 75.8 | 70.7 | 67.1 | 53.8 |
| 烦躁/易怒 ≥1小时 | 34.5 | 27.0 | 26.4 | 23.6 | 33.3 | 30.5 | 26.2 | 19.4 |
| 烦躁/易怒 >3小时 | 4.3 | 4.0 | 5.0 | 5.3 | 5.6 | 5.5 | 4.3 | 4.5 |
*任何:轻度、中度或重度;轻度:受试者在触摸部位时呜咽;中度:受试者在触摸部位时哭泣;严重:受试者在腿或手臂移动时会哭。
†发热基于记录的实际温度,未对测量路线进行调整。
‡在注射第1-3剂疫苗后,通过腋窝、直肠或其他途径测量体温或未记录体温的比例分别为:Pentacel疫苗46.0%、53.0%、1.0%和0%,DAPTACEL + IPOL + ActHIB疫苗44.8%、54.0%、1.0%和0.1%。在第4剂后,通过腋窝、直肠或其他途径进行或未记录的体温测量的比例对于Pentacel疫苗分别为62.7%、34.4%、2.4%和0.5%,对于DAPTACEL + ActHIB分别为61.1%、36.6%、1.7%和0.5%。
§中度:干扰或限制平时的日常活动;重度:残疾,对日常活动不感兴趣。
低渗低反应发作
在研究P3T06中,日记卡包括与HHEs相关的问题。在研究494- 01、494-03和5A9908中,在接种疫苗后的电话中询问了一个关于昏厥或精神状态变化的问题。在这4项研究中,在接种 潘太欣酚(N = 5,979)、分别接种HCPDT +脊髓灰质炎疫苗+ACTH IB(N = 1,032)或分别接种DAPTACEL+IPOL+ACTH IB(N = 1,455)的参与者中,未报告美国公共卫生服务研讨会报告中定义的HHE。据报告,4名受试者在注射并潘太欣后7天内出现不符合HHE标准的肌张力减退(1名在第一次接种的同一天;3名在第3次接种的同一天)和1名在接种DAPTACEL+ IPOL + ActHIB后(第1次接种后4天)的参与者。
发作
在研究494-01、494-03、5A9908和P3T06中,共有8名参与者在接种潘太欣后7天内出现癫痫发作(4名参与者;对于剂量1-3中的至少一种,N = 4,197;第4剂的N = 5,033),分别给予HCPDT +脊髓灰质炎疫苗+ACTH IB(3名参与者;对于剂量1-3中的至少一种,N = 1,032;对于剂量4,N = 739),分别给予DAPTACEL+IPOL+ActHIB(1名参与者;对于剂量1-3中的至少一种,N = 1,455),或单独接种的DAPTACEL+ActHIB(0名参与者;剂量4的N = 418)。在接种Pentacel后7天内出现癫痫发作的四名参与者中,研究494-01的一名参与者在第一次接种后6天出现无热癫痫发作,研究494-01的一名参与者在第三次接种当天可能出现癫痫发作,研究5A9908的两名参与者分别在第四次接种后2天和4天出现热性癫痫发作。在接种对照疫苗后7天内出现癫痫发作的四名参与者中,一名参与者在接种第1剂DAPTACEL+ IPOL + ActHIB的当天出现无热癫痫发作,一名参与者在接种第2剂HCPDT +脊髓灰质炎疫苗+ ActHIB的当天出现无热癫痫发作,两名参与者在接种第4剂HCPDT +脊髓灰质炎疫苗+ ActHIB后分别在6天和7天出现热性癫痫发作。
严重不良事件
在P3T06研究中,在注射1-3剂Pentacel疫苗或对照疫苗后的30天内,接种 Pentacel疫苗的484名参与者中有19名(3.9%)和接种 DAPTACEL + IPOL + ActHIB疫苗的1,455名参与者中有50名(3.4%)出现严重不良事件。在第4剂Pentacel或对照疫苗接种后30天内,431名接种 Pentacel的参与者中有5名(1.2%)和418名接种 DAPTACEL + ActHIB的参与者中有4名(1.0%)出现严重不良事件。在研究494-01中,在注射1-3剂Pentacel疫苗或对照疫苗后的30天内,接种 Pentacel疫苗的2506名参与者中的23名(0.9%)和接种 HCPDT +脊髓灰质炎疫苗+ ActHIB疫苗的1032名参与者中的11名(1.1%)出现了严重不良事件。在接种第4剂Pentacel或对照疫苗后30天内,接种 Pentacel的1,862名参与者中有6名(0.3%)和接种 HCPDT +脊髓灰质炎疫苗+ ActHIB的739名参与者中有2名(0.3%)出现严重不良事件。
在494-01、494-03和P3T06研究中,在注射1-3剂Pentacel疫苗或对照疫苗后的30天内,最常报告的严重不良事件是细支气管炎、脱水、肺炎和胃肠炎。在494-01、494-03、5A9908和P3T06研究中,在注射第4剂Pentacel疫苗或对照疫苗后30天内,最常报告的严重不良事件是脱水、胃肠炎、哮喘和肺炎。
在研究494-01、494-03、5A9908和P3T06中,报告了两例脑病病例,均发生在接种了潘太欣酚治疗的参与者中(N = 5,979)。一例发生在疫苗接种后30天,继发于心脏手术后心脏骤停。一名婴儿在接种疫苗后8天出现神经系统症状,随后发现其大脑结构异常,并被诊断为先天性脑病。
在研究494-01、494-03、5A9908和P3T06: 4期间,接种潘太欣的儿童(N = 5,979)共有5例死亡,接种 DAPTACEL+ IPOL + ActHIB的参与者(N = 1,455)有1例死亡。接种 HCPDT +脊灰疫苗+ ActHIB的儿童中没有死亡报告(N = 1,032)。接种了潘太欣酚的儿童的死亡原因是窒息、头部创伤、婴儿猝死综合征和神经母细胞瘤(分别在接种后8、23、52和256天)。一名患有室管膜瘤的参与者在DAPTACEL+ IPOL + ActHIB治疗222天后死于继发吸入。
6.2上市后体验
自1997年以来,在全球范围内使用潘太欣上市后,自发报告了以下其他不良事件。1997年至2007年间,潘太欣主要在加拿大使用。由于这些事件是由规模不确定的人群自愿报告的,因此可能无法可靠地估计其频率或建立与疫苗暴露的因果关系。
以下不良事件是根据以下一个或多个因素纳入的:严重性、报告频率或与潘太欣有因果关系的证据强度。
• 心脏疾病发绀
• 胃肠疾病呕吐、腹泻
• 全身疾病和接种部位条件
注射部位反应(包括炎症、肿块、脓肿和无菌脓肿)、注射肢体广泛肿胀(包括涉及邻近关节的肿胀)、疫苗接种失败/治疗反应下降(侵入性b型流感嗜血杆菌疾病)
• 免疫系统疾病
过敏反应/过敏反应、超敏反应(如皮疹和荨麻疹)
• 感染和侵扰
脑膜炎、鼻炎、病毒感染
• 新陈代谢和营养失调
食欲下降
• 神经系统疾病
嗜睡,HHE,意识水平下降
• 精神疾病尖叫的
• 呼吸、胸腔和纵隔疾病呼吸暂停、咳嗽
• 皮肤和皮下组织疾病红斑、皮肤变色
• 血管疾病苍白
7药物相互作用
7.1与其他疫苗同时接种
在临床试验中,潘太欣与下列一种或多种美国许可的疫苗同时接种:乙型肝炎疫苗、7价肺炎球菌结合疫苗、MMR和水痘疫苗。[参见不良反应5和临床研究(14)。】当与另一种可注射疫苗同时注射潘太欣时,应使用不同的注射器在不同的注射部位注射疫苗。
7.2免疫抑制治疗
免疫抑制疗法,包括放射疗法、抗代谢药、烷化剂、细胞毒性药物和皮质类固醇(使用剂量超过生理剂量),可能会降低对潘太欣的免疫反应。[参见警告和注意事项(5.6)。]
7.3药物/实验室检测相互作用
在接种 ActHIB后的某些情况下检测到了抗遗尿症。在接种潘太欣后一周内对疑似b型流感嗜血杆菌疾病可能没有明确的诊断价值。(6)
8在特定人群中使用
8.4儿科使用
在临床研究的基础上,在6周到18月龄的年龄组中确定了潘太欣的安全性和有效性。[参见不良反应(6.1)和临床研究(14)。】在6周至18月龄的儿童中,有证据支持潘太欣在19月龄至4岁年龄组中的安全性和有效性。尚未确定潘太欣在6周以下婴儿和5至16岁儿童中的安全性和有效性。
11描述
潘太欣由吸附了白喉、破伤风类毒素和无细胞百日咳的灭活脊髓灰质炎病毒(DTaP-IPV)成分和重组用于肌肉注射的ActHIB成分组成。ActHIB(b型流感嗜血杆菌结合疫苗【破伤风类毒素结合疫苗】)由以下成分组成H.流感与破伤风类毒素(PRP-T)共价结合的b型荚膜多糖(聚核糖基核糖醇磷酸酯【PRP】)。DTaP-IPV成分以无菌液体的形式提供,用于重构冻干的ActHIB成分以形成并潘太欣。潘太欣是一种均匀、混浊、白色至米白色(微黄)的悬浮液。
每0.5毫升剂量含有15微克白喉类毒素、5微克破伤风类毒素、无细胞百日咳抗原【20微克去毒百日咳毒素(PT)、20微克丝状血凝素(FHA)、3微克百日咳杆菌粘附素(PRN)、5微克2型和3型菌毛(FIM)】、灭活脊髓灰质炎病毒【40个D抗原单位(DU)1型(Mahoney)、8个DU 2型(MEF-1)、32微克3型6H.流感与24微克破伤风类毒素(PRP-T)共价结合的b型。
每0.5毫升剂量的其他成分包括1.5毫克磷酸铝(0.33毫克铝)作为佐剂、聚山梨醇酯80(经计算约为10 ppm)、42.5毫克蔗糖、<2微克残余甲醛、<50纳克残余戊二醛、≤50纳克残余牛血清白蛋白、3.3毫克(0.6% v/v)2-苯氧乙醇(不作为防腐剂)、<4皮克新霉素和<4皮克硫酸多粘菌素B。
白喉棒状杆菌在改良的米勒氏生长培养基中生长。(7)通过硫酸铵分级纯化后,用甲醛对白喉毒素进行解毒并渗滤。
破伤风梭菌生长在改良的米勒-米勒酪蛋白氨基酸培养基中,不含牛心浸液。(8)破伤风毒素用甲醛解毒,并通过硫酸铵分级和渗滤纯化。白喉和破伤风类毒素分别吸附在磷酸铝上。
无细胞百日咳疫苗抗原由以下物质产生百日咳博德特氏菌在通过添加酪蛋白氨基酸和二甲基-β-环糊精改良的Stainer-Scholte培养基(9)中生长的培养物。从上清液培养基中分别分离出铂、FHA和PRN。从细菌细胞中提取并共纯化FIM。百日咳抗原通过连续过滤、盐沉淀、超滤和层析进行纯化。PT用戊二醛解毒。用甲醛处理FHA,通过超滤除去残留的醛。单个抗原分别吸附在磷酸铝上。
通过微载体方法,1型、2型和3型脊髓灰质炎病毒各自在MRC-5细胞(一种正常人类二倍体细胞系)的单独培养物中生长。(10)(11)细胞在补充有小牛血清的CMRL(康诺特医学研究实验室)1969培养基中生长。对于病毒生长,用不含小牛血清的培养基199代替培养基。澄清和过滤后,通过超滤浓缩病毒悬浮液,并通过液相色谱步骤纯化。单价病毒悬液用甲醛灭活。将每种灭活脊髓灰质炎病毒的单价浓缩物合并以产生三价脊髓灰质炎病毒浓缩物。
吸附的白喉、破伤风和无细胞百日咳抗原与磷酸铝(作为佐剂)、2-苯氧乙醇(不作为防腐剂)和注射用水混合成中间浓缩物。加入三价脊髓灰质炎病毒浓缩物,并将DTaP-IPV组分稀释至其最终浓度。DTaP-IPV成分不含防腐剂。
在豚鼠效力试验中,白喉和破伤风类毒素每毫升至少诱导2个中和单位。通过酶联免疫吸附试验(ELISA)测定的免疫小鼠对去毒百日咳杆菌、FHA、PRN和FIM的抗体反应来评估无细胞百日咳抗原的效力。通过测量免疫大鼠血清中抗体介导的脊髓灰质炎病毒中和作用来确定灭活脊髓灰质炎病毒抗原的效力。
PRP是一种高分子量聚合物,由以下物质制备而成流感嗜血杆菌在半合成培养基中生长的b型菌株1482。(12)通过硫酸铵纯化和福尔马林灭活来自下列细菌培养物的毒素来制备用于与PRP结合的破伤风类毒素破伤风梭菌(哈佛菌株)生长在改良的米勒培养基中。(13)类毒素在结合过程之前过滤灭菌。ActHIB成分不含防腐剂。ActHIB成分的效价在每批中通过对每剂PRP多糖和蛋白质含量的限制以及被称为高分子量结合物的多糖和蛋白质的比例来指定。
潘太欣的DTaP-IPV和ActHIB成分的瓶塞不是由天然橡胶乳胶制成的。
12临床药理学
12.1作用机制
白喉
白喉是一种由产毒素的白喉梭菌菌株引起的急性毒素介导的疾病。对疾病的保护是由于白喉毒素的中和抗体的发展。0.01 IU/mL的血清白喉抗毒素水平是提供一定程度保护的最低水平。通常认为至少0.1 IU/mL的抗毒素水平是有保护作用的。(14)1.0 IU/mL的水平与长期保护有关。(15)
破伤风
破伤风是一种由强伤风杆菌产生的一种极强的神经毒素引起的急性疾病。对疾病的保护是由于破伤风毒素中和抗体的发展。通过中和试验测定的至少0.01 IU/mL的血清破伤风抗毒素水平被认为是最低保护水平。(14)(16)根据潘太欣临床研究中使用的酶联免疫吸附测定法测得的破伤风抗毒素水平≥0.1 IU/mL被视为具有保护作用。
百日咳
百日咳是一种由百日咳杆菌引起的呼吸道疾病。这种革兰氏阴性球菌产生多种生物活性成分,尽管它们在百日咳发病或免疫中的作用尚未明确定义。
脊髓灰质炎
有三种血清型(1型、2型和3型)的脊髓灰质炎病毒是肠道病毒。脊髓灰质炎病毒类型特异性中和抗体的存在与预防脊髓灰质炎相关。(17)
侵袭性疾病由于b型流感嗜血杆菌
b型流感嗜血杆菌能引起侵袭性疾病,如脑膜炎和败血症。抗PRP抗体已被证明与抵抗侵袭性疾病的保护作用相关b型流感嗜血杆菌。
基于被动抗体研究(18)和芬兰b型流感嗜血杆菌多糖疫苗的疗效研究,(19)接种后0.15水平mcg/mL已被接受为最低保护水平。芬兰一项b型流感嗜血杆菌多糖疫苗疗效研究的数据表明,接种疫苗3周后>1.0mcg/mL水平为,预示着随后一年的保护。(20)(21)这些水平已用于评估b型流感嗜血杆菌结合疫苗的有效性,包括Pentacel的ActHIB成分。
13非临床毒理学
13.1致癌、诱变、生育能力受损
尚未评估潘太欣的致癌或致突变潜力或对生育能力的损害。
14项临床研究
与单独施用的疫苗相比,Pentacel的功效基于单个抗原的免疫原性。白喉、破伤风、脊髓灰质炎和以下侵袭性疾病的血清学保护相关b型流感嗜血杆菌。【参见临床药理学(12.1)。]在瑞典进行的一项功效研究(瑞典I功效试验)中,针对百日咳的功效部分是基于对美国儿童接种潘太欣酚后的百日咳免疫反应与接种DAPTACEL(赛诺菲巴斯德有限公司生产的吸附白喉和破伤风类毒素和无细胞百日咳疫苗(DTaP))后的反应进行的比较,目前尚无可靠的血清学保护相关性。虽然Pentacel和DAPTACEL含有相同的百日咳抗原,由相同的工艺生产,但Pentacel含有两倍于DAPTACEL的去毒PT和四倍于DAPTACEL的FHA。
在四项美国研究中评估了对潘太欣的免疫反应:研究494-01、P3T06、494-03和M5A10。表1提供了研究494-01、P3T06和494-03中使用的Pentacel疫苗、对照疫苗和同时使用的疫苗的接种时间表。[参见不良反应(6.1)。】在研究M5A10中,参与者在2、4和6月龄大时被随机分配接种 并潘太欣或分别接种DAPTACEL、IPOL和ActHIB。2月龄、4月龄和6月龄的7价肺炎球菌结合物(PCV7,Wyeth Pharmaceuticals Inc .)和2月龄和6月龄的乙型肝炎疫苗(默克公司或葛兰素史克生物制品公司)与潘太欣或对照疫苗同时接种。(22)
14.1白喉
表3提供了在P3T06研究中,接种3剂和4剂潘太欣或DAPTACEL后一月龄内达到白喉抗毒素血清保护水平的参与者比例。
14.2破伤风
表3提供了在P3T06研究中,接种3剂和4剂潘太欣或DAPTACEL后一月龄达到破伤风抗毒素血清保护水平的参与者比例。
表3:研究P3T06在2、4、6和15-16月龄大的美国儿童中接种第3剂和第4剂潘太欣或DAPTACEL+ IPOL + ActHIB疫苗后一月龄的白喉抗毒素和破伤风抗毒素反应
| 潘太欣 | DAPTACEL+ IPOL + ActHIB | |
| 第3剂后 | N = 331-345 | N = 1,037-1,099 |
| 白喉抗毒素 | ||
| % ≥0.01 IU/mL* | 100.0% | 100.0% |
| % ≥0.10 IU/mL† | 98.8% | 98.5% |
| 破伤风抗毒素 | ||
| % ≥0.10 IU/mL† | 99.7% | 100.0% |
| 第4剂后 | N = 341-352 | N = 328-334 |
| 白喉抗毒素 | ||
| % ≥0.10 IU/mL* | 100.0% | 100.0% |
| % ≥1.0 IU/mL† | 96.5% | 95.7% |
| 破伤风抗毒素 | ||
| % ≥0.10 IU/mL* | 100.0% | 100.0% |
| % ≥1.0 IU/mL†‡ | 92.9% | 99.4% |
符合方案免疫原性人群。
*接种Pentacel疫苗后的血清保护率不低于DAPTACEL疫苗(DAPTACEL–Pentacel差异的90%置信区间上限<10%)。
†未预先指定非劣效性标准。
‡ 使用本研究中使用的ELISA,1.0 IU/mL的破伤风抗毒素水平是保护水平的10倍。
14.3百日咳
在1992-1995年期间在瑞典进行的一项临床百日咳疫苗效力研究(瑞典I效力试验)中,2587名婴儿在2、4和6月龄大时接种了DAPTACEL疫苗,2574名婴儿接种了非美国许可的DT疫苗。(1)第3剂疫苗接种后的平均随访时间为2年。根据世界卫生组织(WHO)的病例定义( 连续>21天发作性咳嗽,并经培养或血清学证实或与确诊病例有流行病学联系),接种3剂疫苗后,DAPTACEL对百日咳的保护效力为84.9%(95%置信区间【CI】80.1%,88.6%)。DAPTACEL对轻度百日咳(经实验室确认咳嗽时间大于1天)的保护效力为77.9%(95%可信区间为72.6%,82.2%)。DAPTACEL对百日咳的保护作用持续了2年的随访期。
根据美国婴儿(第3剂后)和加拿大儿童(第4剂后)相对于参与瑞典I疗效试验的婴儿的免疫反应比较,得出的结论是,在美国儿童中进行百日咳初级免疫接种需要4剂DAPTACEL。(1)
在一项血清学桥接分析中,将瑞典I疗效试验中接种 3剂DAPTACEL的婴儿子集对FHA、PRN和FIM的免疫反应与研究494-01中接种潘太欣酚的美国儿童子集在第3剂和第4剂后的反应进行了比较(表4)。平行检测了在瑞典I功效试验中接种 DAPTACEL的婴儿的可用储存血清和在研究494-01中与前3剂Pentacel同时接种 PCV7的儿童的血清(表1)。在这项血清学桥接分析中,没有使用足够特异的检测方法获得PT抗体水平的数据。
表4显示了瑞典I功效试验的婴儿子集在接种第3剂DAPTACEL后一月龄以及美国研究494-01的婴儿子集在接种第3剂和第4剂潘太欣后一月龄的FHA、PRN和FIM抗体的几何平均抗体浓度(GMCs)和血清转化率。血清转化定义为抗体水平上升4倍(第3剂后/第1剂前或第4剂后/第1剂前)。就抗FHA和抗FIM而言,血清转化率符合非劣效性标准;就抗FHA、抗PRN和抗FIM而言,接种第4剂与第3剂DAPTACEL相比的Pentacel后的GMCs符合非劣效性标准。相对于第3剂DAPTACEL,第4剂DAPTACEL后的抗PRN血清转化未达到非劣效性标准【比率差异的95%可信区间上限(DAPTACEL减去DAPTACEL)= 13.24%】。美国儿童接种第4剂潘太欣酚后的抗PRN血清转换率低于瑞典婴儿接种第3剂DAPTACEL后的转换率,这是否与潘太欣酚治疗百日咳的疗效降低有关尚不清楚。
表4:在瑞典I功效试验中,在2、4和6月龄大的婴儿亚组中接种第3剂DAPTACEL1个月后的FHA、PRN和FIM抗体反应,以及在美国研究494-01中,在2、4、6和15-16月龄大的婴儿亚组中接种第3剂和第4剂潘太欣1个月后的抗体反应
| 第3剂后 DAPTACEL 瑞典I功效 试验 N = 80 | 第3剂后 潘太欣* 美国研究494-01 N = 730-995 | 第4剂后 潘太欣† 美国研究494-01 N = 507-554 | |
| 抗FHA %实现4倍增长‡ GMC(EU/mL) | 68.8 40.70 | 79.8 71.46 | 91.7§ 129.85§ |
| 抗PRN %实现4倍增长‡ GMC(EU/mL) | 98.8 111.26 | 74.4 38.11 | 89.2¶ 90.82§ |
| 抗FIM %实现4倍增长‡ GMC(EU/mL) | 86.3 339.31 | 86.5 265.02 | 91.5§ 506.57§ |
分析的血清来自每项研究中符合方案免疫原性人群的子集。
使用足够特异的检测方法获得的抗PT水平数据不可用。
*没有预先指定非劣效性标准来比较第3剂后对潘太欣疫苗的免疫应答与第3剂后对DAPTACEL疫苗的免疫应答。
†预先指定的非劣效性分析比较了第4剂后对Pentacel疫苗的免疫反应与第3剂后对DAPTACEL疫苗的免疫反应。
‡根据第3剂后/第1剂前抗体水平或第4剂后/第1剂前抗体水平计算增加倍数。
§注射第4剂潘太欣疫苗后实现4倍增长或GMC的百分比不劣于注射第3剂DAPTACEL疫苗【比率差异(DAPTACEL减去潘太欣)<10%的95%可信区间上限和GMC比率(DAPTACEL/潘太欣)<1.5的90%可信区间上限】。
¶相对于第3剂DAPTACEL疫苗,第4剂DAPTACEL疫苗接种后抗PRN病毒的百分比增加了4倍,不符合非劣效性标准【比率差异(DAPTACEL减去Pentacel)的95%置信区间上限= 13.24%,超过<10%> 的非劣效性标准】。
在另一项研究P3T06中,美国婴儿在2、4、6和15-16月龄大时随机接种潘太欣或DAPTACEL+ IPOL + ActHIB治疗(表1)。比较了两组在第3剂和第4剂接种后一月龄的百日咳免疫反应(GMCs和血清转化率)(表5)。血清转化定义为抗体水平上升4倍(第3剂后/第1剂前或第4剂后/第1剂前)。从足够具体的检测中获得的抗PT反应数据仅在研究参与者的非随机子集上可用。研究参与者的子集代表了所有研究参与者在第1剂前、第3剂后和第4剂后的FHA、PRN和FIM抗体GMCs。
对于每种百日咳抗原,相对于第3剂DAPTACEL,第3剂潘太欣达唑的血清转化率和GMCs均符合非劣效性标准。
相对于剂量4的DAPTACEL,剂量4的并潘太欣治疗后,除抗PRN GMCs外,所有比较均符合非劣效性标准【GMCs比率(DAPTACEL/并潘太欣)的90%置信区间上限= 2.25】。在美国儿童中,相对于第4剂量的DAPTACEL而言,第4剂量的并潘太欣的抗PRN GMC较低是否与并潘太欣抗百日咳的疗效降低有关尚不清楚。
表5:在P3T06研究中,美国婴儿在2、4、6和15-16月龄大时接种第3剂和第4剂潘太欣或DAPTACEL+ IPOL + ActHIB疫苗1个月后的百日咳抗体反应
| 第3剂后 潘太欣 N = 143 | 第3剂后 DAPTACEL+ IPOL +ActHIB N = 481-485 | 第4剂后 潘太欣 N = 113 | 第4剂后 DAPTACEL + ActHIB N = 127-128 | |
| 抗PT %实现4倍增长* | 95.8† | 87.3 | 93.8‡ | 91.3 |
| 抗PT GMC(EU/mL) | 102.62† | 61.88 | 107.89‡ | 100.29 |
| 第3剂后 潘太欣 N = 218-318 | 第3剂后 DAPTACEL+ IPOL +ActHIB n = 714-1016 | 第4剂后 潘太欣 N = 230-367 | 第4剂后 DAPTACEL + ActHIB N = 237-347 | |
| 抗FHA %实现4倍增长* | 81.9 | 60.9 | 88.4¶ | 79.3 |
| 抗FHA GMC(EU/mL) | 73.68§ | 29.22 | 107.89¶ | 64.02 |
| 抗PRN %实现4倍增长* | 74.2§ | 75.4 | 92.7¶ | 98.3 |
| 抗PRN GMC(EU/mL) | 36.05§ | 43.25 | 93.59# | 186.07 |
| 反FIM %实现4倍增长* | 91.7§ | 86.3 | 93.5¶ | 91.6 |
| 反FIM GMC(EU/mL) | 268.15§ | 267.18 | 553.39¶ | 513.54 |
抗FHA、抗PRN和抗FIM的符合方案免疫原性人群。
抗PT方案免疫原性群体的非随机子集。有关评估子集的更多信息,请参见正文。
*增加倍数计算为第3次接种后/第1次接种前抗体水平或第4次接种后/第1次接种前抗体水平。
†获得4倍增长的百分比或第3剂潘太欣疫苗后的GMC不劣于第3剂DAPTACEL疫苗【GMC比率(DAPTACEL/潘太欣)的95%可信区间上限<1.5,比率差异(DAPTACEL减去潘太欣)的95%可信区间上限<10%】。
‡获得4倍增长的百分比或第4剂潘太欣疫苗后的GMC不劣于第4剂DAPTACEL疫苗【GMC比率(DAPTACEL/潘太欣)的95%置信区间上限<1.5,比率差异(DAPTACEL减去潘太欣)的95%置信区间上限<10%】。
§注射第3剂潘太欣疫苗后GMC增加4倍的百分比或不劣于注射第3剂DAPTACEL疫苗【GMC比率(DAPTACEL/潘太欣)的90%可信区间上限<1.5,比率差异(DAPTACEL减去潘太欣)的90%可信区间上限<10%】。
¶注射第4剂潘太欣疫苗后GMC增加4倍的百分比或不劣于注射第4剂DAPTACEL疫苗【GMC比率(DAPTACEL/潘太欣)的90%可信区间上限<1.5,比率差异(DAPTACEL减去潘太欣)的90%可信区间上限<10%】。
#与第4剂DAPTACEL疫苗相比,第4剂DAPTACEL疫苗后的GMC不符合非劣效性标准【GMC比率(DAPTACEL/Pentacel)的90% CI上限= 2.25,超过了<1.5的非劣效性标准】。
研究006是在美国进行的一项研究,其中婴儿随机在2、4和6月龄大时接种 3剂VAXELIS疫苗和15月龄大时接种 Pentacel疫苗(N=2,406),或在2和6月龄大时接种对照组疫苗(2、4、6和15月龄大时接种 4剂Pentacel疫苗+重组乙肝疫苗);N=402)。所有受试者在2、4、6和15月龄大时同时接种 Prevnar 13(13价肺炎球菌结合疫苗【白喉CRM197蛋白】)。
在15月龄大时给予一定剂量的潘太欣后,评估参与者对百日咳抗原的免疫反应。接种第4剂疫苗后,所有百日咳抗原的抗体疫苗应答率和GMC均符合非劣效性标准,但PRN的GMC除外(GMC比率【VAXELIS组/对照组疫苗】的双侧95% CI下限为0.66,低于非劣效性标准> 0.67)。(22)
14.4脊髓灰质炎
在P3T06研究(表1)中,婴儿在2、4和6月龄大时随机接种 前3剂Pentacel或DAPTACEL + IPOL + ActHIB,在接种第3剂研究疫苗一个月后,两组中≥99.4%的参与者(Pentacel: N = 338-350)、(DAPTACEL + IPOL + ActHIB: N = 1,050-1,097)对1型、2型和3型脊髓灰质炎病毒的中和抗体水平≥1:8。
在研究494-01(表1)中,婴儿随机接种 了潘太欣或HCPDT +脊髓灰质炎疫苗+ ActHIB,在第4剂潘太欣疫苗(N = 851-857)后一个月,1型、2型和3型脊髓灰质炎病毒抗体的GMT(1/dil)分别为2,304、4,178和4,415,在第4剂脊髓灰质炎疫苗(N = 284-287)后1个月分别为2330、2840和3300。
14.5以下原因导致的侵入性疾病b型流感嗜血杆菌
在研究494-01、P3T06和M5A10中,接种第3剂并潘太欣或单独接种ActHIB1个月后的抗PRP血清保护率和GMCs如表6所示。在研究494-01中,与单独接种ActHIB相比,接种Pentacel后抗PRP水平≥1.0 mcg/mL的参与者比例和抗PRP GMCs未达到非劣效性标准。在P3T06和M5A10的每项研究中,与单独接种ActHIB相比,接种Pentacel后抗PRP水平≥1.0 mcg/mL的参与者比例符合非劣效性标准。在研究M5A10中,与单独接种ActHIB相比,接种Pentacel后的抗PRP GMCs符合非劣效性标准。
表6:在研究494-01、P3T06和M5A10中,在2、4和6月龄大时分别给予3剂潘太欣或单独的DTaP + IPV + ActHIB后一月龄的抗PRP血清保护率和GMCs
| 研究494-01 潘太欣 N = 1,127 | 研究494-01 HCPDT +脊髓灰质炎疫苗+ ActHIB N = 401 | |
| 实现抗PRP ≥0.15 mcg/mL 的百分比 | 95.4* | 98.3 |
| 实现抗PRP ≥1.0 mcg/mL 的百分比 | 79.1† | 88.8 |
| 抗PRP GMC( mcg/mL ) | 3.19‡ | 6.23 |
| 研究P3T06 潘太欣 N = 365 | 研究P3T06 DAPTACEL+ IPOL + ActHIB N = 1,128 | |
| 实现抗PRP ≥0.15 mcg/mL 的百分比 | 92.3* | 93.3 |
| 实现抗PRP ≥1.0 mcg/mL 的百分比 | 72.1* | 70.8 |
| 抗PRP GMC( mcg/mL ) | 2.31§ | 2.29 |
| 研究报告M5A10 潘太欣 N = 826 | 研究报告M5A10 DAPTACEL+ IPOL + ActHIB N = 421 | |
| 实现抗PRP ≥0.15 mcg/mL 的百分比 | 93.8¶ | 90.3 |
| 实现抗PRP ≥1.0 mcg/mL 的百分比 | 75.1¶ | 74.8 |
| 抗PRP GMC( mcg/mL ) | 2.52# | 2.38 |
所有研究的方案免疫原性人群。
IPV表示脊髓灰质炎疫苗已灭活。
*接种不劣于ActHIB疫苗的Pentacel疫苗后达到规定水平的百分比【比率差异的90%置信区间上限(ActHIB减去Pentacel)<10%】。
†相对于ActHIB疫苗,使用Pentacel疫苗后抗PRP抗体≥1.0 mcg/mL的百分比不符合非劣效性标准【比率差异(ActHIB减去Pentacel)的90% CI上限为12.9%,超过非劣效性标准<10%】。
‡相对于ActHIB疫苗,接种Pentacel疫苗后的GMC不符合非劣效性标准【GMC比率(ActHIB/Pentacel)的90% CI上限为2.26,超过非劣效性标准<1.5】。
§非劣效标准未预先指定。
¶在接种不低于ActHIB疫苗的Pentacel疫苗后达到规定水平的百分比【比率差异的95%置信区间上限(ActHIB减去Pentacel)<10%】。
#接种Pentacel疫苗后的GMC不劣于ActHIB疫苗【GMC比率(ActHIB/Pentacel)的90% CI上限<1.5】。
在研究494-01中,在接种第4剂研究疫苗前的15月龄龄时,68.6%的Pentacel受试者(N = 829)和80.8%的单独接种ActHIB的受试者(N = 276)的抗PRP水平≥0.15 mcg/mL。接种第4剂研究疫苗后,98.2%的潘太欣接种者(N = 874)和99.0%的单独接种ActHIB接种者(N = 291)的抗PRP水平≥1.0 mcg/mL 。
在P3T06研究中,在接种第4剂研究疫苗前的15月龄龄时,65.4%的Pentacel受试者(N = 335)和60.7%的单独接种ActHIB的受试者(N = 323)的抗PRP水平≥0.15 mcg/mL。接种第4剂研究疫苗后,97.8%的潘太欣接种者(N = 361)和95.9%的单独接种ActHIB接种者(N = 340)的抗PRP水平≥1.0 mcg/mL 。
14.6同时接种疫苗
在P3T06研究中,(表1)没有证据表明,相对于与DAPTACEL+IPOL+ActHIB(N = 998-1,025)同时接种的乙肝疫苗(抗-HBsAg ≥10 mIU/mL和GMCs的参与者百分比)或PCV7(抗体水平≥0.15 mcg/mL和≥0.5 mcg/mL和各血清型GMCs的参与者百分比)同时接种的抗体反应降低接种第3剂后一月龄评估对乙型肝炎疫苗和PCV7的免疫反应。
在研究494-03(表1)中,相对于与MMR和水痘疫苗(N = 158)同时接种的该疫苗,在15月龄大时同时接种第4剂PCV7(抗体水平≥0.15 mcg/mL和≥0.5 mcg/mL的参与者百分比以及各血清型的GMCs)的免疫反应没有受到干扰的证据。相对于与PCV7(N = 144)同时接种MMR和水痘疫苗而言,在15月龄大时与Pentacel(N = 154)同时接种MMR和水痘疫苗(具有预先指定血清反应水平的参与者百分比)的免疫反应没有受到干扰的证据。接种后一月龄评估对MMR、水痘疫苗和第4剂PCV7的免疫反应。
15参考文献
1 DAPTACEL【完整处方信息】。安大略省多伦多:赛诺菲巴斯德有限公司。
2 Quadracel【完整处方信息】。安大略省多伦多:赛诺菲巴斯德有限公司。
3疾控中心。免疫实践咨询委员会(ACIP)关于常规脊髓灰质炎疫苗接种的最新建议。MMWR 2009年;58:829- 30.
4 Stratton KR等编辑。与儿童疫苗相关的不良事件;与因果关系有关的证据。华盛顿特区:国家学院出版社。1994.第67-117页。
5 Braun MM .美国公共卫生服务研讨会关于百日咳免疫接种后低渗低反应性发作(HHE)的报告。儿科1998;102(5)1-5.
6 Rothstein EP,等。三种b型流感嗜血杆菌结合疫苗免疫后抗遗尿症的比较。儿科传染病杂志1991;10:311-4.
斯坦纳大道7号。白喉毒素的产生。编辑:Manclark CR。关于世界卫生组织对白喉、破伤风、百日咳和联合疫苗需求的非正式磋商会议记录。马里兰州DHHS贝塞斯达美国公共卫生局91-1174。1991.第7-11页。
宾夕法尼亚州米勒JH 8号。影响破伤风毒素产生的可变因素。J Bacteriol 195467(3):271-7.
9 Stainer DW等。一种用于生产1期百日咳博德特氏菌的简单化学成分确定的培养基。<微生物学杂志> 1971年;63:211-20.
10 van Wezel等。灭活脊髓灰质炎疫苗:目前的生产方法和新发展。Rev Infect Dis 19846(补编2):S335-40。
11蒙塔尼翁·BJ等。通过在微载体上培养vero细胞制备灭活脊髓灰质炎病毒疫苗的工业规模生产。Rev Infect Dis 19846(补编2):S341-4。
12 Chu CY等。关于b型流感嗜血杆菌和肺炎球菌型6A多糖-蛋白结合物免疫原性的进一步研究。传染免疫1983;40:245-56.
13米勒·JH等在可复制培养基上生产高效白喉毒素(100 Lf)。免疫学杂志1941年;40:21-32.
14美国食品药品监督管理局卫生与公众服务部。生物制品;细菌疫苗和类毒素;实施疗效审查;提议的规则。1985年联邦公报;50(240):51002-117.
15 Vitek CR,Wharton M .白喉类毒素载于:Plotkin SA、Orenstein WA、Offit PA编辑。疫苗。第五版。宾夕法尼亚州费城:W. B .桑德斯;2008.第139-56页。
16瓦西拉克·SGF等。破伤风类毒素。载于:Plotkin SA、Orenstein WA、Offit PA编辑。疫苗。第五版。宾夕法尼亚州费城:W.B .桑德斯;2008.第805-39页。
17 Sutter RW等定义关于预测的替代血清学试验
保护性疫苗效力:脊髓灰质炎病毒疫苗接种。载于:Williams JC等人编辑的。联合疫苗和同时接种。当前问题和
视角。纽约:纽约科学院。1995:289-99.
18 Robbins JB等。定量测定“天然”和免疫诱导的b型流感嗜血杆菌荚膜多糖抗体。儿科研究1973年;7:103-10.
19 Peltola H,et al.<儿童b型流感嗜血杆菌荚膜多糖疫苗:对芬兰100,000名3月龄至5岁疫苗接种者的双盲现场研究> 。儿科1977年;60:730-7.
20 Kayhty H等。b型流感嗜血杆菌荚膜多糖血清抗体的保护水平。感染疾病杂志1983;147:1100.
21 Anderson P型流感嗜血杆菌荚膜多糖血清抗体的保护水平。J Infect Dis 1984149:1034.22 VAXELIS【完整处方信息】。多伦多:MSP疫苗公司。
16如何供应/储存和搬运
16.1供货方式
Pentacel的DTaP-IPV和ActHIB疫苗成分的瓶塞不是由天然橡胶乳胶制成的。
5剂包装(NDC编号49281-510-05)包含5瓶DTaP-IPV成分(NDC编号49281-560-05),用于复溶5瓶单剂量冻干的ActHIB疫苗成分(NDC编号49281-548-58)。
16.2储存和搬运
潘太欣应储存在2℃至8℃(35℉至46℉)的环境中。不要冻结。不要使用已经冷冻的产品。不要在标签上显示的过期日期后使用。
潘太欣应在复溶后立即使用。
17患者咨询信息
在施用Pentacel之前,卫生保健人员应告知父母或监护人疫苗的益处和风险以及完成免疫接种系列的重要性,除非存在进一步免疫接种的禁忌症。
医疗保健提供者应告知父母或监护人与Pentacel或其他含有类似成分的疫苗暂时相关的潜在不良反应。卫生保健提供者应提供疫苗信息声明(VIS),这是1986年国家儿童疫苗伤害法案要求在每次免疫接种时提供的。应指示家长或监护人向其医疗保健提供者报告不良反应。
制造商:
赛诺菲巴斯德有限公司
加拿大安大略省多伦多
和赛诺菲巴斯德有限公司
Marcy L‘etoile France
分发人:
赛诺菲巴斯德公司。
美国宾夕法尼亚州斯威夫特沃特18370
Pentacel是赛诺菲及其附属公司和子公司的注册商标。
r10-xx22美国
Hits: 829
