CDC Guidance for Evaluating Health-Care Personnel for Hepatitis B Virus Protection and for Administering Postexposure Management
建议和报告
December 20, 2013 / 62(RR10);1-19
对应编制人:Sarah Schillie,医学博士,美国疾病预防控制中心国家艾滋病毒/艾滋病、病毒性肝炎、性病和结核病预防中心病毒性肝炎部。电话:404-718-8608;电子邮件:sschillie@cdc.gov.
摘要
该报告包含CDC指南,该指南补充了免疫实践咨询委员会(ACIP)2011年关于评估卫生保健人员(HCP)的乙型肝炎防护和实施暴露后预防的建议。为在卫生保健机构工作、培训或志愿服务的人员提供了明确的指导,这些人员在受雇或入学前几年就已经接种了乙型肝炎(HepB)疫苗(例如,当HepB疫苗接种作为常规婴儿[自1991年以来推荐]或青少年补种[自1995年以来推荐]疫苗接种的一部分时)。
在美国,2011年向CDC报告了2,890例急性乙型肝炎病例,在考虑病例漏报和无症状感染后,估计有18,800例新的乙型肝炎病例发生。尽管急性乙型肝炎病毒(HBV)感染率在1990-2011年间下降了约89%,从美国每10万人口中的8.5例降至0.9例,但在HCP,职业获得性HBV的风险仍然存在,主要来自与慢性HBV感染患者的接触。
ACIP建议未接种或未完全接种HCP疫苗的人接种HepB疫苗,这些人有合理预期的血液或体液暴露风险。ACIP还建议接种HCP疫苗的人在接种最后一剂疫苗后1-2个月接受疫苗后血清学检测(乙肝表面抗原抗体[抗-HBs])(CDC。保健人员的免疫接种:免疫接种实践咨询委员会的建议[ACIP]。MMWR 2011;60[编号RR-7])。越来越多的HCP人在婴儿时期(从1991年开始推荐)或青少年时期(从1995年开始推荐)接受常规HepB疫苗接种。HepB疫苗接种导致大约95%的健康足月儿产生保护性抗-HBs反应。某些机构通过在雇用或入学时测量抗-HBs来测试接种的HCP,即使抗-HBs测试发生在接种后超过2个月。该指南可以帮助临床医生、职业健康和学生健康提供者、感染控制专家、医院和卫生保健培训项目管理者以及其他人选择一种方法来评估接种HCP疫苗的HBV保护作用。该报告强调了在全HCP接种HepB疫苗的重要性,为评估以前接种过疫苗的HCP人(特别是那些在婴儿或青少年时期接种疫苗的人)的乙型肝炎保护提供了明确的指导,并阐明了对暴露于血液或体液的HCP的暴露后管理的建议。
介绍
乙型肝炎病毒(HBV)长期以来被认为是卫生保健人员(HCP)的一种职业风险,包括HCP受训人员(1,2)。该病毒在环境表面上长时间保持传染性,并且在没有可见血液(1)。HCP不承认对潜在传染性血液或体液的所有暴露(2)并且,即使暴露是已知的,通常也不寻求暴露后的预防性管理(3)。在20世纪70年代在美国进行的血清学研究中,HCP的HBV感染流行率比普通人群高大约10倍(1)。1983年,在HCP(4)。
预防HBV的疫苗于1981年在美国上市,并于1982年由免疫实践咨询委员会(ACIP)推荐给HCP(5)。尽管临床试验中高比例的健康疫苗接受者对乙型肝炎(HepB)疫苗接种有应答,但应答者的比例在一般人群中可能较低,特别是在患有慢性疾病的人群中(6,7)。急性和慢性HBV感染在对HepB疫苗接种有反应的HCP人中很少见,但对疫苗接种无反应的HCP人被认为仍然易感。疫苗接种后乙型肝炎表面抗原抗体(抗-HBs)的血清学检测可识别疫苗无应答者,并指导是否需要再次接种、对慢性HBV感染进行额外检测,以及对疫苗接种无应答后仍然易感的HCP进行咨询。
1991年,ACIP建议考虑对有针刺暴露风险的HCP人进行疫苗接种后抗-HBs血清学检测(8)。在1997年,ACIP建议在HepB疫苗系列完成后1-2个月对与患者或血液有接触的HCP人以及有被尖锐器具或针刺伤害的持续风险的人进行疫苗接种后血清学检测(9)。自1982年(HepB疫苗被推荐用于HCP)以来,HCP急性乙型肝炎的报告大幅下降(10)。2011年,ACIP重申,未接种疫苗和未完全接种疫苗的HCP在合理预期的血液或体液暴露风险下,应在潜在暴露前接受HepB疫苗接种,暴露风险高的HCP应在疫苗系列完成后1-2个月接受疫苗接种后血清学检测(11)。
该报告为在医疗机构工作、培训或志愿服务的人员提供了CDC指南,这些人员记录了在受雇或入学前数年接受的HepB疫苗接种(例如,当HepB疫苗接种作为常规婴儿[自1991年以来推荐]或青少年补种[自1995年以来推荐]疫苗接种的一部分时)。常规婴儿或青少年HepB疫苗接种后,不建议进行疫苗接种后血清学检测。尽管自从美国引入HepB疫苗接种以来,急性HBV感染已大幅下降,但职业暴露于HBV的风险仍然存在(10),主要来自慢性HBV病毒感染者。因为疫苗诱导的抗-HBs随着时间的推移而减弱,在接种疫苗数年后检测HCP的抗-HBs可能无法区分疫苗无应答者和应答者。在雇用或入学时对当前或过去的抗-HBs结果进行暴露前评估,然后在必要时对抗-HBs <10 mIU/mL的HCP人进行一次或多次额外剂量的HepB疫苗接种,有助于确保HCP在暴露于含HBV的血液或体液时受到保护。
由CDC召集的专家小组承认,接种疫苗的HCP感染HBV病毒的风险可能因环境和职业而有很大差异,在某些环境中可能足够低,以至于在暴露于潜在传染性血液或体液时可以进行抗-HBs状态的评估和适当的随访。该方法依赖于HCP对血液和体液暴露的识别和报告,因此可以在记录的低风险、实施和成本考虑的基础上应用。某些HCP职业的职业性血液和体液暴露风险较低(例如,涉及咨询和执行程序的职业),非受训人员的血液和体液暴露风险低于受训人员。与其他环境相比,一些环境中接受服务的患者人群的HBV感染率较低,这将影响HCP暴露于乙型肝炎表面抗原(HBsAg)阳性血液和体液的风险。所有卫生保健机构应确保HCP接受识别和报告暴露的培训,建立便于报告和暴露后评估的系统,并提供预防措施以便及时用药。这份报告可以指导临床医生、职业健康和学生健康临床医生、感染控制专家、医院和卫生保健培训项目管理者以及其他人选择一种方法来评估接种HCP疫苗后的HBV保护作用。
医疗保健专业人员是指所有有偿和无偿提供医疗保健,或在医疗保健机构工作或培训的人员,他们有合理的预期暴露于传染性物质的风险,包括血液或体液、受污染的医疗用品和设备,或受污染的环境表面。HCP可能包括但不限于医师、护士、护理助理、执业护士、医师助理、治疗师、技术人员、紧急医疗服务人员、牙科人员、药剂师、实验室人员、尸检人员、卫生保健学生和实习生、卫生保健机构未雇佣的合同工,以及不直接参与患者护理但可能暴露于可在患者和HCP之间传播的传染性病原体的人员(例如,家政、洗衣、保安、维护和志愿者) (1,11)。
本指南适用于但不限于急症医院、长期护理机构(如疗养院、专业护理机构和辅助生活机构)、医师办公室、牙科诊所、康复中心、急救中心、门诊手术中心、透析中心和门诊诊所的HCP,以及提供家庭保健和急救医疗服务的人员。尽管本指南适用于HCP,但同样的原则可能适用于其他职业中有合理预期的血液或体液暴露风险的人员(如公共安全工作者、防腐人员和犯罪现场清理人员)。
关于在入学或就业前对有感染HBV病毒风险的特定人群进行HCP检测的建议可在其他地方找到,本文仅对其进行简要回顾(11–13)。HCP针对丙型肝炎病毒(HCV)、人类免疫缺陷病毒(HIV)和其他感染的保障也在其他地方承保(1,11,14)。疫苗接种后血清学检测以及免疫功能低下的HCP患者(如正在接受透析治疗的HCP患者、感染了HIV病毒的患者、接受造血干细胞移植的患者以及正在接受化疗的患者)的复种需求在单独的建议中进行了阐述(15)。关于HCP慢性HBV感染管理的补充指南已经发布(13)。提供了常用缩写的列表(盒子)。
本指南中提供的新信息或更新信息
本文件研究了评估接种HCP疫苗的HBV保护的方法,并为HCP的暴露后评估和检测提供了额外的指导,考虑到:
- 美国HBV感染的流行病学变化
- 自从引入工程和工作实践控制以及2001年针刺安全和预防法案以来,职业性血液或体液暴露的风险
- 血液或体液暴露的HCP报告
- HCP HepB疫苗接种覆盖率
- 接种疫苗后间隔一段时间检测到抗-HBs的成人比例估计值
- 疫苗诱导保护的持续时间
- 当前疫苗接种和疫苗接种后血清学检测实践
- HCP HBV保护评估方法的成本效益
- 实施暴露后管理的建议。
方法
2012年,疾病预防控制中心确定并召集了HBV感染、卫生保健流行病学和循证医学领域的主题专家,成立了一个专家小组,以解决评估接种疫苗后HBV保护的机制问题HCP。*专家小组由来自学术医学(如儿科、家庭医学、内科和传染病)和职业健康的专业人员组成;具有肝炎和保健相关感染专业知识的联邦和州公共卫生专业人员;以及来自美国卫生保健流行病学协会(SHEA)、卫生保健感染控制实践咨询委员会(HICPAC)、美国医学主任协会(AMDA)、美国大学健康协会(ACHA)、美国家庭医师学会(AAFP)和青少年健康和医学协会(SAHM)的联络人。专家组在2012年1月19日至2013年1月8日期间召开了21次电话会议进行审议。用于电话会议讨论的材料以电子方式分发给成员。
专家小组审查了通过PubMed搜索、引用和个人档案确定的相关出版文献。对参考列表进行了审查,以检索额外的相关信息。专家小组考虑了监测报告中不断变化的乙型肝炎感染流行病学,包括跟进州卫生部门,以获得2005-2010年期间报告有阳性或未知HepB疫苗接种史的HCP急性乙型肝炎的更多信息。专家组审查了ACIP、HICPAC和美国公共卫生服务局之前的建议;包括定义HCP职业暴露、HepB疫苗接种和疫苗接种后血清学检测风险的建议。该小组还审查了暴露后预防(1,5,9,11,13,15,16),以及对医疗机构进行的关于当前做法的电子调查结果(见HCP乙肝疫苗接种和疫苗接种后检测)。在制定这些准则的过程中,征求了专家小组各成员的意见,以解决问题。专家小组电话会议期间讨论的发言中也总结了证据。
专家组根据专家意见确定了两种评估接种HCP疫苗后HBV保护作用的方法,这两种方法构成了本指南的基础。专家小组成员通过电话会议以个人或集体的形式仔细审查了由疾病预防控制中心制定的早期指南草案。在起草这些建议的过程中提供投入的人员的姓名和所属机构包含在本文件的开头和致谢部分。
HBV感染的流行病学变化
乙型肝炎是国家报告疾病(17)。在美国,2011年向CDC报告了2,890例急性乙型肝炎病例,在考虑了病例漏报和无症状感染(图1) (10)。在报告有急性乙型肝炎病例的患者中,约55%住院,1.3%死于乙型肝炎(10)。在90%的婴儿、30%的5岁以下儿童和< 1%–12%的成人中,急性HBV感染会变成慢性(18)。大约25%在儿童期被慢性感染的人和15%在儿童期后被慢性感染的人过早死于肝硬化或肝癌(1,15)。据估计,美国有80万到140万人患有慢性HBV感染;这些人是HBV的主要储藏库(12)。与急性乙型肝炎报告的下降相反,通常无症状的慢性HBV的患病率保持相对稳定(图2) (19)在2005-2010年期间,每100,000人中有3人死亡(95%置信区间=每100,000人中有2-5人死亡),死亡证明登记的死亡人数(20)。
1991年实施了消除HBV病毒传播的国家战略(16)。一个关键的组成部分是建议对婴儿进行常规疫苗接种(16)。因此,在1990年至2011年期间,美国新报告的急性HBV感染率下降了约89%,从每10万人口8.5例降至0.9例(10,11)。年龄≤19岁的人群发病率最低(每100,000人中0.04例)10),人群在婴儿和青少年时常规接种疫苗。尽管2011年HepB疫苗在婴儿、儿童和青少年中的覆盖率较高(19-35个月的儿童中为91.1%,13-17岁的青少年中为92.3%)(21,22),自报≥3剂的成人覆盖率仍然相当低(2011年19-49岁的成人为35.9%)(23)。
HBV暴露和暴露报告的职业风险
在所有体液中,HBV感染者的血液含有最高的HBV滴度,并且是卫生保健环境中最重要的传播媒介(1)。下列体液也被认为具有潜在的传染性:脑脊液、滑液、胸膜液、腹膜液、心包液和羊水(1)。尽管有研究证明唾液和眼泪中含有HBV病毒,但这些体液通常不会造成HBV感染的职业风险,除非它们含有血液(1)。精液和阴道分泌物与HBV病毒的性传播有关,但与从患者到HCP的职业传播无关(1)。HBsAg的存在,通常是活动性HBV感染的指标,也在其他体液中发现(如母乳、胆汁、粪便、鼻咽洗液和汗液)。然而,大多数体液不是有效的传播媒介(除非它们含有血液),因为它们含有少量的传染性HBV(1)。痰、尿和呕吐物不被认为具有潜在传染性,除非它们含有血液(1)。
HBV具有高度传染性,可以在没有可见血液的情况下传播(1),并在环境表面保持传染性至少7天(24)。HBV通过经皮(即针刺)、粘膜(即直接接触粘膜)或非接触皮肤(如银屑病、湿疹、烧伤、创伤、割伤和擦伤)接触传染性血液或体液传播。尽管经皮接触是最有效的HBV传播方式之一,但这些接触可能仅占HCP HBV感染的一小部分。在对HBV疫情的几项调查中,大多数受感染的HCP人不记得有过明显的经皮接触(2,25)。
乙型肝炎e抗原(HBeAg)是高HBV复制和病毒载量(15)。尽管检测职业暴露源患者的HBeAg不可行,也不推荐,但在职业暴露于HBeAg阳性源患者的血液或体液时,感染HBV病毒的风险特别高(4)。在对因被含有HBV的血液污染的针头而受伤的HCP人进行的研究中,如果血液中HBsAg阳性和HBeAg阳性,发生临床肝炎的风险为22%-31%;出现HBV感染血清学证据的风险为37%-62%(1,26)。相比之下,被HBsAg阳性、HBeAg阴性血液污染的针头导致临床肝炎的风险为1%-6%,出现HBV感染血清学证据的风险为23%-37%(1,26)。
《2001年针刺安全和预防法案》指导职业安全和健康管理局(OSHA)修订血源性病原体的职业暴露标准,并为雇主建立了关于识别和使用有效和更安全的医疗设备(27)。此后,经皮伤害从1999年的每100张病床39.6起降至2011年的每100张病床19.5起(图3) (28)。自2002年以来的数据表明,18%的HCP受训人员每年都要接受经皮暴露,54%的经皮暴露被报告给职业健康部(3,29–32)。不愿意报告职业健康暴露可能是因为害怕被斥责、担心保密以及认为报告可能很耗时(29,31)。受训者粘膜暴露的年风险为22%,其中17%报告给职业健康部(3,29–32)。非受培训者的暴露风险通常较低,并因职业和工作职责而异(32,33)。监测数据表明,护士和医生分别占报告经皮暴露的HCP的41.9%和22.8%(28)。导致暴露的尖锐物品在30.5%的暴露中用于肌肉或皮下注射,在18.7%的暴露中用于缝合(28)。在报告粘膜暴露的HCP中,医科学生占44.3%(28)。
HCP受训人员感染HBV病毒的概率因源患者的HBsAg阳性率和评估方法而异(图4)。2000-2012年期间的暴露日志代表了美国三个医疗保健系统的7170次暴露,表明0.9%的源患者为HBsAg阳性(34)。这一数字可能因环境不同而有很大差异;在一些针对高危人群的社区筛查项目中,11%-25%的被筛查者感染了HBV病毒(35)。
源患者在大约95%的暴露中是可识别的(28)。在暴露于从处置容器伸出的物品、在不适当的容器中处置的物品、或留在不适当的地方的物品(28)。
接种疫苗
HepB疫苗
HepB疫苗可作为单一抗原制剂使用,也可与其他疫苗(表1) (15)。在美国有两种单抗原重组HBsAg疫苗:Recombivax HB (Merck and Co,Inc .,Whitehouse Station,NJ)和Engerix-B(GlaxoSmithKline Biologicals,Rixensart,比利时) (15)。在三种许可的联合疫苗中,一种(twin rix[葛兰素史克生物制品])适用于18岁以上的人群。Twinrix含有重组HBsAg和灭活的甲型肝炎病毒(15)。
成人的初次HepB疫苗接种通常包括3剂10或20剂µ在0个月、1个月和6个月的时间表中向三角肌内肌内施用1g重组HBsAg蛋白(15)。替代方案(包括0、1、2和12个月的4剂方案)经美国批准用于特定年龄和疫苗配方的常规疫苗接种;根据这些方案接种疫苗引发的最终血清保护率与0、1和6个月方案获得的相似(15)。肥胖者可能需要调整用于施用HepB疫苗的针头长度以实现最佳的血清保护(11,15)。
疫苗安全
HepB疫苗已被证明对所有年龄组的人都是安全的(15)。在1982-2004年间,美国估计有7000万青少年和成人接种了≥1剂HepB疫苗(15)。最常报告的副作用是注射部位疼痛(3%–29%)和温度> 99.9°F(> 37.7°C)(1%–6%)(15)。在安慰剂对照研究中,这些副作用在接受HepB疫苗的人群中并不比在接受安慰剂的人群中报告的更频繁(15)。对无应答者给予额外的疫苗剂量与不良事件的增加无关(36)。
医学研究所对27起不良事件进行的流行病学和机械学评估支持了与HepB疫苗接种的因果关系,仅针对对酵母过敏的人群(37)。对酵母或任何疫苗成分过敏史的人禁用HepB疫苗(15)。接受HepB疫苗后有严重不良事件(如过敏反应)史的人不应接受额外剂量。与其他疫苗一样,患有中度或重度急性疾病(无论是否发烧)的人的疫苗接种应推迟到疾病缓解后进行(15)。患有多发性硬化症、格林-巴利综合征、自身免疫性疾病(如系统性红斑狼疮和类风湿性关节炎)或其他慢性疾病(15)。HepB疫苗不禁止孕妇(15,38,39)或泌乳(1)女人。可用的疫苗含有非感染性HBsAg,不会对胎儿造成感染风险(15)。
疫苗血清保护
在接受完整的≥3剂HepB疫苗系列后1-2个月,免疫活性成人和儿童的疫苗诱导抗-HBs水平≥10 mIU/mL,被视为受血清保护的疫苗应答者(15)。疫苗效力研究表明,免疫活性疫苗应答者可预防急性和慢性疾病(40,41)。疫苗诱导的血清保护是疫苗效力的有用替代物(42)。大约95%的健康婴儿获得了疫苗接种后血清保护(43,44),大约92%的HCP人年龄小于40岁,大约84%的HCP人年龄≥40岁(6)。在出生时接种疫苗的婴儿中,低出生体重与获得血清保护的婴儿比例较低有关(45)。在成人接种疫苗的人群中,吸烟、肥胖、衰老、慢性疾病、男性、遗传因素和免疫抑制与血清保护比例的降低有关(6,11,36,46–48)。虽然免疫缺陷者的免疫原性较低,但那些在暴露于HBV前达到并维持血清保护性抗体水平的人具有高水平的保护(15)。
疫苗诱导抗体的持久性
接种疫苗后抗-HBs水平随时间下降。可检测到的抗-HBs水平的持久性因接种疫苗时的年龄而异。在接种疫苗后18年,大约16%在1岁以下接种疫苗的人的可检测抗体水平≥10 mIU/mL(49–54) (图5),相比之下,年龄≥1岁的疫苗接种者为74%(41,54–62)。在一项对入学健康科学学生的研究中,接种过3剂HepB疫苗的人中有92.9%具有抗-HBs ≥10 mIU/mL(58)。接受第一系列疫苗接种的中位年龄为14.5岁(四分位数范围:11.6-20.2岁),接种后测试的中位年龄为23.2岁(四分位数范围:22.1-24.8岁) (58)。
对疫苗攻击剂量的反应
为了评估远程接种的HCP的疫苗应答,可以使用HepB疫苗的攻击剂量,通过产生回忆性应答来确定疫苗诱导的免疫记忆的存在。术语“加强剂量”是指在一系列初次疫苗接种后施用的HepB疫苗的剂量,以提供针对显著感染(即,导致HBV血清学试验结果阳性和/或临床显著疾病的感染)的快速保护性免疫(40)。在5.9-17.5年前接种疫苗的1岁以下人群中,抗-HBs水平< 10 mIU/mL的人群中,约60.0%-97.4%的人对HepB疫苗的单次攻击剂量有反应,表明抗-HBs的保护水平≥10 mIU/mL(50–54)。在9-22年前接种疫苗且年龄≥1岁且抗-HBs水平< 10 mIU/mL的人群中,69.2%-96.4%的人对单次HepB疫苗攻击剂量有反应,表明抗-HBs保护水平≥10 mIU/mL(41,54,60,62)。接受初级HepB系列试验的人群和年龄不同,激发剂量的应答者比例也不同。无论抗-HBs未来是否下降,攻毒剂量后反应≥10 mIU/mL的HCP被视为受保护。关于挑战剂量反应的结论是在相对较少的研究基础上得出的,可能会随着更多数据的获得而改变。
应答者中疫苗保护的持续时间
在具有免疫活性的HepB疫苗应答者中,研究表明对急性症状性和慢性乙型肝炎感染的保护作用持续≥22年(9,15,40)。三项对1006名受试者进行了20年以上监测的队列研究提供了大量信息(41,63,64)。在来自HBV高流行地区的两个队列中,在513名(109名和404名)受试者中,分别有0.8% (0和1.0%)的受试者记录了新的慢性HBV感染,这些受试者在出生时就对HepB疫苗接种有反应或可能有反应(63,64)。大约20%的受试者有抗-HBs自然增强的证据,推测是由于暴露于HBV(63,64)。第三组493名受试者来自HBV中度流行地区,年龄在6个月至≥50岁之间,接受了HepB疫苗接种(41)。在疫苗应答者中,没有检测到急性或慢性HBV,尽管1%的受试者在≥20年的随访中经历了亚临床HBV感染而没有慢性感染(41)。没有慢性HBV和短暂HBV感染的亚临床突破性HBV感染的意义是未知的。
HCP HepB疫苗接种和接种后检测
OSHA于1991年发布的血源性病原体标准规定,对于有理由预期皮肤、眼睛、粘膜或肠胃外接触血液或其他潜在传染性物质(可能因员工履行职责而产生)的员工,应由雇主出资提供HepB疫苗(27)。通过2011年全国健康访谈调查(NHIS)获得的HepB疫苗接种覆盖率数据表明,在年龄≥19岁的HCP人中,3剂疫苗的覆盖率为63.8%(23)。NHIS 2010年的数据表明,与患者直接接触的HCP≥3剂的覆盖率为74%,与患者无直接接触的HCP为46%65),大大低于健康人2020 HCP HepB疫苗接种覆盖率达到90%的目标(IID目标15.3)(66)。
对于有职业经皮或粘膜暴露风险的HCP,建议在最后一剂疫苗后1-2个月进行疫苗接种后抗-HBs血清学检测(11)。2012年期间,对389家加州急症护理医院或由一家以上医院组成的中心进行了一项调查,以评估当前确保HCP免受HBV感染的做法。从包含580名感染预防和员工保健人员(67)。从约39%的医院(67)。参与调查的医院并不代表美国的所有医院(67)。在153家接受调查的医院中,大多数(92家[60.1%])是非政府非营利性社区医院,其次是投资者拥有的(营利性)社区医院(32家[20.9%]),以及州和地方政府社区医院(13家[8.5%])(67)。四分之一(37所[24.2%])是教学医院(67)。参与调查的医院有35到15,421例(中位数:1,000) HCP,具有合理的血液或体液暴露预期风险(67)。大多数受访者(71.9%)表示,他们机构目前的做法包括在暴露前基础上测量抗-HBs,如果抗-HBs < 10 mIU/mL,则进行HepB疫苗接种(67)。较小比例的受访者(15.7%)表示他们的机构遵循依赖于暴露后管理的方法(67)。在这些机构中,大约69%的HCP人的接种后抗-HBs结果是已知的(67)。
疫苗无应答复种
在初次接种后,接种≥1剂无应答HepB疫苗可增加获得疫苗诱导血清保护的人群比例(15)。在178名有HBV感染职业风险的人群中,47%的人在首次接种一系列疫苗后没有保护性抗体水平,在额外接种一剂HepB疫苗后产生了疫苗诱导的血清保护(6)。在第一次再接种剂量后没有保护性抗-HBs水平的86名患者中,估计有42%的人在接受了2次额外剂量后产生了保护性抗-HBs水平,这表示在3次再接种剂量后初始无应答者中的累积应答率为69%6)。在初始系列后具有可测量的但低水平(即1-9 mIU/mL)的抗-HBs的人比没有可测量的抗-HBs的人对再接种有更好的反应(36,62,68,69)。
未证明较高剂量的单剂量复种会增加健康成人无应答者的比例(70,71)或作为临床试验的一部分重新接种疫苗的先前应答者(62)获得疫苗诱导血清保护。然而,较高剂量的3剂再接种(40µg)在一项研究中确实提高了无应答者达到抗-HBs水平≥10 mIU/mL的比例(17名接受40µg剂量与接受10g剂量的18人中的62.5%相比µg剂量,p = 0.015,费希尔精确检验) (70)。不建议接种超过3剂(即超过6剂)的疫苗(11)。
接种和未接种HCP疫苗人群中的HBV感染
从1983年到2010年,HCP的HBV感染人数下降了约98%,从估计的17,000例感染降至263例急性HBV感染(考虑到43.6%的病例评估了职业史,并使用10.5的校正系数来解释漏报和无症状感染) (10)。HCP急性HBV感染的减少可能是由于常规的暴露前HepB疫苗接种和通过改善感染控制实践降低暴露风险(28,72,73)。
尽管很少有研究评估急性乙型肝炎患者的疫苗接种史(74),在未接种疫苗者和疫苗无应答者中可能会出现一些急性乙型肝炎和慢性HBV病毒感染病例。在2005-2010年期间,HCP共有203例急性乙型肝炎病例报告给CDC的国家法定传染病监测系统(NNDSS)(75)。17名具有慢性HBV感染发展信息的患者中有6名发展为慢性HBV感染(75)。对最初报告有阳性或未知HepB疫苗接种史的88名HCP中的67名(76.1%)进行的随访表明,35名HCP报告接种了≥3剂HepB疫苗(7名有文件支持报告的疫苗接种史) (75)。在报告接种≥3剂HepB疫苗的35名HCP中,1名HCP表现出免疫应答(即抗-HBs≥10 mlU/mL);其余34名为无应答者或应答状态未知(75)。8名HCP患者中有4名在接种≥3剂HepB疫苗后出现慢性HBV感染;这四人都没有≥3剂HepB疫苗的完整记录(75)。七名有≥3剂HepB疫苗记录的医护专业人员中,只有一名接受了疫苗接种后血清学检测;该HCP在4剂疫苗后抗-HBs水平< 10 mIU/mL(75)。
尽管报告的数据无法确定传播方式或接受暴露后预防的信息,但在168名可获得数据的HCP中,有28名(16.7%)报告了在患病前6周到6个月期间被针头或其他被血液污染的物体意外刺伤或刺伤,这可能代表职业性感染(75)。未被识别的暴露可能导致未报告暴露的HCP人感染HBV病毒(2)。在203名HCP患者中,有121人(59.6%)在患病前6周至6个月期间暴露于HBV病毒的其他风险因素(即,注射毒品、男男性行为者、多个性伙伴、接触乙肝病例、透析患者、接受输血、手术、针灸和纹身收据),这可能表明他们的暴露不是职业性的(75)。
管理HCP疫苗接种和血清学检测结果
免疫信息系统(IIS)提供统一的疫苗接种历史,供疫苗接种提供者在确定适当的疫苗接种时使用(76)。访问IIS获取疫苗接种记录可能会减少不再有HepB疫苗接种记录的HCP人不必要的再接种。IIS不接受疫苗接种后的抗-HBs测试结果(77)。当HCP被不同的医疗机构雇用时,为了减少重复抗-HBs检测的费用和不便,CDC建议机构考虑抗-HBs和其他乙型肝炎血清学检测结果的长期管理系统。卫生信息技术产品中跟踪疫苗接种和乙型肝炎血清学检测结果的机制也可以减少重复抗-HBs检测的成本和不便。
暴露于HBV的医护人员的被动预防
乙型肝炎免疫球蛋白
乙型肝炎免疫球蛋白(HBIG)提供被动抗HBs和临时(即3-6个月)保护(15)。HBIG是从已知含有高滴度抗-HBs的人血浆中制备的。HBIG通常与HepB疫苗一起用于暴露后预防(15)。对于对HepB疫苗没有反应的人,单独施用HBIG是接触HBV后的主要保护方法(15)。HBIG的标准成人剂量为0.06毫升/千克。HBIG通过肌肉注射给药;应该选择合适的肌肉块(即三角肌或臀肌)来输送所需的大量HBIG,并且应该使用适合HCP大小的针长度。HBIG可与HepB疫苗同时注射,但注射部位不同(15)。
安全
从制备HBIG的血浆中筛选HBsAg、HCV和HIV(15)。用于制备HBIG的过程使最终产品中的HBV病毒、丙肝病毒和艾滋病病毒失活。没有证据表明HBV病毒、丙型肝炎病毒或艾滋病毒曾经通过HBIG传播,塔尔在美国可以买到(15)。
当按照建议给药时,HBIG引起的严重不良反应是罕见的(1)。可能出现注射部位的局部疼痛和压痛、荨麻疹和血管性水肿;过敏反应虽然罕见,但在注射人免疫球蛋白(IG)制剂(1)。HBIG不是孕妇的禁忌(1,78)或哺乳期妇女(1)。
功效
前瞻性研究评估了HBIG和HepB疫苗在不同暴露后环境中的有效性。对于围产期暴露于HBsAg和HBeAg均阳性的母亲,结合HBIG和出生时开始HepB疫苗系列的方案在预防HBV感染方面有85%-95%的有效性(79,80)。当在暴露后不久进行给药时,包括多剂量HBIG单独给药或HepB疫苗系列单独给药的方案在预防HBV感染方面有70%-75%的有效性(81)。在职业环境中,在经皮接触HBsAg阳性血液后1周内开始多剂量的HBIG提供了约75%的HBV感染保护(82–86)。服用HBIG可能会延长感染HBV病毒的人的潜伏期(82,85,87,88)。尚未在职业环境中评估HBIG和HepB疫苗系列联合用药或HBIG单独用药的暴露后疗效比较(1)。与单用HBIG相比,在围产期观察到的HepB疫苗中加入HBIG后的增效作用是否适用于职业暴露的成年人仍然未知。
成本效益考虑
为了检验评估HCP乙型肝炎防护的各种策略的成本效益,开发了两个经济模型来计算每质量调整生命年(QALY)节省的增量成本。一个模型代表了一种方法,其中在暴露前的基础上测量抗-HBs,抗-HBs <10 mIU/mL的HCP接受额外剂量的HepB疫苗,然后重复抗-HBs测量。如果在第一次再接种剂量后抗-HBs仍然< 10 mIU/mL,HCP接受两次额外的HepB疫苗再接种剂量,随后重复抗-HBs测量。另一个模型代表了一种暴露后管理方法;在暴露时,对HCP进行抗-HBs检测,同时对源患者进行HBsAg检测,并根据这些结果进行暴露后预防。对两个模型的结果进行了比较。使用决策树分析来结合所有参数并计算总干预成本和感染概率。此外,HBV感染相关成本和QALY损失(考虑急性和无症状感染以及6%的慢性感染概率)通过现有模型确定(89)并被认为是HCP的余生。干预时间框架包括一年的分析和一个涵盖长达10年暴露的多年分析。使用了3%的年贴现率,所有最终成本数字都使用医疗消费价格指数转换为2010年美元。
基线成本效益模型假设,不管是否存在可检测到的抗-HBs抗体,95%的HCP人在接种≥3剂HepB疫苗系列后获得了初始和持续的抗HBV病毒感染保护。95%的保护率来源于年龄< 40岁的人群比例,包括在一系列初次疫苗接种后不久可测量的抗-HBs ≥10 mIU/mL的足月新生儿。接种疫苗后大约18-25年,大约20%的HCP人(1岁以下接种)或大约80%的HCP人(1岁以上接种)保持抗-HBs ≥10 mIU/mL。该模型没有考虑未识别的暴露,因为未识别的暴露的概率数据不可用,或者HCP存在的次优疫苗覆盖率。
对于暴露前抗-HBs检测以及随后的复种和再检测(如有必要),与什么都不做相比,第一年受训者每QALY节省的增量成本为4,542,467美元,非受训者为3,149,183美元,10年后分别降至893,619美元和796,140美元。这种方法预计将使受训者和非受训者分别获得3.7次和1.6次职业健康咨询。受训者和非受训者的预期感染人数分别为每100,000人0.7例和每100,000人0.4例。对于依赖暴露后管理的方法,与什么都不做相比,第一年受训者和非受训者每QALY节约的增量成本分别为2,270,801美元和1,610,998美元,10年后分别降至917,859美元和1,114,364美元。受训者和非受训者的预期感染人数分别为每100,000人中3.0人和每100,000人中1.7人。尽管依赖于暴露后管理的方法可能比许多机构最初节省的每QALY成本更低,但随着时间的推移,暴露前抗-HBs检测以及可能的再次接种比暴露后方法更具成本效益。
敏感性分析表明,在HBsAg阳性源患者比例较高的环境中,以及在暴露风险较高的HCP中(如外科医生),成本效益有所提高。随着新的抗病毒药物可用于治疗HBV病毒感染,成本效益可能会发生变化。与什么都不做相比,对以前未接种疫苗的HCP受训者进行疫苗接种,然后进行疫苗接种后血清学检测,第一年每QALY节省的增量成本为374,646美元,10年后为51,537美元,这包括医疗保健系统的直接成本和乙型肝炎相关疾病和并发症的直接医疗成本。
推荐
暴露前管理
教育和基础设施
在雇用或录取时,医疗保健提供者和医疗保健机构应向HCP提供培训,以提高识别能力并鼓励及时报告血液和体液暴露。暴露后评估可能会导致HCP损失工作时间,但这不应成为报告的障碍。各机构应确保HCP能快速获得暴露后检测和预防,包括HBIG和HepB疫苗。
HBV感染的血清学检测
由于职业风险,检测未接种HCP的HBV感染通常不适用于接受乙肝防护评估的人。出生在HBsAg流行率≥2%的地理区域(例如,东欧、亚洲、非洲、中东和太平洋岛屿的大部分地区)的所有人以及来自HBV流行率总体较低的国家的某些土著人口需要进行接种前血清学检测(< 2%)。行为暴露于HBV病毒的人(例如,男男性行为者和过去或现在的注射毒品使用者);接受细胞毒性或免疫抑制治疗的人;和患有不明病因的肝病的人。
HBV地方病(HBsAg流行率)可分为低水平(< 2%)、中等水平(2% –< 8%)和高水平(≥8%)。由于某些人在接受HepB疫苗接种前可能已经感染了HBV病毒,因此建议对出生于HBsAg流行率≥2%的地理区域的人、出生于婴儿时期未接种疫苗的美国人(其父母出生于HBV病毒流行率高(HBsAg流行率≥8%)的区域)、在青少年或成人时期接受HepB疫苗接种的人(在开始危险行为后)进行HBsAg检测,而不考虑其疫苗接种史(12),以及爱滋病带菌者患者或接受血液透析的人士(11)。
检测有HBV感染风险的HCP应包括HBsAg的血清学检测,除了抗-HBc或抗-HBs(11,12)。对于以前有HBV感染风险的未接种HCP,在接种第一剂疫苗前应抽血检测。
接种疫苗
其工作、训练和志愿者相关活动涉及合理预期的血液或体液暴露风险的所有HCP人应接种完整的≥3剂HepB疫苗系列。OSHA要求员工在初次分配后10天内接种疫苗(27)。HCP受训人员应在可能接触血液或体液之前完成该系列,因为在专业培训(如住院医师培训)期间已报告了更高的风险。
未完全接种的HCP应接受额外剂量以完成疫苗系列(15)。对于系列不完整的HCP,疫苗系列不需要重启;但是,应注意最小剂量间隔(15)。第一次和第二次给药之间的最小给药间隔为4周,第二次和第三次给药之间为8周,第一次和第三次给药之间为16周(15)。
缺乏HepB疫苗接种记录的HCP应被视为未接种疫苗(当缺乏HepB疫苗剂量记录时)或未完全接种疫苗(当缺乏某些HepB疫苗剂量记录时),并应接受额外剂量以完成记录的HepB系列。鼓励卫生保健机构在可行的情况下,寻找IIS中“缺失”HepB剂量的文件,以避免不必要的疫苗接种。
OSHA要求拒绝HepB疫苗接种的HCP签署拒绝声明(http://www.osha.gov/pls/oshaweb/owadisp.show_document?p _ id = 10052 & p _ table =标准)。如果HCP仍在OSHA的血源性病原体标准范围内,拒绝接种HepB疫苗的HCP可以在以后免费接种疫苗。卫生保健机构应鼓励在HCP人群中接种HepB疫苗,以提高对HBV的保护,并实现健康人202090%疫苗接种的目标(66)。
疫苗接种后血清学测试
拥有完整的≥3剂HepB疫苗系列书面文件,且随后接种后抗-HBs ≥10 mIU/mL的HCP被视为乙肝免疫。具有免疫能力的人对HBV具有长期保护作用,不需要进一步的定期检测来评估抗-HBs水平(图6)。
所有最近接种疫苗或最近完成HepB疫苗接种的HCP人,如果有职业血液或体液暴露的风险,都应该接受抗-HBs检测。如果可能,抗-HBs检测应在最后一剂疫苗注射后1-2个月进行。HCP有完整的≥3剂HepB疫苗系列的记录,但没有抗-HBs ≥10 mIU/mL的记录,有职业血液或体液暴露风险的人可能在雇用或入学时接受抗-HBs检测。检测应使用定量方法,允许检测抗-HBs的保护浓度(≥10 mIU/mL)(如酶联免疫吸附试验[ELISA])。
- 抗-HBs ≥10 mIU/mL的完全接种HCP被认为是乙肝免疫的。具有免疫能力的人具有长期保护作用,不需要进一步的定期检测来评估抗-HBs水平。
- 完全接种抗-HBs <10 mIU/mL的HCP应接受额外剂量的HepB疫苗,随后在1-2个月后进行抗-HBs检测。抗-HBs仍然< 10 mIU/mL的HCP应接受2剂额外疫苗(通常总共6剂),然后在最后一剂后1-2个月重复抗-HBs检测。或者,对于最近接种过抗-HBs <10 mIU/mL的HCP人来说,更实际的做法是连续额外接种3剂HepB疫苗(通常总共6剂),然后在最后一剂后1-2个月进行抗-HBs检测。
标准预防措施和建议HCP报告暴露
所有HCP都应遵守感染控制指南并遵循标准预防措施(90),包括使用工程和工作实践控制,以降低血液或体液暴露的风险。应建议所有HCP人,包括那些已证明对HBV病毒有保护作用的人,立即向职业健康部门报告血液或体液暴露,以评估防止血源性病原体(包括艾滋病毒、丙型肝炎和乙型肝炎)传播的适当措施。
暴露后管理
初始暴露后管理
接触过血液或体液的伤口和皮肤部位要用肥皂和水清洗;粘膜应该用水冲洗。使用防腐剂(如2%-4%的氯己定)护理伤口或通过挤压伤口挤出液体并不能降低HBV病毒传播的风险;然而,并不禁止使用防腐剂。不建议在伤口中使用腐蚀性试剂(如漂白剂)或注射防腐剂或消毒剂。
根据适用法律,应遵循检测已知来源人员的程序,包括获得知情同意。被确定为HBsAg阳性的源患者应接受适当的治疗,并应向州或地方卫生部门报告。当来源患者未知时(例如,由于用针在垃圾中穿刺而发生),暴露的HCP应按照来源患者为HBsAg阳性来处理。不建议使用与暴露有关的测试针头和其他尖锐器械,无论是否已知患者。在这种情况下,结果的可靠性和解释是未知的,并且测试可能对操作尖锐器械的人是危险的。涉及人咬伤的暴露应在了解被咬伤者和参与咬伤者都有潜在暴露的情况下进行管理。
机构应确保HCP及时获得暴露后管理和预防,包括HBIG和HepB疫苗。对于被认为易受HBV病毒感染的HCP病毒感染者,应在暴露后尽快接种HBIG和HepB疫苗。在经皮、粘膜或非接触皮肤暴露后7天以上给药时,HBIG的有效性未知。HBIG和HepB疫苗可以在不同的注射部位同时给药。
接受HBIG的HCP人的抗-HBs检测应在不再检测到来自HBIG的抗-HBs后进行(给药后6个月) (11)。抗-HBs检测应使用允许检测抗-HBs保护浓度(≥10 mIU/mL)的方法(表2)。
管理接种疫苗的HCP
对于已接种疫苗的HCP(有完整的≥3剂HepB疫苗系列的书面文件记录)且随后记录的抗-HBs ≥10 mIU/mL,没有必要检测源患者的HBsAg。无论源患者的HBsAg状态如何,HBV都没有必要进行暴露后处理。
对于接种过两次完整的≥3剂HepB疫苗系列后抗-HBs <10 mIU/mL的HCP(有HepB疫苗接种的书面文件),源患者应在暴露后尽快检测HBsAg。如果源患者是HBsAg阳性或具有未知的HBsAg状态,HCP应接受2剂HBIG(1,11)。第一剂应在暴露后尽快施用,第二剂应在1个月后施用。如果源病人是HBsAg阴性,HBIG和HepB疫苗都是不必要的。
对于以前未进行抗-HBs检测的已接种HCP(有完整的≥3剂HepB疫苗系列的书面文件),应在暴露后尽快检测HCP的抗-HBs和源患者(如果已知)的HBsAg。检测源患者和HCP应同时进行;在等待HCP抗-HBs检测结果时,不应延迟对源患者的检测,同样,在等待源患者HBsAg结果时,也不应延迟对HCP的检测。
- 如果HCP的抗-HBs <10 mIU/mL,且源患者为HBsAg阳性或HBsAg状态未知,则HCP应接受1剂HBIG,并在暴露后尽快再次接种。然后,HCP应根据疫苗接种计划接受第二次2剂疫苗,以完成第二次HepB疫苗接种系列(当计入最初的3剂系列时,总共6剂)。为了记录HCP对未来暴露的疫苗反应状态,应在最后一剂疫苗后1-2个月进行抗-HBs检测。
- 如果HCP的抗-HBs <10 mIU/mL,并且源患者是HBsAg阴性,HCP应接受额外的HepB疫苗剂量,然后在1-2个月后重复抗-HBs检测。抗-HBs仍< 10 mIU/mL的HCP应再接种2剂疫苗(当考虑到最初的3剂系列时,总共6剂)。为了记录HCP对未来暴露的疫苗反应状态,应在最后一剂疫苗后1-2个月进行抗-HBs检测。
- 如果HCP在暴露时抗-HBs ≥10 mIU/mL,则无需进行暴露后HBV管理,无论源患者的HBsAg状态如何。
管理缺乏疫苗接种记录、未接种或未完全接种的HCP
对于未接种或未完全接种的HCP(包括拒绝接种者),暴露后应尽快对源患者进行HBsAg检测。没有必要对未接种或未完全接种的HCP进行抗-HBs检测,这可能会产生误导,因为抗-HBs ≥10 mIU/mL与疫苗诱导的保护作用相关,这仅适用于已完成批准的一系列疫苗接种的人群(15,42)。
- 如果源患者是HBsAg阳性或具有未知的HBsAg状态,HCP应在暴露后尽快接受1剂HBIG和1剂HepB疫苗。HCP应根据疫苗接种计划完成HepB系列疫苗接种。为了记录HCP对未来暴露的疫苗反应状态,应在最后一剂疫苗后约1-2个月进行抗-HBs检测。由于接受HBIG的HCP患者的抗-HBs检测应在不再检测到来自HBIG的抗-HBs后进行(给药后6个月),因此可能有必要将抗-HBs检测推迟到末次接种疫苗后1-2个月以上。
—接受第一批疫苗后抗-HBs ≥10 mIU/mL的HCP被认为是免疫的。具有免疫能力的人具有长期保护作用,不需要进一步的定期检测来评估抗-HBs水平。
—接受第一系列疫苗接种后,抗-HBs <10 mIU/mL的HCP应重新接种。对于这些HCP,按照适当的时间表进行第二次完整的3剂系列注射,然后在第三剂后1-2个月进行抗-HBs检测,通常比在每增加一剂疫苗后进行血清学检测更实际。为了记录HCP对未来暴露的疫苗反应状态,应在最后一剂疫苗后1-2个月进行抗-HBs检测。 - 如果源患者HBsAg阴性,HCP应根据疫苗接种计划完成HepB疫苗系列。为了记录HCP对未来暴露的疫苗反应状态,应在最后一剂疫苗后约1-2个月进行抗-HBs检测。
—接受第一批疫苗后抗-HBs ≥10 mIU/mL的HCP被认为是免疫的。具有免疫能力的人具有长期保护作用,不需要进一步的定期检测来评估抗-HBs水平。
—接受第一系列疫苗接种后,抗-HBs <10 mIU/mL的HCP应重新接种。对于这些HCP,按照适当的时间表进行第二次完整的3剂系列注射,然后在第三剂后1-2个月进行抗-HBs检测,通常比在每增加一剂疫苗后进行血清学检测更实际。为了记录HCP对未来暴露的疫苗反应状态,应在最后一剂疫苗后1-2个月进行抗-HBs检测。
检测暴露于HBsAg阳性或未知来源的HCP
抗-HBs <10 mIU/mL的HCP,或未接种或未完全接种疫苗的人,以及持续经皮、粘膜或非接触性皮肤暴露于HBsAg阳性或HBsAg状态未知的源患者的人,应在暴露后尽快进行HBV感染基线检测,并在大约6个月后进行随访检测。暴露后立即进行的检测应包括总抗-HBc,大约6个月后的随访检测应包括HBsAg和总抗-HBc。
在随访期间,与HBsAg阳性或HBsAg状态未知的源患者接触的HCP无需采取特殊预防措施来防止二次传播;然而,他们应该避免捐献血液、血浆、器官、组织或精液(1)。暴露的HCP不需要改变性行为或避免怀孕(1)。如果暴露的HCP正在哺乳,她不需要停止(1)。没有必要修改暴露的HCP患者护理责任,以防止仅因暴露于HBsAg阳性或HBsAg状态未知的源患者而传播给患者。
疫苗无应答者
在再次接种后(即接受总共6剂疫苗后),抗-HBs仍< 10 mIU/mL的已接种HCP应检测HBsAg和抗-HBc,以确定感染状态。那些被确定为未感染HBV病毒的人(疫苗无应答者)应被视为易受HBV病毒感染。不建议对疫苗无应答者进行具体的工作限制(91)。
证明文件
医疗保健机构应保留记录,最好是暴露后易于检索的电子记录,记录疫苗接种史和血清学检测结果,以供管理职业暴露时参考,并在HCP要求时提供给其他医疗保健机构。疫苗接种信息应输入接受成人疫苗接种记录的IIS(如果有)。应向HCP提供一份HepB疫苗接种和抗HBs检测结果的复印件,并鼓励其将这些结果与个人健康记录保存在一起,以便将来的雇主可以随时查阅。
HCP与HBV感染
应该建议HBsAg阳性的HCP人如何防止将HBV病毒传染给他人,并推荐他们做进一步的评估(92)。应建议那些进行易暴露程序的人,根据最新的CDC对HBsAg阳性卫生保健提供者和学生的管理建议,他们可以安全地进行程序(11,13)。慢性乙型肝炎感染本身不应排除医学、外科、牙科或相关健康专业的实践或研究(13)。
未来研究
准确评估HCP乙型肝炎负担的国家监测系统和追踪HCP职业暴露的医疗机构数据库对于监测职业获得性HBV感染和其他血源性病原体的流行病学变化非常重要。理想情况下,系统和数据库可以与员工健康记录进行电子链接,并应包括识别HepB疫苗应答者和非应答者的结果、暴露源和暴露后管理的性质和HBV状态,以及HCP的抗-HBs水平。应采取适当的安全措施来保护健康信息的隐私。数据收集应代表HCP的各种环境(例如,急性护理、长期护理和透析),包括人员流动频繁的环境。研究评估暴露于HBsAg阳性来源的所有HCP中的HBV传播,不考虑疫苗接种史或抗-HBs水平,大约在暴露后6个月,将有助于了解疫苗保护的持续时间。除HepB疫苗接种史外,急性乙型肝炎感染的监测活动应继续确定病例中的职业。评估婴儿和老年人接种疫苗后疾病发生率和抗-HBs持续时间的长期随访研究,包括在初次疫苗接种后接受加强剂量的人和来自HBV流行区的人,也可能提供疫苗诱导保护持续时间的信息。将从研究中受益的其他主题领域包括抗病毒剂用于暴露后预防的功效和成本效益、更高剂量或新疫苗用于重新接种疫苗无应答者的免疫原性,以及对暴露后乙型肝炎病毒脱氧核糖核酸(HBV DNA)检测的未来作用的检查。
感谢
在起草这些建议的过程中,征求了以下人员的意见:北卡罗莱纳州达勒姆国际三角研究所的Thomas J. Hoerger博士、Christina Lud low-Bradley;Henry Roberts博士,艾米丽·史密斯,公共卫生硕士,Steven Veselsky,公共卫生硕士,国家艾滋病、病毒性肝炎、性病和结核病预防中心;Donna Weaver,RN,国家免疫和呼吸疾病中心;Tara MacCannell博士,Ronda Sinkowitz-Cochran,公共卫生硕士,国家新发和动物传染病中心。
参考
- 美国公共卫生服务。更新的美国公共卫生服务关于HBV、丙型肝炎病毒和艾滋病毒职业暴露管理指南和暴露后预防建议。MMWR 2001年;29时50分(编号RR-11)。
- 罗森伯格JL,琼斯DP,利皮兹LR,克斯纳JB。病毒性肝炎:外科医生的职业危害。JAMA 1973223:395–400.
- 注册护士的工作时间表,针的使用和针刺伤。传染病控制医院,2007年;28:156–64.
- 贝尔特拉米EM,威廉姆斯IT,夏皮罗CN,钱伯兰我。卫生保健工作者血源性感染的风险和管理。临床微生物学2000年修订版;13:385–407.
- 疾病控制中心。免疫实践咨询委员会的建议(ACIP)。乙型肝炎灭活疫苗。MMWR 1982;31:317–22, 27–8.
- 乙肝疫苗的免疫原性。对有乙型肝炎病毒感染职业风险的人的影响。美国医学杂志1998年版;15:1–8.
- 哈德勒SC,弗朗西斯DP,梅纳德JE,等。乙肝疫苗在同性恋男性中的长期免疫原性和有效性。英国医学杂志1986;315:209–14.
- 疾病控制中心。成人免疫接种的最新情况:免疫接种实践咨询委员会的建议(ACIP)。MMWR 1991年;40(编号RR-12)。
- 疾病控制中心。卫生保健工作者的免疫接种:免疫接种实践咨询委员会(ACIP)和医院感染控制实践咨询委员会(HICPAC)的建议。MMWR 1997年;46(编号RR-18)。
- 疾病控制中心。病毒性肝炎统计和监测。可从以下网址获得http://www.cdc.gov/hepatitis/statistics/index.htm.
- 疾病控制中心。保健人员的免疫接种:免疫接种实践咨询委员会的建议(ACIP)。MMWR 2011;60(编号RR-7)。
- 疾病控制中心。慢性乙型肝炎病毒感染者的识别和公共卫生管理建议。MMWR 2008;57(编号RR-8)。
- 疾病控制中心。更新了CDC对乙型肝炎病毒感染的医护人员和学生的管理建议。MMWR 2012;61(编号RR-3)。
- 疾病控制中心。更新的美国公共卫生服务指南:HIV职业暴露管理和暴露后预防建议。MMWR 2005年;54(编号RR-9)。
- 疾病控制中心。消除美国乙型肝炎病毒感染传播的综合免疫策略:免疫实践咨询委员会(ACIP)的建议第二部分:成人免疫。MMWR 2006年;55(编号RR-16);小测验。
- 疾病控制中心。乙型肝炎病毒:通过普及儿童疫苗接种在美国消除传播的综合策略:免疫实践咨询委员会的建议(ACIP)。MMWR 1991年;40(编号RR-13)。
- 疾病控制中心。2012年病例定义:全国通报条件传染性和非传染性病例。佐治亚州亚特兰大市:疾病预防控制中心;2012.
- Hyams KC。急性乙型肝炎病毒感染后的慢性化风险:一项综述。Clin Infect Dis 199520:992–1000.
- 疫苗接种时代美国乙型肝炎病毒感染的流行。j传染疾病2010年;202:192–201.
- 1999-2007年间美国病毒性肝炎死亡率的增加。Ann实习生Med 2012156:271–8.
- 疾病控制中心。19-35个月儿童的国家、州和地方疫苗接种覆盖率——美国,2011年。MMWR 2012;61:689–96.
- 疾病控制中心。13-17岁青少年的国家和州疫苗接种覆盖率——美国,2011年。MMWR 2012;61:671–7.
- 疾病控制中心。成人非流感疫苗接种覆盖率——美国,2011年。MMWR青奥会;62:66–72.
- Bond WW,Favero MS,Petersen NJ,等。干燥和储存一周后乙型肝炎病毒的存活率。柳叶刀1981;1:550–1.
- 加里波第RA,哈奇菲,比斯诺铝,哈奇MH,格雷格MB。非肠道血清肝炎:一次暴发报告。JAMA 1972220:963–6.
- 沃纳BG,格雷迪GF。意外乙型肝炎表面抗原阳性接种:使用e抗原评估传染性。安实习医师医学1982;97:367–9.
- 美国劳工部。职业健康与安全管理局。可从以下网址获得http://www.osha.gov
 .
. - 弗吉尼亚大学卫生系统。国际医疗工作者安全中心。可从以下网址获得http://www.healthsystem.virginia.edu/pub/epinet/home.html
 .
. - 波尔·WL,莱斯·JK,索萨·S等,《预防护理人员血液暴露的国家研究:暴露报告》。美国医学杂志2008;51:213–22.
- 格申RR,皮尔森JM,谢尔曼MF,等。家庭保健部门注册护士经皮损伤的患病率和危险因素。Am J感染控制2009;37:525–33.
- 非医院注册护士与血源性病原体暴露的风险。Ind Health 200745:695–704.
- 科普斯科姆J,索卡斯R,麦克法勒K,等。无证家庭护理工作者和家庭护理注册护士的职业血液暴露:他们受到保护吗?美国医学杂志2009;52:563–70.
- JM,艾普林,奥斯特拜,庞贝,亨特。卫生保健工作者的血液和体液暴露风险:来自杜克健康和安全监督系统的结果。美国医学杂志2004;46:637–48.
- 疾病控制中心。美国三个医疗保健系统的2000-2012年暴露日志。个人通信,莎拉·席利。
- 王,编辑。乙型肝炎合作护理模式:在社区卫生中心的实施。第一保健2011年秋季研讨会整合医疗保健:改善健康结果的规划和系统;2011.
- 哈德勒SC,马戈利斯HS。乙型肝炎免疫:疫苗类型、效力和免疫适应症。当前临床顶部感染Dis 199212:282–308.
- 斯特拉顿K,福特A,Rusch E,克莱顿EW。疫苗的副作用:证据和因果关系。DC华盛顿:美国国家学院出版社;2012.
- 约翰逊·奥·阿尤拉。妊娠期乙型肝炎疫苗:免疫原性、安全性和抗体向婴儿的转移。1987年国际妇产科杂志;25:297–301.
- 妊娠期乙型肝炎疫苗:母体和胎儿的安全性。Am J Perinatol 19918:227–32.
- 乙型肝炎和加强剂量的需要。临床感染Dis 201153:68–75.
- 乙肝疫苗后的抗体水平和保护作用:一项22年随访研究的结果和对加强剂量的反应。J Infect Dis 2009200:1390–6.
- 杰克广告,霍尔AJ,缅因州北部,门迪M,惠特尔HC。什么水平的乙肝抗体有保护作用?j传染疾病调查,1999年;179:489–92.
- Alikaş ifoğ lu M,Cullu F,Kutlu T,等。不同类型和剂量的重组乙型肝炎疫苗在健康新生儿中免疫原性的比较研究。J Trop儿科杂志2001年;47:60–2.
- Goldfarb J,Baley J,Medendorp SV,等。新生儿接种Engerix-B乙型肝炎疫苗两种给药方案的免疫原性和安全性的比较研究。儿科传染病杂志1994;13:18–21.
- 希利SF,墨菲电视。新生儿接种重组乙型肝炎疫苗后的血清保护作用:综述。疫苗2013;31:2506–16.
- 1型糖尿病患者对酵母乙肝疫苗的体液免疫应答。糖尿病医学1992年;9:66–9.
- 韦伯DJ,鲁塔拉瓦,萨姆萨GP,圣蒂莫JE,柠檬SM。肥胖是乙型肝炎血浆疫苗抗体应答不良的预测因素。JAMA 1985254:3187–9.
- 明尼苏达州医护人员接种乙肝疫苗后缺乏可检测抗体的危险因素。JAMA 1993270:2935–9.
- 丹廷格·CM、麦克马洪·BJ、巴特勒·JC等:《出生时接受免疫接种的阿拉斯加土著人乙型肝炎抗体的持久性和对疾病的保护》。儿科传染病杂志2005;24:786–92.
- Hammitt LL,Hennessy TW,Fiore AE,等。从出生时开始接种重组乙型肝炎疫苗的儿童的乙型肝炎免疫:15年的随访研究。疫苗2007;25:6958–64.
- 美国16-19岁青少年出生后不久接种乙肝疫苗的免疫持续时间。于2012年4月29日提交给马萨诸塞州波士顿的儿科学会。
- 彼得森KM,Bulkow LR,麦克马洪BJ,等。低风险儿童出生后接受乙肝疫苗接种的乙肝免疫持续时间。儿科传染病杂志2004;23:650–5.
- 婴儿时期接种乙肝疫苗的阿拉斯加儿童和青少年对乙肝疫苗加强剂量反应的差异。儿科2007;120:e373–81。
- 免疫实践咨询委员会。成本效益分析的证据:非成本相关的模型输入。佐治亚州亚特兰大:CDC2012.可从以下网址获得http://www . CDC . gov/vaccines/acip/meetings/downloads/min-archive/min-jun 12 . pdf
 .
. - 斯潘塞·l·方德伯克《高危卫生保健工作者的乙肝免疫》。接种疫苗后七年。AAOHN J 2000;48:325–30.
- 麦克马洪B,编辑。成人和儿童接种乙肝疫苗后30年随访。病毒性肝炎预防技术委员会会议;意大利米兰;2011.
- 麦克马洪BJ,布鲁登DL,彼得森KM,等。乙肝疫苗接种后的抗体水平和保护:15年随访结果。安实习医师医学2005;142:333–41.
- Spradling PR,Williams RE,Xing J,Soyemi K,Towers J .美国一所健康科学大学学生乙型肝炎病毒感染的血清学检测。传染病控制医院,2012年;33:732–6.
- 史提芬斯,托伊,泰勒,李,叶。控制乙型肝炎病毒感染的前景:儿童期疫苗接种和长期保护的意义。儿科学1992;90:170–3.
- Tohme RA,Ribner B,Huey MJ,Spradling PR。美国一所学术机构的入学保健学生的乙肝疫苗接种覆盖率和有记录的血清保护。传染病控制医院,2011年;32:818–21.
- Watson B,West DJ,Chilkatowsky A,Piercy S,Ioli VA .重组乙型肝炎疫苗接受者的免疫记忆持续13年。2001年疫苗;19:3164–8.
- 威廉姆斯·JL,克里斯滕森·CJ,麦克马洪·BJ,等。对先前免疫过的医护人员进行乙肝疫苗加强剂量的反应评估。2001年疫苗;19:4081–5.
- Poovorawan Y,Chongsrisawat V,Theamboonlers A,等:高流行地区婴儿接种疫苗20年后预防临床和慢性乙型肝炎感染的证据。j病毒性肝炎2011;18:369–75.
- 朱春林,刘平,陈婷,等。新生儿接种乙肝疫苗后成人对乙肝病毒的免疫记忆和免疫力。疫苗2011;29:7835–41.
- 伯德KB,卢,墨菲电视。美国卫生保健人员的乙肝疫苗接种覆盖率。2013年公共卫生代表;128:498–509.
- 疾病控制中心。健康人主题和目标索引。可从以下网址获得http://www . healthy people . gov/2020/topics objectives 2020/default . aspx
 .
. - 疾病控制中心。对加州卫生保健机构感染预防专家的调查。佐治亚州亚特兰大市:疾病预防控制中心;2012.
- Clemens R,Sanger R,Kruppenbacher J,等。标准三剂乙肝疫苗计划后低应答者和无应答者的加强免疫接种——上市后监测的结果。1997年疫苗;15:349–52.
- 医护人员对乙肝疫苗无反应。复种和基因分型的结果。安实习医师医学1986;105:356–60.
- 标准或高剂量S亚单位重组乙型肝炎疫苗与含有S亚单位、前S1病毒和前S2病毒颗粒的疫苗对健康成人无应答者进行再接种的比较试验j传染疾病调查,1997年;175:678–81.
- 戈德华特PN。乙型肝炎疫苗无应答者接种20微克与40微克恩格里克斯B疫苗的随机对照试验。1997年疫苗;15:353–6.
- 美国乙型肝炎流行病学的变化:对替代疫苗接种策略的需求。JAMA 1990263:1218–22.
- 奥斯特霍尔姆山,加拉亚尔德山。明尼苏达州医院人员的临床乙型病毒性肝炎:一项为期十年的全州调查结果。JAMA 1985254:3207–12.
- 听我说,编辑。接种疫苗人群的突破性HBV感染:意大利的一项10年监测研究病毒性肝炎预防技术委员会会议。意大利米兰;2011.
- 疾病控制中心。中国疾病预防控制中心急性乙型肝炎监测项目医护人员乙肝疫苗接种史评估:2012.
- 疾病控制中心。免疫信息系统。可从以下网址获得http://www.cdc.gov/vaccines/programs/iis/index.html.
- 疾病控制中心。免疫信息系统。个人通信,加里·厄克特;2012.
- 史志,李,马,杨。孕期注射乙肝免疫球蛋白阻断乙肝病毒母婴传播的荟萃分析。Int J Infect Dis 201014:e622–34。
- 乙型肝炎免疫球蛋白和乙型肝炎疫苗预防围产期传播的乙型肝炎病毒感染。柳叶刀1983;2:1099–102.
- Stevens CE,Toy PT,Tong MJ,等。美国围产期乙型肝炎病毒传播:被动-主动免疫预防。JAMA 1985253:1740–5.
- 乙型肝炎免疫球蛋白预防乙型肝炎病毒携带者围产期传播的效果:一项随机双盲、安慰剂对照试验的最终报告。国际肝病1983;3:135–41.
- 医务人员意外暴露乙肝免疫球蛋白:一项多中心对照试验的最终报告。j传染Dis 1978138:625–38.
- 乙型肝炎免疫球蛋白:一项预防透析相关肝炎的多中心对照试验的最终报告。j传染Dis 1978137:131–44.
- 乙型肝炎“免疫”球蛋白:预防透析相关肝炎的有效性。英国医学杂志1975年;293:1063–7.
- 针刺暴露后的乙型肝炎:用乙型肝炎免疫球蛋白预防。退伍军人管理局合作研究最终报告。安实习医师医学1978;88:285–93.
- 一项关于免疫血清球蛋白预防输血后肝炎疗效的随机双盲对照试验:一项退伍军人管理局合作研究。胃肠病学1977;72:111–21.
- 用特异性乙型肝炎免疫血清球蛋白预防乙型病毒性肝炎(MS-2株)。JAMA 1971218:1665–70.
- 乙型肝炎免疫血清球蛋白治疗后的迟发性肝炎。BMJ 1976;2:19–20.
- 在休斯顿和达拉斯的越南裔美国儿童和青少年中推广乙型肝炎疫苗接种的经济学分析。儿科2003;111:1289–96.
- 疾病控制中心。卫生保健人员感染控制指南,1998年。可从以下网址获得http://www.cdc.gov/hicpac/pdf/infectcontrol98.pdf
 .
. - Bolyard EA,Tablan OC,Williams WW,等。医护人员感染控制指南,1998年:医院感染控制实践咨询委员会。传染病控制医院,1998年;19:407–63.
- 恩菲尔德KB,莎拉波娃U,霍尔KK,等。乙型肝炎病毒从一个高病毒载量的骨科医生传播。Clin Infect Dis 201356:218–24.
*小组成员名单见第20页。
ACIP 免疫实践咨询委员会 anti-HBc 抗乙型肝炎核心抗原抗体 anti-HBs 抗乙型肝炎表面抗原的抗体 ELISA 酶联免疫吸附试验 HBeAg 乙型肝炎e抗原 HBIG 乙型肝炎免疫球蛋白 HBsAg 乙型肝炎表面抗原 HBV 乙型肝炎病毒 HBV DNA 乙型肝炎病毒脱氧核糖核酸 HCP 保健人员 HCV 丙型肝炎病毒 HepB 乙型肝炎疫苗 HIV人类免疫缺陷病毒 IDU 注射毒品使用 IG 免疫球蛋白 IIS 免疫信息系统 IOM 医学研究所 MSM 男男性行为者 NHIS 国民健康访谈调查 NNDSS国家法定传染病监测系统 OSHA 职业安全与健康管理局 PCR 聚合酶链反应 QALY 质量调整生命年 |
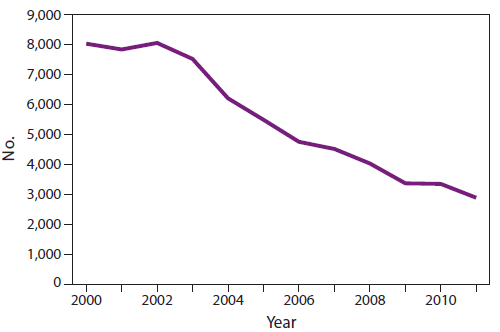
来源:疾病控制中心。病毒性肝炎统计和监测。可从以下网址获得http://www.cdc.gov/hepatitis/statistics/index.htm.
* 2011年,报告的病例数为2,890例;估计病例数(18,800)是在考虑了漏报和无症状感染后计算出来的。
替代文本:上图是2000年至2011年间报告病例数的线形图。2011年,报告的病例数为2,890例,估计病例数(18,800例)考虑了漏报和无症状感染。
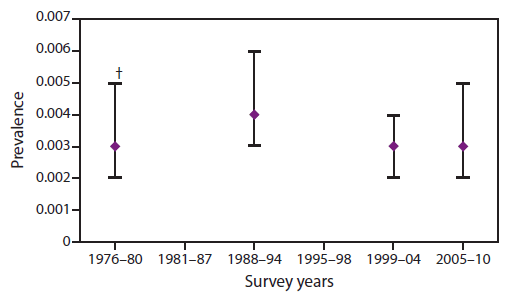
来源:疫苗接种时代美国乙型肝炎病毒感染的流行。j传染疾病2010年;202:192–201.个人交流。罗伯特H博士。佐治亚州亚特兰大市:疾病预防控制中心;2012.
*慢性乙型肝炎定义为同时存在乙型肝炎表面抗原(HBsAg)和乙型肝炎核心抗原抗体(抗HBc)。
†代表95%的置信区间。
替代文本:上图显示了慢性乙型肝炎感染的患病率,慢性乙型肝炎感染被定义为同时存在乙型肝炎表面抗原(HBsAg)和乙型肝炎核心抗原抗体(抗Hbc)。所代表的时期是1976年至2010年。
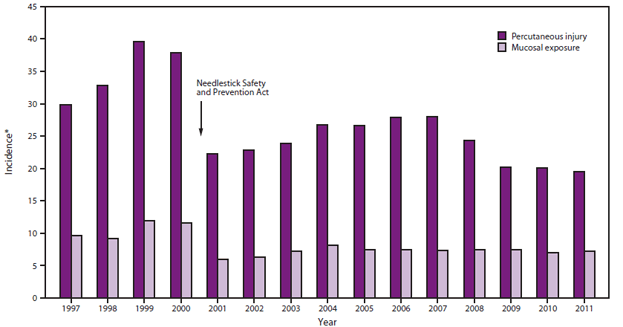
来源:弗吉尼亚大学卫生系统。国际医疗工作者安全中心。可从以下网址获得http://www.healthsystem.virginia.edu/pub/epinet/home.html![]() .
.
*每100张床位。
†包括针刺、割伤和咬伤。
§包括接触粘膜或非接触皮肤(暴露预防信息网络[EPINet]称之为“血液和体液暴露”)。
替代文本:上图是一个条形图,提供了1997-2011年期间暴露预防和信息网络报告的针刺和粘膜暴露的伤害发生率。
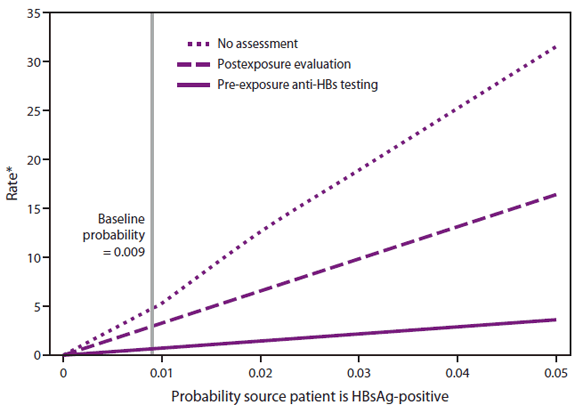
来源:个人交流。Hoerger TJ,Ludlow-Bradley C. Durham,北卡罗莱纳州:国际三角研究所;2012.
*每100,000名保健人员。
替代文本:上图是一个线形图,根据源患者的HBsAg阳性率和评估方法,显示了HCP受训者中HBV感染的概率。
特性 | 单一抗原疫苗* | 联合疫苗 | ||||
|---|---|---|---|---|---|---|
Recombivax HB | Engerix-B | Twinrix† | ||||
剂量 | 体积 | 剂量 | Twinrix | 剂量 | Twinrix | |
年龄(岁) | ||||||
11–15 | 10§ | 1 | 钠 | 钠 | 钠 | 钠 |
11–19 | 5 | 0.5 | 10 | 0.5 | 钠 | 钠 |
≥20 | 10 | 1 | 20 | 1 | 20 | 1 |
血液透析患者和其他免疫功能低下的人 | ||||||
<20¶ | 5 | 0.5 | 10 | 0.5 | 钠 | 钠 |
≥20 | 40** | 1 | 40†† | 2 | 钠 | 钠 |
缩写:NA =不适用。 *单抗原疫苗通常在0、1和6个月时分3次给药。其他时间表也是可用的。参见包装插页。 † 建议年龄≥18岁的人群接种甲型肝炎和乙型肝炎联合疫苗,以增加乙型肝炎病毒和甲型肝炎病毒感染的风险。 § 成人配方,分两次给药。 ¶ 更高的剂量可能更有免疫原性,但没有具体的建议。 **在第0个月、第1个月和第6个月按3剂方案给药的透析制剂。 ††在第0个月、第1个月、第2个月和第6个月,在一个部位分4次给药,每次1毫升。 | ||||||
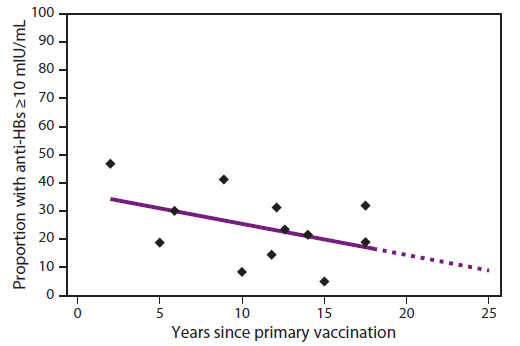
来源:婴儿时期接种乙肝疫苗的阿拉斯加儿童和青少年对乙肝疫苗加强剂量反应的差异。儿科2007;120:e373–81。彼得森KM,Bulkow LR,麦克马洪BJ,等。低风险儿童出生后接受乙肝疫苗接种的乙肝免疫持续时间。儿科传染病杂志2004;23:650–5.Hammitt LL,Hennessy TW,Fiore AE,等。从出生时开始接种重组乙型肝炎疫苗的儿童的乙型肝炎免疫:15年的随访研究。疫苗。2007;25:6958–64.丹廷格·CM、麦克马洪·BJ、巴特勒·JC等:《出生时接受免疫接种的阿拉斯加土著人乙型肝炎抗体的持久性和对疾病的保护》。儿科传染病杂志2005;24:786–92.美国16-19岁青少年出生后不久接种乙肝疫苗的免疫持续时间。于2012年4月29日提交给马萨诸塞州波士顿的儿科学会。
*仅包括美国的研究。
替代文本:上图以5年为增量,通过抗-HBs ≥10 mIU/mL的人的比例来衡量,显示了根据接种疫苗的年数预防乙型肝炎病毒的证据。
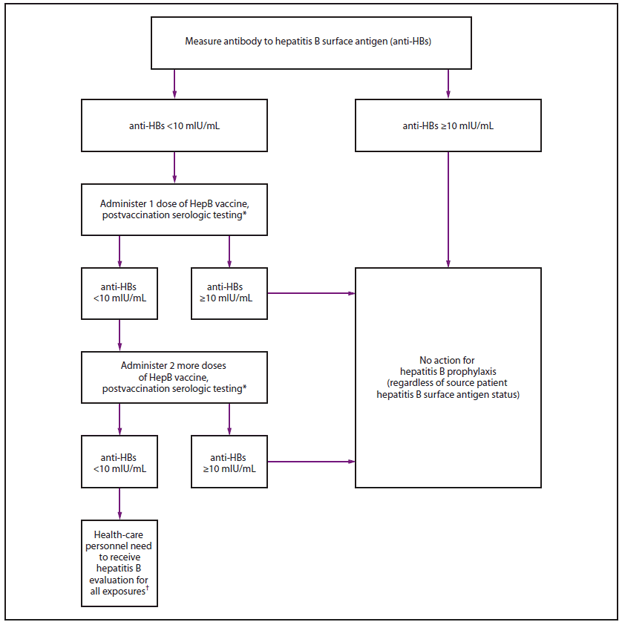
来源:改编自疾控中心。消除美国乙型肝炎病毒感染传播的综合免疫策略:免疫实践咨询委员会的建议(ACIP)。第二部分:成人免疫。MMWR 2006年;55(编号RR-16)。
*应在最后一剂疫苗注射后1-2个月使用定量方法检测抗-HBs保护性浓度(≥10 mIU/mL)(如酶联免疫吸附试验[ELISA])。
†无应答者被定义为接种≥6剂HepB疫苗后抗-HBs <10 mIU/mL的人。复种后没有保护性抗-HBs浓度的人应进行HBsAg检测。如果呈阳性,该人应接受适当的管理或接种疫苗。
替代文本:该图为已完全接种≥3剂HepB系列疫苗且未进行疫苗接种后血清学检测的卫生保健人员的暴露前评估提供了指导。
保健人员状况 | 暴露后测试 | 暴露后预防 | 疫苗接种后血清学 | ||
|---|---|---|---|---|---|
源患者 | HCP测试 | HBIG* | 接种疫苗 | ||
记录在案的响应者§完整系列后(≥3剂) | 不需要任何操作 | ||||
记录在案的不回复者¶ | 肯定/未知 | —** | HBIG x2分隔 | — | 不 |
否定的;消极的;负面的;负的 | 不需要任何操作 | ||||
之后未知的响应 | 肯定/未知 | <10mIU/mL** | HBIG x1 | 新加入某组织的人 | 是 |
否定的;消极的;负面的;负的 | <10mIU/mL | 没有人 | |||
有结果吗 | ≥10毫微克/毫升 | 不需要任何操作 | |||
未接种/未完全接种疫苗或疫苗拒绝者 | 肯定/未知 | —** | HBIG x1 | 完成 | 是 |
否定的;消极的;负面的;负的 | — | 没有人 | 完成 | 是 | |
缩写:HCP =保健人员;HBsAg =乙肝表面抗原;抗-HBs =乙肝表面抗原抗体;HBIG =乙型肝炎免疫球蛋白。 *如有指示,HBIG应在暴露后尽快通过肌肉注射给药。在经皮、粘膜或非接触皮肤暴露后7天以上给药时,HBIG的有效性未知。HBIG用量为0.06毫升/千克。 †应在HepB系列疫苗最后一剂后1-2个月(以及使用HBIG后4-6个月,以避免检测被动使用的抗-HBs)使用定量方法检测抗-HBs的保护浓度(≥10 mIU/mL)。 §应答者定义为接种≥3剂HepB疫苗后抗-HBs ≥10 mIU/mL的人。 ¶无应答者被定义为接种≥6剂HepB疫苗后抗-HBs <10 mIU/mL的人。 **抗-HBs <10mIU/mL的HCP,或未接种疫苗或未完全接种疫苗的人,以及持续暴露于HBsAg阳性或HBsAg状态未知的源患者的人,应在暴露后尽快进行HBV感染基线检测,并在大约6个月后进行随访检测。初始基线测试包括总抗-HBc;大约6个月的测试包括HBsAg和总抗-HBc。 | |||||
专家小组成员
Douglas Campos-Outcalt,医学博士,亚利桑那大学医学院,亚利桑那州凤凰城;密苏里州圣路易斯华盛顿大学医学院医学博士Alexis Elward凯瑟琳·哈里曼博士,加利福尼亚州里士满市加州公共卫生部;塞缪尔·卡茨,医学博士,杜克大学,达勒姆,北卡罗来纳州;哈里·凯瑟林,医学博士,佐治亚州亚特兰大市埃默里大学医学院;北卡罗莱纳州牛津市杜克大学医学博士托马斯·科尼斯;苏珊·列特,医学博士,马萨诸塞州公共卫生部,马萨诸塞州波士顿;Brian McMahon,医学博士,阿拉斯加土著部落健康联盟,阿拉斯加安克雷奇;得克萨斯州休斯顿贝勒医学院医学博士艾米·米中曼;马里兰州哥伦比亚市美国医学主任协会医学博士大卫·a·纳斯;马克·索耶,医学博士,加州大学圣地亚哥分校;Brenna Simons博士,阿拉斯加安克雷奇阿拉斯加土著部落健康联合会;乔纳森·特姆特,医学博士,威斯康星大学医学和公共卫生学院博士,威斯康星麦迪逊;詹姆斯·特纳,医学博士,弗吉尼亚大学医学院,弗吉尼亚州夏洛茨维尔;David Weber,医学博士,美国卫生保健流行病学协会,北卡罗来纳大学,教堂山,北卡罗来纳;马里恩·梅杰博士,马里兰州贝塞斯达美国食品药品监督管理局;Marie A. de Perio,医学博士,国家职业安全和健康研究所;Geoff Beckett,PA-C,Kathy Byrd,医学博士,Scott Holmberg,医学博士,Trudy V. Murphy,医学博士,Sarah Schillie,医学博士,Philip Spradling,医学博士,Eyasu Teshale,医学博士,Xu,医学博士,国家艾滋病、病毒性肝炎、性病和结核病预防中心;Erin Kennedy,DVM,国家免疫和呼吸疾病中心;David Kuhar,医学博士,Cindy Weinbaum,医学博士,国家新发和人畜共患传染病中心。
使用商品名称和商业来源仅用于识别,并不意味着美国卫生与公众服务部的认可。
互联网上非CDC网站的参考资料是作为一项服务提供给MMWR读者和不构成或暗示CDC或美国卫生与人类服务部对这些组织或其项目的认可。CDC对这些网站上的网页内容不负任何责任。中列出的URL地址MMWR在出版之日是最新的。
全部MMWR文章的HTML版本是排版文档的电子转换。这种转换可能会导致HTML版本中的字符翻译或格式错误。用户可参考电子PDF版本(http://www.cdc.gov/mmwr)和/或原件MMWR官方文本、图表和表格的印刷版本。可以从DC华盛顿州美国政府印刷局(GPO)的文件主管处(邮编:20402-9371)获得该问题的原始纸质副本;电话:(202) 512-1800。联系GPO了解当前价格。
- 上次审阅的页面:2013年12月20日
- 页面上次更新时间:2013年12月20日
Hits: 75
