Contents
预防和控制b型流感嗜血杆菌疾病:免疫实践咨询委员会(ACIP)的建议
Prevention and Control of Haemophilus influenzae Type b Disease: Recommendations of the Advisory Committee on Immunization Practices (ACIP)
编写人
伊丽莎白C.布里尔,医学博士1
洛里·鲁宾,医学博士2
佩德罗·莫罗(PedroL.Moro),医学博士3
阿曼达·科恩(AmandaCohn),医学博士1
托马斯·克拉克,医学博士1
南希·梅索尼尔,医学博士1
1疾病预防控制中心国家免疫与呼吸系统疾病中心细菌疾病科
2纽约史蒂文和亚历山德拉·科恩儿童医疗中心,纽约新海德公园
3美国疾病预防控制中心国家新发和人畜共患传染病中心医疗质量促进处
对应编制者:ElizabethC.Briere,医学博士,国家免疫和呼吸系统疾病中心,疾病预防控制中心,1600CliftonRoadNE,MSC-09,亚特兰大,GA30333。电子邮件:ebriere@cdc.gov.
总结
本报告汇编并总结了CDC免疫实践咨询委员会(ACIP)关于预防和控制美国的b型流感嗜血杆菌(Hib)疾病。作为对以前发表的建议的全面总结,本报告不包含任何新的建议;它旨在供临床医生、公共卫生官员、疫苗接种提供者和免疫计划人员用作资源。ACIP建议2至6个月大的婴儿常规接种经许可的Hib结合疫苗(2剂或3剂,具体取决于疫苗产品),并在12至15月龄时接种加强剂。ACIP还建议某些Hib病风险增加的人(即早期成分补体缺乏症、免疫球蛋白缺乏症、解剖学或功能性无脾或HIV感染者、造血干细胞移植受者以及恶性肿瘤化疗或放疗接受者)接种疫苗。本报告总结了美国Hib流行病学的最新信息,并介绍了已获准在美国使用的Hib疫苗。此外,还提供了对Hib病患者接触者进行抗菌化学预防的指南。
介绍
在1985年之前,b型流感嗜血杆菌(Hib)是美国<5岁儿童细菌性脑膜炎的主要原因,也是其他侵袭性疾病(例如会厌炎、肺炎、化脓性关节炎、蜂窝织炎、化脓性心包炎和菌血症)的常见病因(1)。大约三分之二的侵袭性Hib疾病患儿发生脑膜炎;15%-30%的幸存者有听力障碍或严重的永久性神经系统后遗症。大约4%的病例是致命的(2)。1985年,美国推出了第一种多糖Hib疫苗,随后于1987年和1989年推出了结合Hib疫苗。在1989-2000年期间,<5岁儿童侵袭性Hib病的年发病率下降了99%,降至每10万名儿童不到1例(3-7)。2000-2012年期间,美国<5岁儿童侵袭性Hib疾病的年平均发病率仍低于2020年健康人群0.27/100,000(8)的目标(数据见http://www.cdc.gov/abcs/reports-findings/surv-reports.html)(图1和图2)。研究表明,接种Hib结合疫苗可减少已接种疫苗和未接种疫苗儿童的口咽定植(9-11);学龄前儿童中b型流感嗜血杆菌携带的患病率从疫苗接种前的2%-7%下降到疫苗时代的<1%(9,12)。
自1993年免疫实践咨询委员会(ACIP)首次发布关于预防和控制Hib疾病的建议以来,几种含Hib的疫苗已获得许可(13 );随后的出版物为这些疫苗提供了额外的数据和更新的建议(14-17)。本报告总结了先前发表的ACIP关于免疫功能正常和高危人群中Hib病预防和控制的建议(14-18);它不包含新的建议,旨在为临床医生、公共卫生官员、疫苗接种提供者和免疫计划人员提供资源。此外,本报告还总结了美国Hib流行病学的最新信息,并介绍了已获准在美国使用的Hib疫苗。此外,还提供了对Hib病患者接触者进行抗菌化学预防的指南。
方法
ACIP的脑膜炎球菌和b型流感嗜血杆菌工作组*由不同的卫生保健提供者和公共卫生官员组成。工作组包括来自学术医学(儿科、家庭医学、内科和传染病专家)、联邦和州公共卫生专业人员以及专业医疗组织的代表。
已发表的Hib疫苗建议是工作组总结Hib疾病预防和控制建议时使用的主要数据来源,包括2013年美国传染病学会关于免疫功能低下宿主疫苗接种的循证临床实践指南(17 –23)。监测数据来自活性细菌核心监测(ABCs)系统和国家法定传染病监测系统(NNDSS)(24)。
根据2012年4月2日完成的PubMed和WebofScience数据库文献检索结果,总结了当前已获得许可和可用的Hib疫苗的免疫原性和安全性数据。对从疫苗许可到2012年3月发表的当前Hib疫苗的安全性、有效性和免疫原性研究进行了非系统评价。由于MenHibRix于2012年6月获得许可,因此在获得许可之前发表的研究也进行了审查。文献检索包括临床试验、随机对照试验、对照临床试验、评价研究以及在全球范围内进行并以英文发表的比较研究。疫苗不良事件报告系统(VAERS)(可在http://www.vaers.hhs.gov)还检索了目前已获得许可和可用的Hib疫苗的许可后安全性数据。
在2012年12月至2013年2月期间,工作组举行了一次电话会议,成员们通过电子邮件相互沟通,以审查当前的建议并考虑对声明的潜在修订。在ACIP2013年2月的会议上,提交了所审查的数据摘要、工作组讨论和Hib流行病学的当前描述。2013年2月20日,ACIP成员批准了Hib疫苗建议声明。在CDC随后的审查过程中,对ACIP声明进行了修改,以更新和澄清报告中的措辞。
背景
流感嗜血杆菌是一种具有荚膜(可分型)或未荚膜(不可分型)菌株的细菌。包封菌株表达六种抗原性不同的荚膜多糖(a、b、c、d、e或f型)之一。荚膜的流感嗜血杆菌非b型菌株,尤其是a型流感嗜血杆菌,可引起类似于Hib病的侵袭性疾病(25,26)。不可分型的菌株也可引起侵袭性疾病,但更常引起粘膜感染,如中耳炎、结膜炎和鼻窦炎。Hib疫苗仅预防b型流感嗜血杆菌毒株;目前尚无针对非B型或不可分型菌株的疫苗。流感嗜血杆菌定植于人类上呼吸道,通过吸入呼吸道飞沫或直接接触呼吸道分泌物在人与人之间传播。
在美国,大多数Hib疾病发生在未接种疫苗和免疫接种不足的婴儿和儿童(初级系列接种不完整或缺乏加强剂量的婴儿和儿童)以及年龄太小而无法完成初级免疫系列接种的婴儿中(27)(图3)。虽然罕见,但在完全接种初级系列疫苗和加强剂后确实会发生Hib病;在2002-2012年美国报告的年龄适龄接种状态的<5岁Hib病例患者中,16%完成了原发性Hib系列接种,43%完成了完整的Hib系列接种(图3)。Hib病在成人和>5岁儿童中并不常见。有关流感嗜血杆菌病的更多信息,请访问http://www.cdc.gov/hi-disease。
患有某些免疫功能低下疾病的人被认为患侵袭性Hib疾病的风险增加;这些情况可能包括:
- 功能性或解剖性无脾,
- HIV感染,
- 免疫球蛋白缺乏症,包括免疫球蛋白G2亚类缺乏症,
- 早期成分补体缺乏症,
- 接受造血干细胞移植,或
- 接受恶性肿瘤的化疗或放疗。
尽管接种了适当的疫苗,但仍发生Hib病的儿童应评估其是否存在免疫缺陷,使他们易患Hib病[28]。
从历史上看,美洲印第安人/阿拉斯加原住民(AI/AN)人群的Hib疾病和定植率高于美国一般人群,与其他美国婴儿人群(6-7个月)相比,疾病高峰期(4-6个月)(29-31)。在1985年引入疫苗之前,阿拉斯加AN儿童的发病率是非AN儿童的五倍(4)。尽管在接种疫苗后时代,AI/AN儿童的Hib发病率有所下降,但仍高于非AI/AN儿童。在1998-2009年期间,美国<5岁儿童的Hib病年平均发病率(1.3/100,000)是白人(0.16/100,000)和黑人(0.12/100,000)儿童(27)的8-10倍。
Hib疫苗的开发
1985年在美国获准使用的第一款Hib疫苗是一种单价疫苗,由来自b型菌株的纯化聚核糖基核糖醇磷酸(PRP)荚膜材料组成。尽管该疫苗在芬兰≥18个月大儿童的试验中非常有效,但美国的上市后有效性研究显示出可变的有效性(-69%-88%)(32)。PRP疫苗对<18个月大的儿童无效,因为对PRP多糖的免疫反应不依赖T淋巴细胞(13 )。PRP多糖与含有T淋巴细胞表位的蛋白质载体结合,赋予疫苗T淋巴细胞依赖性特征。这种结合增强了对PRP抗原的免疫反应,尤其是在小婴儿中,并导致免疫记忆(例如记忆删除反应)(33)。研究表明,对侵袭性Hib疾病的长期保护与未接种疫苗儿童的抗PRP水平≥0.15μg/ml)和接种疫苗的儿童的抗PRP水平≥1.0μg/ml相关(34,35)。
到1989年,三种单价Hib结合疫苗获准用于≥15个月大的儿童(29)。1990年末,其中两种结合疫苗获准用于婴儿(36,37)。自1990年以来,来自众多制造商的其他Hib疫苗已获得许可,目前已在美国使用,包括单价Hib结合疫苗和含有Hib结合疫苗的联合疫苗。美国目前没有使用多糖Hib疫苗。
目前已获得许可和可用的Hib单价结合疫苗
截至2014年1月1日,三种单价PRP多糖-蛋白结合疫苗已获得美国食品和药物管理局(FDA)的许可,并已在美国上市:PRP-OMP(PedvaxHIB,MerckandCo.,Inc.,WhitehouseStation,NewJersey)、PRP-T(ActHIB,SanofiPasteur,Inc.,Swiftwater,Pennsylvania)和PRP-T(Hiberix,GlaxoSmithKline,ResearchTrianglePark,NorthCarolina)(表1)。
1990年12月,PRP-OMP(PedvaxHIB)被FDA批准为2个月和4个月婴儿的2剂基础系列疫苗,在12个月大时加强剂量(第3剂)(39)。PRP-OMP含有与脑膜炎奈瑟菌血清群B的B11菌株的外膜蛋白复合物(OMPC)偶联的纯化PRP。更多信息可在包装说明书中找到,网址为http://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM253652.pdf .
1993年3月,PRP-T(ActHIB)被FDA批准为2、4和6个月婴儿的3剂初级系列疫苗,在15个月大时加强剂量(第4剂)[40]。该疫苗含有与破伤风类毒素偶联的纯化PRP。更多信息可在包装说明书中找到,网址为http://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM109841.pdf .
2009年8月,PRP-T(Hiberix)获得FDA许可,用于Hib疫苗系列的加强剂量(即第3剂或第4剂,具体取决于用于初级系列的疫苗类型),用于15个月至4岁接受Hib初级系列接种的儿童(16)。该疫苗含有与破伤风类毒素偶联的纯化PRP。更多信息可在包装说明书中找到,网址为http://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM179530.pdf .
目前已获许可和可用的Hib组合结合疫苗
截至2014年1月1日,含有b型流感嗜血杆菌结合疫苗的三种联合疫苗已获得FDA许可,并已在美国上市:PRP-OMP/HepB(Comvax,MerckandCo.,Inc.,WhitehouseStation,NewJersey),DTaP-IPV/PRP-T(Pentacel,SanofiPasteur,Inc.,Swiftwater,Pennsylvania)和MenCY/PRP-T(MenHibRix,GlaxoSmithKline,Inc.,Rixensart,Belgium)(表1)。
1996年10月,PRP-OMP/HepB(Comvax)获得FDA许可,用于2、4和12至15个月婴儿的侵袭性Hib疾病和乙型肝炎感染疫苗接种(14)。该疫苗包括PedvaxHIB(PRP-OMP)和RecombivaxHB(乙型肝炎表面抗原)中使用的抗原成分。更多信息可在包装说明书中找到,网址为http://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM109869.pdf .
2008年6月,DTaP/IPV/PRP-T(Pentacel)获得FDA许可,用于2、4、6和15至18个月婴儿的侵袭性Hib病、白喉、破伤风、百日咳和脊髓灰质炎疫苗接种(15)。不适用于4至6岁的DTaP/IPV加强剂量。该疫苗包括ActHIB中使用的抗原成分(PRP-T)和脊髓灰质炎。更多信息可在包装说明书中找到,网址为http://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM109810.pdf .
2012年6月,MenCY/PRP-T(MenHibRix)获得FDA许可,用于2、4、6和12至15个月(17 )。脑膜炎球菌病风险增加的婴儿†应接种4剂系列的MenCY/PRP-T疫苗。仅建议对脑膜炎球菌病风险增加的婴儿进行常规脑膜炎球菌疫苗接种。然而,MenCY/PRP-T可用于任何婴儿的常规Hib疫苗接种。关于使用MenCY/PRP-T的MenCY成分的进一步建议之前已发表(17 )。更多疫苗信息可在包装说明书中找到,网址为http://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM308577.pdf .
当前许可和可用的Hib疫苗的免疫原性
在初级系列研究后,可检测PedvaxHib和ActHib的保护性抗体水平(41–43)。然而,疫苗在抗体反应的时间上有所不同。PedvaxHib在第一次接种后产生显著的抗体反应,第二次或第三次接种后几何平均抗体浓度进一步增加(41,42,44–46)。因此,PedvaxHib被许可为2剂初级系列。PedvaxHib在接种2剂系列疫苗的纳瓦霍婴儿中的有效性为93%-100%(13 ,41,47)。
第一剂和第二剂ActHIB后,几何平均抗体浓度保持在或低于1.0μg/ml,但在第三剂后观察到保护性抗体反应(41,42,45,48,49)。ActHIB的有效性研究在美国提前终止,并获得了第一种Hib结合疫苗的许可;在研究终止时,疫苗接种者中没有报告侵袭性Hib疾病病例(13 ,47)。一项在英国56,000名受试者中进行的PRP-T前瞻性对照试验发现,有效性为95%(95%置信区间[CI]=74%–100%)(47)。
PRP-T和PRP-OMP疫苗完成初级系列接种后抗体水平下降,需要在12-15个月大时接种加强剂以维持保护性抗体水平。在12-15月龄时加强剂量的PedvaxHib、ActHib和Hiberix可提供针对侵袭性Hib疾病的保护性抗体水平(16,44,46,48,50,51)。
在接种第二剂Comvax疫苗初级剂量和加强剂量后,观察到与接受单独接种的PedVaxHIB和RecombivaxHB疫苗后检测到的保护性抗体反应相当(14,52)。Pentacel和MenHibRix诱导的保护性抗体反应在第三次初级剂量和加强剂量后不劣于单独接种的PRP-T疫苗(53–59)。
未观察到任何可用的单价或联合Hib疫苗以及同时接种其他常规儿童疫苗的临床显着免疫干扰(51,52,60–67;ACIP,未公布的数据,2009年)。
目前已获许可和可用的Hib疫苗的安全性
在许可前试验中,对PedvaxHib、ActHib和Hiberix的不良反应并不常见,通常较轻,通常在12-24小时内消退(16,41,43,46,49,50)。Comvax、Pentacel和MenHibRix的不良反应发生率与单独接种的疫苗相似(14,52–54,68)。
接种Hib疫苗后不良事件的上市后监测主要由美国的两个系统进行:VAERS和疫苗安全数据链(VSD)。VAERS是由CDC和FDA联合运营的国家被动监测系统,接收来自卫生保健人员、制造商、疫苗接受者和其他人员的疫苗接种后不良事件的报告(69)。VAERS可以生成疫苗安全性假设,但不能测试疫苗安全性假设,并且受到一些限制,包括报告偏倚和数据质量不一致(69)。VSD是CDC与九个综合卫生保健组织之间的合作,开展基于人群的疫苗接种安全性研究,以评估因审查医学文献、向VAERS报告、免疫计划的变化或引入新疫苗而产生的假设(70)。
向VAERS报告的安全数据
在1990年1月1日至2013年5月31日期间,VAERS收到了29,047份报告,涉及在美国接受Hib疫苗(PedvaxHIB、ActHIB、Hiberix、Comvax和Pentacel);26,375份(91%)报告涉及<2岁的儿童。在95%的病例报告中,Hib疫苗与一种或多种其他疫苗同时接种。从接种疫苗到发生不良事件的中位时间为1天。最常报告的不良事件是发热(31%)、哭泣(11%)、注射部位红斑(11%)、易激惹(10%)和皮疹(9%)。
在所有Hib疫苗报告中,大约17%被编码为《联邦法规》(71)中定义的严重(即报告包含该事件导致死亡、危及生命的疾病、住院、住院时间延长或永久性残疾的信息)。在5,062份被编码为严重的报告中,最常见的不良事件是发烧(37%)、呕吐(21%)、抽搐(20%)、易激惹(17%)和肠套叠(11%)。在97%的肠套叠报告中,轮状病毒疫苗是同时接种的,可能促使报告了这一不良事件。
VAERS收到的报告显示,在1990年1月1日至2013年5月31日期间,有878例含Hib疫苗死亡。其中620例(71%)的死亡病例有尸检报告或其他医疗记录,其中最常见的死因是婴儿猝死综合症(52%)。其他死因包括呼吸系统(9%)、心血管(5%)、感染性(5%)、神经系统(3%)和胃肠道(2%)疾病。在14%的报告中,病因未确定,在11%的报告中,报告了各种其他原因(例如窒息和钝器外伤)。
含b型流感嗜血杆菌的疫苗的报告频率与其他推荐的儿童疫苗相似。在任何Hib疫苗的VAERS数据中均未观察到异常或意外的安全模式。
基于人群的安全性调查结果
文献综述未发现单价Hib疫苗的许可后安全性研究。然而,VSD在2008年9月至2011年1月期间对Hib联合疫苗DTaP-IPV-Hib(Pentacel)进行了观察性研究(55)。与接种含DTaP的对照疫苗(即不含Hib)的儿童相比,接种DTaP-IPV-Hib疫苗的1-2岁儿童发热风险升高(RR=1.83;95%CI=1.34-2.50)。DTaP-IPV-Hib疫苗与任何其他医学上发生的不良健康事件无关。
1997年7月至2000年12月期间,华盛顿州西雅图的一家管理式医疗组织对Hib-HepB(Comvax)进行了独立的上市后安全性评估(72)。回顾性队列研究使用ICD-9代码评估了Hib-HepB接种后1-30天报告的不良事件,并与两个对照组(历史对照组和自我对照组)的不良事件发生率进行了比较。在研究期间,共接种了27,802剂疫苗,在任何医疗保健环境中接种Comvax后0-30天内记录了111,129例诊断。有127个独立的不良事件代码具有显着的相对风险升高,66个代码的相对风险显着降低(p<0.5)。在病历审查中,呼吸道或胃肠道疾病没有一致的模式;发热结果似乎是由于数据收集的变化或同时接种麻疹、腮腺炎和风疹病毒疫苗所致。研究期间发生了两例死亡,均被认为与疫苗接种无关。严重不良事件与Hib-HepB疫苗接种之间没有确定一致的关联,并且该疫苗具有良好的安全性。
b型流感嗜血杆菌疫苗使用建议
常规疫苗接种建议
ACIP建议从2个月大开始常规接种结合型Hib疫苗系列(单价疫苗[PedvaxHib(PRP-OMP)或ActHib(PRP-T)]或Hib疫苗联合HepB[Comvax]、DTaP/IPV[Pentacel]或MenCY[MenHibRix])。2-6月龄婴儿应接受3剂系列HibPRP-T(ActHib、Pentacel或MenHibRix)或2剂HibPRP-OMP系列(PedvaxHib或Comvax)(表1)。第一剂最早可在6周龄时接种。建议在12-15月龄和最近一次Hib疫苗接种后至少8周接种任何获得许可的结合Hib疫苗(单价疫苗[PedvaxHib(PRP-OMP)、ActHib(PRP-T)或Hiberix(PRP-T)]或Hib疫苗联合HepB[Comvax]或DTaP/IPV[Pentacel]或MenCY[MenHibRix])的加强剂量(将为第3剂或第4剂,取决于初级系列中使用的疫苗类型)(表1)。
已发现Hib疫苗在免疫功能低下的患者中具有免疫原性,但免疫原性随免疫能力程度(13 ,73–84)。除某些情况外,已接种疫苗(已接种Hib初级系列疫苗和≥12个月大时接种加强剂)的侵袭性Hib疾病风险增加的患者不需要进一步的常规免疫接种(表2)。
b型流感嗜血杆菌疫苗使用指南
常规疫苗接种指南
初级系列(2剂或3剂)的剂量应间隔8周接种;但是,如有必要,剂量之间的间隔为4周是可以接受的。如果在初级系列中接种了两剂PRP-OMP疫苗(PedvaxHIB或Comvax),则不需要接种第三剂初级疫苗。如果PRP-OMP疫苗(PedvaxHib或Comvax)未在初级系列中接种两剂,或者不确定之前接种了哪些产品,则需要接种第三剂初级系列疫苗Hib结合疫苗才能完成初级系列。任何单价或联合Hib结合疫苗都可以用于加强剂量(剂量3或4,取决于初级系列中使用的疫苗类型),无论用于初级系列的产品如何。Hiberix应仅用于12个月至4岁儿童的加强剂量(第3剂或第4剂,取决于用于初级系列疫苗的疫苗类型),这些儿童之前至少接种过1剂Hib疫苗。
追赶时间表指南
如果第一次疫苗接种延迟了>1个月,则应遵循推荐的补种时间表(可在http://www.cdc.gov/vaccines/schedules/hcp/child-adolescent.html处获得)。
- 对于在<7个月大时接种第一剂的未接种疫苗的婴儿,应接种2剂PRP-OMP或3剂PRP-T疫苗,两剂之间至少间隔4周。只有在12月龄之前接种了2剂或3剂初级剂量(取决于所使用的疫苗类型)时,才需要在12至15月龄时接种加强剂(第3剂或第4剂,具体取决于用于初级系列的疫苗类型)。
- 对于在7至11个月大时接种第一剂的未接种疫苗的婴儿,应至少在4周后接种第二剂(无论第一剂使用何种Hib结合疫苗[PRP-T或PRP-OMP])。第三剂(也是最后一剂)应在12至15个月或第二剂后8周(以较晚日期为准)接种。
- 对于在12至14个月大时接种第一剂的未接种疫苗的儿童,应在接种第一剂后8周接种第二剂任何单价或联合Hib结合疫苗。不需要第三剂。
- 对于在15至59个月大时接种第一剂的未接种疫苗的儿童,无需再接种任何单价或联合Hib结合疫苗。
- 以前未接种疫苗的≥60个月大且不被视为高危儿童通常对Hib疾病具有免疫力,不需要补种疫苗接种。
对于<12个月大、Hib疾病风险增加且延迟或未接种Hib疫苗的儿童,应遵循推荐的补种时间表。针对Hib病风险较高、延迟接种或未接种Hib疫苗的12-59月龄儿童的补种指导见下文(参见“高危人群”;表2)。
特殊人群疫苗接种指南
美洲印第安人/阿拉斯加原住民
Hib脑膜炎发病率在AI/AN婴儿中比美国其他婴儿人群(6-7个月)更年轻(4-6个月)达到峰值(29-31)。AI/AN婴儿首选接种含有PRP-OMP(PedvaxHIB或Comvax)的2剂Hib疫苗初级系列,以提供早期保护,因为这些疫苗在第一次接种后会产生保护性抗体反应(41–43,51,52,85)。如果第一剂疫苗接种延迟了>1个月,则应遵循推荐的补种时间表(可在http://www.cdc.gov/vaccines/schedules/hcp/child-adolescent.html处获得)。建议在12至15个月大时接种Hib疫苗加强剂(第3剂);对于加强剂量,没有首选的疫苗配方(即,任何获得许可的Hib结合疫苗都是可以接受的)。阿拉斯加(30,86)证明了这种早期保护的重要性。1991年7月至1996年1月期间,阿拉斯加在全州范围内使用了PRP-OMP疫苗,AN和非本地儿童的Hib发病率降低了>90%(30,86)。在1996-1997年期间,在全州疫苗改为包含非OMPHib成分的联合疫苗后,AN儿童的Hib发病率显着增加(19.8至91.1例/100,000名<5岁儿童,p<0.001),而在非本地儿童中保持不变(30,86)。疾病复发似乎归因于使用Hib疫苗,该疫苗在密切接触者中通过口咽定植持续暴露于Hib的儿童中没有达到早期保护性抗体浓度。在阿拉斯加恢复使用含有PRP-OMP的疫苗后,AN儿童的Hib病发病率降至每100,00名<5岁儿童不到6例(30,86)。
患有侵袭性Hib疾病的<24个月大的儿童
发生侵袭性Hib疾病的<24个月大儿童仍有发生第二次发作的风险,因为该年龄组的自然感染不能可靠地导致保护性抗体水平的产生。无论之前是否接种过Hib,这些儿童都应被视为未接种疫苗,并应根据未接种疫苗儿童的适龄时间表接种Hib疫苗剂量(28,87-89)。发生侵袭性Hib病的<24月龄儿童应在发病后4周开始接受初次疫苗接种或再次接种第二针。
早产儿
医学上稳定的早产儿§应从2个月大开始接种疫苗,根据实际年龄,根据为其他婴儿推荐的时间表。
高危人群
被认为侵袭性Hib疾病风险增加的人包括功能性或解剖性无脾、HIV感染、免疫球蛋白缺乏症(包括免疫球蛋白G2亚类缺乏症)或早期成分补体缺乏症患者、造血干细胞移植受者以及接受恶性肿瘤化疗或放疗的患者。对于未接种疫苗的无脾或计划进行择期脾切除术的成人,应接种单剂经许可的Hib结合疫苗。一些专家建议在择期脾切除术前接种一剂,无论既往疫苗接种史如何(22)。基于脾切除术前Hib疫苗接种时间的有限数据,专家建议在手术前至少14天接种疫苗(18 ,19,23)(表2)。
未接种≥60个月的HIV感染儿童应接种1剂Hib疫苗。接种了完整的3剂或4剂疫苗系列(取决于用于初级系列的疫苗类型)的HIV感染儿童是否会从额外的Hib剂量中受益尚不清楚。由于HIV感染成人中Hib感染的发生率较低,因此不建议HIV感染的成年人接种Hib疫苗(21 ,23)(表2)。
12-59月龄儿童(无脾、HIV感染、免疫球蛋白缺乏症、早期成分补体缺乏症或化疗或放疗受者)患Hib病的风险增加,且在12月龄前未接种或仅接种1剂Hib结合疫苗,应间隔8周再接种2剂疫苗;在12月龄前接种2剂或更多剂Hib结合疫苗的儿童应在最后一剂后至少8周再接种1剂(表2)。
应避免在化疗或放疗期间接种Hib疫苗,因为抗体反应可能欠佳。在开始免疫抑制治疗后14天内或在接受免疫抑制治疗期间接种疫苗的患者应被视为未接种疫苗,应在化疗完成后至少3个月开始重复接种。化疗前14天以上接种疫苗的患者不需要重新接种疫苗,但造血干细胞移植受者除外,无论疫苗接种史如何,他们都应在成功移植后6-12个月重新接种3剂方案(80);至少4周应分开剂量(表2)。
疫苗接种指南
Hib疫苗以0.5mL的个体剂量肌肉注射。接种任何疫苗后发生的不良事件都应报告给VAERS。报告可以在线、传真或邮寄方式提交给VAERS。有关VAERS的更多信息,请致电1-800-822-7967(免费)或在线http://vaers.hhs.gov.
疫苗产品的互换性
研究表明,与相同的单价产品相比,获得许可的一剂和加强剂的单价Hib结合疫苗的任何组合都能提供相当或更高的抗体水平(33,44-46,51,91-93)。因此,获得许可的单价Hib结合疫苗被认为可以互换为初级剂量和加强剂量(第3剂或第4剂,取决于用于初级系列的疫苗类型)(18 ,94)。关于联合疫苗与其他联合疫苗或单价疫苗的互换性的数据有限(52,63)。在可行的情况下,后续剂量应使用相同的联合疫苗;但是,如果使用不同品牌的剂量,则应认为该剂量有效,无需重复。
注意事项和禁忌症
含Hib的单价疫苗的不良反应并不常见,通常较轻,通常在12-24小时内消退(41-43,49)。Hib联合疫苗的不良反应发生率与单独接种的疫苗相似(14,33,52-54)。有关特定疫苗不良反应的更完整信息,请参见每种疫苗的包装说明书,以及CDC的http://www.cdc.gov/vaccines/vac-gen/side-effects.htm。
<6周龄的婴儿禁用含Hib疫苗的疫苗接种。已知对疫苗的任何成分有严重过敏反应的人禁用接种含Hib疫苗的疫苗。Hiberix预充式注射器的尖端盖可能含有天然橡胶乳胶,而Comvax、ActHib和PedvaxHIB的小瓶塞含有天然橡胶乳胶,这可能会对乳胶敏感的人引起过敏反应。因此,已知对干天然橡胶乳胶有严重过敏反应的人禁用接种这些疫苗(48,50–52)。Pentacel和MenHibRix的小瓶塞不含乳胶(63,95)。对酵母过敏的患者禁忌接种Comvax疫苗(52)。
与所有含百日咳的疫苗一样,在对有发热≥40.5oC、低渗性低反应发作、接种含百日咳疫苗后48小时内持续持续≥3小时的持续性无法安慰的哭泣或接种含百日咳疫苗后3天内癫痫发作的人施用Pentacel之前,应考虑益处和风险(63)。
Hib单价和联合结合疫苗是灭活疫苗,可用于免疫功能低下的人。然而,对疫苗的免疫反应可能不理想(18 )。
化学预防指导
b型流感嗜血杆菌病(与患者接触后60天内发生的疾病)的继发性病例会发生,但很少见。<48个月(2.1%)的家庭接触者继发性发作率更高,尤其是<12个月(6%)和<24个月(3%)(29)的家庭接触者。关于儿童保育接触者继发性疾病风险的数据相互矛盾,但被认为低于家庭接触者(29)。推荐使用利福平进行化学预防,因为它在呼吸道分泌物中达到高浓度,并在>95%的携带者中根除鼻咽携带(96-99)。目前尚无针对侵袭性非b型流感嗜血杆菌疾病病例的控制措施指南。不建议对非b型流感嗜血杆菌所致侵袭性疾病患者的接触者进行化学预防,因为尚未记录疾病继发传播的病例(100,101)。
浸润性Hib疾病索引患者
接受头孢噻肟或头孢曲松以外的抗生素治疗且年龄为<2岁的指示患者应在出院前接受利福平治疗(22)。由于头孢噻肟和头孢曲松可根除Hib定植,因此接受这两种抗菌药物治疗的患者不需要预防。
家庭联系人
建议对指示患者(除非使用头孢噻肟或头孢曲松治疗)以及有<4岁未全剂量接种疫苗或<18岁免疫功能低下成员的家庭中的所有家庭接触者进行利福平化学预防,无论其疫苗接种状态如何(22)。
托儿所联系方式
当60天内发生两例或两例以上侵袭性Hib病病例,且未免疫或免疫接种不足的儿童就诊时,建议在托儿所进行利福平化学预防(22)。当需要预防时,应为所有参与者(无论年龄或疫苗接种状况如何)以及托儿所开具处方。
结论
Hib病曾经是美国<5岁儿童细菌性脑膜炎的主要原因。由于在美国引进了Hib疫苗并持续保持高疫苗覆盖率,Hib疾病现在很少见,发病率低于2020年健康人群的目标。然而,在未接种疫苗和免疫接种不足的儿童中,侵袭性Hib疾病的风险仍然存在,这凸显了全面接种初级系列和加强剂量的重要性。虽然Hib疾病并不常见,但有必要使用完整的血清分型数据进行持续的流感嗜血杆菌监测,以便识别所有Hib病例并采取适当的化学预防措施。
*工作组成员名单见第14页。
†患有持续性补体成分缺乏症的婴儿、功能性或解剖性无脾(包括镰状细胞病)的婴儿、建议接种疫苗的脑膜炎球菌病暴发社区的健康婴儿,以及前往或居住在高流行性或流行性脑膜炎球菌病地区的婴儿。
§对于严重感染、代谢疾病或急性肾脏、心血管、神经系统或呼吸道疾病,不需要持续治疗的婴儿,并且表现出持续恢复的临床病程和稳定生长模式的婴儿(90)。
图1.1980-2012年<5岁儿童侵袭性b型流感嗜血杆菌(Hib)疾病的估计年发病率*—美国

资料来源:1980-1997年:国家细菌性脑膜炎报告系统和国家法定传染病监测数据;AdamsWG、DeaverKA、CochiSL等。Hib疫苗时代儿童b型流感嗜血杆菌(Hib)疾病的下降。美国医学会杂志1993;269:221–6;美国疾病预防控制中心(CDC)在消除婴儿和儿童b型流感嗜血杆菌疾病方面的进展——美国,1987-1995年。MMWR1996年;45:901–6;美国疾病预防控制中心(CDC)在消除婴儿和儿童b型流感嗜血杆菌疾病方面的进展——美国,1987-1997年。MMWR1998年;47:993–8.1998-2009年:NNDSS和活性细菌核心监测(ABCs)数据。2010-2012年:估计美国人口的ABC病例。
*每100,000人。
替代文本:该图显示了1980-2012年美国<5岁儿童每100,000人中侵袭性流感嗜血杆菌b型(Hib)疾病的估计发病率。在获得用于≥18个月儿童和≥2个月婴儿的疫苗许可后,发病率急剧下降。
图2.2000-2012年<5岁儿童侵袭性流感嗜血杆菌b型感染的估计年发病率*—美国
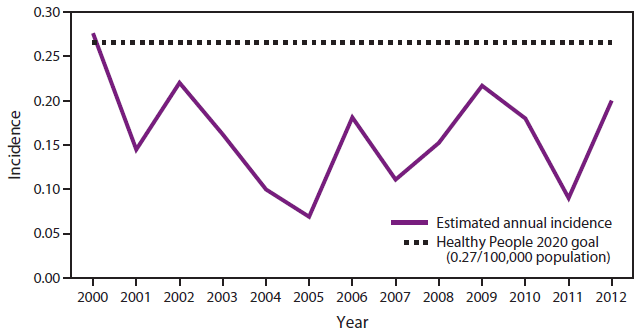
来源:国家法定传染病监测和活性细菌核心监测(ABC)数据。
*每100,000人。
替代文本:该图显示了2000-2012年美国<5岁儿童每100,000人中侵袭性流感嗜血杆菌b型疾病的估计发病率。自2000年以来的所有年份,发病率均低于2020年健康人群每100,000人0.27例的目标(略高于2000年的目标)。
图3.2002-2012年美国<5岁侵袭性b型流感嗜血杆菌(Hib)病例百分比*,按疫苗接种状况分列
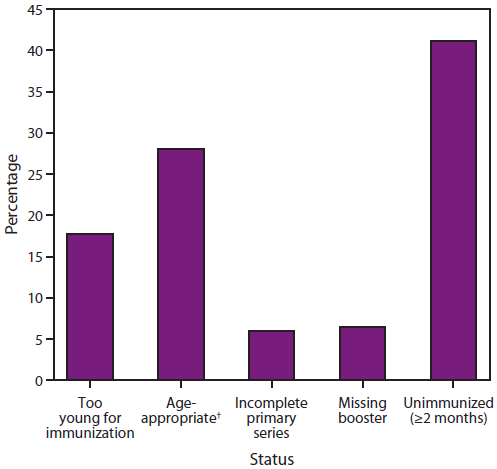
来源:活性细菌核心监测系统和国家法定传染病监测系统。
*N=265。另有57名<5岁Hib儿童的疫苗接种状态未知,被排除在外。
†在具有适龄疫苗接种状态的人群中,41%的人年龄太小而无法完成初级系列,16%完成了初级系列,43%完成了完整系列。
替代文本:该图显示了2002-2012年美国<5岁儿童感染侵袭性b型流感嗜血杆菌(Hib)病例的百分比,按疫苗接种情况分列。在具有适龄疫苗接种状态的人群中,41%的人年龄太小而无法完成初级系列,16%完成了初级系列,43%完成了完整系列。
表1.截至2014年1月,b型流感嗜血杆菌(Hib)结合疫苗已在美国获得许可和上市
| 疫苗产品 | 制造商 | 商品名 | 组成 | 初级系列 | 加强剂量 |
| 单价疫苗 | |||||
| PRP-OMP*,† | 默克公司 | PedvaxHIB | PRP偶联OMP | 2、4个月 | 12–15个月 |
| PRP-T型 | 赛诺菲巴斯德 | ActHIB | PRP与破伤风类毒素偶联 | 2、4、6个月 | 12–15个月 |
| PRP-T型 | 葛兰素史克 | Hiberix | PRP与破伤风类毒素偶联 | 未获得初级系列的许可 | 12–15个月§ |
| 联合疫苗 | |||||
| PRP-OMP-HepB*,† | 默克公司 | Comvax | PRP-OMP+乙型肝炎疫苗 | 2、4个月 | 12–15个月 |
| DTaP-IPV/PRP-T | 赛诺菲巴斯德 | Pentacel | DTaP-IPV+PRP-T | 2、4、6个月 | 15–18个月¶ |
| MenCY/PRP-T** | 葛兰素史克 | MenHibRix | MenCY+PRP-T | 2、4、6个月 | 12–15个月 |
| 源:改编自美国儿科学会。流感嗜血杆菌感染。PickeringL、BakerC、KimberlinD、LongS、编辑。红皮书:传染病委员会2012年报告。伊利诺伊州麋鹿格罗夫村:美国儿科学会;2012:345–52. *如果PRP-OMP疫苗未在初级系列中作为两剂接种,或者如果不确定之前接种了哪些产品,则需要接种第三剂Hib结合疫苗才能完成初级系列。 †美洲印第安人/阿拉斯加原住民儿童的首选疫苗。 §为了便于及时接种加强疫苗,Hiberix最早可以在12个月大时接种,根据常规和补种免疫的Hib疫苗接种时间表(CDC.b型流感嗜血杆菌[Hib]疫苗[Hiberix]的许可和Hib疫苗使用的最新建议。MMWR2009年;58:1008–9) ¶加强剂量最早可在12个月大时接种,前提是自第三剂以来至少过去了6个月。 **MenCY/PRP-T的MenCY成分的建议之前已发表(CDC.婴儿脑膜炎球菌疫苗接种:免疫实践咨询委员会(ACIP)的建议和理由。MMWR2013年;62:52-4)。 | |||||
表2.高危人群b型流感嗜血杆菌(Hib)疫苗接种指南
| 高危人群* | b型流感嗜血杆菌疫苗接种指南 |
| 年龄<12个月的患者 | 遵循常规Hib疫苗接种建议 |
| 12-59个月的患者 | 如果在12个月前未接种疫苗或接受0或1剂:2剂,间隔 8周如果在12个月之前接受≥2剂:最后一次接种 后8周接种1剂如果在≥12个月时完成基础系列接种并接受加强剂量:无额外剂量 |
| <60个月接受化疗或放疗的患者† | 如果在开始治疗前≥14天接种的常规Hib剂量:不需要 重新接种如果在开始治疗后14天内接种或在治疗期间接种: 在治疗完成后至少3个月开始重复接种 |
| 接受择期脾切除术的≥15个月患者 | 如果未免疫:§手术前1剂¶ |
| >59个月的无脾患者和成人 | 如果未免疫:§1剂 |
| ≥60个月的HIV感染儿童 | 如果未免疫:§1剂 |
| HIV感染成人 | 不建议接种b型流感嗜血杆菌疫苗 |
| 所有年龄段的造血干细胞移植受者 | 无论Hib疫苗接种史如何:移植后6-12个月开始接种3剂(至少间隔4周) |
| *患有功能性或解剖学无脾、HIV感染、免疫球蛋白缺乏症(包括免疫球蛋白G2亚类缺乏症)或早期成分补体缺乏症的人、造血干细胞移植的受者以及接受恶性肿瘤化疗或放疗的人。 †一些专家建议对这些患者进行血清学检测(来源:RubinLG、LevinMJ、LjungmanP等人,2013年IDSA免疫功能低下宿主疫苗接种临床实践指南。临床感染Dis2013;[Epub印刷前]doi:10.1093/cid/cit684)。 §14个月后未接种初级系列和加强剂或至少1剂Hib疫苗的患者被视为未接种疫苗。 ¶一些专家建议在手术前至少14天接种疫苗(来源:CDC。关于免疫接种的一般性建议:免疫接种实践咨询委员会的建议。MMWR2011年;60[否。RR-2];疾病预防控制中心。免疫实践咨询委员会(ACIP)的建议:在免疫功能改变的人中使用疫苗和免疫球蛋白。MMWR1993年;42 [否。RR-4型];RubinLG,LevinMJ,LjungmanP,etal.2013IDSA免疫功能低下宿主疫苗接种临床实践指南。临床感染Dis2013;[印刷前的Epub]doi:10.1093/cid/cit684.)一些专家建议在择期脾切除术前接种一剂,无论既往疫苗接种史如何(来源:美国儿科学会。流感嗜血杆菌感染。在:PickeringL,BakerC,KimberlinD,LongS,编辑。红皮书:传染病委员会2012年报告。伊利诺伊州麋鹿格罗夫村:美国儿科学会;2012:345–52)。 | |
引用
- WengerJD,HightowerAW,FacklamRR,GaventaS,BroomeCV.美国细菌性脑膜炎,1986年:多州监测研究报告。J感染Dis1990;162:1316–23.
- 美国b型流感嗜血杆菌感染的流行病学。PediatrInfectDisJ1987年;6:779–82.
- AdamsWG、DeaverKA、CochiSL等。Hib疫苗时代儿童b型流感嗜血杆菌(Hib)疾病的下降。美国医学会杂志1993;269:221–6.
- BisgardKM、KaoA、LeakeJ、StrebelPM、PerkinsBA、WhartonM.美国流感嗜血杆菌侵袭性疾病,1994-1995年:疫苗可预防儿童疾病几乎消失。EmergInfectDis1998年;4:229–37.
- 美国疾病预防控制中心(CDC)在消除婴儿和儿童b型流感嗜血杆菌疾病方面的进展——美国,1987-1995年。MMWR1996年;45:901-6。
- 美国疾病预防控制中心(CDC)在消除婴儿和儿童b型流感嗜血杆菌疾病方面的进展——美国,1987-1997年。MMWR1998年;47:993-8。
- 美国疾病预防控制中心在消除婴儿和儿童b型流感嗜血杆菌疾病方面的进展——美国,1998-2000年。MMWR2002年;51:234-7。
- 美国卫生与公众服务部。健康人2020主题和目标。华盛顿特区:美国卫生与公众服务部;2013.可用于http://www.healthypeople.gov/2020/topicsobjectives2020/objectiveslist.aspx?topicid=23
 .
. - Mohle-BoetaniJ、AjelloG、BrenemanE等人。广泛接种b型流感嗜血杆菌结合疫苗后儿童携带b型流感嗜血杆菌。PediatrInfectDisJ1993年;12:589–93.
- TakalaA、EskolaJ、LeinonenM等人。减少接种Hib结合疫苗的儿童口咽部携带b型流感嗜血杆菌(Hib)。J感染Dis1991;164:982–6.
- BarbourM,PhilD.结合疫苗和b型流感嗜血杆菌的携带EmergInfectDis1996;2:176–82.
- LowtherSA,ShinodaN,JuniBA,etal.2008-2009年明尼苏达州儿童的b型流感嗜血杆菌感染、疫苗接种和流感嗜血杆菌携带。流行病学感染2012;140:566–74.
- 疾病预防控制中心。使用乙型嗜血杆菌结合疫苗和联合白喉、破伤风、百日咳和乙型嗜血杆菌疫苗的建议:免疫实践咨询委员会(ACIP)的建议。MMWR1993年;42(编号。RR-13号) .
- 美国食品和药物管理局(FDA)批准婴儿接种b型流感嗜血杆菌结合疫苗和乙型肝炎(重组)联合疫苗。MMWR1997年;46:107-9。
- 白喉和破伤风类毒素和无细胞百日咳吸附、灭活脊髓灰质炎病毒和嗜血杆菌 b结合疫苗的许可以及用于婴儿和儿童的指南。MMWR2008年;57:1079-80。
- 疾病预防控制中心。b型流感嗜血杆菌 (Hib)疫苗(Hiberix)的许可和Hib疫苗使用的最新建议。MMWR2009年;58:1008-9。
- 婴儿脑膜炎球菌疫苗接种:免疫实践咨询委员会(ACIP)的建议和理由。MMWR2013年;62:52–4 .
- 关于免疫接种的一般建议:免疫实践咨询委员会(ACIP)的建议。MMWR2011年;60(编号RR-2型) .
- 疾病预防控制中心。免疫实践咨询委员会(ACIP)的建议:在免疫功能改变的人中使用疫苗和免疫球蛋白。MMWR1993年;42(编号。RR-4)。
- CDC.HIV暴露和HIV感染儿童机会性感染预防和治疗指南:CDC、美国国立卫生研究院、美国传染病学会HIV医学协会、儿科传染病学会和美国儿科学会的建议。MMWR2009年;58(编号。RR-11号) .
- HIV感染成人和青少年机会性感染的预防和治疗指南:CDC、美国国立卫生研究院和美国传染病学会HIV医学协会的建议。MMWR2009年;58(编号。RR-4型) .
- 美国儿科学会。流感嗜血杆菌感染。在:PickeringL,BakerC,KimberlinD,LongS,编辑。红皮书:传染病委员会2012年报告。伊利诺伊州麋鹿格罗夫村:美国儿科学会;2012:345–52.
- RubinLG、LevinMJ、LjungmanP等人,2013年IDSA免疫感染宿主疫苗接种临床实践指南。临床感染Dis2013;[印刷前的Epub]doi:10.1093/cid/cit684.
- SchuchatA、HilgerT、ZellE等人。新发感染计划网络的主动细菌核心监测。EmergInfectDis2001年;7:92–9.
- BruceMG、DeeksSL、ZulzT等人。2000-2005年北美北极地区A型流感嗜血杆菌血清型的流行病学。EmergInfectDis2008年;14:48–55.
- AddersonEE、ByingtonL、SpencerL等人。侵袭性血清型A流感嗜血杆菌感染,其毒力基因型类似于b型流感嗜血杆菌:疫苗时代的新兴病原体?儿科2001;108:E18.
- BriereEJM,JacksonM,ShahSG,etal.b型流感嗜血杆菌疾病和疫苗加强剂量推迟,美国,1998-2009年。儿科2012;130:414–20.
- HeathP、BooyR、GriffithsH等人。与b型流感嗜血杆菌相关的临床和免疫危险因素导致儿童期结合疫苗失败。临床感染Dis2000;31:973–80.
- 温格JD,WardJI.流感嗜血杆菌疫苗。在:PlotkinSA,OrensteinWA,OffitPA,编辑疫苗。第4版:WBSaundersCompany;2003:229–68.
- 辛格尔顿R、哈米特L、轩尼诗T等人。阿拉斯加b型流感嗜血杆菌的经验:控制疫苗可预防疾病的经验教训。儿科2006;118:E421-9。
- CoulehanJ,MichaelsR,HallowellC.纳瓦霍印第安人B型流感嗜血杆菌疾病的流行病学。公共卫生代表1984;99:404–9.
- WardJI、BroomeCV、HarrisonLH、ShinefieldH、BlackS.b型流感嗜血杆菌疫苗:未来的教训。儿科1988;81:886–93.
- 墨菲电视台。流感嗜血杆菌疫苗:1997年。在:AronoffSC.儿科传染病的进展。加利福尼亚州圣地亚哥:Mosby-YearBook,Inc.;1998.
- 夏皮罗ED,病房JI。b型流感嗜血杆菌引起的疾病的流行病学和预防,流行病学修订版,1991年;13:113–42.
- 凯蒂H、佩尔托拉H、卡兰科V、马克拉PH。b型流感嗜血杆菌荚膜多糖血清抗体的保护水平。JInfectDis1983;147:1100。
- BlackSB,ShinefieldHR,FiremanB,HiattR,PolenM,VittinghoffE.寡糖结合物b型流感嗜血杆菌(HbOC)疫苗在美国61,080名儿童人群中的婴儿期疗效。PediatrInfectDisJ1991年;10:97–104.
- 桑托舍姆M、沃尔夫M、里德R、霍亨博肯M、贝特曼M.由b型流感嗜血杆菌多糖和脑膜炎奈瑟菌外膜蛋白复合物组成的结合疫苗对纳瓦霍婴儿的疗效。NEnglJMed1991年;324:1767–72.
- 美国食品和药物管理局。在美国获准用于免疫和分销的疫苗的完整清单。马里兰州银泉市:美国食品和药物管理局;2012.可用于http://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm093833.htm
 .
. - 美国食品和药物管理局批准将b型嗜血杆菌结合疫苗用于婴儿。MMWR1990年;39:925.
- 美国食品和药物管理局(FDA)批准使用一种新的b型嗜血杆菌结合疫苗以及一种用于婴儿和儿童的白喉-破伤风-百日咳和B型嗜血杆菌联合疫苗。MMWR1993年;42:296-8。
- DeckerMD,EdwardsKM,BradleyR,PalmerP.四种结合流感嗜血杆菌b型疫苗婴儿的比较试验。JPediatr1992年;120:184–9.
- DeckerMD,EdwardsKM.b型流感嗜血杆菌疫苗:历史、选择和比较。PediatrInfectDisJ1998年;17:S113-6。
- FritzellB,PlotkinS.b型流感嗜血杆菌荚膜多糖-破伤风蛋白结合疫苗的有效性和安全性。JPediatr1992年;121:355–62.
- AndersonE、DeckerMD、EnglundJ等人。结合的b型流感嗜血杆菌疫苗在婴儿中的互换性。美国医学会杂志1995;273:849–53.
- 贝利KM、施瓦布JG、BallancoGA、DaumRS。b型流感嗜血杆菌疫苗在初级系列中的互换性:两剂混合方案的评估。儿科1996;98:898–904.
- GreenbergDP,FeldmanS.疫苗互换性。ClinPediatr(Phila)2003年;42:93–9.
- HeathP.B型流感嗜血杆菌结合疫苗:疗效数据综述。PediatrInfectDisJ1998年;17(增刊):S117–22。
- 赛诺菲巴斯德。嗜血杆菌b结合疫苗(破伤风类毒素结合物)ActHIB[包装说明书]。可在http://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM109841.pdf .
- HolmesSJ、FritzellB、GuitoKP等。婴儿流感嗜血杆菌b型多糖-破伤风类毒素结合疫苗的免疫原性。AmJDisChild1993年;147:832–6.
- 葛兰素史克。HIBERIX(嗜血杆菌b结合疫苗[破伤风类毒素结合物])[包装说明书]。可在http://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM179530.pdf .
- Merck&Co.,Inc.LiquidPedvaxHIB(嗜血杆菌b结合疫苗(脑膜炎球菌蛋白结合物)。[包装说明书]可在http://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM253652.pdf .)
- Merck&Co.,Inc.COMVAX(嗜血杆菌b结合物[脑膜炎球菌蛋白结合物]和乙型肝炎(重组)疫苗)[包装说明书]。可在http://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM109869.pdf .
- GuerraFA,BlatterMM,GreenbergDP,PichicheroM,NoriegaFR.Pentacel研究G.五价疫苗的安全性和免疫原性与美国婴幼儿单独接种许可等效疫苗以及学龄前加强剂量前抗体的持久性相比:一项随机临床试验。儿科2009;123:301–12.
- 布莱克S,格林伯格DP。白喉、破伤风、五组分无细胞百日咳、脊髓灰质炎病毒和b型流感嗜血杆菌联合疫苗。2005年专家修订疫苗;4:793–805.
- NelsonJ、YuO、Dominguez-IslasC等人。将组序贯方法应用于观察性许可后疫苗安全性监测:五价联合DTaP-IPV-Hib疫苗安全性研究的结果。AmJ流行病学2013;177:131–41.
- MarchantCD、MillerJM、MarshallGS等。评估婴儿流感嗜血杆菌和脑膜炎奈瑟菌血清型C和Y破伤风类毒素结合疫苗的免疫原性和安全性的随机试验。儿科感染杂志2010;29:48–52.
- MarshallGS、MarchantCD、BlatterM等人。在12至15个月大时接种第四剂新型b型流感嗜血杆菌和脑膜炎奈瑟菌血清型C和Y-破伤风类毒素结合疫苗(HibMenCY)后的免疫反应和一年抗体持久性。儿科感染杂志2010;29:469–71.
- NolanT、LambertS、RobertonD等人。一种新型联用流感嗜血杆菌b型脑膜炎奈瑟菌血清型C和Y-破伤风类毒素结合疫苗,在与婴儿DTPa-HBV-IPV和肺炎球菌结合疫苗联合接种时可诱导免疫记忆。疫苗2007;25:8487–99.
- NolanT、RichmondP、MarshallH等人。研究性流感嗜血杆菌b型脑膜炎奈瑟菌血清群C和Y-破伤风类毒素结合疫苗联合疫苗的免疫原性和安全性。儿科感染杂志2011;30:190–6.
- UsonisV,BakasenasV.同时注射白喉-破伤风-无细胞百日咳-乙型肝炎病毒灭活脊髓灰质炎病毒联合疫苗是否会影响商业b型流感嗜血杆菌结合疫苗的反应原性和免疫原性?EurJPediatr1999年;158:398–402.
- ReumanPD、SawyerMH、KuterBJ等。在12至18个月大的健康儿童中同时接种麻疹-腮腺炎-风疹-水痘疫苗和PedvaxHIB(R)疫苗的安全性和免疫原性。PediatrInfectDisJ1997年;16:662–7.
- SchmittHJ、ZeppF、MuschenbornS等人。b型流感嗜血杆菌破伤风结合疫苗单独接种或与伴随的白喉-破伤风-类毒素和无细胞百日咳疫苗混合用于初次免疫和加强免疫时的免疫原性和反应原性。EurJPediatr1998年;157:208–14.
- 赛诺菲巴斯德。Pentacel(白喉和破伤风类毒素和无细胞百日咳吸附,灭活脊髓灰质炎病毒和嗜血杆菌b结合物(破伤风类毒素结合物)疫苗混悬液用于肌肉注射[包装说明书]。可在http://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM109810.pdf .
- 迪隆S,基姆SJ。DTaP-IPV/Hib疫苗(Pentacel)。儿科药物2008;10:405–16.
- HesleyTM、ReisingerKS、SullivanBJ等。同时接种二价b型流感嗜血杆菌疫苗、麻疹-腮腺炎-风疹疫苗和水痘疫苗:安全性、耐受性和免疫原性。儿科感染杂志2004;23:240–5.
- 伯恩斯坦HH、诺列加F、组地图。联合白喉、破伤风、5组分无细胞百日咳、灭活脊髓灰质炎、b型嗜血杆菌结合疫苗与肺炎球菌结合疫苗同时接种时的免疫原性和安全性:一项随机、开放标签、3期研究。疫苗2011;29:2212–21.
- DennehyPH,BertrandHR,SilasPE,DamasoS,FriedlandLR,Abu-ElyazeedR.在美国,口服人轮状病毒疫苗RIX4414共同接种不会影响对常规婴儿疫苗中所含抗原的免疫反应。儿科2008;122:E1062-6。
- RinderknechtS、BryantKA、NolanT等人。b型流感嗜血杆菌-脑膜炎奈瑟菌血清群C和Y破伤风类毒素结合物vacine(HibMenCY)的安全性简介。嗡嗡声VaccinImmunother2012;8:304–11.
- VarricchioF、IskanderJ、DestefanoF等人。了解疫苗不良事件报告系统中的疫苗安全信息。儿科感染杂志2004;23:287–94.
- BaggsJ、GeeJ、LewisE等人。疫苗安全数据链:监测免疫安全性的模型。儿科2011;127:S45-53。
- 美国食品和药物管理局。21CFR第600.80部分。不良经历的上市后报告。1997年美联储注册;62:52252–3.
- DavisRL、BlackS、ShinefieldH等人。COMVAX(R)短期安全性的上市后评估。疫苗2004;22:536–43.
- EkT,MellanderL,Hahn-ZoricM,AbrahamssonJ.儿童急性淋巴细胞白血病的强化治疗可降低对白喉、破伤风和b型流感嗜血杆菌的免疫反应。JPediatrHematolOncol2004;26:727–34.
- DazaP、BandaR、MisoyaK等人。在人类免疫缺陷病毒流行率高的国家,使用b型流感嗜血杆菌结合疫苗进行常规婴儿免疫接种的影响。疫苗2006;24:6232–9.
- 马迪SA。b型流感嗜血杆菌结合疫苗在HIV感染和未感染的非洲儿童中的免疫原性和有效性。疫苗2005;23:5517–25.
- MadhiSA、PetersenK、KhoosalM等人。b型流感嗜血杆菌结合疫苗在人类免疫缺陷病毒1型感染高患病率儿童中的有效性降低。PediatrInfectDisJ2002年;21:315–21.
- 帕克卡利T,凯蒂H,鲁图,沃林L,埃斯科拉J,鲁图P.同种异体BMT后b型流感嗜血杆菌结合疫苗和肺炎球菌多糖疫苗的早期和晚期疫苗接种的比较。骨髓移植1996;18:961–7.
- GuinanEC、MolrineD、AntinJ等人。多糖结合疫苗在骨髓移植患者中的反应。移植1994;57:677–84.
- BarraA、CordonnierC、PreziosiM-P等人。b型流感嗜血杆菌结合疫苗在同种异体骨髓受者中的免疫原性。J感染Dis1992;166:1021–8.
- AvanziniMA、CarraAM、MaccarioR等人。在接受骨髓移植的儿童中接种b型流感嗜血杆菌结合疫苗:与健康年龄匹配对照的比较。临床免疫学杂志1998;1998:3。
- NewcomerW,SantoshamM,BengstonS,PannyS,DoverG.b型流感嗜血杆菌多糖和脑膜炎奈瑟菌外膜蛋白复合物结合疫苗在镰状细胞病婴儿和儿童中的免疫原性。PediatrInfectDisJ1993年;12:1026–7.
- JakackiR,LueryN,McVerryP,LangeB.霍奇金病脾切除患者治疗后的流感嗜血杆菌双喉蛋白结合物免疫。AnnInternMed1990年;112:143–4.
- FrankAL、LabotkaRJ、RaoS等人镰状细胞病儿童的b型流感嗜血杆菌免疫接种。儿科1988;82:571–5.
- FeldmanS,GigliottiF,ShenepJL,RobersonPK,LottL.癌症患儿患流感嗜血杆菌b型疾病的风险以及免疫功能低下白血病儿童对结合疫苗的反应。J感染Dis1990;161:926–31.
- 美国儿科学会。美洲原住民儿童的免疫接种。儿科1999;104:564–7.
- GalilK、SingletonR、LevineO等人。侵袭性流感嗜血杆菌b型疾病在偏远阿拉斯加疫苗接种良好的人群中重新出现。JInfectDis1999年;179:101–6.
- JohnsonPDR,HanlonM,IsaacsD,GilbertGL.脑膜炎或会厌炎后对b型流感嗜血杆菌的不同抗体反应。流行病学感染1996;116:21–6.
- LadhaniS、HeathP、RamsayME等人。英国流感嗜血杆菌血清型b疫苗失败儿童的长期免疫学随访。临床感染Dis2009;49:372–80.
- BreukelsMA,SpanjaardL,SandersLAM,RijkersGT.婴儿结合流感嗜血杆菌b型疫苗失败的免疫学特征。临床感染Dis2001;32:1700–5.
- 美国儿科学会。特殊临床情况下的免疫接种。在:PickeringL,BakerC,KimberlinD,LongS,编辑红皮书:2012年传染病委员会报告。伊利诺伊州麋鹿格罗夫村;2012:69–71.
- FeldmanS.疫苗的可互换性。儿科感染杂志2001年;20:S23-9。
- ScheifeleD,LawB,MitchellL,OchnioJ.两种b型流感嗜血杆菌结合疫苗加强剂量的研究,包括它们的可互换性。疫苗1996;14:1399–406.
- ReidR,SantoshamM,CrollJ,ThompsonC,NewcomerW,SiberGR.接种PRP-OMP疫苗的纳瓦霍儿童对PRP-OMP加强剂量与HbOC疫苗的抗体反应。PediatrInfectDisJ1993年;12:812–5.
- 美国疾病预防控制中心(CDC)推荐的儿童免疫接种时间表—美国,1998年。MMWR1998年;47:8-12。
- 葛兰素史克。MENHIBRIX(脑膜炎球菌C组和Y组以及B型嗜血杆菌破伤风类毒素结合疫苗)[包装说明书]。可在http://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM308577.pdf .
- 利福平在消除b型流感嗜血杆菌咽部携带方面的疗效。儿科1980;66:5–8.
- McCrackenG,GinsburgCM,ZweighaftTC,ClahsenJ.利福平在婴儿和儿童中的药代动力学:与预防b型流感嗜血杆菌疾病的相关性。儿科1980;66:17–21.
- GlodeM,DaumR,BoiesE,BallardT,MurrayM,GranoffD.利福平化学预防对接触者中携带根除和新获得b型流感嗜血杆菌的影响。儿科1985;76:537–42.
- BandJ,FaserD,AjelloG.预防b型流感嗜血杆菌疾病。美国医学会杂志1984;251:2381–6.
- BruceMG,ZulzT,DeByleAP,etal.流感嗜血杆菌血清型侵袭性疾病,美国阿拉斯加,1983-2011年。EmergInfectDis2013年;19:932–7.
- HammittLL、BlockS、HennessyTW等。侵袭性流感嗜血杆菌血清型A疾病的暴发。儿科感染杂志2005;24:453–6.
- 页面上次审核日期:2014年2月28日
- 页面最近更新日期:2014年2月28日
- 内容来源:美国疾病控制与预防中心
https://www.cdc.gov/mmwr/preview/mmwrhtml/rr6301a1.htm
Hits: 54

