Contents
- 1 总结
- 2 介绍
- 3 方法
- 4 普遍筛查系统评价和证据评价总结
- 5 筛查策略的成本效益
- 6 普遍筛查结果摘要
- 6.1 建议检测乙型肝炎病毒感染风险较高的人士
- 7 提出新建议的理由
- 8 乙型肝炎病毒筛查和检测建议
- 9 来自非CDC来源的建议和指导
- 10 未来方向
- 11 结论
- 12 引用
- 12.0.0.1 方框1.乙型肝炎病毒筛查和检测建议—CDC,2023年
- 12.0.0.2 表1.乙型肝炎病毒感染筛查结果的解释和建议的措施
- 12.0.0.3 图1.急性和慢性乙型肝炎病毒感染的典型血清学病程
- 12.0.0.4 方框2.普遍筛查乙型肝炎病毒的基本原理
- 12.0.0.5 框注3.按国家或地区分列的慢性乙型肝炎病毒感染患病率
- 12.0.0.6 图2.按年龄将乙型肝炎病毒筛查和检测纳入临床工作流程
- 12.0.0.7 框注4.与乙型肝炎病毒感染风险增加相关的人员和活动、暴露或状况—CDC检测建议,2023 年
- 12.0.0.8 表2.乙型肝炎表面抗原阳性者的初步医学评估
- 12.0.0.9 框注5.乙型肝炎病毒感染者的预防信息
Screening and Testing for HepatitisB Virus Infection:CDC Recommendations—United States,2023
ErinE.Conners,博士1;拉克希米·帕纳吉奥塔科普洛斯,医学博士1;MeganG.Hofmeister,医学博士1;PhilipR.Spradling,医学博士1;LieslM.Hagan,公共卫生硕士1;亚伦·哈里斯(AaronM.Harris),医学博士1;JessicaS.Rogers-Brown,博士1;卡罗琳·韦斯特,医学博士1;NoeleP.Nelson,医学博士,博士1 (查看作者单位)
本页内容
结论
总结
慢性乙型肝炎病毒(HBV)感染可导致严重的发病率和死亡率。虽然治疗不被认为是治愈性的,但抗病毒治疗、监测和肝癌监测可以降低发病率和死亡率。预防乙型肝炎的有效疫苗是可用的。本报告更新并扩展了CDC之前发布的慢性乙型肝炎病毒感染者的识别和公共卫生管理建议(MMWRRecommRep2008;57[不。RR-8])关于美国HBV感染筛查。新的建议包括对≥18岁的成年人进行乙型肝炎筛查,一生中至少进行一次三项实验室检查。该报告还扩展了基于风险的检测建议,以包括与HBV感染风险增加相关的以下人群、活动、暴露或条件:在监狱、监狱或其他拘留环境中被监禁或以前被监禁的人;有性传播感染史或有多个性伴侣的人;以及有丙型肝炎病毒感染史的人。此外,为了提供更多的检测机会,任何要求进行HBV检测的人都应该接受检测,无论是否披露风险,因为许多人可能不愿意披露污名化的风险。
介绍
慢性乙型肝炎病毒(HBV)感染者患肝癌和肝硬化的风险增加,过早死亡的可能性比一般人群高70%-85%(1-4)。据估计,美国有58万至240万人感染了HBV(5,6),其中三分之二的人可能不知道自己感染了HBV(5)。慢性HBV感染对美国境外出生的人的影响尤为严重;非美国出生的人占总人口的14%,但占美国慢性HBV感染人口的69%(5-7)。
HBV通过接触受感染的血液或体液传播,例如在怀孕或分娩期间,通过性行为或注射吸毒(IDU),围产期感染期间发生慢性感染的风险最大(8)。乙型肝炎(HepB)疫苗对预防HBV感染和随后的肝脏疾病非常有效;然而,截至2018年,美国70%的成年人自我报告他们未接种疫苗(9)。虽然治疗不被认为是治愈性的,但抗病毒治疗、监测和肝癌监测可以降低发病率和死亡率(10,11)。
为了提供实现世界卫生组织消除病毒性肝炎目标的框架,《美国病毒性肝炎国家战略计划》呼吁到2030年将意识到自己感染的HBV感染者的比例从32%(2013-2016年)提高到90%(12,13)。为了支持这一目标,本报告更新了2008年CDC关于对美国慢性HBV感染者进行基于风险的检测和管理的建议(14)。这份报告为卫生保健专业人员、公共卫生官员和支持意识、预防和联系的组织提供建议,以关心谁应该筛查乙型肝炎病毒感染,以及哪些有感染风险的群体需要定期检测(框注1)。
筛查测试的解释
用于确定HBV感染状态的三种主要血清学标志物是乙型肝炎表面抗原(HBsAg)、乙型肝炎表面抗原抗体(抗-HBs)和乙型肝炎核心抗原抗体(抗-HBc)(表1)。血清学标志物在急性感染消退和进展为慢性感染的典型病程中发生变化(图1)(15)。
HBsAg乙肝表面抗原:HBsAg的存在表明HBV感染,无论是急性还是慢性,除非在接种HepB疫苗后不久可能短暂呈阳性(16)。美国肝病研究协会(AASLD)将慢性感染定义为HBsAg存在至少6个月(11)。
Anti-HBs抗-HBs:HBsAg下降后出现抗HBs表明HBV感染恢复。在从未感染过乙型肝炎病毒的免疫功能正常者中,乙肝疫苗系列接种后1-2个月浓度为≥10mIU/mL的抗乙型肝炎表明具有免疫力。虽然某些人在部分接种疫苗后可能有≥10mIU/mL的抗HB,但这是否能带来长期保护尚不清楚。在完成疫苗系列接种的疫苗应答者中,抗乙型肝炎可随时间推移下降至<10mIU/mL的水平;然而,大多数人仍然具有免疫力,并且在接种疫苗后≥35年会对疫苗挑战产生免疫反应(17-20)。乙型肝炎免疫球蛋白(HBIG)可在给药后4-6个月内提供抗HB;因此,在HBIG给药后≤6个月进行抗HBs检测并不能准确衡量一个人的免疫状态(21)。
总抗HBc:在所有已解决或当前的HBV感染中,总抗HBc均可发生,并且通常持续终生。疫苗对HBV产生免疫力的人不会产生抗HBc。总抗HBc检测可检测针对HBcAg的免疫球蛋白M(IgM)和免疫球蛋白G(IgG)抗体;目前尚无单独针对IgG抗HBc的检测方法。在典型的慢性感染过程中,总抗HBc和HBsAg将存在,而抗HBc的IgM将消失(图1)。只有在担心急性HBV感染时,才应进行抗HBcIgM检测。
其他标志物(HBVDNA、HBeAg和抗HBe):HBVDNA是衡量病毒载量的指标。HBeAg是病毒复制和高传染性的标志物;HBeAg抗体(抗-HBe)可用于监测对治疗的反应和慢性HBV感染的进展。在确定HBV感染者后,检测HBeAg、抗HBe和HBVDNA可以提供有关病毒复制水平和感染性的信息,并有助于指导临床管理。
有关乙型肝炎病毒的背景信息,包括病毒描述、传播、临床特征、自然病程以及乙肝疫苗接种血清保护和覆盖率(补充附录1,https://stacks.cdc.gov/view/cdc/124432)。
流行病学和危险因素
急性乙型肝炎病毒感染
在2019年向CDC报告的3,192例急性HBV感染病例中,估计有20,700例新感染病例(95%CI=11,800–50,800)在调整了确定不足和漏报后被发现。在2012-2019年期间,美国报告的急性HBV感染病例数保持相对稳定(22,23)。
存在地域差异,2019年报告的病例率最高(≥每100,000人中有2.5例),佛罗里达州、印第安纳州、肯塔基州、缅因州、俄亥俄州、田纳西州和西弗吉尼亚州(23 例)。从2011年到2017年,育龄妇女中急性HBV感染的百分比在全国范围内保持稳定,但在阿拉巴马州(从0%到0.3%)、印第安纳州(从0%到0.1%)和肯塔基州(从0.1%到0.2%)(24)有所增加。新感染的地理差异可能是由于阿片类药物危机;在2006-2013年期间,肯塔基州、田纳西州和西弗吉尼亚州的急性HBV感染病例有所增加,报告注射吸毒者是危险因素(25)。
2019年,美国报告的急性感染总体率为每100,000人1.0例。自2006年以来,0-19岁人群报告的急性HBV感染率一直保持在每10万人≤0.1例,部分原因是常规的儿童疫苗接种(23)。然而,乙型肝炎病毒感染在成年人中持续传播,特别是在疫苗接种率不高的老年人中。
男性急性乙型肝炎病毒感染率(每10万人1.3例)高于女性(0.7例),非西班牙裔或拉丁裔(非西班牙裔)白人(1.0)和非西班牙裔黑人(0.9)最高。在包含注射吸毒风险信息的1,780例病例报告中,35%报告了注射吸毒者(23例)。在包含性伴侣数据的1,042例病例报告中,23%报告了多个性伴侣。在包含任何风险信息的2,009份病例报告中,47%没有发现风险。
慢性乙型肝炎病毒感染
全国健康与营养检查调查(NHANES)的数据显示,2013-2018年期间估计有88万人患有慢性HBV感染(95%CI=580,000-1,170,000)(5)。已解决的HBV感染或HBV感染的患病率为1170万人(95%CI=10.2-1350万)。NHANES不包括机构化人口,可能低估了在调查中代表性不强的少数族裔群体的患病率。在2018年的一项患病率荟萃分析中,估计有189万人(范围=1.49-240万)长期感染HBV,其中42万人(范围=0.28-0.67万人)出生于美国,147万人(95%CI=1.21-1.73)为非美国人。出生(6,26)。按地区划分,美国慢性HBV感染者中出生在东亚、东南亚、加勒比海、中南亚和西非的比例最高(6)。
从2011年到2017年,肯塔基州(从0.2%到0.4%)、密西西比州(从0.2%到0.4%)和西弗吉尼亚州(从0.3%到0.4%)(24)接受HBV感染检测的育龄妇女中慢性HBV感染的百分比有所增加。2019年,成人慢性乙型肝炎病毒新报告病例的发生率因年龄而异,其中30-39岁人群报告的发病率最高(每10万人11.3例),0-19岁人群报告的发病率最低(0.5例)(23)。在2015-2017年期间,估计有20,678-21,314名婴儿出生于HBsAg阳性的孕妇(27)。国家围产期乙型肝炎预防规划数据表明,2017年只有一半(52.6%)的婴儿是通过产前筛查发现的。
2019年,美国共有1,662例死亡报告,导致每100,000人中有0.42例年龄调整(95%CI=0.40-0.44)(23)。亚洲和其他太平洋岛民的死亡率最高(2.10)、男性(0.66)和65-74岁的人(1.54)。然而,在死亡证明上发现,可归因于HBV感染的死亡被低估了(1)。
方法
本报告更新并扩展了CDC于2008年发布的成人乙型肝炎筛查建议(14)。CDC评估了在2008年检测建议中未包括的成人以及预计HBV感染风险增加的检测人群中增加的普遍筛查建议。
CDC指南工作组(以下简称工作组)的成员遵循CDC指南制定和报告标准(28),以制定评估拟议更新所需的研究问题;进行系统评价;评估证据质量;并回顾现有的系统评价、荟萃分析和成本效益分析(如有)(补充附录2;附表1、表4、表7、https://stacks.cdc.gov/view/cdc/124432)。对以下建议进行了全面的系统文献综述:1)将筛查范围扩大到所有成年人(即普遍筛查),2)定期检测丙型肝炎病毒(HCV)感染者的HBV感染,以及3)对有监禁史的人进行HBV感染检测。
对于所有三项系统综述,文献检索均由CDC图书馆员在主题专家的指导下进行。检索了在Medline(OVID)、Embase(OVID)、CINAHL(Ebsco)和Cochrane图书馆发表的全球英语文献。使用Endnote(版本20;ClarivateAnalytics)和DistillerSR系统评价软件(2.35版;EvidencePartners)自动执行“查找重复项”功能。
CDC的病毒性肝炎指导委员会考虑了多种方法来评估证据质量。之所以选择混合方法评估工具(MMAT),是因为它是一种经过验证的非随机分析和描述性研究工具,这些研究构成了大多数HBV感染流行率文献[29]。MMAT用户根据方法学质量标准对每项研究进行评分,表明是否符合标准,包括“是”、“否”或“无法判断”。不建议对该工具计算总分,因为提供单个数字并不能说明研究的哪些方面存在问题。通过评估研究是否符合综合卫生经济评估报告标准(CHEERS)来评估经济分析(30)。
CDC认为,新建议构成了有影响力的科学信息,将对重要的公共政策和私营部门决策产生明确而实质性的影响。因此,《信息质量法》要求由未参与制定这些建议的该领域专家进行同行评审。CDC向AASLD、美国传染病学会和美国内科医师学会(ACP)征集审稿人提名。五名具有肝病学、胃肠病学、内科或传染病专业知识的临床医生提供了结构化的同行评审,并记录了为回应所做的任何编辑(补充附录2和 3,https://stacks.cdc.gov/view/cdc/124432)。没有CDC工作人员或外部同行评审员报告利益冲突。此外,还通过《联邦公报》通知征求公众反馈意见,宣布建议草案将于2022年4月4日至6月3日期间征询公众意见。CDC收到了来自非营利/倡导团体、提供者、行业团体、医疗专业组织、公众、学术界和咨询团体的28条关于文件草案的公众意见。工作组考虑了公众意见,并记录了针对回应所做的任何编辑(补充附录 4,https://stacks.cdc.gov/view/cdc/124432)。
工作组还向CDC/卫生资源和服务管理局(HRSA)艾滋病毒、病毒性肝炎和性传播疾病预防和治疗咨询委员会提交了这些指南,但没有寻求该咨询委员会的共识决策。指导委员会结合成本效益分析、补充文献、实施指南的实用性、公共卫生效益、主题专业知识以及审稿人和公众反馈,审议了系统评价的结果。
系统评价方法
普遍筛查
检索期为2008年1月1日(CDC最新筛查指南的年份)至2021年2月8日(补充表2,https://stacks.cdc.gov/view/cdc/124432)。检索结果由通过综述文章中的参考文献列表和新发表的研究确定的相关研究进行补充。DistillerSR用于组织审查过程。每篇文章都由两位作者(EC和LP)进行审查。在达成共识之前,讨论了要包括的决定中的分歧。如果文章包含≥18岁成年人中HBV感染的患病率或发生率或与护理的联系数据,则纳入这些文章。如果文章在美国和美国领土之外进行,则被排除在外;仅报告了非人类研究、环境研究或技术评估研究的数据;缺乏原始数据(例如,社论、评论和建模数据);是病例报告;或仅包括自我报告(即未经证实的)HBV感染患病率(补充表 3,https://stacks.cdc.gov/view/cdc/124432)。当审稿人确定一篇文章符合任何排除标准时,不会评估或记录其他排除标准。当多篇文章报告了同一队列的数据时,仅包括数据最完整的文章。数据由两名评价员(EC和LP)独立提取,并讨论差异,直到达成共识或由第三位评价员(NN)解决。最后,两名独立评估员(LP、JB或NN)使用MMAT评估用于计算普通人群中HBV感染患病率的文章质量。
丙型肝炎病毒感染者
检索期为2005年1月1日至2020年9月22日(附表5,https://stacks.cdc.gov/view/cdc/124432)。DistillerSR和Endnote用于组织审查过程。标题由一名审稿人(PS或EC)审查,并排除那些与研究问题明显无关的标题。每篇可能相关的文章都由两位作者(MH和PS)进行审查。在达成共识之前,讨论了要纳入的决定的差异(补充表6,https://stacks.cdc.gov/view/cdc/124432)。纳入全文文章的数据由两名评价员(MH、PS或EC)独立提取。使用MMAT评估文章的质量。如果HBV感染的患病率为≥1%,则该人群被认为处于“风险增加”状态。
在监狱、监狱或其他拘留场所有监禁史的人
工作组使用现有的文献检索有关惩教和拘留设施中乙型肝炎和丙型肝炎病毒感染的文章。检索期为2000年1月1日至2021年3月3日(附表8,https://stacks.cdc.gov/view/cdc/124432)。摘要由两名评价员(AH、LH、JB、OR或EC)进行相关性审查,纳入差异由第一作者(EC)或协商一致讨论解决。本综述仅纳入包含有监禁史或监禁史的HBV感染发生率或患病率的文章,作为HBV感染的危险因素(补充表9,https://stacks.cdc.gov/view/cdc/124432)。纳入的全文文章或摘要的数据由两名评价员(LP和EC)独立摘录,分歧通过协商解决。由于关于惩教环境中乙型肝炎病毒感染的文献数量有限,工作组纳入了会议摘要,这些摘要被标记为会议摘要,因为它们被认为质量较低。使用MMAT评估文章的质量。如果HBV感染的患病率为≥1%,则该人群被认为处于“风险增加”状态。
普遍筛查系统评价和证据评价总结
重复数据删除后,有2,580条记录可用于初始标题屏幕;1,374篇文章在标题筛选中被排除在外。在摘要审查期间,另有1,028篇文章被排除在外。在178篇全文文章中,有136篇经评审不符合纳入标准;最终审查纳入了42篇文章(补充表11,https://stacks.cdc.gov/view/cdc/124432)。另外一篇文章符合纳入标准,但在检索期后发表,并被摘要以补充系统检索的证据。
18篇文章有来自一般人群的HBV检测数据(即筛查未知的HBV感染风险增加的人)(补充表11,https://stacks.cdc.gov/view/cdc/124432)。测试建议是基于风险的;因此,对已经接受HBV感染检测的人的便利样本进行的研究被认为偏向于高估HBV感染的患病率,即使该研究没有明确指出存在基于风险的检测。其余文章(n=25)包括HBV感染风险增加的人,他们被认为不能代表美国一般人群。提供单独的MMAT质量等级(补充表14和15,https://stacks.cdc.gov/view/cdc/124432)。
关键研究问题
问1:成人乙型肝炎普遍筛查如何影响乙型肝炎病毒感染筛查阳性的人数(和组成)?
Q1a:美国慢性HBV感染的患病率是多少?在一般人群中,按年龄组划分?
工作组将慢性HBV感染患者定义为HBsAg阳性患者,但一项研究除外,其中作者将患者归类为慢性HBV感染患者,但没有提供定义。纳入了对首次献血者、器官捐献者、孕妇(其中已建议进行普遍筛查)、NHANES登记者和寻求HBV感染以外的疾病治疗的患者的研究。
根据在美国和美国领土进行的17项研究,普通人群中慢性HBV感染的中位患病率为0.4%(范围=0.0%–2.0%)(补充表11,https://stacks.cdc.gov/view/cdc/124432)。根据仅在美国进行的研究,患病率为0.38%(范围=0%–0.74%)(补充表 11,https://stacks.cdc.gov/view/cdc/124432)。8项研究报告了感染史(即抗HBc阳性,HBsAg阴性)的患病率;中位数为6.2%(范围=4.8%–14.0%)(31–38)。
慢性HBV感染患者的年龄(如果有的话)包括在汇总表中(补充表11,https://stacks.cdc.gov/view/cdc/124432)。在各研究中,没有发现按年龄划分的慢性HBV感染患病率的明显趋势。因此,工作组在确定普遍成人筛查的年龄阈值时,考虑了经济分析、疫苗接种率和有效性、监测数据中急性和慢性感染的流行病学、实施的难易程度以及漏诊慢性感染的危害。
Q1b:替代HBV筛查策略(例如,通用筛查与靶向筛查或基于替代危险因素的筛查策略)的检出率(每次完成的新诊断数量)和敏感性如何?
作为HBV筛查建议系统评价的一部分,美国预防服务工作组(USPSTF)评估了替代HBV感染筛查策略的出率(每次完成的新诊断数量)和敏感性(39)。USPSTF确定了三项质量一般的非美国研究,这可能会限制适用性(40-42)。根据这些研究,需要接受筛查以使用基于风险的策略识别一种乙型肝炎病毒感染的人数从32人到148人不等。相比之下,使用基于风险的筛查,需要筛查的人数不到20人,以识别HCV感染病例(43)。
在法国进行的一项研究中,只有一项评估了CDC基于风险的检测标准(41)。使用基于风险的检测具有100%的敏感性(即100%的感染者被识别出来),自我报告确定了70%的人至少有一个危险因素;然而,研究人群特别高估了感染风险增加的人群。
该工作组还考虑了一项针对美国一家健康中心的癌症患者的前瞻性队列研究,其中将CDC风险标准应用于筛查的敏感性为97%(44)。符合至少一项风险标准的患者比例为91%。因此,就提供者时间而言,普遍筛查可能比基于风险的检测更有效。由于没有研究直接评估普遍筛查,工作组无法提供普遍筛查与基于风险的筛查的产量。
问题2:还有多少人会与护理联系起来?
Q2a:乙型肝炎病毒检测的诊断准确性如何?
HBV检测的诊断准确性已经过美国食品药品监督管理局(FoodandDrugAdministration,FDA)的评估,但未被纳入系统评价。任何获得FDA批准用于临床的检测都必须符合诊断准确性的高标准。FDA批准的HBV血清学检测列表,包括有关其性能特征的详细信息的链接(补充表21,https://stacks.cdc.gov/view/cdc/124432)。
Q2b:乙型肝炎筛查有什么危害?
系统评价中关于危害的数据有限。在一项研究中,拥有公共保险并自费支付医疗保健服务费用的妇女不太可能接受筛查,即使HBsAg筛查费用本应得到支付;作者假设自付费用可能是筛查的障碍(45)。在另一项评估结肠镜检查期间患者肝炎筛查可接受性的研究中,接受率为78%(46)。
HBV筛查的危害预计与HCV相似。在之前的综述中,筛查丙型肝炎的可能危害是身体疼痛、焦虑、成本、与学习感染状态相关的人际关系问题、耻辱感、时间、恐惧和不愿披露非法风险行为(47)。其他可能的危害包括假阳性结果引起的担忧、缺乏教育或对已解决的感染的理解、可保险性和就业问题以及治疗不良反应导致的痛苦。
工作组得出的结论是,筛查的潜在危害并没有超过好处。此外,与基于风险的筛查相比,普遍筛查可能减少危害,因为不要求人们披露潜在的污名化风险条件(例如,移民身份和注射吸毒者)来接受检测。
问2c:乙型肝炎病毒感染筛查呈阳性的人士中,有多少比例与护理有关?
问2d:乙型肝炎病毒感染筛查呈阳性的人士中,有多少人符合治疗条件?
问2e:在乙型肝炎病毒感染筛查呈阳性的合资格人士中,有多少人接受治疗?
普遍筛查评价中只有两项研究报告了与护理的联系。在一项针对参加免费诊所的人的研究中,69%的慢性HBV感染患者参加了随访护理(48)。在免费筛查诊所中,78%的HBV感染患者选择接受随访监测(即丙氨酸氨基转移酶[ALT])和HBVDNA),24%(45人中的11人)接受监测符合治疗条件(即病毒载量为>20,000拷贝/mL)(49)。
只有两项关于化疗期间抗病毒治疗的研究提供了治疗数据。在一项研究中,23%有再激活风险的患者被开具了预防性核苷类似物(50)。在另一项研究中,12%(152人中有18人)既往HBV感染患者接受了抗病毒药物治疗,73%(15人中有11人)的慢性HBV感染患者接受了抗病毒药物治疗(36)。
为了回答这些关键问题,工作组还评估了另外两项研究的证据,这些研究不属于系统评价的一部分,但包括普通人群。在2008-2016年一项针对成人慢性HBV感染和商业保险的研究中,36%(16,644人中有6,004人)的患者与护理有关(定义为接受过ALT检测和HBVDNA或HBeAg检测)(51)。在有处方索赔的慢性HBV感染患者中,18%(16,572人中的2,926人)接受了治疗。在一项前瞻性队列研究中随访的2,338例慢性HBV感染患者中,78%每年进行一次或多次ALT检测,37%每年进行一次或多次HBVDNA检测,32%接受治疗[52]。并非所有慢性HBV感染患者都需要治疗;符合AASLD治疗标准的HBV感染患者的估计范围为24%-48%(53,54)。这两项研究没有评估接受治疗的人在符合条件的人中的比例。总体而言,工作组发现,与护理的联系率在36%至78%之间,18%至32%的慢性HBV感染患者接受了处方治疗。
问3:可以预防多少新的乙型肝炎病毒感染?
问3a:密切接触者中有多少比例有感染风险?
工作组没有发现直接评估有感染风险的密切接触者(不包括围产期传播)比例的证据,因此无法估计通过普遍成人筛查可以预防的新感染比例。然而,工作组发现有证据表明,HBV感染者的密切接触者本身也感染了HBV。
根据系统评价,一项针对既往HBV感染患者的癌症患者的队列研究发现,8.1%的人报告与HBV感染者有家庭接触(非性伴侣),15.2%的人报告与HBV感染者发生性接触。在慢性HBV感染患者中,0.5%报告与HBV感染有非性家庭接触,1.5%报告与HBV感染者有性接触[36]。
在美国一项关于乙型肝炎患者与护理的检测和联系项目的研究中,14%的HBsAg阳性者的家庭接触者本身就是HBsAg阳性,30%有感染史(抗HBc阳性)(55)。2019年,监测数据显示,10%(899人中有92人)有性接触,2%(899人中有17人)有非性家庭接触(23人)。然而,依靠HBV感染密切接触者的自我报告可能低估了风险。1974-2007年期间进行的全球研究发现,生活在慢性HBV感染者家庭中的人中有14%-60%有HBV感染已消退的血清学证据,3%-30%的人有慢性感染(14)。虽然筛查可以防止乙型肝炎病毒感染的进一步传播,但工作组无法估计这种影响的规模。
Q4:理想的管理和治疗效果是否超过不良效果?
系统评价未评估关键问题,因为已在其他地方报道过。USPSTF审查了治疗在降低病毒载量,HBeAg,HBsAg,肝硬化,肝细胞癌(HCC)和死亡方面的有效性[39]。抗病毒治疗与病毒抑制、HBsAg丢失、ALT水平正常化和HBeAg丢失有关。与安慰剂或不治疗相比,抗病毒治疗与HCC和死亡风险降低相关;然而,数据稀少,估计不准确。治疗与严重不良事件的风险增加无关。AASLD在制定治疗指南时使用的系统评价的结论是,推荐的治疗可减少活动性慢性HBV感染成人的肝硬化、失代偿性肝硬化、HCC和死亡,因此强烈建议[10]。
筛查策略的成本效益
普遍筛查
2021年对18-69岁成年人进行一次性普遍HBV筛查的成本效益的经济分析为这些指南提供了信息(56)。据估计,未确诊的慢性HBV感染率为0.24%,假设抗病毒治疗药物成本保持在每年<894美元,与目前的做法相比,在18-69岁的成年人中进行普遍的HBsAg筛查可以节省成本。抗病毒治疗药物成本需要上升到每年9,692美元(大约是研究时成本的19倍),才能使普遍筛查不再具有成本效益。未确诊的患病率基于NHANES估计的0.36%,以及67%的HBV感染者不知道自己感染的发现(57)。目前的做法是基于文献,并假设目前诊断出33%的HBV感染者,36%与护理有关,18%正在接受治疗(56)。
与目前的做法相比,普遍筛查预计每100,000名筛查者可避免7.4例代偿性肝硬化、3.3例失代偿性肝硬化、5.5例HCC、1.9例肝移植和10.3例HBV相关死亡(56)。对18-69岁的成年人进行普遍的HBsAg筛查将为每个质量调整生命年(QALY)节省262,857美元,并导致每100,000名筛查成年人增加135个QALY。同时改变模型中所有参数的概率敏感性分析表明,与目前的做法相比,普遍筛查具有成本效益的可能性为>99%,最高支付意愿阈值为每QALY50,000美元。
研究作者使用与本报告中描述的经济分析相同的方法进行了未发表的分析,但年龄上限为80岁而不是69岁。他们发现,对18-80岁的成年人进行一次性普遍筛查,进行HBsAg检测将节省200,334美元,并导致每100,000名接受筛查的成年人增加128个QALY。
敏感性分析发现,使用三联板(HBsAg、抗HBc、抗HBs)并假设Medicare报销28.27美元,使用三联板进行普遍筛查将具有成本效益,每个QALY的增量成本效益比为11,207美元(56)。使用每QALY$50,000的成本效益阈值,如果HBV感染率为>0.15%,则使用三组组合进行普遍筛查仍然具有成本效益。CHEERS清单摘要(补充表20,https://stacks.cdc.gov/view/cdc/124432)。与推荐标准的微小偏差不被视为对质量构成重大风险。
在高患病率地区进行筛查
2022年的一项成本效益分析评估了在STI诊所(即高患病率环境)进行普遍疫苗接种的筛查是否可以降低成本并改善护理(58)。研究人员假设研究人群年龄在18-69岁之间,估计HBsAg患病率为4.2%,并且以前没有接种过HepB疫苗或已知的HBV感染。使用三联组进行一次性筛查可节省成本,并预防了每100,000名接受筛查的成年人中新增138例肝硬化、47例失代偿性肝硬化、90例HCC、33例肝移植和163例HBV相关死亡。即使假定性传播感染门诊人群中的慢性乙型肝炎病毒感染患病率为零,筛查加疫苗接种也比单独接种疫苗的成本更低,因为它可以识别以前接种过疫苗的人,并避免了额外疫苗剂量的成本。
普遍筛查结果摘要
指导委员会结合成本效益分析、补充文献、实施指南的实用性、公共卫生效益、主题专业知识以及审稿人和公众反馈,审议了系统评价的结果。由于数据有限,指导委员会只能间接评估关键问题“成人普遍筛查乙型肝炎将如何影响HBV感染筛查阳性的人数[和组成]?所考虑的证据、筛选理由(框2)、指导委员会的结论和局限性的摘要(补充表10,https://stacks.cdc.gov/view/cdc/124432)。 指导委员会得出的结论是,将筛查的实施从基于风险的方法简化为普遍的方法可能会增加意识到自己感染的人数。总体而言,在美国,基于风险的检测不足以识别HBV感染者,并且一直是适当筛查疾病患病率不成比例的人群的障碍。对医务人员来说,风险评估是困难的,并且可能会给患者带来耻辱感。
对成人进行一次性HBV筛查将补充2022年免疫实践咨询委员会(ACIP)的建议,即为所有19-59岁的成年人接种HBV感染疫苗,因为筛查可以确定任何感染史,而疫苗接种可以防止未来感染和需要额外检测(59)。这些建议得到了该领域专家同行评审员以及大多数公众意见的支持。HBV感染患者的发病率和死亡率增加,监测和治疗可以改善健康结果。如果将来批准更有效的治疗方法,这种益处将进一步增加。尽管提高对感染的认识有望减少向密切接触者的传播,但由于缺乏直接证据,这一假设是假设性的。没有研究直接将普遍筛查与基于风险的筛查进行比较;因此,指导委员会依赖于成本效益研究发现,与基于风险的筛查相比,一次性成人普遍筛查具有成本效益,并可改善健康结果(56)。
建议检测乙型肝炎病毒感染风险较高的人士
丙型肝炎病毒感染者或既往丙型肝炎病毒感染者
系统评价发现了8,295篇文章供审查;经过标题审查,还剩下1,233篇可能相关的文章。在对符合纳入和排除标准的条目进行审查后,纳入了17篇条目(附表12,https://stacks.cdc.gov/view/cdc/124432)。在10项美国研究中,HCV感染者当前HBV感染的患病率(基于HBsAg阳性、HBVDNA阳性或国际疾病分类第十修订版代码)在HCV感染者中范围为0.2%至5.8%(中位数=1.2%)(60-69)。在丙型肝炎病毒感染者中,曾经接触乙型肝炎病毒的患病率在24.7%至62.6%之间(中位数=43.0%);这一发现基于抗HBc阳性,而不管其他HBV检测结果如何(62–65,69,70)。HCV感染患者的孤立性抗HBc阳性率为36.9%-53.8%(中位数=39.5%)(62,65,69)。
HCV直接抗病毒治疗期间的HBV再激活
FDA要求在HCV感染的直接作用抗病毒(DAA)药物的药物标签上添加有关HBV再激活风险的方框警告。方框警告指示卫生保健专业人员筛查和监测所有接受DAA治疗的患者的HBV感染(71)。
在一项已发表的关于HCV感染患者DAA治疗期间HBV再激活的系统评价中,未经治疗的慢性HBV感染患者HBV再激活的总体风险为24%(95%CI=19%-30%),HBV感染已解决的患者为1.4%(95%CI=0.8%-2.4%)(72)。在慢性HBV感染患者中,HBV再激活相关肝炎(即有症状)的风险为9%(95%CI=5%–16%);HBV再激活相关肝炎未发生于感染已消退的患者中。在1,621例慢性HBV感染患者中,有3例发生了与再激活相关的主要临床事件(肝失代偿或衰竭),但没有死亡。
2018年系统评价后发表了四项研究(62,69,73,74)[72]。在两项针对美国慢性HCV感染退伍军人的全国性队列研究中,接受DAA治疗时,HBV再激活很少见(<0.1%),并且在HBsAg阳性患者中更常见(62,73)。同样,另外两项针对合并感染HBV的HCV患者的美国队列研究未检测到任何DAA相关HBV再激活病例(69,74)。
HCV/HBV合并感染的结果
在一项比较HCV感染患者对HCV治疗产生持续病毒学反应的研究中,抗HBc阳性被确定为HCC发展的独立危险因素(HR=5.57;95%CI=1.45-21.39)(75)。相反,一项针对HBsAg阴性且HCV感染患者的嵌套病例对照研究表明,既往和隐匿性HBV感染均与HCC的发生相关[76]。与接受DAA治疗的慢性HCV感染的非肝硬化抗HBc阳性患者相比,具有临床意义的肝脏事件(包括HBV再激活)在肝硬化患者中更常见[73]。在51,781名感染HCV并开始DAA治疗的退伍军人队列中,与HCV单一感染患者相比,HBV/HCV合并感染者(比值比[OR]=2.25;95%CI=1.17-4.31)和HBV感染已解决者(OR=1.09;95%CI=1.03-1.15)更有可能获得持续的病毒学反应[64]。
在一项包含99,548名美国退伍军人的全国队列中,HCV感染和记录的HBV病毒血症(检测到HBV DNA)的患者发生肝硬化(调整后风险比[aHR]=1.89;95%CI=1.46-2.45)、HCC(aHR=2.12;95%CI=1.26-3.60)和死亡(aHR=1.62;95%CI=1.33-1.99)的风险明显高于HCV单一感染者,在控制人口统计学、临床和抗病毒治疗相关因素后(68)。在该队列中,HBV复制的缺失与与HCV单一感染患者的临床病程相似相关。与HCV单发感染患者相比,HBV/HCV合并感染患者的纤维化更晚期,纤维化进展速度更快,脂肪变性更严重[63]。在一项匹配的病例对照研究中,与无HCC的HCV感染对照组相比,HBsAg阴性HCV感染合并HCC的患者更可能既往感染HBV(抗HB阳性),无论抗HBs状态如何(抗HBs阴性[OR=2.98;95%CI=2.12-5.08];抗HBs阳性[OR=1.84;95%CI=1.22-3.08]),77。
许多研究的检验数据不完整,并使用了显著性的描述性检验,而不是控制其他变量的模型。MMAT质量评估的结果现已公布(补充表18和19,https://stacks.cdc.gov/view/cdc/124432)。工作组的结论是,由于HBV感染的患病率估计为≥1%,并且由于DAAs的方框警告,应考虑HCV感染或既往HCV感染者感染HBV的风险增加。
在监狱、监狱或其他拘留场所被监禁或曾被监禁的人
用于这些检测指南的惩教环境中HBV感染的系统综述是更大规模综述的一部分,该综述还包含关于惩教环境中HCV感染的文章(“综述1”)。对有关HBV感染和惩教环境中HCV感染的文献的初步检索产生了2,395篇独特的文章供审查;其中,1,961篇被标题和摘要筛选认为不相关,导致434篇潜在的文章需要审查1。二次摘要综述(“综述2”)应用了这些指南的纳入和排除标准,得出了57篇文章,符合全文综述的纳入标准;其中三篇文章也被纳入HBV普遍筛查系统评价。经全文审查,共纳入10条(附表13,https://stacks.cdc.gov/view/cdc/124432)。提供单独的MMAT质量等级(补充表16和17,https://stacks.cdc.gov/view/cdc/124432)。
在8项研究中,有监禁史的人慢性HBV感染的患病率为0.6%至8.7%(中位数=1.0%)(78-85)。两项针对被监禁男性的研究评估了发病率,每年每10万人中有2,700至3,579例感染(78,81)。一项研究报告了41例在监狱中获得的急性HBV感染;然而,没有报告检测的总数,因此无法计算患病率或发病率(85)。另一项研究报告称,在高安全性惩教设施中爆发HBV感染期间,感染率为1.2%(83)。
三项研究发现,与监禁相关的HBV感染风险增加。在一项针对献血者的研究中,在监狱或拘留设施中被拘留≥3晚的人获得HBV感染血清学证据的几率高出三倍;但是,没有提供对照组(P≤0.001)(86)。在另一项研究中,与被监禁≤7年的人相比,被监禁>14岁的人感染HBV的几率高1.68(95%CI=1.08–2.59)(81)。最后,第三项研究表明,与没有监禁史的人相比,有任何自我报告的监禁史的人感染HBV的几率增加(OR=1.84;95%CI=1.02-3.31)(87)。
工作组决定,在监狱、监狱或其他拘留场所被监禁或以前被监禁的人应被视为风险增加的人。这一结论是基于HBV感染患病率估计为≥1%,以及直接表明HBV感染与监禁之间存在关联的研究。被监禁者感染HBV风险增加的原因可能包括监禁前或监禁期间发生的行为,包括吸毒、高危性行为、经皮暴露(例如纹身)以及影响这些行为风险水平的结构性因素(例如,避孕套、清洁注射器和参与医疗保健)。为确保所有被监禁者都能接受推荐的乙肝病毒检测,惩教和拘留设施应考虑在入狱时提供乙肝病毒筛查,对长期服刑的易感者进行定期检测,并为易感者提供乙肝疫苗(16)。
患有性传播感染或有性传播感染史或有多个性伴侣的人
该工作组使用已发表的系统评价和荟萃分析来评估有非HIV性传播感染(STI)病史的人的风险(88)。这项对全球研究的分析发现,HBV感染的患病率与其他性传播感染之间存在正相关且具有统计学意义的关联。2008-2009年发表的三项美国研究包括梅毒或任何性传播感染者HBsAg患病率的四项估计值;中位患病率为1.6%(范围=0.9%–33.2%)。在四项估计中,有两项属于具有其他HBV感染危险因素的群体(例如,被处理入狱的人和男男性行为者[MSM])。1998-2000年间发表的7项美国研究包括9项对STI患者或STI病史中HBV感染或HBV感染史(HBsAg或抗HBc阳性)患病率的估计;中位患病率为22.4%(范围=8.6%–83.5%)。在对既往感染的9个估计值中,有4个属于具有其他HBV感染危险因素的组(例如,吸毒者、HIV感染者和MSM)。
一项对2013-2018年国家监测报告和调查数据的研究发现,在排除有注射吸毒报告的病例后,有1,324例(38.2%)性传播急性乙型肝炎病毒感染病例;5.3%的人报告与HBV感染者发生性接触,3.1%的人报告是男性并与另一名男性伴侣发生性关系,27.8%的人报告有多个性伴侣,2%的人报告在HBV感染诊断前6周至6个月有性传播感染治疗史(89)。案件按所列顺序分为相互排斥的类别。工作组认为,性传播感染患者中HBsAg患病率为>1%,是风险增加的充分证据。尽管文献没有直接支持对多个性伴侣的建议,但它与AASLD的建议一致,即筛查没有长期一夫一妻制关系的人(即在过去6个月内有多个性伴侣)(11)。
HBsAg阳性孕妇所生婴儿
如果不采取预防措施,90%的HBsAg和HBeAg阳性女性所生的婴儿和5%-20%的HBsAg阳性、HBeAg阴性女性所生的婴儿会被感染(90-92)。更多信息见《美国乙型肝炎病毒感染的预防:免疫实践咨询委员会的建议》(15)和AASLD(11)。
出生在乙型肝炎病毒感染率为≥2%的地区的人
2021年的一项系统评价和荟萃分析估计,美国非美国出生的慢性HBV感染者的患病率为3.1%(95%CI=2.5%–3.6%)。非洲的患病率最高(8.6%),其次是亚洲(5.9%)和大洋洲(4.5%)(6)(框注3)。
在美国出生但未接种疫苗的婴儿,其父母出生在乙型肝炎病毒感染率为≥8%的地区
在美国出生的婴儿未接种疫苗,其父母出生在HBV感染率为≥8%的地区,感染风险增加。该人群的潜在患病率较高,增加了围产期或密切接触暴露的可能性(框注3)。
使用注射毒品或有注射吸毒史的人
一项系统评价估计,使用注射吸毒者的HBV感染率为11.8%(范围=3.5%-20%),曾经感染过的人为22.6%(93)。乙型肝炎病毒在注射吸毒者中的传播可能正在增加。一项关于全国调查数据中抗HBc患病率的研究发现,注射吸毒者从2001-2006年的35.3%增加到2013-2018年的58.4%(94)。
爱滋病病毒感染者
1986-2012年期间具有不同纳入标准和时期的多项研究使用来自美国军方HIV自然史研究(NHS)的前瞻性队列数据来计算HIV感染者中HBV感染的患病率。在NHS患者中,合并感染率为3.0%至6.0%(95-97)。在一项针对成人HIV感染者的大型前瞻性队列研究中,1996-2007年期间的年慢性HBV感染率在7.8%至8.6%之间(98)。
男男性行为者
在加利福尼亚州洛杉矶县的一个样本中,来自国家HIV行为监测系统的居民中,19%(95%CI=15%-24%)的MSM感染了HBV或有HBV感染史,35%的样本合并感染了HIV(99)。在1998年至2000年期间对美国六个大都市地区的MSM进行的一项调查中,曾经感染的患病率为20.6%,2.3%的参与者患有活动性HBV感染;HBV感染与另一种性传播感染史、终生伴侣较多、曾进行过以及曾经使用过注射毒品(100)独立相关。
已知HBV感染者的家庭、共用针头或性接触
乙型肝炎病毒具有高度传染性,可在环境中长期存活。已知HBV感染者的密切接触者(即家庭接触者、共用针头接触者或性接触者)风险更高(普遍筛查系统评价和证据综述总结)。
接受透析、血液透析或腹膜透析的人
1997-2001年期间一项针对成人血液透析患者的研究发现,HBV感染的调整后患病率为2.4%(95%CI=2.1-2.7)(101)。在2,019例急性HBV感染病例中,只有3%(1,292例中的34例)报告了透析;然而,免疫抑制和透析的人发生慢性感染的风险高于免疫功能正常的人(23,102,103)。预防慢性血液透析患者感染传播的建议包括对血液透析患者的检测建议(104)。
ALT或天冬氨酸转氨酶水平升高的人
已知患有慢性肝病(例如肝硬化、脂肪肝、酒精性肝病或自身免疫性肝炎)的人发生HBV感染的风险不会增加,除非他们有额外的暴露或危险因素。然而,对于ALT或天冬氨酸转氨酶(AST)水平持续升高且原因不明的患者,应进行HBV感染检测,作为对这些异常实验室值进行医学评估的一部分。
提出新建议的理由
慢性HBV感染可导致严重的发病率和死亡率,但在发生严重肝病之前,使用可靠且廉价的筛查测试可以检测到。慢性HBV感染的常规监测和治疗可以降低发病率和死亡率,支持早期发现HBV感染的重要性。此外,虽然无法量化,但通过预防工作对慢性感染进行管理可以防止进一步传播给他人。这些建议考虑了一种比以前基于风险的HBV筛查建议更简单、更少污名化的实施策略。这些建议还提供了对2022年ACIP建议的补充,即通过提供一种建立免疫力或任何感染史或接种疫苗以防止未来感染的需要的手段,为所有19-59岁的成年人接种HBV感染疫苗(59)。建议的具体理由如下:
普遍筛查:与基于风险的筛查相比,成人普遍筛查具有成本效益,可避免肝病和死亡(56)。虽然尚无根治性治疗方法,但慢性HBV感染的早期诊断和治疗可降低肝硬化、肝癌和死亡的风险[10,11]。仅靠基于风险的检测并不能识别出大多数慢性HBV感染者,并且被认为提供者实施效率低下。
三联板筛查:建议使用三联检测组(HBsAg、抗HBs和总抗HBc)进行初步筛查,因为它可以帮助识别活动性HBV感染者,这些患者可能与护理有关、感染已消退且可能易受再激活(例如免疫抑制者)、易感且需要接种疫苗或已接种疫苗。当有人接受三联面板筛查时,任何未来的定期检测都可以酌情使用检测(例如,如果患者未接种疫苗,则仅进行HBsAg和抗HBc)。
≥18岁的成年人:“所有成年人”的建议被认为比在特定年龄组中实施更可行(例如,纳入电子病历警报)。考虑因素包括对成人年龄组的有利经济分析、成人年龄组的疫苗接种率同样低、年龄组监测数据对急性和慢性感染的可比流行病学,以及漏检慢性感染的危害。
<18岁的儿童和青少年:<18岁的儿童和青少年未被纳入普遍筛查建议,因为该年龄组的HBV感染率较低,而HepB疫苗接种水平较高。对于有危险因素且未接种完整疫苗系列的<18岁儿童和青少年,应进行检测(图2)。
新风险组:增加三个新的风险组是基于HBV感染率临界值为≥1%。对进行系统评价的三个群体的选择是基于专家的判断,工作组认识到其他人群也可能面临更高的风险。
乙型肝炎病毒筛查和检测建议
在这些指南中,“筛查”是指对未知的乙型肝炎病毒暴露风险增加的无症状者进行血清学检测。“检测”是指对有症状或被确定接触乙型肝炎病毒风险增加的人进行血清学检测。以下关于HBV筛查的循证建议更新并扩展了CDC在2008年发布的建议(14)。
建议对以下人士进行筛查(方框1):
所有≥18岁的成年人一生中至少一次(新推荐)。
每次怀孕期间的所有孕妇*,最好是在妊娠早期,无论疫苗接种状态或检测史如何(15)(见临床注意事项)。
建议对以下人员进行检测(方框1):
所有有乙型肝炎病毒感染风险史的人,无论年龄大小,如果他们在风险期间可能易感(框注4)(图2)。易感人群包括从未感染过HBV(即总抗HBc阴性)且未按照ACIP建议完成HepB疫苗系列接种或已知疫苗无反应者(15)。
无论年龄大小,在风险持续存在的情况下,应定期对有持续风险的易感人群进行检测(图2)(临床注意事项)。
o如果暴露风险发生在既往HBV血清学检测之后且患者易感时,应进行检测。
任何要求HBV检测的人。无论是否披露风险,这些人都应该接受检测,因为许多人可能不愿意披露污名化的风险(新建议)。
感染乙型肝炎病毒的风险增加的人,包括:
oHBsAg阳性孕妇所生婴儿(15)
o出生在乙型肝炎病毒感染率为≥2%的地区(框注3)
o父母出生在乙型肝炎病毒感染率为≥8%的地区时未接种疫苗的美国出生婴儿(框注3)
o注射吸毒者或有注射吸毒史的人
o在监狱、监狱或其他拘留场所被监禁或曾被监禁的人(新建议)
o爱滋病病毒感染者
o丙型肝炎病毒感染者或既往丙型肝炎病毒感染者(新推荐)
o男男性行为者
o性传播感染患者或既往性传播感染者或多个性伴侣(新推荐)(见临床注意事项)
o已知乙型肝炎病毒感染者的家庭接触者或前家庭接触者
o已知HBV感染者的共用针头或性接触
o接受维持性透析的人,包括中心或家庭血液透析和腹膜透析(104)
oALT或AST水平升高且原因不明的人
提供者在提供筛查和检测时应遵循以下建议:
在初始筛查期间,检测HBsAg、抗HBs和总抗HBc(新推荐)。
o使用三种检测(三联板)进行筛查可以帮助识别以下活动性HBV感染者,这些患者可能与护理有关、感染已消退且可能易受再激活(例如,免疫抑制者)、易感者且需要接种疫苗或已接种疫苗(表1)。≥10 mIU/mL的抗HB抗体仅在完整的HepB疫苗系列检测后才是已知的保护相关性。
在采集血液进行血清学检测后,未完成疫苗系列的人应在同一次就诊或相关提供者就诊时按照ACIP的建议接种疫苗(105)。建议在接种疫苗前采血,因为据报道,接种后长达18天的短暂HBsAg阳性。
o提供者无需等待血清学检测结果即可接种第一剂或下一剂疫苗。
o虽然筛查可以识别出未接种疫苗和易感染HBV的人,但筛查不应成为乙肝疫苗接种的障碍,特别是在参与或获得卫生保健的机会减少的人群中(59)。在检测不可行或患者拒绝检测的情况下,应根据ACIP的建议继续为患者接种疫苗。在以后的就诊中应继续提供血清学检测。
对于某些人群,包括献血者、新抵达的难民以及开始细胞毒性或免疫抑制治疗的人,可能会建议对血液透析患者、医护人员、围产期暴露婴儿以及涉及暴露事件的人员进行额外的筛查,这些事件可能需要暴露后预防和疫苗接种后血清学检测。对这些群体的建议详见其他专题(14,15,104,106-110)。本报告中描述的新建议是在普遍成人筛查期间纳入全面的抗HBc检测,这将有助于识别既往HBV感染者,这些人应意识到他们在免疫抑制背景下的再激活风险。
临床注意事项
定期检测的频率应由患者和医务人员共同决定,并基于个体危险因素,包括年龄和免疫状态。对于定期检测,医务人员应考虑使用三联板检测或AASLD的检测策略(例如,如果阳性,则先进行抗HBc,然后进行HBsAg和抗HB)。
有多个性伴侣会增加接触乙型肝炎病毒和其他性传播感染的风险;然而,证据不足以具体说明性伴侣的数量和筛查的最佳时间框架,以识别慢性感染病例。因此,在推荐对有多个性伴侣的人进行检测时,应根据性伴侣数量、性别类型、频率和最后一次血清学检测的时间,使用临床判断来确定暴露风险。
为了完成成人HBV筛查,产前检查是向孕妇提供三联检测的机会,并根据需要将患者与护理或疫苗接种联系起来。有适当时机的三联板筛查史且后续无HBV暴露风险(即自三联板筛查以来没有新的HBV暴露)的孕妇只需进行HBsAg筛查。对已知患有慢性感染或免疫力的孕妇进行检测,可以记录妊娠期间的HBsAg检测结果,以确保及时预防暴露的婴儿。
普遍筛查是对强大的乙肝疫苗接种计划的补充。病历中乙肝疫苗的接种记录提供了疫苗接种的验证。根据ACIP的建议,提供者应仅接受注明日期的记录作为HepB疫苗接种的证据(15)。对于未接种疫苗或部分接种疫苗(例如,未完成完整系列疫苗接种)的人,应在采集血液进行血清学检测后立即接种乙肝疫苗。有活动性HBV感染证据(即HBsAg阳性)或既往HBV感染(即总抗HBc阳性)的人不需要额外的疫苗剂量(15)。
HBV检测后的随访
活动性乙型肝炎病毒感染者
应告知急性感染患者发生慢性HBV感染的风险、再激活的风险以及传播给他人的风险。急性HBV感染的治疗通常不适用,除非是重症患者(11)。
被诊断为慢性HBV感染的人可以从监测和咨询中受益,包括心理健康支持(111)。CDC治疗指南尚未制定,超出了这些筛查指南的范围。然而,AASLD对慢性HBV感染的监测和治疗有指导(11)。乙型肝炎初级保健工作组(表2)(112)提供了针对初级保健医疗提供者或其他非专科医生的简化指南。
应向所有活动性HBV感染检测呈阳性的患者提供有关如何预防传播给他人的信息(框注5)。建议酌情通知、检测和接种疫苗其家庭接触者或以前的家庭接触者、性伴侣和共用针头的接触者。在资源允许的情况下,地方或州卫生部门内的病毒性肝炎或性传播感染项目可能可用于支持提供者进行接触者追踪和通知。
HBV感染者的权利受到《美国残疾人法案》(113)的保护。不应因为HBV感染而将人们排除在卫生保健领域或学校、游戏、儿童保育、工作或其他环境中(114,115)。
已解决(过去)HBV感染的人
应告知患者HBV感染史和再激活风险。再激活风险最高的疗法包括B细胞耗竭剂(例如利妥昔单抗和奥法妥尤单抗)。美国临床肿瘤学会(AmericanSocietyofClinicalOncology)和AASLD指南提供了更多关于与再激活风险增加相关的治疗和病症的信息,以及治疗建议(11,109,116,117)。在免疫抑制或细胞毒性治疗之前开始HBV感染的抗病毒治疗可以防止疾病再激活(118)。系统评价表明,在一般人群中,已解决的HBV感染(即HBsAg阴性和抗HBc阳性)的患病率为4.8%-14.0%(中位数=6.2%)。建议酌情通知、检测和接种HBV感染或有HBV感染史的患者的家庭、性伴侣和共用针头接触者。
易感染乙型肝炎病毒的人士
应告知易感染乙型肝炎病毒的人,他们从未感染过乙型肝炎病毒,也不能保护他们免受未来感染。所有易受感染的人都应根据ACIP的建议接种乙肝疫苗(59)。疫苗应答者的抗乙型肝炎浓度会随着时间的推移而减弱。对于有明确记录的疫苗接种系列但抗乙型肝炎检测呈阴性的人,请参阅美国乙型肝炎病毒感染的预防:免疫实践咨询委员会的建议 (15)。应向已开始但未完成乙肝疫苗系列接种的人接种疫苗,无论其抗乙型肝炎状态如何。完成HepB疫苗系列对长期免疫原性很重要。
易感者、拒绝接种疫苗和乙型肝炎病毒感染风险增加者应定期接受检测。定期检测的频率应由患者和医务人员共同决定,并基于个体危险因素和免疫状态。
已完全接种乙型肝炎病毒感染疫苗的人士
如果人们已经完成了乙肝疫苗系列,则可以放心地预防未来的疾病,则被视为完全接种疫苗。疫苗接种状态应清楚地记录在病历中。在疫苗应答者中,抗HBs浓度会随着时间的推移而减弱(20)。对于有明确记录的疫苗接种系列且抗HBs检测呈阴性的人,请参阅美国乙型肝炎病毒感染的预防:免疫实践咨询委员会对可能建议再次接种疫苗的特定人群(例如血液透析患者)的建议(15)。对于免疫功能正常的人,不常规推荐重新接种疫苗或加强剂量(15)。
分离出核心抗体的人
孤立的抗HBc患者在决定下一步行动之前,应考虑其免疫状态和风险史。所有FDA批准的总抗HBc测定的性能特征均有链接(补充表 21,https://stacks.cdc.gov/view/cdc/124432)。总抗HBc检测的特异性为99.8%(119,120)。但是,如果一个人没有风险因素,结果可能是假阳性;需要用相同的测定法重复测试以确认结果(121)。分离出的核心抗体结果呈假阳性意味着该人易感,应根据当前的ACIP建议提供HepB疫苗(105)。
2001-2018年的一项全国调查发现,孤立性抗HBc阳性的患病率为0.8%(约210万人)(122)。在暴露于HBV的患者中,孤立的抗HBc阳性结果可能是由于既往感染消退后抗HBs丢失、隐匿性感染(即HBsAg为阴性,但HBVDNA为阳性)、处于抗HBs出现前的窗口期或HBsAg突变体感染(即HBsAg检测无法检测到突变体未检测到的感染)。应考虑免疫抑制患者有HBV再激活的风险,并推荐进行HBVDNA检测以评估隐匿感染(11)。在婴儿中,孤立的抗HBc结果可能是HBsAg阳性母亲被动胎盘转移的结果,这就是为什么在24月龄之前不需要进行抗HBc检测的原因(15)。
患者教育
患者教育应以文化敏感、非污名化的方式进行,使用患者的主要语言(尽可能书面和口头)。必要时,应使用双语、双文化和受过医学培训的口译员。
报告
急性和慢性乙型肝炎病毒感染病例应按照要求向适当的州或地方卫生管辖区报告。州和地区流行病学家委员会公布了HBV感染报告病例分类的病例定义(123,124)。CDC更新了卫生部门关于病毒性肝炎监测和病例管理的指导方针(125)。
来自非CDC来源的建议和指导
USPSTF、AASLD和ACP也发布了HBV筛查建议。2021年USPSTF系统评价发现,没有研究直接评估HBV感染筛查对临床结果的影响,并且基于风险的筛查策略几乎可以识别所有HBV感染患者(126)。USPSTF建议对HBsAg感染风险增加的青少年和成人进行HBsAg检测。尽管工作组没有发现任何直接比较普遍筛查与基于风险的筛查效果的研究,但考虑了成本效益分析、筛查效果的间接证据、实施指南的实用性、公共卫生益处和主题专业知识。工作组得出的结论是,普遍筛查的好处大于成本。
AASLD还建议对感染风险增加的人进行筛查;但是,该指南主要基于CDC以前的建议。AASLD指南与CDC指南不同,建议对19-49岁未接种疫苗的糖尿病患者、前往HBV感染中度或高患病率国家的旅行者以及发育障碍者设施的居民和工作人员进行筛查(11)。CDC建议对这些人群进行普遍的成人筛查,但不进行定期检测。AASLD还仅推荐对某些群体进行抗HBc检测(11)。
ACP和CDC在其最佳实践建议中建议对HBV感染风险增加的人进行HBsAg检测,总抗HBc检测和抗HBs检测[121]。ACP最佳实践风险组与目前的检测建议一致,但ACP忽略了有性传播感染史或多个性伴侣的人(框注4)。
CDC筛查指南是独立于ACIP对HepB疫苗接种的建议而制定的。2018年ACIP建议还包括血清学检测建议(15)。CDC的筛查和检测指南涵盖了根据ACIP推荐进行血清学检测的所有人员,并超出了该列表(框1)。在考虑疫苗接种前检测或HBV感染检测时,CDC建议采用通用检测方法进行检测(图2)。
工作组未评估筛查后患者的临床指导。降低肝损伤风险的最新专家指南是,HBV感染患者应接种甲型肝炎病毒疫苗(如果尚未免疫)(112);筛查HIV、HCV和丁型肝炎病毒(HDV)(112);并评估酒精危险因素,例如酒精筛查和简短干预(127)。根据可能的传播途径,患者可能受益于STI筛查、药物治疗或减少伤害咨询。提供了检查、教育、实验室、血清学和影像学检查的推荐步骤的完整列表(表2)。
对于献血者、新抵达的难民和开始细胞毒性或免疫抑制治疗的患者,可能会建议进行额外筛查,对于接受血液透析的患者、医护人员、围产期暴露婴儿以及可能需要暴露后预防和疫苗接种后血清学检测的暴露事件相关人员,可能会建议进行额外筛查。这些建议详见其他专题(14,15,104,106-110)。当建议不同时,提供者应遵循最保守的方法。
未来方向
CDC将在新的治疗方法、检测、流行病学、HepB疫苗接种率以及从实施这些建议中获得的经验后审查这些建议;建议将根据需要进行修订。工作组没有进行系统评价,以重新评估2008年指南中任何HBV感染风险增加的群体;将来的建议可能会修改建议进行定期测试的组。需要有关定期测试的理想频率的额外数据。继续与实验室合作,将三种HBV检测(HBsAg、抗-HBs和抗-HBc)捆绑在一起,将有助于将检测结果作为一个三联板进行排序。此外,报告三联板汇总结果将有助于提供者正确解释结果。最后,需要更好地了解美国丁型肝炎病毒的患病率,以便为HBV感染者的丁型肝炎筛查提供建议。
结论
与基于风险的筛查相比,对成人进行HBV感染的普遍筛查具有成本效益,并可避免肝病和死亡(56)。虽然尚无根治性治疗方法,但慢性HBV感染的早期诊断和治疗可降低肝硬化、肝癌和死亡的风险[10,11]。仅基于风险的检测并不能识别出大多数慢性HBV感染者,并且提供者实施效率低下。除了疫苗接种策略外,对成人进行普遍筛查和对HBV感染风险增加人群进行适当检测将改善健康结果,降低美国HBV感染的患病率,并推进病毒性肝炎消除目标。
通讯作者:ErinE.Conners,疾病预防控制中心国家艾滋病毒、病毒性肝炎、性病和结核病预防中心病毒性肝炎科。电话:404-718-7086;电子邮件: econners@cdc.gov.
1疾病预防控制中心国家艾滋病毒、病毒性肝炎、性病和结核病预防中心病毒性肝炎科
*孕妇是指任何可以生育的人,无论性别如何,因为这些建议包括任何性别(https://uspreventiveservicestaskforce.org/uspstf/about-uspstf/methods-and-processes).
引用
1.BixlerD,ZhongY,LyKN,etal.;CHeCS调查员。慢性乙型肝炎感染患者的死亡率:慢性肝炎队列研究(CHeCS)。临床感染Dis2019;68:956–63.https://doi.org/10.1093/cid/ciy598 PMID:30060032
2.MontuclardC、HamzaS、RollotF等人。慢性HBV感染者的死亡原因:一项基于人群的队列研究。JHepatol2015年;62:1265–71.https://doi.org/10.1016/j.jhep.2015.01.020 PMID:25625233
3.BeasleyRP,HwangLY,LinCC,ChienCS.肝细胞癌和乙型肝炎病毒。一项针对台湾22707名男性的前瞻性研究。柳叶刀1981;2:1129–33.https://doi.org/10.1016/S0140-6736(81)90585-7 PMID:6118576
4.McMahonBJ,AlbertsSR,WainwrightRB,BulkowL,LanierAP.乙型肝炎相关后遗症。对1400名乙型肝炎表面抗原阳性阿拉斯加原住民携带者的前瞻性研究。ArchInternMed1990;150:1051–4.https://doi.org/10.1001/archinte.1990.00390170087019 PMID:2158773
5.RobertsH,LyKN,YinS,HughesE,TeshaleE,JilesR.乙型肝炎病毒(HBV)感染率、疫苗诱导的免疫力和高危人群的易感性:美国家庭,2013-2018年。肝病学2021;74:2353–65.https://doi.org/10.1002/hep.31991 PMID:34097776
6.WongRJ、BrosgartCL、WelchS等人。对居住在美国的外国出生者的慢性乙型肝炎患病率的最新评估。肝病学2021;74:607–26.https://doi.org/10.1002/hep.31782 PMID:33655536
7.2018年美国社区调查1年公共使用微数据样本(PUMS)。变量:出生地和入境十年。华盛顿特区:美国劳工部人口普查局;2019.https://www.census.gov/programs-surveys/acs/microdata/access.2018.html
8.McMahonBJ、AlwardWL、HallDB等。急性乙型肝炎病毒感染:年龄与疾病临床表现和随后携带者状态发展的关系。J感染Dis1985;151:599–603.https://doi.org/10.1093/infdis/151.4.599 PMID:3973412
9.LuP-J,HungM-C,SrivastavA,etal.成年人群疫苗接种覆盖率监测——美国,2018年。MMWRSurveillSumm2021;70(编号。SS-3):1-26。https://doi.org/10.15585/mmwr.ss7003a1 PMID:33983910
10.TerraultNA、BzowejNH、ChangKM、HwangJP、JonasMM、MuradMH;美国肝病研究协会。AASLD慢性乙型肝炎治疗指南,肝病学2016;63:261–83.https://doi.org/10.1002/hep.28156 PMID:26566064
11.TerraultNA、LokASF、McMahonBJ等。慢性乙型肝炎预防、诊断和治疗的最新情况:AASLD2018乙型肝炎指南。肝病学2018;67:1560–99.https://doi.org/10.1002/hep.29800 PMID:29405329
12.美国卫生与公众服务部。美国病毒性肝炎国家战略计划:消除路线图(2021-2025年)。华盛顿特区:美国卫生与公众服务部;2020.https://www.hhs.gov/sites/default/files/Viral-Hepatitis-National-Strategic-Plan-2021-2025.pdf
13.世界卫生组织。2022-2030年期间全球卫生部门分别针对艾滋病毒、病毒性肝炎和性传播感染的战略。瑞士日内瓦:世界卫生组织;2022.https://cdn.who.int/media/docs/default-source/hq-hiv-hepatitis-and-stis-library/full-final-who-ghss-hiv-vh-sti_1-june2022.pdf?sfvrsn=7c074b36_1
14.WeinbaumCM、WilliamsI、MastEE等人;慢性乙型肝炎病毒感染者的识别和公共卫生管理建议。MMWRRecommRep2008;57(编号。RR-8):1-20。PMID:18802412
15.SchillieS、VellozziC、ReingoldA等人。美国乙型肝炎病毒感染的预防:免疫实践咨询委员会的建议。MMWRRecommRep2018;67(编号。RR-1):1-31。https://doi.org/10.15585/mmwr.rr6701a1 PMID:29939980
16.SchillieS,HarrisA,Link-GellesR,RomeroJ,WardJ,NelsonN.免疫实践咨询委员会关于使用乙型肝炎疫苗和新型佐剂的建议。MMWRMorbMortalWklyRep2018;67:455–8.https://doi.org/10.15585/mmwr.mm6715a5 PMID:29672472
17.BruceMG、BrudenD、HurlburtD等。乙型肝炎疫苗后的抗体水平和保护:30年随访研究的结果和对加强剂量的反应。J感染Dis2016;214:16–22.https://doi.org/10.1093/infdis/jiv748 PMID:26802139
18.LeuridanE,VanDammeP.乙型肝炎和加强剂量的必要性。2011年临床感染Dis;53:68–75.https://doi.org/10.1093/cid/cir270 PMID:21653306
19.MiddlemanAB、BakerCJ、KozinetzCA等。婴儿乙型肝炎疫苗接种系列后的保护期。儿科2014;133:E1500-7。https://doi.org/10.1542/peds.2013-2940 PMID:24843060
20.BruceMG、BrudenD、HurlburtD等。乙型肝炎疫苗初级系列接种后35年的保护和抗体水平以及对加强剂量的反应。肝病学2022;76:1180–9.https://doi.org/10.1002/hep.32474 PMID:35320592
21.ScheiermannN,KuwertEK.乙型肝炎免疫球蛋白在人体肌肉注射后摄取和消除。DevBiolStand1983;54:347–55.PMID:6653890
22.KlevensRM,LiuS,RobertsH,JilesRB,HolmbergSD.从全国报告的病例中估计急性病毒性肝炎感染。AmJ公共卫生2014;104:482–7.https://doi.org/10.2105/AJPH.2013.301601 PMID:24432918
23.病毒性肝炎监测——美国,2019年。佐治亚州亚特兰大:美国卫生与公众服务部,CDC;2021. https://www.cdc.gov/hepatitis/statistics/2019surveillance/index.htm
24.库什纳T、陈Z、特雷斯勒S、考夫曼H、范伯格J、特劳特NA。美国育龄妇女乙型肝炎感染和免疫趋势。2020年临床感染疾病;71:586–92.https://doi.org/10.1093/cid/ciz841 PMID:31504302
25.HarrisAM、IqbalK、SchillieS等人。急性乙型肝炎病毒感染的增加——肯塔基州、田纳西州和西弗吉尼亚州,2006-2013年。MMWRMorbMortalWklyRep2016年;65:47–50.https://doi.org/10.15585/mmwr.mm6503a2 PMID:26821369
26.LimJK,NguyenMH,KimWR,GishR,PerumalswamiP,JacobsonIM.美国慢性乙型肝炎病毒感染的患病率。AmJ胃肠病2020;115:1429–38.https://doi.org/10.14309/ajg.0000000000000651 PMID:32483003
27.KoneruA,FenlonN,SchillieS,WilliamsC,WengMK,NelsonN.国家围产期乙型肝炎预防计划:2009-2017。儿科2021;147:e20201823.https://doi.org/10.1542/peds.2020-1823 PMID:33531336
28.Carande-KulisV,ElderRW,KoffmanDM.制定CDC循证指南所需的标准。MMWR增刊2022;71(增刊-1):1-6。https://doi.org/10.15585/mmwr.su7101a1 PMID:35025853
29.HongQN,PluyeP,FàbreguesS,etal.提高混合方法评估工具的内容效度:改进的e-Delphi研究。临床流行病学杂志2019;111:49-59.e1。https://doi.org/10.1016/j.jclinepi.2019.03.008 PMID:30905698
30.HusereauD、DrummondM、PetrouS等人;CHEERS工作组。综合卫生经济评估报告标准(CHEERS)声明。2013年国际技术评估医疗保健;29:117–22.https://doi.org/10.1017/S0266462313000160 PMID:23587340
31.AbaraWE、CollierMG、MoormanA等人。已故实体器官捐献者的特征以及乙型肝炎、丙型肝炎和人类免疫缺陷病毒的筛查结果——美国,2010-2017年。MMWRMorbMortalWklyRep2019;68:61–6.https://doi.org/10.15585/mmwr.mm6803a2 PMID:30677008
32.MortensenE、KamaliA、SchirmerPL等人。目前对慢性乙型肝炎病毒感染的筛查方案是否足够?诊断微生物感染Dis2016;85:159–67.https://doi.org/10.1016/j.diagmicrobio.2015.12.005 PMID:27009896
33.RobertsH、Kruszon-MoranD、LyKN等人。美国家庭慢性乙型肝炎病毒(HBV)感染率:1988-2012年全国健康和营养检查调查(NHANES)。肝病学2016;63:388–97.https://doi.org/10.1002/hep.28109 PMID:26251317
34.SeamonMJ,GinwallaR,KulpH,etal.城市穿透性创伤人群中的艾滋病毒和肝炎:未识别和未治疗。创伤杂志2011;71:306-10,讨论311。https://doi.org/10.1097/TA.0b013e31822178bd PMID:21825931
35.LevyV,YuanJ,RuizJ,etal.北加州低收入社区基于人口的家庭调查中移民男性的乙型肝炎血清流行率和风险行为。JImmigrMinorHealth2010年;12:828–33.https://doi.org/10.1007/s10903-009-9239-6 PMID:19319680
36.RamseySD、UngerJM、BakerLH等。来自学术和社区肿瘤学实践的新诊断癌症患者中乙型肝炎病毒、丙型肝炎病毒和HIV感染的患病率。JAMAOncol2019年;5:497–505.https://doi.org/10.1001/jamaoncol.2018.6437 PMID:30653226
37.ThompsonLA,HeathLJ,FremlH,DelateT.接受免疫抑制化疗的癌症患者的普遍乙型肝炎筛查和管理。JOncolPharmPract2020年;26:1141–6.https://doi.org/10.1177/1078155219889116 PMID:31789111
38.BesteLA、IoannouGN、ChangMF等。退伍军人健康管理局乙型肝炎病毒暴露的患病率以及与军事相关危险因素的关联。临床胃肠醇肝2020;18:954-962.e6。https://doi.org/10.1016/j.cgh.2019.07.056 PMID:31394284
39.ChouR、BlazinaI、BougatsosC等人。非妊娠青少年和成人乙型肝炎病毒感染筛查:美国预防服务工作组的最新证据报告和系统评价。美国医学会杂志2020;324:2423–36.https://doi.org/10.1001/jama.2020.19750 PMID:33320229
40.SpenattoN,BoulinguezS,MularczykM,etal.乙型肝炎筛查:针对谁?法国性传播感染诊所的经历。JHepatol2013;58:690–7.https://doi.org/10.1016/j.jhep.2012.11.044 PMID:23220369
41.BotteroJ、BoydA、LemoineM等人。乙型肝炎筛查的现状和需求:在低流行率的大都市地区进行的一项大型筛查研究的结果。PLoSOne2014年;9:e92266。https://doi.org/10.1371/journal.pone.0092266 PMID:24663387
42.WolfframI、PetroffD、BätzO等人;德语体检35+学习小组。初级保健环境中ALT值、HBsAg和抗HCV升高的患病率以及指南定义的肝炎风险情景的评估。JHepatol2015年;62:1256–64.https://doi.org/10.1016/j.jhep.2015.01.011 PMID:25617500
43.弗吉尼亚州莫耶;美国预防服务工作组。成人丙型肝炎病毒感染筛查:美国预防服务工作组建议声明。AnnInternMed2013年;159:349–57.https://doi.org/10.7326/0003-4819-159-5-201309030-00672 PMID:23798026
44.HwangJP,LokAS,FischMJ,etal.预测接受全身抗癌治疗的癌症患者乙型肝炎病毒感染的模型:一项前瞻性队列研究。临床肿瘤杂志2018;36:959–67.勘误表:JClinOncol2020;38:2599。https://doi.org/10.1200/JCO.2017.75.6387 PMID:29447061
45.AbaraWE、ChaS、MalikT等。孕妇乙型肝炎表面抗原的产前筛查和流行情况,以及预防传播给受感染母亲所生婴儿——关岛,2014年。J儿科感染病2018;7:290–5.https://doi.org/10.1093/jpids/pix062 PMID:28992071
46.西尔斯DM,科恩DC,阿克曼K,马JE,宋J.结肠镜检查期间慢性肝炎的出生队列筛查。AmJ胃肠病学2013;108:981–9.https://doi.org/10.1038/ajg.2013.50 PMID:23511461
47.SchillieS,WesterC,OsborneM,WesolowskiL,RyersonAB.CDC对成人丙型肝炎筛查的建议——美国,2020年。MMWRRecommRep2020;69(编号。RR-4):1-17。https://doi.org/10.15585/mmwr.rr6902a1 PMID:32271723
48.BaileyMB,ShiauR,ZolaJ,etal.旧金山无乙肝:预防乙型肝炎和肝癌的基层社区联盟。J社区卫生2011;36:538–51.https://doi.org/10.1007/s10900-010-9339-1 PMID:21125320
49.LinSY,ChangET,SoSK.在服务不足的亚洲和太平洋岛民社区中阻止一个沉默的杀手:医学生的慢性乙型肝炎和肝癌预防诊所。2009年亚洲PacJ癌症杂志;10:383–6.PMID:19640178
50.HaiderM,FloccoG,LopezR,CareyW.接受利妥昔单抗治疗的患者乙型肝炎筛查时间趋势和结果的回顾性观察性研究。BMJ公开赛2020;10:e043672。https://doi.org/10.1136/bmjopen-2020-043672 PMID:33323450
51.哈里斯AM、奥西努比A、尼尔森NP、汤普森WW。2016年使用行政索赔数据的乙型肝炎护理级联。AmJManagCare2020年;26:331–8.https://doi.org/10.37765/ajmc.2020.44069 PMID:32835460
52.SpradlingPR、XingJ、RuppLB等;慢性肝炎队列研究(CHeCS)研究人员。在美国一般医疗机构中,对慢性乙型肝炎患者的临床评估很少。临床感染Dis2016;63:1205–8.https://doi.org/10.1093/cid/ciw516 PMID:27486115
53.ToyM、WeiB、VirdiTS等。加利福尼亚州慢性乙型肝炎的种族/民族和县特定患病率及其负担。肝医学政策2018;3:6。https://doi.org/10.1186/s41124-018-0034-7 PMID:30288329
54.KimLH,NguyenVG,TrinhHN,LiJ,ZhangJQ,NguyenMH.在不同的实践环境中,符合指南标准的患者治疗率低。DigDisSci2014年;59:2091–9.https://doi.org/10.1007/s10620-014-3283-3 PMID:25060778
55.HarrisAM、Link-GellesR、KimK等人。2014年10月至2017年9月,以社区为基础的服务,以改善非美国出生的慢性乙型肝炎病毒感染者的检测和护理联系——三个美国项目。MMWRMorbMortalWklyRep2018;67:541–6.https://doi.org/10.15585/mmwr.mm6719a2 PMID:29771873
56.ToyM,HuttonD,HarrisAM,NelsonN,SalomonJA,SoS.美国成人慢性乙型肝炎感染一次性普遍筛查的成本效益。2022年临床感染病;74:210–7.https://doi.org/10.1093/cid/ciab405 PMID:33956937
57.帕特尔欧盟、ThioCL、BoonD、ThomasDL、TobianAAR。2011-2016年美国乙型肝炎和丁型肝炎病毒感染的患病率。临床感染Dis2019;69:709–12.https://doi.org/10.1093/cid/ciz001 PMID:30605508
58.HuttonDW、ToyM、SalomonJA等人。对寻求性传播感染治疗的成年人进行乙型肝炎检测和疫苗接种的成本效益。2022年性变送Dis;49:517–25.https://doi.org/10.1097/OLQ.0000000000001632 PMID:35312661
59.WengMK、DoshaniM、KhanMA等。19-59岁成人普遍接种乙型肝炎疫苗:免疫实践咨询委员会的最新建议——美国,2022年。MMWRMorbMortalWklyRep2022;71:477–83.https://doi.org/10.15585/mmwr.mm7113a1 PMID:35358162
60.AbutalebA、AlmarioJA、AlghsoonS等人。在患有慢性病毒性肝炎的退伍军人队列中,纤维化水平较高与肝外癌有关。临床实验肝病杂志2021;11:195–200.https://doi.org/10.1016/j.jceh.2020.08.001 PMID:33746444
61.武装部队健康监测中心(AFHSC)。病毒性乙型肝炎,活性成分,美国武装部队,2000-2010年。MSMR2011年;18:5–9.PMID:21879785
62.BelperioPS,ShahoumianTA,MoleLA,BackusLI.评估62,920名接受口服丙型肝炎抗病毒药物治疗的退伍军人的乙型肝炎再激活。肝病学2017;66:27–36.https://doi.org/10.1002/hep.29135 PMID:28240789
63.BiniEJ,PerumalswamiPV。美国慢性丙型肝炎病毒感染患者的乙型肝炎病毒感染:患病率、种族/民族差异和病毒相互作用。肝病学2010;51:759–66.https://doi.org/10.1002/hep.23461 PMID:20140950
64.ButtAA,YanP,AslamS,etal.乙型肝炎和丙型肝炎合并感染者接受直接抗病毒药物治疗的丙型肝炎病毒学反应:来自ERCIVES的结果。IntJInfectDis2020年;92:184–8.https://doi.org/10.1016/j.ijid.2020.01.025 PMID:31978574
65.哈里斯AM、米尔曼AJ、劳拉M、奥西努比A、洛姆J、米勒LS。乙型肝炎感染者登记册内的乙型肝炎检测、护理联系和疫苗接种覆盖率。疫苗2019;37:2188–93.https://doi.org/10.1016/j.vaccine.2019.03.012 PMID:30902481
66.HomJK,KuncioD,JohnsonCC,VinerK.丙型肝炎感染者合并感染乙型肝炎的健康和社会脆弱性增加。J卫生保健穷人服务不足2018;29:1269–80.https://doi.org/10.1353/hpu.2018.0094 PMID:30449745
67.泰森GL、克莱默JR、段Z、达维拉JA、理查森PA、埃尔塞拉格HB。美国丙型肝炎病毒感染患者队列中乙型肝炎病毒合并感染的患病率和预测因素。肝病学2013;58:538–45.https://doi.org/10.1002/hep.26400 PMID:23505059
68.KruseRL、KramerJR、TysonGL等。美国丙型肝炎病毒感染患者队列中乙型肝炎病毒合并感染的临床结果。肝病学2014;60:1871–8.https://doi.org/10.1002/hep.27337 PMID:25065513
69.MoormanAC、XingJ、RuppLB等;慢性肝炎队列研究调查员。在美国一大批丙型肝炎感染患者中进行乙型肝炎病毒感染和丙型肝炎病毒治疗。胃肠病学2018;154:754–8.https://doi.org/10.1053/j.gastro.2017.12.002 PMID:29360428
70.DavisonJ,O’SheaA,WaterburyN,VillalvazoY.检查甲型和乙型肝炎疫苗接种,以及丙型肝炎直接抗病毒治疗期间的HBV再激活监测。J社区健康2018;43:1124–7.https://doi.org/10.1007/s10900-018-0530-0 PMID:29846860
71.美国食品和药物管理局。FDA药物安全沟通:FDA警告一些接受丙型肝炎直接抗病毒药物治疗的患者有乙型肝炎再激活的风险。马里兰州银泉市:美国卫生与公众服务部,食品和药物管理局;2016.https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-fda-warns-about-risk-hepatitis-b-reactivating-some-patients-treated
72.MückeMM,BackusLI,MückeVT,etal.丙型肝炎直接抗病毒治疗期间乙型肝炎病毒再激活:系统评价和荟萃分析。柳叶刀胃肠醇肝2018;3:172–80.https://doi.org/10.1016/S2468-1253(18)30002-5 PMID:29371017
73.SerperM,FordeKA,KaplanDE.罕见的具有临床意义的肝脏事件和乙型肝炎再激活更频繁地发生在慢性丙型肝炎直接抗病毒治疗之后,而不是在治疗期间:来自美国全国队列的数据。J病毒性肝炎2018;25:187–97.https://doi.org/10.1111/jvh.12784 PMID:28845882
74.YannyBT、LattNL、SaabS等。接受Ledipasvir-Sofosbuvir治疗丙型肝炎病毒感染的患者的乙型肝炎病毒再激活风险。临床胃肠病杂志2018;52:908–12.https://doi.org/10.1097/MCG.0000000000000986 PMID:29334502
75.慢性丙型肝炎患者病毒清除后肝细胞癌的晚期发展:需要持续监测。JDigDis2018年;19:411–20.https://doi.org/10.1111/1751-2980.12615 PMID:29889353
76.LokAS、EverhartJE、DiBisceglieAM、KimHY、HussainM、MorganTR;HALT-C试验组。在美国慢性丙型肝炎患者中,隐匿性和既往乙型肝炎病毒感染与肝细胞癌无关。肝病学2011;54:434–42.https://doi.org/10.1002/hep.24257 PMID:21374690
77.ReddyA,MayE,EhrinpreisM,MutchnickM.潜伏性乙型肝炎是慢性丙型肝炎患者肝细胞癌的危险因素。世界胃肠病杂志2013;19:9328–33.https://doi.org/10.3748/wjg.v19.i48.9328 PMID:24409059
78.MacalinoGE、VlahovD、Sanford-ColbyS等人。罗德岛监狱男性中艾滋病毒、乙型肝炎病毒和丙型肝炎病毒感染的流行率和发病率。美国公共卫生杂志2004;94:1218–23.https://doi.org/10.2105/AJPH.94.7.1218 PMID:15226146
79.SolomonL,FlynnC,MuckK,VertefeuilleJ.马里兰州惩教设施进入者中艾滋病毒、梅毒、乙型肝炎和丙型肝炎的流行率。J城市健康2004;81:25–37.https://doi.org/10.1093/jurban/jth085 PMID:15047781
80.SosmanJ、MacgowanR、MargolisA等人;START项目生物制剂研究小组。有监禁史的男性的性传播感染和肝炎。2011年性变送Dis;38:634–9.https://doi.org/10.1097/OLQ.0b013e31820bc86c PMID:21844713
81.KhanAJ、SimardEP、BowerWA等。乙型肝炎病毒感染在州惩教所的囚犯中持续传播。AmJ公共卫生2005;95:1793–9.https://doi.org/10.2105/AJPH.2004.047753 PMID:16186457
82.HennesseyKA,KimAA,GriffinV,CollinsNT,WeinbaumCM,SabinK.三所监狱中乙型和丙型肝炎病毒感染的流行率以及艾滋病毒的合并感染:美国监狱中预防病毒性肝炎的案例。J城市健康2009;86:93–105.https://doi.org/10.1007/s11524-008-9305-8 PMID:18622707
83.2000年,国家惩教机构中乙型肝炎爆发。MMWRMorbMortalWklyRep2001年;50:529–32.PMID:11446570
84.LedermanE、BlackwellA、TomkusG等人。2018年,在2个移民和海关执法卫生服务团(ImmigrationandCustomsEnforcementHealthServiceCorps)配备人员的拘留设施中,对移民被拘留者进行性传播感染的选择退出测试试点。公共卫生代表2020;135(1_suppl):82S–9S。https://doi.org/10.1177/0033354920928491 PMID:32735186
85.乙型肝炎病毒在惩教设施中的传播——佐治亚州,1999年1月至2002年6月。MMWRMorbMortalWklyRep2004年;53:678–81.PMID:15295311
86.CusterB、KesslerDA、VahidniaF等人。与美国献血者HIV、HBV、HCV和HTLV感染相关的行为因素。输血2014;90:209A-10A。
87.KittikraisakW、DavidsonPJ、HahnJA等。旧金山年轻注射者的监禁:与丙型肝炎病毒感染风险的关联。J2006年基本用途;11:271–81.https://doi.org/10.1080/14659890500420095
88.MarseilleE,HarrisAM,HorvathH,etal.乙型肝炎患病率与性传播感染的关联:系统评价和荟萃分析。性健康2021;18:269–79.https://doi.org/10.1071/SH20185 PMID:34183114
89.RobertsH,JilesR,HarrisAM,GuptaN,TeshaleE.2013-2018年美国性传播乙型肝炎的发病率和患病率。性变送Dis2021;48:305–9.https://doi.org/10.1097/OLQ.0000000000001359 PMID:33492099
90.尼尔森NP、JamiesonDJ、墨菲电视台。预防围产期乙型肝炎病毒传播。JPediatricInfectDisSoc2014;3(增刊1):S7–12。https://doi.org/10.1093/jpids/piu064 PMID:25232477
91.BeasleyRP、HwangLY、LeeGC等。使用乙型肝炎免疫球蛋白和乙型肝炎疫苗预防围产期传播的乙型肝炎病毒感染。柳叶刀1983;2:1099–102.https://doi.org/10.1016/S0140-6736(83)90624-4 PMID:6138642
92.LeeC,GongY,BrokJ,BoxallEH,GluudC.乙型肝炎免疫接种对乙型肝炎表面抗原阳性母亲新生儿的影响:系统评价和荟萃分析。英国医学杂志2006;332:328–36.https://doi.org/10.1136/bmj.38719.435833.7C PMID:16443611
93.NelsonPK、MathersBM、CowieB等人。注射吸毒者乙型肝炎和丙型肝炎的全球流行病学:系统评价结果。柳叶刀2011;378:571–83.https://doi.org/10.1016/S0140-6736(11)61097-0 PMID:21802134
94.美国出生的人中已解决和当前乙型肝炎的患病率和特征趋势:2001-2018年全国健康和营养检查调查。J感染Dis2021;224:804–12.https://doi.org/10.1093/infdis/jiab224 PMID:33903902
95.GanesanA、KrantzEM、HupplerHullsiekK等人;传染病临床研究计划HIV/STI工作组。慢性肾病发病和HIV感染者队列中进展的决定因素,这些感染者可以不受限制地获得医疗保健。艾滋病毒医学2013;14:65–76.https://doi.org/10.1111/j.1468-1293.2012.01036.x PMID:22808988
96.ChunHM、MesnerO、ThioCL等;传染病临床研究计划HIV工作组。HAART上乙型肝炎病毒合并感染个体的HIV结果。JAcquir免疫缺陷Syndr2014;66:197–205.https://doi.org/10.1097/QAI.0000000000000142 PMID:24694929
97.ChunHM、RoedigerMP、HullsiekKH等;传染病临床研究计划HIV工作组。乙型肝炎病毒合并感染对HIV血清转化者的HIV结局产生负面影响。J感染Dis2012;205:185–93.https://doi.org/10.1093/infdis/jir720 PMID:22147794
98.SpradlingPR、RichardsonJT、BuchaczK、MoormanAC、BrooksJT;HIV门诊研究(HOPS)调查员。1996-2007年HIV门诊研究中慢性乙型肝炎病毒感染患者患病率。J病毒性肝炎2010;17:879–86.https://doi.org/10.1111/j.1365-2893.2009.01249.x PMID:20158604
99.PitasiMA、BinghamTA、SeyEK、SmithAJ、TeshaleEH。乙型肝炎病毒(HBV)感染、免疫力和男男性行为者(MSM)的易感性,美国洛杉矶县。艾滋病行为2014;18(增刊3):248–55。https://doi.org/10.1007/s10461-013-0670-2 PMID:24276792
100.WeinbaumCM、LyerlaR、MackellarDA等人;青年男子调查研究小组。青年男子调查第二阶段:男男性行为青年男子的乙型肝炎免疫接种和感染。AmJ公共卫生2008;98:839–45.https://doi.org/10.2105/AJPH.2006.101915 PMID:18382012
101.BurdickRA、Bragg-GreshamJL、WoodsJD等。来自三大洲的血液透析单位的乙型肝炎患病率和血清转化模式:DOPPS。肾脏国际2003;63:2222–9.https://doi.org/10.1046/j.1523-1755.2003.00017.x PMID:12753311
102.LondonWT,DrewJS,LustbaderED,WernerBG,BlumbergBS.宿主对慢性血液透析病房患者乙型肝炎感染的反应。肾脏国际1977;12:51–8.https://doi.org/10.1038/ki.1977.78 PMID:894916
103.RibotS,RothsteinM,GoldblatM,GrassoM.血液透析患者乙型肝炎表面抗原血症(HBsAg)的持续时间。ArchInternMed1979年;139:178–80.https://doi.org/10.1001/archinte.1979.03630390036015 PMID:434972
104.AlterMJ、ArduinoMJ、LyerlaHC、MillerER、TokarsJI。预防慢性血液透析患者感染传播的建议。MMWRRecommRep2001;50(RR-5):1–43。PMID:11349873
105.WangS,CohenC,TangAS,GrahamCS.在美国消除乙型肝炎病毒:是时候消除障碍并实施解决方案了。CurrHepatol代表2021;20:34–42.https://doi.org/10.1007/s11901-020-00557-3
106.疾病预防控制中心。在对新抵达的难民进行国内体检时筛查病毒性肝炎。佐治亚州亚特兰大:美国卫生与公众服务部,CDC;2020. https://www.cdc.gov/immigrantrefugeehealth/guidelines/domestic/hepatitis-screening-guidelines.html
107.标题21,食品和药品。21CFR§610.40(2020)。https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?FR=610.40
108.MyintA,TongMJ,BeavenSW.乙型肝炎病毒的再激活:临床指南综述。临床肝病(霍博肯)2020;15:162–7.https://doi.org/10.1002/cld.883 PMID:32395244
109.HwangJP,FeldJJ,HammondSP,etal.治疗前癌症患者的乙型肝炎病毒筛查和管理:ASCO临时临床意见更新。临床肿瘤杂志2020;38:3698–715.https://doi.org/10.1200/JCO.20.01757 PMID:32716741
110.SchillieS、MurphyTV、SawyerM等人;CDC关于评估医护人员乙型肝炎病毒保护和管理暴露后管理的指南。MMWRRecommRep2013;62(否。RR-10):1-19。PMID:24352112
111.DaidaYG、BoscarinoJA、MoormanAC等;慢性肝炎队列研究调查员。慢性乙型肝炎患者的身心健康状况。QualLifeRes2020年;29:1567–77.https://doi.org/10.1007/s11136-020-02416-6 PMID:31938963
112.TangA,ThorntonK,初级保健工作组HBV。乙型肝炎管理:初级保健提供者指南。华盛顿州西雅图:华盛顿大学国家肝炎培训中心;2020.https://www.hepatitisb.uw.edu/page/primary-care-workgroup/guidance
113.MorarasK,BlockJ,ShiromaN,CannizzoA,CohenC.根据《美国残疾人法案》保护患有乙型肝炎的医疗保健学生的权利。公共卫生代表2020;135(1_suppl):13S–8S。https://doi.org/10.1177/0033354920921252 PMID:32735187
114.霍姆伯格SD、苏里亚普拉萨德A、沃德JW;更新了CDC关于乙型肝炎病毒感染医务人员和学生管理的建议。MMWRRecommRep2012;61(编号。RR-3):1-12。PMID:22763928
115.SamuelsJ,GalanterS,RodriguezL.关于乙型肝炎歧视的联合机构致健康相关研究生院的信函。华盛顿特区:美国司法部、卫生与公众服务部和教育部;2013.https://www.justice.gov/iso/opa/resources/732013612162552847322.pdf
116.LoombaR,梁TJ.与免疫抑制和生物修饰剂治疗相关的乙型肝炎再激活:当前概念、管理策略和未来方向。胃肠病学2017;152:1297–309.https://doi.org/10.1053/j.gastro.2017.02.009 PMID:28219691
117.美国食品和药物管理局。FDA药物安全沟通:使用免疫抑制和抗癌药物Arzerra(奥法木单抗)和利妥昔单抗(利妥昔单抗)降低乙型肝炎再激活风险的方框警告和新建议。马里兰州银泉市:美国卫生与公众服务部、食品和药物管理局;2016.https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-boxed-warning-and-new-recommendations-decrease-risk-hepatitis-b
118.LoombaR、RowleyA、WesleyR等人。系统评价:预防性拉米夫定对化疗期间乙型肝炎再激活的影响。AnnInternMed2008年;148:519–28.https://doi.org/10.7326/0003-4819-148-7-200804010-00008 PMID:18378948
119.HourfarMK、WalchLA、GeusendamG等人。抗HBc筛查检测的灵敏度和特异性——哪种检测最适合献血者筛查?国际实验室血液学杂志2009;31:649–56.https://doi.org/10.1111/j.1751-553X.2008.01092.x PMID:18673399
120.GishRG,BasitSA,RyanJ,DawoodA,ProtzerU.乙型肝炎核心抗体:2020年在临床实践中的作用。CurrHepatol代表2020;19:254–65.https://doi.org/10.1007/s11901-020-00522-0
121.阿巴拉WE、卡西姆A、席利S、麦克马洪BJ、哈里斯AM;美国内科医师学会和疾病预防控制中心的高价值护理工作组。乙型肝炎疫苗接种、筛查和与护理的联系:美国内科医师学会和疾病控制与预防中心的最佳实践建议。AnnInternMed2017年;167:794–804.https://doi.org/10.7326/M17-1106 PMID:29159414
122.SpradlingPR,XingJ,HarrisAM,LyKN.2001-2018年美国乙型肝炎核心抗原和相关隐匿性乙型肝炎分离抗体的估计患病率和人数。J感染Dis2022;225:465–9.https://doi.org/10.1093/infdis/jiab366 PMID:34252183
123.州和地区流行病学家委员会。急性乙型肝炎感染的公共卫生报告和国家通报。11-ID-03型佐治亚州亚特兰大:州和地区流行病学家委员会;2011.https://cdn.ymaws.com/www.cste.org/resource/resmgr/PS/11-ID-03.pdf
124.州和地区流行病学家委员会。慢性乙型肝炎感染的公共卫生报告和国家通报。11-ID-04型佐治亚州亚特兰大:州和地区流行病学家委员会;2011.https://cdn.ymaws.com/www.cste.org/resource/resmgr/PS/11-ID-04.pdf
125.病毒性肝炎监测和病例管理:州、地区和地方卫生部门指南。佐治亚州亚特兰大:疾病预防控制中心;2021https://www.cdc.gov/hepatitis/statistics/surveillanceguidance/docs/viral-hepatitis-surveillance-and-case-management_508.pdf
126.KristAH、DavidsonKW、MangioneCM等;美国预防服务工作组。青少年和成人乙型肝炎病毒感染筛查:美国预防服务工作组建议声明。美国医学会杂志2020;324:2415–22.https://doi.org/10.1001/jama.2020.22980 PMID:33320230
127.疾病预防控制中心。规划和实施危险饮酒筛查和简短干预:初级保健实践的分步指南。佐治亚州亚特兰大:CDC、国家出生缺陷和发育障碍中心;2014.https://www.cdc.gov/ncbddd/fasd/documents/AlcoholSBIImplementationGuide-P.pdf
方框1.乙型肝炎病毒筛查和检测建议—CDC,2023年
乙型肝炎病毒(HBV)普遍筛查
≥18岁成人一生中至少筛查一次HBV(新推荐)
在筛查过程中,检测乙型肝炎表面抗原(HBsAg)、HBsAg抗体和HBcAg总抗体(总抗HBc)(新推荐)
孕妇筛查
在每次怀孕期间,最好在孕早期对所有孕妇进行乙型肝炎病毒筛查,无论疫苗接种情况或检测史如何*
有适当时机的三联板筛查史且后续无HBV暴露风险(即自三联板筛查以来没有新的HBV暴露)的孕妇只需进行HBsAg筛查
基于风险的测试
对所有有HBV感染风险增加史的人进行检测,无论他们的年龄大小,如果他们在风险增加期间可能易感†
对易感人群进行定期检测,无论年龄大小,这些人群存在持续的暴露风险,而暴露风险持续存在†
* 源:SchillieS、VellozziC、ReingoldA等人。美国乙型肝炎病毒感染的预防:免疫实践咨询委员会的建议。MMWRRecommRep2018;67(编号。RR-1):1-31。
†易感人群包括从未感染过乙型肝炎病毒(即总抗乙型肝炎阴性)且未按照免疫实践咨询委员会的建议完成乙肝疫苗系列接种或已知疫苗无反应者的人。
表1.乙型肝炎病毒感染筛查结果的解释和建议的措施
| 临床状态 | HBsAg | Anti-HBs | 总anti-HBc* | IgM anti-HBc | 行动† |
|---|---|---|---|---|---|
| 急性感染 | 阳性 | 阴性 | 阳性 | 阳性 | 链接到乙型肝炎病毒感染治疗 |
| 慢性感染 | 阳性 | 阴性 | 阳性 | 阴性§ | 链接到乙型肝炎病毒感染治疗 |
| 已解决的感染 | 阴性 | 阳性 | 阳性 | 阴性 | 关于HBV感染再激活风险的咨询 |
| 免疫力(从先前接种疫苗推断出的免疫力) | 阴性 | 阳性¶ | 阴性 | 阴性 | 如果完成HepB疫苗系列的病史,请放心;如果部分接种了疫苗,请按照ACIP的建议完成疫苗系列 |
| 易感,从未感染 | 阴性 | 阴性** | 阴性 | 阴性 | 根据ACIP建议提供HepB疫苗 |
| 分离核心抗体阳性†† | 阴性 | 阴性 | 阳性 | 阴性 | 取决于阳性结果的原因 |
缩写:ACIP=免疫实践咨询委员会;Anti-HBs=乙型肝炎表面抗原抗体;HBcAg=乙型肝炎核心抗原;HBsAg=乙型肝炎表面抗原;HBV=乙型肝炎病毒;HepB=乙型肝炎;IgG=免疫球蛋白G;IgM anti-HBc=乙型肝炎核心抗原的免疫球蛋白M抗体;总抗HBc=乙型肝炎核心抗原总抗体。
*总抗HBc是HBcAg的IgM和IgG抗体的量度。
† 源:AbaraWE,QaseemA,SchillieS,etal.乙型肝炎疫苗接种、筛查和护理联系:来自美国内科医师学会和疾病控制与预防中心的最佳实践建议。AnnInternMed2017年;167:794–804.
在严重HBV感染发作或再激活期间,慢性感染患者的抗HBcIgM也可能呈阳性。
如果疫苗系列完成后抗HBs浓度为>10mIU/mL,则具有免疫力。
**疫苗应答者的抗乙型肝炎浓度可能会随着时间的推移而减弱(资料来源:SchillieS,VellozziC,ReingoldA,etal.预防美国乙型肝炎病毒感染:免疫实践咨询委员会的建议。MMWRRecommRep2018;67[否RR-1]:1-31)。§¶
††可能是既往抗HBs水平减弱时感染、隐匿性感染、抗HBc被动转移给HBsAg阳性妊娠父母所生婴儿、假阳性或实验室检测无法检测到的突变HBsAg菌株的结果。
图1.急性和慢性乙型肝炎病毒感染的典型血清学病程
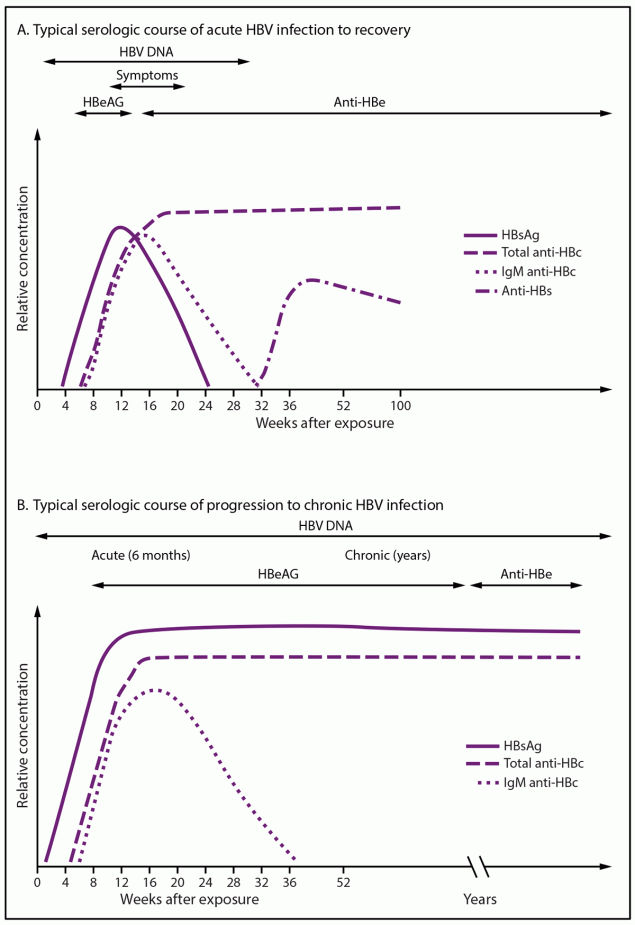
源:改编自WeinbaumCM、WilliamsI、MastEE等人;慢性乙型肝炎病毒感染者的识别和公共卫生管理建议。MMWRRecommRep2008;57(编号。RR-8):1-20。
缩写:抗-HBc=乙型肝炎核心抗原抗体;抗-HBe=乙型肝炎e抗原抗体;抗-HBs=乙型肝炎表面抗原抗体;HBeAg=乙型肝炎e抗原;HBsAg=乙型肝炎表面抗原;HBV=乙型肝炎病毒;IgM=免疫球蛋白M。
方框2.普遍筛查乙型肝炎病毒的基本原理
乙型肝炎病毒(HBV)感染的发病率和死亡率很高。
慢性HBV感染可以在发生严重肝病之前使用可靠且廉价的筛查测试进行检测。
慢性HBV感染的治疗可以降低发病率和死亡率。
慢性HBV感染的治疗可以防止传播给他人。
对成人进行普遍筛查具有成本效益。
筛查可以识别和管理感染乙肝病毒的孕妇及其婴儿,从而降低围产期传播的风险。
筛查可以识别出有HBV感染再激活风险的人。
筛查可能会确定哪些人将从乙型肝炎疫苗接种中受益。
框注3.按国家或地区分列的慢性乙型肝炎病毒感染患病率
高患病率(≥8%):安哥拉、佛得角、中非共和国、乍得、斯威士兰、加纳、几内亚、几内亚比绍、基里巴斯、莱索托、利比里亚、马里、毛里塔尼亚、尼日尔、尼日利亚、菲律宾、圣多美和普林西比、塞拉利昂、所罗门群岛、台湾、东帝汶、多哥、汤加、土库曼斯坦、图瓦卢和津巴布韦。
中度患病率(5%–7.9%):阿尔巴尼亚、贝宁、布基纳法索、喀麦隆、中国、科特迪瓦、朝鲜民主主义人民共和国、吉布提、厄立特里亚、埃塞俄比亚、密克罗尼西亚联邦、加蓬、印度尼西亚、吉尔吉斯斯坦、摩尔多瓦、蒙古、莫桑比克、缅甸、巴布亚新几内亚、塞内加尔、索马里、南苏丹、叙利亚、塔吉克斯坦、乌兹别克斯坦、瓦努阿图和越南。
中低患病率(2%–4.9%):阿富汗、阿塞拜疆、孟加拉国、白俄罗斯、波斯尼亚和黑塞哥维那、保加利亚、布隆迪、柬埔寨、科摩罗、刚果、刚果民主共和国、冈比亚、格鲁吉亚、圭亚那、海地、香港、印度、伊拉克、牙买加、约旦、哈萨克斯坦、韩国、老挝、马达加斯加、马拉维、马来西亚、马绍尔群岛、阿曼、巴基斯坦、罗马尼亚、卢旺达、萨摩亚、新加坡、南非、斯里兰卡、苏丹、坦桑尼亚、泰国、特立尼达和多巴哥、突尼斯、土耳其、乌干达、也门和赞比亚。
低患病率(≤1.9%):阿尔及利亚、阿根廷、亚美尼亚、澳大利亚、奥地利、巴林、比利时、伯利兹、不丹、玻利维亚、巴西、加拿大、智利、哥伦比亚、哥斯达黎加、克罗地亚、古巴、捷克、丹麦、多米尼加共和国、厄瓜多尔、埃及、萨尔瓦多、爱沙尼亚、斐济、芬兰、法国、德国、希腊、危地马拉、洪都拉斯、匈牙利、伊朗、爱尔兰、以色列、意大利、日本、肯尼亚、科索沃、科威特、黎巴嫩、利比亚、墨西哥、摩洛哥、尼泊尔、荷兰、新西兰、尼加拉瓜、挪威、巴勒斯坦、巴拿马、巴拉圭、秘鲁、波兰、葡萄牙、卡塔尔、俄罗斯、沙特阿拉伯、斯洛伐克、斯洛文尼亚、西班牙、苏里南、瑞典、瑞士、乌克兰、阿拉伯联合酋长国、英国、美国和委内瑞拉。
未知患病率(数据不可用):美属萨摩亚、安道尔、安圭拉、安提瓜和巴布达、阿鲁巴、巴哈马、巴巴多斯、百慕大、博内尔岛、圣尤斯特歇斯和萨巴、博茨瓦纳、英属维尔京群岛、文莱、开曼群岛、库克群岛、库拉索岛、塞浦路斯、多米尼克、赤道几内亚、福克兰群岛、法罗群岛、法属圭亚那、法属波利尼西亚、直布罗陀、格陵兰、格林纳达、瓜德罗普岛、关岛、教廷、冰岛、马恩岛、拉脱维亚、列支敦士登、立陶宛、卢森堡、澳门、马其顿、马尔代夫、马耳他、马提尼克岛、毛里求斯、马约特岛、摩纳哥、黑山、蒙特塞拉特、纳米比亚、瑙鲁、新喀里多尼亚、纽埃、北马里亚纳群岛、帕劳、波多黎各、留尼汪岛、圣巴泰勒米岛、圣赫勒拿岛、圣基茨和尼维斯、圣卢西亚、圣马丁岛、圣皮埃尔和密克隆岛、圣文森特和格林纳丁斯、圣马力诺、塞尔维亚、塞舌尔、圣马丁岛、托克劳、特克斯和凯科斯群岛、美属维尔京群岛、乌拉圭、瓦利斯和富图纳群岛、和西撒哈拉。
源:北极星天文台[互联网]。科罗拉多州拉斐特:疾病分析基金会中心;2021.https://cdafound.org/polaris
图2.按年龄将乙型肝炎病毒筛查和检测纳入临床工作流程
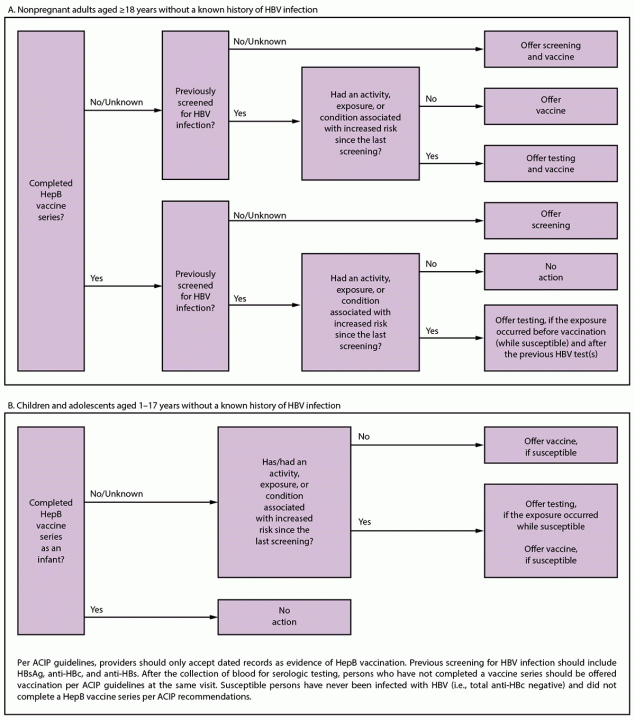
缩写:ACIP=免疫实践咨询委员会;抗-HBc=乙型肝炎核心抗原抗体;抗-HBs=乙型肝炎表面抗原抗体;HBV=乙型肝炎病毒;HBsAg=乙型肝炎表面抗原;HepB=乙型肝炎。
框注4.与乙型肝炎病毒感染风险增加相关的人员和活动、暴露或状况—CDC检测建议,2023 年
乙型肝炎表面抗原阳性的孕妇所生婴儿
出生在乙型肝炎病毒(HBV)感染率为≥2%的地区的人
美国出生的婴儿未接种疫苗,其父母出生在乙型肝炎病毒感染率为≥8%的地区
注射吸毒
监禁在监狱、监狱或其他拘留场所(新建议)
HIV感染
丙型肝炎病毒感染(新推荐)
男男性行为者
性传播感染或多个性伴侣(新推荐)
已知乙型肝炎病毒感染者的家庭接触者
已知HBV感染者的共用针头或性接触
维持性透析,包括中心或家庭血液透析和腹膜透析
未知原因的丙氨酸转氨酶或天冬氨酸转氨酶水平升高
要求进行乙型肝炎病毒检测的人(新建议)
表2.乙型肝炎表面抗原阳性者的初步医学评估
| 病史/体格检查 | 患者教育 | 常规实验室检查 | 血清学/病毒学 | 影像学/分期研究 |
|---|---|---|---|---|
| •肝硬化的 症状/体征•酒精筛查和简短干预 •代谢危险因素 •肝细胞癌家族史 •甲型肝炎疫苗接种状况;如果未接种疫苗,请接种疫苗 | •教育患者如何防止传播给他人 •确定家庭接触者、性伴侣或共用针头的接触者,以便进行筛查和疫苗接种 •建议戒酒或限制饮酒* •推荐降低代谢综合征和脂肪肝 风险的措施•根据需要转介减少伤害咨询或药物治疗服务 | •全血细胞计数 •全面的代谢检查,包括AST/ALT、总胆红素、碱性磷酸酶、白蛋白、肌酐和INR | •HBeAg/抗-HBe •HBVDNA •抗HAV(总或IgG),用于确定是否需要接种疫苗(如果没有记录 •抗HCV •抗HDV† •抗艾滋病毒 •其他性传播感染(如指征) | •腹部超声检查伴或不伴AFP •弹性成像(例如FibroScan)或血清纤维化评估(例如APRI、FibroSure、FIB-4)§ |
源:表改编自TangAS,ThorntonK;乙型肝炎初级保健工作组。乙型肝炎管理:初级保健提供者指南。华盛顿州西雅图:华盛顿大学国家肝炎培训中心;2020.
缩写:AFP=甲胎蛋白;抗HAV=甲型肝炎病毒抗体;抗-HBe=乙型肝炎e抗原抗体;抗HCV=丙型肝炎病毒抗体;抗丁型肝炎病毒=丁型肝炎病毒抗体;APRI=AST与血小板比值指数;AST/ALT=天冬氨酸转氨酶/丙氨酸转氨酶;全血细胞计数=全血细胞计数;HBeAg=乙型肝炎e抗原;HBsAg=乙型肝炎表面抗原;HBV=乙型肝炎病毒;INR=国际标准化比值;STI=性传播感染。
*女性每周饮酒超过7杯,男性每周饮酒超过14杯与肝病风险增加有关(来源:TerraultNA、LokASF、McMahonBJ等人慢性乙型肝炎预防、诊断和治疗的最新情况:AASLD2018乙型肝炎指南。肝病学2018;67:1560–99).
† 源:AASLD实践指南(https://www.aasld.org/practice-guidelines).
超声用于肝细胞癌监测的诊断准确性高于AFP;因此,除非超声不可用或负担不起,否则不建议单独使用AFP(来源:TerraultNA、LokASF、McMahonBJ等人。慢性乙型肝炎预防、诊断和治疗更新:AASLD2018乙型肝炎指南。肝病学2018;67:1560–99).§
框注5.乙型肝炎病毒感染者的预防信息
为预防或降低传播给他人的风险,乙型肝炎表面抗原(HBsAg)阳性者应采取以下措施:
o通知他们的家庭接触者、性接触者和共用针头的接触者,他们应该接受乙型肝炎病毒(HBV)感染标志物检测;如果易感,接触者应完成乙型肝炎(HepB)疫苗系列
o使用避孕套保护易感性伴侣免于因性行为感染乙型肝炎病毒,直到性伴侣可以接种疫苗并记录其免疫力(避孕套和其他预防方法也可以降低其他性传播感染的风险)
o覆盖伤口和皮肤病变,以防止感染性分泌物或血液扩散
o用漂白剂溶液清洁溢出的血液*
o避免捐献血液、血浆、组织或精液
o避免共用可能被血液污染的家居用品(例如牙刷和剃须刀)
o避免共用针头、注射器和其他注射设备
o妥善处理血液、体液和医疗废物
乙肝表面抗原阳性孕妇的新生儿应在出生时接种乙肝疫苗和乙肝免疫球蛋白,并按照建议的疫苗接种时间表完成乙肝疫苗系列接种。†
在寻求医疗或牙科护理时,HBsAg阳性者应告知负责其护理人员其HBsAg状况,以便对其进行适当评估和管理。
* 源:RutalaWA,韦伯DJ;医疗保健感染控制实践咨询委员会。医疗机构消毒和灭菌指南,2008年。佐治亚州亚特兰大:美国卫生与公众服务部,CDC;2008. https://stacks.cdc.gov/view/cdc/47378
† 源:SchillieS、VellozziC、ReingoldA等人。美国乙型肝炎病毒感染的预防:免疫实践咨询委员会的建议。MMWRRecommRep2018;67:(不。RR-1):1-31。
建议引用本文:ConnersEE、PanagiotakopoulosL、HofmeisterMG等人。乙型肝炎病毒感染的筛查和检测:CDC建议—美国,2023年。MMWRRecommRep2023;72(编号。RR-1):1-25。DOI:http://dx.doi.org/10.15585/mmwr.rr7201a1.
最后审核日期: 2023年8月10日
资料来源:美国疾病控制与预防中心
ScreeningandTestingforHepatitisBVirusInfection:CDCRecommendations—UnitedStates,2023|MMWR
Hits: 255

