Contents
CDC Laboratory Recommendations for Syphilis Testing, United States, 2024
CDC实验室对梅毒检测的建议,美国,2024年
建议和报告/2024年2月8日/73(1);1–32
JohnR.Papp,博士1;伊娜·帕克,医学博士1,2;YetundeFakile,博士1;劳拉·佩雷拉(LaraPereira)博士3;艾伦·皮莱(AllanPillay)博士1;盖尔·博兰(GailA.Bolan),医学博士1(查看作者单位)
本页内容
总结
本报告提供了CDC对可支持梅毒诊断的检测的新建议,包括梅毒螺旋体血清学检测和识别病原体的方法。这些综合建议是CDC首次发表的关于梅毒实验室检测的建议,梅毒实验室检测传统上基于血清学法来检测对 梅毒螺旋体的体液免疫反应。这些检测可分为非密螺旋体和密螺旋体检测,具体取决于它们分别检测对宿主和梅毒螺旋体共有的脂质抗原具有广泛反应的抗体或对梅毒螺旋体具有特异性的抗体。这两种类型的检查必须结合使用,以帮助区分未经治疗的感染或已成功治疗的既往感染。较新的血清学检测允许实验室自动化,但必须在算法中使用,这也可能涉及较旧的手动血清学检测。苍白梅毒螺旋体的直接检测继续从对病灶材料进行显微镜检查以可视化梅毒螺旋体发展到对生物体的分子检测。美国提供有限的梅毒即时检测;增加敏感性和特异性的即时检测的可用性可以促进筛查项目的扩展,并缩短从检测结果到治疗的时间。这些建议旨在供临床实验室主任、实验室工作人员、临床医生和疾病控制人员使用,他们必须在多种可用的检测方法中进行选择,建立收集和处理标本的标准操作程序,解释实验室报告的检测结果,并为患者提供咨询和治疗。未来对这些建议的修订将基于梅毒临床实验室科学的新研究或技术进步。
介绍
背景
梅毒螺旋体亚种(Treponema pallidum subsp. pallidum)主要通过性接触传播,是梅螺旋体属(Treponemataceae)属的四种致病菌之一(1)。其他三种致病性密螺旋体引起皮肤病,主要通过皮肤与皮肤的直接接触传播。雅司病由雅司苍白螺旋体雅司亚型引起,分布于非洲、亚洲和拉丁美洲的热带地区(2)。密螺旋体感染导致品他(Pinta) ,虽然罕见,但在拉丁美洲的热带地区发现(3)。地方性梅毒或贝杰尔病由苍白梅毒螺旋体地方性亚种引起,主要发生在儿童中,主要见于地中海东部、西非和古巴(4,5)。然而,对贝杰尔流行地区以外的某些患者病变标本的系统发育分析显示,苍白梅毒螺旋体地方性亚种可能通过性传播。这些患者的临床病程与梅毒相似(5-8)。在本报告中,除非有必要进一步区分亚种,否则T.pallidum亚种将缩写为T.pallidum。
梅毒螺旋体可引起全身感染,并可能导致多个器官系统(包括中枢神经系统(CNS)以及眼和耳系统)出现严重的中风。垂直传播可引起先天性梅毒,可能导致自然流产、流产或死产;患有先天性梅毒的婴儿在出生时或出生后数月至数年可能出现感染的临床体征。成人的临床特征从一期梅毒开始经历不同的阶段,一期梅毒通常在暴露后约3周出现,潜伏期为10-90天(9)。一期梅毒的特征是单个或多个溃疡样病变(下疳),这些病变通常是无痛的,因此当它们发生在口腔、阴道或直肠内时可能不会引起注意。下疳可以持续2-6周,然后才能自愈。二期梅毒通常在大多数原发性皮损愈合后2-24周开始,通常表现为躯干、手掌和脚底出现皮肤黏膜皮疹;口腔粘液斑块或生殖器或直肠上的阔湿疣见于约四分之一的患者。一期和二期梅毒症状可同时发生,这在HIV感染者中更常见。潮湿的一期和二期梅毒病变含有传染性 梅毒螺旋体,可通过性接触传播给易感人群。继发性临床表现还可能包括淋巴结肿大、脱发,偶尔还有神经系统和眼部表现。二期梅毒的体征和症状通常在大约3个月内消退,范围为1-12个月(10,11),但在≤25%的未经治疗的患者中,感染的最初几年可能会周期性复发(12)。
当不存在梅毒的症状或体征时,一期至二期和继发期至三期梅毒之间的间隔称为潜伏期。从二期梅毒到三期梅毒的间隔可以持续数年或数十年,然后才会出现症状。在多达三分之二的患者中,该疾病可以终生潜伏,并且永远不会进展为三期梅毒(13-15)。潜伏性无症状梅毒分为三类:被认为在过去一年内获得的早期潜伏感染;晚期潜伏感染被认为持续时间超过1年;以及持续时间不明的潜伏梅毒,其感染时间无法根据现有的临床、病史或实验室数据确定。三期梅毒是一种罕见的疾病,其临床症状包括心血管梅毒,伴有胸主动脉或冠状动脉中密螺旋体增殖导致的动脉瘤或狭窄;梅毒性胶质瘤,伴有软肉芽肿性生长,可导致任何器官系统(包括骨骼和软骨)的组织破坏;和神经梅毒,伴有晚期神经系统表现,包括脊髓痨和全身麻痹。神经梅毒可发生于梅毒的任何阶段,在感染的任何阶段可以是无症状的或有症状的。
CDC新建议的基本原理
梅毒是一种全国性的法定报告疾病,2021年美国向CDC报告了约176,000例病例(16),全球约有600万例新病例(17),由梅毒螺旋体引起。梅毒正在美国流行,一期和二期梅毒持续增加,从2000年报告的5,979例增加到2020年报告的133,945例,增加了2,140%(16,18)。该流行病的特点是健康差异,特别是在性少数群体和性别少数群体之间,与艾滋病毒和物质使用流行病有交集,以及先天性梅毒感染导致的发病率和死亡率增加(16)。
实验室在应对梅毒流行的公共卫生方面发挥着关键作用。实验室的职责是及时检测标本并报告结果,使临床医生能够有效地为患者管理做出临床诊断。实验室的公共卫生报告还使地方卫生部门和疾病预防控制中心能够进行监测和监测疾病趋势。本报告详细介绍了CDC对梅毒检测的新建议,包括基于实验室的检测、即时检测(POC)、样本处理以及检测结果报告,以帮助实验室医生和临床医生诊断梅毒。未来对这些建议的修订将基于梅毒临床实验室科学的新研究或技术进步。
方法
这些建议是由CDC工作人员根据同行评审的科学期刊上发表的证据制定的。对美国食品和药物管理局(Food and Drug Administration,FDA)批准的梅毒诊断检测试剂盒中的可用数据进行了审查和评估,以确保与已发表的结果一致。2017年,公共卫生实验室协会(APHL)通过一个独立的工作组协助进行文献综述,该工作组旨在评估CDC在制定美国梅毒检测循证建议时考虑的科学文献。APHL工作组成员是根据梅毒领域的专业知识选出的,代表了公共卫生和商业实验室主任、公共和私营部门提供者以及学术研究人员。工作组负责人在对文献进行系统综述方面经验丰富。潜在的利益冲突已向APHL披露,并列在工作组末尾(补充附录1,https://stacks.cdc.gov/view/cdc/138288)。APHL工作人员审查了潜在的冲突,并得出结论,没有工作组成员有经济利益或持续的关系,可能会使文献综述和随后的讨论产生偏见。APHL工作组没有对证据进行排名,也没有根据科学文献综述提出任何建议。CDC工作人员根据科学文献对证据进行排名和起草建议,证明他们对这项活动没有感知或实际的竞争利益。
CDC确定了在文献综述过程中应解决的有关美国梅毒检测的关键问题,并于2017年3月与APHL工作组成员分享了这些问题。工作组成员被分配了要审查的关键问题(补充附录2,https://stacks.cdc.gov/view/cdc/138288),并在CDC和APHL工作人员的协助下,对Medline、Embase、Scopus、Cochrane图书馆和CINAHL进行了广泛的文献检索;每个关键问题的检索词组合用于检索2017年1月1日至6月30日期间发表的文献(补充附录2,https://stacks.cdc.gov/view/cdc/138288)。宽的时间间隔是必要的,因为某些测试已经使用了近一个世纪。2017年11月,工作组成员向CDC和APHL工作人员提交了他们的审查。对关键问题和相关出版物的优点、缺点和相关性进行了审查,并由工作组成员个人进行了讨论。讨论是非正式的,不是为了达成共识;没有使用正式的评级系统。总结所审查证据的背景文件经过同行评审,并于2020年7月发表(19-23)。随后,CDC工作人员使用前面描述的相同检索标准和证据审查排名方法来识别截至2022年9月1日发表的文章。
2017年11月会议后,APHL工作组解散。CDC工作人员审查了科学证据,并根据美国预防服务工作组评级(https://www.uspreventiveservicestaskforce.org/uspstf/us-preventive-services-task-force-ratings)。如果研究使用临床特征标本质量高、按阶段分层、样本量较大、具有前瞻性或横断面或回顾性研究,则评级为A。B级研究质量良好至中等,样本量大,具有临床特征但未按阶段分层,或者具有特征但不清楚其确切方法学问题。C级研究质量一般,包括样本量小、方法学问题适中、使用单一实验室试验作为金标准或描述性的研究。D级研究质量较差,纳入的研究存在重大方法学问题或样本量小。病例报告或小型案例研究被评定为I.与关键问题无关的研究被指定为NR,不再进一步评级。这些建议基于来自A级和B级研究的高排名科学证据,这些证据将为梅毒的诊断和最终的患者护理带来净益处(补充表1、2、3、4、5、6和7,https://stacks.cdc.gov/view/cdc/138288)。CDC工作人员在制定这些建议时考虑了对患者的危害和益处,因此不包括具有误导性或不良数据的研究,这些研究可能因实验室检测不准确而对患者护理造成净伤害。本报告还考虑了其他因素(例如成本效益),并将其纳入其中。
建议草案按照管理和预算办公室的定义进行了同行审查,以获得有影响力的科学信息(https://wcms-wp.cdc.gov/os/quality/support/peer-review.htm)。2022年2月,建议草案由梅毒领域的四位专家进行了同行评审,他们不是美国联邦雇员,没有得到CDC资助的梅毒研究,也没有参与这些建议的制定(补充附录3,https://stacks.cdc.gov/view/cdc/138288)。在外部同行评审期间提交的意见已得到解决,该文件自2023年4月5日起提供为期60天的公众意见征询期。建议草案由主题专家和利益相关者审查,包括APHL,美国微生物学会,医疗保险和医疗补助服务中心(CMS)和FDA。在公众意见征询和利益攸关方审查后,CDC在制定梅毒最终检测建议时考虑了所有意见。
更新梅毒血清学实验室术语
梅毒血清学检测是在20世纪初开发的,并被医务人员用于诊断梅毒。第一项测试称为Wassermann测试,是一种补体结合测试,使用肝脏提取物,最初来自胎儿,随后来自梅毒患者的心脏组织(24)。在公布了一种从牛心脏中分离心磷脂和卵磷脂(磷酰胆碱)并将它们与胆固醇结合作为这些测试的抗原的方法后,实验室进一步标准化了该测定以提高可重复性(25)。随后的测试涉及固定苍白梅毒螺旋体、凝集或絮凝,其原理与检测对苍白梅毒螺旋体反应的血清(苍白梅毒螺旋体固定[TPI]测试)或苍白梅毒螺旋体膜中发现的抗原(心磷脂[二磷脂酰甘油]、磷酰胆碱和胆固醇)的相同原理用于快速血浆反应素(RPR)和性病研究实验室(VDRL)测试。1954年,世界卫生组织召集了密螺旋体病专家委员会,并就抗原制备、检测标准化和术语提出了建议(26)。该术语基于对同时期科学发现的理解,并成为描述今天仍在使用的梅毒血清学检测概念的基础(27)。随着时间推移,应重新审视和更新术语“非密螺旋体试验”、“密螺旋体试验”和“非特异性抗体”的使用,以符合与梅毒螺旋体免疫生物学相关的科学证据。
免疫生物学
苍白梅毒螺旋体是专性微需氧螺旋体细菌,具有弯曲的扁波形态,长度为5至20μm,直径为0.1至0.4μm(28)。原生质被细胞壁包围,细胞壁由细胞质膜、薄肽聚糖层和简单的脂质双层外膜组成(29,30)。细菌结构与其他革兰氏阴性菌相似(例如,周质空间将细胞质和外膜分开)。然而,与大多数其他革兰氏阴性菌相比,苍白梅毒螺旋体的外膜极其脆弱,缺乏脂多糖外层,肽聚糖层位于细胞质膜上方而不是外膜下方,并且跨越膜的蛋白质密度大约低100倍(2,31–36)。该生物体表现出类似开瓶器的运动,绕其纵轴旋转,纵轴由位于周质空间的内鞭毛提供并包裹在细胞体周围(37–39)。相对较少的整合膜蛋白、暴露的脂蛋白和磷脂可能构成细菌表面,并导致其相对缺乏表面抗原性(30,40)。
在通过粘膜或皮肤中的微擦伤进入后,梅毒螺旋体在局部复制,并通过心血管和淋巴系统迅速扩散到全身,包括中枢神经系统(41)。 梅毒螺旋体细胞表面缺乏与病原体相关的分子模式,导致先天免疫系统在初次感染和随后的传播期间无法清除病原体(42)。先天免疫系统的激活可能被外膜中发现的密螺旋体磷脂下调(43)。然而,树突状细胞在感染早期吞噬梅毒螺旋体,并且大多数迁移到引流淋巴结,在那里它们将加工过的密螺旋体抗原(主要是蛋白抗原)呈递给B细胞和T细胞以启动适应性免疫应答(44)。
在梅毒螺旋体感染期间,吞噬细胞加工和呈递的抗原要么是生物体独有的,要么是生物体、宿主细胞或两者共有的。心磷脂是一种二磷脂酰甘油,是正常线粒体功能所需的整合线粒体细胞膜磷脂(45)。B1细胞是B细胞的一个亚群,在既往感染未激活的情况下分泌低至中等亲和力的抗体(46)。B1分泌的抗体被称为天然抗体,它们可以与心磷脂和其他磷脂(例如胆固醇和磷脂酰胆碱)结合。然而,除了梅毒和自身免疫性疾病外,其他感染或病症也可能导致针对心磷脂的天然抗体短暂增加(47)。苍白梅毒螺旋体的细胞质膜含有心磷脂和其他磷脂,这些磷脂有助于感染期间的免疫刺激(48,49)。胆固醇和磷脂酰胆碱是宿主磷脂,也是苍白梅毒螺旋体细胞质膜中的组成大分子(48)。磷酰胆碱可作为保护性免疫靶标,如苍白梅毒螺旋体表面与该抗原结合的单克隆抗体的杀菌作用所证明的那样(50)。胆固醇和磷脂酰胆碱的抗体在 梅毒螺旋体感染的某些阶段升高(51),并通过RPR和VDRL检测检测到。
梅毒血清学实验室检测术语
非密螺旋体试验
对Wassermann和随后的凝集或絮凝试验中使用的脂质抗原发生反应的抗体要么是伴随梅毒螺旋体感染的迹象,要么是与宿主组织损伤和脂质抗原释放相关的其他疾病。1960年,文献中首次使用术语非密螺旋体试验来区分基于梅毒螺旋体特异性抗原的试验(TPI、梅毒螺旋体荧光抗体吸收[FTA-ABS]、梅毒螺旋体抗体抗体[MHA-TP]、梅毒螺旋体血凝试验[TPHA]和梅毒螺旋体颗粒凝集[TPPA]),来自基于抗原(即心磷脂、磷脂酰胆碱和胆固醇)的测试,这些抗原在健康动物组织和其他生物体中发现,除了梅毒螺旋体外,还用于VDRL和RPR测试。1979年首次描述了梅毒螺旋体的脂质组成,当时有报道称该生物体含有非密螺旋体试验中使用的所有磷脂(48)。对T.pallidum的基因组分析进一步揭示了这些细胞质和外膜磷脂所需的生物合成途径缺乏某些酶,表明宿主对磷脂的固有需求(52)。
在梅毒螺旋体感染期间,心磷脂、磷脂酰胆碱和胆固醇抗体的增加可能是细菌和宿主抗原联合的结果,而不仅仅是宿主组织损伤的结果。在兔子模型中,苍白梅毒螺旋体心磷脂在活动性感染期间诱导高抗体滴度(49)。用灭活的苍白梅毒螺旋体接种兔子导致较低的抗心磷脂滴度,表明在活动性感染期间观察到的反应增加可归因于苍白梅毒螺旋体释放的心磷脂和受损宿主细胞组合的免疫刺激(49)。由于非密螺旋体检测中使用的抗原存在于梅毒螺旋体膜和宿主膜中,因此将这些检测称为非密螺旋体是用词不当。2019年的一项研究表明,在526,540次反应性非密螺旋体检测中,有11%与梅毒无关,在这些情况下,这些检测检测的是其他疾病造成的宿主组织损伤产生的非密螺旋体抗原抗体(53)。然而,89%的反应性检测与梅毒有关,这意味着大多数非密螺旋体检测在感染期间检测到由梅毒螺旋体磷脂抗原触发的抗体。据称的非密螺旋体检测可以更准确地称为脂质抗原检测。在本报告的下文中,这些测试将被称为非密螺旋体(类脂质抗原)测试。
密螺旋体试验
1960年,梅毒螺旋体试验与非密螺旋体试验一起引入(54)。密螺旋体试验仍然是对检测对梅毒螺旋体特异性抗原的抗体反应的试验的准确描述。
非特异性抗体
梅毒文献中已使用术语“非特异性抗体”来表征对梅毒螺旋体非特异性抗体,但在非密螺旋体试验中检测到的抗体。所有抗体都与抗原上的特异性表位结合,并且对该抗原具有特异性。然而,抗体可能不具有特异性,无法检测需要检测的疾病或病症;因此,它们的存在会影响测试特异性。报告抗体特异性和对检测特异性的影响,而不是使用笼统的术语非特异性抗体会更准确。
梅毒诊断原则
梅毒检测的适应证包括确定暴露于梅毒螺旋体的个体、人群或社区危险因素;提示梅毒的体征和症状;或已知与梅毒患者发生性接触。实验室检查的选择和结果的解释因梅毒分期和既往治疗史而异。在诊断和分期后,苄星青霉素G是临床缓解感染和避免后遗症的推荐疗法[55]。有青霉素过敏史的患者应根据CDC的《2021年性传播感染治疗指南》(55)进行管理。
梅毒的检测基于反应性抗体(通常在血清或脑脊液[CSF]中)的检测,提示暴露于梅毒螺旋体;通过暗场或荧光显微镜检查病变液体或渗出液直接观察病原体;或感染组织的组织学评估或液体、渗出液或组织活检材料中梅毒螺旋体特异性核酸序列的扩增。用于检查革兰氏染色涂片的常规显微镜不足以观察梅毒螺旋体,因为该细菌的细长形态和苯胺染料的吸收不良(51)。目前尚无可用的核酸扩增检测(NAAT)已获FDA批准在美国上市,梅毒螺旋体的培养很麻烦,仅在选定的研究实验室中可用。非密螺旋体(类脂质抗原)检测最适合与病史和体格检查相结合进行筛查或诊断,因为抗体滴度对于确定近期感染暴露、对有提示梅毒的体征或症状的患者的推定诊断或确定对治疗的反应很重要。
密螺旋体检测靶向特异性梅毒螺旋体抗原,包括完整或超声处理的梅毒螺旋体或确定的重组蛋白;这些检测传统上用于确认反应性非密螺旋体(脂质抗原)检测是梅毒螺旋体感染的结果(51)。密螺旋体抗体通常在治疗后持续存在,不能用于区分当前感染或既往治疗过的感染。非密螺旋体(脂质抗原)或密螺旋体检测均不能区分由其他梅毒螺旋体亚种引起的感染。通过皮肤穿刺采集标本的多种毛细血管全血免疫测定已被开发为快速检测,并可能在临床、公共卫生或非临床环境中提供诊断效用。梅毒螺旋体的直接检测仅限于病变液的暗场显微镜检查、病变液或渗出液涂片的染色或通过活检获得的密螺旋体螺旋体的组织切片,或通过经过验证的实验室开发的测试扩增特定核酸序列。
美国梅毒检测建议
非密螺旋体(类脂质抗原)检测
非密螺旋体(类脂质抗原)检测通常被用作梅毒筛查试验,当患者有提示梅毒的体征或症状或已知有性接触时,在评估可能的再感染时,在监测治疗结果时,作为诊断试验(图1)。RPR和VDRL检测仍然是美国公共卫生实验室使用的主要筛查方法(56);其他经FDA批准的非密螺旋体(类脂质抗原)检测(例如,甲苯胺红未加热血清试验[TRUST]和未加热血清反应素试验[USR])也可用,但在美国不太常用。无论采用哪种检测方法,RPR、VDRL和其他非密螺旋体(脂质抗原)检测的血清抗体滴度都不应互换用于管理患者,因为它们是不同的检测方法,并且主观滴度结果可能因实验室而异。因此,应使用相同的非密螺旋体(脂质抗原)检测方法和标本类型对患者标本进行检测。
手动非密螺旋体(脂质抗原)检测是絮凝试验,可检测作为沉淀物从溶液中脱落的抗体-抗原复合物。已经开发了显微镜或宏观程序来检测抗体与心磷脂、胆固醇和磷脂酰胆碱组合特异性结合后形成的沉淀物,这些组合在非密螺旋体(脂质抗原)测试中用作抗原。VDRL测试在100倍放大倍率下显微镜下读取(51)。RPR测试使用木炭来帮助检测絮凝剂,并且由于抗原抗体晶格捕获了木炭颗粒,因此可以从宏观上读取结果。TRUST测试使用甲苯胺红染料代替木炭。
非密螺旋体(类脂质抗原)检测通常手动进行;但是,某些RPR测试已实现自动化以提高吞吐量。自动化系统以数字方式分析抗体抗原絮凝的密度和大小,并存储结果以备将来检索(57–59)。任何非密螺旋体(类脂质抗原)检测的结果都应报告为终点滴度,而不是大于或小于值,以便进行最佳临床解释。某些自动RPR检测的血清稀释范围有限(例如,1:40–1:64),可能无法产生超出此范围的终点滴度。在这些情况下,必须考虑自动检测的滴度范围,并且样本应要求使用手动RPR程序进行反射测试,以在报告之前在下限或上限处确定终点滴度。
无论是自动还是手动,性能取决于多种因素,包括标本类型和质量、梅毒分期、自身免疫性或其他疾病的存在,以及是否存在感染或与 梅毒螺旋体以外的其他微生物合并感染。对于早期一期梅毒,非密螺旋体(脂质抗原)检测的敏感性可能低于密螺旋体检测,并且无论治疗如何,都倾向于随着时间的推移而减弱。在检测前,应仔细考虑检测和标本类型,因为血清和血浆不能总是互换使用,并且某些非密螺旋体(脂质抗原)检测需要对标本进行热处理。
手动检测结果解释的主观性以及实验室和技术人员之间的差异性对临床医生提出了挑战,他们将滴度与梅毒分期进行比较以进行治疗,尤其是在评估可能的再感染或监测治疗结果时。非密螺旋体(类脂质抗原)检测的一个警告是,由于近期疾病(例如感染、疫苗接种或注射吸毒,或潜在的自身免疫性或其他慢性疾病),反应性结果可能是假阳性。尽管如此,当由经验丰富的实验室技术人员进行并与梅毒螺旋体检测、临床病史、体格检查和接触史结合使用时,非密螺旋体(脂质抗原)检测是一种高度可靠的检测方法,用于筛选和确定终点滴度,以便治疗后进行后续血清学监测。
治疗后的血清学反应
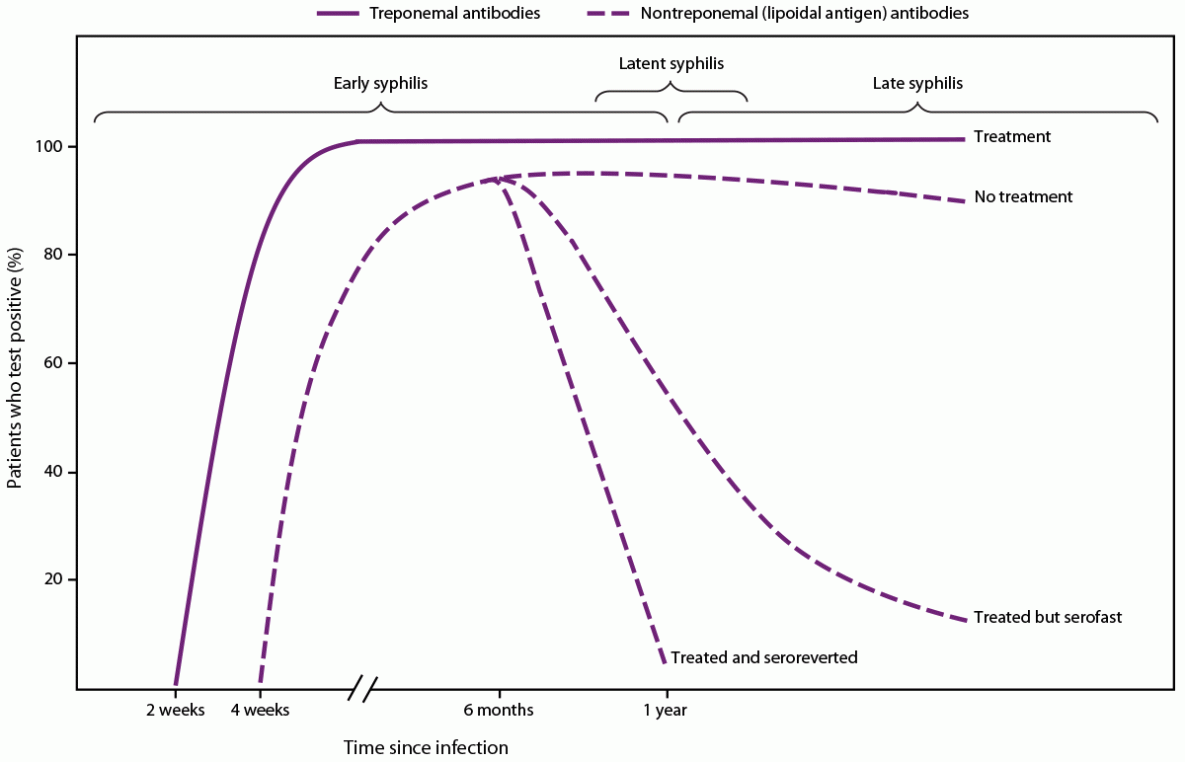
在梅毒治疗后的12个月内,非密螺旋体抗体滴度通常至少降低4倍(图1),特别是在感染早期接受治疗的患者中,并且随着时间的推移可能变得无反应,特别是在梅毒第二阶段之前接受治疗的患者中(60-62)。然而,在某些患者中,尽管进行了推荐的治疗,但非密螺旋体抗体滴度的下降幅度不到4倍。一项关于早期梅毒治疗的前瞻性随机、双盲、多中心研究(n=541)发现,14%的患者在治疗后12个月的血清学滴度下降不到4倍;患有一期或二期梅毒的HIV感染患者比未感染HIV的患者更有可能反应不足(60)。此外,滴度在治疗后可能不会恢复到无反应的结果,并保持持续的反应性,通常称为血清快速状态。这种状态最常见于梅毒后≥1年接受治疗的人或多次梅毒发作的人。滴度通常为≤1:8,但也观察到更高的滴度(63,64)。CDC的《2021年性传播感染治疗指南》(55)中提供了有关非密螺旋体滴度临床解释的其他建议。临床医生可以咨询性病临床咨询网络,以协助处理复杂的滴度解释病例(https://stdccn.org/render/Public)。
终点滴度建议。当使用非密螺旋体(脂质抗原)检测血清时,应确定终点滴度(产生反应性结果的最高稀释度),以检测脂质抗原抗体(即RPR和VDRL)。报告不应包含数学符号,例如>或<符号(框)。
评论和证据摘要。通过非密螺旋体(脂质抗原)检测测得的抗体滴度可能与感染状态相关,并且是唯一可用于监测治疗结果的检测(60,62)。使用相同的非密螺旋体(脂质抗原)检测的两个结果之间的滴度变化四倍被认为具有临床意义(55)。需要报告滴度以进行适当的临床管理。使用某些自动RPR测试测试的血清样本超出了测试的稀释范围,应使用手动RPR进行反射测试。
Prozone前体
在凝集或絮凝测定中检测抗原-抗体相互作用取决于抗原-抗体复合物的形成,这些抗原-抗体复合物在凝集试验中聚集细胞或称为絮凝体的小颗粒聚集体。抗原上的许多表位可以与抗原特异性的抗体结合。免疫球蛋白G(IgG)抗体有两个结合位点,免疫球蛋白M(IgM)抗体有10个结合位点,可分别结合多达10种相同的抗原。随着这些相互作用的继续,晶格结构可以发展并变得足够大以引起凝集或絮凝。凝集或絮凝的水平取决于抗原和特异性抗体的相对浓度。凝集和絮凝测定可标准化抗原浓度,以最大限度地在反应性试验中形成晶格。如果每个抗体分子与单个(而不是两个)抗原表位结合,则血清中过量的抗体或检测中的抗原会干扰晶格的形成(图2)。在这种情况下,交联不会发生,也不会形成晶格,尤其是在未稀释的血清样本中。这种假阴性现象被称为前区或钩效应,因为它发生在抗体和抗原浓度足以凝集或絮凝的等效区之前。如果在检测前稀释血清样本,则可以避免前腔。非密螺旋体(脂质抗原)可归因于前体的假阴性结果已有报道,但基于凝集的密螺旋体试验则未见(51,65)。
在两项研究中,分别有4,328和46,856名样本被转诊进行梅毒检测的患者,由前腔引起的假阴性RPR检测很少见(<0.85%)(65,66)。在一项研究中,RPR试验中的前静脉素发生在梅毒的所有阶段,但在一期和二期梅毒中更常见(分别为4.7%和1.8%)(65)。稀释血清可以去除前体;然而,没有特定的稀释值可以确保消除Prozone的所有影响。在同一项研究中,在36个带有前区的血清样本中,有11个需要从1:8到1:16的连续稀释液才能去除前区;这36个样品中有22个需要1:32至1:128的稀释度,以获得用于凝集的最佳抗体和抗原浓度(65)。两个样本继续具有前区,直到它们被稀释到1:256,一个样品被稀释到1:512。由于前腔现象在梅毒筛查的一般人群中被认为是罕见的,因此不建议常规稀释所有非反应性、未稀释的非密螺旋体(脂质抗原)检测。然而,当临床医生要求时,实验室应使用稀释系列进行非密螺旋体(脂质抗原)检测来排除前腔。如果患者有提示梅毒的体征或症状,如果检测结果无反应、未稀释的非密螺旋体(脂质抗原),或者在未稀释血清检测中观察到异常颗粒感,临床医生应要求排除前区。
生物假阳性
对梅毒以外的疾病有反应的非密螺旋体(类脂质抗原)检测称为生物学假阳性(BFP)。抗体在非密螺旋体(脂质抗原)试验中具有反应性,但在确认性密螺旋体试验中无反应的抗体被定义为BFP反应器。卫生部门经常保留已知有BFP反应的人的记录;这些数据可以帮助临床医生将来评估这些人可能感染的梅毒。据估计,可归因于BFP的反应性非密螺旋体(类脂质抗原)检测发生在0.2%-0.8%的人群中,并且与梅毒以外的其他疾病有关(67-71)。BFP反应可归因于其他感染,包括疟疾、麻风病和HIV;近期接种的疫苗;自身免疫性疾病;和注射吸毒(51)。
密螺旋体试验
密螺旋体试验在临床上用于确认反应性非梅毒螺旋体(脂质抗原)检测的结果,并评估在非梅毒螺旋体(脂质抗原)检测可能尚未反应的早期原发感染中具有提示梅毒体征的患者。密螺旋体检测也可以自动化,用于血库和大型实验室的高通量筛查,以便使用反序算法进行常规筛查。在梅毒螺旋体试验中检测到的抗体通常在治疗后终生持续存在,除非在感染过程的早期进行治疗;大约15%–25%的一期梅毒治疗患者可在治疗后2–3年内恢复为无反应性梅毒螺旋体试验(FTA-ABS和MHA-TP)结果(61,62)。在这两项研究中,没有接受二期梅毒治疗或感染持续时间较长的患者血清恢复反应性梅毒螺旋体试验。梅毒螺旋体试验的血清复位也可发生于晚期HIV疾病和AIDS患者(72,73)。
尚无已发表的数据来检验梅毒治疗后酶免疫测定(EIA)或化学发光免疫测定(CIA)是否能恢复为非反应性密螺旋体试验。与非密螺旋体(类脂质抗原)试验不同,密螺旋体试验不能用于监测对治疗的反应,因为它们无限期地保持反应。对于有梅毒治疗史且梅毒螺旋体检测结果有反应的患者,额外的梅毒螺旋体检测对检测再感染没有帮助,因此不推荐。在这种情况下,必须使用非密螺旋体(类脂质抗原)检测滴度以及梅毒临床病史、体格检查和性风险评估(包括接触史)来确定感染状态。
手动密螺旋体测试包括FTA-ABS、TPPA、Captia梅毒IgG EIA、Trep-Sure EIA和Zeus Scientific EIA。在传统检测算法中,手动检测通常用作反射检测,以确认反应性非密螺旋体(脂质抗原)标本。FTA-ABS测试基于荧光显微镜,并使用荧光素异硫氰酸酯标记的抗人免疫球蛋白来检测与固定在载玻片上的整个 梅毒螺旋体的抗体结合。TPPA是一种间接凝集试验,其 梅毒螺旋体抗原与明胶颗粒结合。
在美国,手动TPHA和MHA-TP测试不再可用于体外诊断,但仍在某些国际环境中使用。TPHA和MHA-TP是与禽或绵羊红细胞结合的苍白梅毒螺旋体抗原的间接凝集。MHA-TP是TPHA的微孔板版本。
截至2021年12月31日,共有12种经FDA批准的自动密螺旋体免疫测定可用于临床,包括EIA、CIA和多重流(微珠)免疫测定(MFIA)。与手动检测相比,密螺旋体免疫检测通常作为反向序列筛选算法中的初始检测运行。所有FDA批准的密螺旋体检测都可以对血清进行;某些检查也可以对血浆进行,包括肝素、EDTA和柠檬酸盐血浆。某些实验室还验证了使用带干血斑(DBS)的密螺旋体试验;然而,FDA尚未批准针对这种标本类型的可用测试,也没有公布在美国收集的DBS标本的数据以帮助诊断梅毒。
读数输出通常是一个指数值,使用样品和校准器控制之间的值计算为信号截止比(S/CO)或荧光比。模棱两可的结果应根据包装说明书中的算法重新测试。可以存储原始读数输出和索引值以备将来检索。免疫测定的S/CO强度是测定中分子之间相对结合的估计值,已被研究为丙型肝炎和HIV确认试验中阳性的预测因子(74–78)。当应用于密螺旋体免疫测定时,多项研究报告称,独立梅毒螺旋体试验或非密螺旋体(脂质抗原)和密螺旋体试验联合使用,指数值强度的增加与反应结果之间存在很强的相关性,大多数研究表明S/CO临界值与TPPA阳性之间存在91%-100%的相关性(79–84)。需要更多的研究来建立特定于测试的临界值,这些临界值对于每种FDA批准的免疫测定来说都可能是真阳性。S/CO临界值可以消除使用第二次TPPA来判断密螺旋体免疫测定和非密螺旋体(脂质抗原)检测之间结果差异的需要。
对于不一致的非密螺旋体(类脂质抗原)和密螺旋体检测结果,建议使用不同类型的密螺旋体检测试验和靶标(例如TPPA)进行额外的密螺旋体检测。在获得有关S/CO临界值在筛查算法中的作用的进一步数据之前,临界值可以作为评估复杂情况下感染可能性的额外数据点(例如,在梅毒风险低的孕妇中)。有这些类型病例的临床医生应联系性病临床咨询网络寻求帮助(https://stdccn.org/render/Public)。
血库筛查
献血时需要检测21CFR610.40(a)(2)中概述的梅毒螺旋体抗体。捐献血液被发现具有血清学反应性的人将被推迟(21CFR610.41[a])并通知(21CFR630.40)。有关FDA关于对献血者进行梅毒筛查的最新建议,请访问:https://www.fda.gov/media/85283/download。筛查献血感染因子的检测清单可在以下网址获得:https://www.fda.gov/vaccines-blood-biologics/complete-list-donor-screening-assays-infectious-agents-and-hiv-diagnostic-assays.
梅毒筛查的传统算法和逆算法
传统的梅毒血清学筛查算法从非密螺旋体(脂质抗原)检测开始,任何反应性标本都通过密螺旋体检测进行确认(图3)。该序列已被广泛使用数十年,因为非密螺旋体(脂质抗原)检测相对便宜,而密螺旋体检测是手动的、劳动密集型的、成本更高且数量有限的。然而,最初被FDA批准用于血库筛查的自动密螺旋体免疫测定现在被FDA批准用于临床筛查,从而产生了相反的序列算法。对结果呈阳性的样本进行自动密螺旋体检测进行初步筛查,然后必须进行定量非密螺旋体(脂质抗原)检测。当使用反向序列算法时,任何不一致的结果都应由具有不同格式且包含不同抗原的第二种密螺旋体测定(例如TPPA)来判断(85)。
在参与2015年美国病理学家学会(CAP)梅毒血清学能力测试计划的2,360个实验室中评估了执行传统、反向或两种算法的临床实验室数量(86)。在做出回应的1,911个实验室中,81.1%(n=1,550)仅提供一种算法,9.5%(n=181)根据患者人口统计学或临床医生偏好提供不同的算法,9.4%(n=180)报告不确定是否提供单一算法。大约三分之二的实验室(63.1%;n=1,205)报告使用传统算法,15.9%(n=304)报告使用反序算法,2.5%(n=47)报告使用两种算法,5.9%报告他们不知道,3.9%报告“其他”。在回应的实验室中,8.8%(n=169)表示他们没有反射性地进行确认测试。APHL2017年的一项调查报告称,73个公共卫生实验室中有58个(79.5%)使用传统算法,20.5%使用反向算法(https://www.aphl.org/aboutAPHL/publications/Documents/ID-2020Jan-2017-STD-Testing-Survey-Report.pdf)。应更新CAP和APHL调查,以跟踪临床实验室实践随时间的变化。
对来自梅毒低患病率人群的1,000例患者样本进行前瞻性比较,发现15例(1.5%)对从BioPlexIgG开始的反向序列算法有反应,4例(0.4%)对传统算法有反应,RPR作为第一个测试(87)。RPR反应的4个样品经TPPA确认为阳性。反序算法的假阳性EIA率(例如,EIA反应性、RPR非反应性和TPPA非反应性)高于传统算法(0.6% vs 0%)。CDC报告说,在2006-2010年期间,使用反向序列算法时,密螺旋体免疫测定的假阳性率相似(0.6%;140,176中的866)(85)。
关于传统与反序序列算法的成本效益,数据存在冲突。在梅毒患病率低(约0.5%)的地区,传统算法可能更具成本效益(预防的每次不良事件成本更低),而在高患病率地区(约10%),则可节省成本(88,89)。这些数据与一项研究不一致,该研究报告称,当应用于筛查梅毒患病率分别为0.076%和1.94%的低患病率产前和非产前人群时,反向序列算法具有成本效益(90)。在加利福尼亚州洛杉矶县当地性传播疾病(STD)项目的经济影响模型中,如果梅毒螺旋体测试的成本比非密螺旋体(类脂质抗原)测试的成本低1.67美元,则逆向算法更便宜,并且确定了更多的患者进行治疗5.80美元(91)。分析中包括了检测、治疗和随访费用。应用2015年CMS实验室费用表中的2015年测试成本,其中密螺旋体测试成本是非密螺旋体(类脂质抗原)测试的三倍,反向序列算法比传统算法更昂贵。当使用反向序列算法和2015年CMS测试成本时,每检测到一例额外的梅毒病例将花费约1,242.17美元。这些数据强调,在选择梅毒筛查的最佳算法时,需要考虑当地成本,包括检测、治疗和随访成本。
每种算法都有优点和缺点,两者都是可以接受的(表1)。传统算法在检测早期或晚期潜伏梅毒方面可能不太敏感,尽管在低患病率人群中应用反向算法时可能会出现假阳性增加(22)。与非密螺旋体(脂质抗原)和密螺旋体检测反应的抗体的产生可能需要长达2周的时间才能在梅毒螺旋体原发性感染后(92,93)(图1)。在大批量实验室中,自动密螺旋体免疫测定的主要优点是提高了通量并降低了劳动力成本。测试和算法选择的考虑因素包括成本、人工、样品测试请求量、通量、实验室空间和周转时间。此外,临床医生以及州和地方公共卫生性病项目需要非密螺旋体(脂质抗原)检测结果以及密螺旋体检测结果,以便及时进行临床管理和公共卫生报告。如果算法中的一个检测结果延迟,需要与临床医生或STD程序的初始检测相结合,则可能会出现匹配错误,并且临床管理和报告可能会延迟。处理初始筛查测试的实验室应确保在将报告发送给订购临床医生和公共卫生部门时,第二次或第三次(如有必要)测试结果(尤其是在不同的实验室进行时)与筛查测试结果相关联。
梅毒血清学检测算法的建议。当主要检测反应性时,应联合使用血清学检测,以检测与梅毒感染相关的非密螺旋体(类脂质)和密螺旋体抗原的抗体,以帮助诊断梅毒(框)(图3)。仅仅依赖一种反应性血清学检测结果可能会错误地分类患者的梅毒状态。传统的梅毒筛查算法(使用非密螺旋体[脂质抗原]检测进行初始筛查)和反向梅毒筛查算法(使用密螺旋体免疫检测进行初始筛查)都是可以接受的。首选算法应基于实验室资源,包括人员、空间和成本、检测量和所服务的患者群体。
评论和证据摘要。通过非梅毒螺旋体(类脂质)和密螺旋体抗原检测检测到的抗体因梅毒分期、治疗状态和既往接受过治疗的感染而异(92)。需要两种血清学检测的结果来帮助诊断梅毒的分期。传统梅毒检测算法和反向梅毒检测算法均在美国使用(86),两种方法之间的一致性约为99%(85,87)。这两种算法的成本效益可能因实验室环境而异(88–91),需要由各个实验室考虑。
血清学和脑脊液抗体标本采集和储存
血清、血浆和脑脊液是用于检测梅毒检测梅毒的标本类型,用于检测针对梅毒螺旋体的抗体。本节提供一般指导,因为这些信息是从各种来源总结的,包括产品说明书和标准实验室实践手册(51,94)。应检查产品插件的最佳试样类型、运输和储存,因为它们因测试而异。如果要进行额外的检测,医务人员应联系实验室,以获取有关样本采集量的更多信息。
血清采集设备和储存
血清是用于梅毒血清学检测的最常见标本。全血由训练有素的抽血医生使用不含抗凝剂、凝剂或血清分离剂成分的真空管采集。梅毒血清学检测尚未广泛评估使用带有血清分离器或凝血剂的真空管,应避免使用,除非在检测的产品说明书中说明为可接受的收集装置。收集的全血量应约为测试所需血清量的2.5倍。大约1mL血清足以进行非密螺旋体(脂质抗原)和密螺旋体梅毒血清学检测,如果需要,还可以保留额外的血清用于重复检测。如果需要进行梅毒以外的疾病检测,应考虑采集更多的血清。收集全血后,应将试管在室温下保持约15-30分钟,以形成凝块。真空管或其他含有全血的试管不应冷藏,因为较低的温度会增加凝血时间。如果凝块已经回缩或在1,000–2,000xg离心10分钟后,可以抽吸血清。血清应转移到干净的聚丙烯管中运输或储存。血清应储存在2℃–8℃(35.6℉–46.4℉)下,并在5天内进行测试,或在≤-20℃(-4℉)下冷冻以延长储存时间。血清不应储存在无霜冰箱中,因为这些设备中的冻融循环不利于冷冻血清样品的稳定性。但是,建议的储存条件因测试而异,应查看产品说明书以获取最新信息。样品应无溶血(https://www.cdc.gov/ncezid/dvbd/specimensub/hemolysis-palette.html)、黄疸、细菌污染和脂肪血症。血清应分装储存,以避免反复冻融循环,因为冻融循环可能导致蛋白质降解和变性导致抗体反应性降低。
血浆采集设备和储存
血浆可用于某些定性和定量梅毒血清学测定。全血由训练有素的抽血师使用带有抗凝剂的真空管采集,包括EDTA处理、柠檬酸盐处理或肝素化管。采集的血容量应约为所需血浆体积的2.5倍。大约1mL的血浆足以处理非密螺旋体(脂质抗原)和密螺旋体梅毒检测,如果需要,还可以保留额外的血浆用于重复检测。通过以1,000-2,000xg离心10分钟从血浆中取出细胞。应立即将上清血浆转移到干净的聚丙烯管中,并在收集后1-5天进行测试,具体取决于测试。血浆成功储存的时间通常比血清短,尽管储存条件因测试而异,某些测试允许在冷冻时长期储存血浆。应查看产品说明书以获取最新信息。样品应无溶血(https://www.cdc.gov/ncezid/dvbd/specimensub/hemolysis-palette.html)、黄疸、细菌污染和脂肪血症。血浆应分装储存,以避免反复冻融循环,因为蛋白质降解和变性可能导致测试导致抗体反应性降低。
脑脊液采集设备和储存
只有有资格进行腰椎穿刺的医务人员才能采集脑脊液。大约1mL脑脊液放入干净的聚丙烯管中,足以进行梅毒血清学检测,剩余的脑脊液可用于需要时进行重复检测。其他检查(例如蛋白质、细胞计数、革兰染色或培养)可能需要更大体积的脑脊液。如果测试延迟超过4小时,请将CSF样本在2℃–8℃(35.6℉–46.4℉)下储存≤5天。5天后,脑脊液应在≤-20℃(-4℉)下冷冻储存。采集脑脊液标本时,应避免血液污染,因为存在血清来源的抗体而不是脑脊液产生的抗体,可能导致假阳性结果。
血清学和脑脊液抗体检测性能
一期梅毒血清学检测的敏感性
当直接检测梅毒螺旋体(脂质抗原)检测作为比较试验时,最好评估一期梅毒期间非密螺旋体(脂质抗原)检测的敏感性,以确保梅毒的正确分期用于分析。与病灶渗出液的暗视野显微镜相比,RPR的敏感性范围为48.7%-76.1%(95-101);然而,一项研究报告的敏感性为92.7%(n=109名患者)(102)(补充表1,https://stacks.cdc.gov/view/cdc/138288)。VDRL具有相似的灵敏度范围(50.0%-78.4%)(95-99,102-107)。一项头对头比较研究对76例经暗视野显微镜证实的一期梅毒患者的RPR和VDRL非密螺旋体(脂质抗原)检测结果显示,对RPR和VDRL的敏感性分别为48.7%和50.0%(101)。根据临床检查结果和NAAT阳性,使用NAAT从病变拭子和分期一期梅毒中检测梅毒螺旋体核酸的研究报告称,非密螺旋体(脂质抗原)检测敏感性范围为80%-95%(108-112)。在提示一期梅毒的病变中使用NAAT作为参考标准而不是暗视野显微镜的研究表明,非密螺旋体(脂质抗原)检测可能比以前认为的更敏感。
手动梅毒螺旋体检测对一期梅毒的敏感性是根据使用参考标准的研究估计的,例如暗视野显微镜(95,102,113-115),临床发现(116-118)或从一期梅毒患者收集的储存血清,尽管用于分期的标准尚未完全描述(119-123)(补充表2,https://stacks.cdc.gov/view/cdc/138288)。在以暗场显微镜为参考标准的研究中,MHA-TP的灵敏度分别为53.0%、72.5%和88.6%(102,113,118)。在使用从临床分类为一期梅毒的患者中收集的储存血清的研究中,MHA-TP的敏感性分别为45.9%、64%和88.6%(114,118,123)。2019年的一项研究涉及959名患者,其中55名被归类为一期梅毒(基于血清学、体格检查结果和阳性或阴性暗场显微镜检查),报告对FTA-ABS和TPPA的敏感性分别为78.2%(95%CI=65.0%-88.2%)和94.5%(95%CI=84.9%-98.9%)(115)。其他患者较少、参考标准不同或两者兼而有之的研究更难比较;FTA-ABS和TPPA对一期梅毒的敏感性分别为88.4%-100%和86.2%-100%(102,113,114,117,118,122-127)。
在自动密螺旋体免疫测定中,很少有已发表的关于按阶段分层的测试性能的数据。一项研究发现,与TPPA和FTA-ABS相比,ADVIACentaur、Bioplex2200梅毒IgG、DiasorinLiaison和Trep-Sure在一期梅毒中的敏感性相似(115);然而,另一项针对52名患者的研究发现,Trep-Sure在一期梅毒中的敏感性较差(53.8%;95%CI=39.5%–67.8%)(121)。
非梅毒螺旋体(类脂质抗原)和密螺旋体检测可能对某些一期梅毒患者无反应,尤其是那些最近出现病变的患者。使用暗场显微镜作为唯一的比较器会使结果偏向于较低的敏感性,因为早期病变患者更有可能通过暗场显微镜检查获得阳性检测结果,并且血清学阴性。由于免疫清除,持续时间较长的病变可能在暗视野显微镜下变为阴性,但这些人更有可能是血清阳性。NAAT在早期和老年病变中都可能呈阳性,因为该测试方法不依赖于运动生物体的可视化。需要使用暗视野显微镜和NAAT作为参考标准对生殖器、肛门和口腔病变进行更多研究,包括评估病变年龄的研究,以更好地完善非梅毒螺旋体(类脂质抗原)和梅毒螺旋体检测对一期梅毒的敏感性估计。
二期梅毒血清学检测的敏感性
在根据临床诊断对二期梅毒进行分类的研究中,包括皮疹、皮肤黏膜病变或斑片状脱发、粘液斑块或扁平湿疣;在暗视野显微镜下通过可视化螺旋体进行临床诊断;或反应性非密螺旋体(脂质抗原)和密螺旋体血清学的临床诊断,RPR和VDRL的敏感性均为100%(96-99、101、103、105、128-131)(补充表1,https://stacks.cdc.gov/view/cdc/138288)。只有两项研究报告RPR敏感性为<100%(91%和97.2%)(99,101)。
密螺旋体检测MHA-TP对二期梅毒的敏感性范围为96%至100%,但一项研究报告的敏感性为90%(113,114,118,123)(补充表2,https://stacks.cdc.gov/view/cdc/138288)。FTA-ABS的估计敏感性为>92%,8项研究中有6项报告为100%(113-115,117,123-125,127)。在发现敏感性为<100%(115,124)的两项研究中,FTA-ABS敏感性分别为92.8%(95%CI=85.7%-97.0%)和95.0%(95%CI=76.4%-99.1%)。TPPA在五项研究(115,116,124,126,132)中敏感性为100%。在自动密螺旋体免疫测定中,很少有关于按阶段分层的测试性能的已发表数据;然而,在一项针对98名患者的研究中,五种密螺旋体免疫测定(Liaison、TrepSure、Bioplex2200、ADVIACentaur和INNO-LIA)对二期梅毒的敏感性估计为100%(115)。
非梅毒螺旋体(类脂质抗原)和密螺旋体检测的敏感性均接近100%,因为在梅毒第二阶段抗体滴度较高。在非密螺旋体(脂质抗原)检测中无反应的疑似二期梅毒患者的标本中,可能需要排除前腔。由于实验室医生在提交血清学标本时通常不知道患者的梅毒分期,因此临床医生应特别要求在有临床指征时(例如,在有梅毒体征和症状且无反应性非密螺旋体[lipoidalantigen]检测结果的患者中)评估前腔。
潜伏梅毒血清学检测的敏感性
关于梅毒早期潜伏期和晚期潜伏期非密螺旋体(类脂质抗原)检测性能的数据有限,关于参考标准、既往治疗状态、梅毒患者群体风险和特定潜伏期的信息有限(128-131,133-135)。此外,一些国际研究对早期和晚期梅毒的定义与美国不同。
美国尚未进行涉及潜伏梅毒RPR检测性能的研究。大约10年前进行的两项国际研究没有按潜伏期持续时间(即早期潜伏期为<1年与晚期潜伏期>1年)进行分层,因此难以估计敏感性(128,134)。三项关于VDRL在潜伏梅毒病例中表现的国际研究报告称,<1年早期潜伏梅毒的敏感性为82.1%至100%,>1年或病程未知的晚期潜伏梅毒的敏感性为63%至66%;然而,这些研究受到小样本量(n≤72)的限制,使得结果难以解释(129,131,133)(补充表1,https://stacks.cdc.gov/view/cdc/138288)。
手动梅毒螺旋体检测(FTA-ABS、TPPA和MHA-TP)诊断早期潜伏梅毒的敏感性为94.4%-100%;据报道,晚期潜伏梅毒的发病范围比早期潜伏梅毒(84.5%-100%)更广(113,115,116,118,120,124)(补充表2,https://stacks.cdc.gov/view/cdc/138288)。在密螺旋体免疫测定中,早期潜伏梅毒的敏感性为95%至100%,晚期潜伏梅毒的敏感性为91.7%至100%(115,119,120,136)(补充表2,https://stacks.cdc.gov/view/cdc/138288)。尽管密螺旋体检测对早期潜伏期和晚期潜伏期梅毒的敏感性通常较高,但这些研究中确定的敏感性范围表明,需要对感染持续时间更好的更大样本进行更多研究。延迟的持续时间通常难以确定;某些晚期潜伏期患者可能潜伏期未知,而其他晚期潜伏期患者可能最近感染了梅毒。这种对感染持续时间的错误分类可能会错误地提高晚期潜伏梅毒患者的梅毒检测性能敏感性。
在潜伏性较长的梅毒期间,非密螺旋体(类脂质抗原)检测的敏感性降低,因为这些检测滴度检测到的抗体会随着时间的推移而降低。通常,密螺旋体试验在潜伏梅毒期间仍然有效。
三期梅毒血清学检测的敏感性
由于三期梅毒在后抗生素时代很少见,因此已发表的关于诊断三期梅毒(例如胶质疾病、晚期神经梅毒和心血管梅毒)的血清学检测性能的数据非常有限;不太可能进行进一步的研究。一项研究估计,在17例三期梅毒患者中,FTA-ABS和VDRL的敏感性分别为70.6%和47%(133例),但未说明诊断阶段的标准。有几项研究检查了密螺旋体检测(LiaisonCIA、CaptiaEIA和FTA-ABS)检测心血管梅毒的敏感性。所有研究估计敏感性为100%;然而,样本量非常小(n=1-21例)(119,120,123,137,138)。最大的心血管梅毒研究包括21名患者,发现MHA-TP和FTA-ABS的敏感性分别为89.5%和100%(114)。在三期梅毒期间,非密螺旋体(类脂质抗原)检测的敏感性从47%到64%不等(21),而密螺旋体检测仍然具有反应性。
血清学检测的特异性
特异性分析的参考标准差异很大,包括看似健康的志愿者、产前患者、未感染HIV的梅毒阴性献血者以及临床特征为非梅毒的患者(来自血清库或基于先前的检测结果或图表审查)。某些关于密螺旋体试验特异性的研究也使用不同密螺旋体试验的结果或一组密螺旋体试验的共识作为参考标准。
很少有头对头研究比较了RPR与VDRL特异性对特征明确的标本的特异性。一项针对500份产前血清样本的研究发现,VDRL和RPR之间的特异性差异不大(分别为2例和1例假阳性)(139)。另一项针对200名献血者的研究发现,VDRL的特异性略低于RPR(98.5%,RPR为金标准)(140)。
对于手动梅毒螺旋体检测,一项研究发现FTA-ABS的特异性为87%(n=128名患者)(141例),而FTA-ABS和TPPA的特异性范围(分别为95%-100%和94%-100%)在较早的研究中相似(102,113-115,117,118,122-127)。FTA-ABS测试的特异性可能受到实验室专业知识和质量控制措施的限制。由于这些原因,并且基于最近高质量的头对头研究,该研究显示了卓越的TPPA检测性能特征,手动血清学TPPA检测优于血清学FTA-ABS检测。然而, CSF FTA-ABS 仍然有助于排除神经梅毒诊断,因为在具有超说明书使用该测试经验的实验室中进行时,其预测值为阴性。免疫测定显示出特异性范围为94.5%至100%(119-121,137,142-149);然而,Trep-Sure的特异性为82.6%(95%CI=78.4%–86.1%),显著低于在一项针对959名患者的单项头对头研究中评估的其他免疫测定(115)。
血清学梅毒检测的建议。非密螺旋体(脂质抗原)检测(例如RPR或VDRL)在用于测定抗体滴度时不可互换;对后续样品的测试必须使用相同类型的测试(框)。TPPA试验是首选的手动密螺旋体试验。
评论和证据摘要。在头对头研究和使用相似参考标准(95-99,101-104,106-108,111,112,139)的研究中,RPR和VDRL的敏感性和特异性估计相似,但不准确)。当使用非密螺旋体(脂质抗原)检测评估抗体滴度的变化时,使用相同的检测至关重要,因为临床医生使用滴度对患者的感染状态进行分类并跟踪治疗反应(55)。最近一项针对959名患者的研究估计,在检测一期梅毒患者的标本时,FTA-ABS和TPPA的敏感性分别为78.2%和94.5%(115)。两项检测二期梅毒患者标本的研究报告的敏感性为92.8%-95.0%,而TPPA的敏感性为100%(115,124)。许多自动密螺旋体免疫测定在灵敏度上相似,与手动TPPA相比,某些免疫检测的特异性略低,但Trep-Sure检测的特异性较差。在其他免疫测定中,数据不足以根据检测性能推荐一种检测方法。
神经梅毒的脑脊液抗体检测
与神经梅毒诊断相关的挑战包括:对于无神经系统症状或体征但有梅毒血清学证据的患者,脑脊液异常结果的临床意义缺乏共识,以及在评估实验室检查以帮助诊断神经梅毒的研究中,无症状和有症状患者之间的鉴别较差。此外,包括CSF VDRL 、CSF蛋白升高和细胞增多、CSFNAAT、 CSF FTA-ABS 或其他CSF密螺旋体和非密螺旋体(脂质抗原)检测在内的参考标准品差异很大,限制了神经梅毒研究中脑脊液抗体检测性能的直接比较。最后,脑脊液VDRL是唯一经FDA批准的推荐用于帮助诊断神经梅毒的检测。尽管没有梅毒螺旋体检测获得FDA批准用于帮助诊断神经梅毒,但 CSF FTA-ABS 因其阴性预测值(例如,在具有非特异性神经系统体征或症状、反应性血清学检查和CSF VDRL 阴性的患者中,即使存在CSF淋巴细胞增多和CSF蛋白升高), CSF FTA-ABS 多年来一直在标签外使用。
由于无症状或有症状的中枢神经系统浸润可发生在原发性、继发性、潜伏性或三发性疾病患者中,因此血清检查可以确认梅毒的存在,但不能解决中枢神经系统浸润或受累的问题。需要进行脑脊液检查以确认中枢神经系统浸润,但仅推荐用于血清学检查反应性且提示神经梅毒的体征或症状的患者;在没有任何神经系统发现的患者中,脑脊液实验室异常的临床意义尚不清楚(55)。
神经梅毒的非密螺旋体(类脂质抗原)检测
手动非密螺旋体(脂质抗原)检测已被用于检测脑脊液作为神经梅毒病例的辅助治疗,但性能估计值可能因参考标准而异。在三项研究中,使用NAAT检测脑脊液、听力或视力丧失或神经系统体征和症状提示神经梅毒的脑脊液TPPA反应性,或脑脊液中存在至少10个白细胞和脑脊液TPPA阳性的参考标准,脑脊液VDRL的敏感性和特异性范围为66.7%-85.7%和78.2%-86.7%,分别在149-154例有神经梅毒症状的患者(150,151例)(补充表4,https://stacks.cdc.gov/view/cdc/138288)。在这些研究中,脑脊液RPR的敏感性和特异性分别为51.5%-81.8%和89.7%-90.2%(150,151)。脑脊液VDRL是唯一获得FDA批准的有助于诊断神经梅毒的检测方法。
另一项研究使用反应性 CSF FTS-ABS、>45mg/dL的CSF蛋白升高和≥10个细胞/mm的脑脊液细胞增多的参考标准3估计8名有症状神经梅毒患者的CSF VDRL 敏感性为87.5%(152)。该研究未报告按无症状和有症状神经梅毒分层的脑脊液VDRL特异性;然而,综合特异性为99%。在这项研究中,脑脊液RPR在有症状患者中的敏感性估计为100%。脑脊液RPR的综合特异性估计值为99.3%。没有关于对脑脊液样本进行自动非密螺旋体(脂质抗原)RPR检测的数据。需要更多的头对头研究,具有可比的高质量、商定的参考标准和特征明确的患者症状状态,以更好地了解脑脊液非密螺旋体(脂质抗原)检测性能。
神经梅毒的密螺旋体试验
由于缺乏明确的诊断标准,因此难以解释使用密螺旋体检测来支持神经梅毒诊断的研究。脑脊液密螺旋体试验敏感性的研究包括有症状和无症状的神经梅毒患者;参考标准品使用了各种实验室检查,包括CSF白细胞计数、蛋白质和CSF-VDRL(153)。试验特异性研究包括无梅毒患者以及有梅毒但无神经梅毒症状的患者。参考标准的差异限制了比较研究之间敏感性和特异性估计值的能力。FDA没有批准脑脊液密螺旋体抗体检测来帮助诊断神经梅毒。
在之前的系统评价中总结了13项描述 CSF FTA-ABS 测试性能的研究(154)。敏感性取决于参考标准品是否需要反应性脑脊液-VDRL才能满足病例定义(根治性神经梅毒)或其他标准的组合(推定性神经梅毒),包括反应性非密螺旋体(脂质抗原)或密螺旋体脑脊液、其他脑脊液指标(细胞增多或蛋白升高)、兔接种或临床体征和症状。
在根治性神经梅毒的研究中, CSF FTA-ABS 的敏感性为90.9%–100%(155–157)。在两项关于推定性神经梅毒的最大研究中(n=60和n=156), CSF FTA-ABS 表现出100%的敏感性(158,159)。
CSF FTA-ABS 特异性差异很大,具体取决于真阴性患者是无梅毒患者还是有梅毒但无症状神经梅毒的患者。6项研究纳入了无梅毒患者为真阴性, CSF FTA-ABS 特异性为100%。在11项研究中,包括梅毒患者但不包括有症状的神经梅毒患者,特异性范围为55%至100%(154),这可能是因为血清抗体被动扩散穿过发炎的血脑屏障。在梅毒患者中没有神经系统症状的患者中,这种广泛的特异性可能导致这些患者和具有非特异性神经系统症状的患者出现假阳性结果和过度治疗,在这些患者中不太可能诊断为神经梅毒。在非特异性神经系统体征或症状的病因最有可能由其他疾病引起的复杂病例中, CSF FTA-ABS 阴性结果在临床上有助于排除神经梅毒。
关于脑脊液TPPA在公共卫生和商业实验室中的应用数据有限,并且尚未发表关于脑脊液中自动密螺旋体免疫测定性能的研究。对于脑脊液TPPA,三项研究报告的敏感性为75.6%-95.0%;当反应性CSF-VDRL作为神经梅毒的参考标准时,最高敏感性范围为83.3%-95.0%(160–162)。当神经梅毒被定义为反应性脑脊液-VDRL或新的视力或听力损失时,脑脊液TPPA特异性从75.6%增加到93.9%,脑脊液TPPA滴度分别从≥1:160增加到≥1:640(补充表5,https://stacks.cdc.gov/view/cdc/138288)。基于这些有限的数据,在确定性或推定症状性神经梅毒患者的研究中,CSFTPPA可能具有与 CSF FTA-ABS 相似的敏感性表现(55)。然而,在推荐在独特的临床情况下将密螺旋体检测用于超说明书使用以帮助诊断神经梅毒之前,需要对脑脊液TPPA检测性能和滴度进行进一步研究。
眼部梅毒和耳梅毒的脑脊液抗体检测
眼部梅毒和耳梅毒的诊断很困难,在这些临床情况下,脑脊液非密螺旋体(脂质抗原)和密螺旋体检测性能的数据有限。现有研究主要是回顾性的,样本量小(<50)和使用脑脊液VDRL检测,与梅毒的临床表现和血清学证据相比,眼部梅毒(<50%)和耳糖毒(<10%)的敏感性较低(163-173)。CDC的2021年性传播感染治疗指南指出,对于没有神经系统症状且检查时没有眼部感染证据的患者,脑脊液分析(包括细胞计数、蛋白质测定和CSF-VDRL)可能有助于诊断疑似眼部梅毒;然而,对于有孤立性听觉症状和神经系统检查正常的疑似耳梅毒患者,不建议使用[55]。
目前尚无关于脑脊液密螺旋体检测在眼部梅毒中的性能的已发表数据,对耳梅毒患者脑脊液密螺旋体检测的研究有限,包括样本量不足和参考标准不合适。对于疑似眼部梅毒或耳梅毒且无提示神经梅毒的症状或体征的患者,不建议在超说明书内进行脑脊液密螺旋体检测。
先天性梅毒的血清学检测
母体抗体的被动转移可导致新生儿和婴儿梅毒螺旋体检测结果阳性,持续>1年(174)。目前不建议对新生儿血清进行密螺旋体检测(即TPPA、FTA-ABS或免疫测定),因为很难解释这些结果(55)。尽管研究发现Ig MFTA-ABS或ELISA与新生儿临床先天性梅毒表现或其他反应性血清学检查之间存在良好的相关性(175,176),但这些研究并未使用市售的IgM检测进行。不建议进行IgM检测来帮助诊断先天性梅毒。建议对妊娠期梅毒血清学阳性的母亲所生的新生儿进行定量非密螺旋体(脂质抗原)检测(例如RPR或VDRL)(55)。非密螺旋体(类脂质抗原)检测应在血清上进行,而不是脐带血,因为脐带血可能被母体血液污染并产生假阳性结果,而脐带内的沃顿氏果冻可产生假阴性结果(55)。应使用与分娩时母亲相同的非密螺旋体(脂质抗原)试验,以便比较滴度水平(55)。
孕妇血清学检测性能
1995年的一项研究评估了产科患者分娩后立即进行的RPR血清学检测,结果显示,当使用临床诊断和FTA-ABS、Captia梅毒G或两者作为参考标准时,敏感性和特异性分别为100%和97.6%(177)。与一般人群中生物假阳性的低发生率(<0.85%)类似(65),孕妇的假阳性率较低(0.6%);所有初始反应性非密螺旋体(脂质抗原)检测都应反射为确认性密螺旋体抗体检测(66)。
妊娠期密螺旋体检测性能数据有限。在一项纳入2,000名患者的研究中,使用两种检测之间的一致性作为参考标准(例如,FTA-ABS或TPHA)的手动密螺旋体检测特异性对两种检测都很高(分别为99.8%和99.95%);然而,对于孕妇,这项研究没有对照组(178)。对于手动密螺旋体免疫测定,一项关于Captia EIA的研究使用TPPA作为参考标准,纳入了9,896名孕妇和24,346名非孕妇,他们在筛查高患病率人群的机构进行了筛查,包括HIV感染者和男男性行为者(MSM)(179)。与非妊娠人群相比,孕妇的免疫测定结果不一致(例如,EIA阳性、RPR阴性和TPPA阴性)更常见(71.4%vs43.5%)。这可能与接受筛查的孕妇中的梅毒患病率低于接受筛查的高风险非孕妇有关。一项对大约100,000名孕妇进行自动免疫测定筛查的回顾性研究发现,194名妇女的免疫测定结果不一致;其中156名女性具有反应性联络CIA结果、非反应性RPR和非反应性TPPA(孤立性CIA反应性),38名女性具有反应性联络CIA、非反应性RPR和反应性TPPA(180例)。在77名具有孤立的CIA反应性结果的女性中,41名(53%)在12个月内血清恢复为无反应。
建议对孕妇进行梅毒血清学检测。无论妊娠状态如何,非密螺旋体(类脂质抗原)和密螺旋体试验都应以相同的方式解释(框)。
评论和证据摘要。根据现有数据,密螺旋体检测在孕妇中的表现没有区别,应以与非孕妇相同的方式进行解释(177,179,180)。然而,由于美国许多地区孕妇梅毒的患病率较低,使用反序筛查算法确定的不一致免疫测定结果需要通过梅毒螺旋体检测(如TPPA)进行裁决,并根据CDC的性传播感染治疗指南进行管理,2021年(55)。妊娠期非密螺旋体(脂质抗原)假阳性的发生率与一般人群相似(65,66)。
艾滋病毒/艾滋病感染者的血清学检测性能
关于HIV感染者作为一个独特群体的非密螺旋体(类脂质抗原)检测性能的数据有限;大多数研究报告了RPR和VDRL在一般人群中的敏感性,包括HIV阳性者或神经梅毒或梅毒性后葡萄膜炎的HIV感染者。2007年一项针对868例生殖器溃疡病患者的横断面研究表明,HIV感染患者的RPR检测敏感性和特异性分别为81.8%和90.6%,这与未感染HIV的队列观察到的结果相当(181)。此外,2017年的一项研究发现,当使用CSF VDRL 和CSF聚合酶链反应(PCR)以临床神经系统症状为参考标准评估571份标本时,基于HIV感染状态的敏感性或特异性没有统计学上的显着差异(162);使用实验室和临床诊断标准,CSF-VDRL敏感性范围为49%-68%,特异性范围为90%-91%。其他针对不同HIV流行水平人群的研究发现,血清RPR的总体敏感性为72.5%-85%,CSF RPR的总体敏感性为68.8%,CSF VDRL 的敏感性为13.3%-62.5%,血清VDRL的总体敏感性为72.6%-91.2%(95,152,163,169,182)。
尽管数据表明,非密螺旋体(类脂质抗原)检测性能敏感性在HIV感染者和未感染HIV感染者之间没有显著差异,但研究报告称,HIV阳性者发生BFP的可能性增加。在样本量范围为789至300,000的研究中,通过VDRL或RPR进行的血清检测表明,HIV阳性者的BFP结果率是HIV阴性者的2.5-34.5倍(67-69,183,184)。这些研究是在抗逆转录病毒疗法广泛使用之前的人群中进行的,或者是在未评估病毒载量的人群中进行的。尚未研究病毒抑制的HIV感染者的BFP率。
密螺旋体检测阳性通常在既往接受过治疗的感染后持续存在,除非感染在继发性之前得到治疗,如先前在未感染HIV感染者中所描述的那样。在现代抗逆转录病毒治疗之前,两项研究发现MHA-TP或FTA-ABS检测的血清翻转因HIV疾病的严重程度而异,并且在一项研究中,无症状HIV感染(69例患者中有5例)低于有症状的HIV/AIDS(21例患者中有8例)(62)。在另一项研究中,29例无症状HIV感染患者中有14%发现血清复位,29例有症状HIV感染患者中有41%发现血清复位(72)。然而,随后的两项研究(包括31名和104名患者)发现,在既往接受过梅毒治疗的患者中,不同于HIV状态的梅毒螺旋体检测血清复转没有差异(113,185)。在最近的一项研究中,对294例既往梅毒患者进行了治疗后随访≥6个月且在随访期间没有梅毒迹象,其中87%对FTA-ABS有反应,92%对TPPA有反应,96%-99%对四种梅毒螺旋体免疫测定中的一种有反应(115)。与FTA-ABS相比,密螺旋体免疫测定在统计学上更可能保持反应性(115)。
关于对艾滋病毒/艾滋病感染者进行梅毒血清学检测的建议。无论HIV状态如何,非密螺旋体(类脂质抗原)和密螺旋体检测都应以相同的方式解释(插文)。
评论和证据摘要。根据现有数据,对于有和没有HIV感染的患者,非密螺旋体(脂质抗原)和密螺旋体检测的解释应相同(95,115,152,162,181)。
苍白梅毒螺旋体的直接检测试验
暗场显微镜
暗场显微镜一直是梅毒螺旋体使用最广泛的直接检测方法,但随着时间的推移,随着医疗保健提供系统的发展,在美国的普及程度越来越低(56,186)。暗视野显微镜是一种基于形态学和运动学的测试,依赖于检查活的密螺旋体,必须在标本采集后20分钟内进行(51,94)。该试验适用于疑似肛门生殖器一期或疑似二期梅毒的湿润病变,在这些病变中容易发现密螺旋体(例如溃疡性病变和阔湿疣)。如果按照既定的暗场显微镜标本采集程序收集浆液,则可以检查外生殖器和内生殖器(包括宫颈)和直肠的疑似病变(51)。口腔病变的暗视野显微镜检查难以解释,因为存在口腔共生密螺旋体,容易与梅毒螺旋体混淆;因此,不建议对口腔病变使用暗场显微镜检查。
暗视野显微镜的最佳标本是不含红细胞的浆液,并使用触摸制剂或无菌细菌学环收集在显微镜载玻片上。应轻轻清洁病变,并用无菌纱布垫或蘸有生理盐水的拭子擦拭。当对溃疡底部施加轻微压力时,会出现浆液。应使用显微镜载玻片收集渗出液,并应以避免捕获气泡的方式使用盖玻片。或者,可以使用无菌细菌学环将渗出液转移到载玻片上。对于宫颈、阴道内和直肠病变,可以用湿拭子收集浆液标本并转移到载玻片上。
在梅毒高发地区的诊所中,应保持或建立暗视野显微能力;快速现场检测一期梅毒可及时进行治疗,有利于患者护理和公共卫生。现场需要训练有素的显微镜师和暗场显微镜,以便在采集后20分钟内检查样品,以免影响运动性。暗视野显微镜的能力验证应持续进行,培训由国家性病临床预防培训中心网络(https://www.nnptc.org)。不建议使用共生螺旋体折射和密螺旋体进行暗视野显微镜训练,因为这些螺旋体很容易与梅毒螺旋体混淆(51)。熟练使用暗场显微镜需要能够根据运动和形态将苍白梅毒螺旋体与其他共生螺旋体区分开来。
暗场显微镜的敏感性和特异性(由临床表现和实验室检查结果(即血清学或PCR)定义,原发病灶的敏感性和特异性分别为75%-100%和94%-100%,继发病灶的敏感性-71%和100%[141,187-191]。由于血清学检测在感染早期可能呈阴性,因此对疑似一期梅毒的肛门生殖器病变进行暗视野显微镜检查可导致明确诊断(186)。原发性梅毒的暗场显微镜敏感性的变化可能与病变的持续时间有关,因为大多数研究在进行一期梅毒的性能研究时不会评估病变的年龄。暗视野显微镜仍可用作POC检查,用于明确诊断任何提示一期梅毒的肛门生殖器病变患者。
血清学在成人梅毒第二阶段的敏感性优于暗视野显微镜;因此,对于疑似二期梅毒,不常规推荐进行暗视野显微镜检查,但阔湿疣除外,当POC血清学检查不可用或阴性且需要明确诊断时。如果条件允许,暗视野检测也可能有助于检测先天性梅毒的湿润病变(例如大疱性皮疹和鼻涕)。与兔感染性检测(以前的金标准)相比,暗场显微镜检查对先天性梅毒诊断的敏感性从42%到86%不等,特异性为100%(192,193)。由于数据有限,通常不建议对羊水进行暗野检测。
在口腔中发现的共生密螺旋体可能被误解为梅毒螺旋体(51);因此,不建议对口腔病变进行暗视野显微镜检查。不建议对脑脊液、淋巴结抽吸物和其他体液进行暗视野显微镜检查,因为缺乏用于这些标本类型的科学证据。提供了直接检测梅毒检测的检测性能、标本类型、储存和运输相关指南列表(表2)(补充表6,https://stacks.cdc.gov/view/cdc/138288)。
建议通过暗场显微镜直接检测苍白梅毒螺旋体。如果已经在STD诊所使用或建立暗视野显微镜检查,则应保持暗视野显微镜检查,因为POC检测用于一期或二期梅毒诊断有利于及时治疗患者(插文)。
评论和证据摘要。与NAATs相比,暗场显微镜检测原发病灶的梅毒螺旋体的灵敏度为94%-100%,继发性病灶的敏感性为81%-100%(141,187-191)。暗视野显微镜检查在初期可能比血清学检测更敏感,并具有及时检测和快速治疗一期梅毒的优势(186)。该程序被CLIA归类为中等复杂程度,实施暗场显微镜的设置将需要CLIA认证才能进行此类测试。
用于梅毒螺旋体检测的免疫荧光抗体染色
梅毒螺旋体直接荧光抗体检测(DFA-TP)方法使用荧光标记的特异性抗体来观察一期和二期梅毒病变标本中的梅毒螺旋体。这种试样采集方法类似于暗场显微镜,不同之处在于将试样放在显微镜载玻片上后,将试样固定并送至实验室进行处理。通常,DFA-TP测试的灵敏度与暗场显微镜相当(188,190);然而,虽然评估运动能力的暗场测试性能可能会随着时间的推移而下降,但DFA-TP在较老的原发性病变中可能更敏感。DFA-TP还具有不需要运动生物体检测苍白梅毒螺旋体的优点,并且结果的读数更加客观。主要缺点是结果需要1-2天,因为它们必须在实验室中处理,并且美国不再提供商业的、FDA批准的DFA-TP测试(194)。荧光标记的单克隆或多克隆抗体是市售的,但未经FDA批准。为了用于诊断和标准临床实验室实践,这些试剂需要经过验证以进行临床诊断测试,并且需要进行常规质量控制。
免疫组化和银染
免疫组织化学(IHC)和银染是直接检测方法,用于对皮肤、脑、胎盘、脐带或其他组织的福尔马林固定、石蜡包埋(FFPE)组织活检进行染色和检查。活检可以帮助确定非典型溃疡或皮损或对初始治疗无反应的病因[55]。银染(例如,Warthin-Starry和Steiner染色)是一种基于形态学的检测,而IHC则基于免疫学和形态学。
对于IHC,过氧化物酶偶联的亲和素-生物素复合物(ABC)技术一直是组织切片最常评估的方法。该方法涉及热诱导的表位暴露和与兔抗T的孵育。帕利德免疫球蛋白抗体。随后,加入生物素化的抗兔免疫球蛋白抗体,然后与过氧化物酶偶联的ABC孵育并观察染色的密螺旋体。间接免疫荧光(IIF)方法与 IHC ABC之间的主要区别在于,二抗在IIF中用荧光染料标记。
与二期梅毒的临床或血清学诊断相比, IHC ABC方法在四项研究中显示出100%的特异性,敏感性范围为64%-94%(187,191,195,196)。在其中一项研究中,比较了37份组织样本上 IHC ABC与IIF的敏感性;敏感性分别为95%和89%(191)。
与暗视野显微镜检查、梅毒临床诊断和分期以及血清学相比,四项研究报告的FFPE皮肤活检银染的敏感性范围为0%至41%(195-198)。尽管这些研究没有解决特异性问题,但其他研究报告了解释染色切片的挑战,因为皮肤组织中伪影和网状纤维的背景染色使得难以可视化密螺旋体(196,199)。另一项研究评估了17例先天性梅毒导致的胎儿死亡病例的FFPE组织切片的银染和IIF测定,发现检测敏感性分别为41%(17例中的7例)和88%(17例中的15例)(200例)。由于灵敏度低且难以区分螺旋体,因此不再推荐使用银染直接检测梅毒螺旋体,用于任何类型的FFPE组织标本(195)。
当诊断仍不确定时,应使用 IHC ABC评估非典型病变和组织活检以发现疑似梅毒(一期、二期、先天性和胶质)。与 IHC ABC一起使用的多克隆抗体可能与肠道或其他螺旋体(例如伯氏疏螺旋体)发生交叉反应(196,201)。需要进一步研究比较IIF与 IHC ABC的测试性能。
对于先天性梅毒检测,胎盘和脐带样本应使用 IHC ABC技术或IIF进行检测,但不应使用银染色剂进行检测。胎盘组织样本应在外周和靠近脐带连接处采集。分娩后不久,应从胎盘远端采集约3-4cm长的脐带样本;在样品采集之前,不应使用含抗菌剂的溶液清洁组织(201)。收集后,应立即将组织样本固定在室温下的10%缓冲福尔马林中,并送往病理学实验室进行石蜡包埋和切片。
建议通过免疫组化和银染直接检测梅毒螺旋体。无论解剖部位如何,对于FFPE组织切片,IHC优于银染色(Box)。
评论和证据摘要。IHC的敏感性范围为64%至94%(187,191,195,196),而银染的敏感性为0%–41%(195–198)。两项研究报告称,由于银染切片中的背景伪影,难以可视化密螺旋体(196,199)。
核酸扩增检测
尽管NAAT在梅毒诊断方面有很大的前景,特别是对于一期梅毒,但没有FDA批准的NAAT可用于梅毒。大多数实验室开发的NAAT基于tp47(tp074)或polA(tp0105)基因,根据梅毒的分期和标本类型(193,197,202–204)的不同敏感性。还描述了一种针对16SrRNA基因区域的高灵敏度逆转录酶PCR检测(205),并在研究中用于CSF(206–208)。此外,仅靶向23S rRNA基因(HologicTMA)的实时转录介导检测可用于研究用途,用于评估直肠和咽部标本中是否存在 梅毒螺旋体(108)。某些实验室对苍白梅毒螺旋体进行了CLIA验证的PCR检测,可用于检测生殖器病变和脑脊液的标本。最近使用数字液滴PCR检测来评估唾液中是否存在 梅毒螺旋体(209)。
tp47和polA靶标的敏感性因研究而异,对一期梅毒病变渗出液的敏感性为72%-95%,对继发性病变拭子的敏感性为20%-86%,具体取决于取样的病变类型(皮疹与阔湿疣)。这些研究受到样本量有限和参考标准不同(包括以下因素的某种组合)的限制:梅毒临床诊断、血清学发现或暗视野显微镜结果(109,110,189,203,204,210,211)。如果对同一病灶同时进行暗场显微镜和NAAT,则应首先收集用于暗场显微镜的标本。总结了参考文献中NAAT标本的标本类型以及采集、运输和储存要求(表2)。
靶向polA基因的NAAT在使用灭菌刀片的非切削刃从二期梅毒患者身上刮除的斑丘疹病变中进行检测时,灵敏度为84%(112)。前面描述的NAATs在从斑丘疹病变中检测梅利特菌的低灵敏度可能归因于采样不充分;然而,需要更多的研究使用这种刮痧技术直接检测皮肤病变中的 梅毒螺旋体,以更好地估计NAAT性能。NAATs对继发性梅毒病变活检的敏感性从26%到75%不等。这些研究受到不同样本收集方法和参考标准的限制,包括临床、IHC或血清学结果的组合(187,195,197,198);据报道,使用采集后立即冷冻的未固定组织具有最高的灵敏度。
在24例MSM中,Hologic TMA对直肠和咽拭子的敏感性分别为41.6%和29.5%,而靶向tp47的NAAT对直肠和咽拭子的敏感性分别为37.5%和12.5%(108)。尽管梅毒螺旋体NAAT的靶标序列对病原体具有特异性(41),并且与共生梅毒螺旋体属的最小交叉反应性表明它们可用于口腔病变,但需要对靶标特异性进行更多研究才能得出结论。此外,tp47和polA NAAT可检测所有三种致病性梅利多特亚种(梅利多特梅病特立特亚种、特有梅梅特梅特埃特埃特亚种和地方性梅毒梅特梅特亚种)。已经描述了区分这三个亚种的NAAT,但尚未在梅毒标本中得到验证(212)。
使用全血或其成分(血清和血浆)或成人脑脊液的NAAT敏感性差异很大,并且受样本量小的限制;在考虑将这些样本类型用于临床测试之前,还需要进行额外的研究(110,189,210)。与RIT相比,NAATs对先天性梅毒(192,193,213-215)的羊水(75% vs 100%)、新生儿脑脊液(60% vs 75%)和新生儿全血或血清(67% vs 94%)的敏感性看起来很有希望。CDC的2021年性传播感染治疗指南建议,可以考虑使用CLIA验证的NAAT检查胎盘、脐带、可疑病变、鼻涕或其他体液,以帮助诊断先天性梅毒(55)。
扩增tp47基因的NAAT具有高度特异性(98%–100%),已在不同的标本类型上进行,包括一期和二期梅毒的病变渗出物;二期梅毒的病变活检;来自神经梅毒病例的脑脊液;以及来自原发性、二期和潜伏性梅毒病例的全血、血清和血浆。靶向polA基因的检测显示出相似的特异性(98%-100%),并且已对一期和二期梅毒的病变渗出物以及神经梅毒病例的脑脊液进行了检测(109,110,189,203,204,210,211)。如果不使用严格、清洁的质量控制程序,无论目标如何,具有开放平台的NAAT都比其他直接检测测试更容易受到样品污染引起的假阳性结果的影响。
根据有限的数据,实验室开发的NAAT可用于血清阴性患者的原发性或可能的二期梅毒病变(例如,包括口腔病变[粘液斑块]在内的湿性病变),前提是实验室建立性能规范以满足CMS对CLIA合规性的规定(109,110,189,204,210,211)。与血清学检测相比,NAATs可能更及时地诊断一期梅毒,但与血清学检查相比,二期梅毒的额外益处有限。对于疑似先天性感染病例,NAAT可作为羊水、新生儿脑脊液或新生儿血液的辅助试验(55,192,193,213-215)。尽管NAAT阳性结果有助于确诊,但由于敏感性有限,这些标本中的任何一个结果均为阴性并不能排除感染。由于敏感性低,不建议对全血或血液组分进行NAAT检测,并且数据不足以推荐对有神经梅毒症状的成人进行脑脊液NAAT检测(110,189,210)。数据不足以推荐将其用于眼液或来自胶质或其他三期梅毒病变的组织。
床旁血清学检测
由于梅毒算法可能需要确认性或其他反射检测,因此基于实验室的梅毒血清学检测可能需要3-5天,并且可能需要患者返回诊所进行随访或治疗。准确的梅毒POC血清学抗体检测可以缩短治疗时间,因为感染可以在就诊或就诊时识别出来。评估POC梅毒血清学检测性能的研究包括使用非密螺旋体(类脂质抗原)和基于密螺旋体实验室的血清学检测作为参考标准的传统或反向算法(补充表7,https://stacks.cdc.gov/view/cdc/138288)。多种POC梅毒血清学检测或双重POC血清学检测在国际上可用于治疗HIV和梅毒(https://www.who.int/publications/i/item/9789240077126);然而,只有梅毒健康检查(Diagnostics Direct)和双通路平台(DPP)HIV-梅毒检测(ChembioDiagnostics)获得FDA批准,CLIA豁免用于检测 梅毒螺旋体抗体。提供CLIA豁免测试的医生办公室实验室和公共卫生现场筛查计划必须拥有并保持CLIA豁免证书,该证书要求这些测试由经过培训的人员根据制造商说明(https://www.cdc.gov/labquality/waived-tests.html)进行质量保证和操作。
梅毒健康检查
在两项涉及202名和562名受试者的前瞻性研究中,与Trep-Sure EIA作为参考标准(216,217)相比,梅毒健康检查的敏感性和特异性分别为50.0%至71.4%和91.5%至95.9%(补充表7,https://stacks.cdc.gov/view/cdc/138288)。在另外两项研究中,分别有965名和690名受试者在外展环境和急诊科进行,与RPR和TPPA的参考标准相比,梅毒健康检查的敏感性分别为76.9%和90.0%,特异性为98.5%和99.0%(218,219)。在这项有965名受试者的研究中,与单独使用TPPA相比,梅毒健康检查的敏感性为50.0%,特异性为99.4%(219)。POC检测的目标是覆盖那些可能不会寻求治疗并且更有可能感染而未被发现和治疗的人群。后两项研究的结果表明,梅毒健康检查测试可能成功地覆盖了这些人群。2018年美国疾病控制与预防中心的一项回顾性研究使用来自美国商业和公共卫生实验室的1,406份存档血清来评估梅毒健康检查仅针对梅毒螺旋体检测(TPPA、EIA和CIA)以及密螺旋体和非密螺旋体(脂质抗原)(RPR)检测在实验室环境中的性能(220)。总体分析表明,与单独梅毒螺旋体检测相比,梅毒健康检查的敏感性和特异性分别为88.7%和93.1%;与梅毒螺旋体和非密螺旋体(脂质抗原)检测的比较表明,敏感性为95.7%,特异性为93.2%。该研究表明,梅毒健康检查的性能可能与目前临床环境中使用的密螺旋体抗体测试相当,但没有提供可能不一致的医疗保健寻求人群的性能数据。此外,在本回顾性研究中,患者无法获得梅毒病史和治疗状态数据。
DPP HIV-梅毒检测
在两项涉及150名和450名受试者的研究中,使用FDA批准的DPP HIV-梅毒检测版本和DPP微型阅读器,与TPPA相比,DPP HIV-梅毒检测对梅毒的敏感性和特异性分别为95.3%和100%,以及98.7%和100%(221,222)。尽管准确、低成本的快速检测有可能将检测范围扩大到原本无法及时接受检测的人群,但数据不足以推荐何时何地使用这些检测。需要关于POC血清学检测的成本和预测价值的进一步数据,以评估在为没有常规医疗护理的人群以及有和没有梅毒治疗史的人群提供服务的环境中实施检测的情况。在已建立的梅毒筛查计划中对未经治疗的梅毒患者进行检测和及时治疗的成本需要与在外展机构、急诊科或产房接触、检测和治疗人群的成本进行比较。
梅毒实验室检测报告
向公共卫生部门报告
梅毒具有重要的公共卫生影响,根据州公共卫生报告法规,病例必须由医疗保健提供者、实验室或两者兼而有之地报告给州或地方卫生部门。由于实验室可能无法获得临床信息,因此应向州和地方卫生部门报告所有梅毒直接检测阳性以及标本部位和梅毒血清学检测阳性。州法律详细说明了要报告哪些梅毒检测结果以及报告实验室结果的时间范围。
梅毒的可能和确诊病例都应由卫生保健提供者向当地或州卫生部门报告。用于对梅毒患者进行分期的临床标准可能与公共卫生监测病例定义不同。目前的病例定义可在https://ndc.services.cdc.gov/case-definitions/syphilis-2018上找到。出于监测目的,可能病例被定义为患者具有与梅毒分期一致的体征或症状,并且具有支持性实验室检查结果(例如血清学检查)可检测对病原体的免疫反应(223)。确诊病例与此类似,只是通过特异于 梅毒螺旋体的直接检测方法验证了该病原体的存在。
向医务人员报告
在向卫生保健提供者报告结果时,实验室应列出所有使用的测试,报告每个结果并附有解释,并在适当时记录用于解释的梅毒算法(224)。测试算法中的任何更改都应传达给提交者,并包括有关根据测试算法的解释差异的信息。向提交者发布的初步结果应列出待处理的测试。所有检测和结果都应列在最终报告中,即使一项或多项检测(例如,非密螺旋体[脂质抗原]检测或TPPA)被送到外部实验室。
对梅毒螺旋体感染的实验室检测进行进一步研究的机会
血清学和脑脊液抗体检测
几十年来,梅毒血清学抗体检测一直是美国梅毒检测的主要手段。然而,在多个领域进行额外的研究将提高当前血清学检测的效用。
需要对检测性能进行研究,以评估非梅毒螺旋体(类脂质抗原)检测对一期梅毒的敏感性,以对比暗视野显微镜或表征良好的NAAT的参考标准对肛门生殖器病变的敏感性。对于潜伏性梅毒(按感染持续时间分层:早期潜伏期、晚期潜伏期和潜伏期未知)、晚期梅毒、症状性神经梅毒、眼部梅毒和耳梅毒病例,需要关于血清学检测性能的其他数据。为了进行这些研究,具有梅毒分期良好特征的血清标本库是必不可少的。
与基于实验室的密螺旋体测试相比,DBS测试的测试性能研究将允许评估其作为诊断工具的潜力。此外,应优先确定可能被确认为梅毒真阳性的免疫测定信号强度的临界值。需要更多的研究来确定这些信息是否有助于临床决策。继续研究两种不同的血清学检测算法在梅毒低、中、高患病率人群中的性能,并开发成本效益分析工具,将有助于实验室在选择适合其环境的最佳方法时做出决策。最后,需要在样本量较大的研究以及有和没有梅毒的人群中评估脑脊液TPPA,以更好地评估检测的特异性。为了更好地确定脑脊液抗体检测的检测性能特征,脑脊液非密螺旋体(脂质抗原)和密螺旋体抗体检测的头对头研究将使用更大的样本,使用可比的、高质量的、商定的参考标准,并在更多具有明确特征症状状态的人群中进行。
直接检测测试
梅毒螺旋体的直接检测一直基于显微镜,但正在通过分子检测方法进行现代化检测。美国没有FDA批准的分子测试,尽管某些实验室使用内部实验室开发和验证的测试提供此类测试。FDA批准的 梅毒螺旋体分子测试将促进它们在实验室中的采用。然而,在确定最佳标本类型方面需要更多的研究,包括按梅毒分期分层的生殖器和生殖器外标本、标本运输和储存以及标本充足性;确定可用于监测抗微生物药物耐药性和菌株分型的分子标记,以更好地帮助流行病学调查;评估NAATs对全血或其成分(血清和血浆)的敏感性;以及评估NAAT与共生密螺旋体属的交叉反应性。
POC测试
尽管在国际上进行了多年的研究,但非实验室的梅毒POC检测在美国仍处于起步阶段,只有两种FDA批准和CLIA豁免的检测。需要更多的POC测试和数据来增加对其在临床和外展环境中的表现的了解。研究所需的其他领域包括精心设计的前瞻性研究,在筛查算法、特殊患者群体、与治疗和护理的联系以及成本效益的背景下,对POC测试性能进行精心设计,以便就美国的性能和使用提出建议。还需要研究将POC检测与FDA批准的基于实验室的密螺旋体血清学检测进行比较,然后提出实施的规划建议,以指导其在梅毒检测算法中的适当使用。
通讯作者:JohnR.Papp,疾病预防控制中心国家艾滋病毒、病毒性肝炎、性病和结核病预防中心性病预防部。电话:404-423-2246;电子邮件:jwp6@cdc.gov
1佐治亚州亚特兰大市疾病预防控制中心国家艾滋病毒、病毒性肝炎、性病和结核病预防中心性病预防科;2加州大学旧金山分校,加利福尼亚州旧金山;3全球卫生工作组,佐治亚州迪凯特
图1.梅毒螺旋体梅毒螺旋体感染的血清学反应
源:改编自PeelingRW、MabeyD、KambML、ChenX-S、RadolfJD、BenzakenAS。梅毒。NatRevDisPrimers2017;3:17073。经许可使用。
箱.CDC实验室对梅毒检测的建议,美国,2024年
- 终点滴度建议。当使用非密螺旋体(脂质抗原)检测血清时,应确定终点滴度(产生反应性结果的最高稀释度),以检测脂质抗原抗体(即快速血浆反应素和性病研究实验室)。报告不应包含数学符号,例如>或<符号。
- 梅毒血清学检测算法的建议。当主要检测结果为反应性时,应联合使用血清学检测,以检测与梅毒感染相关的非梅毒螺旋体(类脂质)和密螺旋体抗原抗体,以帮助诊断梅毒。仅仅依赖一种反应性血清学检测结果可能会错误地分类患者的梅毒状态。传统的梅毒筛查算法(使用非密螺旋体[脂质抗原]检测进行初始筛查)和反向梅毒筛查算法(使用密螺旋体免疫检测进行初始筛查)都是可以接受的。首选算法应基于实验室资源,包括人员、空间和成本、检测量和所服务的患者群体。
- 血清学梅毒检测的建议。非密螺旋体(脂质抗原)检测(例如,快速血浆反应素或性病研究实验室)在用于测定抗体滴度时不可互换;对后续样品的测试必须使用相同类型的测试进行。梅毒螺旋体颗粒凝集试验是首选的手动密螺旋体试验。
- 建议对孕妇进行梅毒血清学检测。无论妊娠状态如何,非密螺旋体(脂质抗原)和密螺旋体试验都应以相同的方式解释。
- 关于对艾滋病毒/艾滋病感染者进行梅毒血清学检测的建议。无论HIV状态如何,非密螺旋体(脂质抗原)和密螺旋体检测都应以相同的方式解释。
- 建议通过暗视野显微镜直接检测梅毒螺旋体。如果暗视野显微镜检查已经在性传播疾病诊所使用或建立,则应保持暗视野显微镜检查,因为一期或二期梅毒诊断的即时检测有利于及时治疗患者。
- 建议通过免疫组化和银染直接检测梅毒螺旋体。对于福尔马林固定、石蜡包埋的组织切片,无论解剖部位如何,免疫组化优于银染色。
图2.抗体和抗原浓度对凝集作用的影响
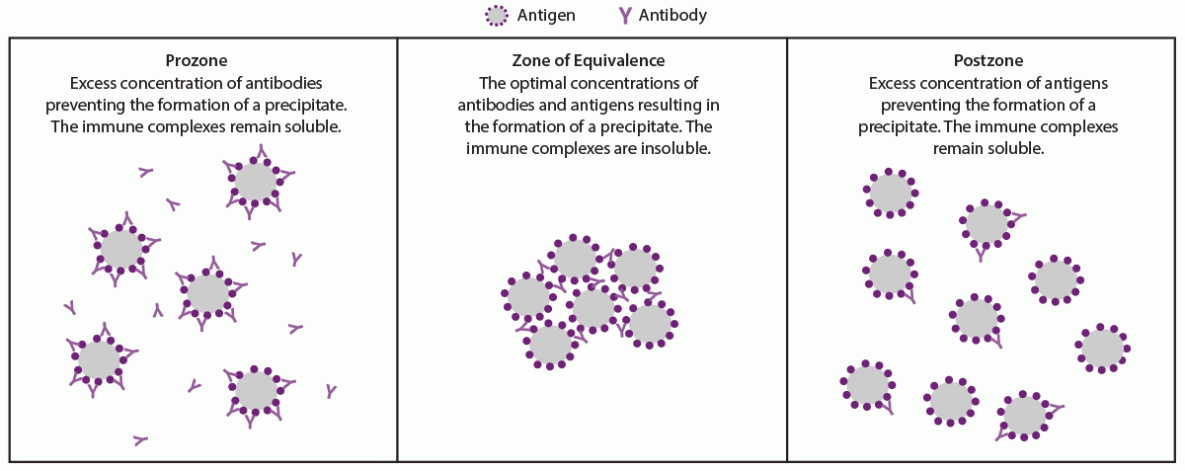
图3.可应用于血清学检测梅毒筛查的算法——CDC实验室对美国梅毒检测的建议,2024年
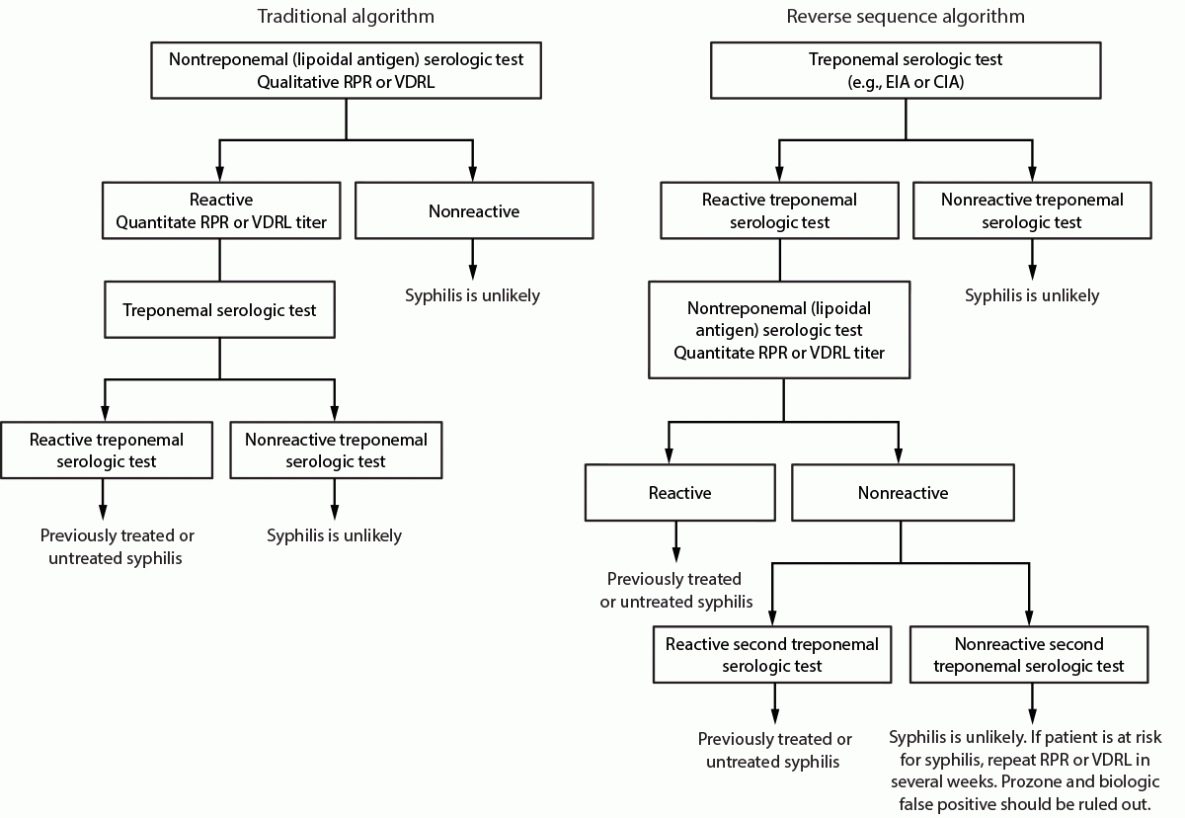
缩写:CIA=化学发光免疫测定;EIA=酶免疫测定;RPR=快速等离子体恢复;TPPA=梅毒密虫颗粒凝集;VDRL=性病研究实验室。
表1.血清学梅毒筛查的传统算法和反向算法的比较——CDC实验室对梅毒检测的建议,美国,2024年
| 参数 | 以非密螺旋体(脂质抗原)检测作为初始检测的传统算法 | 以密螺旋体试验为初始试验的反向算法 |
|---|---|---|
| 试剂成本 | 快速且廉价的试剂 | 每个样本的试剂成本更高 自动化密螺旋体检测广泛可用,具有高通量和更低的人力成本 |
| 试样通量 | 适用于小通量实验室不太适合高通量实验室,因为需要劳动力和资源,并且对单个样本进行移液会造成职业危害 | 可能对样品进行批处理,这可能会延迟测试结果的周转时间 |
| 算法中第一个测试的性能特征 | 非密螺旋体(类脂质抗原)检测结果可能是主观的,滴度 存在实验室差异可能的前区反应可能被错误地解释为阴性, 除非血清样本被稀释由梅毒以外的疾病引起的非特异性反应性导致的生物学假阳性对检测早期和晚期/潜伏梅毒的敏感性 可能较低 | 密螺旋体检测产生客观结果 无前腺反应 检测针对梅毒螺旋体抗原的抗体 可能增加早期梅毒患者的检出率 |
| 筛选应用 | 对既往梅毒可能性高的人群有益 | 如果将该算法用于既往梅毒可能性高的人群,则增加的初次筛查试验可能是假阳性* |
*假阳性被定义为初始密螺旋体血清学测试期间的反应性血清标本,在通过非密螺旋体(脂质抗原)测试和第二次密螺旋体测试进行反射测试时无反应。
表2.梅毒螺旋体直接检测的标本类型、储存和运输——CDC实验室对梅毒检测的建议,美国,2024年
| 直接检测测试 | 试样类型 | 标本储存和运输 |
|---|---|---|
| 暗场显微镜 | 湿润病变(口腔病变除外)的浆液渗出物应直接在显微镜载玻片上或使用无菌细菌学环收集;避免使用红细胞 | 新鲜,室温(20℃至26℃;68℉至78.8℉) |
| 免疫荧光抗体检测染色 | 疑似病变涂片 | 新鲜,室温(20℃至26℃;68℉至78.8℉) |
| 免疫组化染色 | 脑、胎盘、脐带或二期或三期梅毒皮肤病变的福尔马林固定和石蜡包埋组织切片 | 室温(20℃至26℃;68℉至78.8℉) |
| 银染 | 福尔马林固定和石蜡包埋脑、胎盘、脐带或二期、三期或先天性梅毒的皮肤病变的组织切片 | 室温(20℃至26℃;68℉至78.8℉) |
| 核酸扩增试验 | 一期梅毒: 湿润病灶的浆液渗出物应用无菌涤纶拭子收集,并置于商业运输培养基中二期梅毒: 应使用无菌涤纶拭子收集粘液斑块和扁平湿疣标本,并将其置于商业运输培养基中新鲜冷冻组织活检或福尔马林固定和石蜡包埋组织 新生儿全血或血清;全血应收集在EDTA(紫色顶部)管中 | 冷冻(-20℃至-80℃;-4℉至-112℉)、冷冻冰袋或干冰 |
引用
- SkermanVBD、McGowanV、SneathPHA。批准的细菌名称列表。IntJSystEvolMicrobiol1980;30:225–420.https://doi.org/10.1099/00207713-30-1-225
- KazadiWM,AsieduKB,AganaN,MitjàO.雅司病的流行病学:更新。临床流行病学2014;6:119–28.PMID:24729728
- StammLV.品他(Pinta) :拉丁美洲被遗忘的疾病?AmJTropMedHyg2015年;93:901–3.https://doi.org/10.4269/ajtmh.15-0329PMID:26304920
- 马克斯M、所罗门AW、马贝DC。地方性梅毒螺旋体疾病。TransRSocTropMedHyg2014;108:601–7.https://doi.org/10.1093/trstmh/tru128PMID:25157125
- NodaAA、GrillováL、LienhardR、BlancoO、RodríguezI、ŠmajsD.Bejel:在被诊断为性病梅毒的患者中梅毒螺旋体地方性亚种的分子鉴定。临床微生物感染2018;24:1210.e1–5。https://doi.org/10.1016/j.cmi.2018.02.006PMID:29454847
- GrangePA、Allix-BeguecC、ChanalJ等。法国巴黎梅毒螺旋体的分子亚型。2013年性变性;40:641–4.https://doi.org/10.1097/OLQ.0000000000000006PMID:23859911
- GrangePA,MikalováL,GaudinC,etal.梅毒螺旋体11qj亚型可能对应于梅毒螺旋体地方性菌株。2016年性变性;43:517–8.https://doi.org/10.1097/OLQ.0000000000000474PMID:27419817
- ShinoharaK,FurubayashiK,KojimaY,MoriH,KomanoJ,KawahataT.日本关西地区成人地方性桃体感染的临床观点,尤其是男男性行为者:病例系列。J感染化学母2022;28:444–50.https://doi.org/10.1016/j.jiac.2021.11.012PMID:34836779
- O’ByrneP,MacPhersonP.梅毒。英国医学杂志2019;365:l4159。https://doi.org/10.1136/bmj.l4159PMID:31253629
- BruusgaardE.ÜberdasSchicksaldernichtspezifischbehandeltenLuetiker.ArchDermatolRes1929年;157:309–32.https://doi.org/10.1007/BF01959543
- 加内特GP、阿拉尔SO、霍伊尔DV、小凯茨W、安德森RM。梅毒的自然病程。对传播动态和感染控制的影响。1997年《性变性》;24:185–200.https://doi.org/10.1097/00007435-199704000-00002PMID:9101629
- 格尼·克拉克E,丹博尔特N.奥斯陆对未经治疗的梅毒自然病程的研究:基于对Boeck-Bruusgaard材料的重新研究的流行病学调查。MedClinNorthAm1964年;48:613–23.https://doi.org/10.1016/S0025-7125(16)33445-9
- StokesJ,BeermanH,IngrahamN.现代临床梅毒学。第3版。宾夕法尼亚州费城:WBSaundersCo.;1945.
- MerrittH、AdamsR、SolomonH.神经梅毒。纽约,纽约:牛津大学出版社;1940.
- RosahnP.梅毒的尸检研究。JVenerDisInf1947年;649:1–67.
- CDC.2022年性传播疾病监测[互联网]。佐治亚州亚特兰大:美国卫生与公众服务部,CDC;2023.https://www.cdc.gov/std/statistics/2021/default.htm
- 世界卫生组织。关于全球性传播感染监测的报告。瑞士日内瓦:世界卫生组织;2018.https://www.who.int/publications/i/item/9789241565691
- 疾病预防控制中心,2000年性传播疾病监测[互联网]。佐治亚州亚特兰大:美国卫生与公众服务部,CDC;2001.https://www.cdc.gov/std/stats/archive/2000-Surv-All.pdf
- TheelES,KatzSS,PillayA.梅毒螺旋体亚种的分子和直接检测测试:文献综述,1964-2017年。ClinInfectDis2020;71(增刊1):S4-12。https://doi.org/10.1093/cid/ciaa176PMID:32578865
- ParkIU,TranA,PereiraL,FakileY.梅毒螺旋体特异性检测诊断梅毒的敏感性和特异性。ClinInfectDis2020;71(增刊1):S13–20。https://doi.org/10.1093/cid/ciaa349PMID:32578866
- TuddenhamS、KatzSS、GhanemKG。梅毒实验室指南:非密螺旋体抗体检测的性能特征。ClinInfectDis2020;71(增刊1):S21–42。https://doi.org/10.1093/cid/ciaa306PMID:32578862
- 奥尔蒂斯DA、舒克拉MR、洛菲尔霍尔茨MJ。诊断梅毒的传统或反向算法:优点和缺点。临床感染Dis2020;71(增刊1):S43–51。https://doi.org/10.1093/cid/ciaa307PMID:32578864
- BristowCC,KlausnerJD,TranA.快速床旁梅毒螺旋体抗体检测的临床试验性能:系统评价和荟萃分析。ClinInfectDis2020;71(增刊1):S52–7。https://doi.org/10.1093/cid/ciaa350PMID:32578863
- 比亚利尼基-比鲁拉R.Wassermann-Neisser-Bruck反应100周年。临床皮肤2008;26:79–88.https://doi.org/10.1016/j.clindermatol.2007.09.020PMID:18280907
- 潘邦MC。一种来自牛心的新型血清活性磷脂。ExpBiolMed(Maywood)1941年;48:484–6.https://doi.org/10.3181/00379727-48-13365P
- 世界卫生组织。性病感染和密螺旋体病专家委员会,血清学和实验室方面小组委员会:第三次报告。瑞士日内瓦:世界卫生组织;1954.https://iris.who.int/handle/10665/37603
- OlanskyS,价格IN。梅毒的现代诊断。BullWorldHealthOrgan1956年;14:249–62.
- 诺里斯SJ、帕斯特BJ、莫特A、戈贝尔UB。密螺旋体属[第4.2章]。在:德沃金M、法尔科夫S、罗森伯格E、施莱弗KH、斯塔克布兰特E,编辑。原核生物:第7卷:变形菌:δ、ε亚纲。深深扎根细菌。纽约,纽约:施普林格纽约;2006:211–34.https://doi.org/10.1007/0-387-30747-8_8
- IzardJ,RenkenC,HsiehCE,etal.冷冻电子断层扫描阐明了梅毒螺旋体梅毒螺旋体的分子结构。细菌学杂志2009;191:7566–80.https://doi.org/10.1128/JB.01031-09PMID:19820083
- 刘杰,豪威尔JK,布拉德利SD,郑Y,周ZH,诺里斯SJ.梅毒螺旋体的细胞结构:冷冻电子断层扫描揭示的新型鞭毛、周质锥体和细胞包膜。分子生物学杂志2010;403:546–61.https://doi.org/10.1016/j.jmb.2010.09.020PMID:20850455
- 帕斯特BJ。第十五门。螺旋体。第2版。KriegNR、BrownDR、HedlundBP等人,编辑。纽约州纽约市:施普林格;2001.
- WalkerEM、ZampighiGA、BlancoDR、MillerJN、LovettMA。通过冻裂分析证明梅毒螺旋体亚种梅毒螺旋体外膜中稀有蛋白。细菌学杂志1989;171:5005–11.https://doi.org/10.1128/jb.171.9.5005-5011.1989PMID:2670902
- 拉道夫JD、NorgardMV、舒尔茨WW。外膜超微结构解释了毒性梅毒螺旋体的抗原性有限。美国国家科学院院刊1989;86:2051–5.https://doi.org/10.1073/pnas.86.6.2051PMID:2648388
- RadolfJD、RobinsonEJ、BourellKW等。从梅毒螺旋体梅毒螺旋体中分离出的外膜的表征。感染免疫1995;63:4244–52.https://doi.org/10.1128/iai.63.11.4244-4252.1995PMID:7591054
- 考克斯DL、AkinsDR、PorcellaSF、NorgardMV、RadolfJD。凝胶微滴中的梅毒螺旋体:研究密螺旋体分子结构的新策略。MolMicrobiol1995年;15:1151–64.https://doi.org/10.1111/j.1365-2958.1995.tb02288.xPMID:7623668
- 考克斯DL、ChangP、McDowallAW、RadolfJD。外膜(而不是宿主蛋白的外壳)限制了毒性梅毒螺旋体的抗原性。感染免疫1992;60:1076–83.https://doi.org/10.1128/iai.60.3.1076-1083.1992PMID:1541522
- Canale-ParolaE.螺旋体的运动性和趋化性。AnnuRevMicrobiol1978年;32:69–99.https://doi.org/10.1146/annurev.mi.32.100178.000441PMID:360979
- 托马斯DD、纳瓦布M、哈克DA、福格尔曼AM、米勒JN、洛维特MA。梅毒螺旋体侵入内皮细胞单层的细胞间连接。美国国家科学院院刊1988;85:3608–12.https://doi.org/10.1073/pnas.85.10.3608PMID:3285346
- WolgemuthCW.致病性螺旋体的鞭毛运动。SeminCellDevBiol2015;46:104–12.https://doi.org/10.1016/j.semcdb.2015.10.015PMID:26481969
- 拉道夫,法学博士。梅毒螺旋体和对外膜蛋白的追求。MolMicrobiol1995年;16:1067–73.https://doi.org/10.1111/j.1365-2958.1995.tb02332.xPMID:8577243
- RadolfJ、HazlettK、LukehartS.致病性螺旋体:细胞和分子生物学。在:RadolfJD,LukehartSA,编辑。致病性螺旋体瘤:分子和细胞生物学。英国诺福克:凯斯特学术出版社;2006:197–236.
- 拉道夫JD、德卡RK、阿南德A、斯马斯D、诺加德MV、杨XF。梅毒螺旋体,梅毒螺旋体:以隐形病原体为生。NatRevMicrobiol2016年;14:744–59.https://doi.org/10.1038/nrmicro.2016.141PMID:27721440
- HashimotoM,AsaiY,OgawaT.密螺旋体磷脂抑制病原体相关分子模式诱导的先天免疫反应。生物化学杂志2003;278:44205–13.https://doi.org/10.1074/jbc.M306735200PMID:12947124
- 布伊斯DA、波波娃TG、高岛A、诺加德MV。树突状细胞吞噬,并被梅毒螺旋体激活。感染免疫2001;69:518–28.https://doi.org/10.1128/IAI.69.1.518-528.2001PMID:11119545
- ParadiesG,ParadiesV,RuggieroFM,PetrosilloG.心磷脂在线粒体功能和健康和疾病动力学中的作用:分子和药理学方面。细胞2019;8:728。https://doi.org/10.3390/cells8070728PMID:31315173
- LacknerKJ,Müller-CallejaN.抗磷脂抗体:它们的起源和发展。抗体(巴塞尔)2016;5:15。https://doi.org/10.3390/antib5020015PMID:31557996
- 阿卜杜勒-瓦哈卜N、洛佩兹-奥利沃MA、平托-帕塔罗约大奖赛、苏亚雷斯-阿尔马佐尔ME。感染后抗磷脂综合征病例报告的系统评价。狼疮2016;25:1520–31.https://doi.org/10.1177/0961203316640912PMID:27060064
- MatthewsHM,YangTK,JenkinHM.梅毒螺旋体(Nichols毒力菌株)的独特脂质组成。感染免疫1979;24:713–9.https://doi.org/10.1128/iai.24.3.713-719.1979PMID:381199
- 高坤,沈旭,林彦,等.梅毒螺旋体感染期间非密螺旋体抗体的起源:来自兔模型的证据。J感染Dis2018;218:835–43.https://doi.org/10.1093/infdis/jiy241PMID:29701849
- BlancoDR、ChampionCI、DooleyA等。在实验性梅毒中传递体外杀伤和部分保护的单克隆抗体结合梅毒螺旋体的磷酰胆碱表面表位。感染免疫2005;73:3083–95.https://doi.org/10.1128/IAI.73.5.3083-3095.2005PMID:15845516
- 拉森SA、施泰纳BM、鲁道夫AH。梅毒检测的实验室诊断和解释。ClinMicrobiolRev1995;8:1–21.https://doi.org/10.1128/CMR.8.1.1PMID:7704889
- FraserCM、NorrisSJ、WeinstockGM等。梅毒螺旋体梅毒螺旋体的完整基因组序列。科学1998;281:375–88.https://doi.org/10.1126/science.281.5375.375PMID:9665876
- 马蒂亚斯J、克林勒EJ、席林格JA、凯勒G、威尔逊C、彼得曼TA。2013年至2017年美国佛罗里达州和纽约市报告的梅毒生物假阳性检测结果的频率和特征。临床微生物学杂志2019;57:E00898-19。https://doi.org/10.1128/JCM.00898-19PMID:31462551
- 布朗WJ、普莱斯EV、辛普森WG。Reiter蛋白抗原检测与TPI和其他密螺旋体和非密螺旋体抗原技术在梅毒诊断中的比较。JInvestDermatol1960年;34:223–7.https://doi.org/10.1038/jid.1960.34PMID:13805051
- WorkowskiKA、BachmannLH、ChanPA等。性传播感染治疗指南,2021年。MMWRRecommRep2021;70(编号)RR-4):1–187。https://doi.org/10.15585/mmwr.rr7004a1PMID:34292926
- DavisA,GaynorA.美国公共卫生实验室的性传播疾病检测,2016年。2020年性变性;47:122–7.https://doi.org/10.1097/OLQ.0000000000001101PMID:31935208
- 美国食品和药物管理局。用于ASIEvolution的梅毒自动RPR测试。基本等效的510(k)设备信息。马里兰州银泉市:美国卫生与公众服务部、食品和药物管理局;2020.https://www.fda.gov/vaccines-blood-biologics/substantially-equivalent-510k-device-information/bk200488-asi-automated-rpr-test-syphilis-use-asi-evolution
- 美国食品和药物管理局。501(k)上市前通知。GoldStandardDiagnosticsAIX1000RapidPlasmaReagin(RPR)自动测试系统[Internet]。马里兰州银泉市:美国卫生与公众服务部、食品和药物管理局;2015.https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpmn/pmn.cfm?ID=K150358
- 桑菲利波AM、弗里曼K、施密茨JL。用于梅毒实验室诊断的手动和全自动AIX1000快速血浆反应素测定的比较。临床微生物学杂志2018;56:E00214-8。https://doi.org/10.1128/JCM.00214-18PMID:29618500
- RolfsRT、JoesoefMR、HendershotEF等;梅毒和艾滋病毒研究组。一项针对有和没有人类免疫缺陷病毒感染的患者加强治疗早期梅毒的随机试验。NEnglJMed1997;337:307–14.https://doi.org/10.1056/NEJM199707313370504PMID:9235493
- 罗曼诺夫斯基B、萨瑟兰R、菲克GH、穆尼D、爱EJ。对传染性梅毒治疗的血清学反应。AnnInternMed1991年;114:1005–9.https://doi.org/10.7326/0003-4819-114-12-1005PMID:2029095
- HaasJS,BolanG,LarsenSA,ClementMJ,BacchettiP,MossAR.在人类免疫缺陷病毒感染期间检测先前治疗过的梅毒的梅毒螺旋体检测的敏感性。JInfectDis1990年;162:862–6.https://doi.org/10.1093/infdis/162.4.862PMID:1976130
- SeñaAC、WolffM、BehetsF等人。早期梅毒治疗后非密螺旋体抗体滴度和血清复位的下降率。2017年性变性;44:6–10.https://doi.org/10.1097/OLQ.0000000000000541PMID:27898575
- SeñaAC、WolffM、MartinDH等人。HIV阴性早期梅毒患者治疗后血清学治愈和血清学禁食状态的预测因素。临床感染Dis2011;53:1092–9.https://doi.org/10.1093/cid/cir671PMID:21998287
- LiuLL,LinLR,TongML,等.大型队列中梅毒血清学检测中前室现象的发生率和危险因素。临床感染Dis2014;59:384–9.https://doi.org/10.1093/cid/ciu325PMID:24803377
- el-ZaatariMM,MartensMG,AndersonGD.梅毒血清学中前离子现象的发生率。妇产科1994;84:609–12.PMID:8090401
- AugenbraunMH,DeHovitzJA,FeldmanJ,ClarkeL,LandesmanS,MinkoffHM.感染人类免疫缺陷病毒的妇女的生物假阳性梅毒检测结果。ClinInfectDis1994年;19:1040–4.https://doi.org/10.1093/clinids/19.6.1040PMID:7888531
- GeusauA,KittlerH,HeinU,Dangl-ErlachE,StinglG,TschachlerE.在对300,000个血清的分析中,生物假阳性测试在性病研究实验室反应中占很大比例。国际性病艾滋病杂志2005;16:722–6.https://doi.org/10.1258/095646205774763207PMID:16303064
- RompaloAM、CannonRO、QuinnTC、HookEW3rd。梅毒的生物假阳性反应与人类免疫缺陷病毒感染的关联。JInfectDis1992年;165:1124–6.https://doi.org/10.1093/infdis/165.6.1124PMID:1583332
- TuffanelliDL.麻醉成瘾,梅毒假阳性反应。免疫学检查。ActaDermVenereol1968年;48:542–6.PMID:4177582
- SmikleMF,JamesOB,PrabhakarP.牙买加人群中梅毒的生物假阳性血清学检测。生殖素医学1990;66:76–8.https://doi.org/10.1136/sti.66.2.76PMID:2187794
- JohnsonPDR,GravesSR,StewartL,WarrenR,DwyerB,LucasCR.在HIV感染中,特异性梅毒血清学检测可能呈阴性。艾滋病1991;5:419–23.https://doi.org/10.1097/00002030-199104000-00010PMID:2059384
- JanierM、ChastangC、SpindlerE等。HIV状态对梅毒血清学检测血清学逆转影响的前瞻性研究。皮肤病学1999;198:362–9.https://doi.org/10.1159/000018149PMID:10449935
- AlonsoR,Pérez-GarcíaF,GijónP,CollazosA,BouzaE.ArchitectHIVAg/Ab组合检测在低流行环境中的评估:低S/CO比样品的作用。临床病毒杂志2018;103:43–7.https://doi.org/10.1016/j.jcv.2018.04.002PMID:29635210
- AcarA、KemahliS、AltunayH等人。对接受HBV、HCV和HIV免疫测定筛查的土耳其献血者进行重复检测的意义,以及S/CO比率在解释HCV/HIV筛查检测结果中的重要性,以及作为进一步确认检测的决定因素。TransfusMed2010年;20:152–9.https://doi.org/10.1111/j.1365-3148.2009.00987.xPMID:20059750
- AlterMJ、KuhnertWL、FinelliL.疾病预防控制中心。丙型肝炎病毒抗体实验室检测和结果报告指南。MMWRRecommRep2003;52(编号)RR-3):1-13、15,测验CE1-4。PMID:12585742
- 阿尔贝托尼G、阿诺尼CP、阿劳霍PR、卡瓦略FO、巴雷托JA。信号临界值(S/CO)比值和实时荧光定量PCR一步法检测HCV基因型1:是否有任何直接关系?BrazJ感染Dis2010;14:147–52.https://doi.org/10.1016/S1413-8670(10)70028-3PMID:20563440
- 霍奇森CK、克拉索夫斯基医学博士、福特BA。两种HIV抗原/抗体组合检测的信噪比与随后确认低患病率人群中HIV-1感染的关系数据。数据简报2020;31:105707.https://doi.org/10.1016/j.dib.2020.105707PMID:32462068
- LoeffelholzMJ,温T,帕特尔JA.分析不同患者群体中的生物复合梅毒IgG定量结果。临床疫苗免疫学2011;18:2005–6.https://doi.org/10.1128/CVI.05335-11PMID:21880852
- ParkIU,ChowJM,BolanG,StanleyM,ShiehJ,SchapiroJM.梅毒螺旋体免疫分析筛查:血清学结果不一致的分析及其对临床管理的影响。JInfectDis2011年;204:1297–304.https://doi.org/10.1093/infdis/jir524PMID:21930610
- WongEH、KlausnerJD、Caguin-GrygielG等。评估IgM/IgG敏感酶免疫测定法和指标值在高危人群中筛查梅毒感染的效用。2011年性变性;38:528–32.https://doi.org/10.1097/OLQ.0b013e318205491aPMID:21233789
- Yen-LiebermanB、DanielJ、MeansC、WaletzkyJ、DalyTM。使用半定量算法鉴定假阳性梅毒抗体结果。临床疫苗免疫学2011;18:1038–40.https://doi.org/10.1128/CVI.05066-11PMID:21508162
- FakileYF、JostH、HooverKW等。密螺旋体免疫测定信号强度值与确认性密螺旋体检测反应性的相关性。临床微生物学杂志2017;56:e01165-17。PMID:29046410
- 何亲王,马洛EM,施瓦布DA。反转梅毒检测算法中DiaSorin联络梅毒螺旋体抗体指标与确认性检测结果之间的关系。诊断微生物感染Dis2021;100:115303。https://doi.org/10.1016/j.diagmicrobio.2020.115303PMID:33503569
- CDC.反序梅毒筛查结果不一致——五个实验室,美国,2006-2010年。MMWRMorbMortalWklyRep2011年;60:133–7.
- 罗兹DD、GenzenJR、BashlebenCP、FaixJD、AnsariMQ。实验室实践中传统和反向算法梅毒筛查的流行率:对美国病理学家学院梅毒血清学能力测试计划参与者的调查。ArchPatholLabMed2017年;141:93–7.https://doi.org/10.5858/2016-0110-CPPMID:27763779
- 宾尼克MJ、杰斯珀森DJ、罗林斯LO。传统梅毒筛查算法和反向梅毒筛查算法在梅毒低患病率人群中的直接比较。临床微生物学杂志2012;50:148–50.https://doi.org/10.1128/JCM.05636-11PMID:22090407
- Owusu-EduseiKJr,KoskiKA,巴拉德RC.两种血清学检测以筛查梅毒的故事——梅毒螺旋体和非梅毒螺旋体:顺序重要吗?2011年性变性;38:448–56.https://doi.org/10.1097/OLQ.0b013e3182036a0fPMID:21183862
- Owusu-EduseiKJr、PetermanTA、巴拉德RC。美国梅毒血清学检测:两种筛查算法的成本效益分析。2011年性变性;38:1–7.https://doi.org/10.1097/OLQ.0b013e3181ec51f1PMID:20739911
- ChuckA,OhinmaaA,TilleyP,SinghA,JacobsP.酶免疫测定和免疫印迹检测诊断梅毒的成本效益。国际性病艾滋病杂志2008;19:393–9.https://doi.org/10.1258/ijsa.2007.007272PMID:18595877
- BuonoSA、Basurto-DavilaR、GodwinHA、GreenNM。反向算法梅毒筛查在高患病率人群中的经济评估。2018年性变性;45:834–41.https://doi.org/10.1097/OLQ.0000000000000875PMID:29870503
- 剥离RW、MabeyD、KambML、ChenX-S、RadolfJD、BenzakenAS。梅毒。NatRevDisPrimers2017;3:17073。https://doi.org/10.1038/nrdp.2017.73PMID:29022569
- GhanemKG、RamS、RicePA。梅毒的现代流行。NEnglJMed2020年;382:845–54.https://doi.org/10.1056/NEJMra1901593PMID:32101666
- 拉森SAPV、约翰逊RE、小肯尼迪EJ梅毒检测手册。第9版。华盛顿特区:美国公共卫生协会;1998.
- 克里根L、鲍尔HM、塞缪尔MC、克劳斯纳J、利斯卡S、博兰G.性病研究实验室试验和梅毒螺旋体颗粒凝集试验在诊断为一期梅毒的患者中的相对敏感性评估。2007年性变性;34:1016–8.https://doi.org/10.1097/OLQ.0b013e3181124473PMID:18080352
- 博萨克HN、邓肯WP、哈里斯A、法尔科内VH。在未加热的血清上测定梅毒检测。公共卫生代表1960年;75:196–8.https://doi.org/10.2307/4590765PMID:13803076
- 戴克曼JD、温德RD、甘滕拜因D、威廉姆斯RP。reagin筛查的评估,一种新的梅毒血清学检测。临床微生物学杂志1976;4:145–50.https://doi.org/10.1128/jcm.4.2.145-150.1976PMID:787004
- 戴克曼JD、GatenbeinD、WendeRD、威廉姆斯RP。一种新的梅毒筛查试验的临床评估。AmJClinPathol1978年;70:918–21.https://doi.org/10.1093/ajcp/70.6.918PMID:727175
- FalconeVH、StoutGW、MooreMBJr.快速血浆反应素(圆)卡测试的评估。公共卫生代表1964年;79:491–5.https://doi.org/10.2307/4592169PMID:14155846
- SischyA、daL’ExpostoF、DangorY等人。南部非洲一期梅毒和非密螺旋体性传播疾病患者的梅毒血清学检查。生殖素医学1991;67:129–32.https://doi.org/10.1136/sti.67.2.129PMID:2032706
- 摩尔MBJr,诺克斯JM。梅毒血清学的敏感性和特异性:临床意义。SouthMedJ1965年;58:963–8.https://doi.org/10.1097/00007611-196508000-00007PMID:14315433
- HuberTW、StormsS、YoungP等人。微血凝、荧光密螺旋体抗体吸收、性病研究实验室和快速血浆反应素检测在一期梅毒中的反应性。临床微生物学杂志1983;17:405–9.https://doi.org/10.1128/jcm.17.3.405-409.1983PMID:6341398
- DyckmanJD,WendeRD.使用reagin筛选测试比较血清和血浆标本用于梅毒血清学检查。临床微生物学杂志1980;11:16–8.https://doi.org/10.1128/jcm.11.1.16-18.1980PMID:7354126
- 戴克曼JD、StormsS、HuberTW。一期梅毒中微血凝、梅毒螺旋体抗体吸收和性病研究实验室检测的反应性。临床微生物学杂志1980;12:629–30.https://doi.org/10.1128/jcm.12.4.629-630.1980PMID:6999029
- 格里夫斯AB.早期梅毒血清学检测的比较研究。ArchDermatol1962年;85:641–3.https://doi.org/10.1001/archderm.1962.01590050071013PMID:13901356
- 拉苏斯A,穆斯塔卡利奥KK,阿霍K,普特科宁T.早期梅毒对密螺旋体和类脂质试验的反应性出现顺序。ActaPathol微生物学报1967;69:612–3.https://doi.org/10.1111/j.1699-0463.1967.tb03770.xPMID:6031373
- 文德RD、穆德RL、诺克斯JM、霍尔德WR。322例暗野阳性一期梅毒的VDRL玻片试验。南地中海杂志1971;64:633–4.https://doi.org/10.1097/00007611-197105000-00030PMID:5573085
- GoldenM,O’DonnellM,LukehartS,etal.梅毒螺旋体核酸扩增检测,以增强男男性行为者的梅毒筛查。临床微生物学杂志2019;57:E00572-19。https://doi.org/10.1128/JCM.00572-19PMID:31189578
- HeymansR,vanderHelmJJ,deVriesHJC,FennemaHSA,CoutinhoRA,BruistenSM.梅毒螺旋体实时荧光定量PCR诊断梅毒的临床价值.临床微生物学杂志2010;48:497–502.https://doi.org/10.1128/JCM.00720-09PMID:20007388
- Gayet-AgeronA、NinetB、Toutous-TrelluL等人。评估实时荧光定量PCR检测,以诊断来自不同生物样本的梅毒。2009年性传播感染;85:264–9.https://doi.org/10.1136/sti.2008.034314PMID:19155240
- 王春,程莹,刘斌,等.通过巢式PCR测定法灵敏地检测梅毒患者全血中的梅毒螺旋体DNA。新兴微生物感染2018;7:83。https://doi.org/10.1038/s41426-018-0085-2PMID:29739928
- Costa-SilvaM,CoutinhoD,Sobrinho-SimõesJ,AzevedoF,LisboaC.梅毒螺旋体PCR诊断一期和二期梅毒的横断面研究。国际皮肤病杂志2018;57:46–9.https://doi.org/10.1111/ijd.13823PMID:29090453
- 奥根布劳恩M、罗尔夫斯R、约翰逊R、乔索夫R、教皇五世;梅毒和HIV研究组。梅毒血清诊断的密螺旋体特异性检测。1998年《性变性》;25:549–52.https://doi.org/10.1097/00007435-199811000-00010PMID:9858352
- 拉森SA、HambieEA、佩蒂特DE、佩里曼MW、克劳斯SJ。荧光密螺旋体抗体吸收试验、梅毒螺旋体抗体微量血凝试验和梅毒血凝螺旋体试验的特异性、敏感性和重现性。临床微生物学杂志1981;14:441–5.https://doi.org/10.1128/jcm.14.4.441-445.1981PMID:7026610
- ParkIU,FakileYF,ChowJM,etal.梅毒螺旋体检测用于诊断梅毒。临床感染Dis2019;68:913–8.https://doi.org/10.1093/cid/ciy558PMID:29986091
- ManaviK,YoungH,麦克米兰A.梅毒检测在检测早期梅毒不同阶段方面的敏感性。国际性病艾滋病杂志2006;17:768–71.https://doi.org/10.1258/095646206778691185PMID:17062183
- IjsselmuidenOE,MeinardiMMHM,vanderSluisJJ,MenkeHE,StolzE,vanEijkRVW.用于梅毒快速血清诊断的酶联免疫滤过试验。EurJ临床微生物学杂志1987;6:281–5.https://doi.org/10.1007/BF02017613PMID:3305006
- CoffeyEM,BradfordLL,NaritomiLS,WoodRM.梅毒螺旋体抗体的定性和自动定量微血凝测定的评估。应用微生物学1972;24:26–30.https://doi.org/10.1128/am.24.1.26-30.1972PMID:4560472
- 杨H,莫耶斯A,德圣克鲁瓦一世,麦克米兰A.一种新的重组抗原乳胶凝集试验(梅毒快速),用于梅毒的快速血清学诊断。国际性病艾滋病杂志1998;9:196–200.https://doi.org/10.1258/0956462981922034PMID:9598745
- YoungH,MoyesA,SeagarL,McMillanA.用于梅毒血清学诊断的新型重组抗原酶免疫测定法。临床微生物学杂志1998;36:913–7.https://doi.org/10.1128/JCM.36.4.913-917.1998PMID:9542908
- GratzerB,PohlD,HottonAL.疑似一期梅毒感染病例的诊断血清学结果评估。2014年性变性;41:285–9.https://doi.org/10.1097/OLQ.0000000000000126PMID:24722379
- IjsselmuidenOE、SchoulsLM、StolzE等人。使用重组DNA衍生的梅毒螺旋体蛋白TmpA进行酶联免疫吸附测定的敏感性和特异性,以及TmpA在评估抗生素治疗效果方面的潜在用途。临床微生物学杂志1989;27:152–7.https://doi.org/10.1128/jcm.27.1.152-157.1989PMID:2643617
- 教皇五世,亨特EF,菲利JC。梅毒螺旋体抗原微酶联免疫吸附测定的评估。临床微生物学杂志1982;15:630–4.https://doi.org/10.1128/jcm.15.4.630-634.1982PMID:7040460
- LamTK,LauHY,LeeYP,FungSM,LeungWL,KamKM.INNO-LIA梅毒评分和MarDx梅毒螺旋体免疫球蛋白GMarblot检测测定用于梅毒血清学诊断的比较评估。国际性病艾滋病杂志2010;21:110–3.https://doi.org/10.1258/ijsa.2009.009026PMID:20089996
- ByrneRE,LaskaS,BellM,LarsonD,PhillipsJ,ToddJ.梅毒螺旋体蛋白质免疫印迹测定作为梅毒确认试验的评估。临床微生物学杂志1992;30:115–22.https://doi.org/10.1128/jcm.30.1.115-122.1992PMID:1734042
- IgM特异性酶免疫测定法对梅毒血清诊断的有用性:三种不同测定法的比较评估。J感染2013;67:35–42.https://doi.org/10.1016/j.jinf.2013.03.011PMID:23542782
- vanEijkRV,MenkeHE,TidemanGJ,StolzE.以梅毒螺旋体或噬菌体Tphagedenis生物型Reiter的轴向丝作为抗原的酶联免疫吸附测定:评估作为梅毒的筛查测试。生殖素医学1986;62:367–72.https://doi.org/10.1136/sti.62.6.367PMID:3546079
- CastroR,PrietoES,SantoI,AzevedoJ,ExpostoFL.用于检测梅毒螺旋体抗体的酶免疫测定技术的评估。临床微生物学杂志2003;41:250–3.https://doi.org/10.1128/JCM.41.1.250-253.2003PMID:12517856
- GibowskiM,ZabaR,MachonkoT.使用CAPTIA梅毒M反应检测梅毒患者血清中的特异性IgM-CLASS抗毒螺旋体抗体,并将其与VDRL、FTA-ABS和TPHA反应进行比较。医学科学1998;4:PI882–8。
- GlicksmanJ,ShortD,WendeRD,KnoxJ.即时梅毒筛查;快速血浆Reagin泪滴卡测试的评估。德克萨斯医学1967;63:46–8.
- McMillanA,YoungH.早期梅毒血清学诊断的定性和定量方面。国际性病艾滋病杂志2008;19:620–4.https://doi.org/10.1258/ijsa.2008.008103PMID:18725554
- PopeV,FearsMB,MorrillWE,CastroA,KikkertSE.SerodiaTreponemapallidum颗粒凝集、Captia梅毒-G和SpiroTekReaginII测试与用于诊断梅毒的标准测试技术的比较。临床微生物学杂志2000;38:2543–5.https://doi.org/10.1128/JCM.38.7.2543-2545.2000PMID:10878040
- 德莱莫斯EA,贝伦ZR,桑托斯A,费雷拉AW.获得性梅毒临床阶段蛋白质印迹IgG反应模式的表征。2007年微生物感染诊断;58:177–83.https://doi.org/10.1016/j.diagmicrobio.2006.12.024PMID:17350208
- SinghAE,WongT,DeP.原发性和晚期潜伏梅毒病例的特征,这些病例最初对快速血浆反应素作为筛查试验无反应。国际性病艾滋病杂志2008;19:464–8.https://doi.org/10.1258/ijsa.2007.007302PMID:18574118
- StoneDL,MohengMC,RolihS,SinorLT.Capture-S,一种用于梅毒血清学检测的非密螺旋体固相红细胞粘附测定。临床微生物学杂志1997;35:217–22.https://doi.org/10.1128/jcm.35.1.217-222.1997PMID:8968911
- LefevreJC,BertrandMA,BauriaudR.用于检测梅毒梅毒螺旋体的免疫球蛋白G和M的Captia酶免疫测定的评估。临床微生物学杂志1990;28:1704–7.https://doi.org/10.1128/jcm.28.8.1704-1707.1990PMID:2203809
- MarangoniA、SambriV、AccardoS等人。LIAISON密螺旋体筛查的评估,这是一种用于梅毒实验室诊断的新型重组抗原化学发光免疫测定法。临床诊断实验室免疫学2005;12:1231–4.
- VeldkampJ,VisserAM。酶联免疫吸附测定(ELISA)在梅毒血清诊断中的应用。BrJVenerDis1975年;51:227–31.https://doi.org/10.1136/sti.51.4.227PMID:1098730
- 哈里森KMD,麦肯纳H.梅毒C.S.L.快速血浆反应素(R.P.R.)试验的评估。AustJMedTechnol1976年;7:30–2.
- MalmK、AnderssonS、FredlundH等人。用于诊断梅毒的九种血清学检测的分析评估。JEurAcadDermatolVenereol2015;29:2369–76.https://doi.org/10.1111/jdv.13237PMID:26370737
- 罗曼诺夫斯基B、福西E、普拉萨德E、卢克哈特S、谭M、胡克EW第3名。通过荧光单克隆抗体检测梅毒螺旋体。1987年性变性;14:156–9.https://doi.org/10.1097/00007435-198707000-00007PMID:3310278
- 科尔MJ、佩里KR、帕里合资公司。用于检测梅毒感染的15种血清学检测的比较评估。EurJ临床微生物感染Dis2007;26:705–13.https://doi.org/10.1007/s10096-007-0346-9PMID:17647033
- SaralY,DilekAR,DilekN,BahçeciI,UlusanDZ.梅毒的血清学诊断:不同诊断方法的比较。ActaDermatovenerol克罗地亚2012;20:84–8.PMID:22726280
- WellinghausenN,DietenbergerH.评估两种自动化学发光免疫测定法,即联络密螺旋体筛选和ARCHITECT梅毒TP,以及用于梅毒实验室诊断的梅毒螺旋体颗粒凝集试验。临床化学实验室医学2011;49:1375–7.https://doi.org/10.1515/CCLM.2011.643PMID:21619473
- XiaCS,YueZH,WangH.用于梅毒筛查的三种自动化梅毒螺旋体抗体测定的评估.J感染化学母2018;24:887–91.https://doi.org/10.1016/j.jiac.2018.07.017PMID:30197093
- 徐明,谢莹,江C,等.一种使用重组外膜蛋白rTp0663作为抗原进行梅毒血清学诊断的新型ELISA。IntJInfectDis2016;43:51–7.https://doi.org/10.1016/j.ijid.2015.12.013PMID:26747418
- 杨H、莫耶斯A、罗斯JD。将Captia梅毒G抗密螺旋体IgG酶免疫测定与其他密螺旋体抗原检测进行比较的HIV感染中既往梅毒的标志物。国际性病艾滋病杂志1995;6:101–4.https://doi.org/10.1177/095646249500600207PMID:7779920
- 刘春,欧清,陈晏,等.5种血清学检测梅毒螺旋体的诊断价值及性能评价。临床实验室肛门杂志2014;28:204–9.https://doi.org/10.1002/jcla.21667PMID:24478062
- MarangoniA,MoroniA,AccardoS,CeveniniR.使用自动免疫测定法对梅毒进行实验室诊断。临床实验室肛门杂志2009;23:1–6.https://doi.org/10.1002/jcla.20268PMID:19140205
- MarraCM,TantaloLC,MaxwellCL,HoEL,SahiSK,JonesT.快速血浆反应素试验不能取代用于神经梅毒诊断的性病研究实验室试验。2012年性变性;39:453–7.https://doi.org/10.1097/OLQ.0b013e31824b1cdePMID:22592831
- 朱玲,顾旭,彭瑞,等.脑脊液(CSF)甲苯胺红未加热血清试验和脑脊液快速血浆反应素试验与脑脊液性病研究实验室检测在我国HIV阴性梅毒患者神经梅毒诊断中的比较。临床微生物学杂志2014;52:736–40.https://doi.org/10.1128/JCM.02522-13PMID:24335955
- CastroR,PrietoES,daLuzMartinsPereiraF.非密螺旋体检测在神经梅毒诊断中的应用:性病研究实验室(VDRL)和快速血浆反应素(RPR)检测的评估。临床实验室肛门杂志2008;22:257–61.https://doi.org/10.1002/jcla.20254PMID:18623120
- BoogGHP、LopesJVZ、MahlerJV等。神经梅毒的诊断工具:系统评价。BMC感染2021;21:568。https://doi.org/10.1186/s12879-021-06264-8PMID:34126948
- 哈丁AS,加内姆KG。脑脊液密螺旋体特异性抗体检测在神经梅毒中的性能:系统评价。2012年性变性;39:291–7.https://doi.org/10.1097/OLQ.0b013e31824c0e62PMID:22421696
- BirryA,KasatiyaS.评估微血凝测定以确定脑脊液中的密螺旋体抗体。BrJVenerDis1979年;55:239–44.https://doi.org/10.1136/sti.55.4.239PMID:385012
- MarraCM、CritchlowCW、HookEW3rd、CollierAC、LukehartSA。未经治疗的早期梅毒中的脑脊液密螺旋体抗体。ArchNeurol1995年;52:68–72.https://doi.org/10.1001/archneur.1995.00540250072015PMID:7826278
- MarraCM,TantaloLC,MaxwellCL,DoughertyK,WoodB.用于诊断HIV感染者神经梅毒的替代脑脊液测试。神经病学2004;63:85–8.https://doi.org/10.1212/01.WNL.0000131902.69113.34PMID:15249615
- LugerA,SchmidtBL,SteyrerK,SchonwaldE.通过脑脊液检查诊断神经梅毒。BrJVenerDis1981年;57:232–7.https://doi.org/10.1136/sti.57.4.232PMID:7023601
- HooshmandH,EscobarMR,KopfSW.神经梅毒。一项针对241名患者的研究。美国医学会杂志1972;219:726–9.https://doi.org/10.1001/jama.1972.03190320032011PMID:5066697
- GuarnerJ、JostH、PillayA等人。评估对脑脊液进行的梅毒螺旋体血清检测以诊断神经梅毒。AmJ临床病理学杂志2015;143:479–84.https://doi.org/10.1309/AJCPWSL3G8RXMCQRPMID:25779998
- 张珑珑,林玲玲,刘珂,等.现代HIV阴性患者神经梅毒的临床表现。皮肤科2013;226:148–56.https://doi.org/10.1159/000347109PMID:23615173
- MarraCM、MaxwellCL、DunawaySB、SahiSK、TantaloLC。脑脊液梅毒螺旋体颗粒凝集测定用于神经梅毒诊断。临床微生物学杂志2017;55:1865–70.https://doi.org/10.1128/JCM.00310-17PMID:28381602
- BollemeijerJG、WieringaWG、MissottenTO等。梅毒性葡萄膜炎的临床表现和结局。投资眼科科学2016;57:404–11.https://doi.org/10.1167/iovs.15-17906PMID:26848879
- DaiT,WuX,周S,WangQ,LiD.HIV阴性患者眼部梅毒的临床表现和脑脊液状态.BMC感染2016;16:245。https://doi.org/10.1186/s12879-016-1586-zPMID:27266701
- 耳梅毒:诊断和治疗困境。喉镜1992;102:1255–9.https://doi.org/10.1288/00005537-199211000-00010PMID:1307698
- HughesGB,RutherfordI.耳科梅毒血清学检测的预测价值。AnnOtolRhinolLaryngol1986;95:250–9.https://doi.org/10.1177/000348948609500308PMID:3521437
- KimY,YuSY,郭华.韩国人群中非人类免疫缺陷病毒相关眼部梅毒:临床表现和治疗结果。韩国眼科杂志2016;30:360–8.https://doi.org/10.3341/kjo.2016.30.5.360PMID:27729756
- KunkelJ、SchürmannD、PleyerU等。眼部梅毒——既往未知HIV感染的指标。J感染2009;58:32–6.https://doi.org/10.1016/j.jinf.2008.11.004PMID:19081634
- OrmerodLD、PuklinJE、SobelJD。梅毒性后葡萄膜炎:相关表现和意义。临床感染Dis2001;32:1661–73.https://doi.org/10.1086/320766PMID:11360205
- SpoorTC、RamockiJM、NesiFA、SorscherM.眼部梅毒1986年。FTA-ABS反应性和脑脊液表现的患病率。JClinNeuroophthalmol1987;7:191–7.
- SpoorTC,WynnP,HartelWC,BryanCS.眼部梅毒。急性和慢性。JClinNeuroophthalmol1983;3:197–203.
- TuddenhamS,ObengC,加内姆KG.快速血浆反应素阴性且密螺旋体抗体检测结果阳性者的神经梅毒和眼科梅毒。2015年性变性;42:347–9.https://doi.org/10.1097/OLQ.0000000000000282PMID:25970316
- YimtaeK,SrirompotongS,LertsukprasertK.耳梅毒:85例回顾。耳鼻喉头颈外科2007;136:67–71.https://doi.org/10.1016/j.otohns.2006.08.026PMID:17210336
- RawstronSAMS,MehtaS,MarcellinoL,RempelJ,CheryF,BrombergK.先天性梅毒和荧光密螺旋体抗体检测反应性1岁后。2001年性变性;28:412–6.https://doi.org/10.1097/00007435-200107000-00009PMID:11460026
- PedersenNS,ShellerJP,RatnamAV,HiraSK.用于检测免疫球蛋白M与非密螺旋体和密螺旋体抗原的酶联免疫吸附试验,用于诊断先天性梅毒。临床微生物学杂志1989;27:1835–40.https://doi.org/10.1128/jcm.27.8.1835-1840.1989PMID:2671033
- 罗森欧盟,新泽西州理查森。重新评估IgM荧光密螺旋体抗体吸收试验在先天性梅毒诊断中的价值。JPediatr1975年;87:38–42.https://doi.org/10.1016/S0022-3476(75)80065-5PMID:1097616
- 西莱蒂RP。CAPTIA梅毒G酶免疫测定与快速血浆反应素检测梅毒的比较。临床微生物学杂志1995;33:1829–31.https://doi.org/10.1128/jcm.33.7.1829-1831.1995PMID:7665653
- Manikowska-LesińskaW,LindaB,ZajacW.怀孕期间FTA-ABS和TPHA测试的特异性。BrJVenerDis1978年;54:295–8.https://doi.org/10.1136/sti.54.5.295PMID:361166
- HenrichTJ,YawetzS.年龄、性别和怀孕对使用Captia梅毒G测定法进行梅毒筛查的影响。2011年性变性;38:1126–30.https://doi.org/10.1097/OLQ.0b013e31822e60e1PMID:22082723
- MmejeO、ChowJM、DavidsonL、ShiehJ、SchapiroJM、ParkIU。妊娠期梅毒免疫测定不一致:围产期结局及其对临床管理的影响。临床感染Dis2015;61:1049–53.https://doi.org/10.1093/cid/civ445PMID:26063719
- 巴拉德RC,KoornhofHJ,陈CY,拉德贝F,费勒HG,HtunY.伴随HIV感染对南部非洲一期梅毒血清学诊断的影响。SAfrMedJ2007年;97:1151–4.
- VillanuevaAV、SahouriMJ、OrmerodLD、PuklinJE、ReyesMP。梅毒血清学阳性患者的后葡萄膜炎。ClinInfectDis2000;30:479–85.https://doi.org/10.1086/313689PMID:10722431
- 埃尔南德斯-阿瓜多一世、博卢马尔F、莫雷诺R等人;巴伦西亚艾滋病毒流行病学研究小组。静脉注射吸毒者中与人类免疫缺陷病毒和乙型肝炎病毒感染相关的梅毒假阳性检测。EurJ临床微生物感染Dis1998;17:784–7.https://doi.org/10.1007/s100960050186PMID:9923520
- 乔亚内斯P、博罗比奥MV、阿尔克斯JM、佩雷亚EJ。假阳性快速血浆反应素结果与HIV感染的关联。1998年《性变性》;25:569–71.https://doi.org/10.1097/00007435-199811000-00013PMID:9858355
- GourevitchMN、SelwynPA、DavennyK等人。HIV感染对静脉注射吸毒者血清学表现和梅毒治疗反应的影响。AnnInternMed1993年;118:350–5.https://doi.org/10.7326/0003-4819-118-5-199303010-00005PMID:8094280
- PillayA.美国疾病控制与预防中心梅毒峰会——诊断和实验室问题。2018年性变性;45(增刊1):S13–6。https://doi.org/10.1097/OLQ.0000000000000843PMID:30102681
- BuffetM、GrangePA、GerhardtP等人。通过PCR和免疫组化诊断二期梅毒中的梅毒螺旋体。JInvestDermatol2007年;127:2345–50.https://doi.org/10.1038/sj.jid.5700888PMID:17554371
- 丹尼尔斯KCFH,FerneyhoughHS。梅毒螺旋体的特异性直接荧光抗体检测。健康实验室科学1977;14:164–71.PMID:326728
- GrangePA、GressierL、DionPL等。评估用于检测拭子和血液中梅毒螺旋体的PCR测试。临床微生物学杂志2012;50:546–52.https://doi.org/10.1128/JCM.00702-11PMID:22219306
- HookEW3rd,RoddyRE,LukehartSA,HomJ,HolmesKK,TamMR.用病原体特异性单克隆抗体检测病变渗出液中的梅毒螺旋体。临床微生物学杂志1985;22:241–4.https://doi.org/10.1128/jcm.22.2.241-244.1985PMID:3897267
- 李WS,李MG,钟KY,李JB.组织中梅毒螺旋体的检测:亲和素-生物素-过氧化物酶复合物、间接免疫过氧化物酶、FTA-ABS补体技术和暗场法的比较研究。延世医学杂志1991;32:335–41.https://doi.org/10.3349/ymj.1991.32.4.335PMID:1812655
- GrimprelE、SanchezPJ、WendelGD等。使用聚合酶链反应和兔感染性检测来检测羊水、胎儿和新生儿血清以及脑脊液中的梅毒螺旋体。临床微生物学杂志1991;29:1711–8.https://doi.org/10.1128/jcm.29.8.1711-1718.1991PMID:1761693
- HollierLM,HarstadTW,SanchezPJ,TwicklerDM,WendelGDJr.胎儿梅毒:临床和实验室特征。妇产科2001;97:947–53.
- YobsARBL、BrownL、HunterEF。早期梅毒的荧光抗体技术;应用于证明T.pallidum在兔子和人类病变中的应用。ArchPathol1964年;77:220–5.PMID:14088767
- BehrhofW,SpringerE,BräuningerW,KirkpatrickCJ,WeberA.石蜡包埋皮肤活检标本中梅毒螺旋体的PCR检测:测试设计和对梅毒诊断的影响。临床病理学杂志2008;61:390–5.https://doi.org/10.1136/jcp.2007.046714PMID:17557863
- HoangMP,HighWA,MolbergKH。二期梅毒:组织学和免疫组织化学评估。JCutanPathol2004年;31:595–9.https://doi.org/10.1111/j.0303-6987.2004.00236.xPMID:15330990
- CruzAR、PillayA、ZuluagaAV等。哥伦比亚卡利的二期梅毒:疾病发病机制的新概念。PLoSNeglTropdis2010;4:e690。https://doi.org/10.1371/journal.pntd.0000690PMID:20502522
- ZoechlingN,SchluepenEM,SoyerHP,KerlH,VolkenandtM.二期和三期梅毒中梅毒螺旋体的分子检测。BrJDermatol1997年;136:683–6.https://doi.org/10.1046/j.1365-2133.1997.6561614.xPMID:9205499
- QuatresoozP,皮埃拉尔GE.早期梅毒中梅毒螺旋体的皮肤归巢:免疫组织化学研究。应用免疫组化MolMorphol2009;17:47–50.https://doi.org/10.1097/PAI.0b013e3181788186PMID:18800002
- RawstronSA,VetranoJ,TannisG,BrombergK.先天性梅毒:死产梅毒螺旋体的检测。临床感染Dis1997;24:24–7.https://doi.org/10.1093/clinids/24.1.24PMID:8994751
- 塞纳AC、皮莱A、拉道夫JD。密螺旋体和短螺旋体,人类宿主相关螺旋体[第60章]。在:CarrolKC,LandryML,McAdamAJ等人,编辑。临床微生物学手册。华盛顿特区:ASMPress;2019.
- CastroR,ÁguasMJ,BatistaT,AraújoC,MansinhoK,PereiraFL.通过两种PCR技术检测脑脊液(CSF)中的梅毒螺旋体Sp.pallidumDNA。J临床实验室肛门2016;30:628–32.https://doi.org/10.1002/jcla.21913PMID:26892231
- OrleKA、盖茨CA、MartinDH、BodyBA、WeissJB。同时对生殖器溃疡中的杜克雷嗜血杆菌、梅毒螺旋体和1型和2型单纯疱疹病毒进行PCR检测。临床微生物学杂志1996;34:49–54.https://doi.org/10.1128/jcm.34.1.49-54.1996PMID:8748271
- 帕尔默HM、希金斯SP、鲱鱼AJ、马萨诸塞州金斯敦。在英国,PCR在早期梅毒诊断中的应用。2003年性传播感染;79:479–83.https://doi.org/10.1136/sti.79.6.479PMID:14663125
- 百夫长-拉拉A、卡斯特罗C、谢弗JM、范沃里斯WC、马拉CM、卢克哈特SA。通过灵敏的逆转录酶PCR检测梅毒螺旋体。临床微生物学杂志1997;35:1348–52.https://doi.org/10.1128/jcm.35.6.1348-1352.1997PMID:9163442
- MarraCM、CastroCD、KullerL等人。在非人灵长类动物模型中从脑脊液中清除梅毒螺旋体的机制。神经病学1998;51:957–61.https://doi.org/10.1212/WNL.51.4.957PMID:9781512
- MarraCM、MaxwellCL、SahiSK、TantaloLC、DunawaySB、LukehartSA。既往梅毒会改变随后梅毒发作的病程。临床感染Dis2022;74:E1-5。https://doi.org/10.1093/cid/ciab287PMID:33999990
- TantaloLC,LukehartSA,MarraCM.兔子模型中梅毒螺旋体菌株在神经浸润和临床表型方面的特异性差异。JInfectDis2005年;191:75–80.https://doi.org/10.1086/426510PMID:15593006
- 王C,胡,郑旭,等.用于梅毒诊断的新标本:唾液中梅毒螺旋体DNA含量高的证据。临床感染Dis2021;73:e3250-8。https://doi.org/10.1093/cid/ciaa1613PMID:33099614
- MartinIE,TsangRSW,SutherlandK,etal.加拿大患者梅毒的分子特征:阿奇霉素耐药性和全血样本中梅毒螺旋体DNA与溃疡拭子的检测。临床微生物学杂志2009;47:1668–73.https://doi.org/10.1128/JCM.02392-08PMID:19339468
- YangCJ,ChangSY,WuBR,等.出乎意料的是,在从事无保护性行为的人类免疫缺陷病毒感染早期梅毒患者的口腔中,梅毒螺旋体感染的患病率出乎意料地高。临床微生物感染2015;21:787.e1–7。https://doi.org/10.1016/j.cmi.2015.04.018PMID:25964151
- ChiK-H、DanavallD、TaleoF等。使用实时多重PCR和血清学方法对瓦努阿图临床怀疑为雅司病的皮肤溃疡中的梅毒螺旋体亚种进行分子分化。AmJTropMedHyg2015年;92:134–8.https://doi.org/10.4269/ajtmh.14-0459PMID:25404075
- MichelowIC、WendelGDJr、NorgardMV等。先天性梅毒的中枢神经系统感染。NEnglJMed2002年;346:1792–8.https://doi.org/10.1056/NEJMoa012684PMID:12050339
- SánchezPJ、WendelGDJr、GrimprelE等人。评估分子方法学和兔感染性测试,以诊断先天性梅毒和梅毒螺旋体侵袭新生儿中枢神经系统。JInfectDis1993年;167:148–57.https://doi.org/10.1093/infdis/167.1.148PMID:8418161
- 内森L、博曼VR、桑切斯PJ、狮子座NK、特威克勒DM、小温德尔GD妊娠早期宫内梅毒螺旋体感染。PrenatDiagn1997年;17:119–23.https://doi.org/10.1002/(SICI)1097-0223(199702)17:2<119::AID-PD39>3.0.CO;2-吨PMID:9061759
- 法基尔YF、布林森M、莫布里V、帕克IU、盖诺AM。在诊所和实验室环境中进行梅毒健康检查。2019年性变性;46:250–3.https://doi.org/10.1097/OLQ.0000000000000974PMID:30628945
- 马蒂亚斯J、德威金斯P、托滕Y、布莱克莫尔C、威尔逊C、彼得曼TA。来自现场的笔记。市售快速梅毒检测的敏感性和特异性评估——佛罗里达州埃斯坎比亚县,2016年。MMWRMorbMortalWkly代表2016;65:1174–5.https://doi.org/10.15585/mmwr.mm6542a5PMID:27787496
- ObafemiOA、WendelKA、AndersonTS等。在外展环境中对男男性行为者进行快速梅毒检测:评估检测性能和对治疗时间的影响。2019年性变性;46:191–5.https://doi.org/10.1097/OLQ.0000000000000932PMID:30363029
- FakileYF,MarkowitzN,ZhuW,etal.密歇根州底特律急诊科快速梅毒检测的评估。2019年性变性;46:429–33.https://doi.org/10.1097/OLQ.0000000000000993PMID:30839394
- PereiraLE、McCormickJ、DorjiT等。市售快速梅毒检测的实验室评估。临床微生物学杂志2018;56:E00832-18。https://doi.org/10.1128/JCM.00832-18PMID:30021825
- 汉弗莱斯RM、WooJS、ChungJH、SokovicA、BristowCC、KlausnerJD。用于双重检测HIV和梅毒螺旋体抗体的三种快速诊断测试的实验室评估。临床微生物学杂志2014;52:4394–7.https://doi.org/10.1128/JCM.02468-14PMID:25297332
- LeonSR、RamosLB、VargasSK等。用于快速床旁HIV和梅毒检测的双路径平台检测的实验室评估。临床微生物学杂志2016;54:492–4.https://doi.org/10.1128/JCM.03152-15PMID:26659215
- 疾病预防控制中心梅毒(梅毒螺旋体)2018年病例定义。佐治亚州亚特兰大:美国卫生与公众服务部,CDC;2018.https://ndc.services.cdc.gov/case-definitions/syphilis-2018/#:~:text=Syphilis%20is%20a%20sexually%20transmitted,contact%20with%20a%20syphilitic%20chancre
公共卫生实验室协会。梅毒血清学检测的建议报告语言。马里兰州银泉市:公共卫生实验室协会;2020.https://www.aphl.org/programs/infectious_disease/std/Documents/ID-2020Aug-Syphilis-Reporting-Language.pdf
本文的建议引用:PappJR,ParkIU,FakileY,PereiraL,PillayA,BolanGA.CDC实验室对梅毒检测的建议,美国,2024年。MMWRRecommRep2024;73(编号)RR-1):1–32。DOI:http://dx.doi.org/10.15585/mmwr.rr7301a1.
最后审核日期:2024年2月6日
资料来源:美国疾病控制与预防中心
Hits: 326

被恐惧折磨的人,请求孟老师的帮助。
关于加强针和有效保护期
首先是接种史,22年打过一次一针预防,23年有暴露被猫抓破,打了0-3两针,然后24年1月突然发现头上有伤口,明显破皮出血。
问题1,我的0-3两针有什么效果,加上之前的一针,这两针属于全程,还是加强了,
问题2,如果是加强针,那么有没有半年的绝对保护期和3年的有效保护期,
问题3 ,这次暴露距离上次最后一针已经刚好10个月了,按照孟老师和严老师的说法,目前是在有效保护期内,那么我这次需要再接种嘛
问题4-有效保护期可以保护那种程度的伤口,如果伤口在头上呢,有明显破皮出血,但不严重,伤口几天就结痂好了,这种情况要不要继续接种
1.加强;
2.保护至少1年,也许更长;
3.不需要;
4.你和喜欢打针,那就去看医生;
5.个人观点供参考,其它谨遵医嘱;如果需要了解更多相关知识,请阅读疫苗网相关文献参见基于狂犬病中和抗体水平的狂犬病加强剂时机指南