变异适应的新冠肺炎加强疫苗
FLORIAN KRAMMER 和 ALI H. ELLEBEDY
严重急性呼吸综合征冠状病毒-2(SARS-CoV-2)疫苗大大减轻了新冠肺炎疫情的负担,拯救了数百万人的生命(1)。然而,循环中和抗体水平的下降和令人担忧的新型冠状病毒变种的不断出现降低了疫苗效力,并促使需要加强免疫。一些变异体在抗原性上与原始毒株相差甚远,这推动了变异体适应疫苗的发展。免疫力下降和病毒变异在免疫保护方面的纠缠、更新疫苗中的变异体选择、这些疫苗诱导对新变异体的从头反应的有效性以及未来何时改变它们仍然是突出的知识空白。
新型冠状病毒疫苗的初级系列于2020年底和2021年初推出。这些免疫接种引发了高水平的刺突特异性抗体(其识别在新型冠状病毒表面表达的刺突蛋白),该抗体在接种后的最初几个月内显著下降(10-15倍)(2)。这种下降与2021年春夏北半球Delta变体的出现和传播相吻合。虽然疫苗诱导的抗体反应的衰减引起了一些关注,但它可以通过B细胞对疫苗接种反应的动力学来解释:最初的抗体波是由短命的成浆细胞产生的,成浆细胞是应答B细胞的终末分化亚群(3)。由这种初始反应在接种个体的血清中产生的抗体具有数周的半衰期;因此,在接种疫苗后的几个月内,循环抗体滴度缓慢下降。然而,血清峰值抗体水平在疫苗接种后6至9个月开始趋于稳定(2),说明诱导了长寿骨髓浆细胞。该子集可能会在主机的整个生命周期内持续存在。中和血清抗体滴度与保护免受有症状的新型冠状病毒感染密切相关(4)。中和抗体水平下降导致突破性感染的可能性更高,特别是出现新的变异。当推广加强剂量时,血清抗体水平再次升高,与加强前水平相比,长期抗体滴度稳定在较高的基线水平。因此,第三次疫苗剂量对于长期保护可能是重要的,并且可以被认为是例如儿童的初级疫苗接种方案的一部分。
令人担忧的变异体的出现使基于原型新型冠状病毒毒株的疫苗免疫后获得保护之间相对简单的关系变得复杂(5)。至关重要的是,要从新出现的变异免疫逃逸中理清免疫力下降的问题。最初,Delta变体引起广泛的突破性感染,但与同时期的Beta变体相比,它没有强烈的直接免疫逃逸表型。但是Delta在上呼吸道中有效地复制,并且在感染和症状发作之间具有较短的潜伏期(6, 7)。这些特性是间接的免疫逃逸机制:上呼吸道中更多的复制意味着更多的病毒脱落,这反过来意味着与感染者接触的个体可能会吸入更高的病毒载量。这种增加的负荷会压倒原有的免疫力,导致更高的突破性感染的机会。较短的潜伏期限制了在感染出现症状之前唤起免疫反应的时间。
当第一个Omicron刺突序列于2021年秋季在北半球出现时,很明显这种变体将具有广泛的直接免疫逃逸,因为中和抗体靶向的许多抗原位点发生了变化。此外,Omicron及其亚变异体还具有短的孵育时间,甚至比Delta变异体的孵育时间更短,使得回忆(记忆)免疫反应在防止症状感染(7)。当针对Omicron变异体进行测试时,由于传统疫苗诱导的中和血清抗体滴度显著下降,含有来自传统和Omicron BA.5变异体的刺突的更新疫苗于2022年秋季获得美国美国食品药品监督管理局(FDA)的许可。类似地,欧洲药品管理局(EMA)批准了第一批含有原型和BA.1刺突的二价疫苗,随后批准了另一种含有原型和BA.5刺突的二价疫苗。
将原型刺突疫苗与二价原型+BA.1刺突(Moderna和Pfizer)或单价BA.1刺突(Pfizer)进行比较的临床试验表明,与由原型疫苗诱导的抗体滴度相比,这些更新的疫苗诱导了针对BA.1的稍好的中和抗体滴度。值得注意的是,在直接比较中,单价BA.1疫苗比二价疫苗表现更好(8)。在推出二价原型+BA.5疫苗(在获得许可前尚未进行临床试验)后,主要问题是,与单价原型加强疫苗相比,这些疫苗是否会诱导针对BA.5和更新的Omicron亚变异体的更高中和抗体滴度。几项研究表明,由更新的疫苗诱导的滴度仅略微更高,而其他研究显示了显著的差异(9–12)。
然而,这些比较中的许多都因从接种个体收集血清样本的时间而变得复杂,样本来自于2022年上半年收集的接受单价原型加强剂的个体和2022年秋季晚些时候收集的接受二价加强剂的个体。二价加强免疫接受者可能在这两个时间点之间经历了突破性感染,这可能会使比较产生偏差。然而,在欧洲的疫苗首次展示允许直接比较由二价BA.1和二价BA.5加强剂诱导的抗体滴度。一项研究表明,二价BA.5疫苗对BA.5的反应略有偏差,而二价BA.1疫苗对BA.1的反应没有偏差,这可能是由于固有的较低免疫原性(13)。这一结果强调了刺突之间可能固有的免疫原性差异,在选择新的疫苗毒株时应予以考虑。
一个关键的问题是,用更新的变异体接种疫苗是否会诱导对该毒株的从头应答,或者是否只会产生针对共有表位的回忆应答。例如,已经观察到,对于流感病毒,第一次接触抗原会留下免疫印记——免疫记忆——然后使对新的但相关的毒株的反应偏向于初始毒株和新毒株之间共有的表位,而对新毒株几乎没有特异性的从头反应。对于新冠肺炎疫苗,由二价疫苗诱导的血清抗体滴度由特异于原始刺突的抗体和在两个刺突之间交叉反应的抗体(14)。然而,在二价BA.5疫苗接受者的血清样品中没有检测到BA.5特异性反应性(14)。这表明对二价BA.5疫苗接种的初始反应主要是集中于共有表位的回忆反应(见图)。一贯地,从用单价BA.1疫苗加强的个体中分离的378种记忆B细胞衍生的刺突单克隆抗体(mAbs)中只有6种识别BA.1刺突蛋白,但不识别原型蛋白(15)。所有剩余的单克隆抗体鉴定了两种刺突蛋白。这些数据表明,尽管在加强免疫接种后血清中检测不到BA.1或BA.5刺突序列特异性反应性,但免疫系统能够诱导BA.1和BA.5特异性B细胞成为记忆B细胞库的一部分。
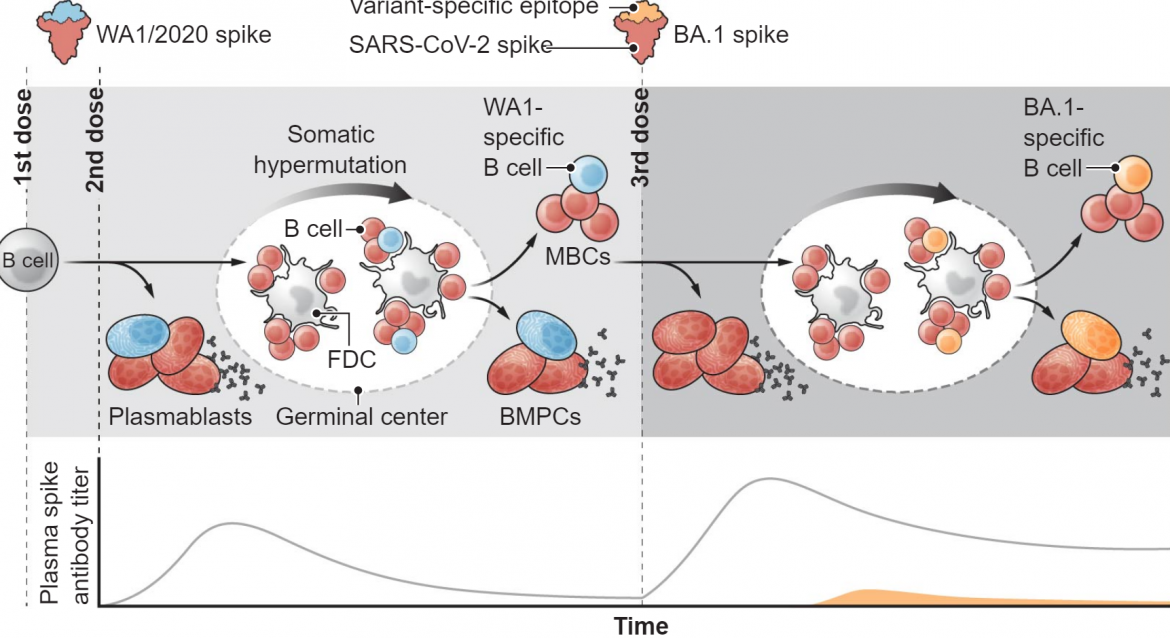
B细胞和抗体对新冠肺炎疫苗应答的动态变化
基于原始系列(WA1/2020刺突蛋白)严重急性呼吸综合征冠状病毒2型(新型冠状病毒)疫苗的免疫接种,随后用基于变异体的疫苗(BA.1刺突)加强,最初引发刺突特异性B细胞的亚群,其快速增殖并分化为分泌抗体的短命浆母细胞。一些活化的B细胞形成生发中心反应,其中应答的B细胞克隆经历反复的体细胞超突变和其B细胞受体针对由滤泡树突细胞(FDCs)呈递的激发抗原的亲和力成熟。生发中心的毕业生分化为长寿骨髓浆细胞(BMPCs)和循环记忆B细胞(MBC)。发展为识别原型刺突蛋白的细胞也可能与新的变异刺突(红色)交叉反应,而其他细胞可能是变异特异性的(蓝色和橙色)。
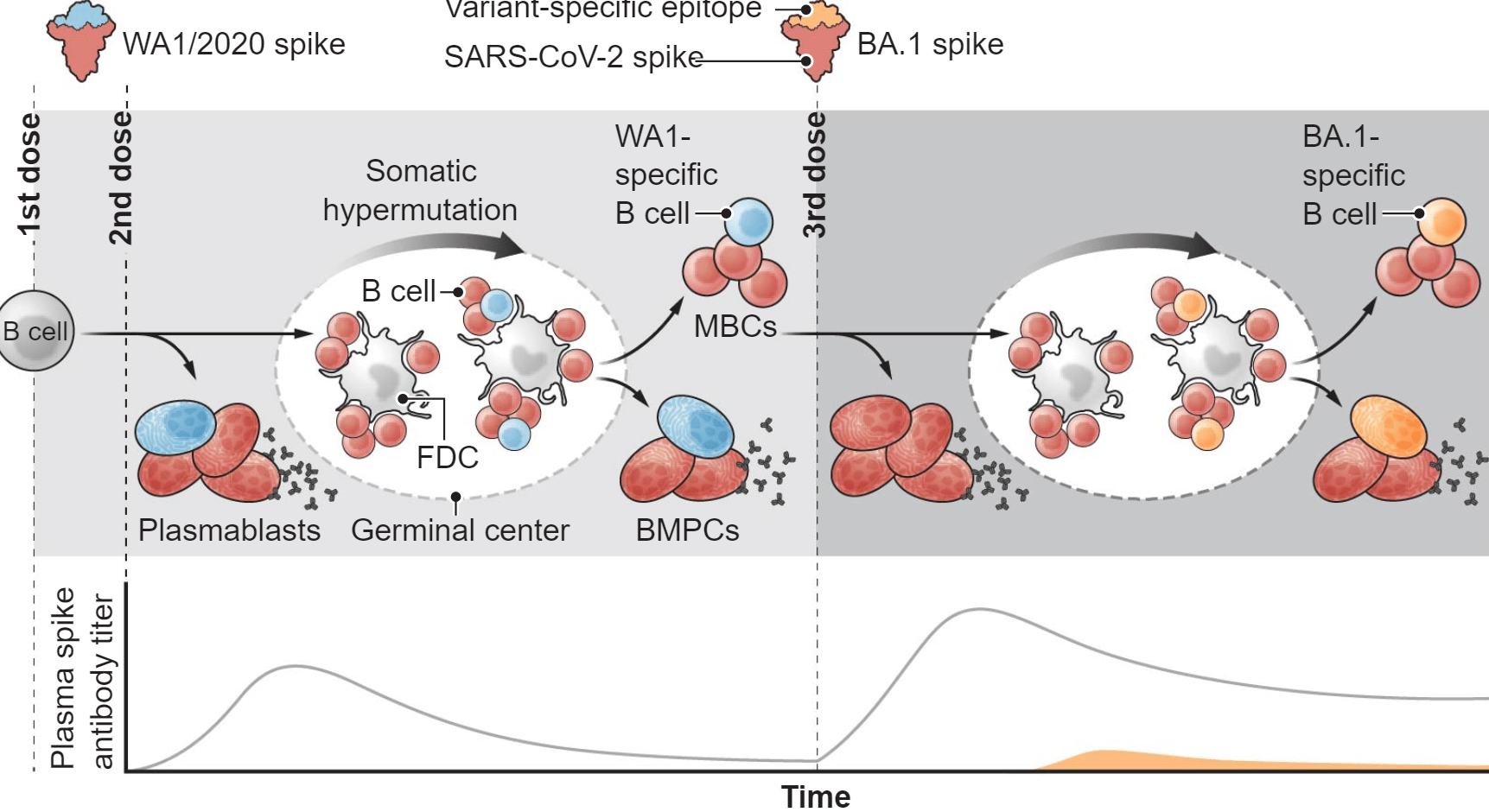
这些发现不一定是坏消息。交叉反应性B细胞可以表达中和抗体,该中和抗体已经以高亲和力与新变体结合。一些可能以低亲和力结合,但可以经历额外的亲和力成熟以增强与刺突抗原的结合。抗体-抗原相互作用的生物化学解决方案针对已改变的抗原进行了重新优化,而不是寻找新的结合解决方案,这是有道理的。值得注意的是,如果两者以相同的滴度存在,有效中和的交叉反应性抗体与具有相同效力的新毒株特异性中和抗体一样好。因此,交叉反应中和抗体很可能和菌株特异性抗体一样具有保护作用。此外,在记忆区室中检测到的从头反应,即使以非常低的频率发生,也可以通过遇到与Omicron相关的变异病毒而扩大。总的来说,考虑到同源刺突抗原参与交叉反应性记忆B细胞的效率,在加强免疫中继续包括原型毒株是非常值得怀疑的。
与此同时,新型冠状病毒并没有停止发展。最后一个显性BA.5后代BQ.1.1已被XBB谱系的重组BA.2后代(包括EG.5)所竞争,其频率正在增加,并显示出更强的免疫逃逸表型。最近还检测到一个新的BA.2衍生谱系BA.2.86,其特征在于大量的氨基酸变化。FDA、EMA和世界卫生组织(WHO)已建议新冠肺炎疫苗应在2023年秋季再次更新,并且可能每年建议包含最新变异体的年度加强剂量,类似于流感病毒疫苗。应该包括哪种毒株?在2023年秋季更新的加强剂量中包括原型毒株是没有用的,因此FDA、EMA和世卫组织推荐更新为基于XBB的单价疫苗,优先选择XBB.1.5是有意义的。
目前还不清楚每年更新新型冠状病毒疫苗是否是最好的解决方案。还不知道mRNA疫苗平台是否最适合更新的加强剂,或者替代平台(如基于重组蛋白的疫苗或新技术)或异源加强是否会更有效,更容易被人群接受。更新疫苗应该注射一次还是两次?疫苗公平性是疫情期间出现的一个重要问题,如果需要,如何向全球人口提供年度加强剂仍未解决。此外,疫苗应该提供给所有人还是只提供给高度脆弱的人群?哪种方案最适合新型冠状病毒的不停变化?实际上,每当出现新的变异时,年度加强剂量比临时加强剂量更容易实施。然而,对于健康的个体来说,可能不需要每年加强免疫,只有当更致命的变异出现时才加强免疫可能更合适。在这种情况下,间隔一个月给予两次剂量可能会增强变异体特异性反应。相比之下,对于患有使其易受新冠肺炎病毒感染的原有疾病的个体,定期的年度加强免疫可能会增加对严重疾病的保护,而不考虑正在传播的变体。
虽然类似的系统已用于流感疫苗,但从长远来看,“流感模型”可能不是新型冠状病毒的最佳解决方案。事实上,正在设计新一代流感病毒疫苗,以提供更广泛和更持久的保护,而不依赖于病毒的抗原变化,并取代目前的年度疫苗接种。新型冠状病毒迫切需要类似的广泛保护性疫苗,可能经粘膜(如鼻内)给药。这些疫苗将在对抗这种病毒快速进化的持续斗争中提供急需的优势。
References and Notes
1F. Krammer, Semin. Immunopathol (2023).
2K. Srivastava et al., medRxiv (2023).
3B. J. Laidlaw, A. H. Ellebedy, Nat. Rev. Immunol. 22, 7 (2022).
4W. Kim et al., Nature 604, 141 (2022).
5P. B. Gilbert et al., Science 375, 43 (2022).
6C. J. H. von Wintersdorff et al., Sci. Rep. 12, 13922 (2022).
7Y. Wu et al., JAMA Netw. Open 5, e2228008 (2022).
8Vaccines and Related Biological Products Advisory Committee June 28, 2022 Meeting Announcement; https://www.fda.gov/advisory-committees/advisorycommittee-calendar/vaccines-and-related-biologicalproducts-advisory-committee-june-28-2022-meetingannouncement.
9A. Y. Collier et al., N. Engl. J. Med. 388, 565 (2023).
10Q. Wang et al., N. Engl. J. Med. 388, 567 (2023).
11M. E. Davis-Gardner et al., N. Engl. J. Med. 388, 183 (2023).
12P. Qu et al., bioRxiv (2023).
13D. N. Springer et al., NPJ Vaccines 8, 110 (2023).
14J. M. Carreño et al., Lancet Microbe 4, e569 (2023).
15W. B. Alsoussi et al., Nature 617, 592 (2023).
https://www.science.org/doi/full/10.1126/science.adh2712
Hits: 17