Contents
第14章:霍乱
2013年12月
霍乱 须申报
疾病
霍乱是一种急性腹泻疾病,由革兰氏阴性细菌霍乱弧菌引起。在小肠定居后,霍乱弧菌产生一种肠毒素,引起液体和电解质的分泌,并导致无痛的水样腹泻。霍乱的特征是突然出现大量水样便,偶尔伴有呕吐。在严重疾病中,脱水、代谢性酸中毒和循环衰竭可能会迅速发生。未经治疗,超过50%的最严重病例在发病数小时内死亡;通过及时、正确的治疗,死亡率低于1%。只有中度腹泻的轻度病例也会发生,无症状感染很常见。潜伏期通常为两至五天,但也可能只有几个小时。
该疾病主要通过食入粪便污染的水或贝类和其他食物传播。人与人之间的传播可能通过粪便-口腔途径发生。即使在受感染的地区,对旅行者的风险也很小。
霍乱血清群O1按生物型(经典型或埃尔托型)分类,并进一步分为亚型(小川奈那型或稻叶型)。在世界范围内,霍乱弧菌El Tor目前是主要的生物型,小川奈那是主要的亚型。
疾病的历史和流行病学
英格兰和威尔士最后一例本土霍乱病例是在1893年报告的。偶尔会出现输入性病例,但在拥有现代卫生设施和水供应以及高标准食品卫生的国家,疫情爆发的风险非常小。在英格兰、威尔士和北爱尔兰,从1990年到2001年报告了126例霍乱实验室通知(Lawrence和Jones,2004)。其中64%是从印度次大陆进口的。关于英格兰和威尔士报告的霍乱病例的最新流行病学数据,请参见:http://www.hpa.org.uk/Topics/InfectiousDiseases/InfectionsAZ/Cholera/EpidemiologicalData/。在过去两年中,由霍乱弧菌的经典生物型引起的霍乱在西孟加拉邦和孟加拉国的恒河三角洲流行导致流行病和全球性流行病。第七次全球疫情始于1961年,是由于El Tor生物型,现在广泛分布于亚洲和非洲;中美洲和南美洲在20世纪90年代早期和中期受到影响,但在很大程度上控制了疾病。产生类似症状的霍乱弧菌(O139)的一个新血清群于20世纪90年代初在孟加拉湾出现,现在东南亚和中国也存在,并且是这些地区约15%报告的霍乱病例的原因(世界卫生组织,2004)。
2003年,45个国家向世界卫生组织(WHO)正式报告了111,575例霍乱病例和1,894例死亡(WHO,2004年),总病死率为1.7%。在某些弱势群体和高风险地区,病死率高达41%。由于漏报和监测系统的局限性,这些病例和死亡报告被认为严重低估了实际数字。2003年,非洲国家(特别是刚果民主共和国、利比亚、莫桑比克、索马里和乌干达)占报告病例的96%。有关来自世卫组织的全球霍乱报告的最新流行病学信息,请参见:http://www.who.int/cholera/statistics/en/index.html。
霍乱的预防主要依赖于改善流行地区的卫生和水供应,以及一丝不苟的个人、食物和水卫生。虽然新的口服霍乱疫苗可以提供针对O1群霍乱弧菌的个体保护,但它们在地方病和疫情中的作用尚未确定(世WHO,2004)。自1973年世卫组织将霍乱疫苗从《国际卫生条例》中删除以来,国家间旅行不再需要霍乱疫苗(WHO,1983年)。
自2004年5月以来,在英国获得许可的唯一霍乱疫苗是Dukoral,这是一种含有重组霍乱毒素B亚单位(rCTB)的灭活霍乱弧菌全细胞(WC)疫苗,口服接种。肌肉注射霍乱疫苗不再被推荐使用。
全细胞B亚单位疫苗(WC-rCTB,在开发重组霍乱毒素之前使用纯化的霍乱毒素)已在孟加拉国和秘鲁的试验中进行了保护效力评估。在孟加拉国的试验中,三剂疫苗在6个月时对2至15岁的儿童和15岁以上的妇女显示了85%的保护效力(95%置信区间56%–94%)(Clemens et al., 1986; Clemens et al., 1990)。
该疫苗对2-5岁儿童的保护效力迅速减弱,因此,在接种后36个月,累积保护效力为26%,相比之下,5岁以上儿童和成人的保护效力为63%。根据该数据,成人需要两剂疫苗,两年后需要加强剂量。幼儿需要三剂疫苗来建立有效的免疫力(Clemens et al., 1987),六个月后再加强一剂。
在秘鲁进行的一项在年轻的成年新兵中使用两剂疫苗(WC-rCTB)的试验表明,在大约四个月时,保护效力为86%(95%置信区间,36%-97%)(Sánchez et al., 1994)。这项试验是在秘鲁的一项早期试验之后进行的,该试验没有达到同样高的保护水平(Taylor et al., 2000)。在一项针对北美志愿者的挑战性研究中,三剂WC-rCTB提供了64%的保护作用(Black et al., 1987)。
霍乱疫苗接种
口服灭活霍乱疫苗(Dukoral)是英国唯一获得许可的霍乱疫苗。在四株被杀死的霍乱弧菌O1的液体悬浮液中,它含有1毫克重组霍乱毒素B (rCTB),代表Inaba和Ogawa亚型以及El Tor和classical生物型(每批25个 109个细菌)。如下所示,将该悬浮液与缓冲液和水混合。
该疫苗不含硫柳汞。它是灭活的,不含活的有机体,不会引起它所保护的疾病。它不包含引起毒素致病性的霍乱毒素A亚单位。
储存
疫苗应储存在+2℃至+8℃的原包装中,并避光保存。所有疫苗在某种程度上都对冷热敏感。高温加速了大多数疫苗效力的下降,从而缩短了它们的保质期。除非储存在正确的温度下,否则无法保证疫苗的有效性。冷冻可能导致某些疫苗的反应原性增加和效力丧失。它还会在容器中产生细小的裂纹,导致内容物被污染。
剂型
口服霍乱疫苗以装在玻璃瓶中的大约3ml白色悬浮液的形式提供。还提供了一小袋碳酸氢钠白色颗粒,应按如下所述与水混合(见图14.1)。
剂量和时间表
六岁以上的成人和儿童
- 第0天接种第一剂疫苗。
- 第一剂后一至六周内第二剂。
每剂疫苗应溶解在150ml配制好的缓冲溶液中。
为了持续保护,应在适当的时间间隔给予加强剂量(见第105页)。
两岁至六岁的儿童
- 第0天接种第一剂疫苗。
- 第一剂后一至六周内第二剂。
- 第二次注射后一至六周内注射第三次。
每剂疫苗应溶解在75ml准备好的缓冲液中。
接种
接种疫苗前一小时和后一小时应避免饮食。在接种疫苗前后一小时内,应避免口服其他药物。
碳酸氢钠缓冲液以泡腾颗粒的形式提供,应溶解在一次性塑料杯中约150ml的冷水中。对于2至6岁的儿童,应丢弃一半的缓冲溶液。对于6岁以上的儿童和成人,应使用全部150ml缓冲溶液(见图14.1)。
然后将适当体积的溶液与发白的疫苗悬浮液混合,得到无色、略带乳白色的液体。疫苗必须在复原后两小时内饮用。
霍乱疫苗可以在注释疫苗的同时接种。
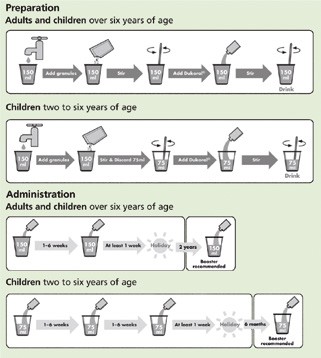
图14.1口服霍乱疫苗的准备和接种
处理
用于接种疫苗的设备,包括用过的小瓶或安瓿,应在每次接种结束后,密封在一个合适的防刺穿“锐器”盒中进行处置(未批准,BS 7320)。塑料杯可以放在黄色的医疗废物袋中处理。
疫苗使用建议
霍乱免疫接种计划的目的是保护那些最有可能患严重疾病或死于该疾病的人。霍乱疫苗适用于被认为有霍乱风险的成人和两岁以上的儿童旅行者针对由O1群霍乱弧菌引起的疾病进行主动免疫接种。根据输入欧洲和北美的病例,一般估计旅行者患霍乱的风险为每百万旅行者2至3例(Mahon et al., 1996; Morger et al., 1983; Wittlinger et al., 1995; Sánchez and Taylor, 1997)。
在进行全面风险评估后,可以考虑对以下类别的旅行者进行霍乱免疫接种(JCVI,2004):
- 救济或灾难援助人员
- 在霍乱流行地区有偏远路线且获得医疗服务有限的人
- 前往潜在霍乱危险地区的旅行者,对他们来说,接种疫苗被认为是潜在有益的。
不应要求任何旅行者证明接种了霍乱疫苗。一些偏远边境的官员偶尔会要求来自疫区的人出示免疫证明。应该建议有可能穿越这种边界,特别是陆路边界的旅行者携带一份在官方文件上签名的声明,声明不需要霍乱疫苗(Lea and Leese, 2001)。
该疫苗不推荐用于预防旅行者腹泻综合征,因为它只能预防产肠毒素性大肠杆菌(LT-ETEC)的不耐热毒素。LT-ETEC对旅行者腹泻的影响是可变的,通常很小。它只是导致这种综合征的许多细菌、病毒和原生动物中的一种。
面临职业风险的个人
建议在工作过程中可能经常接触霍乱的实验室工作人员接种疫苗。这通常只包括在参考实验室或传染病部门附属实验室工作的人员。
初级免疫接种
如果第一次和第二次接种间隔超过6周,或者如果距离最后一次接种间隔超过两年,则必须重新开始免疫的初级过程。这些建议是这种疫苗独有的。
成人和六岁以上的儿童
用这种霍乱疫苗接种的标准初级过程包括两次剂量,间隔至少一周,但两次剂量之间不到六周。
两岁至六岁的儿童
用这种霍乱疫苗接种的标准初级疗程包括三次剂量,间隔至少一周,但两次剂量之间间隔少于六周。
如果两次注射间隔超过6周,应重新开始初级免疫程序。
免疫接种应在可能接触O1群霍乱弧菌前至少一周完成。
两岁以下的儿童
尚未研究这种霍乱疫苗对1至2岁儿童的保护效力。因此,不建议两岁以下的儿童接种霍乱疫苗。
加强免疫
为了持续预防霍乱,建议成人和六岁以上儿童在完成初次免疫两年后,以及两岁至六岁儿童在六个月后,进行一次加强接种。没有关于重复加强剂量的临床疗效数据。
如果距离最后一次疫苗接种已过去两年以上,则应重复第一疗程。这种疫苗独特之处在于需要重复免疫的初级过程。
没有关于该疫苗在加强剂量接种后对霍乱的保护效力的临床数据。
禁忌症
极少数人不能接受推荐的口服霍乱疫苗。如有疑问,应向旅行健康专家寻求适当的建议。
疫苗不应注射给患有以下疾病的人:
- 对先前剂量的口服霍乱疫苗的确认过敏反应,或
- 对甲醛或任何疫苗成分的过敏反应。
预防措施
没有发烧或全身不适的小病不是推迟免疫接种的正当理由。
如果个人急性不适,免疫接种可能会推迟,直到他们完全康复。这是为了避免由于错误地将任何体征或症状归因于疫苗的副作用而混淆任何急性疾病的鉴别诊断。
霍乱疫苗可提供针对O1群霍乱弧菌的保护。免疫接种不能预防霍乱弧菌血清群O139或其他弧菌。疫苗接种不能替代坚持标准的保护性卫生措施以避免霍乱。
患有急性胃肠道疾病的人应推迟接种疫苗。先前存在的胃肠道疾病不是接种疫苗的禁忌症。
怀孕和母乳喂养
尚无关于口服霍乱疫苗对孕妇或哺乳期妇女安全性的数据。没有证据表明给孕妇或哺乳期妇女接种灭活病毒或细菌疫苗或类毒素有风险(Plotkin and Orenstein, 2004)。如果患霍乱的风险很高,那么在这种情况下应该考虑接种疫苗。
免疫抑制和艾滋病毒感染
根据上述建议,应考虑对免疫抑制或HIV感染的个体(无论CD4计数如何)进行霍乱疫苗接种。然而,如果这些人受到免疫抑制,他们可能不会产生完全的抗体反应,而且疫苗的保护效力尚未得到研究。可能需要专家的建议。
皇家儿科和儿童健康学院(www.rcpch.ac.uk)、英国艾滋病毒协会(BHIVA)艾滋病毒感染成人免疫指南(BHIVA,2006)和英国和爱尔兰儿童艾滋病毒协会(CHIVA)免疫指南提供了进一步的指导(www.bhiva.org/chiva)。
不良反应
试验中描述的服用口服霍乱疫苗的个体与摄入无疫苗缓冲液的个体的不良事件具有可比性,在11%至14%的范围内(Sánchez et al., 1997)。
这种疫苗在瑞典和挪威已经售出超过100万剂。根据临床试验和上市后监测的被动报告,轻度胃肠道症状(腹痛、痉挛、腹泻、恶心)是最常见的报告症状,发生频率为0.1%至1%。严重的不良事件,包括流感样综合征、皮疹、关节痛和感觉异常是罕见的,在分发的每10,000剂中发生不到1次(Summary of Product Characteristics, 2004)。
病例、接触和暴发的管理
由于霍乱在英国是一种应报告的疾病,为了对病例、接触者和疫情进行公共卫生管理,所有疑似病例都应立即报告给当地卫生保护单位。应识别传染源并进行适当治疗。霍乱患者的接触者应保持高标准的个人卫生,以避免被感染。在英国,霍乱疫苗在管理病例接触或控制感染传播方面不起作用;这种疾病的控制取决于公共卫生措施。
供应
Dukoral®口服灭活霍乱疫苗由Crucell提供
(电话:084 4800 3907)。
参考
Black RE, Levine MM, Clements ML et al. (1987) Protective efficacy in humans of killed whole-vibrio oral cholera vaccine with and without the B subunit of cholera toxin. InfectImmun 55: 1116–20.
British HIV Association (2006) Immunisation guidelines for HIV-infected adults: www.bhiva.org/pdf/2006/Immunisation506.pdf.
Clemens JD, Sack DA, Harris JR et al. (1986) Field trial of oral cholera vaccines inBangladesh. Lancet 2: 124–7.
Clemens JD, Stanton BF, Chakraborty J et al. (1987) B subunit-whole-cell and whole-cellonly oral vaccines against cholera: studies on reactogenicity and immunogenicity. J Infect Dis 155: 79–85.
Clemens JD, Sack DA, Harris JR et al. (1990) Field trial of oral cholera vaccines inBangladesh: results from three-year follow-up. Lancet 1: 270–3.
Joint Committee on Vaccination and Immunisation. Minutes from the Joint Committee
of Vaccination and Immunisation meeting: 4 June 2004.(www.advisorybodies.doh.gov.uk/jcvi/mins040604.htm).
Lawrence J and Jones J (eds) (2004) Illness in England, Wales, and Northern Ireland
associated with foreign travel. London: Health Protection Agency.
Lea G and Leese J (eds) (2001) Health information for overseas travel. London: The Stationery Office.
Mahon BE, Mintz ED, Greene KD et al., (1996) Reported cholera in the United States, 1992–1994. JAMA 276: 307–12.
Morger H, Steffen R and Schär M (1983) Epidemiology of cholera in travellers, and conclusions for vaccination recommendations. BMJ 286: 184–6.
Novartis Vaccines (2004) Summary of Product Characteristics. Dukoral®. Oxford: Novartis Vaccines.
Plotkin SA and Orenstein WA (eds) (2004) Vaccines, 4th edition. Philadelphia: WB Saunders Company.
Sánchez JL, Trofa AF, Taylor DN et al. (1993) Safety and immunogenicity of the oral, whole-cell/recombinant-B-subunit cholera vaccine in North American volunteers. J Infect Dis 167: 1446–9.
Sánchez JL, Vasquez B, Begue RE et al. (1994) Protective efficacy of oral whole-cell/ recombinant-B-subunit cholera vaccine in Peruvian military recruits. Lancet 344: 1273–6.Sánchez JL and Taylor DN (1997) Cholera. Lancet 349: 1825–30.
Taylor DN, Cardenas V, Sánchez JL et al. (2000) Two-year study of the protective efficacy of the oral whole-cell plus recombinant-B-subunit cholera vaccine in Peru. J Infect Dis 181: 1667–73.
Wittlinger F, Steffen R, Watanabe H and Handszuh H (1995) Risk of cholera among Western and Japanese travelers. Journal of Travel Medicine 2: 154–8.
World Health Organization (1983) International health regulations 1969. Geneva: WHO. WHO (2004) Cholera, 2003. Weekly Epidemiological Record 2004; 79: 281–8.
霍乱
2013年12月
Hits: 43

