Contents
- 1 第17章:甲型肝炎
- 1.1 疾病
- 1.2 疾病的历史和流行病学
- 1.3 甲型肝炎疫苗接种
- 1.4 单价疫苗
- 1.5 甲型和乙型肝炎联合疫苗
- 1.6 甲型肝炎和伤寒联合疫苗
- 1.7 人类正常免疫球蛋白
- 1.8 储存
- 1.9 剂型
- 1.10 剂量和时间表
- 1.11 HNIG剂量
- 1.12 管理
- 1.13 处理
- 1.14 暴露前免疫接种疫苗的使用建议
- 1.15 建议接受接触前免疫接种的人群
- 1.16 面临职业风险的个人
- 1.17 暴露后免疫接种
- 1.18 甲型肝炎感染病例的接触者
- 1.19 爆发
- 1.20 初级免疫接种
- 1.21 加强免疫
- 1.22 第二剂延迟接种
- 1.23 禁忌症
- 1.24 预防措施
- 1.25 HNIG
- 1.26 怀孕和母乳喂养
- 1.27 免疫抑制和艾滋病毒感染
- 1.28 不良反应
- 1.29 供应
- 1.30 参考
第17章:甲型肝炎
甲型肝炎 须呈报
疾病
甲型肝炎是由甲型肝炎病毒引起的肝脏感染。这种疾病一般较轻,但随着年龄的增长,严重程度会增加。无症状的疾病在儿童中很常见。70-80%的成年感染者可能会出现黄疸。暴发性肝炎可能发生,但很罕见。总体病死率较低,但在老年患者和已有肝病史的患者中较高。没有慢性持续状态,也不会发生慢性肝损伤。
这种病毒通常通过人与人之间的传播或受污染的食物或饮料经粪-口途径传播。据报告,在摄入某些贝类(双壳类软体动物,如贻贝、牡蛎和蛤蜊,通过过滤大量污水污染的水进食)、受污染的水果(包括冷冻浆果和枣)和沙拉蔬菜后,出现了食源性疫情。甲型肝炎的传播与因子ⅷ和因子ⅸ浓缩物的使用有关,其中病毒灭活程序不能破坏甲型肝炎病毒。潜伏期通常约为28-30天,但偶尔可能短至15天或长至50天。
疾病的历史和流行病学
生活和卫生水平的提高导致甲型肝炎感染率显著下降。在英国,这导致成年人的高易感水平,典型的感染年龄从儿童向老年群体转移。2001/2002年,英格兰和威尔士甲型肝炎的总体血清阳性率估计为18.9%,5-19岁人群为14.1%,25-44岁人群进一步上升至26.2%(Morris et al., 2004)。因此,大多数青少年和成年人仍然易受甲型肝炎感染,并且在一生中都将如此,有可能爆发甲型肝炎。
在英国获得的甲型肝炎感染可能表现为散发病例,由人与人传播引起的社区范围的暴发,或者罕见地表现为与受污染的食物有关的源头暴发。此前,甲型肝炎的发病率在英国呈周期性变化。然而,在过去的15年里,出现了下降趋势;英格兰和威尔士的甲型肝炎实验室报告数量从1997年的1337例下降到2014年的300例。2010年报告数量的增加是由于伦敦和西南地区爆发了不相关的甲型肝炎。2014年至2016年期间,甲型肝炎的实验室报告略有增加(PHE,2017),这是由该时期发现的一些群集造成的。
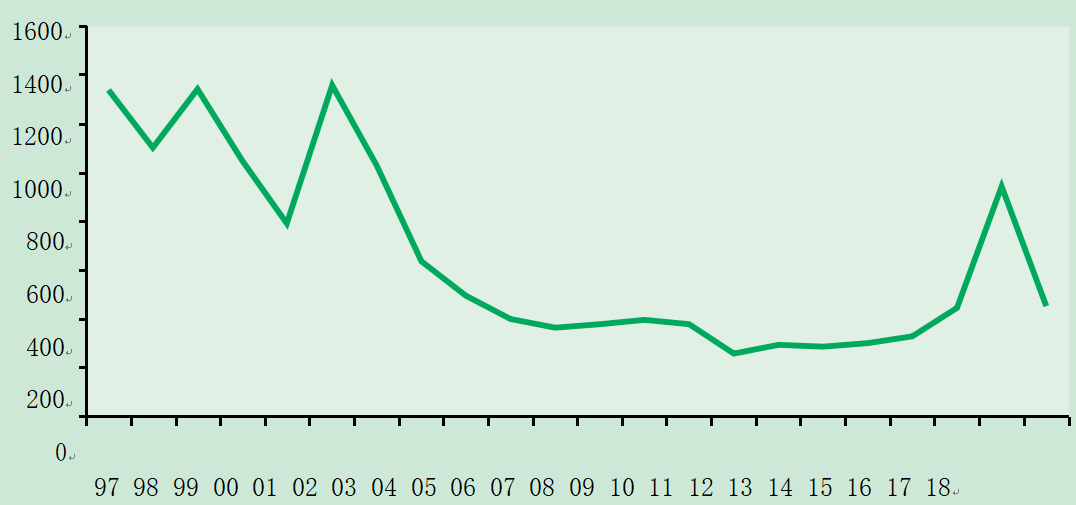
图17.1 1997-2018年英格兰和威尔士甲型肝炎年度实验室报告
近几十年来,在英国,男男性行为者(MSM)中爆发了多次甲型肝炎,最近的一次爆发发生在2016- 2017年的英格兰,导致当年的病例数翻了一番(Beebeejuan et al., 2017; Plunkett et al, 2018)。同样,在其他一些欧洲国家也记录了疫情。传播似乎是通过粪便-口腔途径(Reintjes et al., 1999; Bell et al., 2001; Blystad et al., 2004; Sfetcu et al., 2011; ECDC, 2016)。
在过去十年中,英国和整个欧洲与食品相关的疫情,特别是冷冻浆果,有所增加(Scavia et al., 2017; Boxman et al., 2016; Tavoschi et al., 2015; Swinkels et al., 2014; Nordic Outbreak Investigation Team, 2013)。
在几个国家的注射毒品人群中也有甲型肝炎爆发的记录。阿伯丁注射吸毒者中爆发的疫情(Roy et al., 2004)导致了2001年苏格兰病例数的大幅增加(148例)。在英国其他地区爆发的甲型肝炎涉及大量有注射史的人和无家可归的人一起住在旅馆和避难所(O’Donovan et al., 2001; Syed et al., 2003; Perrett et al., 2003)。2017年,美国几个州也报告了疫情,主要是在报告吸毒或无家可归的人中(Foster M et al MMWR 2018)。这些群体之间的密切接触和较差的个人卫生标准,以及共用注射设备或药物可能造成的粪便污染,似乎是最有可能的传播方式(Hutin et al.,2000; Roy et al., 2004).
甲型肝炎在北欧和西欧、北美、澳大利亚和新西兰以外的国家更为常见。出国旅行是英国散发病例的常见风险因素。对英国游客来说,风险最高的地区是印度次大陆、中东、非洲和东南亚,但现在风险已经扩展到了东欧。
甲型肝炎疫苗接种
有两种甲型肝炎免疫产品。免疫球蛋白提供快速但暂时的免疫。这种疫苗能产生主动免疫,但不会立即产生反应。疫苗可以是单价疫苗,也可以是与伤寒疫苗或乙肝疫苗联合的疫苗。
甲型肝炎单价疫苗和那些与伤寒或乙型肝炎结合的疫苗不含硫柳汞。这些疫苗是灭活的,不含活的有机体,不会引起它们所保护的疾病。
单价疫苗
目前有三种单价疫苗,从甲型肝炎病毒的不同毒株制备;所有这些都是在人类二倍体细胞(MRC5)中生长的。Havrix和Avaxim被吸附到氢氧化铝佐剂上;Vaqta吸附在无定形羟基磷酸硫酸铝上。这些疫苗可以互换使用(Bryan et al., 2000; Clarke et al., 2001; Beck et al., 2004)。
甲型和乙型肝炎联合疫苗
联合疫苗,Twinrix®和Ambirix®,含有纯化的灭活甲型肝炎病毒(吸附在氢氧化铝佐剂上)和纯化的重组乙型肝炎表面抗原(吸附在磷酸铝佐剂上)。当需要预防甲型肝炎和乙型肝炎感染时,可以使用这些联合疫苗。如果成人需要快速预防甲型肝炎,例如在暴露后或暴发期间,则建议接种单剂量单价疫苗。对于16岁以下的儿童,单剂Ambirix®疫苗也可用于快速预防甲型肝炎。Ambirix®和Havrix®初级单剂疫苗都含有较高量的甲型肝炎抗原,因此比Twinrix®儿科疫苗更快地提供甲型肝炎保护。
甲型肝炎和伤寒联合疫苗
当需要预防甲型肝炎和伤寒时,可使用含有吸附在氢氧化铝上的纯化灭活甲型肝炎病毒和纯化Vi荚膜多糖伤寒疫苗(ViATIM)的联合疫苗(另见第34章伤寒)。
人类正常免疫球蛋白
人正常免疫球蛋白(HNIG)是从献血的混合血浆中制备的。HNIG的使用应仅限于严重疾病风险增加的人群中的暴露后预防等情况,在这些情况下,HNIG可能对疫苗有额外的益处。HNIG可以提供即时保护,尽管抗体水平低于甲型肝炎疫苗最终产生的抗体水平。保护期为四至六个月。PHE提供使用HNIG治疗甲型肝炎的指南; https://www.gov.uk/
government/publications/immunoglobulin-when-to-use和“甲型肝炎的公共卫生控制和管理指南”https://www.gov.uk/government/publications/hepatitis-a-infection-prevention-and-control-guidance).
*用于甲型肝炎预防的HNIG供应不足,有时可能需要使用替代产品和剂量。关于最新的建议,请咨询英国公共卫生部(www.gov.uk)或苏格兰健康保护局(www.hps.scot.nhs.uk).
甲型肝炎
由于理论上存在从血浆产品中传播vCJD的风险,英国使用的HNIG现在是从英国以外的血浆中制备的,并且供应稀缺。所有献血者都要接受艾滋病毒、乙型肝炎和丙型肝炎的筛查,所有血浆库都要检测是否存在这些病毒的RNA。生产过程中包括包膜病毒的溶剂去污剂灭活步骤。
储存
疫苗应储存在原包装中,温度为+2℃至+8℃,并避光保存。所有疫苗在某种程度上都对冷热敏感。高温加速了大多数疫苗效力的下降,从而缩短了它们的保质期。除非储存在正确的温度下,否则无法保证疫苗的有效性。冷冻可能导致某些疫苗的反应原性增加和效力丧失。它还会在容器中产生细小的裂纹,导致内容物被污染。
HNIG应在+2℃至+8℃的冰箱中保存在原包装中。这些产品可耐受更高的环境温度长达一周。如果需要,可以在冷链外用坚固的包装分发。
剂型
| 疫苗 | 产品 | 药物形式 | 使用前的操作说明 |
| 单价甲型肝炎疫苗 | Havrix® Monodose® Havrix® Junior Monodose® Avaxim® Vaqta®成人 Vaqta®儿童 | 预装注射器或小瓶中的注射用混悬液 | 充分摇匀,产生稍微不透明的白色悬浮液 |
| 甲型和乙型肝炎联合疫苗 | Twinrix®成人Twinrix®儿科 | 预装注射器中的注射用混悬液 | 充分摇动疫苗,以获得稍微不透明的悬浮液 |
| Ambirix® | 预装注射器中的注射用混悬液 | 充分摇动疫苗,以获得稍微不透明的悬浮液 | |
| 甲型肝炎和伤寒联合疫苗 | ViATIM® | 一种双腔注射器,包含混浊的白色悬浮液和清澈无色的溶液 | 摇动以确保悬浮液完全混合。当注射疫苗时,两个隔室的内容物混合 |
剂量和时间表
为了提供长期保护,甲型肝炎疫苗和甲型肝炎和伤寒联合疫苗的免疫方案包括两剂,第二剂在第一剂后6至12个月。甲型肝炎和乙型肝炎联合疫苗的标准时间表取决于产品。对于Twinrix®,该计划包括三剂,第一剂在选定日期,第二剂在第一剂后一个月,第三剂在第一剂后六个月。对于Ambirix,该方案包括两剂,第一剂在选定日期给药,第二剂在第一剂后6至12个月之间给药。
当需要早期预防乙型肝炎时(例如,对于一个月内出发的旅行者),可以使用0、7和21天的Twinrix®成人加速计划。
单价甲型肝炎免疫的剂量
| 疫苗产品 | 年龄 | 剂量 | 卷 |
| Havrix® Monodose® | 16岁或以上 | 1440 ELISA单位 | 1.0ml |
| Havrix® Junior Monodose® | 1至15岁 | 720 ELISA单位 | 0.5ml |
| Avaxim® Vaqta®成人 | 16岁以上 18岁以上 | 160抗原单位 50个单位 | 0.5ml1.0ml |
| Vaqta®儿科 | 1至17岁 | 25单位 | 0.5ml |
甲型肝炎和乙型肝炎联合疫苗的剂量
| 疫苗产品 | 年龄 | HAV剂量 | HBV剂量 | 卷 |
| Twinrix®成人 | 16岁或以上 | 720 ELISA单位 | 20µg | 1.0ml |
| Twinrix®儿科 | 1至15岁 | 360个ELISA单位 | 10µg | 0.5ml |
| Ambirix® | 1至15岁 | 720 ELISA单位 | 20µg | 1.0ml |
甲型肝炎和伤寒联合疫苗的剂量
| 疫苗产品 | 年龄 | HAV剂量 | Vi P Ty剂量 | 卷 |
| ViATIM® | 16岁或以上 | 160抗原单位 | 25µg | 1.0ml |
HNIG剂量
请参见2017年6月更新的“甲型肝炎公共卫生控制和管理”中关于使用HNIG进行甲型肝炎暴露后预防的指导,网址为https://www.gov.uk/government/publications/hepatitis-a-infection-prevention-and-control-guidance 和“甲型肝炎免疫球蛋白”更新于2019年6月,网址为https://www.gov.uk/government/publications/immunoglobulin-when-to-use。
管理
疫苗通常通过上臂或大腿前外侧肌肉注射。
如果熟悉出血风险的医生认为疫苗或类似的小剂量肌肉注射可以通过这种途径合理安全地施用,则患有出血性疾病的个体可以通过肌内注射接种疫苗。如果个体接受减少出血的药物/治疗,例如血友病的治疗,可以在给予这种药物/治疗后不久安排肌内疫苗接种。正在接受稳定抗凝治疗的个体,包括正在接受华法林治疗的个体,如果其预定的INR测试是最新的,并且其最新的INR低于其治疗范围的上限,则可以接受肌肉注射疫苗。应使用细针(等于23号或更细的口径,如25号)接种疫苗,然后用力按压该部位(不摩擦)至少2分钟。如果有任何疑问,请咨询负责处方或监测个人抗凝治疗的临床医生。
含甲型肝炎的疫苗可与其他疫苗同时接种,如乙型肝炎、MMR、MenACWY、Td/IPV和其他旅行疫苗。疫苗应该在不同的部位注射,最好是在不同的肢体。如果在同一个肢体,他们应至少相隔2.5厘米(American Academy of Pediatrics, 2003)。应在个人记录中注明每种疫苗的注射地点。
HNIG可以在臀部外上象限或大腿前外侧给药(见第4章)。如果给幼儿和婴儿服用超过3ml,或给较大的儿童和成人服用超过5ml,免疫球蛋白应分成较小的剂量,在不同的部位给药。HNIG可以在接种甲肝疫苗的同时,在不同的地点进行接种。
处理
有关用于疫苗接种的设备的处置,包括用过的小瓶、安瓿、注射器或部分排出的疫苗,请参见第3章。
暴露前免疫接种疫苗的使用建议
免疫接种计划的目的是提供两剂甲肝疫苗
在适当的时间间隔内为所有暴露于病毒或疾病并发症的高风险个体接种含甲肝的疫苗(Twinrix®为三剂)。
建议接受接触前免疫接种的人群
所有旅行者都应接受仔细的风险评估,考虑他们的行程、停留时间和计划的活动。建议一岁及一岁以上的人前往甲型肝炎高、中流行区,或偶尔在甲型肝炎暴发期间,接种甲型肝炎疫苗。针对具体国家的建议可在NaTHNaC(www.nathnac.org)和Travax(www.travax.nhs.uk)网站。虽然甲型肝炎在儿童中通常是亚临床的,但它可能是严重的,需要住院治疗。即使是患有轻度或亚临床甲型肝炎的儿童也可能成为其他人的传染源。一岁以下儿童患病的风险很低,疫苗也没有获得在这个年龄使用的许可。应注意防止通过食物和水感染甲型肝炎。
对于旅行者,最好在出发前至少两周注射疫苗,但也可以在出发当天注射。尽管在接种单价甲型肝炎疫苗后12-15天内可能检测不到抗体,但在使用目前的检测方法检测到抗体之前,疫苗可能会提供一些保护。
对于前往或将要居住在北欧或西欧(包括西班牙、葡萄牙和意大利)、北美、澳大利亚或新西兰的个人,通常认为没有必要进行免疫接种。HNIG不再被推荐用于旅行预防。
慢性肝病患者
虽然慢性肝病患者可能没有更大的风险获得甲型肝炎感染,但它可以在这些患者中产生更严重的疾病(Akriviadis and Redeker, 1989; Keefe, 1995)。因此,建议患有任何原因的严重肝病的患者接种甲型肝炎疫苗。对于患有慢性乙型或丙型肝炎感染的个人以及患有轻度肝病的人,也应考虑接种疫苗。
血友病患者
由于标准的病毒灭活过程可能对甲型肝炎无效,接受血浆来源凝血因子的血友病患者应进行甲型肝炎免疫接种。血友病患者应进行皮下免疫接种。
男男性行为者(MSM)
建议MSM进行免疫接种,他们还应被告知甲型肝炎的风险,以及在性生活中保持高标准个人卫生的必要性。
注射毒品的人
建议注射毒品的人进行甲型肝炎免疫接种,并可与乙型肝炎疫苗同时接种,作为单独或联合制剂。应考虑在药品服务机构、监狱以及通过无家可归者收容所、招待所和营地的外展服务,最大限度地增加接种疫苗的机会。
面临职业风险的个人
建议以下人群接种甲型肝炎疫苗:
- 实验室工作人员:在微生物实验室和临床传染病单位工作过程中可能接触甲型肝炎的个人处于危险之中,必须受到保护
- 一些大型住宿机构的工作人员和居民:甲型肝炎的爆发与为有学习困难的人提供的大型住宿机构有关。在这样的机构中传播更容易发生,对员工和居民进行免疫接种是适当的。类似的考虑也适用于客户或病人的个人卫生标准可能较差的其他机构
- 污水处理工人:未经处理的原污水经常被甲型肝炎污染。英国一项评估该风险的研究表明,经常职业接触原污水是甲型肝炎感染的独立风险因素(Brugha et al., 1998)。因此,建议有重复接触原污水风险的工人进行免疫接种,包括洪水发生时的一线反应人员,他们应在当地风险评估后确定
- 与灵长类动物一起工作的人:建议与易受甲型肝炎感染的灵长类动物一起工作的人进行免疫接种
在某些情况下,可以考虑接种甲型肝炎疫苗:
- 食品包装工和食品处理工:英国的食品包装工或食品处理工与甲型肝炎传播的联系还不够频繁,不足以证明他们的免疫接种是一项常规措施。当发生病例或疫情时,应向当地健康保护团队寻求建议
- 日托设施中的工作人员:幼儿的感染可能是亚临床的,在日托中心和其他环境中工作的那些没有经过如厕训练的儿童可能面临更大的风险(Brugha et al., 1998)。在正常情况下,通过注意个人卫生,可将传染给员工和儿童的风险降至最低。然而,在明确界定的社区爆发的情况下,如在学前托儿所,应与当地健康保护团队讨论员工和儿童的免疫接种需求
- 卫生保健工作者:大多数卫生保健工作者没有增加患甲型肝炎的风险,也不需要常规免疫接种
暴露后免疫接种
主动(有或没有被动)免疫接种用于管理病例接触和控制疫情。HNIG在为急性肝炎病例的接触者提供预防方面有着良好的记录。如果在暴露后14天内给药,HNIG将保护免受甲型肝炎感染,并且如果在该时间之后给药,可能改善疾病(Winokur and Stapleton, 1992)。虽然安慰剂对照试验已显示甲型肝炎疫苗作为暴露后预防的功效(Sagliocca et al., 1999, Werzeberger et al., 1992),但来自比较甲型肝炎疫苗和HNIG暴露后功效的随机、双盲非劣效性临床试验的数据表明,当在暴露14天内施用时,疫苗的性能接近HNIG (Victor et al., 2007)。
有关使用含或不含HNIG的肝炎疫苗进行暴露后免疫的指导,另请参见“PHE公共卫生控制和甲型肝炎管理2017指南”,网址为:
https://www.gov.uk/government/publications/hepatitis-a-infection-prevention-and-control-guidance,以及“甲型肝炎免疫球蛋白”https://www.gov.uk/government/publications/immunoglobulin-when-to-use。
当需要快速和长期保护时,疫苗和HNIG可以同时给药,但在不同的部位给药。一剂单价甲型肝炎疫苗将比需要一剂以上的联合制剂提供更快速的保护。
甲型肝炎感染病例的接触者
先前未接种甲肝疫苗的接触者应接种甲肝疫苗,根据接触时间、年龄和共病(如慢性肝病)而定是否接种HNIG。更多指导可参见PHE《public health control and management of hepatitis A 2017 guidelines甲型肝炎公共卫生控制和管理2017指南》。
仅限于家庭密切接触者的预防措施在控制通过三级传播的进一步传播方面可能相对无效。如果给予近期密切接触者的更广泛的社会群体(例如,接吻接触者和食用了由指示病例准备的食物的人),可能更有效地防止更广泛的传播。
对甲型肝炎感染的快速实验室确认和及时通知当地健康保护小组将有助于快速识别密切接触者并提供疫苗预防。
爆发
单价甲型肝炎疫苗的主动免疫可提供长时间的保护,并可在长时间的疫情中有效,如可能发生的食源性、学校和社区疫情(包括爱尔兰旅行者和其他游牧人口,以及无家可归者,在有机会进行干预的情况下,如在庇护所、旅馆、营地和爱尔兰旅行者地点的外展活动),以阻断继续传播。
应与当地健康保护团队讨论使用HNIG和/或甲型肝炎疫苗管理甲型肝炎感染暴发的适当方法。更多指导可参见PHE《public health control and management of hepatitis A 2017 guidelines甲型肝炎公共卫生控制和管理2017指南》。
初级免疫接种
甲型肝炎疫苗以及甲型肝炎和伤寒混合疫苗的初级免疫过程由单剂疫苗组成。对于成人甲型和乙型肝炎联合疫苗(Twinrix® ),一个主要疗程包括三剂。有两种甲型和乙型肝炎联合疫苗适用于儿童。Twinrix®儿科药物的主要疗程包括三剂,而Ambirix®则包括间隔较长的两剂。然而,第一剂Ambirix®疫苗可提供与第一剂甲肝疫苗相当的保护作用,尽管在第二剂疫苗后才能完全预防乙型肝炎。单一或联合疫苗的初级保护持续至少一年。
加强免疫
第二剂甲肝疫苗应在初次注射后6至12个月注射。这导致了抗体滴度的显著增加,并将给予十年以上的免疫力;然而,在注射第二剂疫苗之前,不能保证超过十年的有效保护。
已经进行了许多研究来检测免疫接种后甲型肝炎抗体的持久性(Hammitt, 2008; Ott, 2012; Raczniak, 2013)。两项旨在评估成人使用单价灭活甲型肝炎疫苗进行两剂初次接种(0、6个月或0、12个月计划)后抗甲型肝炎免疫原性的研究表明,两种免疫方案均可使疫苗诱导的抗HAV抗体在初次免疫后持续存在至少17年(Van Herck,2012)。基于模型的估计与至少25年内血清阳性率高达95%的估计一致(Hens,2014)。因此,在获得进一步证据之前,在完成标准剂量的甲型肝炎疫苗疗程25年内,一般不需要加强免疫接种,除非那些处于持续风险或暴露于甲型肝炎患者后的人。可在PHE“public health control and management of hepatitis A 2017 guidelines甲型肝炎2017年公共卫生控制和管理指南”中找到进一步的指导。
在使用甲型肝炎和伤寒联合疫苗进行免疫接种的情况下,6至12个月后将需要一剂单一抗原甲型肝炎疫苗,以提供针对甲型肝炎感染的长期保护。三年后需要伤寒成分的加强剂量。
对于在加速方案(0、7和21天)中接种了甲型肝炎和乙型肝炎联合疫苗的个体,需要在一年后再接种一次以提供延长的保护。
第二剂延迟接种
理想情况下,应遵循制造商推荐的第二剂甲型肝炎疫苗的给药时间。在实践中,特别是在不经常旅行的人群中,注射可能会有延迟。研究表明,即使第二次给药延迟数年,也能成功加强(Landry et al., 2001; Beck et al., 2003),因此课程不需要重新开始。
禁忌症
极少数人不能接种含甲型肝炎的疫苗。如有疑问,应寻求儿科顾问、免疫协调员或当地健康保护团队的适当建议,而不是扣留疫苗。
疫苗不应注射给患有以下疾病的人:
- 确认对先前剂量的含甲型肝炎疫苗有过敏反应,或
- 对疫苗的任何成分的确认过敏反应
预防措施
没有发烧或全身不适的小病不是推迟免疫接种的正当理由。
如果个人急性不适,免疫接种可能会推迟,直到他们完全康复。这是为了避免由于错误地将任何体征或症状归因于疫苗的副作用而混淆任何急性疾病的鉴别诊断。
HNIG
当HNIG用于预防甲型肝炎感染时,应注意它可能会干扰活病毒疫苗主动免疫的后续发展。如果已经首先注射了免疫球蛋白,那么在注射活病毒疫苗之前应该间隔三个月。如果在接种活疫苗的三周内注射了免疫球蛋白,则应在三个月后再次接种。这不适用于黄热病疫苗,因为HNIG不含大量针对该病毒的抗体。
怀孕和母乳喂养
当有临床指征时,孕妇可以接种含甲型肝炎的疫苗。没有证据表明对孕妇或哺乳期妇女接种灭活病毒或细菌疫苗或类毒素有风险(Plotkin et al, Chapter 9, 2018)。
免疫抑制和艾滋病毒感染
具有免疫抑制和HIV感染的个体可以被给予含有甲型肝炎的疫苗(Bodsworth et al., 1997; Kemper et al., 2003),尽管血清转化率和抗体滴度可能较低,并且似乎与免疫接种时个体的CD4计数有关(Kourkounti et al., 2012; Kourkounti et al., 2013; Mena et al., 2015)。应考虑重新免疫,可能需要专家建议。
皇家儿科和儿童健康学院(www.rcpch.ac.uk),在英国艾滋病毒协会(BHIVA)艾滋病毒感染者免疫指南adults (BHIVA,2015)和英国和爱尔兰儿童艾滋病协会(CHIVA)免疫指南(www.bhiva.org/chiva).
不良反应
对甲型肝炎疫苗的不良反应通常是轻微的,并且仅限于免疫接种后的头几天。最常见的反应是注射部位出现轻度、短暂的疼痛、红斑和硬结。注射部位可能会形成一个小而无痛的结节;这通常会消失,没有任何后果。
发热、不适、疲劳、头痛、恶心和食欲不振等一般症状的报告也较少。
HNIG耐受性良好。极少数情况下,过敏样反应发生在具有IgA抗体的低丙种球蛋白血症患者或对输血有非典型反应的患者。
严重的、可疑的疫苗不良反应应通过MHRA黄卡计划进行报告。
任何国家都没有通过肌内使用的免疫球蛋白制剂获得血源性感染的病例记录。
供应
甲型肝炎疫苗
- Avaxim®(16岁或以上的青少年和成人)
该疫苗可从赛诺菲巴斯德公司获得
(电话:01483 505515)获得。
- Vaqta® 儿科(1岁至17岁的儿童和青少年)
- Vaqta®成人(18岁或以上的青少年和成人)
这些疫苗可从Merck Sharpe & Dohme Ltd获得
(电话:01992 467272)。
- Havrix® Monodose®(16岁或以上的成人)
- Havrix® Junior Monodose®(1岁至15岁的儿童和青少年)
这些疫苗可从葛兰素史克英国公司获得
(电话:020 8990 9000)
联合疫苗
- ViATIM®(16岁或以上的成人和青少年)(联合伤寒疫苗)该疫苗可从赛诺菲巴斯德公司获得。
- Ambirix®(1至15岁的儿童/青少年)(联合乙型肝炎疫苗)
- Twinrix®成人(16岁或以上)(联合乙型肝炎疫苗)
- Twinrix®儿科(1至15岁的儿童/青少年)(联合乙型肝炎疫苗)这些疫苗可从英国葛兰素史克公司获得。
免疫球蛋白
HNIG仅适用于以下病例的合格密切接触者:
英格兰:
英国公共卫生部,
免疫和对策司(电话:020 8200 6868)。
威尔士:
威尔士公共卫生-微生物学卡马森郡西威尔士综合医院
(电话:01267 235 151)
苏格兰:
健康保护苏格兰格拉斯哥
(电话:0141 300 1100)。
北爱尔兰:
贝尔法斯特卫生和社会保健信托基金
皇家维多利亚医院药剂科
电话:(028)9032 9241(通过总机并询问皇家药房)。HNIG由苏格兰国家输血服务中心生产(电话:0131 314 5510)。
参考
Akriviadis EA and Redeker AG (1989) Fulminant hepatitis A in intravenous drug users with chronic liver
disease. Ann Intern Med 110: 838–9.
American Academy of Pediatrics (2003) Active immunization. In: Pickering LK (ed.) Red Book: 2003 Report of the Committee on Infectious Diseases, 26th edition. Elk Grove Village, IL: American Academy of Pediatrics, p. 33.
Beck BR, Hatz C, Bronnimann R et al. (2003) Successful booster antibody response up to 54 months after single primary vaccination with virosome-formulated, aluminium-free hepatitis A vaccine. Clin Infect Dis 37: 126–8.
Beck BR, Hatz CFR, Loutan L et al. (2004) Immunogenicity of booster vaccination with a virosomal hepatitis A vaccine after primary immunisation with an aluminium-adsorbed hepatitis A vaccine. J Travel Med 11: 201–207.
Beebeejuan K, Degala S, Balogun K et al. (2017) Outbreak of hepatitis A associated with men who have sex with men (MSM), England, July 2016 to January 2017. Eurosurveillance 22(5): 7-13
Bell A, Ncube F, Hansell A et al. (2001) An outbreak of hepatitis A among young men associated with having sex in public places. Commun Dis Public Health 4(3): 163–70.
Blystad H, Kløvstad H, Stene-Johansen & Steen T. Hepatitis A outbreak in men who have sex with men, Oslo and Bergen in Norway. Eurosurveillance 8(43): Article 1
Bodsworth NJ, Neilson GA and Donovan B (1997) The effect of immunisation with inactivated hepatitis A vaccine on the clinical course of HIV-1 infection: one-year follow- up. AIDS 11: 747–9.
Boxman IL, Verhoef L, Vennema H et al. (2016) International linkage of two food-borne hepatitis A clusters through traceback of mussels, Netherlands, 2012. Eurosurveillance 21(3): 2-11
British HIV Association (2006) Immunisation guidelines for HIV-infected adults. www.bhiva.org/pdf/2006/Immunisation506.pdf
Brugha R, Heptonstall J, Farrington P et al. (1998) Risk of hepatitis A infection in sewage workers. Occup Environ Med 55: 567–9.
Bryan JP, Henry CH, Hoffman AG et al. (2000) Randomized, cross-over, controlled comparison of two inactivated hepatitis A vaccines. Vaccine 19: 743–50.
Clarke P, Kitchin N and Souverbie F (2001) A randomised comparison of two inactivated hepatitis A vaccines, Avaxim and Vaqta, given as a booster to subjects primed with Avaxim. Vaccine 19: 4429–33.
Department of Health (2001) Health information for overseas travel, 2nd edition. London: TSO.
Department of Health (2006) Health technical memorandum 07-01: Safe management of healthcare waste.www.dh.gov.uk/en/Publicationsandstatistics/Publications/PublicationsPolicyAndGuidance/DH_063274. Accessed: Nov. 2008.
European Centre for Disease Prevention and Control (ECDC) (2016) Rapid Risk Assessment -Hepatitis A outbreaks in the EU/EEA mostly affecting men who have sex with men. 19 December, 2016. Available at: http://ecdc.europa.eu/en/publications/Publications/13-12-2016-RRA-Hepatitis%20A-United%20Kingdom.pdf
Foster M et al 2018, Hepatitis A outbreaks associated with drug use and homelessness – California, Kentucky, Michigan and Utah, 2017. MMWR Morb Mortal Wkly Rep 2018;67:1208-1210
Hammitt LL, Bulkow L, Hennessy TW et al., (2008). Persistence of antibody to hepatitis A virus 10 years after vaccination among children and adults. J.Infect Dis.198(12):1776-1782
Henning KJ, Bell E, Braun J and Barkers ND (1995) A community-wide outbreak of hepatitis A: risk factors for infection among homosexual and bisexual men. Am J Med 99: 132–6.
Hutin YJ, Sabin KM, Hutwager LC et al. (2000) Multiple modes of hepatitis A virus transmission among methamphetamine users. Am J Epidemiol 152: 186–92.
Keefe EB (1995) Is hepatitis A more severe in patients with chronic hepatitis B and other chronic liver diseases? Am J Gastroenterol 90: 201–5
Kourkounti S, Mavrianou N, Papaizos VA et al. (2012) Immune response to hepatitis A vaccination in HIVinfected men in Greece. Int J. STD & AIDS 23(7): 464-467
Kourkounti S, Papaizos V, Leuow K et al., (2013) Hepatitis A vaccination and immunological parameters in HIV-infected patients. Viral Immunol. 26(5): 357-363
Landry P, Tremblay S, Darioli R et al. (2001) Inactivated hepatitis A vaccine booster given at or after 24 months after the primary dose. Vaccine 19: 399–402.
Mele A, Sagliocca L, Palumbo F et al. (1991) Travel-associated hepatitis A: effect of place of residence and country visited. J Public Health Med 13: 256–9.
Mena G, Garcia-Bastteiro AL and Bayas JM (2015). Hepatitis B and A vaccination in HIV-infected adults: A review. Hum.Vaccin. Immunother. 11(11) 2582-2598
M. C. Morris-Cunnington, W. J. Edmunds, E. Miller, D. W. G. Brown; A Population-based Seroprevalence Study of Hepatitis A Virus Using Oral Fluid in England and Wales . Am J Epidemiol 2004; 159 (8): 786-794. doi: 10.1093/aje/kwh107.
Nordic Outbreak Investigation Team (2013). Joint analysis by the Nordic countries of a hepatitis A outbreak,October 2012 to June 2013: frozen strawberries suspected. Eurosurveillance 18(27): 8-15
O’Donovan D, Cooke RPD, Joce R et al. (2001) An outbreak of hepatitis A among injecting drug users. Epidemiol Infect 127: 469–73.
Ott JJ, Irving G, Wiersma ST (2012). Long-term protective effects of hepatitis A vaccines. A systematic review. Vaccine, 31(1): 3-11
Perrett K, Granerod J, Crowcroft N et al. (2003) Changing epidemiology of hepatitis A: should we be doing more to vaccinate injecting drug users? Commun Dis Public Health 6: 97–100.
Plotkin SA, Orenstein WA, Offit PA and Edwards KM (eds) (2018) Vaccines, 7th edition. Philadelphia: Elsevier Inc Plunkett J, Mandal S, Balogun K, et al, (2018) Hepatitis A outbreak among men who have sex with men
(MSM) in England, 2016-2018: the contribution of past and current vaccination policy and practice. Vaccine
X 2019 Feb 28;1:100014. doi: 10.1016/j.jvacx.2019.100014. eCollection 2019 Apr 11.
Public Health England. 2017. Laboratory reports of hepatitis A and C: 2016. Health Protection Report, vol 10 -11, 2016
[ONLINE] Available from: https://www.gov.uk/government/publications/laboratory-reports-of-hepatitis-aand-c-2016.
Public Health England (2019). Hepatitis A immunoglobulin : available from:https://www.gov.uk/government/publications/immunoglobulin-when-to-use
Public Health England (2017). Public Health Control and Management of Hepatitis A, 2017 Guidelines, available at:
https://www.gov.uk/government/publications/hepatitis-a-infection-prevention-and-control-guidance
Raczniak GA, Thomas TK, Bulkow LR, et al.,(2013). Duration of protection against hepatitis A for the current two-dose vaccine compared to a three-dose vaccine schedule in children. (Havrix). Duration of protection against hepatitis A for the current two-dose vaccine compared to a three-dose vaccine schedule in children.(Havrix) Vaccine 31(17):2152-2155
Reid TM and Robinson HG (1987) Frozen raspberries and hepatitis A. Epidemiol Infect 98: 109–12.
Reintjes R, Bosman A, de Zwart O et al. (1999) Outbreak of hepatitis A in Rotterdam associated with visits to ‘darkrooms’ in gay bars. Commun Dis Public Health 2(1): 43–6.
Roy K, Howie H, Sweeney C et al. (2004) Hepatitis A virus and injecting drug misuse in Aberdeen, Scotland: a case-control study. J Viral Hepat 11: 277–82.
Scavia G, Alfonsi V, Taffon S et al. (2017) A large prolonged outbreak of hepatitis A associated with consumption of frozen berries, Italy 2013-14. J. Med. Micro. First Published Online:13 January 2017, Journal of Medical Microbiology doi: 10.1099/jmm.0.000433.
Sagliocca L, Amoroso P, Stroffolini T, et al. Efficacy of hepatitis A vaccine in prevention of secondary hepatitis
A infection: a randomised trial. Lancet 1999;353:1136–9
Severo CA, Abensur P, Buisson Y et al. (1997) An outbreak of hepatitis A in a French day-care center and
efforts to combat it. Eur J Epidemiol 13: 139–44.
Sfetcu O, Irvine N, Ngui SL et al .(2011) Hepatitis A outbreak predominantly affecting men who have sex with
men in Northern Ireland, October 2008 to July 2009. Eurosurveillance 16(9): 11-17
Swinkels HM, Kuo M, Embee G et al. (2014). Hepatitis A outbreak in British Columbia, Canada: the roles of
established surveillance, consumer loyalty cards and collaboration, February to May 2012. Eurosurveillance
19(18): 36-43
Syed NA, Hearing SD, Shaw IS et al. (2003) Outbreak of hepatitis A in the injecting drug user and homeless
populations in Bristol: control by a targeted vaccination programme and possible parenteral transmission. Eur
J Gastroenterol Hepatol 15: 901–6.
Tavoschi L, Severi E, Niskanen T et al. (2015) Food-borne diseases associated with frozen berries
consumption : a historical perspective, European Union, 1983 to 2013. Eurosurveillance 20(29): 11-20
Van Herck K, Crasta PD, Messier M, et al.(2012). Seventeen-year antibody persistence in adults primed with
two doses of an inactivated hepatitis A vaccine. Human Vacc and Immunother.8 (3): 323-327 Winokur PL
and Stapleton JT (1992) Immunoglobulin prophylaxis for hepatitis A. Clin Infect Dis 14: 580–6.
Victor JC, Monto AS, Surdina TY, et al. Hepatitis A vaccine versus immune globulin for postexposure
prophylaxis. N Engl J Med 2007;357.
Werzberger A, Mensch B, Kuter B, Brown L, Lewis J, Sitrin R, et al. A controlled trial of a formalin-inactivated
hepatitis A vaccine in healthy children. The New England Journal of Medicine, 1992; 327:453-457
Hits: 60

