Contents
- 1 摘要
- 2 介绍
- 3 方法
- 4 背景
- 5 黄热病疫苗
- 6 YF疫苗建议的基本原理概述
- 7 实验室工作人员使用YF疫苗的建议
- 8 预防旅行者感染YF的建议
- 9 国际旅行前接种疫苗的要求
- 10 黄热病疫苗的施用
- 11 禁忌症
- 12 预防 措施
- 13 特殊人群
- 14 疫苗不良事件的报告
- 15 未来研究
- 16 其他信息
- 17 确认
- 18 参考
- 19 世界卫生组织,流行病学监测和健康状况趋势评估司。全球健康状况和预测-估计。瑞士日内瓦:世界卫生组织;1992.
- 20 古野克,常,土屋KR,卡拉巴索斯北,克罗普CB。该属的系统发育
- 21 。Am J Trop Med Hyg 19288:261 – 82.
- 22 1993 – 1994年巴西马兰豪州东南部地区的森林黄热病流行:流行病学和昆虫学发现。Am J Trop Med Hyg 199757:132 – 7.
- 23 免疫接种实践咨询委员会
- 24 黄热病疫苗工作组
Yellow Fever Vaccine: Recommendations of the Advisory Committee on Immunization Practices (ACIP)
Recommendations and Reports
July 30, 2010 / 59(RR07);1-27
摘要
这份报告更新了CDC关于使用黄热病(YF)疫苗的建议(疾病控制中心。黄热病疫苗:免疫实践咨询委员会的建议:MMWR 2002;51 ![]() [编号RR-17]).自从2002年公布以前的YF疫苗建议以来,关于YF的流行病学、疫苗的安全性以及与疫苗相关的卫生法规的新的或额外的信息已经变得可用。该报告总结了当前YF的流行病学,描述了YF疫苗的免疫原性和安全性数据,并为旅行者和实验室工作人员使用YF疫苗提供了建议。
[编号RR-17]).自从2002年公布以前的YF疫苗建议以来,关于YF的流行病学、疫苗的安全性以及与疫苗相关的卫生法规的新的或额外的信息已经变得可用。该报告总结了当前YF的流行病学,描述了YF疫苗的免疫原性和安全性数据,并为旅行者和实验室工作人员使用YF疫苗提供了建议。
YF是一种媒介传播疾病,由受感染蚊子叮咬传播黄热病病毒(YFV)引起。它是撒哈拉以南非洲和热带南美洲的地方病,估计每年导致200,000例临床疾病和30,000例死亡。人类感染可导致出血热,20% – 50%的重症患者会死亡。因为YF病没有治疗方法,所以预防对降低疾病风险和死亡率至关重要。旅行者感染YFV病毒的风险由多种因素决定,包括免疫状况、旅行地点、季节、暴露时间、旅行时的职业和娱乐活动以及旅行时当地的病毒传播率。
所有前往YF流行国家的旅行者都应被告知感染该疾病的风险和可用的预防方法,包括使用个人防护措施和接种疫苗。建议年龄≥9个月的人前往南美和非洲存在YFV传播风险的地区旅行或居住,接种YF疫苗。由于YF疫苗接种后可能发生严重的不良事件,卫生保健提供者应只为有暴露于YFV病毒风险的人或入境时需要疫苗接种证明的人接种疫苗。为了最大限度地降低严重不良事件的风险,医疗保健提供者应遵守禁忌症,在接种疫苗前考虑预防接种措施,并在必要时签发医疗弃权书。
介绍
黄热病病毒(YFV),一种蚊子传播的黄病毒,存在于非洲和南美洲的热带地区。在人类中,大多数YFV病毒感染是无症状的。临床疾病从轻微、未分化的发热性疾病到具有黄疸和出血表现的严重疾病(1).在3 – 6天的潜伏期后,有症状的黄热病(YF)感染通常表现为突然发热和头痛(2).随着病情的发展,可能会出现其他症状,包括畏光、肌痛、关节痛、上腹痛、厌食、呕吐和黄疸(3,4).有些人会出现多系统器官衰竭和出血症状。重症黄热病并肝肾功能障碍的病死率为20% – 50%(1).因为YF没有特效的抗病毒治疗,所以预防是降低疾病风险和死亡率的关键。
YFV有三个传输周期:丛林(森林),中间(草原)和城市(5).所有的循环都包括YFV在灵长类动物(非人类或人类)和蚊子之间的传播。根据传播周期和地点的不同,涉及不同的蚊子物种,人类或非人类灵长类动物是病毒的主要宿主。
世界卫生组织(世卫组织)估计YFV每年导致200,000例临床疾病和30,000例死亡(6).然而,大多数病例和死亡没有得到确认,因为这种疾病主要发生在农村,而且监测和报告不足(4,7).近几十年来,南美洲每年报告数百起病例,主要发生在林区职业暴露的男性(8).在非洲,该大陆每年报告的病例数差异很大(范围:1 – 5,000例)。非洲年度病例数的大部分波动可能归因于报告和确认的差异。然而,由于疾病的自然发生也可能发生波动,在重新出现之前在某些地区会消失数年,因此疫区的划定取决于对动物宿主和病媒的监测、准确的诊断以及对所有人类病例的及时报告。
对旅行者风险的评估应考虑旅行者的免疫状况和计划的行程,包括旅行地点、季节、暴露时间、职业和娱乐活动以及旅行时当地的病毒传播率。应向所有旅行者提供预防蚊虫叮咬的建议。卫生保健提供者在权衡是否给旅行者注射YF疫苗时,必须考虑多种因素(例如,与旅行相关的YFV病的风险、YF发生时的高发病率和死亡率、YF疫苗的入境要求以及接种疫苗后发生严重不良事件的风险)。这份报告提供了在旅行者和实验室工作人员中使用YF疫苗预防YF的建议。
方法
免疫实践咨询委员会(ACIP)黄热病疫苗工作组*(ACIP工作组)于2008年9月首次召开会议,审查关于旅行者感染YF病毒风险的现有信息,并修订疫苗使用建议。除了ACIP成员,ACIP工作组还包括来自美国家庭医师学会、美国疾病预防控制中心、美国国防部、美国国务院、食品药品监督管理局(FDA)、美国传染病学会、国际旅行医学学会、加拿大公共卫生局(PHAC)、波士顿医疗中心和哈佛大学公共卫生学院的参与者。
ACIP工作组审查和审议的问题包括YF流行病学;旅行相关YF病的发病率和危险因素:预防YF病的现有措施;以及YF疫苗的免疫原性、安全性和疫苗不良事件的发生率。进一步考虑了使用YF疫苗的潜在禁忌症和注意事项以及该疫苗的国际卫生条例(IHRs)。发表的、同行评议的研究是所用数据的主要来源。通过检索PubMed、Global Health和EMBASE数据库确定文章;相关参考书目的审查;以及与主题专家的协商。当与正在讨论的问题相关时,CDC的未发表的数据也被考虑。
直到2009年5月,ACIP工作组每月举行电话会议。工作组制定并讨论了建议选项。当缺乏临床试验或其他研究的证据时,这些建议会纳入ACIP工作组成员的专家意见。在2009年6月的会议上,向ACIP做了简短的概述介绍。向ACIP提交了拟议的建议和声明草案,并在2009年10月的会议上获得批准。
背景
黄热病病毒传播
YFV是一种核糖核酸(RNA)病毒,属于黄病毒。它与西尼罗河病毒、圣路易斯脑炎病毒和日本脑炎病毒(9).YFV病毒主要通过被感染者的叮咬传播给人类伊蚊(一种传染黄热病的蚊子)或者趋血蚊属种蚊子(10–14).蚊子通过吸食受感染的非人类或人类灵长类动物获得病毒,然后可以将病毒传播给天真的非人类或人类灵长类动物。
YFV有三个传播周期:丛林(森林地带)、中间地带(热带草原)和城市(5) (图1).丛林(森林)循环包括病毒在非人灵长类动物(如猴子)和在森林树冠层发现的树洞繁殖蚊子物种(15).当人类在职业或娱乐活动中侵入丛林时,病毒通过蚊子从猴子传播给人类。在非洲,存在一个中间(热带草原)循环,它包括从树洞繁殖传播YFV病毒伊蚊(一种传染黄热病的蚊子)物种对于生活或工作在丛林边缘地区的人类(16,17).在这个循环中,病毒可以通过这些蚊子从猴子传播到人类,或从人类传播到人类。城市循环包括病毒在人类和城市蚊子之间的人为传播,主要是Ae。埃及.
感染YFV病毒的人经历最高水平的病毒血症,并且在发热发作前不久和之后的3 – 5天内对蚊子具有传染性(18).鉴于人类获得的高水平病毒血症,血源性传播理论上可通过输血或针刺伤害发生。
黄热病流行病学
地理分布和传播
YF发生在撒哈拉以南非洲和热带南美洲,在那里它是地方性的和间歇性流行(图2).这些地区的大多数YF病可归因于侧枝或中间传播周期。然而,YF的城市传播确实在非洲周期性发生,在南美洲零星发生(19–21).
在非洲,大多数疫情是在西非报告的;中非和东非报告的疫情较少(22).原因尚不清楚,但可能包括更高的人口密度和Ae。埃及在西部,东部和西部YFV病毒株(基因型)之间的遗传差异,针对其他黄病毒的抗体的存在有助于交叉保护,以及在东非传播疾病的蚊子种类不太可能叮咬人类(5,22,23).在西非疫情期间,高达30%的人口感染了YFV病毒,3% – 4%的人出现临床疾病(24,25).自2008年以来,中部非洲国家(如中非共和国、刚果和乍得)报告的YF病例数量有所增加(26,27;世卫组织,未公布的数据,2009年)。这些国家中的许多国家过去很少报告YF病例,这些国家最近报告的病例是否归因于监测的改善或本地或通过邻近流行区的传播而增加的疾病活动尚不清楚。
在南美洲,YFV的传播主要发生在人口稀少的森林地区,而不是城市地区。大多数YF病例来自奥里诺科河、亚马逊河和阿拉瓜亚河流域以及邻近的草原(28).在过去20年中,秘鲁和玻利维亚的YF累积发病率最高(29).在巴西,大多数病例来自亚马逊和巴西西部。然而,从2007年开始,在更多的南部和东部省份发现了病例,包括圣保罗、南里奥格兰德和戈亚斯州(30–32).与此同时,阿根廷北部与巴西南部毗邻的地区以及巴拉圭也出现了YF确诊病例,这是该病毒自20世纪70年代以来首次在这些地区重现(31).除了近年来该疾病流行区的扩大之外,Ae。埃及也再次感染了南美洲的许多城市中心,增加了YF在美洲城市爆发的风险,正如2007年在巴拉圭亚松森发生的那样(21).
虽然YF在北美和欧洲的城市爆发一直持续到20世纪初,但在过去几十年中,没有报告过本土传播。从未在亚洲或澳洲发现YFV病毒的本地传播。然而,这些地区面临着输入的风险,正如这些地区的许多城市地区一样Ae。埃及并且具有大量易感人群(33).因此,一些疾病非流行的国家(如印度和澳大利亚)要求来自YFV流行地区的旅行者提供YF疫苗接种证明(34).
疾病的发病率和负担
世卫组织估计全世界每年发生200,000例YF病例和30,000例可归因于YF的死亡(6).然而,由于报告不足,这些病例中只有有限的百分比得到确认(24,25).在1988 – 2007年期间,世卫组织共报告了26,356例YF病例,其中23,056例(87%)来自撒哈拉以南非洲,3,300例(13%)来自南美洲(1,35–37).在非洲,每年报告的病例数差异很大(范围:1 – 5,000例),这表明监测和报告不一致。在南美洲,世卫组织每年报告的病例多达524例。病死率变化很大,但在非洲约为20%,在南美洲约为50%(1).南美洲较高的病死率被认为是对患有致命疾病的人加强诊断测试的结果,而不是表明该疾病的毒性更强(5).
生态和季节模式
YFV的生态是复杂的,多种因素促成了它的传播。一般来说,温度、湿度和降雨量的增加会导致蚊子数量增加,从而增加病毒传播(38,39).在南美洲,降雨量、湿度和温度增加的月份(1月至5月)YF发病率最高40).在西非的中间地带,YFV活动在雨季中期(8月左右)增加,在旱季早期(10月)达到高峰(40,41).这个时期相当于蚊子媒介寿命最长的时期。因为Ae。埃及蚊子在用于储水的容器中繁殖,其活动和繁殖模式较少依赖降雨(41).结果,当Ae。埃及参与病毒传播,YF也可发生在旱季。
特定年龄模式
非洲和南美洲YF病的年龄特异性模式不同,并受性别和职业的影响。在非洲,病例经常发生在毗邻森林的热带草原地区的村庄。受影响的主要是儿童,因为社区中的老年人通常具有自然获得或疫苗获得的免疫力(24).在南美洲,YF病最常发生在未接种疫苗的年轻男性中,他们在森林或丛林地区工作时接触到蚊子媒介(42,43).建筑或道路建设中涉及伐木和森林清理的职业与人类感染有关(28).南美洲城市地区YF病例的年龄和性别分布不同于在丛林地区观察到的情况,儿童和妇女的感染率更高,原因是Ae。埃及在住宅周围繁殖(21).
临床表现和诊断
体征和症状
在大多数感染YFV的人中,感染被认为是无症状的(24,25).临床疾病从轻度、未分化的发热性疾病到具有黄疸和出血表现的严重疾病不等。潜伏期通常为3 – 6天(1,2).在其最温和的形式中,YF是一种自限性感染,其特征是突然出现发烧和头痛,没有其他症状(3).其他患者突然出现高烧(高达104°F[40°C])、寒战、严重头痛、全身性肌肉疼痛、腰骶部疼痛、厌食、恶心、呕吐和头晕(4,43).患者表现为急性疾病,检查可能显示与体温升高相关的心动过缓(Faget征)。在此期间,患者通常处于病毒血症状态,大约持续3天。许多患者顺利康复,但在大约15%的感染者中,在病毒血症期后48小时内,疾病以更严重的形式复发(44).症状包括发热、恶心、呕吐、上腹痛、黄疸、肾功能不全和心血管不稳定(4).在症状复发的这个阶段,病毒血症通常是不存在的。可出现出血性素质,伴有呕血、黑便、子宫出血、血尿、瘀点、瘀斑、鼻出血以及牙龈和针刺部位渗血。体检结果包括巩膜和皮肤黄疸、出血和上腹部触痛,但无肝脏肿大(44).
临床实验室检查结果
在YF患者中可以观察到多种实验室异常;这些可以根据疾病的严重程度和阶段而有所不同。在患病的第一周,可能会出现白细胞减少症;然而,白细胞增多也可能发生在疾病的第二周(3).出血性恶液质也可能发生,同时伴有凝血酶原和部分凝血活酶时间升高、血小板计数减少和纤维蛋白分解产物(45,46).高胆红素血症可能在第三天出现,但通常在疾病第一周结束时达到高峰。血清转氨酶水平的升高出现在严重的肝肾疾病中,并可能在发病后2个月内保持升高(47).
初步诊断基于患者的临床特征、YF疫苗接种状况和旅行史,包括目的地、一年中的时间和活动。轻度YF在临床上无法与一系列其他感染区分开来。出现黄疸的YF病例必须与病毒性肝炎、疟疾、钩端螺旋体病、刚果-克里米亚出血热、裂谷热、伤寒、Q热、斑疹伤寒以及外科手术、药物诱发和毒性原因引起的黄疸(17).其他病毒性出血热,通常表现为无黄疸,包括登革出血热、拉沙热、马尔堡和埃博拉病毒病,以及玻利维亚、阿根廷和委内瑞拉出血热(48,49).
实验室确认
实验室诊断通常通过血清学试验检测血清以检测病毒特异性免疫球蛋白M (IgM)和免疫球蛋白G (IgG)抗体来完成(50).与其他黄病毒(如西尼罗病毒或登革热病毒)会发生血清学交叉反应,因此阳性结果应通过更特异的试验(如空斑减少中和试验)进行确认(49).在疾病的早期(最初3 – 4天),通常可以通过病毒分离或核酸扩增测试(例如,逆转录-聚合酶链反应[RT-PCR])在血清中检测到YFV或YFV RNA。然而,当发现明显症状时,病毒或病毒RNA通常是检测不到的。因此,病毒分离和RT-PCR不能用于排除YF的诊断。福尔马林固定材料的免疫组织化学染色可以检测组织病理学标本上的YFV抗原(51).卫生保健提供者应联系他们所在州或当地的卫生部门和CDC(电话:1-970-221-6400 ),寻求YFV感染诊断检测的帮助。
治疗和管理
尽管已经评估或根据经验使用了多种药物来治疗YF病,但是迄今为止,没有一种药物显示出特定的益处(52).管理是支持性的,基于症状和涉及的器官系统。多系统器官受累的患者可能需要重症监护支持,可能需要机械通气或血液透析。休息、液体和非甾体抗炎药或对乙酰氨基酚可以缓解发烧和肌痛的轻微症状。由于出血并发症的风险,应避免使用阿司匹林。在患病的最初几天,应防止感染者进一步接触蚊子(呆在室内和/或蚊帐下),这样他们就不会参与传播周期。
结果和后遗症
大多数轻度YF病患者康复后不会留下长期后遗症。对于那些患有严重疾病并伴有肝肾功能障碍的患者,病程长短不一,病死率为20% – 50%(1).死亡的危险因素包括低血压、休克、肾衰竭、严重出血性疾病、昏迷和惊厥(44).对于那些幸存下来的人来说,恢复期往往很长,持续数周。很少情况下,死亡会发生在恢复期结束时,甚至在急性疾病完全康复后的几周内。这些晚期死亡被认为是由于心肌损伤和心律失常(53).继发性细菌感染(如肺炎)也会使恢复变得复杂。在从血清学记录的YF中恢复后,已经观察到黄疸长达3个月(45).
旅行者中的黄热病
在1970年至2009年期间,报告了9例YF病例,发生在从美国和欧洲前往西非(5例)或南美(4例)的未接种疫苗的旅行者中(54–63).这九名旅行者中有八人死亡(19,40).仅在一名接种疫苗的旅行者中记录了一例YF,该旅行者为来自西班牙的37岁女性,她在1988年期间访问了几个西非国家(56).
旅行者感染YF病毒的风险由多种因素决定,包括免疫状况、针对蚊虫叮咬的个人防护措施的使用、旅行地点、暴露时间、旅行期间的职业和娱乐活动以及旅行时当地的病毒传播率。在西非和南美洲,YFV病毒的传播通常是季节性的,与雨季中后期有关()。然而,YFV可以通过以下途径传播Ae。埃及即使在农村和人口稠密的城市地区的旱季(41).尽管报告的人类疾病病例数经常被用来估计地方病传播的粗略水平,但病例可能没有报告,因为传播水平低,当地人口免疫力高(例如,因为接种疫苗),或病例没有被当地监测系统发现。因此,一个地区没有人类疾病病例并不等于没有传播风险。
由于病毒传播的生态决定因素的变化,感染YF病毒的风险很难预测。对于为期2周的停留,对于前往西非疾病流行地区的未接种疫苗的旅行者,YF引起的疾病和死亡风险估计分别为每100,000人中50例和10例;在南美洲,患病和死亡的风险分别为每100,000人中5例和1例(40).这些对未接种疫苗旅行者的粗略估计是基于对土著人群的风险,通常是在传播高峰季节。因此,这些风险估计可能没有准确反映旅行者的实际风险,他们可能具有不同的免疫特征,采取预防措施防止被蚊子叮咬,并减少户外暴露。在南美洲感染YF病毒的风险可能低于非洲,因为在森林树冠层的猴子之间传播病毒的蚊子不经常与人类接触,而且由于广泛使用疫苗,当地居民的免疫力相对较高。
黄热病疫苗
YF疫苗是在20世纪30年代成功削弱YFV的Asibi毒株(64).建立了两种疫苗:17D和法国亲神经疫苗。法国亲神经疫苗一直生产到1982年,当时由于使用疫苗后报告的神经系统不良事件发生率较高而停止生产(1).
目前生产了两种17D亚系疫苗:17D和17D-204 YF疫苗。这两种疫苗中的YFV毒株具有99.9%的序列同源性(65).17日龄YF疫苗在巴西生产,在巴西和许多其他南美国家使用。17D-204疫苗是在巴西以外生产和使用的,包括在美国。比较多家制造商生产的各种17D YF疫苗的研究表明,这些疫苗产生的反应原性或免疫反应没有差异(66–70).因此,在美国以外的其他国家接种YF疫苗的人应被视为受到保护,不会感染YF病毒。
疫苗成分、储存和处理
17D-204株疫苗,YF-VAX(由宾夕法尼亚州斯威夫特沃特的赛诺菲巴斯德公司生产),是离心胚胎匀浆的冻干上清液,包装在1剂量和5剂量小瓶中供国内使用。疫苗应储存在35度的温度下ºF – 46战斗机º女(2º八国集团ºc)直到通过添加由制造商提供的稀释剂(无菌生理盐水)将其复原。多剂量小瓶的重组疫苗应储存在35ºF – 46战斗机º女(2º八国集团ºc)长达1小时。任何未使用的疫苗,如果在复原后1小时内没有使用,必须丢弃(71).
保护的相关因素
尚未进行人体研究来确定对YFV感染的保护相关性。然而,在恒河猴中进行的剂量反应研究已经确定了保护猴子对抗剧毒YFV所需的最低水平的中和抗体。用恒定量的血清和不同稀释度的病毒进行测试,以建立记录10中和指数(LNI)。这些研究表明,LNI >0.7与保护作用密切相关(1,72).尽管LNI检测所需的血清量适合动物研究或临床试验,但它排除了在人类中进行常规筛查(1).因此,一种类似的试验,噬斑减少中和试验(PRNT ),使用恒定量的病毒和不同稀释度的血清,最常用于诊断试验,以确定中和抗体的存在与否和特异性血清抗体滴度。
功效和免疫原性
尚未对YF疫苗进行人体功效研究。然而,一些观察结果支持YF疫苗对人类具有保护作用,包括1)接种疫苗的工人的实验室相关感染减少,2)在巴西和其他南美国家首次使用疫苗后观察到YF仅发生在未接种疫苗的人群中,以及3)在流行病期间启动的YF疫苗接种活动期间,病例迅速消失。未发表的报告比较了1986年尼日利亚流行期间接种疫苗和未接种疫苗人群的YF发病率,估计疫苗有效性约为85%(1).从世界范围来看,自从YF疫苗开始使用以来,在疫苗接受者中只报告了5例YF病例;他们中的任何人或所有人是否正确接种了经过适当处理的YF疫苗尚不确定(1).
YF疫苗接种后,主要疫苗接受者经常出现低水平的疫苗病毒血症。病毒血症通常在3 – 7天内发生,并持续1 – 3天,随着YFV IgM抗体的产生而缓解(73,74).接种疫苗后的病毒血症水平高到足以通过血液制品传播。YF疫苗病毒的输血相关传播已在三名接受血液制品的人员中得到记录,这些血液制品是从献血前4天接种疫苗的人员收集的(75).
研究表明,80% – 100%接种疫苗的人在接种疫苗后10天内产生中和抗体(74,76,77).大多数研究表明,超过99%的接种疫苗的人在接种疫苗后28天内产生YFV中和抗体(1).总体而言,与针对野生型YFV病毒感染而产生的抗体相比,疫苗诱导的抗体形成延迟,且滴度较低(1).
一项针对1440名健康成年人的两种YF疫苗(YF-VAX和Arilvax)的研究发现,根据性别和种族的不同,对疫苗的中和抗体反应也不同。对于这两种疫苗,与女性、黑人和西班牙人相比,男性和白种人的LNI水平较高(66).接种YF疫苗的年龄似乎不会影响对疫苗的免疫应答(1).
《国际卫生条例》允许各国要求将YF疫苗接种证明作为来自某些国家的旅行者入境的条件,以防止YFV的输入和本土传播。《国际卫生条例》规定,YF疫苗接种证书在初次疫苗接种者接种YF疫苗后10天开始生效(78).这段时间相当于大多数接种者表现出免疫力的时间。国际旅行YF疫苗接种证书有效期为10年。这一时间间隔是基于已发表的研究,表明在接种疫苗后16 – 19年,超过90%的人存在中和抗体(79).后来对美国二战退伍军人的研究表明,在单剂YF疫苗接种30 – 35年后,80%以上的人有中和抗体;在某些亚组中,> 95%仍有中和抗体(80).
健康人接种YF疫苗后很少不产生中和抗体。在对照临床试验中,主要失败率一般约为1%(66).首次接种后未产生抗体的人可在再次接种后产生抗体(81).
三种宿主因素与YF疫苗免疫应答失败有关:妊娠、人类免疫缺陷病毒(HIV)感染和营养不良。在一项研究中,只有39%的孕妇在妊娠晚期接受疫苗后血清转化(82).这种差异归因于与怀孕相关的免疫状态的改变,并表明需要对怀孕期间接种疫苗的高危妇女进行再次接种。然而,最近的一项研究表明,425 441名无意中接种了YF疫苗(主要是在妊娠早期)的妇女中有98%产生了YFV特异性中和抗体(83).因此,怀孕期间接种疫苗的妇女可能没有必要再次接种疫苗,但应检查抗体滴度,以确保仍有患病风险的妇女产生适当的免疫反应。
HIV感染与对许多灭活疫苗和减毒活疫苗的免疫应答降低有关,包括YF疫苗(84).一些病例报告表明,对未免疫抑制的HIV感染者(CD4+t细胞计数[CD4计数]> 500/毫米3)导致血清转化(85).然而,最近的一项回顾性队列研究表明,与接种疫苗的未感染者相比,接种疫苗后1年,HIV感染者具有YFV中和抗体的人数明显减少(分别为83%和97%;p=0.01)(86).该研究测量了艾滋病毒感染者的YFV中和抗体,其基线CD4计数中位数为496个细胞/毫米3(范围:72 – 1,730个细胞/毫米3)以及在他们血液中检测到的不同水平的HIV RNA(52%的人HIV RNA水平≥50拷贝/mL)。在一个发展中国家感染HIV的婴儿中,只有17%在接种YF疫苗后10个月内产生了中和抗体,相比之下,74%未感染HIV的对照组在年龄和营养状况上相匹配(87).这种在HIV感染者中观察到的免疫反应差异的机制尚不确定,但似乎与HIV RNA水平和CD4计数相关。需要进一步的研究来评估这些发现的相关性。
不良事件
一般事件
YF疫苗接种后,接种者报告了5 – 10天的轻度头痛、肌痛、低烧或其他轻微症状(71).接种疫苗后一周内,注射部位可能会出现局部疼痛、肿胀、红斑或发热。在一项对1,440名疫苗接受者的大型研究中,最常见的全身副作用是头痛(33%的受试者)、肌痛(25%)、不适(19%)、发烧(15%)和寒战(11%)(66).这些副作用通常是轻微的,只有1%的接种者因此减少了日常活动。在对1007名接种YF疫苗(17-DD疫苗病毒株)或安慰剂的成人进行的唯一安慰剂对照试验中,3%报告的局部反应和7%的全身反应归因于疫苗(88).
疫苗不良事件报告系统(VAERS)是一个被动的疫苗接种后不良事件监测系统,由CDC和FDA合作运行。不良事件报告可以从各种来源提交给VAERS,包括疫苗提供者和接受者、医疗从业者和制造商。VAERS报告的YF疫苗不良事件发生率为每100,000剂分发43起不良事件(89).大多数报告的不良事件被归类为非严重不良事件(发生率:每100,000人中有38例),包括发热、注射部位疼痛、注射部位红斑、瘙痒、头痛、荨麻疹和皮疹。大多数事件发生在接种疫苗后的中位时间1天;大约60%发生在接种疫苗后的前两天。
2000 – 2006年期间,根据VAERS的数据,每100,000剂药物中有4.7起严重不良事件。年龄≥60岁人群的报告率最高(每100,000剂中有8.3例)。接种YF疫苗后会发生三种典型的严重不良事件:1)速发型超敏反应或过敏反应,2) YF疫苗相关的神经系统疾病(YEL-和),以及3) YF疫苗相关的内脏营养性疾病(YEL-AVD)。
2002年,疾病预防控制中心成立了黄热病疫苗安全工作组,由来自疾病预防控制中心和伙伴组织的疫苗安全专家组成。YFVS工作组系统地审查了YF疫苗的VAERS报告,并设计了YEL和YEL AVD的监测病例定义(方框1和2)来帮助对病例进行分类并确定这些不良事件的发生率。
过敏和过敏反应
YF疫苗的多种成分被认为是可能的过敏原,包括鸡蛋、鸡肉蛋白、明胶或乳胶(在瓶塞中发现) (71).以荨麻疹和呼吸系统症状(如呼吸困难、支气管痉挛或咽部水肿)为特征的速发型超敏反应或过敏反应并不常见,主要发生在对鸡蛋或其他物质(90).然而,据报道,过敏反应发生在对疫苗成分无反应史的人群中。VAERS数据的过敏反应发生率各不相同(范围:每100,000剂分发0.8 – 1.8起事件) (89,90).
YEL-还有
YEL-这是一个严重但很少致命的不良事件。YEL-并表现为几种不同的临床综合征,包括脑膜脑炎(嗜神经性疾病)、格林-巴利综合征(GBS)、急性播散性脑脊髓炎(ADEM)和延髓麻痹(91,92).脑膜脑炎是由于YF疫苗病毒直接侵入中枢神经系统(CNS)并感染脑膜和/或大脑而引起的。其他神经系统综合征(例如,GBS和ADEM)代表自身免疫性表现,其中响应于疫苗而产生的抗体和/或T细胞与神经元表位交叉反应,并导致中枢或外周神经损伤。
通过减毒过程,YF疫苗病毒株被确定发展成神经毒力(93,94).在疫苗历史的早期,与疫苗给药相关的多个脑炎病例被注意到,并被确定为可归因于减毒过程中病毒传代太少或太多。这一发现导致了1945年疫苗种子批系统的建立,该系统明确定义了某些疫苗株(95).然而,即使在实施种子批制度后,仍有与YF疫苗相关的脑炎病例报告。20世纪50年代早期进行的研究在接种YF疫苗的1,000名6个月以下的儿童中发现了4例脑炎病例(96).在20世纪50年代,世界范围内报告了另外10例与4个月以下婴儿接种YF疫苗相关的脑炎(1).因此,在20世纪60年代建议将YF疫苗的使用限制在年龄≥6个月的婴儿(97).随后,婴儿中报告的脑炎病例数量减少。
YFVS工作组对1990 – 2006年间发生的总共29例YEL和(9例脑膜脑炎、8例GBS、3例ADEM、1例延髓麻痹和8例数据不足无法分类的病例)进行了回顾性或前瞻性审查(91,92,98,99).这29例患者从接种疫苗到出现症状的时间不等(范围:3 – 28天)。对于有年龄数据的25例病例,年龄范围也有很大差异(范围:6 – 78岁)。据报告,所有病例都发生在首次接种疫苗者中。报告了一例死亡病例,该患者为一名53岁男性,患有未发现的无症状人类免疫缺陷病毒(HIV)感染,CD4计数< 200/mm3 (98).患者在接种疫苗后3天出现发热和不适,并在接种疫苗后5天出现脑病。他在接种疫苗后第9天死亡。
关于不同神经病学表现的具体年龄和疾病发作的数据可以从VAERS报告(91).在6例报告的脑炎病例中,中位年龄为54岁(范围:16 – 78岁),接种疫苗后的中位发病时间为14天(范围:5 – 24天)。对于6例GBS病例,中位年龄为53岁(范围:17 – 68岁),接种疫苗后的中位发病时间为13天(范围:7 – 27天)。最后,对于三例ADEM病例,中位年龄为19岁(范围:18 – 61岁),接种疫苗后发病的中位时间为15天(范围:7 – 20天)。
最近发表的一份报告首次报道了一例56岁男性纵向脊髓炎,该患者未接受其他疫苗(100).在他的脑脊液(CSF)中检测到YFV IgM抗体,其他区域性黄病毒的血清学检测为阴性。然而,出现症状的时间是接种疫苗后45天,这比所有其他YEL和病例报告的时间都长。第二个最近发表的报告涉及一名23岁的男性,他最初表现为脑膜脑炎,但后来被确定为ADEM(101).ADEM的诊断是通过脑部磁共振成像确定的。
YEL的诊断测试-和具体的临床表现。对于脑膜炎或脑炎病例,通过培养或核酸扩增检测脑脊液中的YF疫苗病毒是诊断性的。脑脊液中YFV IgM和特异性中和抗体的检测也支持诊断。YFV IgM抗体被认为不能正常穿过血脑屏障,因此它们在CSF中的产生被认为是局部CNS感染的指示。对于自身免疫介导的事件,没有特定的YF测试可用。应通过适当的研究(例如,神经影像学、脑电图、肌电图和神经传导研究)对这些疾病进行诊断。因为对于ADEM和GBS的自身免疫性综合征,不存在确诊的YFV特异性实验室检测,所以YFVS工作组病例定义只规定了“可疑”和“可能”的因果关系水平。如果不存在其他诊断的证据,则根据YF疫苗是否是唯一接种的疫苗对病例进行进一步分类。美国疾病控制与预防中心可通过以下网址获得疑似YEL病例的诊断检测http://www . CDC . gov/NCI DOD/dv bid/yellow fever/vaccine/special-testing . htm.
YEL的治疗——也取决于特定的临床综合征。脑膜脑炎的治疗是支持性的,癫痫发作或自主神经功能障碍等表现应根据每种疾病的可接受医学标准进行处理。对于与YF疫苗相关的自身免疫性神经系统表现,治疗通常包括静脉注射免疫球蛋白(IVIG)或血浆置换(GBS)以及皮质类固醇、IVIG或血浆置换(ADEM)102,103).
YEL——而且很少是致命的。除了先前描述的一例艾滋病毒携带者患致命性脑炎的病例外,还报告了另外4例可归因于YEL的死亡病例1,104).一例致命的脑炎病例发生在一名3岁女童,她于1965年接种了疫苗(104).对从该患者脑中分离的YF疫苗病毒的分子研究表明,该病毒已经突变,并且变得更具神经毒性,如猴子研究中所记载的(105).这是唯一一个疫苗病毒的突变与接受者的不良结果相关的案例。1993年大规模疫苗接种运动后,肯尼亚一个以医院为基础的疫苗后脑炎监测系统非正式地报告了另外三例致命的YEL和病例(1).
根据实施疫苗接种年龄限制之前的报告,估计非常小的婴儿中YF疫苗相关脑炎的发病率为每100,000人中50 – 400例(96,106).根据VAERS的数据,YEL和的报告率为每100,000剂分发0.4 – 0.8例(89,107).年龄≥60岁者的报告率较高,60 – 69岁者的报告率为每100,000剂1.6例,年龄≥70岁者的报告率为每100,000剂1.1 – 2.3例。鉴于报告不足,这些估计数很可能偏低。在YF流行的国家,可能不存在国家疫苗不良事件监测系统,或者,如果存在,也应具有足够的一致性和敏感性来检测大多数YEL病毒和确实发生的病例。然而,在大规模疫苗接种运动后,一份来自肯尼亚基于医院的疫苗后脑炎监测系统的非官方报告估计YEL的发病率为每100,000剂0.6例(1).
YEL AVD
在2001年,YF疫苗接种者中以前未被认识到的严重不良反应首次被描述(48,108–113).这种综合征最初被称为发热性多器官系统衰竭;该名称随后被改为YEL-AVD。YEL-AVD模拟自然获得的YF病,疫苗病毒在宿主组织中增殖和传播。
截至2010年2月,共有14个国家(澳大利亚、比利时、巴西、中国、哥伦比亚、厄瓜多尔、法国、德国、日本、秘鲁、西班牙、瑞士、英国和美国)向CDC报告了57例YEL-AVD病例。这些病例与几家制造商生产的YF疫苗的不同亚系有关。根据对可获得信息的病例的分析,YEL-AVD仅在接受者首次接种YF疫苗后发生;没有在接受加强剂量疫苗的人群中发生YEL-AVD病例的报告。在已知性别的53名YEL-AVD患者中,32名(60%)为男性。总体中位年龄为50岁(范围:3 – 81岁),但性别不同,男性中位年龄为62岁(范围:4 – 81岁),女性中位年龄为24岁(范围:3 – 79岁)。从接种疫苗到症状出现的中位时间为3天(范围:1 – 8天)。在57例患者中,37例(65%)死亡,女性(19例[90%])的病死率高于男性(16例[50%])(两例死亡病例的性别未知)。从YF疫苗接种到死亡的中位时间是10天(范围:7 – 30天)。性别间的年龄和病死率差异是否反映了性别特异性宿主因素,或者是监测或报告偏倚的作用尚不清楚。
YEL-AVD患者通常在接种疫苗后1周内出现发热和其他非特异性体征和症状(包括头痛、不适、肌痛、恶心、呕吐或腹泻)。随着病情的发展,可能会出现黄疸和实验室异常(如血小板减少、肝转氨酶、总胆红素和肌酐升高)。根据疾病的阶段和严重程度,可能出现白细胞减少或白细胞增多。病情严重的人会出现低血压、出血、需要血液透析的肾衰竭和需要机械通气的呼吸衰竭。不太常见的并发症包括横纹肌溶解和弥散性血管内凝血。YEL-房室传导阻滞没有特定的治疗方法,假设已经排除了其他疾病,治疗是支持性的。
YF疫苗特异性实验室检测有助于做出诊断。在接种疫苗的前7天内,患者血清中高水平的YF疫苗病毒或在接种疫苗后超过7天的血液中持续存在复制型YF疫苗病毒的记录与YEL-AVD一致(可能病例)。在死亡病例中,当进行尸检时,可以在固定的组织上进行免疫组织化学以检测YFV抗原,并且可以在从冷冻组织中提取的RNA上进行RT-PCR以验证相对于野生型YFV的YF疫苗病毒的存在。肝组织可能具有特征性的组织病理学发现(例如,中带坏死、微泡脂肪变化和议员体) (114).美国疾病控制与预防中心可提供疑似YEL-AVD病例的诊断检测,网址为http://www . CDC . gov/NCI DOD/dv bid/yellow fever/vaccine/special-testing . htm.
YEL-房室传导阻滞的几个风险评估已经发表。根据VAERS的数据,YEL-AVD的报告率为每100,000剂分发0.3 – 0.4例(89,107).与YEL和相似,在≥60岁的人群中报告率也最高,在60 – 69岁的人群中每100,000剂有1.0 – 1.1例,在≥70岁的人群中每100,000剂有2.3 – 3.2例。对1996 – 2003年间发生在欧洲的YEL-AVD病例的分析得出,总发病率为每100,000剂分发0.3例(92).一项基于4例YEL-AVD致死病例的巴西分析得出的致命YEL-AVD风险估计值范围为每100,000剂用药< 0.01至0.21(115).然而,来自巴西的更近期的风险估计已经确定了YEL-房室传导阻滞的总体发生率与美国和欧洲的相似(CDC,未发表的数据,2010)。
几乎所有YEL-AVD病例都发生在接受不同批次疫苗的人群中。然而,至少有一个已知的群集已被报告,涉及与同一批YF疫苗有关的五例YEL-AVD(116).该聚集发生在2007年,此前在秘鲁一个该疾病非地方病的地区开展了疫苗接种活动。4名患者死于确诊的YEL-房室传导阻滞。本次活动中YEL-房室传导阻滞的总发生率为每100,000剂分发7.9例,相比之下,相关批次的特定批次发生率为每100,000剂分发11.7例。一项彻底的调查没有检测到相关疫苗批次的异常,也没有在五名病例患者中发现共同的风险因素。在秘鲁,与此运动相关的YEL-AVD的发生率大大高于以前其他国家的风险估计值,并且仍然无法解释。
迄今为止,YEL-房室传导阻滞的两个特定危险因素已被确定:年龄较大和胸腺疾病或胸腺切除术史。对美国YEL-AVD VAERS报告的两项分析得出年龄≥60岁人群的YEL-AVD报告率为每100,000剂分发1.4 – 1.8例(89,107).这一特定年龄比例比报告的每100,000剂分发0.3 – 0.4例的总体比例高出几倍。前23名确诊的YEL-AVD患者中有4名(17%)有良性或恶性胸腺瘤的胸腺切除术史(117).这些病例的细节表明,胸腺疾病史是YEL-AVD的一个危险因素。在2003年,在美国上市的YF疫苗的包装说明书被更新为包括胸腺疾病史作为疫苗施用的禁忌症(71).自2004年以来,没有新发现的YEL-AVD病例涉及胸腺疾病史。
许多YEL-AVD病例涉及自身免疫性疾病史或具有潜在自身免疫性病因的疾病。其中包括三名系统性红斑狼疮患者、两名艾迪生病患者、一名缓解期克罗恩病患者、一名有风湿性多肌痛和甲状腺功能减退病史的患者、一名溃疡性结肠炎患者和一名重症肌无力患者(108,116,117;美国疾病预防控制中心,未公布的数据,2010年)。这些病例表明,自身免疫性疾病可能是YEL-AVD的一个危险因素。然而,四名患有潜在自身免疫性疾病的患者年龄大于60岁,其中两人有胸腺瘤胸腺切除术史;这两个因素都与YEL-房室传导阻滞风险增加相关。因此,需要更多关于安全接种疫苗的潜在自身免疫性疾病患者数量的信息,以更好地解决自身免疫性疾病患者YEL-AVD的潜在风险。
尽管对某些YEL-AVD病例的研究已经确定了潜在的遗传风险因素(118),未发现常见的遗传异常。没有确凿的证据表明YEL-AVD是由疫苗毒力回复增强引起的(114,119).
怀孕和哺乳期间妇女的疫苗接种
没有关于孕妇或哺乳期妇女及其胎儿或婴儿患YF病风险的数据。然而,根据监测和疫情数据,孕妇和哺乳期妇女似乎没有患更严重的YF病的风险。
YF疫苗在妊娠期间的使用尚未在大型前瞻性试验中进行研究(FDA妊娠C类)。从一些研究中可以获得有限的数据,在这些研究中,孕妇要么无意中接种了疫苗,要么在疫情爆发时接种了疫苗。两项研究涉及81名母亲接种过YF疫苗的婴儿,在一名婴儿出生后不久的脐带血中发现了YFV IgM抗体(82,120).这些发现表明,胎儿感染YF疫苗是可能发生的,尽管发生率很低(即81分之一)。一项对304名在怀孕早期接种YF疫苗的母亲所生婴儿的研究发现,重大畸形(121).轻微畸形(如色素痣)的风险增加,但这一发现可能源于评估偏差。一项对39名接种YF疫苗的孕妇的研究发现,接种疫苗的孕妇自然流产率较高,相对风险为2.3,但差异无统计学意义(95%置信区间= 0.7-8.0;p=0.2)(122).最近一项对441名怀孕早期意外接种疫苗的妇女的研究没有发现胎儿死亡风险增加(接种疫苗的妇女为7.4/1000,而普通人群中未接种疫苗的妇女为18.5/1000)(83).
在怀孕期间接种疫苗的妇女产生YFV抗体的比例是可变的,可能与她们接受疫苗的妊娠三个月有关。在101名主要在妊娠晚期接受YF疫苗的孕妇中,39%有血清转化为YFV病毒的证据(82).在433名主要在妊娠早期接种疫苗的妇女中,425名(98%)产生了YFV特异性中和抗体(83).因为怀孕可能会影响免疫功能,所以应该考虑进行血清学试验来证明对疫苗的免疫反应。
没有证据表明母乳喂养的母亲对YF疫苗的反应有所改变。关于母乳喂养的妇女及其婴儿使用YF疫苗的安全性数据非常有限。一例可能的YEL病例和一例确诊病例——据报告,婴儿的母亲接种了YF疫苗(PHAC,未公布的数据,2008; 123).这两名婴儿都是纯母乳喂养,在暴露时年龄小于1个月,并且他们自己没有接种过疫苗。从确诊病例患者的脑脊液中发现了YF疫苗病毒,在疑似病例患者的脑脊液中检测到了YFV特异性IgM抗体。在这两种情况下,均未对母乳进行检测以确认疫苗病毒的存在。在母乳中发现了来自西尼罗河病毒(一种相关的黄病毒)的RNA,这表明这是一种可能的传播方式(124,125).需要进一步的研究来记录通过母乳喂养暴露于疫苗的潜在风险。
YF疫苗建议的基本原理概述
YF是一种媒介传播疾病,由受感染的蚊子叮咬将YFV病毒传播给人类引起。它是撒哈拉以南非洲和热带南美洲的地方病。人类感染可导致出血热,20% – 50%的重症患者会死亡。因为YF病没有治疗方法,所以预防对降低疾病风险和死亡率至关重要。
旅行者感染YF病毒的风险由多种因素决定,包括疫苗接种状况、旅行地点、季节、暴露时间、旅行时的职业和娱乐活动以及旅行时当地的病毒传播率。尽管自1970年以来,仅报告了10例来自欧洲(7例)或美国(3例)旅行者的输入性YF病例,但这一低病例数很可能,至少部分是由于疫苗的常规使用。为了最大限度地减少疾病向新地区的潜在输入和传播,许多国家实施了IHR,并对入境者有疫苗要求。
关于对旅行者使用YF疫苗的决定必须考虑旅行相关YFV病的总体风险、发生时的高死亡率、IHR的疫苗需求、疫苗接种的禁忌症或注意事项以及YF疫苗接种后严重不良事件的风险。
实验室工作人员使用YF疫苗的建议
YF疫苗推荐给可能通过直接或间接接触或气溶胶暴露于剧毒YFV或YF疫苗病毒株浓缩制剂的实验室人员。
预防旅行者感染YF的建议
所有前往YF流行国家的旅行者都应被告知该疾病的风险以及预防该疾病的可用方法,包括个人防护措施和疫苗。
个人防护措施
所有旅行者都应采取预防措施,避免蚊虫叮咬,以降低YF和其他病媒传染疾病的风险。这些预防措施包括使用驱虫剂,穿氯菊酯浸渍的衣服,住在有屏蔽或空调的房间里。有关防蚊和其他节肢动物的更多信息,请访问http://wwwnc . CDC . gov/travel/yellow book/2010/chapter-2/protection-against-蚊子-蜱-昆虫-节肢动物. aspx.
对旅行者使用YF疫苗的建议
YF疫苗推荐给年龄≥9个月,正在南美洲和非洲有YFV传播风险的地区旅行或居住的人。有YFV病毒传播风险的国家已被列出(表1).对于这些国家中的许多国家来说,只有部分国家面临YFV传播的风险(图2)。鉴于流行地区的指定可能会发生变化,旅行者和卫生保健提供者应从CDC获得最新信息,可从以下网址获得http://wwwnc . CDC . gov/travel/yellow book/2010/chapter-2/yellow-fever . aspx.
进入某些国家可能需要YF疫苗。特定国家的要求列表可从以下网址获得http://wwwnc . CDC . gov/travel/yellow book/2010/chapter-2/黄热病疫苗要求和建议. aspx。这些要求是强制性的,主要是为了防止YFV病毒在特定国家的输入和传播。然而,《国际卫生条例》规定,如果医疗服务提供者判断YF疫苗接种在医学上是禁忌的,则医疗服务提供者可以向旅行者签发YF疫苗接种弃权书,以满足这些要求。
由于YF疫苗接种后可能发生严重不良事件的风险,卫生保健提供者应只为有暴露于YF病毒风险或入境时需要疫苗接种证明的人接种疫苗。为了进一步降低严重不良事件的风险,医疗保健提供者应仔细观察禁忌症,并在接种YF疫苗前考虑预防接种措施,并在需要时提供医疗弃权书(表2).
国际旅行前接种疫苗的要求
某些国家要求所有入境旅客提供疫苗接种证明,包括从美国直接入境的旅客(34).没有疫苗接种证明,到达YF疫苗接种入境要求的国家的旅客可能被隔离长达6天。
《国际卫生条例》对YF疫苗接种证明的入境要求不同于ACIP或CDC的建议。这些要求是强制性的,主要是为了防止YFV病毒在特定国家的输入和传播。CDC的建议是根据现有最佳流行病学数据向旅行者提供的公共卫生建议,以防止前往有YFV传播风险的国家的旅行者感染YFV病毒。
出于国际旅行的目的,YF疫苗必须在经批准的YF疫苗接种中心接种。在美国,州和地区卫生部门有权指定非联邦疫苗接种中心,并向这些中心发放YF疫苗。指定疫苗中心的名单可从CDC获得,网址为http://wwwnc.cdc.gov/travel或者可以从州或地方卫生部门获得。
作为收到YF疫苗的证明,所有接种者都应持有完整的国际疫苗接种或预防证书(ICVP),并经供应商签名和YF疫苗接种中心官方盖章确认(图3).一个ICVP必须在每个细节上是完整的;如果不完整或不准确,则无效。安全验证的失败可能导致旅行者被隔离、被拒绝入境,或者可能在某个国家的入境点重新接种疫苗。一些国家不要求小于特定年龄的婴儿(例如小于6个月、< 9个月或< 1岁,视国家而定)使用ICVP。有关各国疫苗接种年龄要求的信息,请访问http://wwwnc.cdc.gov/travel.
疫苗接种证书自接种之日起10天后开始生效,有效期为10年。如果在这10年期间内接种了加强剂量的疫苗,则该证书自最近一次接种之日起被视为有效。
《国际卫生条例》规定,如果医疗服务提供者判断YF疫苗接种在医学上是禁忌的(参见禁忌症和注意事项),医疗服务提供者可以向旅行者签发YF疫苗接种弃权书。在这种情况下,医生应填写并签署ICVP(图4),提供一封有签名和日期的信笺,明确说明禁忌症,并盖有该中心的YF疫苗接种官方印章。提供者应告知旅行者任何与未接种疫苗相关的YF病毒感染风险的增加,以及如何将这种风险降至最低。除了医学禁忌症以外的原因不接受免于接种疫苗。还应告知旅行者目的地国家可能不接受医疗豁免。
因为要求和建议可能会改变,所有旅行者应该在旅行前从卫生部门、疾病预防控制中心和世卫组织寻求最新信息。旅行社、国际航空公司或航运公司也可能有最新的信息。有关疫苗接种要求和建议的最新信息,请访问http://wwwnc.cdc.gov/travel.
黄热病疫苗的施用
剂量和用法
对于需要接种疫苗的所有年龄的人,使用0.5 mL重组疫苗的单次皮下注射。根据包装说明书,疫苗需要在复原后1小时内注射(71).复溶后,多剂量小瓶应保持在35°F-46°F(2°C-8°C ),剩余剂量应在1小时内使用或丢弃。
尽管有限的数据表明YF疫苗可能在有效期后保持其效力(126),包装插页说明疫苗过期后不得使用。根据ACIP关于免疫接种的一般建议,一剂过期疫苗不应被视为有效,应在28天间隔后使用非过期疫苗重复接种该剂疫苗(127).如需更多关于意外注射过期疫苗的指导,卫生保健提供者应联系疫苗制造商。
如果无意中通过肌肉注射途径接种疫苗,对疫苗的反应可能不会受到影响。通过肌内途径而不是皮下途径施用疫苗的重复剂量是不必要的(127).
据报道,过敏反应发生在对疫苗成分无反应史的人群中。考虑到这一点,所有人在接种疫苗后应接受至少15分钟的观察,并且应随时准备好肾上腺素注射液(1:1,000 ),以防出现严重的过敏反应。此外,由于接种YF疫苗后反应会延迟数小时,因此应告知所有患者过敏反应的体征和症状(例如荨麻疹、血管性水肿、皮疹、呼吸困难、支气管痉挛、咽部水肿、喘息和咽部紧缩)。此外,如果接种疫苗后出现任何过敏反应症状,应建议接种疫苗者立即就医。
在接受从最近接种过疫苗的人身上采集的血液制品的人群中,已记录了与输血相关的黄热病疫苗病毒传播(75).献血中心应筛选献血者,以确定他们是否在前两周内接种了黄热病疫苗,并推迟这些献血者。然而,不同采血中心的做法不同,关于疫苗接种史的问题可能不会被例行询问。因此,卫生保健提供者应建议人们在接种YF疫苗后推迟两周献血。
加强剂量
个人健康记录要求每隔10年重新接种疫苗以提高抗体滴度。多项研究的证据表明,YF疫苗免疫持续数十年,并可能提供终身保护(79,80,128,129).
为了最大限度地减少不良事件的发生并优化免疫反应,应努力观察YF疫苗剂量之间的10年间隔。然而,有限的数据表明,前一次给药后< 10年再次接种疫苗不会增加不良事件的风险(74),特别是因为严重的不良事件主要发生在初次接种YF疫苗之后。尽管再接种后形成的YFV特异性抗体的水平似乎与先前存在的抗体的量成反比(130),没有数据表明早期再接种会对血清保护产生负面影响。如果不能确定最近一次接种疫苗的日期,并且患者需要接种疫苗,则应给予加强剂量。
同时施用其他疫苗或药物
是否同时注射YF疫苗和其他免疫生物制剂(即在同一天但在不同的注射部位注射)应根据旅行者在旅行前完成所需疫苗接种的便利性以及有关可能的免疫干扰的信息来决定。
没有证据表明灭活疫苗和YF疫苗会干扰对疫苗的免疫反应。因此,灭活疫苗可以同时或在YF疫苗接种之前或之后的任何时间给药(127).YF疫苗应与其他活病毒疫苗同时接种或间隔30天接种,因为如果在另一种活病毒疫苗的30天内接种,对一种活病毒疫苗的免疫应答可能会受损(131,132).有限的数据表明,在接种YF疫苗后30天内非同时接种麻疹疫苗不会抑制对YF疫苗的血清学反应(133).然而,在这项研究中没有评估对麻疹疫苗的血清学反应。由于给药途径不同,口服Ty21a伤寒疫苗可同时给药或在YF疫苗之前或之后的任何时间间隔给药(34).
与YF疫苗同时施用而不干扰对疫苗的免疫反应或导致异常安全性特征的疫苗包括卡介苗(134),白喉(135,136)、甲型肝炎(137,138)、乙肝(139)、流感(140),麻疹(133),脑膜炎球菌(Menomune)(141),百日咳(136),小儿麻痹症(135),天花(136,142),破伤风(135,136),和伤寒(均可注射[138]和口头[143,144]).没有关于YF疫苗和狂犬病、人乳头瘤病毒、日本脑炎、减毒流感或水痘病毒疫苗之间可能干扰的数据(145).
对同时接种YF疫苗和免疫球蛋白的人进行的研究发现,与对照组(即单独接种YF疫苗)相比,对YF疫苗的免疫应答没有变化(146,147).尽管氯喹在体外抑制YFV的复制,但它不会对接受抗疟疾预防治疗的人群对YF疫苗的抗体反应产生不利影响(148).
没有关于YF疫苗和潜在抑制结核菌素皮肤试验(TST)反应的数据。然而,由于使用减毒活麻疹疫苗理论上可抑制TST反应性而导致假阴性反应,ACIP的一般免疫建议建议TST应与YF疫苗同时施用或在接受YF疫苗后4周(127).或者,可以在接种YF疫苗前进行TST筛查。但是,如果最近接种了YF疫苗,TST筛查应在接种疫苗后至少延迟4周(127).
禁忌症
对疫苗成分过敏
对任何疫苗成分(包括鸡蛋、蛋制品、鸡肉蛋白或明胶)有过敏史的人禁用YF疫苗。疫苗小瓶中使用的塞子也含有干胶乳橡胶,这可能会引起过敏反应(71).
根据制造商的说法,能够吃鸡蛋或蛋制品的人可以接种疫苗。然而,对鸡蛋有轻微过敏反应史的人可能会出现潜在的过敏反应。对于鸡蛋过敏的人,在注射疫苗前可以进行划痕试验或皮内试验,以检查反应性。如果一个人有严重的鸡蛋过敏或对疫苗的皮肤试验呈阳性,但由于其旅行目的地的特定风险而建议接种疫苗,脱敏可在有过敏反应管理经验的医生的直接监督下进行。脱敏程序详见产品说明书(71).
考虑到过敏反应的风险,即使在对疫苗成分没有反应史的人群中,也应在接种疫苗后对所有人进行至少15分钟的观察,并且应随时准备好肾上腺素(1:1,000 ),以防出现严重的过敏反应。应告知接种者过敏反应的症状,如果接种后出现任何过敏反应症状,应建议其立即就医。
小于6个月的婴儿
小于6个月的婴儿禁用YF疫苗。这种禁忌症是在20世纪60年代末为应对YEL的高发病率而制定的,并记录在接种疫苗的婴儿(97).婴儿神经毒性增加的机制尚不清楚,但可能归因于血脑屏障的不成熟、更高或更长时间的病毒血症或免疫系统的不成熟。
免疫状态改变
胸腺疾病
患有与异常免疫细胞功能相关的胸腺疾病(如胸腺瘤或重症肌无力)的人禁用YF疫苗(149).在最初报告的23例YEL-AVD病例中,有4例(17%)出现在因胸腺瘤而接受胸腺切除术的患者中(117).2003年,胸腺疾病作为禁忌症被添加到YF疫苗包装说明书中。迄今为止,没有证据表明,在曾接受过附带手术切除胸腺或在遥远的过去接受过间接放射治疗的人群中,免疫功能障碍或YF疫苗相关严重不良事件的风险增加。因此,如果根据目的地特异性YF风险有指征,YF疫苗可用于接受过附带手术切除胸腺或有胸腺放射治疗远期史的患者。
艾滋病和艾滋病毒感染伴有严重的免疫抑制
YF疫苗禁忌用于患有获得性免疫缺陷综合征(艾滋病)或其他艾滋病毒临床表现的人(150,151),包括每毫米CD4计数< 200的人3或小于6岁儿童淋巴细胞总数的15%。这一建议是基于理论上该人群患脑炎的风险增加。据报道,一例致命的YEL病例发生在一名先前未确诊的艾滋病毒感染者身上,其CD4细胞计数为108细胞/毫米3谁接种了YF疫苗(98).尚未进行大型前瞻性随机试验来充分说明YF疫苗在该人群中的安全性和有效性。几项回顾性和前瞻性研究共纳入了约450名接受YF疫苗的HIV感染者,未报告其他严重不良事件。然而,这些研究包括CD4计数< 200/mm的成人的有限子集(n = 10)3 (84–87,98,152–155).
如果根据CD4细胞计数(小于200/mm)判断,患有严重免疫抑制的人无法避免前往YF流行地区3或总数< 15%)或有症状的艾滋病毒,应提供医疗豁免,并应强调关于防止蚊虫叮咬的保护措施的咨询。(参见不符合这些标准的其他HIV感染者的注意事项。)
胸腺疾病或艾滋病毒感染以外的免疫缺陷
YF疫苗禁用于患有原发性免疫缺陷、恶性肿瘤和移植(127).虽然没有关于这些人使用YF疫苗的数据,但推测他们发生YF疫苗相关严重不良事件的风险增加。将公布更多关于禁用活病毒疫苗(如YF疫苗)的原发性免疫缺陷的具体信息(127).一般来说,实体器官移植或造血干细胞移植受体在移植后2年内,或移植发生在> 2年前但仍在服用免疫抑制药物的人,被视为免疫抑制(156).有恶性肿瘤或移植史的人应推迟接种活病毒疫苗,直到免疫功能显著改善。这最好由熟悉患者和患者潜在的医疗状况和治疗的医生与YF疫苗接种中心协商确定。如果患有免疫缺陷的人无法避免去YF流行的地区旅行,应提供医疗豁免,并应强调预防蚊虫叮咬的保护措施的咨询。
免疫抑制和免疫调节疗法
YF疫苗禁忌用于免疫反应被当前或最近的放射疗法或药物抑制或调节的人。具有已知免疫抑制或免疫调节特性的药物包括高剂量全身性皮质类固醇、烷化剂、抗代谢药、TNF-α抑制剂(如依那西普)、IL-1阻断剂(如阿那金娜)和其他靶向免疫细胞的单克隆抗体(如利妥昔单抗、阿仑单抗)。没有关于接受这些治疗的人使用YF疫苗的具体数据。然而,据推测,这些人发生YF疫苗相关的严重不良事件的风险增加,根据这些疗法的包装说明书,这些人禁用减毒活疫苗(127).
虽然皮质类固醇的免疫抑制作用可能有所不同,但对于体重> 10 kg的人,服用≥2 mg/kg体重或总计≥20mg/天的泼尼松或其等效物,持续≥2周,被认为具有足够的免疫抑制作用,足以禁止使用减毒活疫苗(127).皮质类固醇在下列情况下不属于禁忌症:短期(即< 2周);低至中等剂量(每天< 20毫克泼尼松或其等效物);用短效制剂进行长期隔日治疗;维持生理剂量(替代疗法);或局部给药(皮肤或眼睛)、吸入或通过关节内、囊内或腱内注射(127).
在免疫功能改善之前,已停止这些治疗的患者应推迟使用活病毒疫苗。这最好由熟悉患者基础疾病的医生和患者的药剂师来确定,他们可以帮助确定免疫抑制药物的具体半衰期和免疫抑制的潜在持续时间。如果接受免疫抑制或免疫调节治疗的人无法避免去YF流行的地区旅行,应提供医疗豁免,并强调对蚊虫叮咬的保护措施的咨询。
预防 措施
6–8个月的婴儿
6–8个月大是黄热病疫苗接种的预防措施。在<6个月大的婴儿中,YEL-AND的发生率显着升高(每50,400名接种疫苗的婴儿中有100–000例)(96,106)。在6–8个月的婴儿中报告了两例YEL-AND病例(96)。到 9 个月大时,YEL-AND 的风险被认为大大降低。一般而言,在可能的情况下,应推迟或避免6-8个月大的儿童前往黄热病流行的国家。如果旅行是不可避免的,那么在决定是否为这些婴儿接种疫苗时,需要平衡黄热病病毒暴露风险和接种疫苗后不良事件的风险。
≥60岁以上的成年人
年龄 ≥60 岁是接种黄热病疫苗的预防措施,特别是如果要接种第一剂黄热病疫苗。最近对2000-2006年期间向VAERS报告的不良事件的分析表明,与年轻人相比,≥60岁的人在接种疫苗后发生任何严重不良事件的风险增加(89)。≥60岁人群的严重不良事件发生率为每8,3剂100.000次,而所有黄热病疫苗接种者每4,7剂次发生率为100.000次。这加强了1990-1998年VAERS数据的发现,该数据报告说,≥7岁人群的严重不良事件发生率是参照组(5–60岁人群)的19.29倍(107)。该年龄组的YEL-AND和YEL-AVD风险也有所增加,每分发1万剂报告病例数分别为8.1例和4.100例,而所有黄热病接种者每分发000万剂报告病例数为0.8例和0.4例。鉴于 YEL-AND 和 YEL-AVD 几乎只见于初次疫苗接种者,因此对于可能首次接种 YF 疫苗的老年旅行者应谨慎行事。如果旅行是不可避免的,那么为≥100岁的旅行者接种疫苗的决定需要根据他们接触黄热病病毒的特定目的地风险来权衡接种疫苗的风险和益处。
中度免疫抑制的无症状 HIV 感染
中度免疫抑制的无症状 HIV 感染(即 ≥4 岁人群的 CD200 计数为 499–3/mm6,<15 岁儿童占总淋巴细胞的 24%–6%)是接种黄热病疫苗的预防措施。尚未进行大型前瞻性随机试验来充分讨论黄热病疫苗在该人群中的安全性和有效性。包括约450名HIV感染者的几项回顾性和前瞻性研究报告称,根据CD4计数(84–87,152–155),被认为中度免疫抑制的患者没有发生严重不良事件。
HIV感染与对许多灭活和减毒活疫苗(包括YF疫苗)的免疫反应降低有关(84)。在最近的一项回顾性队列研究中,65 名 HIV 感染者中有 83 名 (78%) 在接种疫苗后的第一年产生了针对 YFV 的特异性抗体;然而,这明显低于未感染HIV的接种疫苗者(97%[64/66];p=0.01)(86)。在发展中国家的HIV感染婴儿中,17名婴儿中只有18名(10%)在接种疫苗后42个月内产生了YFV特异性中和抗体,而在74名未感染HIV的对照中,有57名(87%)与年龄和营养状况相匹配(4名)。HIV感染者免疫反应减弱的机制尚不确定,但似乎与HIV RNA水平和CD1计数有关。由于无症状的HIV感染者的疫苗接种效果可能不如未感染HIV的人有效,因此在旅行前应考虑测量他们对疫苗接种的中和抗体反应。卫生保健提供者应联系相应的州卫生部门或疾病预防控制中心(电话:970-221 6400-<>),以进一步讨论血清学检测。
对于对抗逆转录病毒治疗产生免疫重建反应的HIV感染者,应使用其当前的CD4计数和HIV感染症状(如果在3个月内稳定)而不是CD4计数最低点和既往机会性感染/有症状HIV的病史来对其HIV状况进行分类(156)。值得注意的是,据报道,有一例 YEL-AVD 病例在确定为趋化因子受体 CCR5 基因多态性的人中 (118)。因此,人们担心,尽管具有足够的免疫功能,但正在接受含有CCR5受体拮抗剂的抗逆转录病毒方案的HIV感染者在接种黄热病疫苗后发生不良事件的风险可能增加(157)。需要进一步的研究来解决这个问题。
如果一名中度免疫抑制的无症状艾滋病毒感染者前往黄热病流行的地区,可以考虑接种疫苗。接种疫苗者在接种疫苗后应密切监测,以发现不良事件的证据。如果发生不良事件,应提交VAERS报告,并应通知州卫生部门或CDC,以获得诊断检测的技术支持和帮助。如果为艾滋病毒感染者接种疫苗的唯一原因不是国际旅行要求而不是增加感染黄热病病毒的风险,则应免除该人的疫苗接种资格,并签发医疗豁免书以符合卫生法规。如果无症状的HIV感染者没有基于CD4计数的免疫抑制证据(CD4计数为CD500计数≥3/mm25或<≥6岁儿童总淋巴细胞的<>%),则可以接种黄热病疫苗,如果根据其目的地特异性黄热病风险提出建议。(见其他不符合这些标准的艾滋病毒感染者的禁忌症。
怀孕
与大多数其他活疫苗相比,怀孕是接种黄热病疫苗的一种预防措施,这些活疫苗在怀孕期间是禁忌的。如果旅行是不可避免的,并且认为暴露于黄热病病毒的风险大于接种疫苗的风险,则应为孕妇接种疫苗。如果认为接种疫苗的风险大于黄热病病毒暴露的风险,应向孕妇发放医疗豁免书,以符合卫生法规。虽然没有具体数据,但女性在接种黄热病疫苗后应等待 4 周后再受孕。(请参阅怀孕和哺乳期间妇女的疫苗接种。
母乳喂养
母乳喂养是接种黄热病疫苗的预防措施。在母亲接种了黄热病疫苗的纯母乳喂养婴儿中报告了两起严重不良事件(123;PHAC,未公布的数据,2008年)。需要进一步的研究来记录通过母乳喂养可能暴露于疫苗的风险。在获得更多信息之前,应避免在母乳喂养妇女中接种黄热病疫苗。然而,当哺乳期母亲前往黄热病流行地区旅行无法避免或推迟时,这些妇女应接种疫苗。(请参阅怀孕和哺乳期间妇女的疫苗接种。
特殊人群
年龄
黄热病疫苗已获批用于≥9个月大的人群。该疫苗禁用于 <6 个月大的婴儿。(有关更多信息,请参阅禁忌症。6–8个月大和≥60岁的成年人接种黄热病疫苗是预防措施。(请参阅注意事项。
怀孕
关于黄热病疫苗在妊娠期的安全性和免疫原性的数据有限。怀孕是接种黄热病疫苗的一种预防措施。(请参阅怀孕和哺乳期间妇女的疫苗接种和注意事项。
母乳喂养妇女
虽然没有关于母乳喂养母亲免疫反应的数据,但不怀疑这些妇女的免疫反应发生了变化。关于黄热病疫苗在母乳喂养婴儿中的安全性,现有数据有限。母乳喂养是接种黄热病疫苗的预防措施。(请参阅怀孕和哺乳期间妇女的疫苗接种和注意事项。
免疫状态改变
以下情况是黄热病疫苗给药的禁忌症:1) 与免疫细胞功能异常相关的胸腺疾病,2) 有症状的 HIV 感染或 CD4+ T 淋巴细胞值<200/mm3 或 <15% < 岁儿童淋巴细胞总数的 6%,3) 原发性免疫缺陷,4) 恶性肿瘤,5) 移植,以及 6) 可归因于当前或最近的放射疗法或药物的免疫抑制或调节。以下免疫状态改变的情况是黄热病疫苗接种的预防措施:无症状 HIV 感染,CD4+ T 淋巴细胞值为 200–499/mm3 或 < 15 岁儿童总淋巴细胞的 24%–6%。(见禁忌症和注意事项。
关于有自身免疫性疾病史或具有潜在自身免疫性病因的九名报告患有 YEL-AVD 的患者正在服用哪些药物的完整详细信息不可用;这些可能包括免疫抑制药物。60例患者中有16例年龄>57岁,其中<>例也有胸腺瘤胸腺切除术史(见YEL-AVD)。高龄和胸腺瘤病史都是 YEL-AVD 的危险因素。尽管如此,在<>例YEL-AVD报告病例中,有<>例(<>%)有自身免疫性疾病病史这一事实令人担忧,并表明自身免疫性疾病本身与其他危险因素(包括免疫抑制药物)相结合,可能会增加YEL-AVD的风险。缺乏明确的数据来指导这些患者接种黄热病疫苗的决策。医务人员在决定是否为这些患者接种黄热病疫苗时,应考虑自身免疫性疾病状态本身和/或所用药物导致免疫功能减弱的可能性。
疫苗不良事件的报告
即使与疫苗接种的因果关系不确定,卫生保健提供者或疫苗接种者认为接种疫苗后所有具有临床意义的不良事件也应在以下情况下向VAERS报告:http://vaers.hhs.gov![]() 或致电 1-800-822-7967。为了提高安全数据的及时性和质量,提供了安全的网络报告,并鼓励卫生保健提供者在以下网址进行电子报告。https://vaers.hhs.gov/esub/step1
或致电 1-800-822-7967。为了提高安全数据的及时性和质量,提供了安全的网络报告,并鼓励卫生保健提供者在以下网址进行电子报告。https://vaers.hhs.gov/esub/step1![]() .
.
监测、描述和量化黄热病疫苗特异性不良结局的监测正在进行中。由于目前的报告机制完全是被动的,因此在最近接种疫苗且出现新症状的人中发现YEL-AVD和YEL-AND在很大程度上取决于卫生保健提供者是否熟悉这些情况和报告要求。目前正在制定一项关于疫苗和可能的严重不良事件的教育计划,并将在2010年秋季之前通过CDC的旅行者健康网站向所有卫生保健提供者提供。鼓励各州卫生部门将完成这些计划的要求纳入其向卫生保健提供者发放黄热病疫苗接种印章的认证和重新认证程序。
未来研究
应设计和实施侧重于严重不良事件的疑似危险因素或对黄热病疫苗的次优反应的研究,这些研究的数据很少或根本没有。这应包括 HIV、免疫抑制性疾病、自身免疫性疾病以及免疫抑制和免疫调节药物的使用。伦理考虑可能会将这些限制在观察性研究中。如果可能的话,旨在收集基于人口的数据的研究将是最有用的,但也是最难实施的。还需要进一步的研究来确定母乳中是否存在黄热病疫苗病毒,以及所涉及的确切传播途径(例如,摄入的牛奶或血液)。
有必要对疫苗免疫反应的持续时间进行研究,特别是接种疫苗后 IgM 抗体的持续时间和保护性抗体水平的持续时间。这些研究将有助于解决与接种疫苗的旅行者可能出现的黄热病有关的问题,并提供有关疫苗加强剂量所需给药间隔的最新证据。最后,正在研究对灭活黄热病疫苗的免疫反应。如果成功,灭活疫苗有可能被用于有使用活病毒疫苗禁忌症的人。
其他信息
关于旅行者和卫生保健提供者的黄热病的信息之前已经发布过(34)。有关黄衣病的更多信息,请访问 http://www.cdc.gov/ncidod/dvbid/yellowfever/index.html。有关在美国获批的黄热病疫苗的其他许可信息,请访问:http://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm094074.htm![]() .
.
确认
本报告部分基于 Nicole Lindsey、MPH、Susan Hills、MBBS、CDC 国家新兴和人畜共患传染病中心病媒传播疾病司的贡献。
参考
莫纳特T,西特龙MS,特温德。黄热病疫苗。载于:Plotkin SA,Orenstein WA,Offit PA,eds。疫苗。第五版。宾夕法尼亚州费城:桑德斯·爱思唯尔;2008:959 – 1055.里德W,卡罗尔JAS,阿格拉蒙特a。黄热病的病因:补充说明。JAMA 190136:431 – 40.![]() 贝里GP,厨房SF。在实验室意外感染黄热病:对7例病例的研究。Am J Trop Med Hyg 193111:365 – 434.在黄金海岸和尼日利亚的四次黄热病大流行期间观察到的西非本土黄热病的临床表现。1936年出版;30:61 – 86.
贝里GP,厨房SF。在实验室意外感染黄热病:对7例病例的研究。Am J Trop Med Hyg 193111:365 – 434.在黄金海岸和尼日利亚的四次黄热病大流行期间观察到的西非本土黄热病的临床表现。1936年出版;30:61 – 86.![]() .
.
巴雷特广告,莫纳斯TP。黄热病病毒的流行病学和生态学。Adv病毒研究2003;61:291 – 315.
世界卫生组织,流行病学监测和健康状况趋势评估司。全球健康状况和预测-估计。瑞士日内瓦:世界卫生组织;1992.
罗伯逊SE,赫尔BP,托莫里O,贝莱O,莱杜克JW,埃斯特韦斯k。黄热病:十年重现。JAMA 1996276:1157 – 62.
奇普A,德贝尔V,莫罗JP,雷恩斯JM。【拉丁美洲黄热病现状】。公牛Soc Pathol Exot 199386:460 – 4.
古野克,常,土屋KR,卡拉巴索斯北,克罗普CB。该属的系统发育
。病毒学杂志1998;72:73 – 83.34辛普森迪,哈多AJ,威廉姆斯MC,伍达尔JP。1964年乌干达中部的黄热病。四。吸血双翅目和猴类调查。《1965年世界卫生组织公报》;59:449 – 58.Germain M,Cornet M,Mouchet J,等[非洲的森林黄热病最近的进展和目前的方法]。地中海(火星)1981年;41:31 – 43.鲍尔·JH。通过蚊子传播黄热病埃及伊蚊![]() .
.
。Am J Trop Med Hyg 19288:261 – 82.
丛林蚊子中的黄热病病毒。科学1938;88:110 – 1.
1993 – 1994年巴西马兰豪州东南部地区的森林黄热病流行:流行病学和昆虫学发现。Am J Trop Med Hyg 199757:132 – 7.
- 索普佛罗里达州。黄热病的最新流行病学。美国公共卫生杂志1937年;27:1 – 14.
- 迪格特JP,短号M,德布尔V,唐斯工作组。黄热病。在:波特菲尔德JS,编辑。外来病毒感染:卡斯传染病手册。英国伦敦:查普曼&霍尔医疗公司;1995: 67 – 102.
- 莫纳思角。黄热病:最新消息。柳叶刀传染病2001年;1:11 – 20.
- 黄热病的传播。柳叶刀1930;216:835 – 42.
- 黄热病:复发的瘟疫。《临床实验室科学评论》2004;41:391 – 427.
- Van der Stuyft P,Gianella A,Pirard M,等,《玻利维亚圣克鲁斯黄热病的城市化》。柳叶刀1999;353:1558 – 62.
- 泛美卫生组织。巴拉圭爆发黄热病。2008年大流行;27.
- 埃利斯BR,巴雷特广告。东非黄热病之谜。修订版医学病毒学2008;18:331 – 46.
- 穆特比JP,巴雷特广告。非洲黄热病的流行病学。微生物感染2002;4:1459 – 68.黄病毒1978 – 1979年冈比亚的黄热病:观察奥伦戈病毒感染的流行病学情况。Am J Trop Med Hyg 198029:912 – 28.
- Nasidi A,Monath TP,DeCock K,等,《尼日利亚西部城市黄热病流行,1987年》。翻译自1989年的《社会与健康》;83:401 – 6.
- 世界卫生组织。暴发新闻:黄热病,刚果共和国。Wkly流行病学记录2009;84:161.
- 世界卫生组织。2009年中非共和国的黄热病。可从以下网址获得http://www.who.int/csr/don/2009_12_01/en/print.html。访问时间为2010年7月1日。
- 泛美卫生组织。美洲的黄热病。公牛泛美卫生组织1985年;19:209 – 12.
- 赛洛斯PF。【黄热病】。《2003年巴西足球杂志修订本》;36:275 – 93.
- 疾病控制中心。爆发通知:2009年巴西的黄热病。可从以下网址获得
- http://wwwnc . CDC . gov/travel/content/outbreak-notice/黄热病-巴西. aspx
- 泛美卫生组织。更新:2009年美洲黄热病形势。可从以下网址获得
- http://new.paho.org/hq/index.php?option = com _ content & task = view & id = 568 & Itemid = 259
- 巴西卫生部。【黄热病情况。巴西,2007 – 2008年】。可从以下网址获得
- http://portal . saude . gov . br/portal/arquivos/pdf/bole Tim _ SVS _ febre _ amarela _ 040408 . pdf
- 古布勒DJ。虫媒病毒疾病作为公共卫生问题在全球出现/死灰复燃。Arch Med Res 200233:330 – 42.
- 格什曼M,施罗德B,斯台普斯JE。黄热病。在:布鲁内特GW,科扎斯基体育,马吉尔AJ,什利姆博士,沃特利广告,编辑。2010年CDC国际旅行健康信息。佐治亚州亚特兰大:美国卫生与公众服务部,公共卫生服务,疾病预防控制中心;2009.
- 世界卫生组织。2007年非洲和南美洲的黄热病。Wkly流行病学记录2009;84:97 – 104.
- 世界卫生组织。2006年非洲和南美洲的黄热病。Wkly流行病学会2008;83:60 – 76.
- 世界卫生组织。2005年非洲和南美洲的黄热病形势。Wkly流行病学记录2006;81:317 – 24.
- 莫纳特TP,威尔逊DC,李VH,斯特罗G,库特伊K,史密斯EA。1970年尼日利亚贝努埃高原州奥克沃加区的黄热病流行。1.流行病学观察。公牛世界卫生组织1973;49:113 – 21.
- 赛洛斯·PF,科斯塔·ZG,特拉瓦索斯·达·罗萨等,《2000年巴西丛林黄热病的流行:气候变化对疾病传播的影响》。医学病毒学杂志2001;65:598 – 604.去热带旅行的人黄热病的预防。Clin Infect Dis 200234:1369 – 78.
 比尤克斯H,克尔JA,韦瑟斯比AA。对黄热病媒介和西非其他家蚊的生物学和相对流行率的观察,以及季节变化的流行病学意义。1933年出版;26:425 – 47.
比尤克斯H,克尔JA,韦瑟斯比AA。对黄热病媒介和西非其他家蚊的生物学和相对流行率的观察,以及季节变化的流行病学意义。1933年出版;26:425 – 47. - 皮涅罗FP,特拉瓦索斯达罗萨AP,莫赖斯马,阿尔梅达内托JC,卡马戈S,菲尔盖拉斯JP。1972 – 1973年巴西中部的一次黄热病流行。一.流行病学研究。Am J Trop Med Hyg 197827:125 – 32.
- 巴西黄热病的临床和流行病学特征:1998 – 2002年报告病例分析。《2007年世界卫生组织公报》;101:169 – 75.
- 莫纳思角。黄热病:一种被医学忽视的疾病。Rev Infect Dis 19879:165 – 75.莫纳思角。黄热病。In: Monath TP,ed。虫媒病毒:流行病学和生态学。佛罗里达州博卡拉顿:CRC出版社;1989.比尤克斯H,克尔JA,韦瑟斯比AA。对黄热病媒介和西非其他家蚊的生物学和相对流行率的观察,以及季节变化的流行病学意义。1933年出版;26:425 – 47.
- Santos F,Pereira Lima C,帕瓦M,Caosta e Silva M,Nery de Castro C .急性黄热病中的弥散性血管内凝血:凝血因子的测定巴西利亚医学1973年;9:9 – 15.23例确诊黄热病患者的蛋白尿、蛋白血症和转氨酶。公牛世界卫生组织1970年;42:95 – 102.
 比尤克斯H,克尔JA,韦瑟斯比AA。对黄热病媒介和西非其他家蚊的生物学和相对流行率的观察,以及季节变化的流行病学意义。1933年出版;26:425 – 47.
比尤克斯H,克尔JA,韦瑟斯比AA。对黄热病媒介和西非其他家蚊的生物学和相对流行率的观察,以及季节变化的流行病学意义。1933年出版;26:425 – 47. - 赛洛斯PF,卢娜EJ,加勒R,等。巴西黄热病17DD疫苗相关的严重不良事件:两例报告。柳叶刀2001;358:91 – 7.美国儿科学会。虫媒病毒。In:皮克林LK,贝克CJ,金伯利DW,龙SS,eds。红皮书:传染病委员会2009年报告。第28版伊利诺伊州埃尔克格罗夫村:美国儿科学会;2009.

 比尤克斯H,克尔JA,韦瑟斯比AA。对黄热病媒介和西非其他家蚊的生物学和相对流行率的观察,以及季节变化的流行病学意义。1933年出版;26:425 – 47.
比尤克斯H,克尔JA,韦瑟斯比AA。对黄热病媒介和西非其他家蚊的生物学和相对流行率的观察,以及季节变化的流行病学意义。1933年出版;26:425 – 47. - 萨卢佐JF,莫纳特TP,短号M,德乌贝尔V,迪格特JP。[用于检测人类样本和蚊池中黄热病病毒的不同方法的比较:快速检测ELISA方法的优势]。安巴斯德研究所(巴黎)1985年;136:115 – 29.
- 帕多克CD,尼科尔森WL,巴特纳加尔J,等。西尼罗河病毒在美国引起的致命性出血热。Clin Infect Dis 200642:1527 – 35.
- 莫纳思角。黄热病的治疗。抗病毒研究2008;78:116 – 24.
- 英国-埃及苏丹努巴山区的黄热病流行。安·特罗普医学1941年;35:67 – 113.
- 麦克法兰·JM、巴杜尔·LM、纳尔逊·JE等人在一名美国公民中输入了黄热病。临床感染Dis 199725:1143 – 7.
- Digoutte JP,Plassart H,Salaun JJ,Heme G,Ferrara L,Germain M. [塞内加尔感染的3例黄热病病例]。公牛世界卫生组织1981;59:759 – 66.
- 诺尔拉-萨拉斯J,萨巴尔斯-拉德雷萨J,巴达JL。接种疫苗游客中的输入性黄热病。柳叶刀1989;334:1275.
- Rodhain F,Hannoun C,Jousset FX,ravis se p .[在巴黎从2例输入性人类病例中分离出黄热病病毒]。公牛Soc Pathol Exot Filiales 197972:411 – 5.
- 疾病控制中心。1999年,一名从委内瑞拉返回的旅行者感染了致命的黄热病。MMWR 1999年;49:303 – 5
- 一名在冈比亚感染黄热病的比利时旅行者。Clin Infect Dis 200235:e113 – 6。
- 疾病控制中心。2002年,一名从巴西亚马逊返回的旅行者感染了致命的黄热病。MMWR 2002年;51:324 – 5
- Teichmann D,Grobusch议员,Wesselmann H,等,《来自科特迪瓦的出血热》。柳叶刀1999;354:1608.
- 世界卫生组织。黄热病1996 – 1997年。第一部分。Wkly流行病记录1998;73:354 – 9.
- 世界卫生组织。2000年荷兰输入性黄热病病例。可从以下网址获得
- http://www.who.int/csr/don/2000_02_25/en
- 劳埃德W,蒂勒M,利玛窦尼。通过体外组织培养修饰黄热病毒的毒力。1936年出版;29:481 – 529.
- 普加乔夫KV,Ocran SW,Guirakhoo F,Furby D,Monath TP。一致测序揭示ARILVAX黄热病17D疫苗基因组的异质性。疫苗2002;20:996 – 9.
- 两种黄热病17D疫苗(ARILVAX和YF-VAX)在III期多中心双盲临床试验中的安全性和免疫原性比较。Am J Trop Med Hyg 200266:533 – 41.
- 对阿根廷常规免疫规划中两种黄热病疫苗的评估。Hum疫苗2008;4:121 – 6.
- 在一项3期临床试验中,BERNA-YF与其他两种17D黄热病疫苗的免疫原性和安全性比较。Am J Trop Med Hyg 200572:339 – 46.
- Lang J,Zuckerman J,Clarke P,Barrett P,柯克帕特里克C,Blondeau C .两种17D黄热病疫苗免疫原性和安全性的比较。Am J Trop Med Hyg 199960:1045 – 50.
- 世卫组织-17D和巴西17D黄热病疫苗的免疫原性:一项随机试验。Rev Saude Publica 200438:671 – 8.
- 赛诺菲巴斯德。黄热病疫苗。YF-VAX。[产品插入]。宾夕法尼亚州斯威夫特沃特:赛诺菲巴斯德;2005.https://www.vaxserve.com/image.cfm?有售doc _ id = 5991 & image _ type = product _ pdf。访问时间为2010年7月1日。
- 梅森RA,陶拉索纳米,斯珀策尔罗,银RK。黄热病疫苗:给予猴子分级剂量的17D疫苗的直接攻击。应用微生物学1973;25:539 – 44.
- Reinhardt B,jasper R R,Niedrig M,屈斯特纳C,L’Age-Stehr J .黄热病毒株17D疫苗接种后病毒血症和免疫激活的体液和细胞参数的发展:人类黄病毒感染模型。医学病毒学杂志1998;56:159 – 67.
- Monath TP,McCarthy K,Bedford P,等。ChimeriVax原理的临床证明:抗黄病毒感染的重组减毒活疫苗。疫苗2002;20:1004 – 18..
- 疾病控制中心。黄热病疫苗病毒的输血相关传播-加利福尼亚州,2009年。MMWR 2010;59:34 – 7
- 莫纳思角。主要免疫球蛋白类别对人黄热病17D疫苗接种的中和抗体反应。1971年美国流行病学杂志;93:122 – 9..
- 库尔图瓦g . 17D疫苗产生免疫的出现时间和持续时间。在:黄热病疫苗。世卫组织系列。瑞士日内瓦:世界卫生组织;1956.
- 世界卫生组织。《国际卫生条例》(2005年)。瑞士日内瓦;2008.可从以下网址获得
- http://whqlibdoc . who . int/publications/2008/9789241580410 _ eng . pdfRosenzweig EC,Babione RW,Wisseman CL,Jr组节肢动物传播病毒的免疫学研究。四。接种17D株黄热病疫苗后黄热病抗体的持久性。Am J Trop Med Hyg 196312:230 – 5.
 比尤克斯H,克尔JA,韦瑟斯比AA。对黄热病媒介和西非其他家蚊的生物学和相对流行率的观察,以及季节变化的流行病学意义。1933年出版;26:425 – 47.
比尤克斯H,克尔JA,韦瑟斯比AA。对黄热病媒介和西非其他家蚊的生物学和相对流行率的观察,以及季节变化的流行病学意义。1933年出版;26:425 – 47. - Poland JD,Calisher CH,Monath TP,Downs WG,Murphy K .用17D黄热病疫苗免疫后30 – 35年中和抗体的持久性。公牛世界卫生组织1981;59:895 – 900.
- 博纳维-尼尔森五世,苍鹭一,莫纳特TP,卡里舍尔CH。用黄热病疫苗进行初次和二次免疫后,在中和抗体和免疫球蛋白M和免疫球蛋白G抗体出现之前,淋巴细胞2’,5’-寡腺苷酸合成酶活性增加。临床诊断实验室免疫1995;2:302 – 6.
- Nasidi A,Monath TP,Vandenberg J,等:《黄热病疫苗接种与妊娠:一项为期四年的前瞻性研究》。翻译自1993年的《社会与健康》;87:337 – 9.
- 日本首相佐藤荣作。在巴西的一次大规模运动中,意外使用黄热病免疫接种(17DD)对妊娠早期的影响。疫苗2006;24:1421 – 6.
- Goujon C,Tohr M,Feuillie V,Coulaud P,Dupont B,Sansonetti P .黄热病疫苗在人类免疫缺陷病毒携带者中的良好耐受性和有效性。第四届国际旅行医学会议;1995年4月23日至27日;墨西哥阿卡普尔科。
- 勒瑟弗尔MC,泽鲍特R,维蒂S,马尔维D,梅西P,布拉斯ML。人类免疫缺陷病毒感染者接种黄热病疫苗2例报告。Clin Infect Dis 200031:E7 – 8。
- 102例HIV感染者接种黄热病疫苗的免疫原性和安全性。Clin Infect Dis 200948:659 – 66.
- Sibailly TS,Wiktor SZ,Tsai TF,等。感染人类免疫缺陷病毒1型的儿童对黄热病疫苗接种的抗体反应差。儿科传染病杂志1997;16:1177 – 9.
- Camacho LA,de Aguiar SG,Freire MS,等,《黄热病疫苗的反应原性随机安慰剂对照试验》。Rev Saude Publica 200539:413 – 20.
- 接种黄热病疫苗后的不良事件报告。疫苗2008;26:6077 – 82.
- 凯尔索JM,Mootrey GT,蔡TF。黄热病疫苗过敏反应。变态反应临床免疫学杂志1999;103:698 – 701.
- 与17D-204黄热病疫苗接种相关的神经系统疾病:15例报告。疫苗2007;25:1727 – 34..
- 接种17D黄热病疫苗ARILVAX后的Kitchener S .嗜内脏和嗜神经疾病。2004年疫苗;22:2103 – 5.
- 福克斯JP,Penna HA。17D黄热病病毒在恒河猴中的行为:与基质、剂量和神经或神经外接种的关系。Am J Hyg 194338:152 – 72.
- 尼克尔斯J,坎内拉M,德罗达,梁Y,世界WS,钱伯斯TJ。神经适应性黄热病毒株17D:E蛋白结构域III中的带电位点控制SCID小鼠模型中的肝素结合活性和神经侵袭性。病毒学杂志2008;82:12510 – 9.世界卫生组织生物标准化专家委员会。第四十六次报告。世卫组织技术报告系列,1998年;872:1 – 90.

 比尤克斯H,克尔JA,韦瑟斯比AA。对黄热病媒介和西非其他家蚊的生物学和相对流行率的观察,以及季节变化的流行病学意义。1933年出版;26:425 – 47.
比尤克斯H,克尔JA,韦瑟斯比AA。对黄热病媒介和西非其他家蚊的生物学和相对流行率的观察,以及季节变化的流行病学意义。1933年出版;26:425 – 47. - 接种黄热病疫苗后的反应。在:黄热病疫苗。世卫组织系列。瑞士日内瓦:世界卫生组织;1956.
- 公共卫生服务。黄热病疫苗:美国公共卫生服务咨询委员会关于免疫实践的建议。安实习医师医学1969;71:365 – 7.
- 一例HIV感染患者接种黄热病疫苗后发生致命性脊髓脑炎。2002年泰国医学协会;85:131 – 4.
- 疾病控制中心。2001 – 2002年美国与17D衍生黄热病疫苗接种相关的不良事件。MMWR 2002年;51:989 – 93
- Chaves M,Riccio P,Patrucco L,Rojas J,Cristiano E .与黄热病疫苗接种相关的纵向脊髓炎。神经病毒学杂志2009;3:1 – 3.
- 米拉瓦勒A,比勒J,席尔瓦E,康内利M,奥基夫p。急性播散性脑脊髓炎:黄热病疫苗接种。Arq神经精神分析2009;67:710 – 1.
- 吉兰-巴雷综合征的最新进展。2009年临床神经科学杂志;16 :733 – 41.
- 急性播散性脑脊髓炎:临床和发病机制特征。神经临床2008;26:759 – 80.
- 匿名。接种黄热病疫苗17D后出现致死性病毒性脑炎。3岁儿童病例报告。JAMA 1966198:671 – 2.
- Jennings AD,Gibson CA,Miller BR,等。从疫苗相关人类脑炎致死病例中分离出的黄热病病毒分析。j传染疾病调查1994年;169:512 – 8.
- 路易·JJ,萧邦P,拉布雷f .[一例接种17 D株抗黄热病疫苗后的脑炎病例]。儿科1981年;36:547 – 50.
- 黄热病疫苗:对高龄作为严重不良事件危险因素的最新评估。疫苗2005;23:3256 – 63.
- 与17D-204黄热病疫苗接种相关的发热和多系统器官衰竭:4例病例报告。柳叶刀2001;358:98 – 104.
- 陈钢筋混凝土,彭尼DJ,小D,卡特IW,罗伯特JA,罗林森WD。接种17D-204黄热病疫苗后的肝炎和死亡。柳叶刀2001;358:121 – 2.
- 疾病控制中心。1996 – 2001年间与17D衍生黄热病疫苗接种相关的发热、黄疸和多器官系统衰竭。MMWR 2001年;50:643 – 5
- 黄热病疫苗接种的效果。柳叶刀2001;358:1907 – 8.
- 黄热病疫苗接种的效果。柳叶刀2001;358:1908 – 9.
- 黄热病疫苗接种的效果。柳叶刀2001;358:1909.
- 贝尔舍·JL、盖伊·P、布林顿·M等:黄热病疫苗相关的嗜内脏疾病导致的致命性多器官衰竭。疫苗2007;25:8480 – 5.
- Struchiner CJ,Luz PM,Dourado I,等.与17日龄黄热病疫苗相关的致命不良事件风险。流行性传染病2004年;132:939 – 46.
- Whittembury A,Ramirez G,Hernandez H,等:《秘鲁黄热病疫苗接种后的肠道传染病》。疫苗2009;27:5974 – 81..
- 胸腺瘤和黄热病疫苗接种史。柳叶刀2004;364:936.
- 黄热病疫苗相关的嗜内脏型疾病,伴有持续的病毒血症、强适应性免疫应答和CCR5和RANTES基因多态性。j传染疾病2008年;198:500 – 7.
- 海斯EB。接种黄热病疫苗后的急性嗜内脏性疾病。《2007年世界卫生组织公报》;101:967 – 71.
- Tsai TF,Paul R,Lynberg MC,Letson GW。妊娠免疫后的先天性黄热病病毒感染。j传染疾病1993年;168:1520 – 3.
- 卡瓦尔康蒂DP,萨洛芒马,洛佩斯-卡梅洛J,佩索托马。怀孕期间早期接触黄热病疫苗。Trop Med国际卫生2007;12:833 – 7.
- 西冈SA,Nunes-Araujo FR,皮雷斯WP,席尔瓦FA,科斯塔HL。妊娠期黄热病疫苗接种与自然流产:一项病例对照研究。Trop Med国际卫生1998;3:29 – 33.
- 疾病控制中心。黄热病疫苗病毒通过母乳喂养的传播-巴西,2009年。MMWR 2010;59:130 – 2
- 蒂勒注册护士,拉斯姆森有限公司,特德韦尔TA,贾米森DJ。女性新发和人畜共患病感染。2008年北美传染病临床;22:755 – 72.
- 疾病控制中心。西尼罗河病毒可能通过母乳喂养传播给婴儿——密歇根州,2002年。MMWR 2002年;51:877 – 8
- Allen KW,Nguyen-Van-Tam JS,Howells J .施用过期黄热病疫苗:公共卫生反应和血清学调查结果。1999年公共卫生社区;2:141 – 2.
- 疾病控制中心。关于免疫的一般性建议:免疫实践咨询委员会的建议(ACIP)。MMWR。正在印刷中。.
- 格鲁特H,里贝里罗RB。接种17D疫苗17年后出现的黄热病中和抗体和血凝抑制抗体。公牛世界卫生组织1962年;27:699 – 707.
- 尼德里格·M,拉德门·M,埃梅里希·P,拉弗伦茨·M。用不同的试验:中和试验,血凝抑制试验,免疫荧光试验和ELISA对接种17D后抗黄热病病毒IgG抗体的评估。Trop Med国际卫生1999;4:867 – 71.
- Hepburn MJ,Kortepeter MG,Pittman PR,等。17D黄热病疫苗加强免疫的中和抗体反应。疫苗2006;24:2843 – 9.
- 麻疹疫苗接种后的循环干扰素。英国医学杂志1965年;273:198 – 201.
- 内源性干扰素对儿童牛痘感染的作用。柳叶刀1965;2:401 – 5.
- 最近的麻疹免疫不干扰黄热病疫苗的血清反应。1999年疫苗;17:1042 – 6.
- 一种新的五价疫苗组合的研究。安微生物学(巴黎)1973年;124:387 – 409.
- Wolga J,Rodhain F,Hannoun C,等[巴斯德研究所对国际旅行者热稳定黄热病疫苗的评估]。生物站杂志1986;14:289 – 95.
- 对尼日利亚儿童同时接种天花、麻疹、黄热病和白喉-百日咳-破伤风抗原。公牛世界卫生组织1973;48:175 – 81.
- Dumas R,Forrat R,Lang J,法里内利T,Loutan L .新型甲型肝炎灭活疫苗与伤寒疫苗或伤寒+黄热病疫苗同时给药的安全性和免疫原性Adv Ther 199714:160 – 7.
- 钟EC,卡普兰公里,伊夫斯卡,轩辕洛尹加州,拉基斯高清,库特BJ。甲型肝炎灭活疫苗与伤寒和黄热病疫苗同时接种的开放性随机研究。j . 2002年旅游医学;9:66 – 70.
- Yvonnet B、Coursaget P、Deubel V、Diop-Mar I、Digoutte JP、凯龙星JP。同时接种乙型肝炎和黄热病疫苗。医学病毒学杂志1986;19:307 – 11.
- Goullin B,Masseron T,Teyssou R,等。【同时接种流感和黄热病疫苗的有效性】。Med Arm 199321:115 – 7..
- Dukes C,Froeschle J,George J,等.伤寒Vi (TV),YF-VAX (YF)和Menomune (MV)同时给药的安全性和免疫原性[摘要].在第36届国际抗菌药物和化疗会议上发表;1996年9月15日至18日;路易斯安那州的新奥尔良。
- 陶拉索NM,迈尔斯MG,瑙EV,奥布莱恩TC,斯平德尔SS,微调RW。接种活天花和黄热病疫苗间隔时间对人抗原性的影响。J Infect Dis 1972126:362 – 71..
- Kollaritsch H,Que JU,Kunz C,Wiedermann G,Herzog C,Cryz SJ,Jr .口服霍乱和伤寒活疫苗单独给药或与抗疟药、口服脊髓灰质炎疫苗或黄热病疫苗联合给药的安全性和免疫原性。j传染疾病调查,1997年;175:871 – 5.
- Tsai TF,Kollaritsch H,Que JU,等.黄热病17D疫苗与口服减毒霍乱活疫苗CVD103-HgR和伤寒ty21a疫苗同时给药的相容性。j传染疾病调查,1999年;179:522 – 4.
- Fletcher MA,Fabre P,Debois H,Saliou P .疫苗同时给药:基于文献回顾的新型联合疫苗方向。Int J Infect Dis 20048:328 – 38.
- 卡普兰·JE,尼尔森·DB,绍恩贝格·LB,等。免疫球蛋白对三价口服脊髓灰质炎病毒和黄热病疫苗接种反应的影响。公牛世界卫生组织1984;62:585 – 90.
- Edupuganti S,Eidex R,Keyserling H,等.一项随机、双盲、对照试验,比较与人免疫球蛋白或安慰剂联用的减毒17D黄热病活疫苗的病毒血症、免疫原性和安全性。在第12届疫苗研究年会上发表;2009年4月27日至29日;巴尔的摩;马里兰州。
- 蔡TF,博林RA,拉祖伊克JS,米勒KD。氯喹不会对黄热病疫苗的抗体反应产生不利影响。j传染Dis 1986154:726 – 7.
- 米斯巴山凯莱赫山口。什么是古德综合症?胸腺瘤患者的免疫异常。临床病理学杂志2003年;56:12 – 6.
- 成人和青少年抗逆转录病毒指南小组。HIV-1感染成人和青少年抗逆转录病毒药物使用指南;卫生部人类服务部;2008.可从以下网址获得
- http://aidsinfo.nih.gov/Guidelines/GuidelineDetail.aspx?指导方针。搜索=关闭& ampGuidelineID = 7 & ampClassID=1
- 艾滋病毒感染儿童抗逆转录病毒疗法和医疗管理工作组。儿科HIV感染抗逆转录病毒药物使用指南,2009年。可从以下网址获得
- http://AIDS info . NIH . gov/content files/pediatric guidelines . pdf
- Tattevin P,Depatureaux AG,Chapplain JM,等。黄热病疫苗对HIV感染患者是安全有效的。2004年艾滋病;18:825 – 7.
- 霍YL,伊诺哈塔T,洛佩斯MH,德索萨多斯桑托斯s。巴西艾滋病毒感染成人的疫苗接种:一项横断面研究。2008年艾滋病患者护理和性传播疾病;22:65 – 70.
- 威尔逊我,冯雷诺CF,芬伯格HV。HIV感染旅行者的感染:风险和预防。安实习医师医学1991;114:582 – 92.
- 皮斯通T,威尔迪埃CH,勒瑟弗尔MC,埃兹丁K,拉丰ME,马尔维d .[黄热病疫苗在携带HIV病毒旅行者中的免疫原性和耐受性,法国,2005]。2007年BEH数学展;25 – 26:238 – 40.
- 钟克,弗雷曼岛。为有特殊需求的旅行者提供建议。在:布鲁内特GW,科扎斯基体育,马吉尔AJ,什利姆博士,沃特利广告,编辑。2010年CDC国际旅行健康信息。亚特兰大。GA:美国卫生与公众服务部,公共健康服务,疾病预防控制中心;2009.
- Conesa-Botella A,Colebunders R .对“黄热病疫苗相关的嗜内脏型疾病病例,具有持续的病毒血症、强适应性免疫应答以及CCR5和RANTES基因多态性”的反应J Infect Dis 2009199:601.
- 图一。黄热病病毒的传播周期
- *丛林(sylatic)传播循环包括病毒在非人灵长类动物和森林树冠中发现的蚊子物种之间的传播。当人类在职业或娱乐活动中侵入丛林时,该病毒通过蚊子从非人灵长类动物传播给人类。
- 城市传播周期包括病毒在人和城市蚊子之间的传播,主要是
- 。从一个地区旅行到另一个地区的病毒携带者可以在其他传播周期中成为蚊子的传染源(虚线)。
- 在非洲,中间(热带草原)循环包括从树洞繁殖传播YFV病毒
- 物种对于生活或工作在丛林边缘地区的人类来说。在这个循环中,病毒可以通过这些蚊子从非人灵长类动物传播给人类或从人类传播给人类。
- 替代文本:
- 该图显示了三个黄热病传播周期:丛林(森林地带)、中间(热带草原)和城市。丛林(sylatic)传播循环包括病毒在非人灵长类动物和森林树冠中发现的蚊子物种之间的传播。当人类在职业或娱乐活动中侵入丛林时,该病毒通过蚊子从非人灵长类动物传播给人类。城市传播周期包括病毒在人和城市蚊子之间的传播,主要是埃及伊蚊。在其他传播周期中,从一个地区到另一个地区传播病毒的人可以成为蚊子的传染源。在非洲,中间(热带草原)循环包括从树洞繁殖的伊蚊传播YFV病毒。对于生活或工作在丛林边缘地区的人类来说。在这个循环中,病毒可以通过这些蚊子从非人灵长类动物传播给人类或从人类传播给人类。图二。有黄热病传播风险的地区*非洲和南美洲,2009年
 比尤克斯H,克尔JA,韦瑟斯比AA。对黄热病媒介和西非其他家蚊的生物学和相对流行率的观察,以及季节变化的流行病学意义。1933年出版;26:425 – 47.
比尤克斯H,克尔JA,韦瑟斯比AA。对黄热病媒介和西非其他家蚊的生物学和相对流行率的观察,以及季节变化的流行病学意义。1933年出版;26:425 – 47. - 来源:布鲁内特GW,科扎斯基体育,马吉尔AJ,什利姆博士,沃特利广告,编辑。2010年CDC国际旅行健康信息。亚特兰大。GA:美国卫生与公众服务部,公共健康服务,疾病预防控制中心;2009.

 比尤克斯H,克尔JA,韦瑟斯比AA。对黄热病媒介和西非其他家蚊的生物学和相对流行率的观察,以及季节变化的流行病学意义。1933年出版;26:425 – 47.
比尤克斯H,克尔JA,韦瑟斯比AA。对黄热病媒介和西非其他家蚊的生物学和相对流行率的观察,以及季节变化的流行病学意义。1933年出版;26:425 – 47. - *根据世界卫生组织的定义,目前或过去报告过黄热病的国家/地区,加上目前存在病媒和动物宿主的地区。
- 该图显示了非洲和南美洲的一些地区,世界卫生组织指出这些地区目前或过去曾报告过黄热病,以及目前存在病媒和动物宿主的地区。
- 方框1。疾病预防控制中心黄热病疫苗安全(YFVS)工作组黄热病疫苗相关神经系统疾病的病例定义*
- 案件查明
- 1级:神经系统疾病
- 以下一种或多种体征和症状:
图 1.黄热病病毒的传播周期
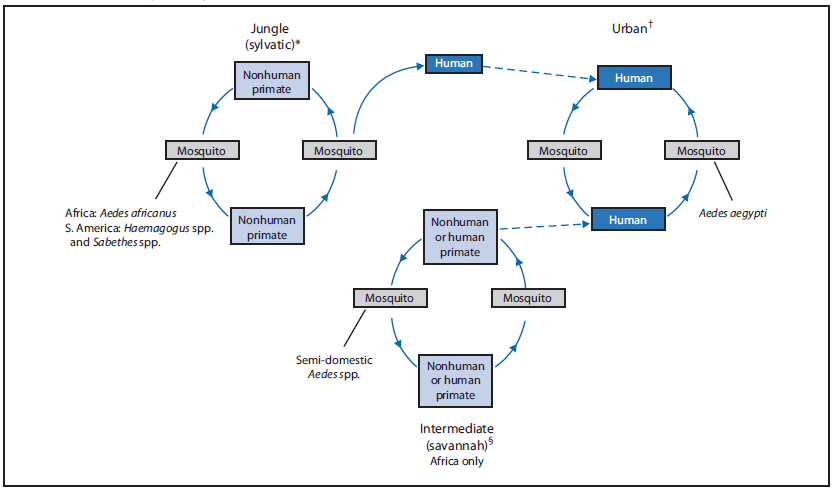
* 丛林(sylatic)传播周期涉及病毒在非人灵长类动物和森林树冠中发现的蚊子物种之间的传播。当人类在职业或娱乐活动中侵入丛林时,该病毒通过蚊子从非人灵长类动物传播给人类。
†城市传播周期涉及病毒在人类和城市蚊子之间的传播,主要是埃及蚊子。病毒血症患者从一个地区传播到另一个地区,可以在其他传播周期中吸食蚊子并成为蚊子的感染源(虚线)。
§在非洲,中间(稀树草原)循环涉及将YFV从树洞繁殖的伊蚊传播给在丛林边境地区生活或工作的人类。在这个循环中,病毒可以通过这些蚊子从非人灵长类动物传播到人类或从人传播到人类。
备用文本:该图显示了黄热病的三个传播周期:丛林(森林)、中度(稀树草原)和城市。丛林(sylatic)传播周期涉及病毒在非人灵长类动物和森林树冠中发现的蚊子物种之间的传播。当人类在职业或娱乐活动中侵入丛林时,该病毒通过蚊子从非人灵长类动物传播给人类。城市传播周期涉及病毒在人类和城市蚊子之间的传播,主要是埃及伊蚊。病毒血症患者从一个地区旅行到另一个地区,可以在其他传播周期中吸食蚊子并成为蚊子的感染源。在非洲,一个中间(稀树草原)循环涉及将YFV从树洞繁殖的伊蚊传播给在丛林边境地区生活或工作的人类。在这个循环中,病毒可以通过这些蚊子从非人灵长类动物传播到人类或从人传播到人类。
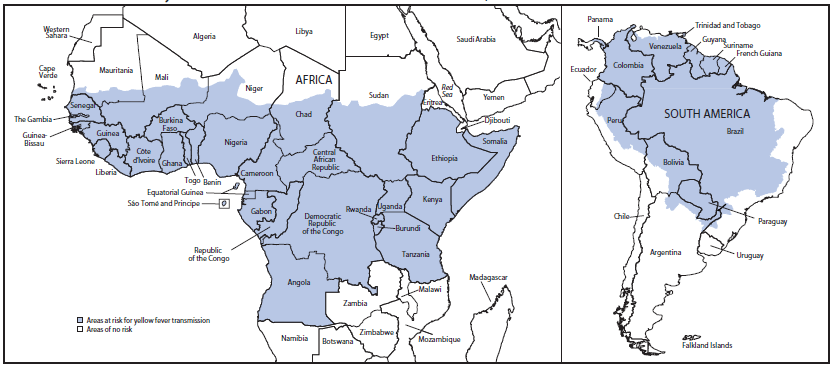
源: Brunette GW、Kozarsky PE、Magill AJ、Shlim DR、Whatley AD,编辑 CDC 2010 年国际旅行健康信息。亚特兰大。GA:美国卫生与公众服务部、公共卫生服务部、疾病预防控制中心;2009.
* 根据世界卫生组织的定义,指目前或过去报告过黄热病的国家/地区,以及目前存在病媒和动物宿主的地区。
备用文本:该图显示了世界卫生组织指出目前或过去曾报告过黄热病的非洲和南美洲地区,以及目前存在病媒和动物宿主的地区。
病例查明 1 级:神经系统疾病 • 以下一种或多种体征和症状: — 发烧 (≥100.5°F [>38.1°C] 持续 >24 小时) 和头痛 (>24 小时) — 局灶性神经功能障碍(包括但不限于共济失调、失语症和麻痹) — 精神状态改变(意识模糊、嗜睡或性格改变持续 >24 小时) — 新发癫痫发作或先前控制的癫痫发作复发 — 脑脊液 (CSF) 细胞增多症 (>5 WBC/mm3) — 脑脊液蛋白升高(>正常限值的 1.5 倍) 2 级:嗜神经性疾病 • 1 级神经系统疾病,以及 • 以下一项或多项: — 符合炎症的神经影像学检查(伴或不伴脱髓鞘) — 脑电图发现与脑病一致 2 级:伴有中枢神经系统受累的自身免疫性疾病 • 1 级神经系统疾病,以及 • 神经影像学检查与多灶性或播散性脱髓鞘区域一致 2 级:伴有周围神经系统受累的自身免疫性疾病 • 1 级神经系统疾病,† 和 • 以下两种或两种以上体征和症状: — 肢体无力,腱反射减弱或消失 — 颅神经异常 — 自主神经功能障碍(包括但不限于体位性低血压、心律失常、出汗异常、胃动力异常) — 四肢麻木或感觉异常 — 肌电图发现与吉兰-巴利综合征一致 案例定义 黄热病疫苗相关的嗜神经疾病 怀疑嗜神经性疾病 • 症状和体征在接种黄热病疫苗后1–30天内出现,可以单独接种,也可以与其他疫苗接种联合接种; • 2 级嗜神经疾病;和 • 没有其他诊断的证据 可能的嗜神经性疾病 • 嫌疑人 YEL-AND,以及 • 以下一项或多项: — 疫苗型黄热病病毒从血液中分离出来(>接种后7天) — 黄热病 17D§ 病毒在任何一天的血清浓度超过 3 log10 pfu/mL 明确的嗜神经性疾病 • 嫌疑人 YEL-AND,以及 • 以下一项或多项: — YF特异性脑脊液IgM — 从脑脊液中分离出黄热病17D§病毒 — 疫苗型病毒从脑脊液中扩增§ 黄热病疫苗相关自身免疫性疾病伴中枢神经系统受累 (YEL-AAD-CNS) 疑似 YEL-AAD-CNS • 症状和体征在接种黄热病疫苗后1–30天内出现,可以单独接种,也可以与其他疫苗接种联合接种; • 2 级自身免疫性疾病,累及中枢神经系统;和 • 没有其他诊断的证据 可能的 YEL-AAD-CNS • 怀疑自身免疫性疾病并累及中枢神经系统,以及 • YEL 单独给药 黄热病疫苗相关自身免疫性疾病伴周围神经系统受累 (YEL-AAD-PNS) 嫌疑人:YEL-AAD-PNS • 症状和体征在接种黄热病疫苗后1–30天内出现,可以单独接种,也可以与其他疫苗接种联合接种; • 2 级自身免疫性疾病,累及 PNS;和 • 没有其他诊断的证据 可能的 YEL-AAD-PNS • 怀疑自身免疫性疾病伴有 PNS 受累,以及 • YEL 单独给药 _______________ * 病例定义的修订版已经公布(Monath T, Cetron MS, Teuwen DE.黄热病疫苗。在:Plotkin SA,Orenstein WA,Offit PA,编辑疫苗。第 5 版。宾夕法尼亚州费城:Saunders Elsevier;2008:959–1055).这些病例定义:1)定义了神经系统疾病的病例,2)定义了自身免疫性受累于中枢神经系统或周围神经系统的病例,以及3)描述了与黄热病疫苗的因果关系。另一种经实验室确诊的诊断能够充分解释临床情况,可能足以排除黄热病疫苗相关疾病。鉴于在获取足够证据以做出明确诊断方面存在挑战,可能有必要将疑似病例、可能病例和确诊病例合并进行危险因素分析和病例计数。 †不需要存在精神状态改变或癫痫发作。 §当存在野生型黄热病感染的可能性时,通过单克隆抗体分析或核苷酸测序确认为 17D 病毒,包括所有 17D 衍生疫苗。 |
病例查明 1 级:嗜内脏疾病(用于监测) • 发烧 (≥100.5°F [(>38.1°C] >24 小时),以及 • 以下一种或多种体征和症状: –恶心 –呕吐 — 不适(持续时间 >72 小时) — 肌痛(持续时间>24小时) — 关节痛(持续时间>24小时) –呼吸困难 2 级:嗜内脏疾病 • 1 级嗜内脏疾病;和 • 以下一个或多个迹象: — 黄疸(总胆红素升高1.5倍正常值) — 肝功能不全(AST和ALT升高至正常值的三倍) — 肾功能损害(肾小球滤过率降低,以尿素氮或肌酐升高超过 1.5 倍且无肾病史来衡量) — 心动过速(心率>100 次/分钟)或心动过缓(<50 次/分钟) — 横纹肌溶解症(>正常CPK的5倍) — 呼吸窘迫(呼吸急促、通气或氧合障碍) — 血小板减少症(血小板<100,000/μL) — 低血压(收缩血≤成人为90毫米汞柱,<16岁儿童年龄小于第五个百分位数;舒张压直立性下降≥躺着到坐着时下降15毫米汞柱,直立性晕厥或直立性头晕) — 心肌炎(相容的异常,包括心电图、超声心动图或心肌酶改变,或组织活检引起的炎症) — 弥散性血管内凝血(凝血酶原时间升高或纤维蛋白分裂产物激活部分凝血活酶时间) –出血 案例定义 黄热病疫苗相关性内脏嗜内脏病 (YEL-AVD) 嫌疑人:YEL-AVD • 症状和体征在接种黄热病疫苗后1–10天内出现,可以单独接种,也可以与其他疫苗接种联合接种; • 2 级嗜内脏疾病,有肝功能不全的证据;和 • 没有其他诊断的证据 可能的 YEL-AVD • 疑似 YEL-AVD,以及 • 以下一项或多项: — 与黄热病一致的组织病理学检查(例如,肝脏中带坏死、议员体) — 黄热病17D†从血液中分离(接种后>7天) — 黄热病 17D† 病毒在任何一天的血清浓度超过 3 log10 pfu/mL 确定的 YEL-AVD • 疑似 YEL-AVD,以及 • 以下一项或多项: — 免疫组化(IHC)证实组织中的YF特异性抗原 — 黄热病17D†从组织中分离出病毒 — 黄热病17D†病毒从组织中扩增 _______________ * 这些病例定义的修改版本已经发布(Monath T, Cetron MS, Teuwen DE.黄热病疫苗。在:Plotkin SA,Orenstein WA,Offit PA,编辑疫苗。第 5 版。宾夕法尼亚州费城:Saunders Elsevier;2008:959–1055.)这些病例定义定义了可能与黄热病疫苗有因果关系的嗜内脏疾病病例和确定性水平。缺乏纳入标准并不能排除疫苗相关内脏嗜内脏疾病 (YEL-AVD) 的诊断;然而,另一个实验室确诊的诊断可以充分解释临床情况,可能足以排除 YEL-AVD。鉴于在获取足够证据以明确诊断 YEL-AVD 方面存在挑战,可能有必要将疑似病例、可能病例和确诊病例结合起来进行危险因素分析和病例计数。 †当存在野生型黄热病感染的可能性时,通过单克隆抗体分析或核苷酸测序确认为 17D 病毒,包括所有 17D 衍生疫苗。 |
非洲 | 中美洲和南美洲 | ||
|---|---|---|---|
安哥拉 贝宁 布基纳法索 蒲隆地 喀麦隆 中非共和国 乍得† 刚果共和国 科特迪瓦 刚果民主共和国 赤道几内亚 埃塞俄比亚 加蓬 | 冈比亚 加纳 几内亚 几内亚比绍 肯尼亚 利比里亚 马里† 毛里塔尼亚† 尼日尔† 尼日利亚 卢旺达 塞拉利昂 圣多美和普林西比 | 塞内加尔 索马里 苏丹† 坦桑尼亚 多哥 乌干达 | 阿根廷† 玻利维亚† 巴西† 哥伦比亚 厄瓜多尔† 法属圭亚那 圭亚那 巴拿马† 巴拉圭 秘鲁† 苏里南 特立尼达和多巴哥† 委内瑞拉† |
* 根据世界卫生组织的定义,指目前或过去报告过黄热病的国家/地区,以及目前存在病媒和动物宿主的地区。 † 这些国家不是全流行国家(即,该国只有一部分地区存在黄热病病毒传播的风险)。有关哪些地区为地方性病的信息,请访问 http://wwwnc.cdc.gov/travel/yellowbook/2010/chapter-2/yellow-fever.aspx。 | |||
禁忌 | 预防 措施 |
|---|---|
对疫苗成分过敏 | 年龄 6–8个月 |
年龄小于 6 个月 | 年龄 ≥60 岁† |
有症状的 HIV 感染或 CD4+ T 淋巴细胞 <200/mm3(或 <15 岁儿童总<6%)* | 无症状 HIV 感染和 CD4+ T 淋巴细胞 200–499/mm3(或 <15 岁儿童占总数的 24%–6%)* |
与免疫功能异常相关的胸腺疾病† | 怀孕 |
原发性免疫缺陷 | 母乳喂养 |
恶性肿瘤 | |
移植 | |
免疫抑制和免疫调节疗法† | |
* 艾滋病毒的症状已被分类(成人和青少年抗逆转录病毒指南小组)。《感染艾滋病毒-1的成人和青少年使用抗逆转录病毒药物的指南》;美国卫生与公众服务部;2008. 可在http://aidsinfo.nih.gov/Guidelines/GuidelineDetail.aspx?MenuItem=Guidelines&Search=Off&GuidelineID=7&ClassID=1 †自2002年ACIP发布黄热病疫苗使用建议以来的新禁忌症或预防措施(CDC.黄热病疫苗:免疫实践咨询委员会的建议:2002年MMWR;51[否。RR-17])。 | |
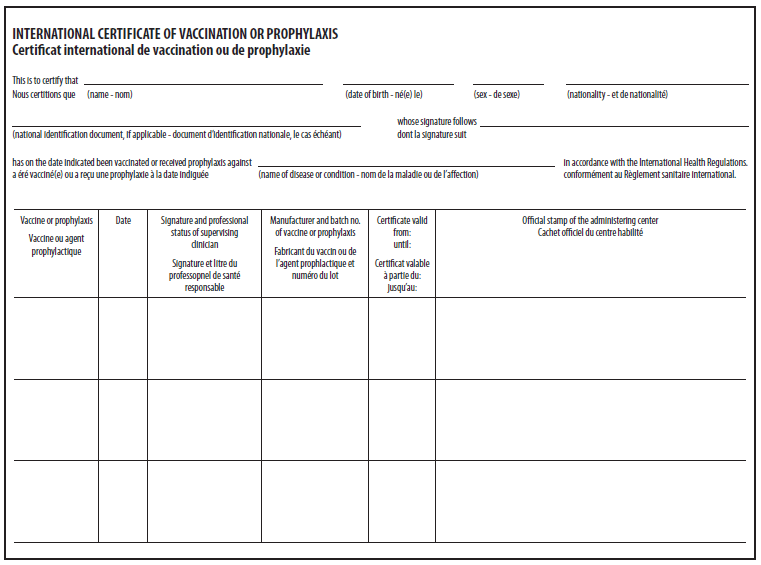
源:Brunette GW、Kozarsky PE、Magill AJ、Shlim DR、Whatley AD,编辑 CDC 2010 年国际旅行健康信息。亚特兰大。GA:美国卫生与公众服务部、公共卫生服务部、疾病预防控制中心;2009.
* 《国际卫生条例》允许各国要求提供入境黄热病疫苗接种证明,并要求来自某些国家的旅行者提供黄热病疫苗接种证明,以防止黄热病疫苗的输入和本地传播。作为疫苗接种证明,疫苗接种者应收到一份完整的 ICVP,并经过验证(盖章和签名),盖有接种疫苗中心的印章。

源: Brunette GW、Kozarsky PE、Magill AJ、Shlim DR、Whatley AD,编辑 CDC 2010 年国际旅行健康信息。亚特兰大。GA:美国卫生与公众服务部、公共卫生服务部、疾病预防控制中心;2009.
* 发现黄热病疫苗接种的医疗禁忌症并希望签发医疗豁免书的卫生保健提供者应填写并签署 ICVP 的疫苗接种医疗禁忌症部分。医疗保健提供者还应向旅行者提供一封签名并注明日期的豁免信。
免疫接种实践咨询委员会
2009年<>月加入名单
椅子: Carol Baker,医学博士,德克萨斯州休斯顿贝勒医学院。
执行秘书: 拉里·皮克林(Larry Pickering),医学博士,美国疾病预防控制中心国家免疫和呼吸系统疾病中心,佐治亚州亚特兰大。
成员: Lance Chilton,医学博士,新墨西哥大学,新墨西哥州阿尔伯克基;Paul Cieslak,医学博士,俄勒冈州波特兰市俄勒冈州公共卫生部;克里斯汀·埃雷斯曼(Kristen Ehresmann),公共卫生硕士,明尼苏达州卫生部,明尼苏达州圣保罗;珍妮特·英格伦(Janet Englund),医学博士,华盛顿大学和华盛顿州西雅图儿童医院和区域医疗中心;Franklyn Judson,医学博士,科罗拉多大学健康科学中心,科罗拉多州丹佛;温迪·凯特尔(Wendy Keitel),医学博士,德克萨斯州休斯顿贝勒医学院;Susan Lett,医学博士,马萨诸塞州公共卫生部,马萨诸塞州波士顿;Michael Marcy,医学博士,加州大学洛杉矶分校疫苗研究中心,加利福尼亚州托伦斯;Cody Meissner,医学博士,马萨诸塞州波士顿塔夫茨医疗中心;凯瑟琳·诺伊齐尔(Kathleen Neuzil),医学博士,华盛顿大学,华盛顿州西雅图;萨拉·罗森鲍姆(Sara Rosenbaum),法学博士,乔治华盛顿大学,哥伦比亚特区;Mark Sawyer,医学博士,加州大学圣地亚哥分校;Ciro Valent Sumaya,医学博士,德克萨斯州大学城德克萨斯 A&M 健康科学中心;Jonathan Temte,医学博士,威斯康星大学医学与公共卫生学院,威斯康星州麦迪逊。
当然成员: James E. Cheek,医学博士,新墨西哥州阿尔伯克基印第安人卫生服务局;Wayne Hachey,DO,国防部,弗吉尼亚州福尔斯彻奇;Geoffrey S. Evans,医学博士,马里兰州罗克维尔市卫生资源和服务管理局;布鲁斯·盖林(Bruce Gellin),医学博士,哥伦比亚特区国家疫苗计划办公室;Linda Murphy,马里兰州巴尔的摩医疗保险和医疗补助服务中心;George T. Curlin,医学博士,美国国立卫生研究院,马里兰州贝塞斯达;诺曼·贝勒(Norman Baylor),医学博士,马里兰州贝塞斯达食品和药物管理局;琳达·金辛格(Linda Kinsinger),医学博士,退伍军人事务部,北卡罗来纳州达勒姆。
联络代表: 美国家庭医师学会,医学博士道格·坎波斯-奥特卡特,亚利桑那州凤凰城;美国儿科学会,Joseph Bocchini,医学博士,路易斯安那州什里夫波特,David Kimberlin,医学博士,阿拉巴马州伯明翰;美国大学健康协会,医学博士 James C. Turner,弗吉尼亚州夏洛茨维尔;美国妇产科医师学会,医学博士斯坦利·加尔,肯塔基州路易斯维尔;美国内科医学院,格雷戈里波兰,明尼苏达州罗切斯特;美国老年医学会,医学博士 Kenneth Schmader,北卡罗来纳州达勒姆;美国健康保险计划,医学博士 Mark Netoskie,德克萨斯州休斯顿;美国医学会,Litjen Tan,博士,伊利诺伊州芝加哥;美国骨科协会,斯坦利·格罗格,DO,俄克拉荷马州塔尔萨;美国药剂师协会,Stephan L. Foster,药学博士,田纳西州孟菲斯;预防教学与研究协会,W. Paul McKinney,医学博士,肯塔基州路易斯维尔;生物技术产业组织,克莱门特·勒温(Clement Lewin)博士,马萨诸塞州剑桥市;加拿大国家免疫咨询委员会,医学博士乔安妮·兰利(Joanne Langley),加拿大新斯科舍省哈利法克斯;州和地区流行病学家委员会,医学博士 Christine Hahn,爱达荷州博伊西;英国卫生部 David M. Salisbury, MD, 伦敦, 英国;医疗保健感染控制实践咨询委员会,医学博士亚历克西斯·埃尔沃德,密苏里州圣路易斯;美国传染病学会,医学博士 Samuel L. Katz,北卡罗来纳州达勒姆;全国县市卫生官员协会,Jeff Duchin,医学博士,华盛顿州西雅图;全国儿科执业护士协会,明尼苏达州圣保罗的帕特里夏·斯廷奇菲尔德;美国国家传染病基金会,医学博士威廉·沙夫纳,田纳西州纳什维尔;墨西哥国家免疫委员会和儿童健康计划,墨西哥墨西哥城 Vesta Richardson,医学博士;美国国家医学协会,医学博士帕特里夏·惠特利-威廉姆斯,新泽西州新不伦瑞克省;国家疫苗咨询委员会,Guthrie Birkhead,医学博士,纽约州奥尔巴尼;美国药物研究和制造商,Damian A. Braga,宾夕法尼亚州斯威夫特沃特,Peter Paradiso,博士,宾夕法尼亚州Collegeville;青少年医学学会,医学博士 Amy Middleman,德克萨斯州休斯顿;美国医疗保健流行病学学会,Harry Keyserling,医学博士,佐治亚州亚特兰大。
黄热病疫苗工作组
椅子:Carol J. Baker,医学博士,德克萨斯州休斯顿。
成员:伊丽莎白·巴内特(Elizabeth Barnett),医学博士,马萨诸塞州波士顿;路易莎·查普曼(Louisa Chapman),医学博士,佐治亚州亚特兰大;艾琳·法农(Eileen Farnon),医学博士,佐治亚州亚特兰大;Patrick Garmon,药学博士,博士,弗吉尼亚州福尔斯彻奇;Mark D. Gershman,医学博士,佐治亚州亚特兰大;克里斯蒂娜·格林纳威(Christina Greenaway),医学博士,加拿大多伦多;Kristen B. Janusz,DVM,科罗拉多州柯林斯堡;James F. Jones,医学博士,佐治亚州亚特兰大;Franklyn N. Judson,医学博士,科罗拉多州丹佛;Katrin S. Kohl,医学博士,佐治亚州亚特兰大;Nina Marano,DVM,佐治亚州亚特兰大;Michael E. Neseman,医学博士,秘鲁利马;凯伦·奥布莱恩(Karen O’Brien),医学博士,弗吉尼亚州门罗堡;Michele Sabourin,加拿大安大略省渥太华;Betsy Schroeder,公共卫生硕士,佐治亚州亚特兰大;Barbara A. Slade,医学博士,佐治亚州亚特兰大;J. Erin Staples,医学博士,博士,科罗拉多州柯林斯堡;安德里亚·萨瑟兰(Andrea Sutherland),医学博士,马里兰州银泉市;Mary E. Wilson,医学博士,马萨诸塞州波士顿。
* 工作组成员名单见本报告第27页。
使用商品名称和商业来源仅用于识别,并不意味着美国国务院的认可 卫生与公众服务。
互联网上对非CDC站点的引用包括 作为一项服务提供给MMWR读者,并不构成或暗示 CDC或美国对这些组织或其项目的认可 卫生与公众服务部。CDC不对内容负责 在这些网站上找到的页面。MMWR 中列出的 URL 地址是截至 发布日期。
文章的所有MMWR HTML版本都是从排版文档的电子转换而来的。 此转换可能会导致 HTML 版本中的字符转换或格式错误。 用户将被推荐给电子PDF版本(http://www.cdc.gov/mmwr) 和/或官方文本、图表和表格的可打印版本的原始 MMWR 纸质副本。 本问题的纸质原件可从美国文件总监处索取。 政府印刷局 (GPO),华盛顿特区 20402-9371; 电话:(202) 512-1800。请联系 GPO 了解当前价格。
**有关格式错误的问题或消息应 mmwrq@cdc.gov 提出。
- 页面上次审核: 2010年7月30日
- 页面最后更新日期:
- 2010年7月30日
- 内容来源:美国疾病控制与预防中心
Hits: 77
- 年龄≥60岁的成人使用呼吸道合胞病毒疫苗:美国免疫实践咨询委员会的最新建议,2024年
- JYNNEOS(活的、非复制的天花和猴痘疫苗)用于正痘病毒职业暴露危险人群的暴露前疫苗接种:美国免疫实践咨询委员会的建议,2022
- 黄热病疫苗:免疫实践咨询委员会(ACIP)的建议
- 美国成人中15价肺炎球菌结合疫苗和20价肺炎球菌结合疫苗的使用:美国免疫实践咨询委员会的最新建议,2022年
- ACIP建议:新冠肺炎疫苗
- 用疫苗预防和控制季节性流感:美国免疫实践咨询委员会的建议,2024-25流感季节
- ACIP建议:水痘疫苗
- 19岁以上免疫功能低下成年人使用重组带状疱疹疫苗的ACIP证据推荐框架
- ACIP建议:麻疹、腮腺炎和风疹疫苗
- ACIP建议:麻疹、腮腺炎、风疹和水痘疫苗
- ≥6月龄的人使用新冠肺炎疫苗:美国免疫实践咨询委员会的建议,2024–2025
- ACIP建议:白喉、破伤风和百日咳(DTaP/Tdap/Td)疫苗
- 19-59岁成年人普遍接种乙肝疫苗的最新建议——美国,2024年
- 对年龄≥65岁的成人和年龄≥6个月的中度或重度免疫缺陷者使用额外剂量的2024-2025新冠肺炎疫苗:美国免疫实践咨询委员会的建议,2024
- Bexsero MenB-4C疫苗的新接种间隔和时间表:美国免疫实践咨询委员会的最新建议,2024年10月
- 更新:免疫实践咨询委员会关于甲型肝炎疫苗用于国际旅行暴露后预防和暴露前预防的建议
- ACIP建议:甲肝疫苗
- ACIP:50岁以上成人使用肺炎球菌结合疫苗的扩展建议
- ACIP建议:人类乳头瘤病毒(HPV)疫苗
- 免疫接种实践咨询委员会推荐 18 岁或以下儿童和青少年的免疫接种计划 — 美国,2025 年
- 免疫接种实践咨询委员会建议 19 岁或以上成人的免疫接种计划 — 美国,2025 年
- ACIP关于常规脊髓灰质炎病毒免疫接种的最新建议
- 使用 23 价肺炎球菌多糖疫苗 (PPSV23) 预防成人侵袭性肺炎球菌疾病的最新建议
- 21价肺炎球菌结合疫苗在美国成人中的使用:美国免疫实践咨询委员会的建议,2024年
- ACIP 对 ≥65 岁成年人使用额外更新的 2023-2024 年 COVID-19 疫苗剂量 2024年
- ACIP 辉瑞五价脑膜炎球菌疫苗在 ≥10 岁人群中的使用,美国,2023 年
- ACIP美国成人使用灭活脊髓灰质炎疫苗的最新建议,2023年
- 蜱传脑炎疫苗(森林脑炎灭活疫苗):美国免疫实践咨询委员会的建议,2023年
- 妊娠期使用辉瑞呼吸道合胞病毒疫苗预防婴儿呼吸道合胞病毒相关下呼吸道疾病:美国免疫实践咨询委员会的建议,2023
- ACIP 演示幻灯片:2025 年 4 月 15 日至 16 日会议
- 在猴痘爆发期间,≥18 岁有猴痘风险的人使用 JYNNEOS(天花和猴痘疫苗,活疫苗,非复制性):免疫实践咨询委员会的建议 — 美国,2023 年
- ACIP建议:肺炎球菌疫苗
- 用于流感治疗和化学预防的抗病毒药物:免疫实践咨询委员会(ACIP)的建议
- ACIP建议:轮状病毒疫苗
- ACIP 建议:炭疽疫苗
- ACIP 疫苗建议和指南
- 美国免疫实践咨询委员会关于 10 岁及以上人群使用葛兰素史克 MenACWY-CRM/MenB-4C 五价脑膜炎球菌疫苗的建议——2025 年
- ACIP 建议:带状疱疹疫苗
- ACIP关于水痘预防的建议
