Contents
第26章:脊髓灰质炎
2013年1月
脊髓灰质炎 应呈报
疾病
脊髓灰质炎是一种急性疾病,由三种脊髓灰质炎病毒血清型之一(血清型1、2和3)通过胃肠道入侵引起。该病毒在肠道中复制,对神经组织有很高的亲和力。通过血流传播到易感组织或通过逆向轴突运输到中枢神经系统。这种感染最常见于临床上不明显,或者症状的严重程度从发烧到无菌性脑膜炎或麻痹不等。可能会出现头痛、胃肠功能紊乱、不适以及颈部和背部僵硬,伴有或不伴有瘫痪。根据脊髓灰质炎病毒类型和社会条件,儿童隐性感染与麻痹性感染的比例可能高达1000比1,成人为75比1(Sutter et al., 2004)。
传播途径是接触感染者的粪便或咽部分泌物。潜伏期由3至21天不等。脊髓灰质炎病毒复制时间更长,它可以在粪便中排泄3至6周,在唾液中排泄2周(Gelfand et al., 1957)。在麻痹性疾病发作前以及发作后一到两周,病例的传染性最强(Sutter et al., 2004)。
当感染是地方性时,麻痹性疾病是由自然发生的脊髓灰质炎病毒——“野生病毒”引起的。减毒活疫苗病毒保留了回复成毒性形式的可能性,这种毒性形式很少引起麻痹性疾病。这被称为疫苗相关麻痹性脊髓灰质炎(VAPP)。当野生病毒被消灭后,在使用减毒活疫苗的地方,VAPP病例很少发生。
疾病的历史和流行病学
在20世纪50年代早期,在英国有多达8000例麻痹性脊髓灰质炎年度报告的脊髓灰质炎感染流行。
灭活脊髓灰质炎疫苗(IPV-索尔克)的常规免疫接种始于1956年。这在1962年被口服脊髓灰质炎减毒活疫苗(OPV-萨宾)所取代。在实行脊髓灰质炎免疫接种的同时,还有针对所有40岁以下个人的大规模运动。
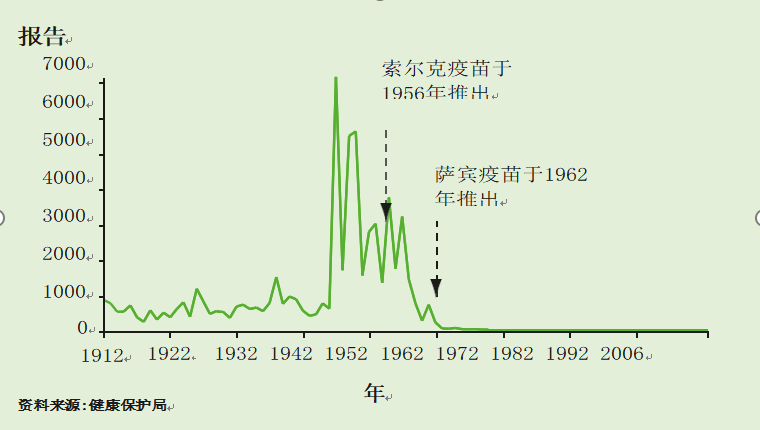
图26.1英格兰和威尔士的脊髓灰质炎报告(1912-2006)
在引入脊髓灰质炎免疫接种后,病例迅速下降到非常低的水平。上一次本土脊髓灰质炎的爆发是在20世纪70年代末。英国最后一例自然感染脊髓灰质炎是在1984年。1985年至2002年间,英国共报告了40例麻痹性脊髓灰质炎病例(图26.2)。30例为VAPP病例,其中6例是海外获得的野生病毒感染;在另外5例病例中,全部发生在1993年之前,传染源不明,但未检测到野生病毒。
全世界报告的小儿麻痹症病例从1988年的35 251例下降到2003年的677例(2004年1月报告)(WHO,2004a)。国际委员会已经证实,在世界卫生组织(WHO)的三个区域,即美洲、西太平洋和欧洲,脊髓灰质炎病毒的传播已经被阻断。世卫组织已将英国列入有可能因野生病毒而消灭本土脊髓灰质炎的国家之列(WHO,2004b)。
到2004年,脊髓灰质炎仍仅在少数发展中国家流行,因此,传入英国的风险已降至非常低的水平。随着脊髓灰质炎在尼日利亚死灰复燃,2005年和2006年期间,几个以前无脊髓灰质炎的国家报告了脊髓灰质炎。在这些国家,正在进行阻断传播和建立控制的密集努力,输入到英国的风险仍然被认为是低的。
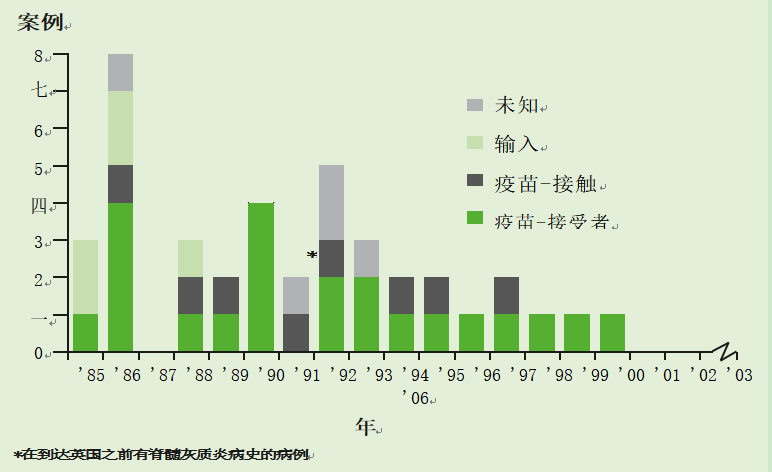
图26.2按病因学分类的麻痹性脊髓灰质炎报告病例(1985-2006年英格兰和威尔士所有资料来源)
直到2004年,由于野生病毒输入的持续风险,OPV被用于英国的常规免疫接种。OPV和IPV都提供优良的个体免疫力。此外,OPV为社区提供了好处,因为最近接种疫苗的儿童的接触者可以通过获得疫苗病毒而得到保护(Ramsay et al., 1994a)。OPV还促进肠道中抗体的形成,为随后的野生脊髓灰质炎病毒感染提供局部抵抗力。这降低了野生病毒无症状排泄的频率。野生脊髓灰质炎病毒被输入的风险和OPV的益处需要与使用OPV病毒导致VAPP的风险和IPV的功效相平衡。自2004年以来,这种平衡有利于在英国常规免疫接种中使用灭活脊髓灰质炎疫苗。
脊髓灰质炎疫苗接种
灭活脊髓灰质炎疫苗(IPV)由生长在Vero细胞培养物中的脊髓灰质炎病毒株Mahoney (Salk血清型1)、MEF-1 (Salk血清型2)和Saukett (Salk血清型3)制成。这些成分用甲醛处理,然后吸附到佐剂(磷酸铝或氢氧化铝)上,以提高免疫原性。最终的疫苗混合物分别含有40、8和32个血清型1、2和3的D-抗原单位。
脊髓灰质炎疫苗仅作为组合产品的一部分提供:
- 白喉/破伤风/无细胞百日咳/灭活脊髓灰质炎疫苗/
b型流感嗜血杆菌(DTaP/IPV/Hib)
- 白喉/破伤风/无细胞百日咳/灭活脊髓灰质炎疫苗(DTaP/ IPV或dTaP/IPV)
- 破伤风/白喉/灭活脊髓灰质炎疫苗(Td/IPV)。
上述疫苗不含硫柳汞。它们是灭活的,不含活的有机体,不会引起它们所保护的疾病。
OPV不再用于常规用途,将仅用于疫情控制。OPV含有在猴肾细胞或人二倍体(MRC-5)细胞培养物中生长的1型、2型和3型脊髓灰质炎病毒的减毒活毒株。
Td/IPV疫苗应在需要预防破伤风、白喉或脊髓灰质炎时使用,以便对所有三种疾病提供全面、长期的保护。
储存
疫苗应储存在+2℃至+8℃的原包装中,并避光保存。所有疫苗在某种程度上都对冷热敏感。高温加速了大多数疫苗效力的下降,从而缩短了它们的保质期。除非储存在正确的温度下,否则无法保证疫苗的有效性。冷冻可能导致某些疫苗的反应原性增加和效力丧失。它还会在容器中产生细小的裂纹,导致内容物被污染。
剂型
脊髓灰质炎疫苗仅作为组合产品的一部分提供。它以混浊的白色混悬液的形式存在于单剂量安瓿或预装注射器中。混悬剂在储存过程中可能会沉淀,在给药前应摇动混悬剂使其均匀分布。
剂量和时间表
- 首剂0.5ml含脊髓灰质炎疫苗。
- 第二剂0.5ml,第一剂后一个月。
- 第三剂0.5ml,第二剂后一个月。
- 第四次和第五次剂量为0.5ml,应在推荐的时间间隔内给药(见下文)。
接种
疫苗通常通过上臂或大腿前外侧肌肉注射。这是为了降低局部反应的风险,局部反应在皮下注射疫苗时更常见(Mark et al., 1999; Diggle and Deeks, 2000; Zuckerman, 2000)。然而,对于患有出血性疾病的个体,应通过深层皮下注射来接种疫苗,以降低出血的风险。
含IPV的疫苗可与MMR、MenC和乙型肝炎等其他疫苗同时接种。这些疫苗应在单独的部位接种,最好是在不同的肢体。如果给药在同一个肢体,它们应该至少分开2.5厘米(美国儿科学会,2003)。每种疫苗的注射部位应在患者记录中注明。
处理
用于接种疫苗的设备,包括用过的小瓶或安瓿,应在每次接种结束后,密封在一个合适的防刺穿“锐器”盒中进行处置(未批准,BS 7320)。
疫苗使用建议
免疫接种计划的目标是在适当的时间间隔为所有人提供至少五剂含脊髓灰质炎的疫苗。在大多数情况下,在适当的时间间隔总共注射五剂疫苗被认为能提供令人满意的长期保护。
为了实现这一目标,每个年龄组的适当疫苗也取决于保护个人免受破伤风、百日咳、Hib和白喉的需要。
初级免疫接种
10岁以下的婴儿和儿童
脊髓灰质炎疫苗接种的主要疗程包括三剂含IPV的产品,每剂之间间隔一个月。DTaP/ IPV/Hib建议在两个月、三个月和四个月时接种,但也可以在两个月至十岁的任何阶段接种。如果第一疗程中断,应重新开始,但不能重复,允许剩余剂量之间有一个月的间隔。那些开始接种口服脊髓灰质炎疫苗的人可以使用含IPV的疫苗完成整个疗程。
十岁或十岁以上的儿童和成人
脊髓灰质炎疫苗接种的主要疗程包括三剂含IPV的产品,每剂之间间隔一个月。Td/ IPV推荐给所有10岁以上的人。如果第一疗程中断,应重新开始,但不能重复,允许剩余剂量之间有一个月的间隔。那些开始接种口服脊髓灰质炎疫苗的人可以使用含IPV的疫苗完成整个疗程。
1962年以前出生的人可能没有接种过疫苗或者接种过低效力的脊髓灰质炎疫苗;不应该错过给它们免疫的任何机会。Td/IPV是用于这种用途的合适疫苗。
强化免疫
10岁以下的儿童应接受第一次脊髓灰质炎加强疫苗,同时接种白喉、破伤风和百日咳疫苗。含IPV疫苗的第一次加强免疫最好应在完成初级疗程三年后进行,通常在三岁四个月至五岁之间。当初次疫苗接种延迟时,可在第三次初次接种后一年内的预定就诊时进行第一次加强接种。这将重新建立孩子的常规时间表。dTaP/IPV或DTaP/IPV应用于该年龄组。Td/IPV不应常规用于该年龄组的此目的,因为它不含百日咳,且与其他推荐制剂相比,未显示出同等的白喉抗毒素反应。
仅接种过三剂脊髓灰质炎疫苗(其中最后一剂至少是在五年前)的10岁或10岁以上的个人应接种第一剂IPV加强剂与白喉和破伤风疫苗(Td/IPV)。
Td/IPV的第二次加强剂量最好应在第一次加强剂量后十年给予所有个体。如果以前的剂量被推迟,第二次加强注射应在学校会议或预定的时间进行,前提是第一次和第二次加强注射之间至少间隔五年。这将是确保长期保护的最后一次预定机会。
如果一个人参加了常规加强剂量,并且有在破伤风易发伤口后接种疫苗的历史,应尝试确定接种了哪种疫苗。如果受伤时注射的疫苗与本次就诊时注射的疫苗相同,并且是在适当的时间间隔后注射的,则不需要常规加强剂量。否则,给予的剂量由于受伤时间可能无法提供针对所有抗原的长期保护,因此应考虑受伤时间,并应进行定期免疫接种。这样的额外剂量不可能产生不可接受的反应速率(Ramsay et al., 1997)。
免疫状态未知或不完全的儿童接种疫苗
如果在英国出生的儿童有不充分的免疫史,应尽一切努力澄清他们可能接种过哪些疫苗(见第11章)。未完成初级疗程的儿童应每月注射一次剩余剂量。儿童可在第三剂首剂疫苗接种一年后接受第一剂加强疫苗接种,以重新建立常规方案。第二次加强剂要在离校的时候打,保证到这个时候有长期的保护。在可能的情况下,第一次加强剂和第二次加强剂之间应至少间隔五年。
来到英国的儿童,如果有在原籍国完成免疫接种的历史,可能无法获得针对目前在英国使用的所有抗原的保护。他们可能已经在他们的原籍国接受了含脊髓灰质炎的疫苗(www-nt.who.int/immuize _ monitoring/en/global summary/country profile select . cfm)。
来自发展中国家、冲突地区或难以接触到的人群的儿童可能没有完全免疫。如果没有可靠的既往免疫史,则应假设他们未免疫,并应遵循完整的英国建议(见第11章)。
来到英国的儿童可能已经接种了第四剂含脊髓灰质炎的疫苗,在一些国家,这种疫苗在18个月左右接种。这一剂量应打折扣,因为它可能无法提供令人满意的保护,直到青少年加强剂的时间。常规的学前教育和随后的强化教育应该按照英国的时间表进行。
旅行者和那些要去国外定居的人
所有前往流行病或地方病地区的旅行者应确保根据英国的时间表(见上文)进行全面免疫接种。根据目的地和旅行的性质,可能需要额外剂量的疫苗(见卫生部,2001年)。如果需要破伤风、白喉或脊髓灰质炎保护,并且相关抗原的最终剂量是在十多年前接受的,则应给予Td/IPV。
实验室和卫生保健工作者
在微生物实验室和临床传染病单位的工作过程中可能接触到小儿麻痹症的个人处于危险之中,必须受到保护(见第12章)。
禁忌症
极少数人不能接种含IPV的疫苗。如有疑问,应向儿科顾问、免疫协调员或传染病控制顾问寻求适当的建议,而不是拒绝接种疫苗。
疫苗不应注射给患有以下疾病的人:
- 对先前剂量的含IPV疫苗的确认过敏反应,或
- 对新霉素、链霉素或多粘菌素B(可能存在微量)的过敏反应。
确诊的过敏反应极少发生。来自英国、加拿大和美国的数据表明,每100万剂疫苗中发生0.65至3次过敏反应事件(Bohlke et al., 2003; Canadian Medical Association, 2002)。其他过敏情况可能更常见,但不是进一步免疫的禁忌症。仔细的事件史通常会区分过敏反应和其他不是由疫苗引起的或不危及生命的事件。在后一种情况下,有可能继续免疫过程。必须寻求专家对疫苗和接种环境的建议。必须考虑到个人未接种疫苗的风险。
预防措施
没有发烧或全身不适的小病不是推迟免疫接种的正当理由。
如果个人急性不适,应推迟免疫接种,直到他们完全康复。这是为了避免由于错误地将任何体征或症状归因于疫苗的副作用而混淆任何急性疾病的鉴别诊断。This section gives advice on the immunisation of children with a history of a severe or mild systemic or local reaction within 72 hours of receiving a preceding vaccine.
先前免疫接种后的全身和局部反应
本节就在之前接种疫苗后72小时内有严重或轻度全身或局部反应史的儿童的免疫接种提供建议。
在有以下情况后,应继续使用含IPV疫苗进行免疫接种::
- 发烧,不论其严重程度
- 低渗-低反应性发作(HHE)
- 持续哭闹或尖叫超过三小时
- 严重的局部反应,与程度无关。
在加拿大,对DTaP/IPV/Hib的严重全身或局部反应不是进一步接种疫苗的禁忌症(Canadian Medical Association, 1998)。加拿大对儿童免疫接种后的不良事件进行了仔细监测(Le Saux et al., 2003),加拿大的经验表明,进一步的剂量与之前事件的复发或恶化无关(S Halperin and R Pless, pers comm, 2003)。
怀孕和母乳喂养
当需要保护时,可以立即给孕妇接种含IPV的疫苗。没有证据表明给孕妇或哺乳期妇女接种灭活病毒或细菌疫苗或类毒素有风险(Plotkin and Orenstein, 2004)。
早产儿
根据时间表,早产儿在适当的年龄接种疫苗是很重要的。接种疫苗后窒息的发生率在早产婴儿中特别高。
住院的极早产儿(妊娠≤28周)在接受第一次免疫接种时,应进行48-72小时的呼吸监测,尤其是那些先前有呼吸不成熟病史的婴儿。如果儿童在第一次免疫接种后出现呼吸暂停、心动过缓或不饱和,第二次免疫接种也应在医院进行,并进行48-72小时的呼吸监测(Pfister et al., 2004; Ohlsson et al., 2004; Schulzke et al., 2005; Pourcyrous et al., 2007; Klein et al., 2008)。
由于这一组婴儿接种疫苗的益处很大,因此不应停止或推迟接种疫苗。
免疫抑制和艾滋病毒感染
根据上述建议,患有免疫抑制和HIV感染的个体(无论CD4计数如何)应接种含IPV的疫苗。这些人可能不会产生完全的抗体反应。在治疗结束并痊愈后,应考虑重新免疫。可能需要专家的建议。
皇家儿科和儿童健康学院(www.rcpch.ac.uk)、英国艾滋病毒协会(BHIVA)艾滋病毒感染成人免疫指南(BHIVA,2006)和英国和爱尔兰儿童艾滋病毒协会(CHIVA)免疫指南(www.bhiva.org/chiva).
神经疾病
已存在的神经系统疾病
神经疾病的存在不是免疫接种的禁忌症。如果有证据表明儿童患有神经疾病,应遵循图26.3中流程图给出的建议。
如果儿童有稳定的、预先存在的神经异常,如脊柱裂、先天性大脑异常或围产期缺氧缺血性脑病,他们应根据建议的时间表进行免疫接种。当有记录的新生儿期脑损伤史时,应进行免疫接种,除非有证据表明出现了神经异常。
如果有证据表明目前的神经系统恶化,包括控制不佳的癫痫,应推迟免疫接种,并应将儿童转介给儿童专家进行调查,以确定潜在的原因。如果没有确定病因,应推迟免疫接种,直到病情稳定。如果确定了病因,免疫接种应该照常进行。
癫痫家族史不是免疫接种的禁忌症。当有热性惊厥的个人或家族病史时,在任何发热(包括由免疫接种引起的发热)后发生热性惊厥的风险会增加。与发热相关的癫痫发作在出生后的前六个月很少见,在出生后的第二年最常见。过了这个年龄,频率下降,五岁以后就很少了。
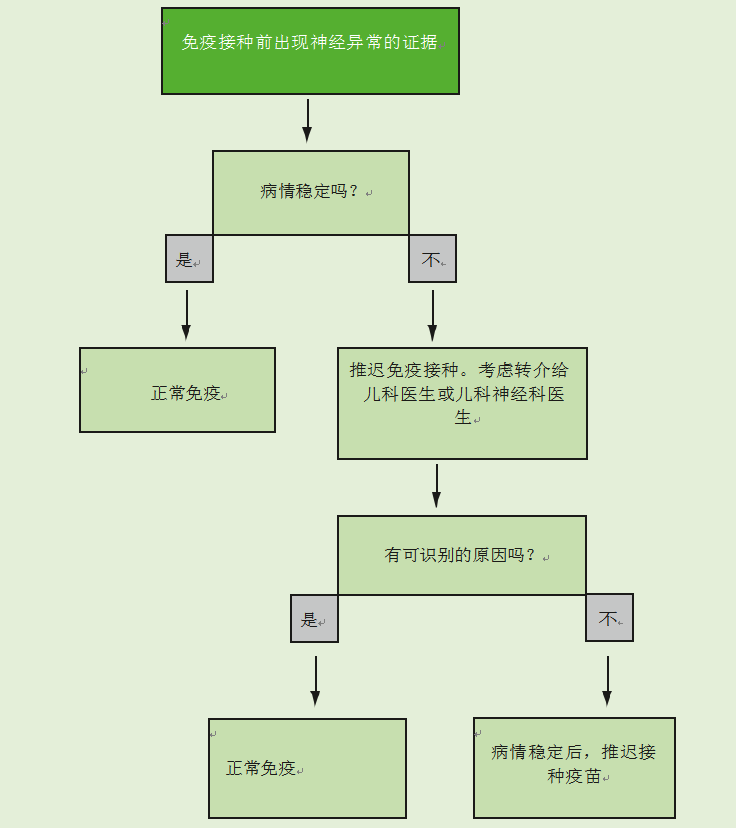
图26.3免疫前神经疾病证据流程图
当儿童在过去有过与发热相关的癫痫发作,没有神经恶化的证据时,应按照建议进行免疫接种。接种疫苗前应提供预防和控制发烧的建议。
当儿童出现与发热无关的癫痫发作,并且没有神经恶化的迹象时,应按照建议进行免疫接种。当接种百白破疫苗时,有癫痫发作家族史或个人史的儿童没有明显的不良事件,他们的发育进程是正常的(Ramsay et al., 1994b)。
免疫接种后的神经异常
如果儿童在免疫接种后七天内出现脑病或脑炎,应遵循图26.4流程图中的建议。这些情况不太可能是由疫苗引起的,应该由专家进行调查。在没有发现潜在病因的情况下,应推迟免疫接种,直到儿童的病情稳定,并且儿童在7天内没有完全康复。如果确定了病因或儿童在七天内康复,应按照建议进行免疫接种。
如果在免疫接种后72小时内出现与发烧相关的癫痫发作,如果没有发现潜在原因,并且儿童在24小时内没有完全康复,则应推迟进一步的免疫接种,直到病情稳定。如果查明了病因或儿童在24小时内康复,应按照建议继续进行免疫接种。
推迟免疫接种
需要推迟免疫接种的情况很少(见上文)。延期使孩子得不到保护;应尽量缩短延期时间,以便尽快开始免疫接种。如果专家建议推迟接种,应明确告知全科医生,一旦孩子适合接种,必须立即告知全科医生。
不良反应
注射部位的疼痛、肿胀或发红是常见的,并且可能在后续剂量后更频繁地发生。注射部位可能会形成一个小而无痛的结节;这通常会消失,没有任何后果。与全细胞百日咳疫苗相比,破伤风疫苗联合无细胞百日咳疫苗的局部反应发生率较低,与DT疫苗后的局部反应发生率相似(Miller, 1999; Tozzi and Olin, 1997)。
接种DTaP和DT疫苗后,发烧、抽搐、高声尖叫以及苍白、发绀和无力(HHE)的发生频率相同(Tozzi and Olin, 1997)。
确诊的过敏反应极少发生。来自英国、加拿大和美国的数据表明,每100万剂疫苗中发生0.65至3次过敏反应事件(Bohlke et al., 2003; Canadian Medical Association, 2002)。其他过敏情况可能更常见,但不是进一步免疫的禁忌症。
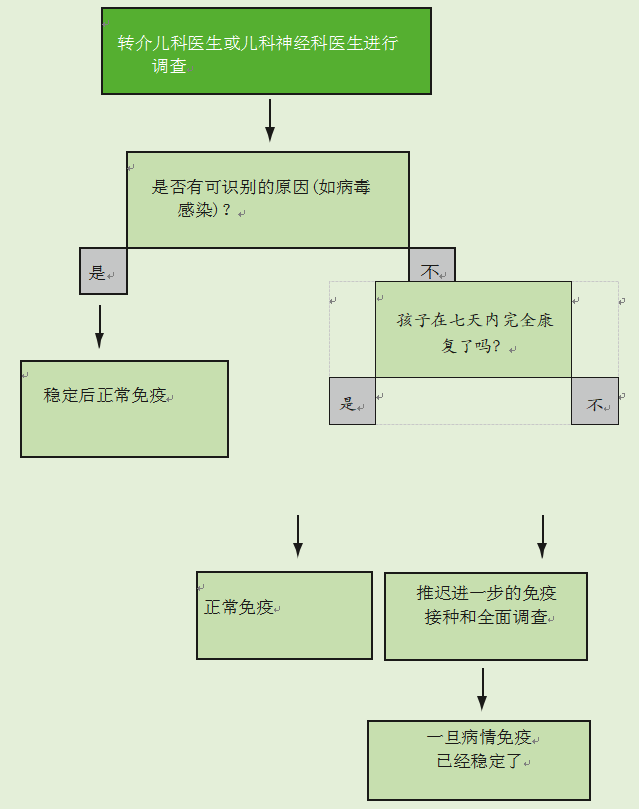
图26.4免疫接种后七天内发生的脑炎或脑病的流程图
儿童或任何年龄的个体对标有黑三角(▼)的疫苗发生的所有疑似不良反应,应通过黄卡计划报告给人类药物委员会。成人对疫苗的严重、可疑不良反应应通过黄卡计划报告。
疑似病例和疫情的管理
由于脊髓灰质炎越来越罕见,并且在临床上难以与其他疾病相鉴别,因此应根据英国微生物学调查标准(SMI)对疑似麻痹性疾病(包括其他形式的急性弛缓性麻痹,如格林-巴利综合征和横贯性脊髓炎)进行全面调查http://www.hpa.org.uk/webc/HPAwebFile/HPAweb_C/ 1317133980627.这应包括在患病的第一周,间隔24至48小时采集的两个病毒学粪便样本。理想情况下,粪便样本也应来自家庭和其他密切接触者。健康保护机构Colindale(或苏格兰的苏格兰健康保护机构(HPS))提供关于疑似病例调查和管理的建议。疑似病例应立即报告给传染病控制顾问(或苏格兰公共卫生医学(CPHM)顾问),不应等待培养或其他病毒学确认。
为防止持续传播,应立即(在获得粪便样本后)对疑似脊髓灰质炎患者的家庭接触者接种含IPV的疫苗。为此,含IPV病毒的疫苗库存被集中保留,并将根据健康保护局(HPA)或HPS的建议发放。在出现由野生病毒引起的麻痹性脊髓灰质炎病例后,可能还需要立即给病例周围的其他人接种含IPV的疫苗,而不管先前是否有脊髓灰质炎免疫史。
在大规模爆发的情况下,可能有必要考虑使用适当的单价OPV (m-OPV)。应向HPA (Colindale)寻求紧急建议,他们可能能够获得适当的m-OPV供应。
应与HPA Colindale(苏格兰HPS)讨论制定其他适当的控制措施,这些措施将取决于病例的性质以及受影响群体或地区的可能疫苗覆盖范围。
保持无脊髓灰质炎状态
世卫组织要求继续证明英国临床监测的充分性。因此,CDSC和HPS正在为英国根除脊髓灰质炎专家组整理所有脊髓灰质炎疑似病例的信息。
供应
- Pediacel(白喉/破伤风/五组分无细胞百日咳/灭活脊髓灰质炎疫苗/b型流感嗜血杆菌(DTaP/IPV/Hib)-由赛诺菲巴斯德MSD公司生产。
- Repevax(白喉/破伤风/五组分无细胞百日咳/灭活脊髓灰质炎疫苗(dTaP/IPV))–由赛诺菲巴斯德MSD公司生产。
- Infanrix IPV(白喉/破伤风/三组分无细胞百日咳/灭活脊髓灰质炎疫苗(DTaP/IPV))–由葛兰素史克公司生产。
- Revaxis(白喉/破伤风/灭活脊髓灰质炎疫苗(Td/IPV))–由赛诺菲巴斯德MSD公司生产。
这些疫苗由医疗物流(电话:0870 871 1890)提供,作为国家儿童免疫规划的一部分。
在苏格兰,应该从当地的儿童疫苗储备中心获得供应。这些细节可从苏格兰保健用品公司获得
(电话:0141 282 2240)。
在北爱尔兰,应该从当地的儿童疫苗储备中心获得供应。详情可向区域药品采购处索取(电话:02890 552368)。
参考
American Academy of Pediatrics (2003) Active immunization. In: Pickering LK (ed.) Red
Book: 2003 Report of the Committee on Infectious Diseases, 26th edition. Elk Grove Village,
IL: American Academy of Pediatrics, p 33.
Bohlke K, Davis RL, Marcy SH et al. (2003) Risk of anaphylaxis after vaccination of
children and adolescents. Pediatrics 112: 815–20.
British HIV Association (2006) Immunisation guidelines for HIV-infected adults: www.bhiva.
org/pdf/2006/Immunisation506.pdf.
Canadian Medical Association (1998) Pertussis vaccine. In Canadian Immunisation Guide, 5th
edition. Canadian Medical Association, p 133.
Canadian Medical Association (2002) General considerations. In Canadian Immunisation
Guide, 6th edition. Canadian Medical Association, p 14.
Department of Health (2001) Health information for overseas travel, 2nd edition. London:
TSO.
Diggle L and Deeks J (2000) Effect of needle length on incidence of local reactions to
routine immunisation in infants aged 4 months: randomised controlled trial. BMJ 321: 931–3.
Gelfand HM, LeBlanc DR, Fox JP and Conwell DP (1957) Studies on the development of
natural immunity to poliomyelitis in Louisiana II. Description and analysis of episodes of infection observed in study households. Am J Hyg 65: 367– 85.
Klein NP, Massolo ML, Greene J et al. (2008) Risk factors for developing apnea after immunization in the neonatal intensive care unit. Pediatrics 121(3): 463-9.
Mark A, Carlsson RM and Granstrom M (1999) Subcutaneous versus intramuscular
injection for booster DT vaccination in adolescents. Vaccine 17: 2067–72
Miller E (1999) Overview of recent clinical trials of acellular pertussis vaccines. Biologicals
27: 79–86.
Ohlsson A and Lacy JB (2004) Intravenous immunoglobulin for preventing infection in preterm and/or low-birth-weight infants. Cochrane Database Syst Rev(1): CD000361.
Pfister RE, Aeschbach V, Niksic-Stuber V et al. (2004) Safety of DTaP-based combined immunization in very-low-birth-weight premature infants: frequent but mostly benign cardiorespiratory events. J Pediatr 145(1): 58-66.
Plotkin SA and Orenstein WA (eds) (2004) Vaccines 4th edition. Philadelphia: WB Saunders
Company, Chapter 8.
Pourcyrous M, Korones SB, Arheart KL et al. (2007) Primary immunization of premature
infants with gestational age <35 weeks: cardiorespiratory complications and C-reactive protein
responses associated with administration of single and multiple separate vaccines simultaneously. J Pediatr 151(2): 167-72.
Ramsay ME, Begg NT, Ghandi J and Brown D (1994a) Antibody response and viral
excretion after live polio vaccine or a combined schedule of live and inactivated polio
vaccines. Pediatr Infect Dis J 13: 1117–21.
Ramsay M, Begg N, Holland B and Dalphinis J (1994b) Pertussis immunisation in children
with a family or personal history of convulsions: a review of children referred for specialist
advice. Health Trends 26: 23–4.
Ramsay M, Joce R and Whalley J (1997) Adverse events after school leavers received
combined tetanus and low dose diphtheria vaccine. CDR Review 5: R65–7.
Le Saux N, Barrowman NJ, Moore DL et al. (2003) Canadian Paediatric Society/Health
Canada Immunization Monitoring Program – Active (IMPACT). Decrease in hospital admissions for febrile seizures and reports of hypotonic-hyporesponsive episodes
presenting to hospital emergency departments since switching to acellular pertussis vaccine in
Canada: a report from IMPACT. Pediatrics 112(5): e348.
Schulzke S, Heininger U, Lucking-Famira M et al. (2005 ) Apnoea and bradycardia in preterm
infants following immunisation with pentavalent or hexavalent vaccines. Eur J Pediatr 164(7):
432-5.
Sutter RW, Cochi S and Melnick JL (2004) Live attenuated polio virus vaccines. In: Plotkin SA
and Orenstein WA (eds) Vaccines, 4th edition. Philadelphia: WB Saunders Company.
Tozzi AE and Olin P (1997) Common side effects in the Italian and Stockholm 1 Trials. Dev
Biol Stand 89: 105–8.
WHO (2004a) www.polioeradication.org/casecount.asp (accessed October 2006).
WHO (2004b) Polio News, Issue 16, September 2002, p 1.
www.who.int/vaccines-documents/DocsPDF02/polio16.pdf (accessed 10 February 2004)
Zuckerman J N (2000) The importance of injecting vaccines into muscle. BMJ 321: 1237–8.
Hits: 31
