Contents
第25章:肺炎球菌
肺炎球菌 2020年1月
肺炎球菌脑膜炎 须呈报
疾病
肺炎球菌疾病是用来描述由细菌引起的感染的术语
肺炎链球菌(也称为肺炎球菌)是一种被包裹的革兰氏阳性球菌。荚膜是肺炎链球菌最重要的毒力因子;没有荚膜的肺炎球菌通常没有毒性。已经鉴定了超过90种不同的荚膜类型。在常规结合疫苗接种计划之前,约69%的侵袭性肺炎球菌感染是由十种(14、9V、1、8、23F、4、3、6B、19F、7F)最常见的血清型引起的(Trotter et al., 2010)。
肺炎球菌的某些血清型可能在鼻咽中无症状地携带,在一小部分受感染个体中发生疾病。其他血清型很少在鼻咽中鉴定,但与侵袭性疾病相关。肺炎球菌疾病的潜伏期没有明确定义,但可能短至一至三天。该微生物可能局部扩散到鼻窦或中耳腔,导致鼻窦炎或中耳炎。它还可能影响肺部,导致肺炎或系统性(侵入性)感染,包括菌血症性肺炎、菌血症和脑膜炎。
传播途径是通过气溶胶、飞沫或直接接触带菌者的呼吸道分泌物。传播通常需要频繁或长时间的密切接触。肺炎球菌疾病有季节性变化,在冬季达到高峰。
疾病的历史和流行病学
侵袭性肺炎球菌疾病是发病率和死亡率的主要原因。2005/2006年,英格兰和威尔士确诊了6346例侵袭性肺炎球菌疾病(Ladhani et al, 2018)。它特别影响非常年幼的人、老年人、脾脏缺失或无功能的人以及其他原因导致免疫力受损的人。复发性感染可能与颅骨缺损、脑脊液(CSF)渗漏、耳蜗植入或颅骨骨折有关。
在英国有三种类型的肺炎球菌疫苗获得许可,可针对不同的血清型提供保护,详见表25.1。这些疫苗是灭活的,不含硫柳汞,也不含活的生物体,因此不会引起它们所保护的疾病。
| 疫苗类型 | 许可疫苗 | 涵盖的血清型 |
| 肺炎球菌多糖疫苗(PPV23) | 肺炎球菌多糖疫苗 | 1,2,3,4,5,6B,7F,8,9N,9V,10A,11A, 12F,14,15B,17F,18C,19F,19A,20,22F, 23F,33F |
| 肺炎球菌结合疫苗(PCV13) | Prevenar13® | 1,3,4,5,6A,6B,7F,9V,14,18C,19A,19F, 23F |
| 肺炎球菌结合疫苗(PCV10) | Synflorix® | 1,4,5,6B,7F,9V,14,18C,19F,23F。 |
表25.1.在英国可获得肺炎球菌疫苗。
肺炎球菌多糖疫苗
PPV23含有来自23种常见肺炎球菌荚膜类型的纯化荚膜多糖。大多数健康成人在免疫接种后的第三周对单剂量的PPV23产生良好的抗体反应。两岁以下的儿童对PPV23免疫接种的抗体反应较差,没有证据表明PPV23在该年龄组有效(Grabenstein et al., 2017)。
在英国,自1992年以来,PPV23一直被推荐用于风险人群,自2003年以来,被推荐用于所有65岁及以上的人群。在接种疫苗后的前两年内,PPV23对65岁及以上成人中由疫苗血清型引起的侵袭性肺炎球菌疾病(IPD)具有41%的中度短期有效性,与患有基础疾病的人相比,健康个体中的疫苗有效性更高(Djennad et al., 2019)。有证据表明,PPV23可预防非菌血症肺炎球菌肺炎(Diao et al., 2016)。
PPV23在危险人群和老年人中提供的保护长度是可变的,并且是血清型依赖的。免疫后抗体水平通常在大约五年后开始下降,但在无脾症患者和肾病综合征儿童中下降更快(Butler et al., 1993)。
肺炎球菌结合疫苗
已经开发出含有来自最常见荚膜类型的多糖的PCV。使用类似于成功用于b型流感嗜血杆菌(Hib)和脑膜炎球菌结合疫苗的生产技术,将多糖结合到蛋白质上,提高了幼儿的抗体反应。已知肺炎球菌结合疫苗在两个月大的儿童中具有高免疫原性。
2006年,英国将7价PCV (PCV7)引入婴儿免疫计划,同时为所有2岁以下儿童提供12月龄的补种。尽管PCV7当时被许可为3+1方案,但在疫苗接种和免疫联合委员会(JCVI)审查证据(包括临床试验结果)后,英国在2月龄、4月龄和1岁时实施了缩减的2+1方案,试验证明,在2、3和4月龄或2和4月龄大的婴儿中接受PCV7具有相似的免疫原性(Goldblatt et al., 2006)。英国2+1 PCV7免疫接种计划实现了非常高的疫苗覆盖率(> 90%),并且由于PCV7血清型,在IPD以及由于直接和间接(畜群)保护,在所有年龄组中,在IPD总体上导致了快速和持续的减少(Miller et al., 2011)。间接保护是通过预防接种疫苗的儿童鼻咽部携带肺炎球菌并传播给他人实现的。在所有年龄组中,PCV7型IPD的大幅下降被非PCV7型IPD的小幅上升部分抵消。英国肺炎球菌免疫接种计划的成功随后导致了PCV7许可的变化,允许简化的2+1方案在全球范围内使用。
2010年4月,PCV13取代了PCV7,也是在2+1方案中,这导致了PCV13中额外血清型的进一步减少;到2013/14年,超过70%的所有IPD病例是由PCV13未覆盖的血清型引起的(Waight et al.,2015)。自2013/14年以来,观察到侵袭性肺炎球菌疾病的总体发病率增加,这主要是由于非PCV13疫苗血清型(特别是血清型8、12F和9N)的增加,并且主要是在较老的年龄组中。目前导致侵袭性肺炎球菌疾病的十种最流行的血清型中有八种包含在PPV23中(Ladhani et al, 2018)(图25.1)。
另一种预防10种肺炎球菌血清型(PCV10)的疫苗获得许可。该疫苗含有与蛋白D(来源于不可分型的流感嗜血杆菌)、破伤风类毒素或白喉类毒素载体蛋白结合的肺炎球菌多糖。PCV10不含血清型3、6A或19A,目前未用于英国免疫计划。
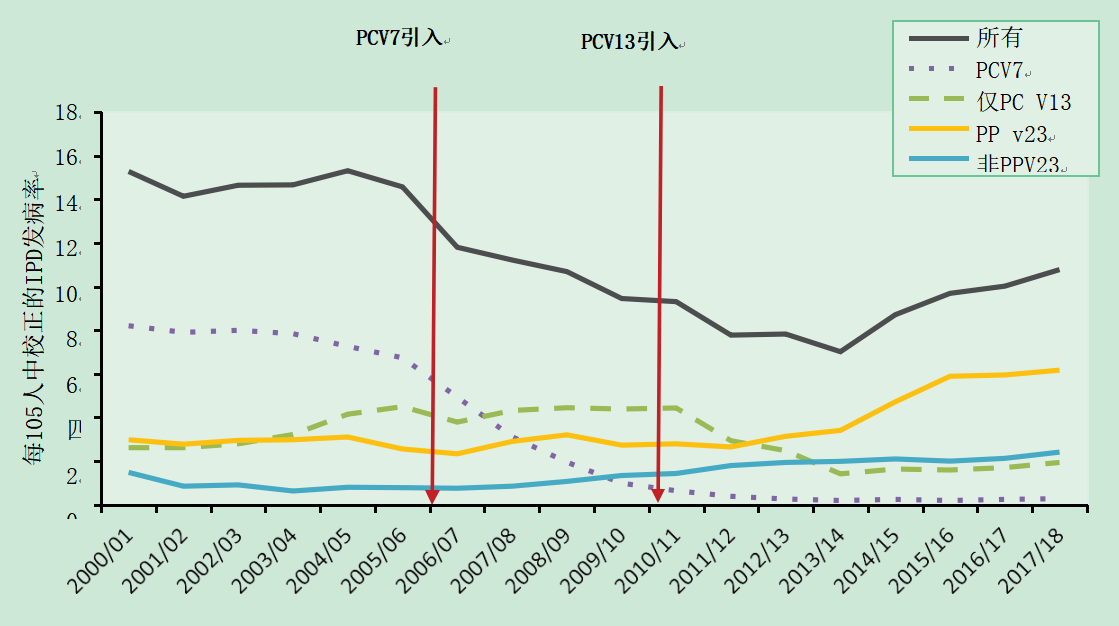
图25.1 2000/2001年至2017/2018年英国经校正的IPD发病率(按血清型分组)
鉴于该计划在接种疫苗者和更广泛的人群(通过群体免疫)中取得的成功,JCVI审查了2017年和2018年的婴儿肺炎球菌疫苗接种计划。一项英国研究显示,当一次婴儿初始剂量加一次加强剂(1+1方案)与两次婴儿初始剂量加一次加强剂(2+1方案)相比时,加强剂量后的免疫原性相似(Goldblatt et al.,2017)。JCVI建议,由于PCV13计划的最大直接和间接效益可能已经实现,英国的时间表可以从2+1(在8周龄、16周和一岁时接种)改为1+1时间表(在12周和一岁时接种)(Choi et al.,2019)。这一变化在2020年实施。
储存
请看第三章贮存、分发和处置有关存储的信息。
剂型
有关PCV10、PCV13和PPV23介绍的信息可在产品特性总结(SPCs)中找到,网址为https://www.medicines.org.uk/emc。
PCV10和PCV13
储存会导致疫苗分离成白色沉淀和澄清的上清液。应摇匀疫苗,以获得白色均质悬浮液,如果摇匀后有任何残留颗粒物质,则不应使用。
PPV23
多糖疫苗在注射前应进行检查,以确保其透明无色。
疫苗不得通过静脉注射。
剂量和时间表
PCV13
对于风险群体中的儿童和成人,请参考表25.2和下面的风险群体部分。
一岁以下婴儿的常规免疫接种:
- 12周龄时0.5毫升PCV13的单次初始剂量
- 在接种Hib/MenC、4CMenB和MMR疫苗的同时,在一岁时(一岁生日当天或之后)给予0.5毫升PCV13的加强剂量(参见 Chapter 11:英国免疫接种计划)
不建议常规免疫接种额外的PCV13剂量,但可能适用于某些风险群体(参见下表25.2和25.3)。
PPV23
65岁及以上的成年人,以及2岁及以上的临床风险人群:
- 0.5毫升PPV23的单剂量
在患有无脾症、脾功能障碍或慢性肾病的个体中,抗体水平可能迅速下降(Giebink et al.,1981;Rytel et al.,1986),因此,
在这些人群中,建议每五年进行一次PPV23再免疫。不要求在接种疫苗前检测抗体水平。
目前不建议任何其他临床风险群体或年龄组再次接种PPV23疫苗。
PCV10
目前不推荐在英国国家免疫计划中使用。请参见SPC了解潜在的接种方案https://www.medicines.org.uk/emc。
接种
有关接种疫苗的指导,请参考第四章:免疫接种程序。
肺炎球菌疫苗可以与其他疫苗同时接种,如DTaP/IPV/ Hib/HepB、4CMenB、MMR、MenACWY、Hib/MenC、轮状病毒和流感。疫苗应该在不同的部位注射,最好是在不同的肢体。如果在同一个肢体上接种,它们应该至少分开2.5厘米。应在个人记录中注明每种疫苗的注射地点。
处理
请看第三章贮存、分发和处置。
有未知或不完整疫苗接种史的个人
除非有可靠的既往免疫史,否则应假定个人未免疫。应遵循完整的英国建议。
未免疫或部分免疫的儿童,如果在一岁前未及时接种疫苗,应接受一次初始剂量的PCV13,然后在一岁时(一岁生日当天或之后)接受一次PCV13加强免疫。如果第一次PCV13剂量接种很晚(如11个月),则在加强剂量前应至少间隔4周,以确保免疫反应的适当加强。
一岁至两岁以下的未免疫或部分免疫儿童应接种一剂PCV13。
第二个生日后不再提供PCV常规免疫。
任何有资格接种PCV疫苗的儿童,如果已经在另一个国家接种了一剂或多剂PCV10疫苗,应在至少4周后再接种一剂PCV13。这确保了婴儿获得与根据英国国家免疫计划接种疫苗的婴儿相同的肺炎球菌血清型的保护。这些婴儿应在12周大时接受一剂PCV13,并在一岁时(在他们的第一个生日当天或之后)接受一剂加强剂,允许两剂PCV13之间有8周龄(理想)或4周(最小)的间隔。
风险群体
临床风险人群中的儿童和成人(表25.2)将需要额外的肺炎球菌疫苗接种,具体取决于他们就诊(诊断)时的年龄、疫苗接种状态和基础状况(见表25.3)。
初级保健人员应确定建议接种疫苗的患者,并利用一切机会确保他们获得适当的免疫接种,例如,在接种流感疫苗或进行其他常规咨询时,尤其是在入院后出院时。
表25.2应接种肺炎球菌疫苗的临床风险人群
| 临床风险组 | 示例(基于临床判断的决定) |
| 无脾症或脾功能障碍 | 这也包括可能导致脾功能障碍的疾病,如纯合性镰状细胞病和腹腔综合征。 |
| 慢性呼吸道疾病(慢性呼吸道疾病是指慢性下呼吸道疾病) | 这包括慢性阻塞性肺疾病(COPD),包括慢性支气管炎和肺气肿;以及支气管扩张、囊性纤维化、间质性肺纤维化、尘肺和支气管肺发育不良等病症(BPD)。患有由吸入引起的呼吸系统疾病或有吸入风险的神经系统疾病(如脑瘫)的儿童。哮喘不是适应症,除非严重到需要连续或频繁重复使用全身性类固醇(定义见下文免疫抑制)。 |
| 慢性心脏病 | 这包括缺血性心脏病、先天性心脏病、伴有心脏并发症的高血压和慢性心力衰竭需要定期药物治疗和/或随访的患者。 |
| 慢性肾脏疾病 | 肾病综合征、第4和第5阶段的慢性肾病以及正在进行肾透析或肾移植的患者。 |
| 慢性肝病 | 这包括肝硬化、胆道闭锁和慢性肝炎。 |
| 糖尿病 | 需要胰岛素或抗糖尿病药物的糖尿病。这不包括控制饮食的糖尿病。 |
| 免疫抑制 | 由于疾病或治疗,包括接受化疗导致免疫抑制、骨髓移植、无脾或脾功能障碍、补体障碍、各阶段艾滋病毒感染、多发性骨髓瘤或影响免疫系统的遗传疾病(如IRAK-4、NEMO)的患者。 服用或可能服用系统性类固醇超过一个月的个人,剂量相当于泼尼松龙每天20毫克或以上(任何年龄),或对于20公斤以下的儿童,剂量为每天每公斤1毫克或以上。 |
| 人工耳蜗植入者 | 重要的是,免疫接种不会延迟耳蜗植入。 |
| 脑脊液漏的个体 | 这包括脑脊液漏,如外伤或大型颅骨手术后(不包括脑脊液分流)。 |
| 职业风险 | 请参见第9页 |
表25.3-高危患者的疫苗剂量汇总。
| 患者在出现或首次诊断出临床风险状况时年龄 | 存在临床风险(不包括患有无脾症、脾功能障碍、补体紊乱或严重免疫缺陷的患者1) | 无脾症、脾功能障碍、补体障碍或严重免疫缺陷1 | ||
| PCV13 | PPV23 | PCV13 | PPV23 | |
| 从出生到一岁的婴儿 | 第12周龄和一岁时的常规PCV13(在一岁生日当天或之后)。 | 2岁时的PPV23,最后一次PCV接种后至少8周龄 | 两次PCV13注射间隔至少8周龄(不早于6周龄开始) | 2岁时的PPV23,最后一次PCV接种后至少8周龄 |
| 一岁时的PCV13增强剂(一岁生日当天或之后) | ||||
| 至少8周龄后追加PCV13剂量 | ||||
| 一岁到两岁 | 一岁时常规PCV13加强剂(一岁生日当天或之后) | 2岁时的PPV23,最后一次PCV接种后至少8周龄 | 一岁时常规PCV13加强剂(一岁生日当天或之后) | 2岁时的PPV23,最后一次PCV接种后至少8周龄 |
| 至少8周龄后追加PCV13剂量 | ||||
| 两岁至十岁以下 | 不需要进一步的PCV13(如果未免疫或部分免疫,注射一剂PCV13) | 2岁时的PPV23,最后一次PCV接种后至少8周龄 | 无脾症、脾功能障碍或补体障碍: 不需要进一步的PCV13(如果未免疫或部分免疫,注射一剂PCV13) | 2岁时的PPV23,最后一次PCV接种后至少8周龄 |
| 严重免疫受损:一剂PCV13(即使未免疫或部分免疫) | ||||
| 10岁以上的儿童和成人 | 不需要进一步的PCV13,不考虑PCV疫苗接种史 | 一剂PPV23 | 无脾症、脾功能障碍或补体障碍: 不需要更多的PCV13 | 一剂PPV23,在最后一剂PCV后至少8周龄2 |
| 严重免疫受损:一剂PCV13 | ||||
1严重免疫缺陷的例子包括骨髓移植患者、急性和慢性白血病患者、多发性骨髓瘤患者或影响免疫系统的遗传疾病患者(如IRAK-4、NEMO)
2如果个人在前2岁接种过PPV23,则不需要PCV13或额外的PPV23,因为理论上存在重新接种肺炎球菌血清型特异性低反应性的风险。
需要脾切除或开始免疫抑制治疗者的疫苗接种时机
由于严重感染的高风险,特别是肺炎球菌疾病,建议所有患有无脾症、脾功能障碍和可能导致脾功能障碍的疾病(包括血红蛋白病,如镰状细胞病和腹腔综合征)的个体接种疫苗。看见第7章:个人免疫接种潜在的医疗条件完整的时间表,包括针对该组的其他疫苗。
那些需要脾切除术或开始免疫抑制治疗的人应根据上述针对特定年龄的建议接种疫苗。理想情况下,疫苗应在选择性脾切除术或化疗或放疗等治疗开始前4-6周接种。在不可能的情况下,可以在治疗前两周接种。如果无法提前接种疫苗,则切脾、化疗或放疗决不能延迟。
如果在脾切除术前两周接种疫苗不可行,免疫接种应推迟到手术后至少两周,因为此时功能性抗体反应可能更好(Shatz et al.,1998)。如果在开始化疗/放疗前两周接种疫苗不可行,则应推迟至治疗结束后至少三个月进行免疫接种,以使疫苗反应最大化。
如果这可能导致接种失败,这些患者的免疫接种不应延迟。
对于白血病患者,应在完成化疗后6个月开始注射PCV13,对于骨髓移植患者,应在移植后9-12月龄注射PCV13。
面临职业风险的个人
接触金属烟雾与肺炎(尤其是大叶性肺炎)之间存在关联,焊接与侵袭性肺炎球菌疾病之间也存在关联(Wong et al.,2010)。考虑到现有的接触控制措施,对于那些有频繁或持续职业接触金属烟雾风险的人(如焊工),应考虑使用PPV23(之前未接受过PPV23的人单剂量为0.5ml)。
接种疫苗可能会降低肺炎球菌疾病的风险,但不应取代采取措施预防或减少暴露的必要性。
禁忌症
很少有人不能接种肺炎球菌疫苗(参见第六章:禁忌症和注意事项)。如有疑问,应向儿科顾问、当地NHS英格兰筛查和免疫团队或当地健康保护团队寻求适当的建议。
疫苗不应注射给患有以下疾病的人:
- 对前一剂疫苗的确认过敏反应
- 对疫苗的任何成分产生过敏反应
确诊过敏反应是罕见的。其他过敏情况,如皮疹,可能更常见,但不是进一步免疫接种的禁忌症。仔细的事件史通常会区分真正的过敏反应和其他不是由疫苗引起的或不危及生命的事件。在后一种情况下,有可能继续免疫过程。必须寻求专家对疫苗以及在何种情况下可以注射疫苗的建议。必须考虑到个人未接种疫苗的风险。参见第8章:疫苗安全性和不良事件了解更多信息。
预防措施
没有发烧或全身不适的小病不是推迟免疫接种的正当理由。如果个人急性不适,应推迟免疫接种,直到他们完全康复。这是为了避免由于错误地将任何体征或症状归因于疫苗的副作用而混淆任何急性疾病的鉴别诊断。
怀孕和母乳喂养
当需要保护时,可以立即给孕妇接种肺炎球菌疫苗。没有证据表明给孕妇或哺乳期妇女接种灭活病毒或细菌疫苗或类毒素有风险(Plotkin et al.,2018)。
早产儿
看见第十一章:免疫接种时间表和第7章:有潜在疾病的个体的免疫以获得更多信息。
免疫抑制和艾滋病毒感染
根据上述建议,患有免疫抑制和HIV感染的个体(无论CD4计数如何)应接种肺炎球菌疫苗。PPV23在预防肺炎球菌疾病方面的潜在益处超过了HIV感染成人的任何潜在风险。
不良反应
任何人都可以使用黄卡报告计划向医疗和保健产品监管机构(MHRA)报告可疑的不良反应 (http://yellowcard.mhra.gov.uk/)。
所有不良反应的报告可在产品特性总结中找到,网址为https://www.medicines.org.uk。
PCV13
在对照临床研究中评估了疫苗的安全性,Prevenar13®的安全性与Prevenar®相似。对于Prevenar13®,在6周至5岁的儿童中最常报告的不良反应是疫苗接种部位反应、发烧、易怒、食欲下降和睡眠增加和/或减少。
PPV23
注射部位会出现持续一到三天的轻度疼痛和硬结,偶尔会出现低烧。更严重的全身反应并不常见。一般来说,局部和全身反应在肺炎球菌多糖抗体浓度较高的人群中更常见。
病例、接触和暴发
任何被认为是由肺炎链球菌引起的侵袭性肺炎球菌感染或大叶性肺炎病例都应提示对患者的病史进行审查,以确定他们是否属于公认的风险群体,以及他们是否已进行了适当的免疫接种。未免疫或部分免疫的个体应尽可能在出院时接种疫苗。
五岁以下儿童的病例
临床医生应该确保被诊断患有IPD的儿童已经完成了推荐的国家免疫接种计划。IPD时年龄小于12月龄且未接种或部分接种疫苗的婴儿应完成推荐的免疫接种计划。
接受免疫接种的儿童随后出现由肺炎球菌疫苗血清型之一引起的IPD,应评估其潜在的免疫缺陷。如果儿童属于表25.2中的临床风险组之一,则应按照本章的建议提供额外的疫苗接种。
来自所有IPD病例的分离株应提交给国家参考实验室进行血清分型。英格兰公共卫生部、威尔士公共卫生部、苏格兰健康保护部或北爱尔兰公共卫生署将对所有5岁以下儿童的IPD新病例进行随访,无论其血清型如何。
接触
侵袭性肺炎球菌疾病的密切接触者通常不会增加肺炎球菌感染的风险,因此不需要抗生素预防。应与当地健康保护团队讨论侵袭性肺炎球菌疾病群。
爆发
医院和疗养院中肺炎球菌呼吸道疾病的爆发需要迅速调查。包括接种疫苗在内的控制措施可能是适当的;这些应在与当地健康保护或感染控制团队的讨论中达成一致。欲了解更多信息,请参见英国《封闭环境中严重肺炎球菌疾病的公共卫生管理指南》(健康保护局,2008年),网址为:https://www.gov.uk/government/collections/pneumococcal-disease-guidance-data-and-analysis。
供应
- 13价PCV (Prevenar 13®)由辉瑞公司生产(医疗信息网站:www.pfizermedicalinformation.co.uk,电话:01304 616161)
- 23价肺炎球菌多糖疫苗由MSD生产。MSD疫苗由AAH有限公司分销(电话:0344 561 8899)
- 10价PCV (Synflorix®)由葛兰素史克公司生产(电话:0800 221 441)
支持常规儿童免疫接种计划的PCV13由中央供应,详情请见第三章贮存、分发和处置。
信息材料
无脾和脾功能低下患者的患者卡和信息表可从以下网址获得:https://www.gov.uk/government/publications/splenectomy-leaflet-and-card
或者在苏格兰来自:
健康保护小组(免疫)卫生局苏格兰行政区3ES圣安德鲁斯宫摄政路爱丁堡EH1 3DG
(电话:0131 244 2879)。
(传真:0131 244 2157)。
(电邮:immunisationprogrammes @ gov . scot)。
或者在威尔士,可从以下网站获得无脾患者指南和患者卡:
www.publichealthwales.org/HealthInformationResources
在北爱尔兰,可从公共卫生机构获得“卫生专业人员脾切除术说明书”、“脾切除术患者传单”和脾切除术患者钱包卡:
https://www.publichealth.hscni.net/publications/splenectomy-factsheet-health-professionals-0
https://www.publichealth.hscni.net/publications/splenectomy-patient-leaflethttp://www.publichealth.hscni.net/publications/splenectomy-wallet-card
参考
Butler JC, Breiman RF, Campbell JF et al. (1993) Pneumococcal polysaccharide vaccine efficacy: an evaluation
of current recommendations. JAMA 270: 1826–31.
Choi YH, Andrews N, Miller E. Estimated impact of revising the 13-valent pneumococcal conjugate vaccine
schedule from 2+1 to 1+1 in England and Wales: A modelling study. PLoS Med. 2019 Jul 3;16(7):e1002845.
Diao WQ, Shen N, Yu PX et al. (2016) Efficacy of 23-valent pneumococcal polysaccharide vaccine in
preventing community-acquired pneumonia among immunocompetent adults: A systematic review and
meta-analysis of randomized trials. Vaccine. 2016 Mar 18;34(13):1496-1503.
Djennad A, Ramsay ME, Pebody R et al. (2019) Effectiveness of 23-Valent Polysaccharide Pneumococcal
Vaccine and Changes in Invasive Pneumococcal Disease Incidence from 2000 to 2017 in Those Aged 65 and
Over in England and Wales. EClinicalMedicine. 2019 Jan 2;6:42-50.
Giebink GS, Le CT, Cosio FG et al. (1981) Serum antibody responses of high-risk children and adults to
vaccination with capsular polysaccharides of Streptococcus pneumoniae. Rev Infect Dis 3:168–78.
Goldblatt D, Southern J, Ashton L et al. (2006) Immunogenicity and boosting after a reduced number of
doses of a pneumococcal conjugate vaccine in infants and toddlers. Pediatr Infect Dis J 25: 312–9.
Goldblatt D, Southern J, Andrews N et al. Pneumococcal conjugate vaccine 13 delivered as one primary and
one booster dose (1 + 1) compared with two primary doses and a booster (2 + 1) in UK infants: a
multicentre, parallel group randomised controlled trial. Lancet Infect Dis. 2018 Feb;18(2):171-179.
Grabenstein JD and Musher DM (2018) Pneumococcal Polysaccharide Vaccines. In: Plotkin SA, Orenstein WA,
Offit PA and Edwards KM (eds) Vaccine, 7th edition. Philadelphia, PA : Elsevier, [2018]
Health Protection Agency (2008) https://www.gov.uk/government/publications/managing-clusters-ofpneumococcal-disease-in-closed-settings
Industrial Injuries Advisory Council (2010) Lobar pneumonia in welders. Information Note. Nov 2010 https://
www.gov.uk/government/publications/lobar-pneumonia-in-welders-iiac-information-note
Ladhani SN, Collins S, Djennad A et al. Rapid increase in non-vaccine serotypes causing invasive
pneumococcal disease in England and Wales, 2000-17: a prospective national observational cohort study.
Lancet Infect Dis. 2018 Apr;18(4):441-451.
Miller E, Andrews NJ, Waight PA et al. Herd immunity and serotype replacement 4 years after seven-valent
pneumococcal conjugate vaccination in England and Wales: an observational cohort study. Lancet Infect Dis
2011;11(10):760-8.
Plotkin SA, Orenstein WA Offit PA and Edwards KM, (eds) (2018) Vaccines, 7th edition. Philadelphia, PA :
Elsevier, [2018], Chapter 9.
Rytel MW, Dailey MP, Schiffman G et al. (1986) Pneumococcal vaccine in immunization of patients with renal
impairment. Proc Soc Exp Biol Med 182: 468–73.
Shatz DV, Schinsky MF, Pais LB et al. (1998) Immune responses of splenectomized trauma patients to the
23-valent pneumococcal polysaccharide vaccine at 1 versus 7 versus 14 days after splenectomy. J Trauma 44:
760–5.
Trotter CL, Waight P, Andrews NJ, Slack M, Efstratiou A, George R, Miller E. Epidemiology of invasive
pneumococcal disease in the pre-conjugate vaccine era: England and Wales, 1996-2006. J Infect. 2010
Mar;60(3):200-8.
Waight PA, Andrews NJ, Ladhani SN et al. Effect of the 13-valent pneumococcal conjugate vaccine on
invasive pneumococcal disease in England and Wales 4 years after its introduction: an observational cohort
study. Lancet Infect Dis 2015 15(5):535-43
Wong et al. (2010) Welders are at increased risk for invasive pneumococcal disease. Int. J. Infect. Dis e796-9.
Hits: 120
