Contents
第24章:百日咳
2018年4月 须呈报
疾病
百日咳是一种高度传染性疾病,通常由百日咳杆菌引起。类似的疾病是由副百日咳杆菌引起的,但这是目前无法用疫苗预防的。
最初是卡他期,随后是刺激性咳嗽,通常在一至两周内逐渐变为阵发性。疾病发作后通常会出现典型的“呐喊”或呕吐。在年幼的婴儿中,典型的“呐喊”可能永远不会出现,咳嗽痉挛之后可能会出现呼吸暂停。这种病通常会持续两到三个月。在较大的儿童和成人中,这种疾病可能表现为没有这些典型症状的持续咳嗽,因此不被认为是百日咳。
百日咳可能会并发支气管肺炎、导致体重减轻的反复呕吐和导致脑损伤风险的脑缺氧。严重的并发症和死亡最常见于6个月以下的婴儿。轻微并发症包括结膜下出血、鼻出血(流鼻血)、面部水肿、舌头或周围区域溃疡以及化脓性中耳炎。
感染通过呼吸道飞沫传播,病例在早期卡他阶段传染性最强。潜伏期为6至20天,从接触后6天到典型疾病发作后3周,病例具有传染性。
疾病的历史和流行病学
在20世纪50年代引入百日咳免疫接种之前,英格兰和威尔士的年均报告数量超过120,000例(图24.1)。
到1972年,疫苗覆盖率约为80%,只有2069例百日咳报告。由于专业人士和公众对全细胞疫苗的安全性和有效性的担忧,覆盖率在1975年下降到约60%,到1978年进一步下降到约30%。重大流行病发生在1977-79年和1981-83年。1978年有超过65,000例报个数和12例死亡(Amirthalingam et al., 2013)。这两大流行病说明了有效疫苗覆盖率下降的影响。由于这些百日咳暴发导致的实际死亡人数更高,因为并非所有婴儿病例都得到确认(Miller and Fletcher, 1976; Crowcroft et al., 2002),但在目前的监测系统下,确诊百日咳病例的死亡人数现在被认为很少(van Hoek et al., 2013b)。
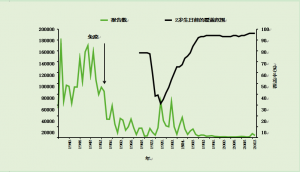
图24.1 1940-2013年儿童两岁生日前的百日咳报个数(英格兰和威尔士)和疫苗覆盖率(仅英格兰)
专业人士和公众信心的恢复提高了疫苗接种率。自1992年以来,两岁以下儿童的接种率一直保持在92%或更高,百日咳报告下降到每年不到5000例。2000-2011年期间,每年通报的病例不超过1,500例。近年来,新诊断方法的引入,尤其是血清学检测的广泛应用,提高了实验室确诊的大龄儿童和成人百日咳的确诊率。
尽管自2010年以来疫苗覆盖率持续保持在95%以上,但从2011年10月开始,在英格兰和威尔士观察到百日咳活动增加,并持续到2012年,最初影响青少年和成人,后来扩展到婴幼儿。因此,2012年4月宣布全国爆发。包括澳大利亚、加拿大和美国在内的其他几个具有长期疫苗接种规划的国家近年来也出现了百日咳活动增加的情况。在持续高疫苗覆盖率的情况下,疾病死灰复燃的原因尚不清楚,但潜在的解释包括病例确诊率的提高、全细胞疫苗向无细胞疫苗的转变、免疫力下降以及百日咳杆菌的基因变化(Cherry,2012)。
非常年幼的百日咳是疾病和死亡的重要原因。大多数住院治疗发生在6个月以下的婴儿,其中一些婴儿病情严重,需要进入儿科重症监护病房(Crowcroft et al., 2003)。在2001-2011年期间,英格兰有48名1岁以下婴儿死于百日咳。在这些死亡病例中,有41例发生在婴儿身上,这些婴儿太小,无法通过接种疫苗获得保护(Hoek et al., 2013b)。成人和较大的儿童可能是太小而不能免疫的婴儿的重要传染源((Crowcroft et al., 2003; van Hoek et al., 2013a),并有助于持续传播(Campbell et al., 2014)。
在2012年百日咳爆发期间,3个月以下婴儿的发病率最高(图24.2)。大多数婴儿病例在他们达到接受第一剂疫苗的年龄之前发病(图24.3)。为应对此次疫情,卫生部于2012年10月推出了一项临时计划,为怀孕28-32周(但最多38周)的孕妇提供百日咳疫苗接种。该方案通过母体抗体的子宫内转移来被动保护婴儿,从出生直到他们能够受到常规婴儿疫苗接种方案的主动保护(Amirthalingam et al., 2014)。2016年2月,JCVI建议孕产妇百日咳免疫接种可从怀孕第16周开始进行(Eberhardt et al., 2016; JCVI February 2016 minute)。
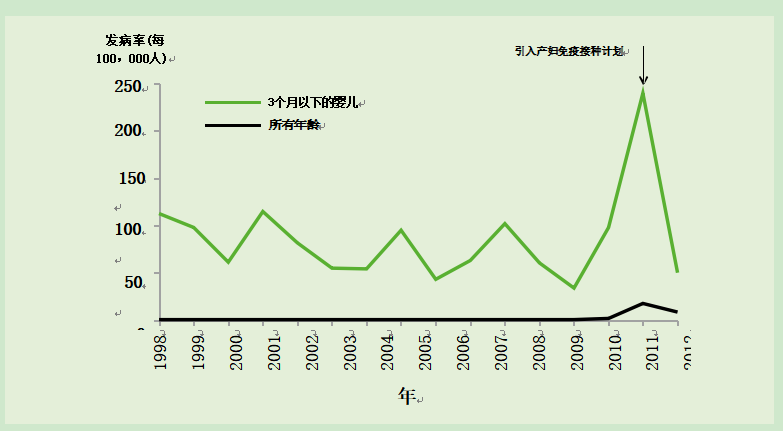
图24.2 1998-2013年英国百日咳实验室确诊病例的发病率
案件总数

图24.3婴儿百日咳发病年龄。一岁以下婴儿百日咳确诊病例,按发病周数(2011-2012年8月)。假设免疫接种后两周内产生保护作用。
自引入以来,产妇百日咳免疫接种方案已被证明在保护婴儿方面非常有效,直到他们在两个月大时可以接受第一次疫苗接种。在该计划的第一年,英格兰的平均疫苗覆盖率为64%,疫苗有效性估计为91% (Amirthalingam et al., 2014)。随后在英格兰和威尔士进行的病例对照研究表明,调整后的疫苗有效性为93% (Dabrera et al., 2014)。2012年期间,
英格兰和威尔士报告了14个婴儿死亡,所有死亡都发生在实施该方案之前出生的婴儿身上。截至2014年10月31日,据报告有10名确诊患有百日咳的婴儿死亡,这些婴儿是在引入孕产妇方案后出生的。这10名婴儿中有9名是由未接种疫苗的母亲所生,所有10名婴儿都太小,无法接种第一剂含百日咳疫苗,也无法通过接种疫苗获得完全保护(英国公共卫生部,2014年)。
由于产妇疫苗接种计划在保护婴儿方面取得了成功,并且有证据表明在产妇计划中安全使用无细胞百日咳疫苗(Donegan et al., 2014),2014年6月,疫苗接种和免疫联合委员会(JCVI)建议,这一临时计划应至少再持续五年。
https://www.gov.uk/government/publications/vaccine-update-issue-217-july-to-august-2014
有关百日咳产妇疫苗接种计划的信息,请点击此处:
https://www.gov.uk/government/publications/whooping-coughvaccination-programme-for-pregnant-women-extension-to-2014
https://www.gov.uk/government/publications/resources-to-supportwhooping-cough-vaccination
https://www.gov.uk/government/publications/vaccine-update-issue-215-may-2014
保健专业人员关于百日咳产妇疫苗接种规划的信息和培训资源可在此获得:
https://www.gov.uk/government/publications/vaccination-againstpertussis-whooping-cough-for-pregnant-women
百日咳疫苗接种
无细胞疫苗由高度纯化的百日咳杆菌生物体的精选成分制成。这些成分用甲醛或戊二醛处理,然后吸附到佐剂(磷酸铝或氢氧化铝)上,以提高免疫原性。
无细胞疫苗在来源、成分数量、每种成分的含量和制造方法方面存在差异(表24.1),从而导致功效和不良反应频率的差异(Edwards and Decker, 2013)。无细胞百日咳疫苗的局部和全身反应的发生率低于全细胞百日咳疫苗(Miller, 1999; Andrews et al., 2010)。
表24.1含百日咳抗原疫苗的组成和治疗适应症。数据摘自产品特性文件摘要(2014年8月)。基于0.5毫升剂量的疫苗组合物。
| 疫苗 | 白喉类毒素 | 破伤风类毒素 | 百日咳抗原 | 灭活脊髓灰质炎病毒(在VERO细胞中培养) | 流感嗜血杆菌 b型多糖 |
| Pediacel® •批准用于6周到4岁•儿主要接种系列 •2004年10月1日批准
| ≥ 30 IU* | ³ ≥ 40 IU* | 百日咳类毒素20µg* 丝状血凝素20µg*
| 1型40 D抗原单位 2型8 D抗原单位 3型32 D抗原单位 | 磷酸聚核糖体核糖醇(10µg)结合破伤风类毒素(18-30µg)
|
| *吸附于磷酸铝沉淀物:苯氧乙醇、聚山梨醇酯80、注射水微量:甲醛、戊二醛、链霉素、新霉素、多粘菌素B、牛血清白蛋白 | |||||
| Infanrix -IPV+Hib •批准用于2月龄以上 •主系列 •2014年6月1日开始 | ≥ 30 IU* | ³ ≥ 40 IU* | 百日咳类毒素25µg* 丝状血凝素25µg* 百日咳杆菌粘附素5µg* 毛状凝集素原2型和3 型各5 µg*
| 1型40 D抗原单位 2型8 D抗原单位 3型32 D抗原单位 | 磷酸聚核糖体核糖醇(10µg)结合破伤风类毒素(30µg) |
| *吸附在氢氧化铝上:乳糖,培养基199,氯化钠,注射水微量:新霉素、多粘菌素、聚山梨醇酯80 | |||||
| Repevax® •自3岁起的加强剂 •2004年9月27日起用于学前儿童加强剂 •从2012年10月1日至2014年6月30日用于孕妇
| ³≥ 2 IU* | ³ ≥ 20 IU* | 百日咳类毒素25µg* 丝状血凝素5µg* 百日咳杆菌粘附素3µg* 毛状凝集素原2型和3 型各5 µg*
| 1型40 D抗原单位 2型8 D抗原单位 3型32 D抗原单位 | |
| *吸附于磷酸铝沉淀物:苯氧乙醇、聚山梨醇酯80、注射水微量:甲醛、戊二醛、链霉素、新霉素、多粘菌素B、牛血清白蛋白 | |||||
| Infanrix® -IPV •批准用于16月龄至13岁•2004年9月27日起批准用于学前儿童加强剂 | ≥ 30 IU* | ³ ≥ 40 IU* | 百日咳类毒素25µg* 丝状血凝素25µg* 百日咳杆菌粘附素8µg* | 1型40 D抗原单位 2型8 D抗原单位 3型32 D抗原单位 | |
| *吸附在氢氧化铝上的沉淀物:介质199,氯化钠,注射水微量:新霉素、多粘菌素、甲醛 | |||||
| Boostrix® -IPV 从4岁开始被授权为加强剂 | ³≥ 2 IU* | ³ ≥ 20 IU* | 百日咳类毒素8µg* 丝状血凝素8µg* 百日咳杆菌粘附素2.5µg* | 1型40 D抗原单位 2型8 D抗原单位 3型32 D抗原单位 | |
| *吸附在氢氧化铝和磷酸铝上:介质199、氯化钠、注射水微量:新霉素、多粘菌素 | |||||
当英国初级免疫计划在2004年从全细胞百日咳疫苗改为无细胞百日咳疫苗时,选择了五组分疫苗(Pediacel ),其包含百日咳类毒素(PT)、丝状血凝素(FHA)、菌毛凝集素(FIM) 2和3以及百日咳杆菌素(PRN)。这种疫苗已被证明比以前在英国使用的全细胞百日咳疫苗对临床典型百日咳疾病提供同等或更好的保护(Miller,1999)。虽然含有PT、FHA和PRN的三组分疫苗(Infanrix® IPV+Hib)可用于初级免疫,但由于功效数据有限,这种疫苗没有使用。随后的分析表明,Infanrix® +Hib(一种具有相同3aP成分的类似疫苗,因全细胞疫苗短缺而于1999-2001年在英国使用)的队列与那些在婴儿期有资格接种全细胞或5aP疫苗的队列一样受到保护,直到学龄前加强剂的年龄(Campbell et al., 2012)。因此,在2008年,JCVI建议将三组分百日咳疫苗改为初级免疫接种不太可能对百日咳流行病学产生明显影响,特别是因为三组分疫苗已经被用作学前加强剂。2010年,世界卫生组织回顾了使用无细胞疫苗的国家控制百日咳的所有全球数据。他们得出结论,含有三种或更多成分的无细胞百日咳疫苗比含有更少成分的疫苗具有更高的保护效力,但没有发现三种和五种成分之间差异的一致证据(世界卫生组织,2010年)。基于这一证据,含三种和五种成分的百日咳疫苗现在都被认为适用于英国的初级免疫接种和学前加强接种。
百日咳疫苗仅作为联合产品的一部分提供:
- 白喉/破伤风/无细胞百日咳/灭活脊髓灰质炎疫苗/b型流感嗜血杆菌(DTaP/IPV/Hib)-用于初级免疫接种
- 白喉/破伤风/无细胞百日咳/灭活脊髓灰质炎疫苗/ (DTaP/ IPV或dTaP/IPV) -用于学前加强剂
- 白喉/破伤风/无细胞百日咳/灭活脊髓灰质炎疫苗(dTaP/ IPV) -用于孕妇。
用于老年人加强免疫的产品的白喉、破伤风和百日咳抗原含量低于用于初次接种的同等产品。重要的是,儿童的初级疫苗接种应使用高剂量百日咳、白喉和破伤风抗原(Infanrix® IPV+Hib或Pediacel ),以确保发生足够的引发。对于成人,包括孕妇,应使用含低剂量白喉和破伤风的疫苗(Repevax®或Boostrix® -IPV ),以避免全剂量制剂出现较高的副作用。为了加强学龄前儿童的免疫接种,可以使用含有更高或更低剂量白喉、破伤风和百日咳抗原的产品(Infanrix® -IPV或Repevax®)。
上述疫苗不含硫柳汞。它们是灭活的,不含活的有机体,不会引起它们所保护的疾病。
单价百日咳疫苗不可用。
储存
疫苗应储存在+2℃至+8℃的原包装中,并避光保存。所有疫苗在某种程度上都对冷热敏感。高温加速了大多数疫苗效力的下降,从而缩短了它们的保质期。除非储存在正确的温度下,否则无法保证疫苗的有效性。冷冻可能导致某些疫苗的反应原性增加和效力丧失。它还会在容器中产生细小的裂纹,导致内容物被污染。有关存储的更多信息,请参见Chapter 3。
剂型
所有含百日咳抗原的疫苗仅作为混合产品的一部分提供(表24.1)。
Pediacel、Repevax®、Boostrix® -IPV和Infanrix® -IPV以预装注射器中的浑浊白色或灰白色悬浮液形式提供。混悬剂在储存过程中可能会沉淀,在接种前应摇动混悬剂使其均匀分布。
Infanrix® -IPV+Hib以小瓶中的粉末和预装注射器中的悬浮液形式提供。疫苗必须通过将预装注射器(含有DTaP-IPV混悬液)的全部内容物添加到含有粉末(Hib)的小瓶中来重新配制。完整的复溶说明见Infanrix® -IPV+Hib产品特性总结。重组后,应立即注射疫苗。
剂量和时间表
所有含百日咳的疫苗都以0.5毫升的单剂量提供。
常规儿童免疫接种
常规儿童免疫接种时间表:
- 两个月大时接种第一剂0.5毫升含百日咳疫苗
- 三个月大时第二次注射0.5毫升(第一次注射后一个月)
- 四个月大时注射第三剂0.5毫升(第二剂后一个月)
- 第四剂0.5毫升应作为学前加强剂的一部分(三岁四个月大或之后不久)。
关于互换性的数据是有限的,因此,只要有可能,同一种含DTaP的疫苗产品应该用于所有三剂一级疫苗疗程。如果做不到这一点,应使用任何可用的初级疫苗(Pediacel或Infanrix® -IPV+Hib)。疫苗接种不应因以前剂量使用的疫苗不可用或未知而推迟。
Repevax® (dTaP/IPV)和Infanrix® -IPV (DTaP/IPV)都适用于学龄前加强免疫接种,无论初级免疫接种使用何种疫苗。
产前疫苗接种
应向孕妇提供单剂0.5毫升的百白破/IPV疫苗。每次怀孕都应该给妇女注射疫苗。疫苗接种应在孕16至32周之间进行,以最大限度地提高婴儿出生时受到保护的可能性。出于手术原因,疫苗接种可能最好在20周左右进行胎儿异常扫描时或之后进行。妇女在怀孕32周后仍可接种疫苗,但这可能不会为婴儿提供高水平的被动保护。然而,怀孕后期接种疫苗可能会直接保护母亲免受疾病的侵害,从而降低婴儿接触疫苗的风险。
Boostrix® -IPV和Repevax® (dTaP/IPV)都适合在产前方案中接种疫苗。Boostrix®-IPV获得了从4岁起进行强化的许可,因此只能用于产妇方案,Repevax® (dTaP/IPV)也可以用作学前强化剂。供应商应订购和使用为产前计划提供的疫苗;这应该是
在Immform上记录或在专业信函中传达。在这些特殊情况下,当一名妇女参加,而Boostrix® -IPV和Repevax® (dTaP/IPV)都不可用时,应给予Infanrix® -IPV (DTaP/IPV)疫苗,而不是推迟接种。
https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/338567/PHE_pertussis_in_pregnancy_information_for_HP_2014_doc_V3.pdf.
接种
疫苗通常通过上臂或大腿前外侧肌肉注射。这是为了降低局部反应的风险,局部反应在皮下注射疫苗时更常见(Mark et al., 1999; Diggle and Deeks, 2000; Zuckerman, 2000)。然而,对于患有出血性疾病的个体,应通过深层皮下注射来接种疫苗,以降低出血的风险。
含百日咳的疫苗可与其他疫苗如MMR、PCV、MenC和乙型肝炎疫苗同时接种。这些疫苗应在不同的部位接种,最好是在不同的肢体。如果接种在同一个肢体,它们应该至少分开2.5厘米(美国儿科学会,2003)。每种疫苗的注射部位应在患者记录中注明。
百日咳疫苗可与流感疫苗同时给孕妇接种,但百日咳疫苗接种不应早于16周,因为这可能损害婴儿对百日咳的被动保护。理想情况下,百日咳疫苗接种应该从大约20周开始,在胎儿异常扫描的同时或之后进行。
处理
用于接种疫苗的设备,包括用过的小瓶、安瓿或注射器,应根据地方当局法规和卫生技术备忘录07-01:医疗废物的安全管理(卫生部,2013年)中的指导,通过将其放置在适当的防穿刺“锐器”箱中进行处置。
疫苗使用建议
儿童免疫接种计划的目标是在适当的时间间隔为所有10岁以下的儿童提供至少4剂含百日咳的疫苗。为了实现这一目标,
每个年龄组的适当疫苗也取决于保护个人免于白喉、破伤风、Hib和脊髓灰质炎的需要。
产妇疫苗接种计划的目标是为每次怀孕16周到32周的孕妇提供单剂百日咳疫苗。
初级免疫接种
10岁以下的婴儿和儿童
百日咳疫苗接种的主要疗程包括三剂含百日咳的产品,每剂之间间隔一个月。DTaP/IPV/Hib推荐用于所有两个月至十岁的婴儿。如果第一疗程中断,应重新开始,但不能重复,允许剩余剂量之间有一个月的间隔。DTaP/IPV/Hib应用于完成已开始使用全细胞或另一种无细胞百日咳制剂的初级疗程。
1至10岁的儿童完成了初级疗程(包括三剂白喉、破伤风和脊髓灰质炎疫苗),但未接种过三剂含百日咳疫苗,应额外接种一剂百白破/IPV(或百白破/IPV/Hib)联合疫苗,以提供一些预防百日咳的免疫。dTaP/IPV疫苗含有较低剂量的百日咳抗原,只应用于完全致敏儿童的加强免疫。然后,他们应该按计划接受第一次强化剂量,也作为DTaP/ IPV(或DTaP/IPV/Hib),最好间隔至少一年。
同样,以前没有接种过任何百日咳疫苗的儿童也应该接种DTaP/IPV(或DTaP/IPV/Hib)。应该给他们注射两剂药物——初始剂量和加强剂量,最好间隔至少一年。
1至10岁的儿童,如果已经完成了初级疗程和加强剂量(包括4剂白喉、破伤风和脊髓灰质炎疫苗),但尚未接种4剂含百日咳疫苗,可额外接种1剂百白破/IPV或百白破/IPV/Hib(如适用),以提供一些或额外的百日咳保护。与遵循标准计划的儿童相比,这些儿童将接受额外剂量的白喉、破伤风和脊髓灰质炎疫苗。这样的额外剂量不可能产生不可接受的反应速率(Ramsay et al., 1997)。
十岁或十岁以上的儿童和成人
目前,除了孕妇(见下文)或作为暴发控制的一部分(见下文),不建议对10岁及以上的人进行百日咳常规免疫接种。
强化免疫
10岁以下的儿童应接受第一次百日咳加强剂与白喉、破伤风和脊髓灰质炎疫苗的联合接种。任何一种推荐的学龄前疫苗都应该用于加强全细胞或无细胞百日咳制剂的初级疗程。含百日咳疫苗的第一次加强免疫最好应在初级疗程结束后三年进行,通常约为三年零四个月。
如果初次疫苗接种被推迟,第一次加强剂量可在预定就诊时进行,前提是第三次初次剂量后至少一年。这将在常规日程中重新建立孩子。dTaP/ IPV或DTaP/IPV应用于该年龄组。
如果一名儿童参加了加强剂量,并有破伤风易发伤口后接种疫苗的历史,应尝试确定接种了哪种疫苗。如果给予的疫苗与当前就诊时到期的疫苗相同,并且间隔适当,则不需要加强剂量。否则,受伤时给予的剂量应打折扣,因为它可能无法提供针对所有抗原的令人满意的保护,因此应给予预定的免疫接种。这样的额外剂量不可能产生不可接受的反应速率(Ramsay et al., 1997)。
仅接种过三剂百日咳疫苗的10岁或10岁以上的人不需要再接种含百日咳疫苗,除非是在怀孕期间或作为疫情控制的一部分(见下文)。
孕妇
应向孕妇提供单剂dTaP/IPV,理想的是在妊娠16周到32周之间,尽管疫苗可在32周后提供(出于操作原因,疫苗应在20周左右,在胎儿异常扫描时或之后提供)。这种疫苗将作为加强剂量,无论先前的疫苗接种状况如何,都应该提供,大多数成年人在婴儿期接种过疫苗或在儿童期自然接触过疫苗。
百日咳疫苗可以提供给孕妇,直到她们进入分娩期。然而这不是免疫的最佳时间,因为在百日咳加强剂后约两周成人的抗体浓度达到峰值。在怀孕16至32周之间接种疫苗可能会使通过胎盘转移的百日咳抗体水平最大化,从而为未出生的婴儿提供被动免疫。
38周后的免疫接种不太可能为婴儿提供被动保护,但可能会保护母亲免受百日咳感染,从而降低婴儿接触百日咳的风险。对于在怀孕期间没有接种疫苗的妇女,含百日咳的疫苗可以在出生后两个月内接种,即直到她们的孩子接种了第一剂含百日咳的疫苗。
免疫状态未知或不完全的儿童接种疫苗
如果在英国出生的儿童有不充分的免疫史,应尽一切努力澄清他们可能接种过哪些疫苗(参见 Chapter 11)。未完成初级疗程的儿童应每月注射一次剩余剂量。儿童可在第三剂首剂疫苗接种一年后接受第一剂加强疫苗接种,以重新建立常规方案。
来到英国的儿童,如果有在原籍国完成免疫接种的历史,可能无法获得针对目前在英国使用的所有抗原的保护。他们可能已经在他们的原籍国接种了含百日咳的疫苗:
http://apps.who.int/immunization_monitoring/globalsummary/schedules
来自发展中国家、冲突地区或服务不足人群的儿童可能没有完全免疫。如果没有可靠的既往免疫史,则应假设他们未进行过免疫,并应遵循完整的英国建议(参见 Chapter 11在疫苗计划中)。
来到英国的儿童可能已经接种了第四剂含百日咳的疫苗,在一些国家,这种疫苗在18个月左右接种。这种剂量应该打折扣,因为它可能无法提供令人满意的预防破伤风、白喉和脊髓灰质炎的保护,直到青少年加强剂量。常规的学前教育和随后的强化教育应该按照英国的时间表进行。
禁忌症
极少数人不能接种含百日咳的疫苗。如有疑问,应寻求儿科顾问、当地筛查和免疫团队或健康保护顾问的适当建议,而不是拒绝接种疫苗。
疫苗不应注射给患有以下疾病的人:
- 对先前剂量的含百日咳疫苗确认过敏反应,或
- 对新霉素、链霉素或多粘菌素B(可能存在微量)的过敏反应。
确诊的过敏反应极少发生。来自英国、加拿大和美国的数据表明,每100万剂疫苗中发生0.65至3次过敏反应事件(Bohlke et al., 2003; Canadian Medical Association, 2002)。其他过敏情况可能更常见,但不是进一步免疫的禁忌症。仔细的事件史通常会区分过敏反应和其他不是由疫苗引起的或不危及生命的事件。在后一种情况下,有可能继续免疫过程。必须寻求专家对疫苗和接种环境的建议。必须考虑到个人未接种疫苗的风险。
预防措施
没有发烧或全身不适的小病不是推迟免疫接种的正当理由。如果个人急性不适,应推迟免疫接种,直到他们完全康复。这是为了避免由于错误地将任何体征或症状归因于疫苗的副作用而混淆任何急性疾病的鉴别诊断。
先前免疫接种后的全身和局部反应
本节给出了对在接种疫苗后72小时内有严重或轻度全身或局部反应史的儿童进行免疫接种的建议。应在以下病史后继续接种含百日咳疫苗:
以前的经验表明,上述事件在接种全细胞百白破疫苗后比单独接种百白破疫苗或百白破疫苗后更易发生。在加拿大用无细胞百日咳疫苗(DTaP/IPV/Hib)替代全细胞百日咳疫苗后,通过免疫监测项目(IMPACT)收集的热性惊厥报告数量显著减少(Le Saux et al., 2003)。当DTaP疫苗与单独的DT相比时,严重的全身和局部反应发生率相同(Tozzi and Olin, 1997)。因此,这些反应不是由无细胞百日咳成分引起的。
如上所述,具有严重反应的儿童继续并完成了含百日咳疫苗的免疫接种,而没有这些反应的复发(Vermeer-de Bondt et al., 1998; Gold et al., 2000)。
在加拿大,对DTaP/IPV/Hib的严重全身或局部反应不是进一步接种疫苗的禁忌症(加拿大医学协会,1998)。加拿大对儿童免疫接种后的不良事件进行了仔细监测(Le Saux et al., 2003),加拿大的经验表明,进一步的剂量与先前事件的复发或恶化无关(S Halperin and R Pless, pers. comm., 2003)。
由于接种无细胞百日咳疫苗后,局部或全身反应比接种全细胞百日咳疫苗更少,因此发生此类事件的儿童数量较少。为了降低不良事件的风险而停用含无细胞百日咳疫苗没有任何益处,而且对完成百日咳免疫接种有额外的保护作用;这应按照常规免疫计划进行。接种全细胞百日咳疫苗后出现局部或全身反应的儿童应使用无细胞百日咳制剂完成免疫接种。
怀孕和母乳喂养
孕妇应该接种含百日咳的疫苗,以保护婴儿出生后获得保护。没有证据表明给孕妇或哺乳期妇女接种灭活病毒或细菌疫苗或类毒素有风险(Kroger et al., 2013)。
自2012年10月引入产妇百日咳计划以来,药品和保健产品管理局(MHRA)已使用黄卡计划和临床实践研究数据链来跟踪接种疫苗后的妊娠结果。这项研究基于一组
18,000名接种疫苗的妇女表明,她们与未接种疫苗的妇女有相似的正常健康分娩率。该研究还发现,没有证据表明死产风险增加,也没有证据表明接种疫苗的母亲出现与妊娠相关的任何一系列不良事件的风险增加(Donegan et al., 2014)。
早产儿
根据时间表,早产儿在适当的年龄接种疫苗是很重要的。接种疫苗后窒息的发生率在早产婴儿中特别高。
住院的极早产儿(出生≤妊娠28周)在接受第一次免疫接种时,应进行48-72小时的呼吸监测,尤其是那些先前有呼吸不成熟病史的婴儿。如果早产儿在第一次免疫接种后出现呼吸暂停、心动过缓或不饱和,第二次免疫接种也应在医院进行,并进行48-72小时的呼吸监测(Pfister et al., 2004; Ohlsson et al., 2004; Schulzke et al., 2005; Pourcyrous et al., 2007; Klein et al., 2008)。由于这一组婴儿接种疫苗的益处很大,因此不应停止或推迟接种疫苗。
免疫抑制和艾滋病毒感染
免疫抑制和HIV感染的个体(不考虑CD4计数)应根据常规推荐方案接种含百日咳疫苗。这些人可能不会产生完全的抗体反应。在治疗结束并痊愈后,应考虑重新免疫。可能需要专家的建议。
皇家儿科和儿童健康学院(http://www.rcpch.ac.uk/),英国艾滋病毒协会(BHIVA)艾滋病毒感染成人免疫指南(BHIVA,2008;http://www.bhiva.org/immunization-guidelines.aspx)以及儿童爱滋病协会的免疫指引(http://www . chiva . org . uk/professionals/health/guidelines/index . html)。
神经疾病
原有的神经疾病
神经疾病的存在不是免疫接种的禁忌症。如果有证据表明儿童患有神经疾病,应遵循图24.4流程图中给出的建议。
如果儿童有稳定的先存神经异常,如脊柱裂、先天性大脑异常或围产期缺氧缺血性脑病,他们应根据建议的时间表进行免疫接种。当有新生儿期脑损伤病史记录时,应进行免疫接种,除非有证据表明出现了神经异常
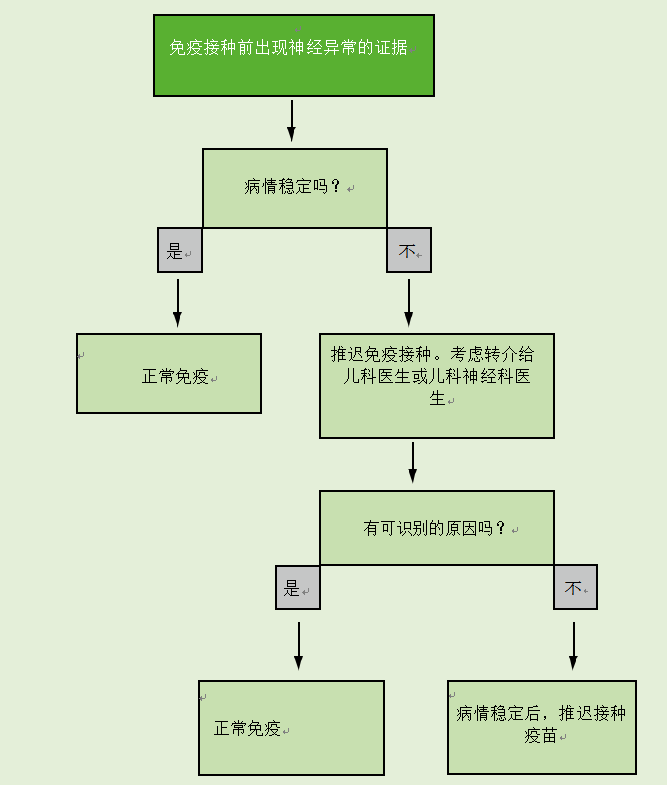
图24.4免疫前神经疾病证据流程图
如果有证据表明目前的神经恶化,包括不良控制癫痫,免疫接种应推迟,儿童应转介给儿童专家进行调查,看看是否可以确定潜在的原因。如果没有确定病因,应推迟免疫接种,直到病情稳定。如果确定了病因,免疫接种应该照常进行。

图24.5免疫接种后七天内发生的脑炎或脑病的流程图
癫痫家族史不是免疫接种的禁忌症。当有热性惊厥的个人或家族病史时,在任何发热(包括由免疫接种引起的发热)后发生热性惊厥的风险会增加。在出生后的前六个月,与发热相关的癫痫发作很少见,
常见于生命的第二年。过了这个年龄,频率下降,五岁以后就很少了。
当儿童在过去有过与发热相关的癫痫发作,没有神经恶化的证据时,应按照建议进行免疫接种。接种疫苗前应提供预防和控制发烧的建议。
当儿童出现与发热无关的癫痫发作,并且没有神经恶化的迹象时,应按照建议进行免疫接种。当接种百白破疫苗时,有癫痫发作家族史或个人史的儿童没有明显的不良事件,他们的发育进程是正常的(Ramsay et al., 1994)。
免疫接种后的神经异常
如果儿童在免疫接种后7天内出现脑病或脑炎,应遵循图24.5流程图中的建议。这些情况不太可能是由疫苗引起的,应该由专家进行调查。如果确定了病因或儿童在七天内康复,应按照建议进行免疫接种。对于未发现潜在病因且在7天内未完全康复的儿童,应推迟免疫接种,直至病情稳定。
如果在免疫接种后72小时内出现与发烧相关的癫痫发作,如果病因得到确定或儿童在24小时内康复,则应按照建议继续免疫接种。但是,如果没有发现潜在的原因,并且儿童没有在24小时内完全康复,则应推迟进一步的免疫接种,直到病情稳定。
推迟免疫接种
需要推迟免疫接种的情况很少(见上文)。延期使孩子得不到保护;应尽量缩短延期时间,以便尽快开始免疫接种。如果专家建议推迟,应明确告知全科医生,一旦儿童适合接种,必须立即告知全科医生。
不良反应
注射部位的疼痛、肿胀或发红是常见的,并且可能在后续剂量后更频繁地发生。可能会形成一个无痛的小结节
在注射部位;这通常会消失,没有任何后果。无细胞百日咳疫苗的局部反应发生率低于全细胞百日咳疫苗,与DT疫苗相似(Miller, 1999; Tozzi and Olin, 1997)。
接种DTaP和DT疫苗后,发烧、抽搐、高声尖叫以及苍白、发绀和无力(HHE)的发生频率相同(Tozzi and Olin, 1997)。
确诊的过敏反应极少发生。来自英国、加拿大和美国的数据表明,每百万剂量的过敏反应事件发生率为0.65至3次(Bohlke et al., 2003;加拿大医学协会,2002年)。其他过敏情况可能更常见,但不是进一步免疫的禁忌症。
任何人都可以使用黄卡报告方案(https://Yellow Card . mhra . gov . uk/)向医疗和保健产品监管机构(MHRA)报告可疑的不良反应。所有发生在儿童身上的疑似疫苗不良反应,或任何年龄的接种了标有黑三角(▼)的疫苗的个体身上的疑似疫苗不良反应,都应使用黄卡计划报告给MHRA。成人对疫苗的严重疑似不良反应应通过黄卡计划进行报告。
历史上与百日咳疫苗相关的疾病
过去,公众和专业人士担心全细胞百日咳疫苗会导致幼儿神经系统问题的发作;自2004年以来,全细胞百日咳疫苗就没有在英国使用过。在1976年至1979年间,共有1182名患有严重神经系统疾病的儿童被报告给国家儿童脑病研究(NCES)。这些儿童中只有39名最近接种了全细胞百日咳疫苗。该研究得出结论,全细胞百日咳疫苗可能很少与先前明显正常的儿童的严重急性神经系统疾病的发展相关;这些孩子中的大多数没有遭受长期伤害。全细胞百日咳免疫接种后严重脑病的发生有时与长期残余神经损伤相关,但证据不足以表明全细胞百白破是否增加慢性神经功能障碍的总体风险。
美国医学研究所于2001年发表了一篇关于百日咳疫苗后不良事件研究的主要综述(Howson et al.,2001)。结论是,证据并未表明百日咳疫苗与婴儿痉挛、高心律失常、雷氏综合症和婴儿猝死综合征(SIDS)之间存在因果关系。
对少数与接种含百日咳疫苗暂时相关的婴儿脑病病例的回顾性研究发现,大多数婴儿患有Dravet或改良Dravet综合征,于1978年首次被确认为“婴儿严重肌阵挛性癫痫”。遗传分析证实,大多数人具有神经元钠通道基因SCN1A的突变,这是该综合征的主要公认原因。因此,在研究的许多病例中,脑病是遗传性的(Berkovic et al., 2006; McIntosh et al., 2010)。
婴儿猝死症(SIDS)最常见于出生后第一年,因此可能与接种含百日咳疫苗同时发生。研究表明这种联系不是因果关系(Fleming et al., 2001)。
有人认为百日咳疫苗与哮喘和过敏的发展有关(Odent et al., 1994)。百日咳疫苗的双盲研究发现,在DTP免疫的儿童和对照组之间,喘息、瘙痒性皮疹或打喷嚏没有显著差异(Nilsson et al., 2003; DeStefano et al., 2002)和一项出生队列研究表明,婴儿时期接种全细胞百日咳疫苗与后来儿童期发生哮喘或过敏之间没有关联(Maitra,2004)。哮喘或过敏不是完成百日咳免疫接种的禁忌症。
疫情管理和病例接触
在存在未免疫或部分免疫的脆弱密切接触者的情况下,应向所有密切接触者提供抗生素预防,无论其免疫状况如何(百日咳公共卫生管理指南,2012年10月)。
https://www.gov.uk/government/publications/pertussis-guidelines-forpublic-health-management
应报告病例并与当地健康保护团队讨论。
对于那些已经接受过抗生素预防的人,应该考虑进行免疫接种。百日咳公共卫生管理指南,2012年10月提供了进一步的详细信息。
《百日咳:医疗机构公共卫生管理指南》( 2012年10月)中提供了关于医疗机构百日咳事件管理和关键公共卫生行动的具体指南。
https://www.gov.uk/government/publications/pertussis-guidelines-forpublic-health-management
供应
下列含百日咳抗原的部分或全部疫苗将随时可用:
- Pediacel®、白喉/破伤风/五组分无细胞百日咳/灭活脊髓灰质炎疫苗/b型流感嗜血杆菌(DTaP/IPV/Hib)-由赛诺菲巴斯德MSD公司生产。
- Repevax®,白喉/破伤风/五组分无细胞百日咳/灭活脊髓灰质炎疫苗(dTaP/IPV)-由赛诺菲巴斯德MSD公司生产。
- Infanrix® -IPV,白喉/破伤风/三联百日咳/灭活脊髓灰质炎疫苗(DTaP/IPV)-由葛兰素史克公司生产。
- Boostrix® -IPV白喉/破伤风/三联百日咳/灭活脊髓灰质炎疫苗(dTaP/IPV)-由葛兰素史克公司生产。
- Infanrix® -IPV+Hib、白喉/破伤风/三组分无细胞百日咳/灭活脊髓灰质炎疫苗/b型流感嗜血杆菌(DTaP/IPV/Hib)
–由葛兰素史克公司制造。
这些疫苗由英国Movianto有限公司(电话:01234 248631)分发,作为国家儿童和产前免疫计划的一部分。
在苏格兰,应该从当地的儿童疫苗储备中心获得供应。详情可从苏格兰国民保健服务系统的采购、调试和设施处获得(电话:0131 275 6725)。
在北爱尔兰,应该从当地的儿童疫苗储备中心获得供应。详情可向区域药品采购处索取(电话:028 9442 4346)。
参考
American Academy of Pediatrics (2003) Active immunization. In: Pickering LK (ed.)
Red Book: 2003 Report of the Committee on Infectious Diseases 26th edition. Elk Grove
Village, IL: American Academy of Pediatrics, p 33.
Amirthalingam G, Andrews N, Campbell H et al. (2014) Effectiveness of maternal
pertussis vaccination in England: an observational study. Lancet 384(9953): 1521-28.
Amirthalingam G, Gupta S and Campbell H (2013) Pertussis immunisation and control
in England and Wales, 1957 to 2012: a historical review. Euro Surveill 18(38): pii: 20587.
Andrews N, Stowe J, Wise L et al. (2010) Post-licensure comparison of the safety profile ofdiphtheria/tetanus/whole cell pertussis/haemophilus influenza type b vaccine and a 5-in-1
diphtheria/tetanus/acellular pertussis/haemophilus influenza type b/polio vaccine in the
United Kingdom. Vaccine 28(44): 7215-20.
Berkovic SF, Harkin L, McMahon JM et al. (2006) De-novo mutations of the sodium
channel gene SCN1A in alleged vaccine encephalopathy: a retrospective study. Lancet
Neurol 5(6): 488-92.
BHIVA (2008) British HIV Association guidelines for immunization of HIV-infected
adults 2008. HIV Med 9(10): 795-848. http://www.bhiva.org/documents/Guidelines/
Immunisation/Immunization2008.pdf. Accessed March 2015.
Bohlke K, Davis RL, Marcy SM et al. (2003) Risk of anaphylaxis after vaccination of
children and adolescents. Pediatrics 112(4): 815–20.
Campbell H, Amirthalingam G, Andrews N et al. (2012) Accelerating control of pertussis
in England and Wales. Emerg Infect Dis 18(1): 38-47.
Campbell H, Amirthalingam G, Fry NK et al. (2014) Oral fluid testing for pertussis,
England and Wales, June 2007-August 2009. Emerg Infect Dis 20(6): 968-75.
Canadian Medical Association (1998) Pertussis vaccine. In: Canadian Immunisation
Guide, 5th edition. Canadian Medical Association, p 133.
Canadian Medical Association (2002) General considerations. In: Canadian Immunisation
Guide, 6th edition. Canadian Medical Association, p 14.
Cherry JD (2012) Epidemic pertussis in 2012 – the resurgence of a vaccine-preventable
disease. N Engl J Med 367(9): 785-7.
Crowcroft NS, Andrews N, Rooney C et al. (2002) Deaths from pertussis are underestimated
in England. Arch Dis Child 86(5): 336–8.
Crowcroft NS, Booy R, Harrison T et al. (2003) Severe and unrecognised: pertussis in UK
infants. Arch Dis Child 88(9): 802–6.
Dabrera G, Amirthalingam G, Andrews N et al. (2014) Case-Control Study to Estimate the
Effectiveness of Maternal Pertussis Vaccination in Protecting Newborn Infants in England
and Wales, 2012-2013. Clin Infect Dis doi:10.1093/cid/ciu821. Available at:
http://cid.oxfordjournals.org/content/early/2014/11/17/cid.ciu821.long. Accessed
March 2015.
Department of Health (2013) Health Technical Memorandum 07-01: Safe management
of healthcare waste. https://www.gov.uk/government/uploads/system/uploads/
attachment_data/file/167976/HTM_07-01_Final.pdf. Accessed March 2015.
DeStefano F, Gu D, Kramarz P et al. (2002) Childhood vaccinations and risk of asthma.
Pediatr Infect Dis J 21(6): 498–504.
Diggle L and Deeks J (2000) Effect of needle length on incidence of local reactions
to routine immunisation in infants aged 4 months: randomised controlled trial. BMJ
321(7266): 931–3.
Donegan K, King B and Bryan P (2014) Safety of pertussis vaccination in pregnant women
in UK: observational study. BMJ 349:g4219. Available at http://www.bmj.com/content/
bmj/349/bmj.g4219.full.pdf. Accessed March 2015.
Eberhardt C, Blanchard-Rohner G, Lemaitre B et al. (2016) Maternal Immunization earlier
in pregnancy maximises maternal antibody transfer and expected infant seropositivity
against pertussis. Clin Infect Dis 62(7): 829-836.
Edwards KM and Decker MD (2013) Pertussis vaccines. In: Plotkin SA, Orenstein WA
and Offit PA (eds). Vaccines, 6th edition. Philadelphia: Saunders, Elsevier, p 447.
Fleming PJ, Blair PS, Platt MW et al. (2001) The UK accelerated immunisation programme
and sudden unexpected death in infancy: case-control study. BMJ 322(7290): 1–5.
Gold M, Goodwin H, Botham S et al. (2000) Re-vaccination of 421 children with a past
history of an adverse vaccine reaction in a special immunisation service. Arch Dis Child
83: 128–31.
Howson CP, Howe CJ and Fineberg HV (eds) (2001) Adverse effects of pertussis and
rubella vaccines. A report of the committee to review the adverse consequences of
pertussis and rubella vaccines. Institute of Medicine Report. Washington, DC: National
Academy Press.
Joint Committee on Vaccination and Immunisation: Minute of the meeting held on
3 February 2016. https://www.gov.uk/government/groups/joint-committee-onvaccination-and-immunisation
Klein NP, Massolo ML, Greene J et al. (2008) Risk factors for developing apnea after
immunization in the neonatal intensive care unit. Pediatrics 121(3): 463-9.
Kroger AT, Atkinson WL and Pickering LK (2013) General immunization practices.
In: Plotkin SA, Orenstein WA and Offit PA (eds). Vaccines, 6th edition. Philadelphia:
Saunders Elsevier, p 88.
Le Saux N, Barrowman NJ, Moore DL et al. for members of the Canadian Paediatric
Society/Health Canada Immunization Monitoring Program–Active (IMPACT)
(2003) Decrease in hospital admissions for febrile seizures and reports of hypotonichyporesponsive episodes presenting to hospital emergency departments since switching
to acellular pertussis vaccine in Canada: a report from IMPACT. Pediatrics 112(5): e348.
Maitra A, Sherriff A, Griffiths M, Henderson J; Avon Longitudinal Study of Parents and
Children Study Team (2004) Pertussis vaccination in infancy and asthma or allergy in later childhood: birth cohort study. BMJ 328(7445): 925-6.
Mark A, Carlsson RM and Granstrom M (1999) Subcutaneous versus intramuscular
injection for booster DT vaccination of adolescents. Vaccine 17(15-16): 2067–72.
McIntosh AM, McMahon J, Dibbens LM et al. (2010) Effects of vaccination on onset and
outcome of Dravet syndrome: a retrospective study. Lancet Neurol 9(6): 592-8.
Miller E (1999) Overview of recent clinical trials of acellular pertussis vaccines.
Biologicals 27(2): 79–86.
Miller CL and Fletcher WB (1976) Severity of notified whooping cough. BMJ 1(6002):
117–19.
Nilsson L, Kjellman NI and Bjorksten B (2003) Allergic disease at the age of 7 years after
pertussis vaccination in infancy: results from the follow-up of a randomised controlled
trial of 3 vaccines. Arch Pediatr Adolesc Med 157(12): 1184–9.
Odent MR, Culpin EE and Kimmel T (1994) Pertussis vaccination and asthma: is there a
link? JAMA 272(8): 592–3.
Ohlsson A and Lacy JB (2004) Intravenous immunoglobulin for preventing infection in
preterm and/or low-birth-weight infants. Cochrane Database Syst Rev (1): CD000361.
Pfister RE, Aeschbach V, Niksic-Stuber V et al. (2004) Safety of DTaP-based combined
immunization in very-low-birth-weight premature infants: frequent but mostly benign
cardiorespiratory events. J Pediatr 145(1): 58-66.
Pourcyrous M, Korones SB, Arheart KL et al. (2007) Primary immunization of premature
infants with gestational age <35 weeks: cardiorespiratory complications and C-reactive
protein responses associated with administration of single and multiple separate vaccines
simultaneously. J Pediatr 151(2): 167-72.
Public Health England (2014). Laboratory confirmed pertussis in England: data to endOctober 2014. Health Protection Report 8(47). https://www.gov.uk/government/
uploads/system/uploads/attachment_data/file/388854/hpr4714_prtsss.pdf.
Accessed March 2015.
Ramsay M, Begg N, Holland B et al. (1994) Pertussis immunisation in children with
a family or personal history of convulsions: a review of children referred for specialist
advice. Health Trends 26(1): 23–4.
Ramsay M, Joce R and Whalley J (1997) Adverse events after school leavers received
combined tetanus and low-dose diphtheria vaccine. Commun Dis Rep CDR Rev 7(5):
R65–7.
Schulzke S, Heininger U, Lucking-Famira M et al. (2005) Apnoea and bradycardia in preterm infants following immunisation with pentavalent or hexavalent vaccines. Eur J
Pediatr 164(7): 432-5.
Summary of Product Characteristics, Infanrix®-IPV+Hib. https://www.medicines.org.
uk/emc/medicine/28678. Accessed March 2015.
Tozzi AE and Olin P (1997) Common side effects in the Italian and Stockholm I trials. Dev
Biol Stand 89: 105–8.
van Hoek AJ, Andrews N, Campbell H et al. (2013a) The social life of infants in the context
of infectious disease transmission; social contacts and mixing patterns of the very young.
PLoS One 8(10): e76180.
van Hoek AJ, Campbell H, Amirthalingam G et al. (2013b) The number of deaths among
infants under one year of age in England with pertussis: results of a capture/recapture
analysis for the period 2001 to 2011. Euro Surveill 18(9): pii: 20414.
Vermeer-de Bondt PE, Labadie J and Rümke HC (1998) Rate of recurrent collapse after
vaccination with whole cell pertussis vaccine: follow up study. BMJ 316(7135): 902-3.
World Health Organization (2010) Pertussis vaccines: WHO position paper. Wkly
Epidemiol Rec 85(40): 385-400.
Zuckerman JN (2000) The importance of injecting vaccines into muscle. Different patients
need different needle sizes. BMJ 321(7271): 1237–8.
Hits: 58

