Contents
- 1 摘要
- 2 主要
- 3 研究人群
- 4 前 Omicron 时代的免疫保护
- 5 Omicron时代的免疫保护
- 6 进一步的验证分析
- 7 讨论
- 8 方法
- 9 数据可用性
- 10 代码可用性
- 11 引用
- 12 致谢
- 13 作者信息
- 14 道德宣言
- 15 同行审查
- 16 其他信息:
- 17 扩展数据图表和表格
- 17.1 扩展数据 图 1 前 omicron 分析中的研究种群选择过程。
- 17.2 扩展数据 图 2 研究 omicron 分析中的人群选择过程。
- 17.3 扩展数据 图 3 卡塔尔的 SARS-CoV-2 感染发生率。
- 17.4 扩展数据 图 4 既往感染通过疫苗接种状态预防再感染的有效性。
- 17.5 扩展数据 图 5 由于先前感染状态的错误分类而导致的偏倚影响。
- 17.6 扩展数据 图 6 共存条件状态错误分类对前 omicron 时代结果的影响。
- 17.7 扩展数据 图 7 共存条件状态错误分类对 omicron 时代结果的影响。
- 17.8 扩展数据 图 8 使用队列研究设计验证前 omicron 时代的结果。
- 17.9 扩展数据 图 9 使用队列研究设计验证 omicron 时代的结果。
- 18 补充信息
- 19 权利和权限
Differential protection against SARS-CoV-2 reinfection pre- and post-Omicron
- 出版日期:
自然界 volume639,pages1024–1031 (2025)
摘要
严重急性呼吸系统综合症冠状病毒 2 (SARS-CoV-2) 在短时间内迅速进化,导致出现传播性更强的变体,例如 Alpha 和 Delta1,2,3.Omicron 变体的到来标志着一个重大转变,与早期变体相比,它在刺突基因中引入了许多额外的突变1,2.这些进化变化引起了人们对它们对免疫逃避、疾病严重程度以及疫苗和治疗有效性的潜在影响的担忧1,3.在这项流行病学研究中,我们确定了 Omicron 与前 Omicron 时代自然感染对再感染的保护作用的两种不同模式。在 Omicron 之前,自然感染为防止再次感染提供了强大而持久的保护,并且随着时间的推移减弱最小。然而,在 Omicron 时代,仅对最近感染的人提供强大的保护作用,随着时间的推移迅速下降,并在一年内减弱。这些结果表明,SARS-CoV-2 免疫保护是由宿主免疫和病毒进化之间的动态相互作用形成的,导致 Omicron 第一波疫情前后的再感染模式截然不同。这种模式的转变表明进化压力发生了变化,内在的传播性推动了 Omicron 之前的适应,而免疫逃逸在 Omicron 之后成为主导,这凸显了定期更新疫苗以维持免疫力的必要性。
主要
与缓慢进化的最初概念相反1,严重急性呼吸系统综合症冠状病毒 2 (SARS-CoV-2) 已显示出短时间内的快速进化变化1,2,3,与冠状病毒和 RNA 病毒的一般情况一致1。在前 Omicron 时代,出现了 SARS-CoV-2 的各种不同谱系,产生了 Alpha、Beta 和 Delta 等不同的变体1,每个都有其特定的表型特征1,4,5,6。
然而,2021 年底 Omicron 变体的出现标志着一个重大转变,因为与其前身相比,它的刺突基因又隐藏了数十个突变1,2.从那时起,Omicron 谱系不断发展,导致新变种的出现1,2。这些快速的进化变化引发了人们对它们对免疫逃避、传播性、疾病严重程度、诊断准确性以及现有疫苗和治疗有效性的潜在影响的担忧1,3。
SARS-CoV-2 感染已被证明在各种情况下都能提供防止再感染的保护作用,例如在不同毒株占主导地位期间7、8、9和针对特定变体10、11、12、13 。研究还调查了 Omicron 前感染对 Omicron 前和 Omicron 再感染所赋予的免疫保护的减弱7、8、9、14。然而,由于大流行的最近性,对这种保护的持久性的调查受到限制,现有研究集中在相对较短的时间内。值得注意的是,Omicron 感染在长期预防 Omicron 本身再次感染方面的持久性仍然未知。
在这项研究中,我们的目标是检查病毒进化的后果,特别是从前 Omicron 时代到 Omicron 时代的过渡,对自然免疫提供的保护水平和持久性的影响。自然免疫力是指从先前感染中获得的保护,防止再次感染,以及再次感染时对 2019 年严重、危重或致命的冠状病毒病 (COVID-19)。我们专门研究了 Omicron 感染在预防 Omicron 病毒再次感染方面的有效性水平和持久性,将其与 Omicron 前感染在预防 Omicron 前病毒再次感染方面的有效性进行了对比。
使用检测阴性病例对照研究设计,在卡塔尔人口中估计自然感染对再感染的有效性,包括总体和自上次感染以来的时间11、12、15、16 。病例(SARS-CoV-2 阳性检测)和对照(SARS-CoV-2 阴性检测)按性别、10 岁年龄组、国籍、共存病症的数量、疫苗剂量、SARS-CoV-2 检测的日历周、检测方法(聚合酶链反应 (PCR) 或快速抗原)和检测原因进行一比二匹配,以平衡观察到的可能影响暴露群体感染风险的混杂因素17。
而分子水平上关于病毒进化和免疫力的证据表明,新的 SARS-CoV-2 变体不断出现,这些变体对康复个体的血浆和接种疫苗个体的血清具有中和作用1、2、18、19、20,这些发现对免疫保护的人群水平现象的影响仍不确定。本研究提供了直接的人群水平证据,对比了前 Omicron 时代和 Omicron 时代病毒进化对免疫保护的功能影响。
前 Omicron 时代的免疫保护
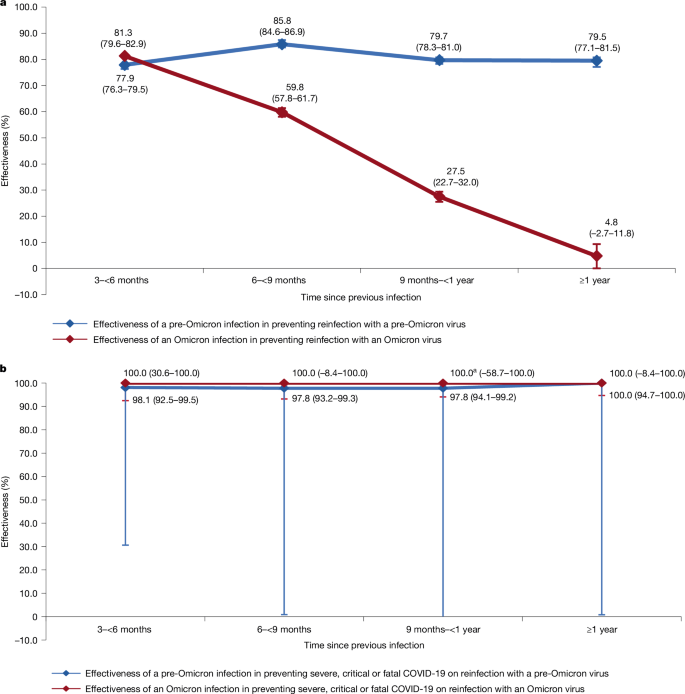
无论症状如何,Omicron前感染预防Omicron前病毒再次感染的总体有效性估计为 81.1%(95% 置信区间 (CI),80.4-81.8%)(表 1a 和图 1)。1a)。先前感染与研究 SARS-CoV-2 检测之间的中位持续时间为 252 天(四分位距 (IQR),175-313 天)。这种强大的保护作用在上次感染后随着时间的推移而减弱有限。上次感染后第一年的有效性为 81.3% (95% CI, 80.6-82.1%),此后为 79.5% (95% CI, 77.1-81.5%)。
表 1 既往感染对再感染的有效性
| 有效性 | 病例a | 对照a | 有效性b (%) (95% 置信区间)c | 病例d | 对照d | 有效性b (%) (95% 置信区间)c | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 既往感染 (n) | 既往无感染 (n) | 既往感染 (n) | 既往无感染 (n) | 既往感染 (n) | 既往无感染 (n) | 既往感染 (n) | 既往无感染 (n) | |||
| Omicron前期感染预防的有效性 | ||||||||||
| (a) 再次感染 Omicron 前病毒 | (b) 再次感染 Omicron 前病毒的严重、危重或致命 COVID-19 | |||||||||
| 任何既往感染 | 2,973 | 381,258 | 26,880 | 657,377 | 81.1(80.4 至 81.8) | 9 | 9,824 | 1,505 | 36,193 | 98.0(96.1 至 99.0) |
| 按自上次感染以来的时间 | ||||||||||
| 子组分析 1 | ||||||||||
| 3-<6 个月 | 870 | 378,591 | 7,018 | 656,824 | 77.9(76.3 至 79.5) | 2 | 9,762 | 355 | 36,191 | 98.1(92.5 至 99.5) |
| 6–<9 个月 | 686 | 378,980 | 8,330 | 656,893 | 85.8(84.6 至 86.9) | 3 | 9,771 | 463 | 36,190 | 97.8(93.2 至 99.3) |
| 9-<1 岁 | 1,007 | 379,405 | 8,124 | 656,972 | 79.7(78.3 至 81.0) | 4 | 9,776 | 615 | 36,190 | 97.8(94.1 至 99.2) |
| ≥1 年 | 389 | 378,150 | 3,385 | 656,760 | 79.5(77.1 至 81.5) | 0 | 9,745 | 72 | 36,188 | 100.0(94.7 到 100.0)e |
| 亚组分析 2 | ||||||||||
| <1 年 | 2,580 | 381,082 | 23,489 | 657,325 | 81.3(80.6 至 82.1) | 9 | 9,822 | 1,433 | 36,193 | 97.9(95.9 至 98.9) |
| ≥1 年 | 389 | 378,150 | 3,385 | 656,760 | 79.5(77.1 至 81.5) | 0 | 9,745 | 72 | 36,188 | 100.0(94.7 到 100.0)e |
| Omicron 感染预防的有效性 | ||||||||||
| (c) 再次感染 Omicron 病毒 | (d) 再次感染 Omicron 病毒后出现严重、危重或致命的 COVID-19 | |||||||||
| 任何既往感染 | 7,476 | 262,515 | 22,170 | 410,785 | 53.6(52.1 至 55.0) | 0 | 230 | 20 | 630 | 100.0(79.7 至 100.0)e |
| 按自上次感染以来的时间 | ||||||||||
| 子组分析 1 | ||||||||||
| 3-<6 个月 | 647 | 259,038 | 4,924 | 408,074 | 81.3(79.6 至 82.9) | 0 | 224 | 7 | 630 | 100.0(30.6 到 100.0)e |
| 6–<9 个月 | 2,611 | 259,888 | 9,689 | 408,881 | 59.8(57.8 至 61.7) | 0 | 222 | 5 | 630 | 100.0(−8.4 至 100.0)e |
| 9-<1 岁 | 1,916 | 258,775 | 4,095 | 408,566 | 27.5(22.7 至 32.0) | 0 | 223 | 3 | 630 | 100.0(−58.7 到 100.0)e |
| ≥1 年 | 1,981 | 258,550 | 2,989 | 408,594 | 4.8(−2.7 至 11.8) | 0 | 225 | 5 | 630 | 100.0(−8.4 至 100.0)e |
| 亚组分析 2 | ||||||||||
| <1 年 | 5,318 | 261,806 | 18,950 | 409,948 | 59.5(58.0 到 60.9) | 0 | 227 | 15 | 630 | 100.0(72.1 到 100.0)e |
| ≥1 年 | 1,981 | 258,550 | 2,989 | 408,594 | 4.8(−2.7 至 11.8) | 0 | 225 | 5 | 630 | 100.0(−8.4 至 100.0)e |
a,b,自上次感染以来的时间,感染在预防再感染方面的有效性,无论症状如何 (a) 和预防再感染时严重、危重或致命的 COVID-19 (b)。a,在前Omicron时代分析中,分别包括病例和对照的 384,231 和 684,257 个独立样本,在Omicron时代分析中,病例和对照分别包括 269,991 和 432,955 个独立样本。在前 Omicron 时代分析中,B 组分别包括 9,833 例和 37,698 个病例和对照独立样本,在 Omicron 时代分析中,病例和对照分别包括 230 和 650 个独立样本。数据以有效性点估计值和相应的 95% CI 表示。误差线表示 95% 置信区间。测量没有针对多重性进行调整。在这个数字中,95% CI 非常小,这使得它们在 Omicron 之前和 Omicron 分析中对再感染的保护,以及在 Omicron 之前时代防止严重、危重或致命的 COVID-19 再感染。这归因于这些分析中的样本量非常大。然而,由于 Omicron 时代严重形式的 COVID-19 病例数量较少,因此 95% CI 对于在 Omicron 时代防止严重、危重或致命的 COVID-19 再次感染的保护非常广泛。一个由于 CI 太宽,CI 的负下限被截断。
Omicron前期感染在预防Omicron前病毒症状性再感染方面的有效性与观察到的任何再感染的模式相似(表 2a)。对有症状再感染的总体有效性为 86.8% (95% CI,85.7-87.9%),没有证据表明在上次感染后随着时间的推移而减弱。先前感染与研究 SARS-CoV-2 检测之间的中位持续时间为 244 天(IQR,169-303 天)。
表 2 既往感染对有症状再感染的有效性
| 有效性 | 病例a | 对照a | 有效性b (%) (95% 置信区间)c | ||
|---|---|---|---|---|---|
| 既往感染 (n) | 既往无感染 (n) | 既往感染 (n) | 既往无感染 (n) | ||
| (a) Omicron前期感染对有症状的有效性d 再次感染 Omicron 前病毒 | |||||
| 任何既往感染 | 626 | 139,378 | 7,277 | 212,793 | 86.8(85.7 至 87.9) |
| 按自上次感染以来的时间 | |||||
| 子组分析 1 | |||||
| 3-<6 个月 | 177 | 137,936 | 2,027 | 212,561 | 85.2(82.8 至 87.4) |
| 6–<9 个月 | 164 | 138,182 | 2,375 | 212,594 | 89.4(87.5 至 91.0) |
| 9 个月 – <1 岁 | 236 | 138,453 | 2,116 | 212,662 | 84.6(82.4 至 86.6) |
| ≥1 年 | 44 | 137,707 | 753 | 212,536 | 90.0(86.5 至 92.7) |
| 亚组分析 2 | |||||
| <1 年 | 581 | 139,316 | 6,523 | 212,781 | 86.5(85.3 至 87.6) |
| ≥1 年 | 44 | 137,707 | 753 | 212,536 | 90.0(86.5 至 92.7) |
| (b) Omicron感染对有症状的有效性d 再次感染 Omicron 病毒 | |||||
| 任何既往感染 | 3,211 | 49,371 | 7,629 | 62,670 | 45.4(42.5 至 48.2) |
| 按自上次感染以来的时间 | |||||
| 子组分析 1 | |||||
| 3-<6 个月 | 119 | 47,753 | 1,125 | 61,367 | 86.3(83.2 至 88.9) |
| 6–<9 个月 | 606 | 48,046 | 2,236 | 61,610 | 64.0(60.1 至 67.5) |
| 9 个月 – <1 岁 | 834 | 47,835 | 1,781 | 61,696 | 29.8(22.6 至 36.4) |
| ≥1 年 | 1,481 | 47,952 | 2,222 | 61,971 | 4.8(-3.8 至 12.7) |
| 亚组分析 2 | |||||
| <1 年 | 1,609 | 48,837 | 5,244 | 62,054 | 58.9(56.1 至 61.5) |
| ≥1 年 | 1,481 | 47,952 | 2,222 | 61,971 | 4.8(-3.8 至 12.7) |
未接种疫苗和接种疫苗的个体的亚组分析得出的结果与主要分析的结果相似(表 3a 和扩展数据图 3)。4a)。使用 40 天窗口的敏感性分析21定义再感染而不是 90 天窗口也产生了与主要分析一致的结果(扩展数据表 2a)。
表 3 按疫苗接种状态划分的既往感染对再感染的有效性
| 有效性 | 病例a | 对照a | 有效性b(%) (95% 置信区间)c | ||
|---|---|---|---|---|---|
| 既往感染 (n) | 既往无感染 (n) | 既往感染 (n) | 既往无感染 (n) | ||
| (a) Omicron前感染对Omicron前病毒再次感染的有效性 | |||||
| 仅包括未接种疫苗的个体 | |||||
| 任何既往感染 | 2,247 | 351,238 | 20,768 | 607,068 | 81.5(80.6 至 82.3) |
| 按自上次感染以来的时间 | |||||
| 子组分析 1 | |||||
| 3-<6 个月 | 665 | 349,165 | 5,938 | 606,661 | 79.9(78.2 至 81.5) |
| 6–<9 个月 | 501 | 349,444 | 6,679 | 606,712 | 87.1(85.8 至 88.2) |
| 9 个月 – <1 岁 | 846 | 349,835 | 6,399 | 606,804 | 78.4(76.8 至 80.0) |
| ≥1 年 | 219 | 348,655 | 1,736 | 606,573 | 76.8(73.3 至 79.9) |
| 亚组分析 2 | |||||
| <1 年 | 2,025 | 351,163 | 19,029 | 607,049 | 81.9(81.0 至 82.7) |
| ≥1 年 | 219 | 348,655 | 1,736 | 606,573 | 76.8(73.3 至 79.9) |
| 仅包括接种疫苗的个体 | |||||
| 任何既往感染 | 726 | 30,020 | 6,112 | 50,309 | 79.9(78.2 至 81.4) |
| 按自上次感染以来的时间 | |||||
| 子组分析 1 | |||||
| 3-<6 个月 | 205 | 29,426 | 1,080 | 50,163 | 67.2(61.8 至 71.8) |
| 6–<9 个月 | 185 | 29,536 | 1,651 | 50,181 | 80.6(77.4 至 83.4) |
| 9 个月 – <1 岁 | 161 | 29,570 | 1,725 | 50,168 | 84.6(81.8 至 86.9) |
| ≥1 年 | 170 | 29,495 | 1,649 | 50,187 | 82.2(79.0 至 84.8) |
| 亚组分析 2 | |||||
| <1 年 | 555 | 29,919 | 4,460 | 50,276 | 79.0(77.0 至 80.8) |
| ≥1 年 | 170 | 29,495 | 1,649 | 50,187 | 82.2(79.0 至 84.8) |
| (b) Omicron感染对Omicron病毒再次感染的有效性 | |||||
| 仅包括未接种疫苗的个体 | |||||
| 任何既往感染 | 1,686 | 92,144 | 4,899 | 152,798 | 47.1(43.7 至 50.4) |
| 按自上次感染以来的时间 | |||||
| 子组分析 1 | |||||
| 3-<6 个月 | 266 | 91,534 | 1,290 | 152,302 | 68.0(63.1 至 72.2) |
| 6–<9 个月 | 778 | 91,662 | 2,328 | 152,492 | 46.0(40.9 至 50.7) |
| 9 个月 – <1 岁 | 331 | 91,418 | 708 | 152,298 | 25.5(14.0 至 35.5) |
| ≥1 年 | 265 | 91,376 | 513 | 152,277 | 25.9(11.7 至 37.8) |
| 亚组分析 2 | |||||
| <1 年 | 1,404 | 92,030 | 4,371 | 152,704 | 49.4(45.9 至 52.7) |
| ≥1 年 | 265 | 91,376 | 513 | 152,277 | 25.9(11.7 至 37.8) |
| 仅包括接种疫苗的个体 | |||||
| 任何既往感染 | 5,790 | 170,371 | 17,271 | 257,987 | 55.5(53.9 至 57.1) |
| 按自上次感染以来的时间 | |||||
| 子组分析 1 | |||||
| 3-<6 个月 | 381 | 167,504 | 3,634 | 255,772 | 85.8(84.0 至 87.3) |
| 6–<9 个月 | 1,833 | 168,226 | 7,361 | 256,389 | 64.0(61.9 至 66.0) |
| 9 个月 – <1 岁 | 1,585 | 167,357 | 3,387 | 256,268 | 28.0(22.7 至 32.9) |
| ≥1 年 | 1,716 | 167,174 | 2,476 | 256,317 | −1.2(−9.3 至 7.0) |
| 亚组分析 2 | |||||
| <1 年 | 3,914 | 169,776 | 14,579 | 257,244 | 62.5(60.9 至 64.0) |
| ≥1 年 | 1,716 | 167,174 | 2,476 | 256,317 | −1.2(−9.3 至 7.0) |
Omicron前感染在再次感染Omicron前病毒后预防严重、危重或致命 COVID-19 的总体有效性为 98.0%(95% CI,96.1-99.0%),在上次感染后没有观察到随着时间的推移而减弱(表 1b 和图 1)。1b)。
Omicron时代的免疫保护
无论症状如何,Omicron感染预防Omicron病毒再次感染的总体有效性估计为 53.6%(95% CI,52.1-55.0%)(表 1c 和图 1)。1a)。先前感染与研究 SARS-CoV-2 检测之间的中位持续时间为 245 天 (IQR,191-311 天)。
这种有效性在上次感染后随着时间的推移迅速下降,从上次感染后 3 到不到 6 个月内的 81.3%(95% CI,79.6-82.9%)下降到随后 3 个月的 59.8%(95% CI,57.8-61.7%),并在随后的 3 个月内进一步下降到 27.5%(95% CI,22.7-32.0%)(表 1c 和图 D)。最终,它在 1 年后达到了一个可以忽略不计的水平。上次感染后第一年的有效性为 59.5% (95% CI,58.0-60.9%),此后为 4.8% (95% CI,-2.7-11.8%)。
Omicron 感染在预防 Omicron 病毒有症状再感染方面的有效性显示出与任何再感染相似的模式(表 2b)。对有症状再感染的总体有效性为 45.4% (95% CI,42.5-48.2%),在上次感染后随着时间的推移观察到迅速下降。先前感染与研究 SARS-CoV-2 检测之间的中位持续时间为 301 天(IQR,225-457 天)。
未接种疫苗和接种疫苗的个体的亚组分析得出的结果与主要分析的结果相似(表 3b 和扩展数据图 3)。4b)。 使用 40 天窗口的敏感性分析21定义再感染而不是 90 天窗口也产生了与主要分析一致的结果(扩展数据表 2b)。
Omicron感染在再次感染Omicron病毒后预防严重、危重或致命 COVID-19 的总体有效性为 100%(95% CI,79.9-100%),没有再感染病例发展为严重、危重或致命的 COVID-19(表 1d)。没有证据表明这种有效性在上次感染后会随着时间的推移而减弱(图 D)。1b)。
进一步的验证分析
既往感染误分类
感染确定不足导致本研究中使用的检测阴性设计中对先前感染状态的错误分类,这可能会使估计产生偏差15。扩展数据图 5 显示了数学建模模拟的结果,该模拟评估了极端不确定(90% 的 SARS-CoV-2 感染未记录)对前 Omicron 和 Omicron 时代免疫保护作用估计减弱模式的影响。
在 Omicron 之前和 Omicron 时代,存在这种偏倚的估计有效性与真实有效性相当,但略低于真实有效性(扩展数据图 1)。5). 在 Omicron 分析中,这种低估更大。然而,在这两种分析中,这种偏倚都不会影响免疫保护的估计持续时间,这是我们研究的中心重点。
共存条件错误分类
通过分析国家公共医疗保健系统数据库中的电子健康记录情况来确定共存疾病(补充方法第 1 节)。但是,这种方法可能无法涵盖所有情况,因为有些情况可能未被诊断或在私人机构中被诊断出来。
敏感性分析去除了共存条件数量的匹配,以模拟完全不确定的情况,显示结果与各种估计的主要分析几乎相同(扩展数据图6 和 7)。在 Omicron 之前和 Omicron 时代都观察到了这种一致性,包括对任何感染以及未接种疫苗和接种疫苗的个体的感染的总体有效性,以及对再次感染的严重、危重或致命 COVID-19 的有效性,以及在上次感染后随时间推移的有效性。
使用队列研究设计进行验证
本研究使用检测阴性设计进行15。为了验证这些发现,还进行了两项全国性的匹配回顾性队列研究:一项针对前 Omicron 时代,一项针对 Omicron 时代。
在前 Omicron 和 Omicron 时代的各种结局中,检测阴性研究设计和队列研究设计的估计值都是一致的(扩展数据图8 和 9)。这些结果包括对任何感染以及未接种疫苗和接种疫苗的个体的感染的总体有效性,以及对再次感染的严重、危重或致命 COVID-19 的有效性,以及上次感染后随时间推移的有效性。虽然检测阴性设计总体上得出的估计值较低,尤其是在 Omicron 分析中,但两种研究设计在免疫保护持续时间内产生了相似的结果,验证了检测阴性设计的结果。
讨论
结果显示,与 Omicron 之前时代相比,Omicron 时代自然感染对再感染的保护作用有两种不同的模式。在 Omicron 出现之前,自然感染提供了强大的保护措施来防止再次感染,有效性约为 80%,并且在感染后随着时间的推移而减弱的迹象最小。然而,在 Omicron 时代,这种保护作用仅对最近感染的个体很强,感染后随着时间的推移迅速下降,最终在一年内减弱。无论是否将任何感染或仅将有症状的感染视为结果,对于接种疫苗和未接种疫苗的人群,这些模式都是一致的。
在 Omicron 时代与前 Omicron 时代观察到的两种不同模式提供了人群水平的结果,验证了先前的实验分子证据1、2、18、19、20,并且可能是几个相互关联的因素复杂相互作用的结果,此外还有免疫力减弱、免疫逃避和 Omicron 的加速和趋同进化,例如免疫印记、不同的免疫原性、毒株面临的全球人群免疫力以及与大流行不同阶段感染相关的人群特征。
虽然这些因素相互关联且难以理清,但观察到的防止再感染的差异可能源于前 Omicron 和 Omicron 时代作用于 SARS-CoV-2 的不同进化压力。在前 Omicron 时代,由于非药物干预和疫苗接种规模的延迟,很大一部分人仍然免疫幼稚,内在传播性可能是病毒适应的主要驱动因素。Alpha 等更具传染性的变体的出现证明了这一点4、22、23和达美24,25 。相反,在 2022 年初非常大和广泛的 Omicron 浪潮之后(扩展数据图 D)。3)26,大多数人都拥有一定程度的免疫力,无论是通过感染还是接种疫苗。这可能已经通过抗原漂移、重组和收敛进化作为病毒的适应机制,将主导进化压力转移到免疫逃逸2、18、27、28。
这种进化压力的转变可以解释在 Omicron 时代观察到的针对再次感染的自然免疫保护迅速下降,并表明 SARS-CoV-2 在当前大流行阶段加速进化为增强免疫逃避。这些发现在多大程度上描述了能够快速突变的新型呼吸道病毒(例如 RNA 病毒)在从出现过渡到地方性流行时的生态生存策略仍然未知,这些发现与其他流行的呼吸道病毒的相关性也是如此。
免疫印记,免疫系统的记忆回忆行为,其中结果受祖先毒株和变体之间的抗原距离的影响 也可能有助于解释这些发现。这种现象,其中免疫事件的特定序列可以增强或损害未来对变异感染的免疫反应,可能会塑造 Omicron 突破性感染引发的多克隆中和抗体的多样性,从而可能导致观察到的模式27、29、30、31、32、33 。
一个重要的发现是,在 Omicron 之前和 Omicron 时代,对再次感染的严重 COVID-19 提供强大而持久的保护,并且没有观察到这种保护减弱。这种独特的模式表明不同的免疫系统成分参与预防非严重与重度再感染。而体液免疫,由阻止病毒进入的中和抗体介导34,35 是防止非严重再感染的主要驱动力,它面临着病毒进化到免疫逃逸的巨大压力。相反,通过记忆 T 细胞对严重再感染的保护似乎受到细胞免疫的强烈影响36,37,38 ,它似乎在很大程度上是保守的37,38 ,可能表明驱动免疫逃逸的进化力量对细胞免疫的压力有限。
接种疫苗和未接种疫苗的人群在 Omicron 之前和 Omicron 时代之间都显示出相似的相反保护模式(扩展数据图 D)。然而,在这些组之间观察到有效性的微小定量差异。这些差异可能归因于先前感染和研究测试之间时间间隔分布的变化,这是感染浪潮动态变化和疫苗接种规模随时间推移的结果。先前的研究表明,免疫印记效应也可能在解释这些差异方面发挥作用11、12、30 ,但需要进一步调查来阐明这些模式。
我们在大流行这一阶段的调查结果证实了早期的观察结果,表明与原发感染相比,再感染的严重程度持续降低9、14、39,即使两者都涉及 Omicron 变体。结果还证实了 Omicron 前免疫对 Omicron 前病毒的强大保护作用4、7、8、9、10、40、41.此外,它们强调了病毒免疫逃避与免疫保护加速减弱之间的关联。这种加速减弱以前在Omicron前期免疫力的快速下降中观察到,这是由疫苗接种或自然感染引起的,在Omicron变异株出现时。总的来说,这些发现表明,免疫逃避和随后的免疫力迅速减弱阻碍了人群对 SARS-CoV-2 的长期免疫力的发展,可能导致周期性的感染浪潮46,类似于观察到的普通感冒冠状病毒47,48 和流感49,50 。
这项研究有局限性。该研究基于记录在案的 SARS-CoV-2 感染,但许多感染可能尚未被记录在案,尤其是自 2022 年 11 月 1 日开始减少检测以来。然而,这种感染记录不足,是先前感染状态错误分类偏倚的来源,可能没有明显影响我们基于我们早期对检测阴性设计方法的分析的结果15。它不应该影响免疫保护的估计持续时间,正如本研究中进行的额外数学建模分析所证明的那样(扩展数据图 .5)。
由于原发感染时 COVID-19 的死亡率,人群中原发感染队列的消耗可能会使该队列向更健康的个体倾斜51。这种偏差可能会导致高估感染在预防再次感染时严重、危重或致命的 COVID-19 的有效性。尽管如此,鉴于卡塔尔以年轻人为主的 COVID-19 死亡率较低(不到原发感染的 0.1%) ,生存效应不太可能明显改变观察到的先前感染在减轻再感染严重程度方面的高有效性。
在敏感性分析中,使用 40 天的时间窗口来定义再感染,而不是传统的 90 天时间窗口21(扩展数据表 2),对整体保护和持续时间少于 1 年的保护的估计都显示出对较低值的轻微偏倚。这种偏倚源于纳入了在初次感染后 40 至 90 天内进行的 SARS-CoV-2 检测。在此时间范围内的测试捕获了零星的阳性 PCR 结果,这些结果并不意味着真正的再感染,而是反映了初始感染持续超过 40 天或由于残留的无活力病毒片段而 PCR 阳性持续的情况54。然而,这种偏倚来源不应影响本研究中的其他估计,因为这种假性再感染在初次感染后 90 天后发生的情况非常罕见21。
检测阴性设计的一个结果是,有效性估计取决于检测的时间,特别是先前感染与研究中使用的 SARS-CoV-2 检测之间的间隔15。这可能会导致看似矛盾的结果,而这些结果并不一定表示真正的差异。例如,在 Omicron 时代分析中,对任何再感染的有效性 (53.6%) 高于对有症状的再感染的有效性 (45.4%)。这似乎有悖常理,因为通常预计对有症状疾病的保护会更高55。然而,这种明显的差异可以用先前感染和研究测试之间的不同时间来解释。对于任何再感染的分析,先前感染与研究测试之间的中位时间为 245 天,而对于有症状的再感染分析,则更长,为 301 天。在后一项分析中,这种较长的间隔导致免疫保护作用的减弱幅度更大,从而导致观察到的有效性估计差异。
卡塔尔人口相对年轻17,我们的研究结果可能无法推广到老年人占人口很大比例的其他国家。虽然实施了稳健匹配,但数据的可用性阻止了对其他因素(如地理位置或职业)的匹配。然而,卡塔尔本质上是一个城邦,感染率广泛分布在各个社区。国籍、年龄和性别是这个国家社会经济地位的有力代表17,因此这些因素的匹配也可能至少部分地控制了其他因素,例如职业。这种匹配方法之前已经在不同流行病学设计的研究中进行了研究,并使用对照组来测试零效应56、57、58、59 。这些研究支持这种匹配的处方有效地控制了感染暴露的差异56、57、58、59 。
然而,真实世界数据中的偏差可能会出乎意料地出现或来自未知来源,例如寻求测试行为的细微差异、由于政策变化而导致的测试模式变化、测试可及性的变化或从先前感染中康复的个体与未感染或先前感染未记录的个体之间接受检测趋势的差异。尽管如此,调查不同偏倚来源的影响以及使用不同的研究设计(队列研究)对整个研究进行重复的进一步分析证实并验证了这些发现。
这项研究有优势。首先,它是在全国范围内进行的,包括基于国家背景的不同人群,并使用了通过大量 SARS-CoV-2 感染研究建立的广泛且经过验证的数据库。其次,从整个全国人口中选择对照,并使用精确匹配来确保病例和对照的严格配对。第三,研究设计控制了疫苗接种状态,这是检测阴性设计的另一个优势,允许区分先前感染和疫苗接种的影响。还获得了未接种疫苗和接种疫苗人群的有效性估计,这些分析的结果彼此一致,并与整个人群的主要分析一致。第四,使用 90 天和 40 天的不同再感染窗口定义导致分析数据集大不相同。然而,在这些不同的标准中,有效性估计保持一致。最后,通过进一步分析和使用独特流行病学研究设计的完全复制,证实了这些发现。
总之,在 Omicron 之前和 Omicron 时代之间,自然感染对 SARS-CoV-2 再感染的保护作用形成了鲜明的对比。在 Omicron 出现之前,自然感染为防止再次感染提供了强大而持久的保护。然而,在 Omicron 时代,这种保护作用仅在近期感染者中较强,在 1 年内迅速下降和减弱。这些对比鲜明的模式可能表明作用于病毒的不同进化压力。在前 Omicron 时代,内在传播性推动了病毒的适应,而第一波 Omicron 浪潮结束时获得的广泛免疫力将进化压力转向免疫逃逸。这凸显了病毒进化与宿主免疫之间的动态相互作用,需要持续监测病毒及其进化,并定期更新 SARS-CoV-2 疫苗,以恢复免疫力并对抗持续的病毒免疫逃避。
方法
监督
哈马德医疗公司 (Hamad Medical Corporation) 和威尔康奈尔医学院卡塔尔分校 (Weill Cornell Medicine–Qatar) 的机构审查委员会在放弃知情同意的情况下批准了这项回顾性研究。该研究是根据加强流行病学观察性研究报告 (STROBE) 指南(扩展数据表 3)报告的。
研究人群和数据来源
这项研究是在 2021 年 12 月 19 日引入 Omicron 变体之前和之后对卡塔尔人口进行的(参考文献16).第一项分析评估了 2020 年 2 月 5 日(卡塔尔 COVID-19 大流行开始)期间 Omicron 前感染在预防 Omicron 前病毒再次感染方面的有效性17) 和 2021 年 12 月 18 日。第二项分析评估了 2021 年 12 月 19 日至 2024 年 2 月 12 日期间(标志着研究结束)Omicron感染在预防再次感染Omicron病毒方面的有效性。
这些数据包括用于 COVID-19 实验室检测、疫苗接种、住院和死亡的国家联合数据库,这些数据库是从集成的全国性数字健康信息平台(补充方法第 2 节)检索的。这些数据库自大流行开始以来捕获了 SARS-CoV-2 相关数据,没有遗漏任何信息,包括所有 PCR 检测,无论地点或设施如何,以及从 2022 年 1 月 5 日起,所有医学监督的快速抗原检测(补充方法第 3 节)。截至 2022 年 10 月 31 日,卡塔尔的 SARS-CoV-2 检测范围广泛,每周有近 5% 的人口接受检测,主要用于常规目的,例如筛查或满足旅行相关要求56,60 .随后,检测率下降,每周接受检测的人口不到 1%61.大流行期间的大多数感染是通过常规检测而不是症状表现诊断的56,60 .
卡塔尔于 2020 年 12 月启动了 COVID-19 疫苗接种计划,使用信使 RNA 疫苗,并根据共存条件和年龄标准优先考虑个人56,59 .无论公民身份或居留身份如何,COVID-19 疫苗接种都是免费提供的,并在全国范围内进行跟踪56,59 .人口统计信息,包括性别、年龄和国籍,是从国家卫生登记处的记录中提取的。卡塔尔的人口结构多样化,89% 的居民是来自 150 多个国家/地区的外籍人士17.卡塔尔人口和国家数据库的详细描述之前已报道过17、32、51、53、56、60、62 .
研究设计
使用检测阴性病例对照研究设计估计自然感染对再感染的有效性,该设计将 SARS-CoV-2 阳性检测(病例)与 SARS-CoV-2 阴性检测(对照)的既往感染几率进行比较11,12,15,16,63,64 .评估是总体评估和自上次感染以来的时间进行的,间隔为 3 个月。
病例和对照是根据每个分析期间进行的 SARS-CoV-2 检测结果确定的。病例被定义为 SARS-CoV-2 阳性检测,而对照组被定义为 SARS-CoV-2 阴性检测。SARS-CoV-2 再感染通常定义为在上次感染后超过 90 天记录的感染,以避免将长期检测阳性错误归类为时间间隔较短的再感染16、21、65、66 。因此,排除了 90 天内 SARS-CoV-2 检测呈阳性的病例或对照。既往感染定义为 SARS-CoV-2 阳性检测大于或等于研究测试前 90 天。
遵守检测阴性研究设计固有的非差异寻求医疗保健行为假设15,63,64 ,分析中仅包括具有记录的测试原因的测试。在 Omicron 时代的分析中,分析中排除了 Omicron 前感染之前的病例或对照,因为研究问题与 Omicron 免疫而不是 Omicron 前免疫对 Omicron 再感染的有效性有关。之前已经研究了 Omicron 前免疫力对 Omicron 再感染的保护14、16、60 。
在估计预防再感染的有效性时,病例和对照按性别、10 岁年龄组、国籍、共存疾病的数量(范围从零到大于或等于六;补充方法 第 1 部分)、疫苗剂量数(范围从零到大于或等于四剂)、SARS-CoV-2 检测的日历周、检测方法(PCR 或快速抗原)和检测原因。该匹配策略旨在平衡观察到的可能影响暴露组感染风险的混杂因素。匹配因素的选择以早期卡塔尔人口研究结果为指导11、56、57、58、59、71 以及需要遵守检测阴性设计固有的非差异就医行为假设15,63,64 。通过 SARS-CoV-2 检测的日历周、检测方法和检测原因进行匹配来满足这一要求。在估计预防严重72危急72或致命的73COVID-19 再感染时,应用 1 比 5 匹配比率以提高统计精度。
重度的分类72危急72和致命的73COVID-19 遵循世界卫生组织指南(补充方法第 4 节)。评估由训练有素的医务人员进行,独立于研究调查人员,并使用单独的图表审查。作为国家协议的一部分,每个 SARS-CoV-2 检测呈阳性并同时入院的 COVID-19 个体都要每 3 天接受一次感染严重程度评估,直到出院或死亡,无论住院时间长短26。在 SARS-CoV-2 检测到本研究结束之间进展为严重、危重或致命 COVID-19 的个体根据其最差结果进行分类,从死亡开始,然后是危重疾病,然后是重症。
感染的变异状态是根据感染诊断时的主要变异来确定的。感染分为 Omicron 前或 Omicron。在整个大流行期间,每种变体的优势持续时间是使用卡塔尔的变体基因组监测来确定的74,75,76 (扩展数据图 .3),其中包括病毒基因组测序74以及多重实时定量 PCR 与逆转录 (RT-qPCR) 变体筛选75每周收集的随机阳性临床样本(补充方法第 3 节)。一旦第一波大规模的 Omicron 浪潮开始,几乎所有感染都是由 Omicron 引起的,因为它取代了所有 Omicron 之前的变体。
统计分析
检查了所有 SARS-CoV-2 检测记录以选择病例和对照,但仅分析了匹配的样本。使用频率分布和集中趋势测量来描述病例和对照,并使用标准化平均差进行比较。小于或等于 0.1 的标准化平均差表示充分匹配77。
使用条件 logistic 回归得出比值比 (ORs),比较病例与对照组之间既往感染的几率,以及相关的 95% CI。按上次感染后的时间分层的分析考虑了最近记录的感染日期。CI 没有针对多重性进行调整,也没有研究相互作用。所有估计的参考组包括没有既往感染记录的个体。
如果 OR 小于 1,则有效性测量和相关的 95% CI 计算为病例与对照组之间既往感染的 1-OR,如果 OR 大于或等于 1,则计算为 1/OR-1(参考文献:15,32,63,78 ).这种方法确保了消极和积极效果的对称尺度,范围从 -100 到 100%,从而对有效性进行清晰而有意义的解释,无论值是积极的还是消极的。
除了估计既往感染预防再感染的有效性外,无论症状如何,还专门评估了针对症状性再感染的有效性。这是通过将分析限制在因临床怀疑而进行的测试来实现的,这些测试表明存在与呼吸道感染一致的症状。
进行了亚组分析,分别仅考虑未接种疫苗和接种疫苗的个体。通过将 SARS-CoV-2 再感染重新定义为在先前感染后超过 40 天或等于 40 天发生的记录感染,而不是传统的大于或等于 90 天,进行了敏感性分析。最近的一项分析表明,40 天的时间窗口足以定义再感染,从而做出了这一调整21。统计分析在 STATA/SE v.18.0 版 (Stata) 中进行。
进一步的验证分析
既往感染误分类
感染确定不足会导致先前感染状态的错误分类到本研究中使用的检测阴性设计中,这可能会使估计产生偏差15。为了评估不确定对免疫保护作用减弱估计的影响,通过扩展我们之前关于测试阴性设计方法的工作进行了数学建模模拟15。这些模拟评估了仅 10% 的感染确定率的影响,这表明 90% 的 SARS-CoV-2 感染没有记录,因此会被错误分类。该模型结合了感染对再感染的保护作用的逐渐(线性)减弱。对 Omicron 前和 Omicron 衰落模式进行了分析,Omicron 前时代的免疫保护持续时间设置为 3 年14Omicron时代为 1 年。结果是在 Omicron 前和 Omicron 大流行阶段开始的 2 年后报告的。该模型、其方法和以前的分析的详细说明可以在其他地方找到15。
共存条件错误分类
通过分析国家公共医疗保健系统数据库中每个人的电子健康记录记录,确定共存疾病(补充方法第 1 节)。但是,这种方法可能无法涵盖所有情况,因为有些情况可能未被诊断或在无法获得记录的私人机构中被诊断出来。为了评估这种潜在偏倚对感染对再感染的估计有效性的影响,进行了敏感性分析,其中完全消除了与共存条件数量的匹配,模拟了这些情况完全不确定的情况。
使用队列研究设计进行验证
本研究使用阴性设计15为了验证这些发现,还进行了两项额外的全国性匹配回顾性队列研究——一项针对前 Omicron 时代,另一项针对 Omicron 时代。每项研究都比较了两个全国队列中感染和严重形式的 COVID-19 发生率:有记录的原发性 SARS-CoV-2 感染个体(原发感染队列)和未感染个体(未感染队列)。
第一项研究评估了 Omicron 前原发感染在预防 Omicron 前病毒再次感染方面的有效性,第二项研究评估了 Omicron 原发感染在预防 Omicron 病毒再次感染方面的有效性。这两项研究的研究持续时间与使用检测阴性设计的主要分析相同。感染发生率定义为随访开始后的任何 PCR 阳性或快速抗原阳性检测,无论症状表现如何。
队列按性别、10 岁年龄组、国籍、共存病症的数量、随访开始时的疫苗剂量、原发感染队列的 SARS-CoV-2 阳性检测和未感染队列的 SARS-CoV-2 阴性检测的日历周、检测方法(PCR 或快速抗原)和检测原因进行一对一匹配。在这两项研究中,匹配的原发感染队列中的个体可能在原发感染之前在未感染队列中贡献了随访时间,随后在感染后作为原发感染队列的一部分贡献了随访时间。
在原发感染队列中个体的原发感染后 90 天开始对每个匹配的对进行随访。为确保可交换性,每对匹配的两个成员在最早接受额外疫苗剂量的情况下被删失。因此,对个体进行随访,直到发生以下任何事件中的第一个:记录在案的 SARS-CoV-2 感染、原发感染队列或未感染队列中个体的新疫苗剂量(匹配对删失)、死亡或行政随访结束,该随访在研究结束时或初次感染后 15 个月确定, 以先到者为准。
总体调整后的风险比 (aHR),比较队列之间 SARS-CoV-2 感染(或严重形式的 COVID-19)的发生率,以及相应的 95% CI,使用 Cox 回归模型计算,并调整队列中的匹配因子和测试率,使用 Stata v.18.0 stcox 命令。实施此调整是为了确保对标准方差的精确和无偏估计79。
总体 aHR 提供时变风险比的加权平均值80为了探索感染(或严重形式的 COVID-19)风险随时间的差异,还使用单独的 Cox 回归从随访开始以 3 个月的间隔估计 aHR,“失败”仅限于特定的时间间隔。
如果 aHR 小于 1,则从 aHR 得出 aHR 对再感染和严重、危重或致命 COVID-19 的有效性,以及相关的 95% CI,即 1-aHR,如果 aHR 大于或等于 1,则为 1/aHR-1(参考文献。32,78 。这种方法确保了消极和积极效果的对称尺度,范围从 −100 到 100%,从而对有效性进行有意义的解释,无论值是正值还是负值。
使用 Stata/SE v.18.0 (Stata) 进行统计分析。有关此类队列研究设计的更多详细信息,请参阅我们之前的出版物,这些出版物还使用相同的国家数据库来估计感染对再感染的有效性或疫苗接种对感染的有效性4,8,10,14,15,30,32,33,45,59,61,62,71,81,82,83.
报告摘要
有关研究设计的更多信息,请参阅本文链接的 Nature Portfolio Reporting Summary。
数据可用性
本研究中使用的 2019 年国家冠状病毒病 (COVID-19) 数据集是卡塔尔公共卫生部的财产,该数据集通过限制访问协议提供给研究人员,该协议禁止与第三方或公开共享数据集。该数据集包括国家 COVID-19 检测数据库、国家 COVID-19 疫苗接种数据库、国家 COVID-19 严重性数据库和国家死亡率数据库。这些数据在限制访问下可用,以保护患者数据的机密性。可以通过直接向公共卫生部长阁下 (https://www.moph.gov.qa/english/OurServices/eservices/Pages/Governmental-HealthCommunication-Center.aspx) 申请数据访问来获得访问权限。作者可以通过.csv文件获得数据,其中的信息是从 CERNER 数据库系统下载的(作者没有链接/访问代码)。原始数据受到保护,由于数据隐私法而不可用。汇总数据可在论文及其补充信息中找到。
代码可用性
使用 STATA/SE v.18.0 中的标准命令进行标准流行病学分析。这些命令已发布在: https://github.com/IDEGWCMQ/TestNegCode/blob/main/TestNegCode.txt。
引用
Markov, P. V. 等人。SARS-CoV-2 的演变。Nat. Rev. 微生物学。 21, 361–379 (2023 年)。
Roemer, C. et al. Omicron时代的 SARS-CoV-2 进化。自然微生物学。 8, 1952–1959 (2023)。
Subissi, L. 等人。针对新出现的 SARS-CoV-2 变体的早期预警系统。Nat. Med. 28, 1110–1115 (2022 年)。
Abu-Raddad, L. J. 等人。卡塔尔 SARS-CoV-2 B.1.1.7 变体和再感染的介绍和扩展:一项具有全国代表性的队列研究。PLoS 医学。 18, e1003879 (2021 年)。
Abu-Raddad, L. J. 等人。SARS-CoV-2 Beta 变体的严重性、严重程度和致死性。克林。感染。Dis.https://doi.org/10.1093/cid/ciab909 (2021 年)。
Butt, A. A. 等人。卡塔尔 SARS-CoV-2 Delta 变体感染者的疾病严重程度与 Beta 变体。JAMA 实习医生 182, 197–205, (2022)。
Covid 预测团队。过去的 SARS-CoV-2 感染对再次感染的保护:系统评价和荟萃分析。柳叶刀 401, 833–842 (2023)。
Abu-Raddad, LJ et al. SARS-CoV-2 抗体阳性可防止再次感染至少 7 个月,疗效为 95%。EClinMed 的。 35, 100861 (2021)。
Bobrovitz, N. 等人。既往 SARS-CoV-2 感染的保护效果和对 omicron 变体和严重疾病的混合免疫:系统评价和荟萃回归。柳叶刀感染 Dis. 23, 556–567 (2023 年)。
Chemaitelly, H., Bertollini, R., Abu-Raddad, L. J. & 国家COVID流行病学研究小组。自然免疫对 SARS-CoV-2 再次感染 beta 变体的功效。N. Engl. J. Med. 385, 2585–2586 (2021 年)。
Chemaitelly, H. 等人。防止 omicron BA.2.75 亚变体再次感染。N. Engl. J. Med. 388, 665–667 (2023 年)。
Altarawneh, H. N. 等人。先前 SARS-CoV-2 感染对 omicron BA.4 和 BA.5 亚变体的保护作用。N. Engl. J. Med. 387, 1620–1622 (2022)。
Chemaitelly, H. 等人。保护自然感染免受 SARS-CoV-2 JN.1 变体的再次感染。J. 旅行医学。 https://doi.org/10.1093/jtm/taae053 (2024 年)。
Chemaitelly, H. 等人。SARS-CoV-2 自然感染对再感染的免疫保护持续时间。J. 旅行医学。 https://doi.org/10.1093/jtm/taac109 (2022 年)。
Ayoub, H. H. 等人。估计既往感染在预防再感染方面提供的保护:应用检测阴性研究设计。美国流行病学杂志。https://doi.org/10.1093/aje/kwad239 (2023)。
Altarawneh, H. N. 等人。防止先前 SARS-CoV-2 感染引起的 omicron 变体。N. Engl. J. Med. 386, 1288–1290 (2022 年)。
Abu-Raddad, L. J. 等人。描述卡塔尔晚期 SARS-CoV-2 流行病的特征。科学代表 11, 6233 (2021)。
SARS-CoV-2 变体进化出收敛策略来重塑宿主反应。单格 186, 4597–4614 e4526 (2023)。
SARS-CoV-2 变体生物学:免疫逃逸、传播和适应性。Nat. Rev. 微生物学。 21, 162–177 (2023 年)。
SARS-CoV-2 omicron 是一种免疫逃逸变体,细胞进入途径发生改变。自然微生物学。 7, 1161–1179 (2022 年)。
Chemaitelly, H. 等人。解决 SARS-CoV-2 再感染定义中的偏差:低估的影响。前医。 11, 1363045 (2024)。
du Plessis, L. 等人。SARS-CoV-2 流行病在英国的建立和谱系动态。科学 371, 708–712 (2021)。
戴维斯,N. G. 等人。SARS-CoV-2 谱系 B.1.1.7 在英格兰的估计传播性和影响。科学 https://doi.org/10.1126/science.abg3055 (2021)。
Luo, CH 等人。与未接种疫苗和接种疫苗的个体的 alpha 变体相比,感染 SARS-CoV-2 delta 变体与传染性病毒的更高恢复率相关。克林。感染。Dis. https://doi.org/10.1093/cid/ciab986 (2021 年)。
Qassim, SH 等人。SARS-CoV-2 Alpha、Beta 和 Delta 变体、年龄、疫苗接种和既往感染对 SARS-CoV-2 感染传染性的影响。前面。免疫学。 13, 984784 (2022).
Chemaitelly, H. 等人。大流行期间 COVID-19 严重程度和死亡率的转折点:卡塔尔的一项全国队列研究。BMJ 公共卫生 1, e000479 (2023)。
Cao, Y. 等人。印记 SARS-CoV-2 体液免疫诱导趋同的 Omicron RBD 进化。自然 614, 521–529 (2023)。
Ito, J. 等人。SARS-CoV-2 omicron 亚变体的趋同进化导致 BQ.1.1 变体的出现。Nat. Commun. 14, 2671 (2023)。
Reynolds, CJ 等人。B.1.1.529 (omicron) 的免疫增强取决于以前的 SARS-CoV-2 暴露。科学 377, eabq1841 (2022)。
Chemaitelly, H. 等人。基础系列和加强疫苗接种史以及防止 omicron 再感染。科学 Adv. 9, EADH0761 (2023 年)。
Roltgen, K. 等人。人类 SARS-CoV-2 感染和疫苗接种中的免疫印记、变异识别的广度和生发中心反应。单格 185, 1025–1040 e1014 (2022)。
Chemaitelly, H. 等人。通过感染史和临床脆弱性和免疫印记确定的长期 COVID-19 助推器有效性:一项基于人群的回顾性队列研究。柳叶刀感染 Dis. 23, 816–827 (2023 年)。
Chemaitelly, H. 等人。免疫印记和防止 SARS-CoV-2 重复再感染。N. Engl. J. Med. https://doi.org/10.1056/NEJMc2211055 (2022 年)。
Doria-Rose, N. 等人。第二剂 COVID-19 mRNA-1273 疫苗后 6 个月内抗体持续存在。N. Engl. J. Med. 384, 2259–2261 (2021)。
Gilbert, P. B. 等人。达到 COVID-19 里程碑 – 疫苗保护的相关性。N. Engl. J. Med. 387, 2203–2206 (2022)。
Sette, A. & Crotty, S. 对 SARS-CoV-2 和 COVID-19 的适应性免疫。单格 184, 861–880 (2021)。
Wherry, E. J. & Barouch, DH T细胞对COVID-19疫苗的免疫力。科学 377, 821–822 (2022)。
Altmann, D. M. & Boyton, R. J. 武装起来对抗Omicron亚型。细胞宿主微生物。 32, 147–148 (2024)。
Abu-Raddad, L. J., Chemaitelly, H., Bertollini, R. & 国家COVID流行病学研究小组。与原发感染相比,SARS-CoV-2 再感染的严重程度。N. Engl. J. Med. 385, 2487–2489 (2021 年)。
Abu-Raddad, L. J. 等人。在强烈再暴露环境中评估严重急性呼吸系统综合症冠状病毒 2 (SARS-CoV-2) 再感染的风险。克林。感染。Dis. 73, e1830–e1840 (2021)。
Altarawneh, H. N. 等人。既往感染、疫苗接种和混合免疫对有症状的 Alpha、Beta 和 Delta SARS-CoV-2 感染的影响:一项观察性研究。EBioMed 的。 95, 104734 (2023)。
Chemaitelly, H. 等人。卡塔尔 mRNA 疫苗对 SARS-CoV-2 Omicron BA.1 和 BA.2 亚变体的保护持续时间。Nat. Commun. 13, 3082 (2022)。
Higdon, MM等人。针对 omicron 变体引起的 COVID-19 疫苗接种的有效性持续时间。柳叶刀感染 Dis. 22, 1114–1116 (2022 年)。
Andrews, N. et al. COVID-19 疫苗对 Omicron (B.1.1.529) 变体的有效性。N. Engl. J. Med. 386, 1532–1546 (2022 年)。
Chemaitelly, H. et al. 卡塔尔儿童和青少年的 COVID-19 疫苗保护。N. Engl. J. Med. 387, 1865–1876 (2022)。
Qassim, SH 等人。COVID-19 大流行期间卡塔尔自然感染、初级系列疫苗接种和加强疫苗接种的人群免疫力:一项观察性研究。EClinMed 的。 62, 102102 (2023)。
Kissler, S. M., Tedijanto, C., Goldstein, E., Grad, Y. H. & Lipsitch, M. 预测SARS-CoV-2在大流行后时期的传播动态。科学 368, 860–868 (2020)。
Lavine, J. S., Bjornstad, O. N. & Antia, R. 免疫学特征决定了COVID-19向地方病的过渡。科学 371, 741–745 (2021)。
Ferguson, N. M., Galvani, A. P. & Bush, R. M. 流感进化的生态和免疫学决定因素。自然 422, 428–433 (2003)。
Patel, M. M., York, I. A., Monto, A. S., Thompson, M. G. & Fry, A. M. 免疫介导的感染后流感疾病减弱:机遇与挑战。柳叶刀微生物。 2, e715–e725 (2021 年)。
Chemaitelly, H. 等人。SARS-CoV-2 感染者的短期和长期全因死亡率以及卡塔尔的拉动现象:一项全国队列研究。Int. J. 感染 Dis. 136, 81–90 (2023 年)。
Seedat, S. et al. 卡塔尔的 SARS-CoV-2 感染住院率、严重程度、危急性和死亡率。科学代表 11, 18182 (2021)。
AlNuaimi, A. A. 等人。COVID-19 大流行期间卡塔尔的全因死亡率和 COVID-19 死亡率。BMJ 全球。健康 8, e012291 (2023)。
Abu-Raddad, L. J. 等人。两次长期病毒血症 SARS-CoV-2 感染,病毒基因组保守,持续两个月。感染。基因。埃沃尔。 88, 104684 (2021)。
Sukik, L. 等人。在前 omicron 时代,两剂和三剂 COVID-19 mRNA 疫苗对感染、症状和严重程度的有效性:时间依赖性梯度。疫苗 https://doi.org/10.1016/j.vaccine.2024.04.026 (2024)。
Chemaitelly, H. 等人。在卡塔尔,BNT162b2 疫苗对 SARS-CoV-2 感染的保护作用减弱。N. Engl. J. Med. 385, e83 (2021 年)。
Chemaitelly, H. et al. mRNA-1273 COVID-19 疫苗对卡塔尔 B.1.1.7 和 B.1.351 变体以及严重 COVID-19 疾病的有效性。Nat. Med. 27, 1614–1621 (2021)。
Abu-Raddad, L. J., Chemaitelly, H., Bertollini, R. & 国家COVID疫苗接种研究小组。卡塔尔 mRNA-1273 疫苗对 SARS-CoV-2 感染的有效性减弱。N. Engl. J. Med. 386, 1091–1093 (2022 年)。
Abu-Raddad, L. J., Chemaitelly, H., Bertollini, R. & 国家COVID疫苗接种研究小组。卡塔尔 mRNA-1273 和 BNT162b2 疫苗的有效性。N. Engl. J. Med. 386, 799–800 (2022 年)。
Altarawneh, H. N. 等人。既往感染和疫苗接种对有症状的 omicron 感染的影响。N. Engl. J. Med. 387, 21–34 (2022 年)。
Chemaitelly, H. et al. 二价 mRNA-1273.214 疫苗对 SARS-CoV-2 omicron XBB* 感染的有效性。J. 旅行医学。 30, taad106 (2023)。
Abu-Raddad, L. J. 等人。mRNA 疫苗加强剂对卡塔尔 SARS-CoV-2 omicron 感染的影响。N. Engl. J. Med. 386, 1804–1816 (2022)。
杰克逊,M. L. & 纳尔逊,J. C.用于估计流感疫苗有效性的阴性检验设计。疫苗 31, 2165–2168 (2013)。
Verani, J. R. 等人。病例对照疫苗有效性研究:病例和对照的准备、设计和招募。疫苗 35, 3295–3302 (2017)。
Pilz, S., Theiler-Schwetz, V., Trummer, C., Krause, R. & Ioannidis, J. P. A. SARS-CoV-2再感染:自然和混合免疫的疗效和持续时间概述。Environ. Res. 209, 112911 (2022)。
小岛,N.,什雷斯塔,N. K.和克劳斯纳,J. D.关于既往 SARS-CoV-2 感染对重复感染的保护作用的系统评价。评估。健康教授 44, 327–332 (2021)。
Ayoub, H. H. 等人。卡塔尔 SARS-CoV-2 流行病的数学建模及其对国家应对 COVID-19 的影响。J. 格洛布。健康 11, 05005 (2021)。
Coyle, PV et al. 卡塔尔城市人口中的 SARS-CoV-2 血清阳性率:对 112,941 人样本的抗体检测分析。iScience 24, 102646 (2021)。
Jeremijenko, A. 等人。卡塔尔 10 个社区针对严重急性呼吸系统综合症冠状病毒 2 感染的群体免疫。新兴。感染。Dis. 27, 1343–1352 (2021)。
Al-Thani, MH et al. SARS-CoV-2 感染在卡塔尔的大部分人口中处于群体免疫状态。开放论坛。感染。Dis. 8, ofab221 (2021 年)。
Chemaitelly, H. 等人。保护 omicron 亚谱系感染免受另一个 omicron 亚谱系的再次感染。Nat. Commun. 13, 4675 (2022 年)。
世界卫生组织。 COVID-19 临床管理生活指南 https://www.who.int/publications/i/item/WHO-2019-nCoV-clinical-2021-2 (2023)。
世界卫生组织。COVID-19 死因认证和分类(编码)国际指南 https://www.who.int/publications/m/item/international-guidelines-for-certification-and-classification-(coding)-of-covid-19-as-cause-of-death (2023)。
Benslimane, FM 等人。SARS-CoV-2 一周年:卡塔尔 COVID-19 爆发的基因组特征。前面。细胞感染。微生物学。 11, 768883 (2021).
Hasan, MR 等人。通过高通量多重 PCR 进行实时 SARS-CoV-2 基因分型揭示了卡塔尔相关变异株的流行病学。Int. J. 感染 Dis. 112, 52–54 (2021 年)。
Saththasivam, J. et al. 在卡塔尔使用基于废水的流行病学进行 COVID-19 (SARS-CoV-2) 疫情监测。Sci. Total Environ. 774, 145608 (2021)。
Austin, PC 使用标准化差异比较观察性研究中两组之间二变量的流行率。Commun. Stat. Simul.计算。 38, 1228–1234 (2009 年)。
Tseng, H. F. 等人。mRNA-1273 疫苗接种对 SARS-CoV-2 Omicron亚变体 BA.1、BA.2、BA.2.12.1、BA.4 和 BA.5 的有效性。Nat. Commun. 14, 189 (2023 年)。
Sjolander, A. & Greenland, S. 在队列研究中忽视匹配变量 – 何时有效,为什么?Stat. Med. 32, 4696–4708 (2013 年)。
Stensrud, M. J. & Hernan, M. A.为什么要测试比例风险?美国医学会 323, 1401–1402 (2020)。
Abu-Raddad, L. J. 等人。既往 SARS-CoV-2 感染与 mRNA 疫苗接种后突破性感染风险的关联。美国医学会 326, 1930–1939 (2021)。
Chemaitelly, H. 等人。与卡塔尔针对 SARS-CoV-2 感染和严重 COVID-19 的 mRNA 疫苗接种相比,对既往自然感染的保护:一项回顾性队列研究。柳叶刀微生物 3, e944–e955 (2022)。
Chemaitelly, H. et al. 青少年的 BNT162b2 抗原剂量和 SARS-CoV-2 omicron 感染。柳叶刀感染 Dis. 23, 276–277 (2023 年)。
致谢
我们感谢 Hamad Medical Corporation、公共卫生部、初级卫生保健公司、卡塔尔生物样本库、Sidra Medicine 和 Weill Cornell Medicine–Qatar 的许多敬业人员,感谢他们为使这项研究成为可能所做的努力和贡献。我们还感谢威尔康奈尔医学院卡塔尔分校生物医学研究计划和生物统计学、流行病学和生物数学研究核心提供的机构薪酬支持,以及公共卫生部、哈马德医疗公司和 Sidra Medicine 提供的机构薪酬支持。我们还感谢卡塔尔基因组计划和卡塔尔大学生物医学研究中心为病毒基因组测序所需试剂提供的机构支持。该研究的资助者在研究设计、数据收集、数据分析、数据解释或文章撰写方面没有任何作用。此处所做的陈述完全由作者负责。
道德宣言
利益争夺
A.A.B. 已获得 Gilead Sciences 的机构资助,与本文中介绍的工作无关。其他作者声明没有竞争利益。
同行审查
同行评审信息
Nature 感谢 Alexandra Hogan 和其他匿名审稿人对这项工作的同行评审做出的贡献。提供同行评议报告。
其他信息:
出版商注施普林格·自然 (Springer Nature) 对已发布的地图和机构隶属关系中的管辖权主张保持中立。
扩展数据图表和表格
扩展数据 图 1 前 omicron 分析中的研究种群选择过程。
描述调查 omicron 前感染在预防 omicron 前病毒再次感染方面的有效性的人群选择过程的流程图。
扩展数据 图 2 研究 omicron 分析中的人群选择过程。
描述调查 omicron 感染在预防 omicron 病毒再次感染方面的有效性的人群选择过程的流程图。
扩展数据 图 3 卡塔尔的 SARS-CoV-2 感染发生率。
截至研究结束,即 2020 年 2 月 5 日至 2024 年 2 月 12 日期间新诊断的 SARS-CoV-2 感染的每日计数。
扩展数据 图 4 既往感染通过疫苗接种状态预防再感染的有效性。
在 a) 前 omicron 时代和 b) omicron 时代的疫苗接种状态,按上次感染后的时间感染预防再感染的有效性。A 包括未接种疫苗病例和对照的 353,485 和 627,836 个独立样本,以及接种疫苗病例和对照的 30,746 和 56,421 个独立样本。B 分别包括未接种疫苗病例和对照的 93,830 和 157,697 个独立样本,以及接种疫苗病例和对照的 176,161 和 275,258 个独立样本。数据以有效性点估计值和相应的 95% 置信区间表示。误差线表示 95% 置信区间。测量没有针对多重性进行调整。
扩展数据 图 5 由于先前感染状态的错误分类而导致的偏倚影响。
假设 90% 的 SARS-CoV-2 感染未记录,则由于检测阴性设计中先前感染状态的错误分类而导致的偏倚影响。该图显示了在先前感染状态分类错误的情况下,与大流行前 omicron a) 和 omicron b) 阶段感染对再感染的真实有效性相比,模拟估计的感染对再感染的有效性。
扩展数据 图 6 共存条件状态错误分类对前 omicron 时代结果的影响。
该图将主要分析结果与敏感性分析的结果进行了比较,在敏感性分析中,完全消除了共存条件数量的匹配,以模拟共存条件的完全不确定。比较包括:a) 感染预防再感染的总体有效性,b) 感染在再次感染后预防严重、危重或致命 COVID-19 的总体有效性,c) 感染预防每个接种疫苗和未接种疫苗的个体再次感染的总体有效性,d) 自上次感染以来感染在预防再感染方面的有效性,以及 e) 感染在预防自上次感染以来再次感染时发生严重、危重或致命 COVID-19 的有效性。主要分析包括病例和对照的 384,231 和 684,257 个独立样本。敏感性分析分别包括 401,686 和 723,529 个独立样本,用于病例和对照。数据以有效性点估计值和相应的 95% 置信区间表示。误差线表示 95% 置信区间。测量没有针对多重性进行调整。
扩展数据 图 7 共存条件状态错误分类对 omicron 时代结果的影响。
该图将主要分析结果与敏感性分析的结果进行了比较,在敏感性分析中,完全消除了共存条件数量的匹配,以模拟共存条件的完全不确定。比较包括:a) 感染预防再感染的总体有效性,b) 感染在再次感染后预防严重、危重或致命 COVID-19 的总体有效性,c) 感染预防每个接种疫苗和未接种疫苗的个体再次感染的总体有效性,d) 自上次感染以来感染在预防再感染方面的有效性,以及 e) 感染在预防自上次感染以来再次感染时发生严重、危重或致命 COVID-19 的有效性。主要分析分别包括 269,991 和 432,955 个病例和对照的独立样本。敏感性分析分别包括 287,576 和 464,064 个独立样本,用于病例和对照。数据以有效性点估计值和相应的 95% 置信区间表示。误差线表示 95% 置信区间。测量没有针对多重性进行调整。
扩展数据 图 8 使用队列研究设计验证前 omicron 时代的结果。
该图将使用测试阴性设计获得的主要分析结果与使用队列研究设计获得的结果进行了比较。比较包括:a) 感染预防再感染的总体有效性,b) 感染在再次感染后预防严重、危重或致命 COVID-19 的总体有效性,c) 感染预防每个接种疫苗和未接种疫苗的个体再次感染的总体有效性,d) 自上次感染以来感染在预防再感染方面的有效性,以及 e) 感染在预防自上次感染以来再次感染时发生严重、危重或致命 COVID-19 的有效性。使用检测阴性设计的分析分别包括 384,231 和 684,257 个独立样本,用于病例和对照。使用队列设计的分析包括每个原发感染和未感染队列的 339,019 个独立样本。数据以有效性点估计值和相应的 95% 置信区间表示。误差线表示 95% 置信区间。测量没有针对多重性进行调整。
扩展数据 图 9 使用队列研究设计验证 omicron 时代的结果。
该图将使用测试阴性设计获得的主要分析结果与使用队列研究设计获得的结果进行了比较。比较包括:a) 感染预防再感染的总体有效性,b) 感染在再次感染后预防严重、危重或致命 COVID-19 的总体有效性,c) 感染预防每个接种疫苗和未接种疫苗的个体再次感染的总体有效性,d) 自上次感染以来感染在预防再感染方面的有效性,以及 e) 感染在预防自上次感染以来再次感染时发生严重、危重或致命 COVID-19 的有效性。使用检测阴性设计的分析分别包括 269,991 和 432,955 个独立样本,用于病例和对照。使用队列设计的分析包括每个原发感染和未感染队列的 329,117 个独立样本。数据以有效性点估计值和相应的 95% 置信区间表示。误差线表示 95% 置信区间。测量没有针对多重性进行调整。
权利和权限
开放获取本文根据 Creative Commons Attribution 4.0 International License 获得许可,该许可允许以任何媒体或格式使用、共享、改编、分发和复制,前提是您对原作者和来源给予适当的信任,提供指向 Creative Commons 许可的链接,并说明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可中,除非在材料的致谢行中另有说明。如果材料未包含在文章的 Creative Commons 许可中,并且您的预期用途未被法律法规允许或超出允许的用途,您将需要直接从版权所有者处获得许可。要查看此许可证的副本,请访问 http://creativecommons.org/licenses/by/4.0/。
Hits: 18