Contents
- 1 新冠肺炎疫苗对瑞典589 722名个体后新冠肺炎病的有效性:基于人群的队列研究
- 2 这项研究的优势和局限性
- 2.1 参考
- 2.1.0.1 1↵Coronavirus WHO. (COVID-19) Dashboard. World Health Organization 2023. https://covid19.who.int
- 2.1.0.2 2↵Regionernas planering avseende vaccinering mot covid-19, delrapport 6. [The planning regarding vaccination against Covid-19 for regions, report 6]. Stockholm, Sweden: Sveriges Kommuner och Regioner, SKR; 2021. https://skr.se/download/18.5bb54e0c179a302981232fd/1621980314035/Regionernas_planering_%20vaccinering_covid-19_delrapport%206.pdf
- 2.1.0.3 3↵Baden LR, El Sahly HM, Essink B, et al., COVE Study Group. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med2021;384:403-16. doi:10.1056/NEJMoa2035389. pmid:33378609CrossRefPubMedGoogle Scholar
- 2.1.0.4 4↵Polack FP, Thomas SJ, Kitchin N, et al., C4591001 Clinical Trial Group. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med2020;383:2603-15. doi:10.1056/NEJMoa2034577. pmid:33301246CrossRefPubMedGoogle Scholar
- 2.1.0.5 5↵Falsey AR, Sobieszczyk ME, Hirsch I, et al., AstraZeneca AZD1222 Clinical Study Group. Phase 3 Safety and Efficacy of AZD1222 (ChAdOx1 nCoV-19) Covid-19 Vaccine. N Engl J Med2021;385:2348-60. doi:10.1056/NEJMoa2105290. pmid:34587382CrossRefPubMedGoogle Scholar
- 2.1.0.6 6↵Abu-Raddad LJ, Chemaitelly H, Butt AA, National Study Group for COVID-19 Vaccination. Effectiveness of the BNT162b2 Covid-19 Vaccine against the B.1.1.7 and B.1.351 Variants. N Engl J Med2021;385:187-9. doi:10.1056/NEJMc2104974. pmid:33951357CrossRefPubMedGoogle Scholar
- 2.1.0.7 7↵Nittas V, Gao M, West EA, et al. Long COVID Through a Public Health Lens: An Umbrella Review. Public Health Rev2022;43:1604501. doi:10.3389/phrs.2022.1604501. pmid:35359614CrossRefPubMedGoogle Scholar
- 2.1.0.8 8↵Crook H, Raza S, Nowell J, Young M, Edison P. Long covid-mechanisms, risk factors, and management. BMJ2021;374:n1648. doi:10.1136/bmj.n1648. pmid:34312178Abstract/FREE Full TextGoogle Scholar
- 2.1.0.9 9↵Gentilotti E, Górska A, Tami A, et al., ORCHESTRA Study Group. Clinical phenotypes and quality of life to define post-COVID-19 syndrome: a cluster analysis of the multinational, prospective ORCHESTRA cohort. EClinicalMedicine2023;62:102107. doi:10.1016/j.eclinm.2023.102107. pmid:37654668CrossRefPubMedGoogle Scholar
- 2.1.0.10 10↵Soriano JB, Murthy S, Marshall JC, Relan P, Diaz JV, WHO Clinical Case Definition Working Group on Post-COVID-19 Condition. A clinical case definition of post-COVID-19 condition by a Delphi consensus. Lancet Infect Dis2022;22:e102-7. doi:10.1016/S1473-3099(21)00703-9. pmid:34951953CrossRefPubMedGoogle Scholar
- 2.1.0.11 11↵Byambasuren O, Stehlik P, Clark J, Alcorn K, Glasziou P. Effect of covid-19 vaccination on long covid: systematic review. BMJ Med2023;2:e000385. doi:10.1136/bmjmed-2022-000385. pmid:36936268Abstract/FREE Full TextGoogle Scholar
- 2.1.0.12 12↵Ludvigsson JF, Otterblad-Olausson P, Pettersson BU, Ekbom A. The Swedish personal identity number: possibilities and pitfalls in healthcare and medical research. Eur J Epidemiol2009;24:659-67. doi:10.1007/s10654-009-9350-y. pmid:19504049CrossRefPubMedWeb of ScienceGoogle Scholar
- 2.1.0.13 13↵National Board of Health and Welfare. Statistik om tillstånd efter covid-19, 2021.
- 2.1.0.14 14↵National Board of Health and Welfare. Statistik om tillstånd efter covid-19 i primärvård och specialiserad vård 2021 [updated 2021-06-22]. https://www.socialstyrelsen.se/globalassets/sharepoint-dokument/artikelkatalog/statistik/2021-6-7495.pdf
- 2.1.0.15 15↵National Board of Health and Welfare. Statistik om postcovid i primärvård och specialiserad vård 2022 [updated 2022-02-24]. https://www.socialstyrelsen.se/globalassets/sharepoint-dokument/artikelkatalog/statistik/2022-2-7778.pdf
- 2.1.0.16 16↵Bygdell M, Leach S, Lundberg L, et al. A comprehensive characterization of patients diagnosed with post-COVID-19 condition in Sweden 16 months after the introduction of the International Classification of Diseases Tenth Revision diagnosis code (U09.9): a population-based cohort study. Int J Infect Dis2023;126:104-13. doi:10.1016/j.ijid.2022.11.021. pmid:36410693CrossRefPubMedGoogle Scholar
- 2.1.0.17 17↵Nyberg F, Franzén S, Lindh M, et al. Swedish Covid-19 Investigation for Future Insights – A Population Epidemiology Approach Using Register Linkage (SCIFI-PEARL). Clin Epidemiol2021;13:649-59. doi:10.2147/CLEP.S312742. pmid:34354377CrossRefPubMedGoogle Scholar
- 2.1.0.18 18↵Statistics Sweden. Folkmängd i riket, län och kommuner 31 December 2021 [och befolkningsförändringar 2021]. https://www.scb.se/hitta-statistik/statistik-efter-amne/befolkning/befolkningens-sammansattning/befolkningsstatistik/pong/tabell-och-diagram/folkmangd-och-befolkningsforandringar-helarsstatistik/folkmangd-i-riket-lan-och-kommuner-31-december-2021-och-befolkningsforandringar-2021/ (accessed 2 June 2023).
- 2.1.0.19 19↵Folkhälsomyndigheten. De flesta åtgärder mot covid-19 [upphör den 9 februari]. https://www.folkhalsomyndigheten.se/nyheter-och-press/nyhetsarkiv/2022/februari/de-flesta-atgarder-mot-covid-19-upphor-den-9-februari/
- 2.1.0.20 20↵Sveriges kommuner och regioner. Regionernas planering avseende vaccinering mot covid-19, delrapport 6 2021. https://skr.se/download/18.5bb54e0c179a302981232fd/1621980314035/Regionernas_planer%20ing_%20vaccinering_covid-19_delrapport%206.pdf
- 2.1.0.21 21↵Läkemedelsverket. Covid-19 vaccines. https://www.lakemedelsverket.se/en/coronavirus/covid-19-vaccine
- 2.1.0.22 22↵Xu Y, Li H, Kirui B, et al. Effectiveness of COVID-19 Vaccines over 13 Months Covering the Period of the Emergence of the Omicron Variant in the Swedish Population. Vaccines (Basel)2022;10:2074. doi:10.3390/vaccines10122074. pmid:36560484CrossRefPubMedGoogle Scholar
- 2.1.0.23 23↵Spetz M, Lundberg L, Nwaru C, et al. An intersectional analysis of sociodemographic disparities in Covid-19 vaccination: A nationwide register-based study in Sweden. Vaccine2022;40:6640-8. doi:10.1016/j.vaccine.2022.09.065. pmid:36210254CrossRefPubMedGoogle Scholar
- 2.1.0.24 24↵Hedberg P, Granath F, Bruchfeld J, et al. Post COVID-19 condition diagnosis: A population-based cohort study of occurrence, associated factors, and healthcare use by severity of acute infection. J Intern Med2023;293:246-58. doi:10.1111/joim.13584. pmid:36478477CrossRefPubMedGoogle Scholar
- 2.1.0.25 25↵CoVariants. Overview of Variants in Countries. [updated 13 June 2023, accessed 22 June 2023]. https://covariants.org/per-country?variant=21A+%28Delta%29&variant=21K+%28Omicron%29&variant=21L+%28Omicron%29&variant=22A+%28Omicron%29&variant=22B+%28Omicron%29&variant=22C+%28Omicron%29&variant=22D+%28Omicron%29&variant=22E+%28Omicron%29&variant=22F+%28Omicron%29&variant=23A+%28Omicron%29&variant=23B+%28Omicron%29 (accessed 22 June 2023).
- 2.1.0.26 26↵Simon MA, Luginbuhl RD, Parker R. Reduced Incidence of Long-COVID Symptoms Related to Administration of COVID-19 Vaccines Both Before COVID-19 Diagnosis and Up to 12 Weeks After.medRxiv2021:2021.11.17.21263608. doi:10.1101/2021.11.17.21263608CrossRefGoogle Scholar
- 2.1.0.27 27↵Al-Aly Z, Bowe B, Xie Y. Long COVID after breakthrough SARS-CoV-2 infection. Nat Med2022;28:1461-7. doi:10.1038/s41591-022-01840-0. pmid:35614233CrossRefPubMedGoogle Scholar
- 2.1.0.28 28↵Taquet M, Dercon Q, Harrison PJ. Six-month sequelae of post-vaccination SARS-CoV-2 infection: A retrospective cohort study of 10,024 breakthrough infections. Brain Behav Immun2022;103:154-62. doi:10.1016/j.bbi.2022.04.013. pmid:35447302CrossRefPubMedGoogle Scholar
- 2.1.0.29 29↵van der Maaden T, Mutubuki EN, de Bruijn S, et al. Prevalence and Severity of Symptoms 3 Months After Infection With SARS-CoV-2 Compared to Test-Negative and Population Controls in the Netherlands. J Infect Dis2023;227:1059-67. doi:10.1093/infdis/jiac474. pmid:36477364CrossRefPubMedGoogle Scholar
- 2.1.0.30 30↵Azzolini E, Levi R, Sarti R, et al. Association Between BNT162b2 Vaccination and Long COVID After Infections Not Requiring Hospitalization in Health Care Workers. JAMA2022;328:676-8. doi:10.1001/jama.2022.11691. pmid:35796131CrossRefPubMedGoogle Scholar
- 2.1.0.31 31↵Ballouz T, Menges D, Kaufmann M, et al. Post COVID-19 condition after Wildtype, Delta, and Omicron SARS-CoV-2 infection and prior vaccination: Pooled analysis of two population-based cohorts. PLoS One2023;18:e0281429. doi:10.1371/journal.pone.0281429. pmid:36812215CrossRefPubMedGoogle Scholar
- 2.1.0.32 32↵Ayoubkhani D, Bosworth ML, King S, et al. Risk of Long COVID in People Infected With Severe Acute Respiratory Syndrome Coronavirus 2 After 2 Doses of a Coronavirus Disease 2019 Vaccine: Community-Based, Matched Cohort Study. Open Forum Infect Dis2022;9:ofac464. doi:10.1093/ofid/ofac464. pmid:36168555CrossRefPubMedGoogle Scholar
- 2.1.0.33 33↵Antonelli M, Penfold RS, Merino J, et al. Risk factors and disease profile of post-vaccination SARS-CoV-2 infection in UK users of the COVID Symptom Study app: a prospective, community-based, nested, case-control study. Lancet Infect Dis2022;22:43-55. doi:10.1016/S1473-3099(21)00460-6. pmid:34480857CrossRefPubMedGoogle Scholar
- 2.1.0.34 34↵Watanabe A, Iwagami M, Yasuhara J, Takagi H, Kuno T. Protective effect of COVID-19 vaccination against long COVID syndrome: A systematic review and meta-analysis. Vaccine2023;41:1783-90. doi:10.1016/j.vaccine.2023.02.008. pmid:36774332CrossRefPubMedGoogle Scholar
- 2.1.0.35 35↵Marra AR, Kobayashi T, Suzuki H, et al. The effectiveness of coronavirus disease 2019 (COVID-19) vaccine in the prevention of post-COVID-19 conditions: A systematic literature review and meta-analysis. Antimicrob Steward Healthc Epidemiol2022;2:e192. doi:10.1017/ash.2022.336. pmid:36505947CrossRefPubMedGoogle Scholar
- 2.1.0.36 36↵Klein SL, Marriott I, Fish EN. Sex-based differences in immune function and responses to vaccination. Trans R Soc Trop Med Hyg2015;109:9-15. doi:10.1093/trstmh/tru167. pmid:25573105CrossRefPubMedGoogle Scholar
- 2.1.0.37 37↵Hernández-Aceituno A, García-Hernández A, Larumbe-Zabala E. COVID-19 long-term sequelae: Omicron versus Alpha and Delta variants. Infect Dis Now2023;53:104688. doi:10.1016/j.idnow.2023.104688. pmid:36858287CrossRefPubMedGoogle Scholar
- 2.1.0.38 38↵Jassat W, Mudara C, Vika C, et al. A cohort study of post-COVID-19 condition across the Beta, Delta, and Omicron waves in South Africa: 6-month follow-up of hospitalized and nonhospitalized participants. Int J Infect Dis2023;128:102-11. doi:10.1016/j.ijid.2022.12.036. pmid:36587841CrossRefPubMedGoogle Scholar
- 2.1.0.39 39↵Antonelli M, Pujol JC, Spector TD, Ourselin S, Steves CJ. Risk of long COVID associated with delta versus omicron variants of SARS-CoV-2. Lancet2022;399:2263-4. doi:10.1016/S0140-6736(22)00941-2. pmid:35717982CrossRefPubMedGoogle Scholar
- 2.1.0.40 40↵Altmann DM, Whettlock EM, Liu S, Arachchillage DJ, Boyton RJ. The immunology of long COVID. Nat Rev Immunol2023;23:618-34. doi:10.1038/s41577-023-00904-7. pmid:37433988CrossRefPubMedGoogle Scholar
- 2.1.0.41 41↵Zheng C, Shao W, Chen X, Zhang B, Wang G, Zhang W. Real-world effectiveness of COVID-19 vaccines: a literature review and meta-analysis. Int J Infect Dis2022;114:252-60. doi:10.1016/j.ijid.2021.11.009. pmid:34800687CrossRefPubMedGoogle Scholar
- 2.1.0.42 42↵Magnusson K, Turkiewicz A, Flottorp SA, Englund M. Prevalence of long COVID complaints in persons with and without COVID-19. Sci Rep2023;13:6074. doi:10.1038/s41598-023-32636-y. pmid:37055494CrossRefPubMedGoogle Scholar
- 2.1.0.43 43↵Ayoubkhani D, Bermingham C, Pouwels KB, et al. Trajectory of long covid symptoms after covid-19 vaccination: community based cohort study. BMJ2022;377:e069676. doi:10.1136/bmj-2021-069676. pmid:35584816Abstract/FREE Full TextGoogle Scholar
- 2.1.0.44 44↵Strain WD, Sherwood O, Banerjee A, Van der Togt V, Hishmeh L, Rossman J. The Impact of COVID Vaccination on Symptoms of Long COVID: An International Survey of People with Lived Experience of Long COVID. Vaccines (Basel)2022;10:652. doi:10.3390/vaccines10050652. pmid:35632408CrossRefPubMedGoogle Scholar
- 2.1.0.45 45↵Wynberg E, Han AX, Boyd A, et al., RECoVERED Study Group. The effect of SARS-CoV-2 vaccination on post-acute sequelae of COVID-19 (PASC): A prospective cohort study. Vaccine2022;40:4424-31. doi:10.1016/j.vaccine.2022.05.090. pmid:35725782CrossRefPubMedGoogle Scholar
- 2.1.0.46 https://www.bmj.com/content/383/bmj-2023-076990
新冠肺炎疫苗对瑞典589 722名个体后新冠肺炎病的有效性:基于人群的队列研究
Covid-19 vaccine effectiveness against post-covid-19 condition among 589 722 individuals in Sweden: population based cohort study
- BMJ 2023; 383 doi:https://doi.org/10.1136/bmj-2023-076990 (2023年11月22日发布)引用如下:BMJ2023;383:e076990
摘要
目标调查初次新冠肺炎疫苗接种(推荐方案中的前两剂和第一次加强剂量)对新冠长期症状(post-covid-19 condition,PCC)的有效性。
设计基于人群的队列研究。
环境瑞典新冠肺炎未来洞察调查——使用登记连锁(SCIFI-珀尔)项目的人群流行病学方法,一项在瑞典进行的基于登记的队列研究。
参与者所有成年人(≥18岁)在2020年12月27日至2022年2月9日期间在瑞典最大的两个地区首次登记患有新冠肺炎。从首次感染到死亡、移民、接种疫苗、再次感染、新冠长期症状诊断(ICD-10诊断代码U09.9)或随访结束(2022年11月30日),以先发生者为准。感染前接受过至少一剂新冠肺炎疫苗的人被视为已接种。
主要结果测量主要结果是新冠长期症状的临床诊断。针对新冠长期症状的疫苗有效性使用Cox回归进行评估,Cox回归根据年龄、性别、共病(糖尿病和心血管、呼吸和精神疾病)、2019年期间的医疗保健接触人数、社会经济因素和感染时的显性病毒变异进行调整。
结果在299 692名接种新冠肺炎疫苗的个体中,1201人(0.4%)在随访中被诊断为新冠长期症状,相比之下,290 030名未接种疫苗的个体中有4118人(1.4%)被诊断为新冠长期症状。感染前接种任何剂量的新冠肺炎疫苗均与新冠长期症状风险降低相关(校正风险比为0.42,95%可信区间为0.38至0.46),疫苗有效性为58%。在接种疫苗的个人中,21 111人只接种了一剂,205 650人接种了两剂,72 931人接种了三剂或三剂以上。一剂、两剂、三剂或更多剂的新冠长期症状疫苗效力分别为21%、59%和73%。
结论这项研究的结果表明,在感染前接种新冠肺炎疫苗和接受新冠长期症状诊断的风险降低之间有很强的相关性。这些发现强调了针对新冠肺炎的初级疫苗接种对于减少新冠长期症状人群负担的重要性。
介绍
2020年3月,新冠肺炎宣布全球疫情,到2023年6月,向世界卫生组织报告的新冠肺炎病例刚刚超过7.67亿,其中包括690万例死亡1。针对新冠肺炎的有效疫苗得到了快速开发,瑞典的第一剂疫苗是在2020年12月进行的,距离疫情开始不到一年2。新冠肺炎疫苗对新型冠状病毒感染和急性新冠肺炎的严重表现的功效和效果已经得到证明3–6。疫情开始后不久,有报道称,一些从新冠肺炎康复的人出现了持续的症状,无论他们是否因疾病住院,这种疾病通常被称为长冠状病毒肺炎或后新冠肺炎状态(post-covid-19 condition,PCC,新冠长期症状)。我们之前发现,在瑞典,2%的新冠肺炎成年患者被诊断为新冠长期症状,尽管依赖于自我报告的持续症状的研究通常报告更高的发病率。最近的一项总括综述显示,在不同的研究人群中,新冠肺炎长期症状的患病率在2%至53%之间变化7。通常描述的新冠长期症状症状包括疲劳、呼吸困难、认知障碍、头痛、肌肉疼痛和心脏异常,如胸痛和心悸8。此外,通过使用机器学习算法,最近的一项研究确定了新冠长期症状组中的四个临床表型聚类;慢性疲劳样综合征、呼吸综合征、慢性疼痛综合征和神经感觉综合征9。根据世卫组织的德尔菲共识,新冠长期症状可能发生在“有可能或确诊新型冠状病毒感染史的个体中,通常在新冠肺炎发病后三个月出现,症状持续至少两个月,并且无法用替代诊断来解释10。”很少有研究评估新冠肺炎疫苗在大规模人群中预防新冠长期症状的有效性。最近的一项系统性综述得出结论,在12项纳入研究中的10项中,在新型冠状病毒感染前接受新冠肺炎疫苗对新冠长期症状有保护作用,感染前任何疫苗剂量的效果估计值(优势比和风险比)在0.48至0.87之间11。然而,由于研究方法和数据的高度异质性,作者没有进行荟萃分析。他们的结论是,由于在纳入的研究中对混杂因素和偏倚风险的调整不充分,证据的确定性很低。
瑞典有着从国家登记册中收集人口健康和人口统计数据的悠久历史。通过使用个人的个人识别号作为多个寄存器中的唯一标识符,有可能以高链接质量链接不同数据源之间的信息12。在瑞典,新冠长期症状的ICD-10(国际疾病分类,第10版)诊断代码(U09.9)已经在2020年10月实施。自那以后,国家卫生和福利委员会鼓励使用与先前新冠肺炎相关的疾病的诊断代码,并将其描述为:“可用于描述与新冠肺炎相关的疾病的附加代码。”在疫情期间,国家健康和福利委员会不断发布报告,使用来自专业医疗保健的诊断代码和来自初级医疗保健的汇总水平数据描述新冠长期症状的患病率13,14,15。我们最近的研究表明,在瑞典,大多数被诊断为前列腺癌的患者(> 85%)是在初级卫生保健中得到诊断的16。因此,在瑞典研究新冠长期症状时,使用个体水平的初级医疗保健数据是至关重要的。通过SCIFI-珀尔(瑞典新冠肺炎未来洞察调查——一种使用注册链接的人口流行病学方法)项目数据库,我们获得了来自瑞典两个最大地区(覆盖约40%的瑞典人口)的关于疫苗接种状况、疾病、社会人口信息和初级医疗保健数据的国家注册数据。我们利用真实世界的数据,在感染前接种疫苗的个体中调查了初级新冠肺炎疫苗接种(推荐方案中的前两次疫苗剂量和第一次加强剂量)对新冠长期症状的有效性。
方法
研究设计和数据来源
这项以人群为基础的队列研究是SCIFI-珀尔项目的一部分,该项目是一项在瑞典新冠肺炎疫情进行的全国性连锁多登记观察研究17。因为在瑞典研究新冠长期症状时初级医疗保健数据很重要16,我们使用了斯德哥尔摩地区和威斯特拉哥德地区(瑞典最大的两个地区,覆盖约40%的瑞典人口)所有成年(≥18岁)居民的登记数据18),从中我们可以获得初级医疗保健的信息。通过使用独特的个人识别号码,我们从国家疫苗接种登记处检索了每个人服用新冠肺炎疫苗的数据;国家法定传染病登记处的阳性新型冠状病毒聚合酶链反应(PCR)结果;新冠肺炎、新冠长期症状和共病的ICD-10诊断代码;以及2019年期间来自国家患者登记册的住院和门诊专家护理以及来自所有公共和大多数私营初级保健的两个区域数据库的初级保健的医疗保健联系人数(分别位于斯德哥尔摩区域和瓦斯特拉特戈塔兰区域的瓦尔和维加);以及来自瑞典统计局健康保险和劳动力市场研究纵向综合数据库的死亡、移民、人口统计和社会经济数据。我们将瑞典重症监护登记与全国患者登记的住院部分结合起来使用,以确定入院的新冠肺炎患者,包括在重症监护病房(ICU)接受治疗的患者。
研究人群和随访
我们纳入了在研究纳入期首次登记的新冠肺炎患者,纳入期定义为2020年12月27日(瑞典开始接种疫苗的时间2)和2022年2月9日(瑞典全人群PCR检测结束19)。选择这一时期包括在瑞典同时进行疫苗接种和PCR检测的时间。新冠肺炎被定义为在国家法定疾病登记册中登记的阳性新型冠状病毒聚合酶链式反应测试结果,或在国家患者登记册、VAL、VEGA或瑞典重症监护登记册中登记的ICD-10诊断代码(U07.1或U07.2作为主要或次要诊断)。新冠肺炎索引日期是新冠肺炎在这些登记册中的首次登记。然后,从新冠肺炎指数日期后28天开始随访纳入的个体,直到新冠长期症状诊断、接种疫苗、再感染、死亡、移民或随访结束(2022年11月30日),以先发生者为准。纳入标准是在随访开始时仍在斯德哥尔摩地区或瑞典的瓦斯特拉特格兰德生活,并且在新冠肺炎指数日期后开始随访时未接种疫苗。因此,我们排除了那些接种过疫苗、移民或在感染后28天内死亡的人。我们将新冠肺炎指数日期后≥90天的额外登记的新型冠状病毒感染视为再感染。
疫苗接种和结果
在瑞典,新冠肺炎疫苗接种计划于2020年12月27日启动,分四个连续阶段实施;第1-3阶段(老年群体(≥60岁)、医疗保健或老年护理工作者以及各种风险群体)和第4阶段(不属于之前阶段的年轻群体),第4阶段将于2021年5月在瑞典大部分地区启动20。在本研究中,在新冠肺炎指数日期之前,在瑞典至少注射一剂任何可获得的新冠肺炎疫苗被定义为已接种疫苗。我们研究了初级疫苗接种系列——也就是说,在推荐的时间表内的前两次剂量和第一次加强剂量。在研究期间,瑞典可用的疫苗包括BNT162b2(辉瑞-BioNTech)、mRNA-1273 (Moderna)、AZD1222(牛津-阿斯利康)、Ad26.COV2.S(让桑/强生)和NVX-CoV2373(诺瓦瓦克斯)21。为了最大限度地降低一剂疫苗重复注册的风险,我们要求两次注册之间至少间隔几天。根据疫苗接种指南和以前接种的疫苗类型,BNT162b2的要求至少为19天,AZD1222和mRNA-1273的要求至少为25天22。我们将疫苗按剂量分类(≥1剂,以及细分为1剂、2剂、3剂及以上)。主要转归是新冠长期症状的临床诊断,在全国患者登记中定义为ICD-10代码U09.9,VEGA或VAL为新冠肺炎指数日期后≥28天的主要或次要诊断。新冠肺炎指数日期和新冠长期症状诊断之间至少需要28天,因为28天内的新冠长期症状诊断被解释为与急性感染而非新冠长期症状相关的错误分类。
协变量
我们从健康保险纵向综合数据库和劳动力市场研究数据库中获得年龄、性别、教育水平、就业状况、出生国家、移民和死亡日期的信息。年龄在研究开始时(2020年12月27日)确定,并分为五组(18-34岁、35-44岁、45-54岁、55-64岁和≥65岁)。教育水平分为四类:小学(< 10岁)、中学(10-12岁)、高等学校(> 12岁)和不详。就业状况分为就业、失业或未知。出生国被并入大陆地区,包括亚洲和大洋洲;非洲;欧洲,除了瑞典;北美和南美;而且不为人知。所包括的共病已被证明与疫苗接种状态和新冠长期症状诊断有关16,23,24包括糖尿病(ICD-10: E10-E11)、心血管疾病(ICD-10: I00-I99)、呼吸系统疾病(ICD-10: J40-J99)和精神疾病(ICD-10: F00-F99)等主要和次要诊断,这些诊断来自2015年1月1日至2019年12月31日全国患者登记册中的住院和门诊专科护理以及维加和瓦尔的初级医疗保健。我们将急性新冠肺炎的严重程度分类为入院(在ICU接受治疗或未接受治疗)或未入院,使用瑞典重症监护注册中心和国家患者注册中心中新冠肺炎指数日期后28天内新冠肺炎的主要和次要诊断。2019年期间医疗保健联系人的数量分为0、1-3、4-10、> 10或未知。我们将医疗保健联系人定义为初级医疗保健、专科门诊护理和专科住院护理的任何注册联系人(包括通过电话)。如果在同一天注册了多个联系人,则只计为一个联系人。对于住院治疗,我们使用入院日期,每个住院期算作一次接触。研究个体也根据在他们的新冠肺炎指数日期期间占主导地位的新冠肺炎变异进行分类。在瑞典,大约从2020年2月到2021年1月,前alpha变体占主导地位,其次是alpha(2021年2月到2021年6月),delta(2021年7月到2021年12月),和omicron(2022年1月到研究结束)25。由于前α变异占优势的时期新冠肺炎患者人数较少,为了分析的目的,我们将前α变异和α占优势的时期合并。
统计分析
描述性统计以数字和百分比表示,或以中位数和四分位距表示(IQR)。我们使用χ2检验了组间的显著性检验和曼-惠特尼U检验。此外,为了能够进一步评估未接种疫苗组和接种疫苗组之间不同类型和大小或患病率的基线变量的分布,我们使用了标准化的平均差异,较大的值表示组间差异较大(较大的不平衡),值≤0.1表示良好的平衡。
我们进行了Cox比例风险回归,以评估感染前新冠肺炎疫苗接种的有效性和发生前列腺癌的风险。通过对疫苗接种状态的Schoenfeld残差图进行目测评估,实现了比例风险的假设。我们包括三个模型:一个没有调整的原始模型;对年龄、性别和感染时的主要变异进行调整的部分调整模型;以及完全调整的模型,除了共病(糖尿病和心血管、呼吸和精神疾病)、2019年期间的医疗保健联系人数量、教育水平、就业状况和出生地区之外,其调整与部分调整的模型相同。结果显示为风险比或调整后的风险比(对应于完全调整后的模型)以及相应的95%置信区间。疫苗有效性计算为100×(1-危害比)。在主要分析中,新冠肺炎指数日期前至少一剂疫苗(任何剂量)被定义为已接种。在新冠肺炎指数日期之前,还对分成一剂、两剂、三剂或更多剂的疫苗接种进行了单独的分析。Kaplan-Meier方法用于估计未接种和接种组新冠长期症状的累积发病率曲线。在探索性分析中,我们通过将急性感染的严重程度作为中介因素加入回归模型,进一步研究了新冠肺炎疫苗对新冠长期症状潜在保护作用的可能途径。我们还根据急性感染的严重程度进行了分层。所有分析均使用R统计软件(version 4.2.2; R Core Team 2023)。
亚组和敏感性分析
通过在疫苗接种变量(新冠肺炎之前的任何疫苗)和每个调整变量(一次一个相互作用项)之间包含一个相互作用项来进行分析,以评估影响修正。如果相互作用项的P值< 0.05,我们认为相互作用具有统计学意义。如果三个最相关的变量表现出显著的相互作用,进一步的分层是有计划的:性别、年龄组和新冠肺炎指数日期时的主要变量。还对共病和疫苗接种与新冠肺炎指数日期之间的中位时间(疫苗接种≥新冠肺炎指数日期前126天,且< 126天)进行了分层。还对不同疫苗进行了单独的亚组分析,按照感染前前两剂疫苗的组合进行分类。这些分析仅限于2021年2月3日至2021年8月16日期间(瑞典三种最常见疫苗的第一剂接种时间:BNT162b2、mRNA-1273和AZD1222)(见补充图S1)。
还进行了三项敏感性分析。首先,我们将接种人群限制在新冠肺炎指数日期前14天以上接受最后一次疫苗接种的人群。其次,我们要求在新冠肺炎指数日期和新冠长期症状诊断之间至少有90天(而不是28天)。最后,我们将接种人群限制在那些在新冠肺炎指数日期前已经接种了两到三次的人群中。
患者和公众的参与
没有患者或公众直接参与这项研究。然而,一位患者审查者在审查过程中确实提供了有见地的意见。
结果
描述统计学
在研究纳入期间,瑞典两个最大地区的649 071人首次登记为新冠肺炎患者。总的来说,59 349人被排除在外:56 760人接种疫苗,2515人死亡,74人在新冠肺炎指数日期的28天内移民。总共有589,722名个体符合参与研究的入选标准(图1).
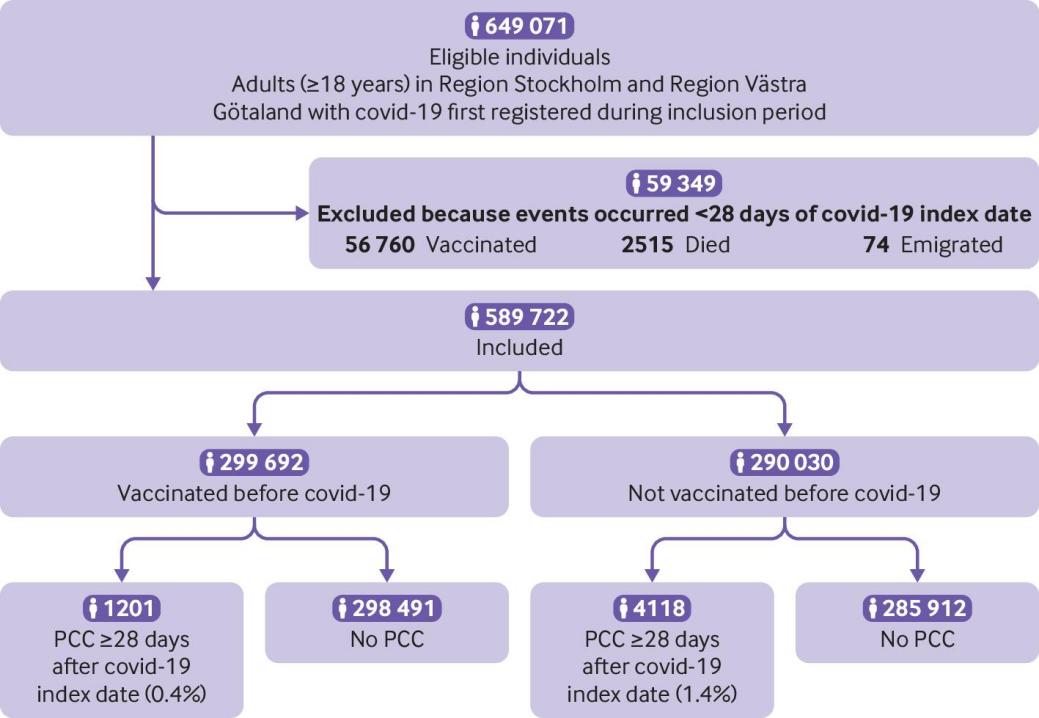
图1 2020年12月27日至2022年2月9日研究纳入期内新冠肺炎的研究人群流程图。PCC =后新冠肺炎条件
在研究人群中的589 722名个体中,299 692名(50.8%)在新冠肺炎指数日期之前已经接种了至少一剂新冠肺炎疫苗,290 030名(49.2%)在感染时没有接种疫苗(表1)。在接种疫苗的个体中,21 111人只接种了一剂,205 650人接种了两剂,72 843人接种了三剂,88人在新冠肺炎指数日期前接种了三剂以上(表1)。BNT162b2最常用于前两剂(见S1补充表)。从最后一次接种疫苗到新冠肺炎指数日期的中间时间为126天(IQR为47-160天)。在新冠肺炎之前,接种过疫苗的女性多于男性(56.7%v44.3%,P<0.001),接种疫苗者的中位年龄显著高于未接种者(42岁(IQR 32-53岁)v39岁(29-50岁),P<0.001)(表1)。虽然大多数研究人群没有因新冠肺炎而入院,但未接种疫苗的人比接种疫苗的人更有可能入院(4.0%v1.5%,P<0.001)(表1)。在未接种疫苗的组中,174 689人(60.2%)在α变异占优势的时期有新冠肺炎指数日期,而接种疫苗的组中的人大多在奥米克隆时期被感染(n=224 330,74.9%)(表1)。
表1 研究人群的描述性统计,根据新冠肺炎感染前的疫苗接种情况进行分层。除非另有说明,数值均为数字(百分比)
| 新冠肺炎之前的疫苗接种状况 | 标准化平均差 | ||
|---|---|---|---|
| 未接种疫苗(n=290 030) | 接种疫苗(n=299 692) | ||
| 性: | 0.10 | ||
| 男人 | 142 921 (49.3) | 132 650 (44.3) | |
| 女人 | 147 109 (50.7) | 167 042 (56.7) | |
| 中位(IQR)年龄(岁)* | 39 (29-50) | 42 (32-53) | 0.20 |
| 年龄组*(岁): | 0.19 | ||
| 18-34 | 118 365 (40.8) | 99 664 (33.3) | |
| 35-44 | 66 840 (23.0) | 73 285 (24.5) | |
| 45-54 | 55 279 (19.1) | 60 790 (20.3) | |
| 55-64 | 32 001 (11.0) | 37 324 (12.5) | |
| ≥65 | 17 545 (6.0) | 28 629 (9.6) | |
| 出生地区: | 0.23 | ||
| 非洲 | 10 121 (3.5) | 6498 (2.2) | |
| 亚洲和大洋洲 | 37 697 (13.0) | 26 980 (9.0) | |
| 欧洲 | 21 493 (7.4) | 15 323 (5.1) | |
| 北美和南美 | 6683 (2.3) | 6269 (2.1) | |
| 瑞典 | 196 490 (67.7) | 232 860 (77.7) | |
| 未知的 | 17 546 (6.0) | 11 762 (3.9) | |
| 教育: | 0.23 | ||
| 小学(< 10岁) | 44 093 (15.2) | 31 835 (10.6) | |
| 中学(10-12岁) | 118 613 (40.9) | 108 470 (36.2) | |
| 高等学校(> 12年) | 116 232 (40.1) | 152 126 (50.8) | |
| 未知的 | 11 092 (3.8) | 7261 (2.4) | |
| 就业状况: | 0.05 | ||
| 被雇用的 | 248 127 (85.6) | 260 318 (86.9) | |
| 失业的 | 37 847 (13.0) | 36 621 (12.2) | |
| 未知的 | 4056 (1.4) | 2753 (0.9) | |
| 共病: | |||
| 糖尿病 | 9388 (3.2) | 11 449 (3.8) | 0.03 |
| 心血管病 | 42 684 (14.7) | 54 491 (18.2) | 0.09 |
| 呼吸道疾病 | 21 807 (7.5) | 25 055 (8.4) | 0.03 |
| 精神疾病 | 81 807 (28.2) | 86 841 (29.0) | 0.02 |
| 2019年医疗保健联系人数量: | 0.07 | ||
| 0 | 63 866 (22.0) | 60 305 (20.1) | |
| 1-3 | 85 699 (29.5) | 87 623 (29.2) | |
| 4-10 | 76 135 (26.3) | 81 056 (27.0) | |
| >10 | 51 609 (17.8) | 58 983 (19.7) | |
| 未知的 | 12 721 (4.4) | 11 725 (3.9) | |
| 新冠肺炎之前的疫苗剂量数: | |||
| 1 | – | 21 111 (7.0) | |
| 2 | – | 205 650 (68.6) | |
| 3 | – | 72 843 (24.3) | |
| 4 | – | 83 (<0.1) | |
| 5 | – | 5 (<0.1) | |
| 新冠肺炎的严重性: | 0.15 | ||
| 入院,重症监护室 | 389 (0.1) | 77 (<0.1) | |
| 入院治疗,不是重症监护室 | 11 178 (3.9) | 4610 (1.5) | |
| 未入院 | 278 463 (96.0) | 295 005 (98.4) | |
| 急性感染期间的主要变异: | 2.4 | ||
| Pre-alpha | 53 021 (18.3) | 405 (0.1) | |
| Alpha | 174 689 (60.2) | 10 394 (3.5) | |
| Delta | 26 260 (9.1) | 64 563 (21.5) | |
| Omicron | 36 060 (12.4) | 224 330 (74.9) | |
ICD-10 =国际疾病分类,第10次修订;。ICU =重症监护病房;IQR =四分位数间距。
研究人群包括瑞典最大的两个地区的所有成年(≥18岁)居民,新冠肺炎在2020年12月27日至2022年2月9日的研究纳入期内首次登记。
*研究开始时的年龄,2020年12月27日。
†不包括瑞典。
‡在2015-19年期间,在专科住院和门诊医疗保健登记和区域初级医疗保健数据库中登记的ICD-10诊断代码的共病:糖尿病(E10-E11)、心血管疾病(I00-I99)、呼吸系统疾病(J40-J99)和精神疾病(F00-F99)。
§在瑞典,从2020年2月到2021年1月,前alpha变体占主导地位,其次是从2021年2月到2021年6月的alpha,从2021年7月到2021年12月的delta,以及从2022年1月到2022年2月9日纳入结束的omicron。
在总研究人群中,从新冠肺炎指数日期后28天开始的中位随访时间为129天(IQR 51-287天)(接种疫苗:197天(IQR 42-288天),未接种疫苗:112天(IQR 57-282天)。在接种疫苗组和未接种疫苗组之间,直到新冠长期症状诊断的中位随访时间相似(18 (IQR 7-47)天v17天(IQR 6-39天)。感染前接种三剂或三剂以上疫苗的个体随访时间最长(中位数250天(IQR 126-283天),而感染前仅接种一剂疫苗的个体随访时间最短(中位数42天(IQR 11-281天))。对于接种疫苗和未接种疫苗的个体,随访期间审查的最常见原因是接种疫苗,其次是随访结束(见补充表S2)。在研究期间,捕获的再感染是罕见的(n=12 888,2.2%),并且在未接种组明显比接种组更常见(3.3v1.1%,P<0.001)(见S2补充表)。在接种疫苗的个体中,1201人(0.4%)在随访期间被诊断为新冠长期症状,相比之下,未接种疫苗的个体中有4118人(1.4%)被诊断为新冠长期症状(图2和补充表S2)。
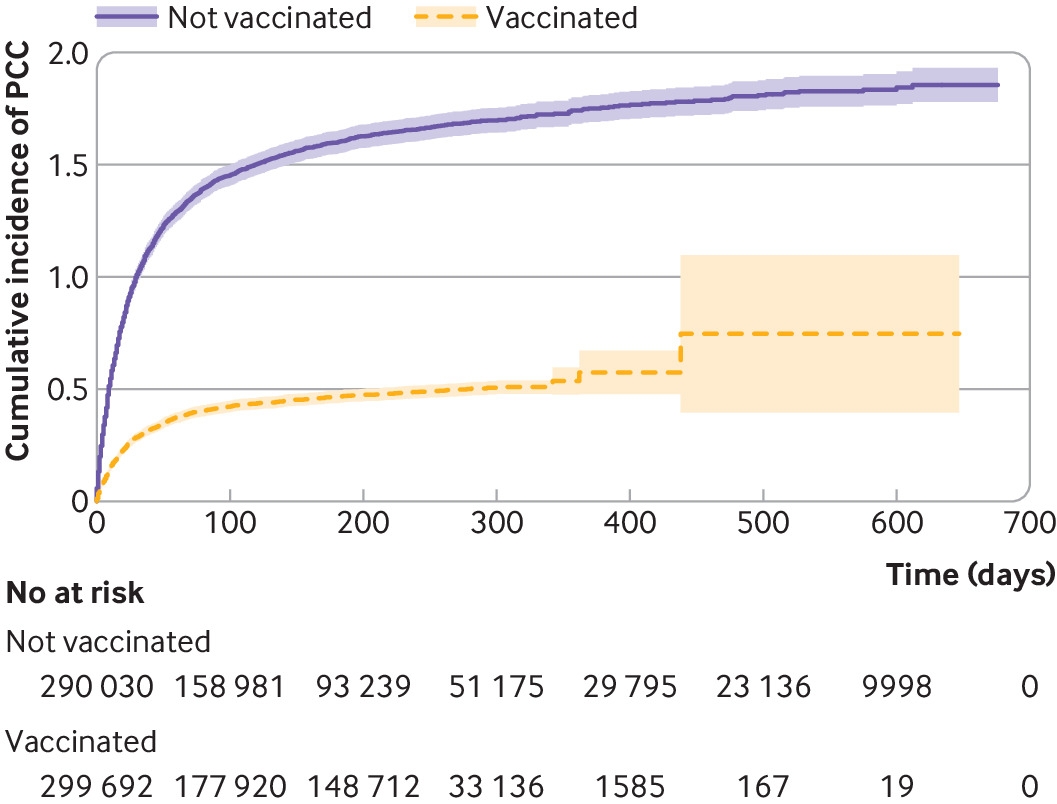
图2使用Kaplan-Meier失败函数,对接种或未接种新冠肺炎疫苗的个体进行新冠长期症状的累积发病率分析。研究人群包括瑞典最大的两个地区的所有成年(≥18岁)居民,新冠肺炎在2020年12月27日至2022年2月9日的研究纳入期内首次登记。新冠长期症状 =后新冠肺炎条件
疫苗效力
在新冠肺炎指数日期前接受至少一剂新冠肺炎疫苗与新冠长期症状风险降低相关(校正风险比为0.42 (95%可信区间为0.38-0.46),疫苗有效性为58%(表2)。在新冠肺炎之前,疫苗效力随着疫苗剂量的增加而增加。一剂、两剂和三剂疫苗的校正风险比为0.79 (0.68至0.91)、0.41 (0.37至0.45)和0.27 (0.23至0.32),疫苗有效性分别为21%、59%和73%(表2)。
表2 感染前的新冠肺炎疫苗接种和感染后的新冠肺炎病诊断之间的疫苗有效性和风险比,95%置信区间,总体分析和按疫苗剂量数分层的独立分析
| 总数 | 有PCC的数量(%) | 危险比(95%可信区间) | p值 | 疫苗有效性% (95%可信区间) | |||
|---|---|---|---|---|---|---|---|
| Crude | 部分调整的模型* | 完全调整的型号 | |||||
| 没有接种疫苗 | 290 030 | 4118 (1.4) | 参考 | 参考 | 参考 | 参考 | 参考 |
| 有接种疫苗吗 | 299 692 | 1201 (0.4) | 0.29 (0.27至0.31) | 0.41 (0.38至0.45) | 0.42 (0.38至0.46) | <0.001 | 58岁(54至62岁) |
| 单独分层分析 | |||||||
| 1剂 | 21 111 | 192 (0.9) | 0.83 (0.72至0.96) | 0.79 (0.68到0.91) | 0.79 (0.68到0.91) | 0.002 | 21 (9至32) |
| 2剂 | 205 650 | 743 (0.4) | 0.27 (0.25至0.29) | 0.40 (0.36至0.45) | 0.41 (0.37至0.45) | <0.001 | 59岁(55岁至63岁) |
| ≥3剂 | 72 931 | 266 (0.4) | 0.23 (0.20至0.26) | 0.26 (0.22到0.31) | 0.27 (0.23至0.32) | <0.001 | 73 (68至77) |
CI =置信区间;PCC =后新冠肺炎条件。
研究人群包括瑞典最大的两个地区的所有成年(≥18岁)居民,新冠肺炎在2020年12月27日至2022年2月9日的研究纳入期内首次登记。
*校正了年龄、性别和感染时主要病毒变异的Cox比例风险回归模型。
†Cox比例风险回归模型根据年龄、性别、感染时的主要病毒变异、共病(糖尿病和心血管、呼吸和精神疾病)、2019年期间的医疗保健联系人数、出生地区、教育水平和就业状况进行了调整。
‡基于完全调整的模型。
§包括1-5剂。
¶进行的分析与未接种疫苗的对比。
为了通过降低因急性感染入院的风险来评估针对新冠长期症状的潜在疫苗有效性,我们将急性感染的严重程度(入院需要ICU入院,入院不需要ICU入院,无入院)加入回归模型。感染前任何剂量的校正风险比为0.54 (0.50至0.60),一剂、两剂和三剂或更多剂的校正风险比分别为0.81 (0.70至0.93)、0.53 (0.48至0.59)和0.42 (0.35至0.49)(见S3补充表)。然后,我们根据急性感染的严重程度对任何剂量的分析进行分层,结果在入院但未入住ICU组和未入院组之间得到相似的校正风险比(0.57(0.48-0.68)v0.56(分别为0.50至0.62)(见S4补充表)。
亚组和敏感性分析
在对最后一次接种疫苗和感染之间的中位时间(126天)进行分层的亚组分析中,与主要分析相比,新冠肺炎之前任何剂量的新冠长期症状疫苗效力在自最后一次给药以来的较长时间内略低,在较短时间内略高(≥126天:49%,< 126天:63%)(见补充表S5)。感染后最后一次接种超过126天的个体主要接受了两剂疫苗(0.1%接受了≥3剂疫苗,数据未显示)。当单独加入完整模型时,年龄、性别、新冠肺炎指数日期时的主要变量、就业状况、医疗联系人数、糖尿病和心血管疾病的交互项是显著的。男性显示出比女性更高的疫苗有效性(≥1剂:分别为64%和54%)。55-64岁年龄组的疫苗效力最高(≥1剂:69%),18-34岁年龄组最低(≥1剂:28%)。我们还对前显性变异体的感染进行了分层,发现在δ期,新冠肺炎个体的疫苗有效性最高(68%)(见补充表S4)。在对新冠肺炎之前的前两剂疫苗组合进行分层分析时,没有发现重大差异,调整后的风险比为0.43 (0.32至0.58)至0.49 (0.44至0.54);除了AZD1222和BNT162b2的组合(见补充表S6)。
在第一次敏感性分析中,我们将接种组限定为那些在新冠肺炎指数日期前至少14天接种疫苗的个体(n=265 299,占总接种组的88.5%),与主要分析相比,这仅略微改变了结果(见补充表S7)。在第二次敏感性分析中,我们将新冠肺炎指数日期和新冠长期症状诊断之间的时间限制在最少90天,这产生了与要求28天的分析相似的结果(见补充表S8)。最后,当我们将接种组限定为在感染前仅接种两到三剂疫苗的人群时,疫苗有效率为64%(见补充表S9)。
讨论
在这项包括来自瑞典两个最大地区的589 722名居民的大型登记队列研究中,我们发现在首次登记新冠肺炎之前接种疫苗与接受新冠长期症状诊断的风险降低之间有很强的相关性。在研究人群中,与感染前接种疫苗的人相比,未接种疫苗的人的新冠长期症状诊断比例几乎高4倍(1.4v0.4%).我们发现,在首次登记感染前给予的初级疫苗接种系列中的任何剂量(即,在推荐的时间表内给予的前两次剂量和第一次加强剂量)对新冠长期症状的疫苗有效性为58%。疫苗效力随着系列中的每一剂而增加:一剂为21%,两剂为59%,三剂或三剂以上为73%。
背景调查结果
针对新冠肺炎长期效应的疫苗有效性的少数早期研究大多显示了保护性效应,具有广泛的效应估计26,27,但是有些没有显示出全面的保护效果28,29。早期研究中包括的方法和数据是异质的,有局限性。研究人群很少以人群为基础,通常包括少量参与者30,31。在新冠肺炎之前,并不总是对不同疫苗剂量的不同效果进行分析27,32。因为随访期间的疫苗接种通常不是审查的标准,接种和未接种的个体都被包括在未接种组中。在本研究中,我们使用了589 722名个体的基于人群的存活数据,对疫苗接种和再感染进行了审查,并分别报告了任何剂量、一剂、二剂、三剂或更多剂的疫苗有效性。早期的研究通常缺乏新冠长期症状的明确定义,症状通常是自我报告的29-33,而我们使用基于注册的新冠长期症状临床诊断作为结果。此外,在早期的研究中,随访持续时间通常很短29,而在我们的研究中,从首次登记感染后的28天开始,中位随访时间为129天。最近的一项系统性综述得出结论,在12项纳入研究中的10项研究中,感染前接种新冠肺炎疫苗对新冠长期症状具有保护作用,对感染前给予的任何疫苗剂量,效果估计值在0.48至0.87之间11。由于研究之间的高度异质性和证据的低确定性,没有进行荟萃分析。然而,在其他系统综述中,荟萃分析包括了几个这样的研究,但是结果应该谨慎解释34,35。其中一项荟萃分析得出结论,与未接种疫苗相比,在新冠肺炎之前接种两剂疫苗与新冠长期症状风险较低相关,优势比为0.6434,感染前至少服用一剂的优势比为0.7135。
使用来自瑞典两个最大地区的全部成年人口的登记数据,我们表明在感染前接种新冠肺炎疫苗与接受新冠长期症状诊断的风险降低相关。当通过最后一次疫苗接种和感染之间的中位时间(126天)进行分层以评估近期和早期疫苗接种的潜在不同效果时,我们发现在新冠肺炎前126天接受最后一次疫苗剂量仍然与相对较高的新冠长期症状疫苗有效性相关,并且仅略低于主要分析。此外,为了确保疫苗接种和急性感染之间有足够的时间,在一项敏感性分析中,我们将接种人群限制为在新冠肺炎之前14天以上接受最后一次疫苗接种的人群,并且估计的疫苗效果与主要分析相比没有显著变化。此外,在主要分析中,我们只考虑了感染后至少28天的首次新冠长期症状诊断,但在敏感性分析中,我们要求感染后至少90天,结果相似。
研究表明,女性可能比男性对疫苗产生更强的免疫反应,36尽管这并不一定意味着对疾病的更好保护。在我们的研究中,男性显示出比女性更高的新冠长期症状疫苗效力。还没有完全确定新冠长期症状是否更有可能发生在特定的变异体上。然而,现有数据表明,感染omicron变异体的个体比感染其他变异体的个体发生新冠肺炎长期效应的风险更低37-39。然而,很难确定这种较低的风险是否与特定的变异有关,或者是以前感染或接种疫苗的免疫结果,或者是随访时间较短的结果。一项小型研究评估了新冠肺炎疫苗对新冠长期症状的保护作用,该研究包括了omicron期和早期感染的个体,并未显示出不同变异体之间的显著差异30。在目前的研究中,研究人群包括在α和δ变异占优势时,以及在部分前α期和后α期感染的个体。尽管在这些时期疫苗接种的覆盖面并不是均匀分布的,但对感染时显性变异的时期进行分层显示,与前α期和α期相比,在6月期对新冠长期症状的疫苗效力仅稍低。由于我们在分析中无法获得病毒测序数据,我们使用感染时间作为变异的替代。因此,在一些研究个体中引起急性感染的变异体可能被错误分类。
新冠长期症状的发病机制尚未阐明,但已经提出了与不同症状表现相关的几种机制,并且越来越明显,新冠长期症状患者是一个异质性群体。潜在的机制包括器官损伤、急性感染期间的异常免疫激活、其他病毒的再激活、系统性免疫改变、自身免疫以及由于病毒持续存在而导致的持续免疫激活40。确定发病机理可能会提示疫苗保护作用的潜在途径——例如,接种疫苗后急性感染期间病毒载量的减少可能会减少病毒的持久性,并产生持久的免疫激活。新冠长期症状的不同症状群可能具有不同的病因,因此疫苗效果的机制也不同。我们已经表明,几乎37%在ICU接受治疗的新冠肺炎患者随后被诊断为新冠长期症状16。新冠肺炎疫苗已被证明可以防止因新冠肺炎而住院41,这可能是疫苗发挥抗新冠长期症状保护作用的一种途径。在我们的分析中,疫苗对新冠长期症状的有效性似乎只能部分解释为住院风险的降低。此外,根据入院需求对急性疾病的严重程度进行分层分析表明,在没有ICU入院的入院组和没有入院的入院组中,疫苗的有效性相似。此外,一项研究表明,在新冠肺炎后接种疫苗的人比在新冠肺炎后12周未接种疫苗的人患前列腺癌的风险低26。这一点,以及本研究的发现,支持了新冠肺炎疫苗对新冠长期症状的保护作用可能有助于防止入院的保护作用之外的途径的假说。同样值得注意的是,不仅在确诊为新冠肺炎的患者中,而且在新型冠状病毒聚合酶链式反应测试结果不呈阳性的患者中,也经常观察到新冠长期症状的症状42。
这项研究的优势和局限性
目前的研究有几个优点。首先,我们使用了从高质量登记中收集的基于登记的数据,结果基本上没有随访损失,并且自我报告偏倚的风险较低。在瑞典,根据法律规定,必须在国家疫苗登记处登记每一剂新冠肺炎疫苗。因此,暴露数据(疫苗接种)特别全面和准确。其次,我们可以访问来自初级医疗保健以及住院和门诊专科医疗保健的个人水平数据。这在研究前列腺癌的诊断时非常重要,因为我们之前已经表明,瑞典大多数前列腺癌患者(> 85%)是在初级卫生保健中得到诊断的16。此外,为了充分说明寻求健康的行为以及新冠长期症状组是一个有偏见的医疗保健寻求者组的可能性,2019年的医疗保健联系人数量作为混杂因素包括在完整模型中。此外,这项研究是以人口为基础的,覆盖了瑞典最大的两个地区(斯德哥尔摩地区和瓦斯特拉特格兰德地区,占瑞典总人口的40%)。最后,大多数先前发表的研究调查了在新冠肺炎之前接种疫苗对新冠长期症状的保护作用,但这些研究都不能解释感染后接种疫苗的原因。如果不考虑这些疫苗接种,由于各组之间变得更加相似,对新冠长期症状的总保护作用可能会降低。通过将存活数据与国家疫苗接种登记处的疫苗接种数据结合使用,我们能够对急性感染后接种疫苗的个体进行审查。
本研究的局限性包括新冠长期症状和ICD-10诊断代码U09.9都相对较新,且该代码尚未在瑞典得到验证。新冠长期症状可能被过度诊断,也可能被诊断不足,这可能影响新冠长期症状作为一项结果指标的敏感性和特异性。如果这对未接种疫苗和已接种疫苗的个体的影响相当的话,这将导致结果的非差异错误分类,平均来说,这将导致对空值的一些偏差。然而,我们不能完全排除这样的可能性,即由于患者和医疗保健提供者对疫苗接种的保护作用的期望,接种疫苗的个体比未接种疫苗的个体接受新冠长期症状诊断的可能性更低,尽管这种偏差不太可能随着疫苗剂量的增加而增加,并在我们的结果中显示出强烈的剂量反应相关性。瑞典最近的一篇论文调查了具有新冠长期症状诊断代码的患者在新冠肺炎后的医疗保健使用情况,并与年龄、性别和感染前医疗保健接触次数匹配的对照组进行了比较,结果显示新冠长期症状组在新冠肺炎后有明显更多的医疗保健接触24。因此,我们认为新冠长期症状诊断代码的特异性可能是好的,而其敏感性仍然不太清楚。此外,与经历新冠长期症状谱中另一种症状的患者相比,经历特定症状的患者的疫苗效力可能不同。然而,如果疫苗的保护作用仅对新冠长期症状谱中的一些特定症状有效,那么我们在本研究中看到的对新冠长期症状诊断的相对强的作用就不太可能发生。一些研究还调查了疫苗接种对现有前列腺癌的影响,结果显示疫苗接种对前列腺癌症状既没有影响,也有缓解和加重的作用43-45。本研究中使用的基于注册的数据在症状方面的数据有限,因此很难评估已经存在的前列腺癌症状的变化。此外,尽管新冠长期症状是在特定的日期诊断的,但其状况和症状通常在诊断日期之前就已经存在。最后,我们的结果是基于首次新型冠状病毒感染,而再感染可能代表今天的大多数感染。新冠长期症状再感染对新冠肺炎疫苗效力的潜在影响仍有待阐明。
结论
这项研究发现,在感染前接受初级疫苗接种系列中的新冠肺炎疫苗剂量(即,在推荐的时间表内的前两次剂量和第一次加强剂量)与接受新冠长期症状诊断的风险降低之间有很强的相关性。在新冠肺炎之前的一系列注射中,疫苗的有效性随着剂量的增加而增加。这项研究的结果强调了针对新冠肺炎的完全初级疫苗接种覆盖的重要性,不仅降低了严重急性新冠肺炎感染的风险,还降低了人群中新冠长期症状的负担。
关于这个话题已经知道了什么
新冠肺炎疫苗对新型冠状病毒感染和急性新冠肺炎的严重表现的功效和效果已经得到证明
新冠肺炎疫苗对后新冠肺炎状态(新冠长期症状)的有效性很少使用基于人群的真实世界数据进行评估
这项研究增加了什么
这些发现表明,在新冠肺炎之前接受前三剂疫苗与接受新冠长期症状诊断的风险降低之间有很强的相关性
疫苗效力随着每次连续剂量的增加而增加
这些结果强调了针对新冠肺炎的初级疫苗接种对于减少人群中新冠长期症状负担的重要性
参考
2↵Regionernas planering avseende vaccinering mot covid-19, delrapport 6. [The planning regarding vaccination against Covid-19 for regions, report 6]. Stockholm, Sweden: Sveriges Kommuner och Regioner, SKR; 2021. https://skr.se/download/18.5bb54e0c179a302981232fd/1621980314035/Regionernas_planering_%20vaccinering_covid-19_delrapport%206.pdf
3↵Baden LR, El Sahly HM, Essink B, et al., COVE Study Group. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med2021;384:403-16. doi:10.1056/NEJMoa2035389. pmid:33378609CrossRefPubMedGoogle Scholar
4↵Polack FP, Thomas SJ, Kitchin N, et al., C4591001 Clinical Trial Group. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med2020;383:2603-15. doi:10.1056/NEJMoa2034577. pmid:33301246CrossRefPubMedGoogle Scholar
5↵Falsey AR, Sobieszczyk ME, Hirsch I, et al., AstraZeneca AZD1222 Clinical Study Group. Phase 3 Safety and Efficacy of AZD1222 (ChAdOx1 nCoV-19) Covid-19 Vaccine. N Engl J Med2021;385:2348-60. doi:10.1056/NEJMoa2105290. pmid:34587382CrossRefPubMedGoogle Scholar
6↵Abu-Raddad LJ, Chemaitelly H, Butt AA, National Study Group for COVID-19 Vaccination. Effectiveness of the BNT162b2 Covid-19 Vaccine against the B.1.1.7 and B.1.351 Variants. N Engl J Med2021;385:187-9. doi:10.1056/NEJMc2104974. pmid:33951357CrossRefPubMedGoogle Scholar
7↵Nittas V, Gao M, West EA, et al. Long COVID Through a Public Health Lens: An Umbrella Review. Public Health Rev2022;43:1604501. doi:10.3389/phrs.2022.1604501. pmid:35359614CrossRefPubMedGoogle Scholar
8↵Crook H, Raza S, Nowell J, Young M, Edison P. Long covid-mechanisms, risk factors, and management. BMJ2021;374:n1648. doi:10.1136/bmj.n1648. pmid:34312178Abstract/FREE Full TextGoogle Scholar
9↵Gentilotti E, Górska A, Tami A, et al., ORCHESTRA Study Group. Clinical phenotypes and quality of life to define post-COVID-19 syndrome: a cluster analysis of the multinational, prospective ORCHESTRA cohort. EClinicalMedicine2023;62:102107. doi:10.1016/j.eclinm.2023.102107. pmid:37654668CrossRefPubMedGoogle Scholar
10↵Soriano JB, Murthy S, Marshall JC, Relan P, Diaz JV, WHO Clinical Case Definition Working Group on Post-COVID-19 Condition. A clinical case definition of post-COVID-19 condition by a Delphi consensus. Lancet Infect Dis2022;22:e102-7. doi:10.1016/S1473-3099(21)00703-9. pmid:34951953CrossRefPubMedGoogle Scholar
11↵Byambasuren O, Stehlik P, Clark J, Alcorn K, Glasziou P. Effect of covid-19 vaccination on long covid: systematic review. BMJ Med2023;2:e000385. doi:10.1136/bmjmed-2022-000385. pmid:36936268Abstract/FREE Full TextGoogle Scholar
12↵Ludvigsson JF, Otterblad-Olausson P, Pettersson BU, Ekbom A. The Swedish personal identity number: possibilities and pitfalls in healthcare and medical research. Eur J Epidemiol2009;24:659-67. doi:10.1007/s10654-009-9350-y. pmid:19504049CrossRefPubMedWeb of ScienceGoogle Scholar
13↵National Board of Health and Welfare. Statistik om tillstånd efter covid-19, 2021.
16↵Bygdell M, Leach S, Lundberg L, et al. A comprehensive characterization of patients diagnosed with post-COVID-19 condition in Sweden 16 months after the introduction of the International Classification of Diseases Tenth Revision diagnosis code (U09.9): a population-based cohort study. Int J Infect Dis2023;126:104-13. doi:10.1016/j.ijid.2022.11.021. pmid:36410693CrossRefPubMedGoogle Scholar
17↵Nyberg F, Franzén S, Lindh M, et al. Swedish Covid-19 Investigation for Future Insights – A Population Epidemiology Approach Using Register Linkage (SCIFI-PEARL). Clin Epidemiol2021;13:649-59. doi:10.2147/CLEP.S312742. pmid:34354377CrossRefPubMedGoogle Scholar
18↵Statistics Sweden. Folkmängd i riket, län och kommuner 31 December 2021 [och befolkningsförändringar 2021]. https://www.scb.se/hitta-statistik/statistik-efter-amne/befolkning/befolkningens-sammansattning/befolkningsstatistik/pong/tabell-och-diagram/folkmangd-och-befolkningsforandringar-helarsstatistik/folkmangd-i-riket-lan-och-kommuner-31-december-2021-och-befolkningsforandringar-2021/ (accessed 2 June 2023).
19↵Folkhälsomyndigheten. De flesta åtgärder mot covid-19 [upphör den 9 februari]. https://www.folkhalsomyndigheten.se/nyheter-och-press/nyhetsarkiv/2022/februari/de-flesta-atgarder-mot-covid-19-upphor-den-9-februari/
20↵Sveriges kommuner och regioner. Regionernas planering avseende vaccinering mot covid-19, delrapport 6 2021. https://skr.se/download/18.5bb54e0c179a302981232fd/1621980314035/Regionernas_planer%20ing_%20vaccinering_covid-19_delrapport%206.pdf
22↵Xu Y, Li H, Kirui B, et al. Effectiveness of COVID-19 Vaccines over 13 Months Covering the Period of the Emergence of the Omicron Variant in the Swedish Population. Vaccines (Basel)2022;10:2074. doi:10.3390/vaccines10122074. pmid:36560484CrossRefPubMedGoogle Scholar
23↵Spetz M, Lundberg L, Nwaru C, et al. An intersectional analysis of sociodemographic disparities in Covid-19 vaccination: A nationwide register-based study in Sweden. Vaccine2022;40:6640-8. doi:10.1016/j.vaccine.2022.09.065. pmid:36210254CrossRefPubMedGoogle Scholar
24↵Hedberg P, Granath F, Bruchfeld J, et al. Post COVID-19 condition diagnosis: A population-based cohort study of occurrence, associated factors, and healthcare use by severity of acute infection. J Intern Med2023;293:246-58. doi:10.1111/joim.13584. pmid:36478477CrossRefPubMedGoogle Scholar
25↵CoVariants. Overview of Variants in Countries. [updated 13 June 2023, accessed 22 June 2023]. https://covariants.org/per-country?variant=21A+%28Delta%29&variant=21K+%28Omicron%29&variant=21L+%28Omicron%29&variant=22A+%28Omicron%29&variant=22B+%28Omicron%29&variant=22C+%28Omicron%29&variant=22D+%28Omicron%29&variant=22E+%28Omicron%29&variant=22F+%28Omicron%29&variant=23A+%28Omicron%29&variant=23B+%28Omicron%29 (accessed 22 June 2023).
26↵Simon MA, Luginbuhl RD, Parker R. Reduced Incidence of Long-COVID Symptoms Related to Administration of COVID-19 Vaccines Both Before COVID-19 Diagnosis and Up to 12 Weeks After.medRxiv2021:2021.11.17.21263608. doi:10.1101/2021.11.17.21263608CrossRefGoogle Scholar
27↵Al-Aly Z, Bowe B, Xie Y. Long COVID after breakthrough SARS-CoV-2 infection. Nat Med2022;28:1461-7. doi:10.1038/s41591-022-01840-0. pmid:35614233CrossRefPubMedGoogle Scholar
28↵Taquet M, Dercon Q, Harrison PJ. Six-month sequelae of post-vaccination SARS-CoV-2 infection: A retrospective cohort study of 10,024 breakthrough infections. Brain Behav Immun2022;103:154-62. doi:10.1016/j.bbi.2022.04.013. pmid:35447302CrossRefPubMedGoogle Scholar
29↵van der Maaden T, Mutubuki EN, de Bruijn S, et al. Prevalence and Severity of Symptoms 3 Months After Infection With SARS-CoV-2 Compared to Test-Negative and Population Controls in the Netherlands. J Infect Dis2023;227:1059-67. doi:10.1093/infdis/jiac474. pmid:36477364CrossRefPubMedGoogle Scholar
30↵Azzolini E, Levi R, Sarti R, et al. Association Between BNT162b2 Vaccination and Long COVID After Infections Not Requiring Hospitalization in Health Care Workers. JAMA2022;328:676-8. doi:10.1001/jama.2022.11691. pmid:35796131CrossRefPubMedGoogle Scholar
31↵Ballouz T, Menges D, Kaufmann M, et al. Post COVID-19 condition after Wildtype, Delta, and Omicron SARS-CoV-2 infection and prior vaccination: Pooled analysis of two population-based cohorts. PLoS One2023;18:e0281429. doi:10.1371/journal.pone.0281429. pmid:36812215CrossRefPubMedGoogle Scholar
33↵Antonelli M, Penfold RS, Merino J, et al. Risk factors and disease profile of post-vaccination SARS-CoV-2 infection in UK users of the COVID Symptom Study app: a prospective, community-based, nested, case-control study. Lancet Infect Dis2022;22:43-55. doi:10.1016/S1473-3099(21)00460-6. pmid:34480857CrossRefPubMedGoogle Scholar
34↵Watanabe A, Iwagami M, Yasuhara J, Takagi H, Kuno T. Protective effect of COVID-19 vaccination against long COVID syndrome: A systematic review and meta-analysis. Vaccine2023;41:1783-90. doi:10.1016/j.vaccine.2023.02.008. pmid:36774332CrossRefPubMedGoogle Scholar
36↵Klein SL, Marriott I, Fish EN. Sex-based differences in immune function and responses to vaccination. Trans R Soc Trop Med Hyg2015;109:9-15. doi:10.1093/trstmh/tru167. pmid:25573105CrossRefPubMedGoogle Scholar
37↵Hernández-Aceituno A, García-Hernández A, Larumbe-Zabala E. COVID-19 long-term sequelae: Omicron versus Alpha and Delta variants. Infect Dis Now2023;53:104688. doi:10.1016/j.idnow.2023.104688. pmid:36858287CrossRefPubMedGoogle Scholar
38↵Jassat W, Mudara C, Vika C, et al. A cohort study of post-COVID-19 condition across the Beta, Delta, and Omicron waves in South Africa: 6-month follow-up of hospitalized and nonhospitalized participants. Int J Infect Dis2023;128:102-11. doi:10.1016/j.ijid.2022.12.036. pmid:36587841CrossRefPubMedGoogle Scholar
39↵Antonelli M, Pujol JC, Spector TD, Ourselin S, Steves CJ. Risk of long COVID associated with delta versus omicron variants of SARS-CoV-2. Lancet2022;399:2263-4. doi:10.1016/S0140-6736(22)00941-2. pmid:35717982CrossRefPubMedGoogle Scholar
40↵Altmann DM, Whettlock EM, Liu S, Arachchillage DJ, Boyton RJ. The immunology of long COVID. Nat Rev Immunol2023;23:618-34. doi:10.1038/s41577-023-00904-7. pmid:37433988CrossRefPubMedGoogle Scholar
41↵Zheng C, Shao W, Chen X, Zhang B, Wang G, Zhang W. Real-world effectiveness of COVID-19 vaccines: a literature review and meta-analysis. Int J Infect Dis2022;114:252-60. doi:10.1016/j.ijid.2021.11.009. pmid:34800687CrossRefPubMedGoogle Scholar
42↵Magnusson K, Turkiewicz A, Flottorp SA, Englund M. Prevalence of long COVID complaints in persons with and without COVID-19. Sci Rep2023;13:6074. doi:10.1038/s41598-023-32636-y. pmid:37055494CrossRefPubMedGoogle Scholar
43↵Ayoubkhani D, Bermingham C, Pouwels KB, et al. Trajectory of long covid symptoms after covid-19 vaccination: community based cohort study. BMJ2022;377:e069676. doi:10.1136/bmj-2021-069676. pmid:35584816Abstract/FREE Full TextGoogle Scholar
44↵Strain WD, Sherwood O, Banerjee A, Van der Togt V, Hishmeh L, Rossman J. The Impact of COVID Vaccination on Symptoms of Long COVID: An International Survey of People with Lived Experience of Long COVID. Vaccines (Basel)2022;10:652. doi:10.3390/vaccines10050652. pmid:35632408CrossRefPubMedGoogle Scholar
45↵Wynberg E, Han AX, Boyd A, et al., RECoVERED Study Group. The effect of SARS-CoV-2 vaccination on post-acute sequelae of COVID-19 (PASC): A prospective cohort study. Vaccine2022;40:4424-31. doi:10.1016/j.vaccine.2022.05.090. pmid:35725782CrossRefPubMedGoogle Scholar
https://www.bmj.com/content/383/bmj-2023-076990
Hits: 8

