Contents
LC16m8 (live-attenuated freeze-dried vaccinia) smallpox and mpox vaccine: interim guidance, 22 April 2025
一、疫苗基本信息
- 疫苗类型与用途
- LC16m8是第三代天花疫苗,近年获许可用于预防猴痘(mpox)。
- 成分:减毒活疫苗(牛痘病毒 LC16m8 株),通过细胞培养传代减毒,冻干制剂,不含防腐剂。
- 作用机制:通过皮肤划痕接种引发局部免疫反应(“take”),表现为红斑、水疱、结痂,作为接种成功的标志。
- 监管批准
- 日本 PMDA 于 1975 年批准用于天花(无年龄限制),2022 年扩展至猴痘预防。
- WHO 于 2024 年 11 月授予紧急使用清单(EUL),适用于 1 岁及以上人群。
二、适用人群与接种剂量
- 目标人群
- 常规接种:1 岁及以上免疫功能正常的非孕妇 / 非哺乳期成人。
- 高风险人群:接触猴痘病毒风险者(如医护人员、疫情地区居民)。
- 禁忌人群:孕妇、免疫缺陷者(如 HIV 感染者 CD4<200 cells/μL)、严重皮肤病患者、对疫苗成分过敏者(如明胶、链霉素、红霉素)。
- 接种剂量与途径
- 剂量:单剂 0.5 mL 复溶疫苗,含≥1.5×10 PFU 病毒颗粒,通过分叉针(bifurcated needle)皮肤划痕接种(非注射)。
- 部位:上臂三角肌处,使用无菌分叉针垂直皮肤穿刺 15 次,形成直径 5 mm 的接种区域。
三、接种程序与免疫效果
- 接种时间
- 基础免疫:1 剂即可,建议 1 岁以上接种。
- 应急接种:暴露后尽早接种(可能提供保护)。
- 间隔与加强:目前无明确加强接种建议,保护期数据尚不明确(动物研究显示可抵御致命攻击,但人类长期免疫数据缺失)。
- 免疫反应
- 局部反应(“take”):接种后 6-14 天出现,表现为红斑、水疱、结痂,发生率 90%-100%,是成功接种的标志。
- 血清转化:未接种过牛痘者接种后 30 天血清转化率达 100%,既往接种者为 60%。
- 保护起效时间:接种后 4 周达到最大免疫保护。
四、疫苗储存与复溶
- 储存条件
- 未开封:
- 长期储存:-20°C 冷冻(保质期 10 年)。
- 短期储存(如卫生机构):2-8°C 冷藏(从冷冻转移后保质期 2 年)。
- 复溶后:2-8°C 避光保存,6 小时内使用,不可冷冻。
- 运输:使用 WHO 预认证冷链箱,温度维持 2-8°C,避免光照和冻结。
- 未开封:
- 复溶步骤
- 使用随附的含 20% 甘油的注射用水复溶,轻轻旋转混匀,避免摇晃或接触橡胶塞。
- 复溶后为澄清或微浊的黄色 / 红色溶液,如出现沉淀需重新溶解(不可摇晃)。
五、操作注意事项
- 接种工具
- 分叉针:一次性无菌针,单剂使用,不可重复使用。WHO 暂未预认证分叉针产品,需确保包装无菌(如独立包装或 50 支 / 容器)。
- 避免污染:针头不可接触皮肤或非无菌表面,接种后立即丢弃于防刺锐器盒。
- 接种后护理
- 局部护理:保持接种部位干燥清洁,覆盖无菌纱布,避免抓挠或浸水(可淋浴但需防水贴覆盖),直至痂皮自然脱落。
- 观察期:接种后留观至少 15 分钟,监测过敏等严重不良反应。
六、安全性与不良反应
- 常见反应
- 局部:红斑、肿胀、硬结、水疱、结痂、淋巴结肿大(如腋窝)。
- 全身:发热、疲劳、皮疹,通常轻微自限。
- 严重不良反应
- 过敏反应(如荨麻疹、呼吸困难)、惊厥(发生率 < 0.1%)、严重皮肤反应(如多形红斑)。
- 处理:立即就医,备好 AEFI 急救包(含肾上腺素等)。
- 特殊人群注意事项
- 孕妇:禁用(活病毒可能致畸),优先使用非复制型疫苗(如 MVA-BN)。
- 哺乳期女性:权衡风险与收益,优先选择 MVA-BN。
- HIV 感染者:CD4≥200 cells/μL 且抗病毒治疗≥6 个月者可接种,否则禁用。
七、冷链与废弃物管理
- 冷链要求
- 严格遵循 2-8°C 储存,避免反复冻融,运输时使用保温箱和冷却剂。
- 复溶后疫苗需避光,置于泡沫垫中防止光照灭活病毒。
- 废弃物处理
- 生物危害:使用后的分叉针、疫苗瓶、棉签等均需作为生物危害废物,放入防刺盒或防渗容器。
- 消毒方法:高压灭菌、70% 酒精或 1:10 漂白剂消毒后,按国家指南处置,避免环境污染。
八、疫情应对与推广建议
- 疫情期间使用
- 优先用于高风险人群(如接触者、医护人员),可与其他公共卫生措施(如 WASH)结合。
- 暴发期间可考虑大规模接种,但需评估疫苗可及性、冷链能力及人群接受度。
- 沟通与培训
- 向公众普及接种后局部反应的正常性,避免对分叉针接种方式的误解。
- 培训接种人员严格遵循操作规范,避免交叉污染或接种错误。
九、总结
LC16m8(冻干牛痘减毒活疫苗)天花和 mpox 疫苗
临时指引 2025 年 4 月 22 日
目标受众
第一版临时指南主要供卫生当局、卫生工作者和参与 mpox 疫苗接种和物流的其他利益相关者在刚果民主共和国 (DRC) 和其他国家/地区部署相关 LC16m8 mpox 疫苗时使用。
概述
LC16m8 疫苗(也称为 LC16 或 LC16 KMB)是作为第三代天花疫苗开发的,最近获准用于对抗 mpox。它是一种冻干减毒活疫苗,1 最低复制性疫苗,含有 LC16m8 毒株,该毒株来源于牛痘病毒的李斯特毒株(实现全球天花根除的毒株之一),通过多次传代在细胞培养物中生长。在细胞培养物或活体动物中多次传代的过程提高了安全性。 与非复制疫苗相比,例如改良的牛痘安卡拉毒株(例如 MVA-BN),LC16m8 疫苗会产生与疫苗相关的局部皮肤反应——称为疫苗接受者的“接种”。它表现为不断发展的局部皮肤反应,最初表现为红斑和硬结,然后在疫苗接种部位发展为水泡和结痂.2 “接种”已被用作疫苗接种成功的“指标”。
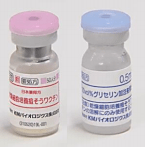
图 1.LC16m8 共包装疫苗(粉色)和稀释剂(蓝色)样品瓶
© KM Biologics Co., Ltd. 凯明生物制药有限公司
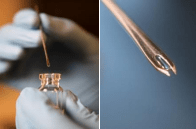
LC16m8 疫苗使用多次穿刺技术直接穿过皮肤接种,即 用无菌分叉针对上臂三角肌区域进行经皮瘢痕化(图 2)。分叉的针,即两尖的针,有一个扁平的末端,切成两个短尖。当针叉浸入疫苗中时,针叉之间的间隙可容纳一滴足以进行一次疫苗接种的疫苗。
由于 LC16m8 疫苗株于 1970 年代在日本开发,在发现最后一例天花病例后,在此期间评估其对天花有效性的机会有限。LC16m8 疫苗对天花和 mpox 的临床有效性是从间接证据中推断出来的。在四项研究中,通过分叉针头接种 LC16m8 疫苗后“接种”的疫苗接受者比例在 90% 到 100% 之间,出现在接种疫苗后 6 至 14 天。在接种疫苗后 30 天,达到血清转化率的 LC16m8 疫苗接种个体的比例从先前接种疫苗的参与者的 60% 到未接种牛痘的参与者的 100% 不等。接种 LC16m8 疫苗的人在接种 4 周后将对 mpox 产生最大的免疫力。目前,没有关于对 LC16m8 长期免疫持续时间的数据。动物研究表明,当动物接种 LC16m8 疫苗时,对 mpox 病毒的致命攻击具有保护作用。

图 2.在 1970 年代 WHO 根除天花加强疫苗接种运动期间使用了经皮疤痕技术。
建议有 mpox 暴露风险的个体接种一剂 LC16m8 疫苗。3 根据日本厚生劳动省 (MHLW) 于 1975 年发表的研究,在 10 578 名积极随访临床症状的儿童中未观察到令人担忧的不良反应.3 总共有 50 000 名儿童接种了 LC16m8 疫苗,没有报告严重不良事件。
疫苗的部署始终需要得到明确的风险沟通和社区参与策略的支持。对于 LC16m8 疫苗,这对于最大限度地减少对分叉针头不熟悉的接种模式的混淆和担忧尤为重要。
制造商: KM Biologics Co., Ltd,日本。
监管授权
日本药品和医疗器械管理局 (PMDA) 于 1975 年批准了无年龄限制的天花疫苗。
日本 PMDA 许可证被延长以预防 mpox: 2022 年 8 月 4 日
WHO 于 2024 年 11 月 19 日批准了 LC16m8 紧急使用清单 (EUL),供 10 岁以上的个人使用
1 岁及以上。
产品特点
| 介绍 | 多剂量小瓶冻干减毒活疫苗(冻干疫苗;无防腐剂)用于重建。 |
| 每瓶的剂量数 | 由于一滴小药就足以触发针对 mpox 的免疫反应,因此在需要大量人接种疫苗的情况下,每瓶 LC16m8 疫苗在用 0.5 mL 稀释剂复溶后,可以接种 250 剂或更多剂疫苗。应相应地计划疫苗接种时间,以最大限度地利用每个小瓶。出于安全原因和运营考虑,WHO 建议对打开的未保存复溶疫苗瓶应用多剂量瓶政策 (MDVP)。因此,打开的这种疫苗小瓶应在打开后 6 小时或免疫接种结束时丢弃,以先到者为准。 在此期间,应严格遵守感染预防和控制 (IPC) 措施。 请注意,包装说明书显示用 0.5 mL 复溶后,每瓶 50 剂或更多剂量(50 个受体或更多)。 |
| 疫苗接种针型 | 一次性使用无菌分叉针,用于经皮瘢痕化。不要通过注射接种 LC16m8 疫苗。 |
| 稀释剂 | 含 20 体积% 甘油的注射用水,装在含 0.5 mL 稀释剂的玻璃瓶中。稀释剂和疫苗瓶共同包装在一个盒子中。 |
| 混合注射器 | 带 21G–23G 针头的 1 mL 或 2 mL 防重复使用 (RUP) 注射器。 |
| 剂量 | 1 μL 液滴 (±0.5 μL) 复溶疫苗/剂量,含有不少于 1.5×105 个噬菌斑形成单位 (PFU)5。 |
稳定性和储存
| 疫苗和稀释剂的储存温度 | 中央和地方各级疫苗储存库: 将未开封的疫苗和稀释剂样品瓶保存在原包装盒中,并储存在 -20 °C 的冰箱中,以便长期储存并最大限度地延长保质期6。地区疫苗储存和卫生设施: 将未开封的疫苗和稀释剂样品瓶保存在原包装盒中,并存放在 +2 °C 至 +8 °C 的冰箱中。 在有效期内使用。 |
| 不同温度下的保质期 | 未开封的疫苗和稀释剂样品瓶: 未开封的冻存管存放在冰箱 (-20 °C):自生产之日起 10 年。 储存在冰箱(+2 °C 至 +8 °C)中的未开封样品瓶:自从冰箱转移到冰箱之日起 2 年。 复溶疫苗: 复溶疫苗瓶(+2 °C 至 +8 °C):复溶后 6 小时7。 |
| 多剂量样品瓶策略 (MDVP) | 在重建后 6 小时或免疫接种结束时丢弃疫苗瓶,以先到者为准。 |
| 冻结敏感度 | 未开封的样品瓶一旦储存在冰箱(+2 °C 至 +8 °C)中,请勿放回冰箱。不要冷冻复溶疫苗。 |
| 感光度 | 直接暴露在光线和阳光下可以完全灭活疫苗中的减毒活病毒。在冲溶之前、期间和之后避免暴露在阳光直射或阳光下。 请参阅“疫苗复溶期间的预防措施”部分。 |
| 疫苗浪费 | 取决于国家或地方情况。 |
| 所需的缓冲库存 | 取决于国家或地方情况。 |
标签和包装
| 疫苗瓶监测器 (VVM) | 没有。 | |||||
| 疫苗标签 | LC16m8 疫苗标籤可以日文书写(英文 LC16m8 包装说明书可在 WHO LC16 KMB 网页8 上找到)。 | |||||
| 二次包装尺寸和体积 | 纸箱内含 2 个样品瓶(1 个疫苗和 1 个共包装稀释剂)。尺寸:4.3 cm (L) x 2.8 cm (W) x 6.0 cm (H) 。 重量:19.5 克/纸箱。 | |||||
| 每个样品瓶的填充体积 | 每个疫苗瓶(包括共填充稀释剂)的填充体积为 72.3 cm3。 冷链总体积等于供应的西林瓶数量乘以 72.3 cm3。 | |||||
| 第三的 包装 尺寸 | 纸板箱 200 个纸箱。 尺寸:45.5 厘米(长)x 29.2 厘米(宽)x 14.5 厘米(高)。 重量:4.4 公斤/纸板箱。 | |||||
| ||||||
时间表和接种
| 适应症和 年龄 建议 | 在 mpox 暴发期间,建议有 mpox 暴露风险的个体接种 LC16m8 疫苗,包括 1 岁及以上的儿童和免疫功能正常的非妊娠/非母乳喂养成人。 WHO 建议,符合疫苗接种条件的个人应接种疫苗,无论之前是否有天花疫苗接种记录和/或是否有明显的天花疫苗疤痕,例如 45 岁以上的人群10。 | |||
| 接种路线和 疫苗接种点 | 使用无菌分叉针通过多次穿刺(15 次)技术(经皮疤痕化)经皮接种。首选的接种部位是上臂三角肌区域的皮肤。 | |||
| 建议数量 剂量/时间表 | 一剂。 | |||
| 加强剂量 | 尚未研究 LC16m8 疫苗对 mpox 的免疫持续时间。因此,没有证据推荐加强剂量。 | |||
| 疫苗 复溶 | 复溶前 • 复溶前,将共填充的疫苗和稀释剂样品瓶储存在 +2 °C 至 +8 °C 下。 • 目视检查疫苗和稀释剂标签信息和内容。11确保有效期未过。 • 始终保护疫苗避免直接暴露在光线或阳光下。请参阅“疫苗复溶期间的预防措施”部分。 复溶程序 • 打开疫苗和稀释剂样品瓶的塑料盖。 此时不要从疫苗瓶中取出铝盖和橡胶塞。 • 使用紧紧挤压的酒精棉签对疫苗和稀释剂瓶的橡胶塞及周围区域进行消毒,并在复溶前使其完全干燥。 • 使用无菌 RUP 注射器吸取 0.5 mL 稀释剂,并将其轻轻转移至疫苗瓶中。立即将用过的 RUP 注射器丢弃在防刺穿的锐器容器中。 • 轻轻旋转样品瓶,让疫苗充分溶解。 不要让疫苗接触橡胶塞。请勿摇晃样品瓶或将其倒置。 • 确认内容物已完全溶解,并检查复溶疫苗的外观。 它应为透明或微浑浊、淡黄色或微红色的溶液。 • 从复溶的疫苗瓶中完全取下铝盖(具有分体式结构)。 • 将重组的疫苗瓶放入疫苗载体中干净的泡沫垫中。 确保泡沫完全覆盖小瓶主体,并在不使用时盖住疫苗载体,以保护疫苗免受光线和污染物的影响。 | |||
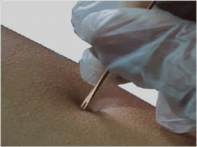
| 疫苗 接种 | 接种疫苗前• 筛查要接种疫苗的人是否有任何禁忌症(参见“禁忌症”部分)。 • 解释 LC16m8 疫苗的接种程序、“接种”反应的预期发展以及接种疫苗后其他可能的副作用或不良反应。 • 询问疫苗接种者或护理人员是否对这种疫苗或其接种方法有任何恐惧或担忧。如果需要,请解决这些问题。 使用无菌分叉针头接种疫苗的程序 12,13 • 疫苗接种员应专门根据会议期间预计接种疫苗的人数来接种疫苗。 • 每次接种疫苗前戴上一双新手套。 • 检查疫苗接种部位(即三角肌上方的上臂外侧)是否有炎症、受伤或污垢的迹象。如果需要,考虑另一个上臂。
• 用紧紧挤压的酒精棉球或酒精棉签清洁该部位,以准备该部位。 立即丢弃用过的棉球/酒精棉签,只使用一次。 • 使用干净、干燥的棉球擦去接种部位多余的酒精,以确保接种前完全干燥。酒精会使疫苗失活,并在接种过程中引起更多疼痛。 • 检查小瓶中的复溶疫苗。 不应有变色或任何颗粒物。如果已经形成沉淀物,请轻轻旋转小瓶以使其重新溶解,不要让液体疫苗接触橡胶塞。请勿摇晃或倒置样品瓶。 • 从重组的疫苗瓶中取出橡胶塞,并立即用无菌纱布包裹。不使用时,橡胶塞将用于覆盖和保护小瓶中的疫苗。 • 将重组的疫苗瓶保存在疫苗载体的泡沫垫中,以保持适当的疫苗温度,并防止其免受光照、污染或意外溢出。 • 检查分叉针的包装。 如果它看起来已损坏或之前打开过,请勿使用包装并将针头丢弃在锐器容器中。 • 从中取出分叉的针 包裹 叉端。请勿插入针头 如果它接触了任何皮肤或非 – 无菌表面。 • 浸入分叉的尖头 针头进入疫苗溶液收集 a 剂量.14 而针尖是图 5.接种 LC16m8 疫苗 使用分叉针 浸入溶液中,轻轻搅拌一次至 © PATH/Patrick McKern。 确保抽取疫苗液滴 叉齿之间(见图 5)。以 针出;使用时按住它 另一只手固定疫苗臂 疫苗将要接种的接收方接种。 • 握住疫苗接种者的手臂 在下面,用一只手绷紧 轻轻地皮肤。 调整对方的手腕位置 握住分叉针的手 图 6.接种 LC16m8 疫苗 垂直于皮肤(90° 角)。使用分叉针 © 谁。 • 将疫苗液滴转移到 用针尖轻轻接触皮肤表面(见图 6)。 • 通过沉积的疫苗滴剂在 5 毫米直径内轻轻但快速地刺破皮肤 15 次。 手持垂直于皮肤的分叉针,将握针的手手腕放在皮肤上,通过移动手腕刺破皮肤。可能会观察到少量血迹。接种部位大量出血表明疫苗接种技术不正确。 • 立即将用过的分叉针头丢弃在防穿刺锐器容器中。 这种针头没有防止重复使用的功能;必须小心确保它不会用于为他人接种疫苗。 • 接种 1-3 分钟后,使用干燥的棉球/纱布擦去皮肤上多余的疫苗和血滴。立即将用过的棉球/纱布丢弃在生物危害废物容器中。 • 用松散的干净纱布覆盖接种部位,并使用医用胶带将其固定到位。这将保护疫苗接种者和其他人免于徒手意外接触接种部位。 • 请勿用接触接种部位或疫苗的戴手套的手触摸您或其他人的任何部位。如果您或其他人触摸了该部位,请立即用肥皂和水或免洗手消毒液洗手。 • 在两次疫苗接种之间戴一副新手套,以防止牛痘病毒传播(即通过自体接种15或接触传播)或疫苗接种者的任何血源性感染。 • 如果队列中没有人,未达到 6 小时丢弃点,并且疫苗接种时间尚未结束,请更换疫苗瓶上的橡胶塞。如果橡胶塞明显脏污或接触过未消毒的环境,请勿使用橡胶塞。 接种疫苗后 • 适应症疫苗接种者停留至少 15 分钟观察免疫接种后是否有任何不良事件 (AEFI) 的迹象。请参阅“识别和减轻 AEFI 的风险”部分。 • 告知疫苗接种者或护理人员在疫苗接种点的预期“接种”,以及接种疫苗后可能出现的其他副作用。 • 建议疫苗接种者或护理人员在发生 AEFI 的情况下该怎么做,在哪里寻求信息和建议,并提供报告不良反应的联系方式。 • 向疫苗接种者或护理人员解释如何在家中照顾接种部位和接种疫苗后的“接种”。 接种疫苗后的“接种” “接种”是 LC16m8 疫苗接种后发生的一系列局部炎症反应。它代表疫苗的成功接种,通常表现为接种部位红斑、肿胀、硬结、水泡和结痂(见图 D)。 7)16 几项研究表明,90-100% 的 LC16m8 受体都会发生 “获取”。接种疫苗后 3-4 天可能会观察到接种部位皮肤红斑或发红。但是,即使没有观察到 “接种”,也不建议重新接种疫苗。 | |||
 第 3 天至第 4 天 第 3 天至第 4 天 | 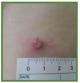 第 7 天至第 11 天 | 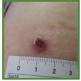 第 2-3 周 | 图 7.良好的接种 技术与完全有效的疫苗将在接种后 10-14 天内引起称为“接种”的反应 © KM Biologics Co., Ltd. 凯明生物制药有限公司 | |
安全信息
| 禁忌 | •孕妇。如果条件允许,任何有 mpox 暴露风险的孕妇(包括与 mpox 患者接触)都应接种 MVA-BN 疫苗。 • 发烧的人。 • 患有严重急性疾病的人。 • 对该疫苗的某种成分有过敏反应史的人。 • 免疫功能低下的儿童、青少年和成人: o 感染不受控制的 HIV 的人(例如 当前的 CD4 计数< 200 个细胞 μl)。 o 接受免疫抑制治疗的人(肾上腺皮质类固醇或免疫抑制药物,例如 活动性癌症的治疗)。 o 先前被诊断患有免疫缺陷的人,例如 白血病或艾滋病。 • 患有增生性皮肤病(例如 湿疹、特应性皮炎、烧伤、脓疱病、水痘或带状疱疹),可能会因疫苗而恶化。 • 除上述情况外,医生认为不适合接种疫苗的任何人。 |
| 特殊 人口群体 | • 作为一种最低限度复制的疫苗,建议为 1 岁或以上的儿童、青少年和免疫功能正常的非孕妇接种疫苗。 • 尚未在孕妇中研究 LC16m8 疫苗。怀孕期间接种 LC16m8 疫苗是禁忌的,因为尚未研究活牛痘病毒对胎儿的潜在影响。 • LC16m8 疫苗禁用于免疫功能低下的儿童、青少年和成人。没有对“不受控制”的 HIV 感染个体接种这种疫苗的经验(例如 CD4 计数为 < 200 个细胞/μL)。保健 • 工作人员应检查 HIV 感染者的 CD4 计数是否为 > 200 个细胞/μL,并且在接种 LC16m8 疫苗前至少 6 个月接受抗逆转录病毒治疗。MVA-BN mpox 疫苗(一种活的不可复制疫苗)可用于免疫功能低下的儿童、青少年和成人,包括“不受控制”的 HIV 感染者。 |
| 预防 措施 | • 任何符合以下任何标准的人,在进行医学评估并根据个人的健康状况和状况确定 LC16m8 疫苗接种的可取性后,应谨慎接种疫苗。应向他们提供有关接种疫苗的必要性和好处、可能的不良反应以及发生时该怎么办的充分解释。o 被诊断患有心血管疾病、肾病、肝病、血液病和发育障碍等基础疾病的人。 o 既往接种任何疫苗后 2 天内出现发热的人,以及出现与过敏一致的症状(例如全身皮疹)的人。 o 有抽搐病史的人。 o 近亲患有先天性免疫缺陷的人。 • 计划怀孕的妇女。卫生工作者应建议女性在接种 LC16m8 疫苗后 2 个月内避免怀孕。 • 母乳喂养的妇女。在进行疫苗接种之前,应在个体风险收益评估中考虑 LC16m8 疫苗接种对母亲的益处和母乳营养对婴儿的益处。在可用的情况下,母乳喂养妇女首选 MVA-BN mpox 疫苗。 • LC16m8 疫苗产品含有来自储备溶液的明胶 (≤ 0.15 w/v%)。据报道,接种含有明胶的疫苗会引起超敏反应,例如休克和过敏反应(荨麻疹、呼吸窘迫、嘴唇水肿和喉水肿等)。 • LC16m8 疫苗产品含有链霉素和红霉素作为添加剂。 对链霉素或红霉素敏感的人可能发生超敏反应。 |
| 疫苗的共同接种 | • 尚未研究 LC16m8 疫苗与其他疫苗的共同接种。• 不要与其他疫苗、皮质类固醇或免疫抑制药物一起服用。 • 如果在 28 天(即 4 周)内接种另一种减毒活疫苗,对另一种减毒活疫苗(例如麻疹、风疹、腮腺炎、水痘、卡介苗、黄热病疫苗)的免疫反应可能会受损(这不是安全问题)。然而,在 mpox 疫情应对的情况下,如果最近接种疫苗的人出席了会议,请在没有任何特定禁忌证的情况下继续接种 mpox 疫苗。 |
| 可能发生的不良事件 免疫接种 (AEFI) | • 副作用:发烧、疲劳、过敏反应/超敏反应(皮疹、瘙痒、多形性红斑)、局部反应(例如接种部位疼痛)等。• 常见的局部不良事件:皮肤发红(红斑)、皮肤和皮下组织的局部硬化或坚硬(硬结)、淋巴结肿胀(即 腋窝淋巴结肿大)。 • 严重不良事件:惊厥 (< 0.1%)、发热惊厥和严重的过敏反应或过敏反应(例如 荨麻疹、呼吸窘迫、嘴唇水肿和喉水肿)。 |
卫生工作者的重要提醒/其他重要信息
疫苗和稀释剂的储存和运输
| 该做 | |
| • 交货时检查疫苗和稀释剂的温度和身体状况。疫苗和稀释剂一起装在一个盒子里,然后是运送到 -30 °C 至 -20 °C 的冷冻国家。• 将疫苗和稀释剂样品瓶一起存放在原包装中并一起运输。删除只有在准备好重组和使用时才能从盒子中取出它们。 • 在 +2 °C 至 +8 °C 下运输疫苗 WHO 对带冷却剂袋的冷藏箱进行了资格预审17。 • 在 LC16m8 疫苗接种期间使用疫苗载体、泡沫垫和冷却剂包之前和之后,对它们进行清洁和消毒。 | • 请勿将共包装疫苗和稀释剂存放在 -35 °C 以下,因为橡胶塞可能会破裂。• 一旦将共包装疫苗和稀释剂储存在 +2 °C 至 +8 °C 的冰箱中,请勿将其退回冰箱。 它们应该在没有恢复到冻结储存状态。 • 不要冷冻复溶疫苗。 • 疗程结束后,请勿将未使用剂量的疫苗瓶放回冰箱。部分使用的样品瓶不应用于下一次治疗。 |
如果在重组后 6 小时内使用,每 0.5 mL 小瓶重组的 LC16m8 疫苗可提供 250 剂或更多剂量。仔细规划至关重要,包括提供同等数量的分叉针头、为每位接种人员提供一个安全处置容器以及充足的手套和其他推荐的感染预防控制材料,以确保遵守推荐的安全措施。
免疫接种团队在免疫接种过程中每瓶可以接种的实际剂量取决于几个因素:
• 目标群体的估计数量(会话大小)。
• 免疫接种策略:基于设施或非基于设施的免疫接种。
• 一名疫苗接种员在丢弃小瓶前 6 小时(360 分钟)内可以接种的剂量。
• 考虑到消毒、更换手套、完成多次穿刺接种技术的需要,每个个体一名疫苗接种员花费的时间。
• 疫苗接种团队成员的数量,包括卫生工作者和其他人员,以及他们之间的任务分配(例如人群控制/顾问、健康信息提供者、疫苗接种员和记录员)。
• 疫苗接种团队在会议之前或之后提供疫苗接种前/后指导所花费的时间。
• 可能的疫苗浪费率取决于计划的会话大小、疫苗接种人员数量、打开的样品瓶数量、可能发生的任何意外溢出、因任何原因丢弃的任何样品瓶。
• 基于当地情况的其他因素。
组织疫苗接种会议现场
• 由于接种方法、禁忌症和信息需求不同,在与 MVA-BN 疫苗接种不同的地点或时间进行 LC16m8 疫苗接种,以避免混淆。
• 考虑在卫生机构或疫苗接种站开展疫苗接种课程,以促进遵守良好做法,例如:
o 光线充足、通风良好的等候区和良好的人群控制。
o 系统地设置会议地点,以确保安全有效地进行疫苗接种和人员畅通。
o 为医护人员和会议现场的其他人提供消毒/洗手设施。
o 获得 AEFI 工具包以及充足的疫苗和物流供应,包括所有参与会议的疫苗接种人员的个人防护设备 (PPE)(例如手套)。
o 存在包含 mpox 疾病、预防和控制措施关键信息的视觉辅助工具,包括 AEFI 信息。
o 在疫苗接种期间有监督员。
• 确保一线卫生工作者和疫苗接种人员在可行的情况下提前或在免疫接种开始时接种疫苗。
• 确保所有参与免疫接种的医护人员都穿着推荐的个人防护装备(例如手套)并在接种疫苗之前、期间和之后遵循标准预防措施。
• 确保疫苗接种团队成员的数量足以满足计划的会议规模,并且疫苗接种员接受了使用分叉针头接种 LC16m8 疫苗的培训。
• 组织疫苗接种员的工作站,确保工作台清洁和消毒,所有用品和物流充足,并且接种员触手可及,包括消毒、洗手和安全废物处理设施。
• 确保指派卫生工作者为 AEFI 提供疫苗接种前健康筛查、咨询、记录和疫苗接种后观察。
• 如果免疫接种团队不是来自社区,请确保社区领导或指定成员知道如何在免疫接种后的 4 周内就任何问题或疑虑联系卫生团队。
免疫接种期间的一般预防措施
• 如果要连续接种大量个体,一个重组的疫苗瓶就足以在一次疫苗接种期间为 250 人或更多人接种疫苗。
• 由于污染风险高,不建议与其他疫苗接种员共用重组样品瓶或将部分内容物转移到另一个容器中。
• 避免 LC16m8 疫苗接触皮肤、眼睛和粘膜。
• 使用适当的冷却剂包(根据环境温度和疫苗载体类型),将复溶疫苗保存在疫苗载体中 +2°C 至 + 8°C 的温度下18,19。
• 将疫苗载体安全地放在工作台上,并放在儿童接触不到的地方。
• 如果疫苗意外洒在工作台上,请用注入酒精的棉花/纱布清洁溢出物,以净化表面,并立即将用过的棉花/纱布作为生物危害废物丢弃。戴手套做这个。记录事件和估计的剂量损失。
• 取下铝帽和橡胶塞后,必须立即使用疫苗。任何未使用的剂量应在复溶后 6 小时或免疫接种结束时丢弃,以先到者为准。将未使用的剂量保存在小瓶中并用橡胶塞盖住,然后在记录接种剂量和估计浪费的剂量数后,按照国家指南将小瓶作为生物危害废物丢弃。
疫苗重建过程中的预防措施
• 仅使用与疫苗共同包装的稀释剂。请勿使用其他疫苗的稀释剂来复溶 LC16m8 疫苗。
• 每位被指派为疫苗接种员的卫生工作者一次只能重新配制一个疫苗瓶。
• 在复溶过程中,只需旋转样品瓶即可。请勿摇晃样品瓶或将其倒置或让液体接触橡胶塞。
• 通过以下方式始终保护疫苗免受阳光直射:
o 将工作区设置在没有阳光直射或阳光直射的地方;
o 将未开封的疫苗和稀释剂保存在原来的盒子中,直到准备好重新配制;和
o 将重组的疫苗瓶放入疫苗载体的泡沫垫中。
• 用无菌纱布包裹橡胶塞,并放入疫苗载体内的拉链塑料袋中。
橡胶塞将用于覆盖和保护疫苗在不使用时免受溢出、暴露和污染。
接种疫苗前、接种疫苗期间和接种疫苗后的预防措施
| 该做 | |
| • 评估疫苗接种者的一般健康状况,并筛查怀孕、母乳喂养、免疫功能低下的情况(包括 HIV 状态)和其他禁忌症和预防措施。 • 为疫苗接种者和护理人员提供 接种疫苗前的推荐咨询信息 管理(见“咨询信息”部分)。 • 在每个疫苗瓶之前戴上一双新手套准备工作,并在可行的情况下,在疫苗接种之间。 • 立即用肥皂和水洗手,以防您不小心徒手接触接种部位或疫苗。 • 为每个疫苗接种者使用新的无菌分叉针头(参见“维护注射安全”部分 当使用分叉针时”)。 • 提醒疫苗接种者和护理人员如何在家中照顾接种点。 | • 请勿共用样品瓶。建议每瓶仅分配一名疫苗接种器。• 请勿通过注射器注射疫苗 皮内、皮下、 肌内或静脉内途径。LC16m8 疫苗有效 使用经皮疤痕化方法和分叉针接种。 |
使用分叉针头时保持注射安全性
| 注意事项 | |
| • 在为每个人接种疫苗之前,请戴上一副新手套。• 仔细阅读制造商的说明,并遵循所有产品特定的预防措施来使用分叉针。 • 仅使用新开封的无菌分叉 每个疫苗接种者的针头。该针头没有重复使用预防 (RUP) 功能 功能,并且不得重复使用。 • 立即将分叉的针头丢弃在防刺穿的锐器容器中(最好是 由耐用的塑料、金属或玻璃制成)。 • 提供独立包装的分叉针头,以确保整个疫苗接种过程中的无菌。 • 如果使用独立包装的无菌分叉 针头,只有在准备好接种疫苗时才能打开包装。 | • 请勿徒手触摸分叉的针头。• 不要对以前使用的分叉针头进行消毒。 • 请勿重复使用分叉针头。 • 请勿将分叉针头重新插入疫苗瓶。 • 请勿将分叉针头插入疫苗瓶的橡胶塞。相反,请取下塞子并将针头浸入小瓶中以获得剂量。 • 不要让带有一滴疫苗的分叉针头接触任何表面。用你的惯用手握住它,并使用你的非惯用手 用手固定疫苗接种者的手臂。 • 不要使用纸板安全箱,因为小针头可能会掉出来,湿针头可能会掉出来 污染容器。 |
目前没有分叉针产品经过 WHO 资格预审。
为接种人员提供独立包装的无菌分叉针头有助于确保使用新的无菌针头进行疫苗接种。
每个容器以 50 支一捆的形式提供的无菌分叉针头存在污染风险。使用本产品时,鼓励接种人员谨慎行事,严格遵守 IPC 和有效的疫苗管理良好实践;确保手套供应充足;和洗手液,和/或洗手设施的可用性。必须注意降低污染风险,并确保接种者和接种疫苗者的安全。
如果一个国家/地区使用的是 50 件装容器中的分叉针头,则需要采取以下额外预防措施。
• 使用新打开的分叉针头容器开始每次疫苗接种。请勿在上次疫苗接种期间打开的容器中使用剩余的未使用的针头。在从容器中取出另一根分叉针头之前,请先戴上一副新手套。
• 一次不要服用多于一根分叉针。
• 请勿将未使用的分叉针头重新插入容器中。在取出新的锐器之前,先将其丢弃在锐器容器中。
• 在打开后 6 小时或免疫接种结束时,将任何剩余的未使用的分叉针头丢弃在防刺穿锐器容器中。特别是在资源匮乏的环境中,一旦打开了包含 50 根针头的包装,就不能保证针头的无菌状态会在疫苗接种的另一天保持。
认识和降低 AEFI 的风险
进行疫苗接种前筛查和咨询
在疫苗接种期间,鼓励卫生工作者进行疫苗接种前健康评估,以确定是否存在任何禁忌症、预防措施以及对该疫苗产生不良反应的任何风险。它还提供了一个机会来倾听和解决疫苗接种者和护理人员的问题和疑虑。卫生工作者应彻底记录和审查患者的病史。这是通过以下方式完成的:
• 接种疫苗前检查疫苗接种者的状态:回顾病史,评估一般健康状况,询问怀孕状况、母乳喂养和任何免疫功能低下的情况,包括 HIV 状态(包括 CD4 计数、病毒载量,如果有),进行目视检查可能禁忌接种这种疫苗的增殖性皮肤病的迹象。
• 确定以前对其他疫苗的反应:确定疫苗接种者过去是否经历过任何副作用或疫苗接种后反应,包括晕厥或焦虑。为疫苗接种者提供提问和表达任何疑虑的机会。花时间回答问题并缓解焦虑。
• 评估超敏反应的风险:了解以下疫苗成分并确定疫苗接受者是否对其中任何一种过敏:
o LC16m8 含有来自储备溶液的明胶 (≤ 0.15 w/v%)。据报道,接种含有明胶的疫苗会引起超敏反应,例如休克和过敏反应(荨麻疹、呼吸窘迫、嘴唇水肿和喉水肿等)。
o LC16m8 含有链霉素和红霉素作为添加剂。对链霉素和红霉素敏感的人可能会发生超敏反应。
AEFI 的疫苗接种后观察
• 确保指派一名卫生工作者观察疫苗接种者是否有 AEFI 的迹象,并提供疫苗接种后咨询(见“咨询信息”部分)。
• 接种疫苗后,医护人员应建议疫苗接种者在接种地点停留至少 15 分钟以进行观察。
• 观察时间可用于提供有关如何在家中照顾接种部位以及在 AEFI 延迟发作的情况下该怎么办的信息。
• 如果出现症状,卫生工作者应进行适当的治疗。确保每次疫苗接种期间都有 AEFI 试剂盒。
识别和解决免疫应激相关反应
免疫应激相关反应 (ISRR) 是指应激反应的一系列体征和症状,包括焦虑。个人对压力的反应因人而异,也可能根据时间或环境而变化。与其他 AEFI 不同,ISRR 的症状可能发生在接种疫苗之前或之后,并且可能由几个人经历。当多人同时经历 ISRR 时,它会形成一组 ISRR,这可能会引起公众的关注并错误地与疫苗本身联系起来。
不建议停止免疫接种,因为这可能会加剧犹豫、错失机会并增加疫苗可预防疾病的风险。在服务提供点和社区内部进行清晰的双向沟通对于维持信任和接受至关重要(见“咨询信息”部分)。
卫生工作者应认识到以下与免疫接种相关的 ISRR 风险因素:
• 年龄 10-19 岁(但可能发生在此年龄组之外)。
• 血管迷走神经性晕厥史。
• 以前的负面经历(例如 来自疼痛或血管迷走性晕厥)和对注射的明显恐惧,包括血液注射损伤恐惧症;和一般的针头。
• 既往病症,如焦虑症和发育障碍(尤其是自闭症谱系障碍)。
预防 ISRR 在免疫接种之前就开始了,方法是收集相关数据,解决风险因素,并确保接受者感到舒适、消息灵通和位置正确。提供减少焦虑的选择也是关键20。
为疫苗接种者和照护者提供咨询信息
安抚和沟通
在某些情况下,卫生工作者/疫苗接种人员可能需要向疫苗接种者、照护者和其他相关人员提供安抚和信息。鼓励各国采用沟通策略。世卫组织猴痘疫情工具21中提供了资源,为卫生工作者提供信息和工具,以有效解决对猴痘和 LC16m8 疫苗的担忧和误解,包括关于据称不孕症、毒性和疤痕化过程的谣言。
疫苗接受者和照护者的一般信息
• LC16m8 疫苗不是新疫苗;它是作为一种更安全的疫苗版本开发的,在 1960 年代和 1970 年代有效地用于为人们接种天花疫苗。一小滴就足以触发针对天花和 mpox 的免疫反应。
• LC16m8 疫苗使用分叉针头接种,该针头有两个尖端,可容纳一滴疫苗并刺破皮肤多达 15 次。这种“多次穿刺技术”或“经皮瘢痕化技术”可确保适当吸收。
• 由于采用多次穿刺技术,注射部位有一小滴血是正常的。
• 从接种疫苗后的第 3 天到 1 个月,通常会在接种部位出现局部皮肤反应。该部位会在 3 到 4 天内首先出现红肿。到第 7 天到第 11 天,会形成水泡,然后在第 10 天到第 14 天之间变干并变成结痂。大多数人会在接种疫苗后 2 至 3 周内形成小疤痕。这种局部皮肤反应,称为“接种”,表明疫苗已成功接种。
• 自 1968 年以来开始使用分叉针头,在根除天花运动期间为数千万人成功接种疫苗。
• 所有疫苗都可能有副作用;然而,它们通常是轻微的,并且会自行消退。LC16m8 疫苗的常见副作用包括注射部位疼痛、发红、肿胀、起泡、结痂和瘙痒。这被称为 “take” 并且是预期的。一些接受者还可能会出现发烧或疲劳。
建议医护人员向 LC16m8 疫苗接种者提供建议
• 监测任何疫苗接种后反应(参见“AEFI 疫苗接种后观察”部分)。
• 如果您在接种部位出现高烧、抽搐或异常皮肤反应等严重症状,请立即就医。
• 接种疫苗当天避免剧烈运动。
• 请勿在接种疫苗当天或之后使用浴缸洗澡(将自己浸入水中)。这可能会使疫苗接种点暴露在水中,并可能污染浴缸,从而导致水平传播。允许用流水淋浴或沐浴,但要覆盖疫苗接种点(见下一节)。
• 接种 LC16m8 疫苗后 2 个月内避免怀孕。如果您在接种 LC16m8 疫苗后怀孕,请咨询医生。
• 请注意接种疫苗后 2 个月内无法献血。
• 在接种任何其他疫苗或药物治疗之前,请告知医生/医疗保健提供者您已接种 LC16m8 mpox 疫苗。
照顾疫苗接种点和可能受污染的材料
医护人员应向所有接种疫苗者和照护者提供以下说明:
• 保持接种部位干燥、清洁和松散覆盖。不要在该部位涂抹乳液、油或软膏。
• 避免抓挠或抠病变或周围皮肤。
• 用胶带松散固定的纱布完全覆盖疫苗接种部位,以允许空气流通。
• 预计疫苗接种地点会出现皮肤病变(“接种”)。这是正常的,发生在超过 90% 的接种疫苗的人中。它会在 3 到 4 周内自然愈合。
• 每 1 至 3 天更换一次纱布和敷料,或在它变湿或变脏时更换,以保持皮肤完整性并防止过多的水分积聚。
• 淋浴时用防水绷带或保鲜膜保护疫苗接种部位,并用胶带固定。不要清理网站。这样做直到结痂脱落。沐浴后,纱布湿了,换上新的纱布。
• 妥善处理弄脏的敷料。丢弃前,请将用过的纱布/绷带放入密封的塑料袋中。
• 避免触摸病变或受污染的物体,如绷带、敷料、衣服和床单,然后触摸眼睛、嘴巴、生殖器或肛门区域,因为这会传播病毒。
• 接触病变及其周围皮肤后或更换敷料后,用肥皂和水彻底洗手或使用免洗手消毒液(≥ 60% 酒精)。
• 使用蘸有清洁剂和/或漂白剂的热水单独清洗与疫苗接种点直接接触或皮肤病变引流物的衣服、毛巾和床上用品。
• 穿着覆盖疫苗接种地点的衣服,例如长袖衬衫,以降低牛痘病毒传播的风险,尤其是在密切接触(例如公共交通工具)期间,并防止阳光照射,这可能有助于减少疤痕形成。
• 保持疫苗接种部位被覆盖,直到结痂自然脱落。发生这种情况时,请将其妥善丢弃在密封的塑料袋中并立即洗手。
废物管理实务指引
在疫苗接种现场安全处理废物
由于 LC16m8 是一种减毒活疫苗,因此用过的针头和小瓶(丢弃时有或没有剩余剂量)都被视为生物危害性材料。
• 使用后立即将用过的分叉针头和复溶注射器丢弃在防刺穿锐器容器中。
• 将用过的疫苗瓶丢弃在防漏容器中。
• 丢弃与疫苗或疫苗接种部位直接接触或用过的针头的用过的棉球和其他非尖锐材料。
• 不要将废弃容器装得太满。当它们装满四分之三时密封并丢弃它们。指派专人监控填充水平并根据需要更换容器。
• 用“生物危害”贴纸或清晰的永久性记号笔清楚地标记所有生物危害废物容器(用于分叉针头、疫苗瓶和棉球)。
• 将非尖锐和非传染性废物分装到适当的颜色编码袋中。稀释剂样品瓶不具有生物危害性,应进行相应处理。
• 在运输之前,将传染性废物容器放入适当的颜色编码可密封塑料袋中,并将其存放在只有授权人员才能进入的安全区域,然后再进行最终处置。
• 遵循国家指导方针,进行适当的废物管理和分类。
在最终处置之前,对用过的分叉针头和疫苗瓶(有和没有剩余剂量)进行消毒和处置
以下是危险废物的消毒和最终处置选项:
• 高压灭菌:最终处置前的推荐消毒方法。将指定用于用过的 RUP 重组注射器、分叉针头和疫苗瓶的处理容器放入高压灭菌器中。无需将它们从容器中取出。
• 用 70% 酒精或 1:10 稀释的漂白剂溶液消毒:无需从防漏废物容器中取出,即可在最终处置前将 70% 酒精或 1:10 漂白剂溶液倒入容器中,对用过的分叉针头、重组注射器和疫苗瓶进行消毒。当高压灭菌器不可用且废液容器由塑料、玻璃或金属等无孔材料制成时,建议使用此方法。如果容器由纸基或多孔材料制成,请勿使用此程序,因为它们可能会吸收消毒剂并影响密闭性。
• 焚烧:并非所有焚烧炉都适合焚烧金属。使用前检查设备规格。
• 封装:一种废物处理方法,将有害物质包装在由不透水和非反应材料制成的容器中。容器用混凝土、塑料或钢材密封,以便掩埋或储存。封装对于处理锐器、药物残留物和一些危险废物特别有用。
• 安全的坑埋:处置坑是专为放置和容纳废料而设计的挖掘或挖出区域。它们是工程结构,有助于将废物受控且安全地沉积在特定的安全位置。理想情况下,坑应该用围栏起来,以防止未经授权的进入或事故,并且应该安装在远离水源的地方。考虑所有其他更安全的选项何时不可用。
指导开发方法
本临时指南是根据现有技术文件制定的,包括:天花和 mpox
(正痘病毒)疫苗:WHO 立场文件(2024 年 8 月);WHO 对 LC16m8 疫苗的 EUL 的建议;WHO 批准的 LC16m8 产品说明书;在同行评审期刊上发表文章;以及来自 WHO、US-CDC 和制造商的现有 mpox 技术资源。在开发过程中咨询了相关的 WHO 和外部主题专家并做出了贡献。支持 mpox 应急响应的合作伙伴也审查了该文件并提供了意见。
资金
该产品的开发由 WHO 资助。
致谢
WHO 免疫疫苗和生物制品 (IVB) 部门感谢以下个人对本出版物编写的贡献:
起草和编辑团队: Maricel de Quiroz Castro、Rosamund Lewis、Ryoko Miyazaki-Krause、Judith Van Holten、Alba Vilajeliu。
贡献:
世卫组织总部: 阿尔图格·阿金、唐纳德·约瑟夫·布鲁克斯、豪尔赫·卡斯蒂利亚-埃切尼克、罗兰多·多明格斯·莫拉莱斯、卡门·罗德里克斯·埃尔南德斯、亚历山德拉·希尔、约阿希姆·玛丽亚·洪巴赫、苏莱曼·科内、安·林德斯特兰、丽莎·门宁、本尼迪克特·米林奇普、蒂姆·阮、凯瑟琳·奥布莱恩、伊丽莎白·普卢特、马达瓦·拉姆·巴拉克里希南、奥利维亚·图洛克、爱丽丝·维默。
世卫组织区域办事处: Reena Hemendra Doshi、Miluka Prasanjalee Gunaratna、Claude Mangobo、Harou Moussa、Sidy Ndiaye、Sheillah Nsasiirwe、Charles Shey Umaru Wiysonge(世卫组织非洲区域办事处);Khanal Sudhir(世卫组织东南亚区域办事处)。
评论家: Courtney Nora Sylvana Efire Emagha(非洲疾病预防控制中心);Kibamba Pitchum Nlandu (刚果民主共和国 MSPHP);Mugen Ujiie(NCGM,日本);Jarrahian, Clara Orndorff, Manjari Quintanar Solares (PATH);Surangani Abeyesekera、Aarunima Bhatnagar、Nagwa Hasanin、Imran Mirza、Ann Ottosen、Mariana Palavra、Deepa Vincent Petit、Risal Pokharel(儿基会);Brian Ajong、Thierno Oumar Fofana、Richard Fotsing、Jerry-Jonas Mbasha、Alhassane Toure(世卫组织刚果民主共和国国家办事处)。
利益申报
外部主题专家填写了一份意向声明。WHO 审查了每一项,并得出结论,没有一项技术产品不会引起与该技术产品所涵盖的主题相关的潜在或合理感知的利益冲突。
更新计划
除非提前修订,否则本临时指南自发布之日起 1 年内有效。早期更新的触发因素包括但不限于以下因素: 有关此疫苗使用的新信息的可用性、监管批准或许可的任何变化以及商品特性的更新。世卫组织将密切监测情况,以了解可能影响本临时指导意见的任何变化。
Bibliography
Eto A, Saito T, Yokote H, Kurane I, Kanatani Y. Recent advances in the study of live attenuated cell-cultured smallpox vaccine LC16m8. Vaccine. 2015;33(45):6106-11 (https://pubmed.ncbi.nlm.nih.gov/26319072/).
Fulginiti VA, Papier A, Lane JM, Neff JM, Henderson DA. Smallpox vaccination: a review, part I. Background, vaccination
technique, normal vaccination and revaccination, and expected normal reactions. Clin Infect Dis. 2003;37(2):241-50 (https://pubmed.ncbi.nlm.nih.gov/12856217/).
Fulginiti VA, Papier A, Lane JM, Neff JM, Henderson DA. Smallpox vaccination: a review, part II. Adverse events. Clin Infect Dis. 2003;37(2):251-71 (https://pubmed.ncbi.nlm.nih.gov/12856218/).
Grabenstein JD, Hacker A. Vaccines against mpox: MVA-BN and LC16m8. Expert Rev Vaccines. 2024;23(1):796-811
(Vaccines against mpox: MVA-BN and LC16m8 – PubMed).
Hashizume S. Development of the attenuated smallpox vaccine, LC16m8, Produced by Cell Culture. Modern Media.
2004;50(2);4-9 [translated from Japanese].
Kennedy JS, Gurwith M, Dekker CL, Frey SE, Edwards KM, Kenner J et al. Safety and immunogenicity of LC16m8, an attenuated smallpox vaccine in vaccinia-native adults. J Infect Dis. 2011;204(9):1395-402 (DOI:10.1093/infdis/jir527).
Kenner J, Cameron F, Empig C, Jobes DV, Gurwith M. LC16m8: an attenuated smallpox vaccine. Vaccine. 2006;24(47-
48):7009-22 (https://doi.org/10.1016/j.vaccine.2006.03.087).
KM Biologics, Japan. LC16 “KMB” vaccination procedure video English version (Smallpox / Mpox Vaccine (Lc16m8)
KM Biologics, Japan. LC16 “KMB” vaccination procedure video French version (Guide d’administration du vaccin contre la
LC16m8® package insert (English)
(https://www.hosp.jihs.go.jp/isc/vaccines/MNK/Vaccination_Procedure_Guideline_for_Lc16.pdf).
LC16m8® package insert (French)
(https://www.hosp.jihs.go.jp/isc/vaccines/MNK/Vaccination_Procedure_Guideline_French.pdf).
Morikawa S, Sakiyama T, Hasegawa H Saijo M, Maeda A, Kurane I et al. An attenuated LC16m8 smallpox vaccine:
analysis of full-genome sequence and induction of immune protection. J Virol. 2005;79(18):11873-91
(https://pubmed.ncbi.nlm.nih.gov/16140764/).
Morino E, Mine S, Tomita N, Uemura Y, Shimizu Y, Saito S et al. Mpox neutralizing antibody response to LC16m8 vaccine in healthy adults. NEJM Evid. 2024;3(3):EVIDoa2300290 (https://pubmed.ncbi.nlm.nih.gov/38411447/).
Nishiyama Y, Fujii T, Kanatani Y, Shinmura Y, Yokote H, Hashizume S. Freeze-dried live attenuated smallpox vaccine prepared in cell culture “LC16-KAKETSUKEN”: post-marketing surveillance study on safety and efficacy compliant with good clinical practice. Vaccine. 2015;33(45):6120-7 (https://doi.org/10.1016/j.vaccine.2015.09.067).
Okumura N, Ishikane M, Ujiie M, Ohmagari N. “Take” after LC16m8 for mpox. Int J Infect Dis. 2023;134:290-291 (DOI:10.1016/j.ijid.2023.07.005).
Pischel L, Martini BA, Yu N, Cacesse D, Tracy M, Kharbanda K et al. Vaccine effectiveness of 3rd generation mpox vaccines against mpox and disease severity: a systematic review and meta-analysis. Vaccine. 2024;42(25):126053
(https://pubmed.ncbi.nlm.nih.gov/38906763/).
Poland G, Kennedy RB, Tosh PK. Prevention of monkeypox with vaccines: a rapid review. Lancet Infect Dis.
2022;22(12):e349-e358 (https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(22)00574-6/fulltext)
Saijo M, Ami Y, Suzaki Y, Nagata N, Iwata N, Hasegawa H et al. LC16m8, a highly attenuated vaccinia virus vaccine lacking expression of the membrane protein B5R, protects monkeys from monkeypox. J Virol. 2006;80(11):5179-88
(https://pubmed.ncbi.nlm.nih.gov/16698998/).
Saito T, Fujii T, Kanatani Y, Saijo M, Morikawa S, Yokote H et al. Clinical and immunological response to attenuated tissue-cultured smallpox vaccine LC16m8. JAMA.2009;301(10):1025-33
(https://jamanetwork.com/journals/jama/fullarticle/183542).
Tomita N, Terada-Hirashima J, Uemura Y, Shimizu Y, Iwasaki H, Yano R et al. An open-label, non-randomized study investigating the safety and efficacy of smallpox vaccine, LC16, as post-exposure prophylaxis for mpox. Hum Vaccin Immunother. 2023;19(2):2242219 (https://www.tandfonline.com/doi/full/10.1080/21645515.2023.2242219).
WHO. WHO best practices for injections and related procedures toolkit. Geneva: World Health Organization; 2010
WHO. WHO policy statement: multi-dose vial policy (MDVP): handling of multi-dose vaccine vials after opening. Geneva:
World Health Organization; 2014 (https://iris.who.int/handle/10665/135972).
WHO. Global manual on surveillance of adverse events following immunization , 2016 update. Geneva: World Health Organization; 2016 (https://iris.who.int/handle/10665/206144).
WHO. Aide-memoire: infection prevention and control (IPC) principles and procedures for COVID-19 vaccination activities.
Geneva: World Health Organization; 2021 (https://iris.who.int/handle/10665/338715).
WHO. Brief overview of anaphylaxis as an adverse event following immunization (AEFI) and practical guidance on its identification, case management and response in a primary care setting. Geneva: World Health Organization; 2021
(https://iris.who.int/handle/10665/342195).
WHO. WHO Job aide: how to use a bifurcated needle to perform multiple puncture vaccination technique: job aid. Geneva: World Health Organization; 2022 (https://www.who.int/publications/m/item/how-to-use-a-bifurcated-needle-to-perform- multiple–puncture–vaccination–technique).
WHO. Smallpox and mpox (orthopoxviruses): WHO position paper. Weekly Epidemiological Record. 2024;34(99):429-456. Geneva: World Health Organization; 2024 (https://www.who.int/publications/i/item/who-wer-9934-429-456).
WHO. Mpox (monkeypox) outbreak toolbox. Geneva: World Health Organization; 2025
(https://www.who.int/emergencies/outbreak-toolkit/disease-outbreak-toolboxes/mpox-outbreak-toolbox)
WHO. Strategic Advisory Group of Experts on Immunization (SAGE): Monkeypox vaccines technical documents. Geneva: World Health Organization; 2025 (https://www.who.int/groups/strategic-advisory-group-of-experts-on- immunization/monkeypox-vaccines-technical-documents)
WHO, UNICEF. Promoting the exclusive use of injection safety devices for all immunization activities: Joint Policy
Statement Promoting the exclusive use of injection safety devices for all immunization activities. Geneva: United Nations
Children’s Fund and World Health Organization; 2019 (https://www.who.int/publications/m/item/joint–policy– statement–promoting-the-exclusive-use-of-injection-safety-devices-for-all-immunization-activities).
WHO. UNICEF. IFRC. How to achieve and sustain high uptake of mpox vaccination in outbreak settings. Geneva:
TechNet; 2025. (https://www.technet-21.org/en/resources/guidance/how-to-achieve-and-sustain-high-uptake-of-mpox- vaccination-in-outbreak-settings)
WHO, UNICEF, PATH. Guidance on selecting, commissioning and using freeze-preventative vaccine carrier. Geneva:
World Health Organization, United Nations Children’s Fund, PATH; 2021. (https://iris.who.int/handle/10665/347046)
Yamaguchi M, Kimura M, Hirayama M. Research on treatment of post inoculation adverse reactions and complications, study report of the inoculation study group-special study by the Ministry of Health, Labour and Welfare. [In Japanese]. J Clin Virol. 1975;3:269-279.
© World Health Organization 2025. Some rights reserved. This work is available under theCC BY-NC-SA 3.0 IGOlicence. Suggested citation. LC16m8 (live-attenuated freeze-dried vaccinia) smallpox and mpox vaccine: interim guidance, 22 April
- Geneva: WorldHealthOrganization; 2025.https://doi.org/10.2471/B09388
1 Live-attenuated vaccines are prepared by using live viruses whose toxicity is extremely weakened.
2 Smallpox and mpox (orthopoxviruses): WHO position paper (https://www.who.int/publications/i/item/who-wer-9934-429-456)
3 Recommendation for an Emergency Use Listing of freeze-dried smallpox vaccine prepared in cell culture LC16 “KMB” (mpox- lc16m8_tag-report-19-11-2024-final.pdf).
4 The extension was granted based on the report on the deliberation results for LC16 KMB conducted by the Pharmaceuticals and Medical Devices Agency in Japan in August 2022 (https://www.pmda.go.jp/files/000247943.pdf.).
5 A plaque-forming unit (PFU) is a measure used in virology to describe the number of virus particles capable of forming plaques per unit volume.
6 Do not store at -35 °C or lower due to risk of the rubber stopper breaking.
7 The vaccine has proven to be stable for few hours at 37°C after reconstitution; however, an open vial should be discarded after 6 hours as per WHO MDVP.
8 LC16m8® package insert (English) (https://extranet.who.int/prequal/sites/default/files/document_files/package-insert_lc16- kmb_20241121_0.pdf)
9 This multi-packed (50 pieces) bifurcated needles was used in Japan.
10 Smallpox and mpox (orthopoxviruses): WHO position paper.
11 In case the label is written in a language other than English, refer to the English version of the package insert available in the WHO LC16 KMB product overview (https://extranet.who.int/prequal/vaccines/lc16-kmb).
12 WHO Job aide: how to use a bifurcated needle to perform multiple puncture vaccination technique. WHO; 2022
13 Video of vaccine administration using bifurcated needle published by DCCwebchannel: English
(https://www.youtube.com/watch?v=0Y1F9-E7zks&t=4s); French (https://youtu.be/2TwKtSxa3xA?si=a5HcUe8JhsrFG8Ac).
14 This droplet is not easily visible but as long as the needle is inserted into the reconstituted vaccine and moved around a bit, a droplet will be collected between the prongs.
15 Autoinoculation or ectopic inoculation refers to the movement of micro-organisms from one part of the body to another. In the context of LC16m8, it happens when the recipient or another person touches the site with their hand after vaccination and the vaccine virus spreads to other sites.
16 The absence of “take” represents unsuccessful inoculation. Erythema and induration alone are not considered as “take” .
17 The type of coolant packs to be use depends on the ambient temperature and type of cold box (regular or freeze-preventive type).
18 Vaccine management handbook: how to use passive containers and coolant-packs for vaccine transport and outreach operations. WHO; 2015 (https://iris.who.int/handle/10665/183584).
19 Guidance on selecting, commissioning and using freeze-preventative vaccine carriers. WHO; 2021 (https://www.who.int/publications/i/item/WHO-IVB-2021.02Rev.1/).
20 For more details see Immunization stress-related responses: a manual for program managers and health professionals to prevent, identify and respond to stress-related responses following immunization. WHO; 2019 (https://iris.who.int/handle/10665/330277).
21 Mpox (monkeypox) outbreak tool. WHO; 2025 (https://www.who.int/emergencies/outbreak-toolkit/disease-outbreak-toolboxes/mpox- outbreak-toolbox). Other relevant resources are available at TechNet: Mpox vaccination toolkit (https://www.technet-
21.org/en/topics/programme–management/mpox–vaccination–toolkit).
Hits: 153
- 生物类似药药学相似性研究的问题与解答(征求意见稿)
- 麻疹疫苗:世卫组织的立场文件
- 已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(预防用生物制品)
- 生物技术/生物制品在生产工艺变更前后的可比性
- 疫苗生产场地变更质量可比性研究技术指导原则
- 已上市疫苗药学变更研究技术指导原则(征求意见稿)
- 已上市生物制品药学变更研究技术指导原则(试行)
- 青少年免疫接种讨论指南
- 推荐的儿童和青少年免疫计划:美国,2025年:政策声明
- 儿童免疫接种讨论指南
- 建议用于出生至 6 岁儿童疫苗接种计划
- 脑膜炎(细菌性)和脑膜炎球菌病:识别、诊断和管理NICE指南更新摘要
- 轮状病毒疫苗:世卫组织立场文件-2021年7月
- 关于新冠肺炎疫苗抗原成分的声明 2024年12月
- 多糖结合疫苗药学研究及评价技术指导原则(试行)
- 疫苗临床试验统计学指导原则(试行)
- ACIP建议
- 药物临床试验样本量估计指导原则(试行)
- 预防用猴痘疫苗临床试验技术指导原则(试行)
- 美国胃肠病学会免疫抑制药物治疗期间乙型肝炎病毒再激活的预防和治疗指南
- 免疫抑制情况下的乙型肝炎再激活
- 使用自体配子降低生育治疗期间病毒传播风险的建议:委员会意见
- HBV筛查、检测和诊断
- 选择初始 HBV 治疗方案
- 何时开始HBV治疗
- 监测开始接受丙肝治疗、正在接受治疗或已经完成治疗的患者
- 慢性乙型肝炎患者的初步评估
- 疫苗说明书临床相关信息撰写指导原则(试行)
- 预防用猴痘疫苗药学研究技术指导原则(试行)
- 了解疫苗接种率的行为和社会驱动因素 世卫组织立场文件 – 2022年5月
- 2025年至2026年夏季新冠肺炎疫苗使用指南
- COVID-19 体征、症状和疾病严重程度:临床医生指南
- 预防和控制儿童流感的建议,2024–2025:政策声明
- 预防和控制儿童流感的建议,2024–2025:技术报告
- 卡介苗疫苗:世卫组织立场文件——2018年2月
- 减轻疫苗接种疼痛:世界卫生组织(WHO)立场文件—2015年9月
- 霍乱疫苗:世卫组织立场文件 – 2017 年 8 月
- 维生素A用于美国麻疹管理
- 生物制品注册受理审查指南(试行)
- 登革热疫苗:世卫组织立场文件 – 2024 年 5 月
- 白喉疫苗:世卫组织立场文件——2017年8月
- 世卫组织关于甲型肝炎疫苗的立场文件 – 2022年10月
- 世界卫生组织《根除特定类型脊髓灰质炎后遏制脊髓灰质炎病毒指南》 — 全球,2015 年
- 老年人 RSV 疫苗指南
- 英国2025年常规免疫计划
- 麻疹、腮腺炎、风疹疫苗 (PRIORIX):免疫实践咨询委员会的建议 — 美国,2022 年
- 2025 年推荐的7至18岁儿童和青少年免疫接种计划
- 乙型肝炎疫苗:世界卫生组织立场文件(2017 年 7 月)
- 全科医生带状疱疹疫苗接种计划技术指南
- AGA 关于预防和治疗高危人群乙型肝炎病毒再激活的临床实践指南
- 世界卫生组织关于戊型肝炎疫苗的立场文件(2015 年5 月)
- 世界卫生组织立场文件:b 型流感嗜血杆菌疫苗的接种(2013 年 7 月)
- 人乳头状瘤病毒疫苗:世卫组织立场文件(2022年更新)
- 2022年美国动物医院协会(AAHA)推荐的犬类疫苗指南
- 流感疫苗:世卫组织立场文件—— 2022年5月
- 日本脑炎疫苗:WHO 立场文件
- 猴痘临床指南
- 疟疾疫苗:世卫组织的立场文件
- 麻疹疫苗:世卫组织立场文件—2017年4月
- 脑膜炎球菌疫苗:世卫组织关于非洲脑膜炎地带国家使用多价脑膜炎球菌结合疫苗的立场文件,2024 年 1 月
- A 群脑膜炎球菌结合疫苗:更新后的指导意见(2015 年 2 月)
- 百日咳疫苗:世卫组织立场文件 – 2015 年 8 月
- 猴痘的临床管理与感染预防与控制 临时快速响应指南
- 老年人肺炎球菌疫苗接种考虑因素
- 肺炎球菌疫苗:世卫组织关于其在社区爆发环境中使用的立场文件
- 婴幼儿使用的肺炎球菌结合疫苗:世卫组织立场文件——2019年2月
- 脊灰疫苗:世卫组织立场文件 – 2022年6月
- 风疹疫苗:世卫组织立场文件——2020年7月
- 世界卫生组织关于破伤风疫苗的立场文件——2017 年 2 月
- 蜱传脑炎疫苗: 世卫组织立场文件 – 2011 年
- 伤寒疫苗:世卫组织立场文件 – 2018 年 3 月
- 水痘疫苗和带状疱疹疫苗: 世界卫生组织立场文件(2014年6月)
- LC16m8(冻干牛痘减毒活疫苗)天花和 mpox 疫苗:临时指南,2025 年 4 月 22 日
- 世卫组织关于黄热病疫苗的立场文件(2013 年 6 月)
- 黄热病疫苗:世卫组织对分次剂量使用的立场 – 2017 年 6 月
- 世卫组织关于免疫接种以保护婴儿感染呼吸道合胞病毒病的立场文件 2025 年 5 月
- 世卫组织接触者追踪指南
- 世卫组织关于带状疱疹疫苗的立场文件 – 2025 年 7 月
- 世卫组织立场文件:5岁以下婴幼儿肺炎球菌结合疫苗——2025年9月
- 世界卫生组织关于水痘疫苗的立场文件 ——2025 年 11 月
相关文章:
- ACIP 建议:正痘病毒(天花和 Mpox)疫苗
- 2025 年 4 月 30 日的 NACI 声明摘要:关于 2025-2026 年季节性流感疫苗的声明
- Jynneos 估计显示对 mpox 有很强的保护作用
- 疫苗概况:mpox
- Mpox:给旅行者的建议
- 免疫功能低下人群 mpox 的临床注意事项
- 储备 mpox 紧急情况
- 2024-2025 年 COVID-19 疫苗在 ≥18 岁成年人中的有效性中期估计 — VISION 和 IVY Networks,2024 年 9 月至 2025 年 1 月
- 2024-2025 年季节性流感疫苗有效性中期估计 — 四个疫苗有效性网络,美国,2024 年 10 月至 2025 年 2 月
- mpox–它是什么,它不是什么
- 结膜炎、视力受损、主要 mpox 眼部并发症
- Mpox:治疗严重病变
- 识别 mpox
- 填写 Mpox 相关死亡证明
- 2025 年推荐的7至18岁儿童和青少年免疫接种计划
Powered by YARPP.