Contents
Clinical Guidance for Smallpox Vaccine Use in a Postevent Vaccination Program
建议和报告
February 20, 2015 / 64(RR02);1-26
对应编制人:美国疾病预防控制中心新发和人畜共患传染病中心高后果病原体和病理学部门。电话:404-639-5464;电子邮件:ige3@cdc.gov.
摘要
本报告概述了美国国家战略储备中储存的三种天花疫苗的临床使用建议,适用于在有意或意外释放病毒后的事件后疫苗接种计划中暴露于天花病毒或面临天花感染高风险的人。在事后环境中接种天花疫苗没有绝对的禁忌症。然而,在患有某些疾病的人群中存在一些相对禁忌症。CDC关于天花疫苗使用的建议是在考虑了天花感染的风险、接种疫苗后不良事件的风险以及接种疫苗的益处后制定的。
天花疫苗是由预防天花疾病的活痘苗病毒制成的。它们不含天花病毒,天花的病原体。储存的三种天花疫苗是ACAM2000、Aventis Pasteur天花疫苗(APSV)和Imvamune。监测和遏制活动,包括接种具有复制能力的天花疫苗(即能够在哺乳动物细胞中复制的疫苗病毒,如ACAM2000和APSV)将是实现流行病控制的主要应对策略。
暴露于天花病毒的人具有发展和传播天花的高风险,应接种具有复制能力的天花疫苗,除非有严重的免疫缺陷。由于免疫反应不良的可能性很高,且不良事件的风险增加,因此,患有严重免疫缺陷且预计不会从疫苗中获益的人应避免接种天花疫苗,包括移植后4个月内的骨髓移植受者、CD4细胞计数< 50细胞/mm的HIV感染者3、以及患有严重联合免疫缺陷、完全性迪乔治综合征和其他需要隔离的严重免疫缺陷状态的人。如果抗病毒药物不能立即获得,在严重免疫缺陷者暴露于天花病毒的情况下,考虑使用Imvamune是合理的。
根据疫情的严重程度和公共卫生应对措施的有效性,没有已知天花病毒接触史的人仍可能处于发展为天花感染的高风险中。这些人将由公共卫生当局界定,并应筛查天花疫苗接种的相对禁忌症。相对禁忌症包括特应性皮炎(湿疹)、艾滋病毒感染(CD4细胞计数为50–199细胞/毫米3)、其他免疫受损状态以及疫苗或疫苗成分过敏。有相对禁忌症的人应接种Imvamune疫苗(如果有的话),并由食品药品监督管理局批准使用。随着有关天花疫苗的新数据的出现,以及包括抗病毒药物在内的其他医学对策的进一步临床指南的制定,这些建议将得到更新。
介绍
天花是一种发热性皮疹疾病,由正痘病毒天花 (1)。在人类历史的大部分时间里,该疾病导致高发病率和高死亡率,仅在20世纪就导致大约5亿人死亡(1,2)。20世纪60年代发起了一场密集的公共卫生疫苗接种运动,并成功地根除了作为人类疾病的天花(1)。因此,不再推荐常规的儿童天花疫苗接种,美国公众的疫苗接种于1971年停止(3)。
在强化天花根除运动期间,监测和控制策略的重点是对患者的密切接触者进行疫苗接种,并结合隔离和/或检疫(1)。美国最后一例天花是在1949年,世界上最后一例自然发生的天花是在1977年的索马里(1)。世界卫生组织(世卫组织)于1980年正式宣布该疾病为根部雕出的(1)。随后,所有剩余的天花病毒被整合到两个官方储存库中,目前保存在两个独立的世卫组织合作中心:位于俄罗斯新西伯利亚Koltsovo的国家病毒学和生物技术研究中心(VECTOR)和位于美国佐治亚州Atlanta的CDC(4)。
尽管自然发生的天花不再存在,但天花的威胁仍然存在,因为人们担心天花病毒可能存在于这些储存库之外,并可能被用作生物恐怖主义或生物战的媒介(5)。尽管人们认为故意或意外释放天花病毒的风险很低,但为潜在事件做好准备对于减轻此类事件的灾难性后果至关重要。美国政府已经购买并储备了天花疫苗,这些疫苗将在天花病毒传播时提供给高危人群。
在1991年、2001年和2003年,CDC发布了免疫实践咨询委员会(ACIP)的建议和关于天花疫苗及其在事件前疫苗接种计划(即没有天花病例的计划)中的使用的临床指南(6–9 ![]() )。然而,这些建议并没有完全解决天花疫苗在事件后应急环境中的使用问题,在这种情况下,世界任何地方发现的一例实验室确认的天花病例都需要按照《国际卫生条例》的规定紧急通知世卫组织(10)。
)。然而,这些建议并没有完全解决天花疫苗在事件后应急环境中的使用问题,在这种情况下,世界任何地方发现的一例实验室确认的天花病例都需要按照《国际卫生条例》的规定紧急通知世卫组织(10)。
天花疫苗是由预防天花疾病的活痘苗病毒制成的。它们不含天花病毒,天花的病原体。2007年,一种新的天花疫苗(ACAM2000)获得了食品药品监督管理局(FDA)的许可,并取代了之前获得许可的疫苗(Dryvax),后者随后被销毁(11)。此外,美国政府购买并储存了一种新开发的天花疫苗(Imvamune ),用于涉及天花的公共卫生紧急情况。出于这些原因,卫生保健提供者和公共卫生人员需要在事件后应急反应环境中使用这些疫苗的建议。
该指南概述了美国国家战略储备(SNS)中三种天花疫苗的临床使用建议,适用于有意或意外释放病毒后面临天花感染风险的人。储存的三种天花疫苗是ACAM2000、Aventis Pasteur天花疫苗(APSV)和Imvamune。监测和遏制活动,包括接种具有复制能力的天花疫苗(即能够在哺乳动物细胞中复制的疫苗病毒,如ACAM2000和APSV)将是实现流行病控制的主要应对策略。
方法
CDC与国家县市卫生官员协会(NACCHO)和美国儿科学会(AAP)合作,为目前储存在美国SNS的三种天花疫苗制定了事件后临床指南。成立了一个多机构指导委员会,由来自美国疾病预防控制中心、美国国家卫生研究院(NIH)、美国食品和药物管理局(FDA)以及负责准备和应对的助理国务卿办公室(ASPR)的代表组成,负责监督指南的制定过程。*2013年5月,召开了一次专家小组研讨会,由公共卫生、临床医学和公共政策方面的专家组成,以提供个人专家意见,为临床建议提供信息。这个40人的小组拥有天花和根除运动的历史知识;贡献了内科、家庭医学、皮肤病学、传染病、人类免疫缺陷病毒(HIV)医学、公共卫生、护理、妇产科和儿科的临床专业知识;并代表联邦政府机构,包括CDC、国防部(DoD)、NIH、FDA和ASPR。† 所有非联邦专家小组成员都完成了疾控中心批准的竞争利益披露表。联邦专家组成员有义务考虑与他们作为政府官员和雇员的官方行为相关的潜在利益冲突。在参加研讨会活动之前,指导委员会对所有披露利益冲突的小组成员进行了评估。指导委员会没有收到阻止参与者参与研讨会或制定指南的重大冲突或利益冲突的报告。然而,两名成员申报了潜在的竞争利益,如竞争利益披露声明中所述。指导委员会对这些活动进行了广泛审查,并确定在公开宣布这些活动后,这些参与者可以充分参与会议审议。
主题专家就天花和天花疫苗的各个方面进行了口头陈述,包括天花根除运动的回顾、美国政府疫苗应对策略、国防部天花疫苗接种计划的监测和研究数据、天花疫苗使用的监管考虑以及不良事件的发生率、严重性和治疗。疫苗制造商提交了数据并回答了专家小组成员的问题,但没有观察或参与会议的任何其他方面,以避免因潜在的利益竞争而产生偏见。临床指南开发的主要证据基础包括通过PubMed数据库的文献搜索、主题专家个人图书馆的手动搜索以及与疫苗制造商和研究人员的交流确定的相关研究。使用标准术语索引进行非系统文献搜索,涵盖术语“天花疫苗”、“ACAM2000”、“Imvamune”、“改良安卡拉痘苗”、“MVA”、“安万特巴斯德天花疫苗”和“APSV”
对确定的出版物进行筛选,以确定其相关性并满足预定义的纳入和排除标准。纳入标准包括任何已发表或未发表的涉及ACAM2000、Imvamune或Aventis Pasteur天花疫苗(APSV)的随机临床试验,美国自20世纪60年代以来使用Dryvax的监测数据,以及涉及特应性皮炎(湿疹)患者、HIV感染者、孕妇和儿科人群天花疫苗并发症的队列研究、调查研究、病例系列和病例报告。没有摘要的出版物、非英语的文章、政策指南、社论和评论文章被排除在外。向专家小组成员提供了文献摘要,包括不良事件发生率的数据(如有),以供审查。小组成员被要求运用他们的专业经验和临床判断来评估证据的质量和评估每种疫苗的风险和益处。
在研讨会之前,CDC和选定的专家小组成员根据文献综述和个人专家意见制定了建议草案,并在研讨会上作为启动讨论的框架进行了介绍。在研讨会期间,专家小组成员被要求在参与关于修改建议草案的讨论时考虑文献审查和陈述中的数据。然后,对这些建议草案进行了修订,以纳入专家在研讨会上对数据进行审查后提供的意见,并针对提出的新问题进行了调整。讲习班后的建议已分发给讲习班参与者以及各种专业组织和政府机构,供其审查和评论。本报告中包含的CDC最终建议代表了天花疫苗及其推荐用途的知识现状。随着更多关于疫苗安全性和有效性的数据可用,这些建议将得到更新。
背景
天花的发病机理和疾病
天花病毒是严格意义上的人类病原体,没有已知的动物宿主(1)。天花大菌株引起具有严重前驱症状、发烧和虚脱的疾病,而天花小菌株产生不太严重的感染(12)。在根除天花的运动中,世卫组织使用了四个主要的临床描述符来根据疾病表现和皮疹负担对由天花病毒引起的天花进行分类:普通型、改良型、扁平型和出血型(13)。
最常见的类型是普通天花,约占天花爆发病例的85(1)。普通天花的临床病程以持续10-14天(范围为7-17天)的无症状潜伏期为特征。发病通常表现为突然出现发热和不适,伴有头痛、背痛、腹痛、呕吐和咽炎症状(1)。这些前驱症状在首次出现粘膜和皮肤损伤之前持续了大约2-3天(1)。病变通常首先出现在口咽部,然后是面部和四肢,然后按照离心分布模式扩散到躯干、手掌和脚底。在4-5天的过程中,病变从斑疹发展到丘疹再到水疱。在接下来的1-2天内,水疱通常会形成脐状并发展成脓疱,这些脓疱是圆形的、紧绷的、摸起来很结实,并且深深地位于真皮内。在任何给定的时间,在身体的任何一个区域,损伤通常表现出相同的发展阶段(1,12)。结痂和痂形成通常在出疹的第九天开始,随后在皮疹发作后大约14天结痂脱落。
与普通天花相比,改良天花的特点是前驱症状较轻,病变较少,临床病程较短,这是由于以前的疫苗接种使疾病减弱或“改良”了。这种类型约占所有病例的5%-7%,很少致命(1,13)。天花的另一种轻微表现称为正弦出疹性天花,这种表现在以前接种过疫苗的人中很少见,其特征是发热而无皮疹。
相比之下,扁平天花通常是致命的,发生频率与改良天花相似(1,14)。扁平天花的病变发展缓慢,通常持续为柔软、天鹅绒般的无脓疱的小泡,通常合并成大的融合性水肿小泡斑(15)。扁平天花最常发生在免疫反应有缺陷的儿童身上,尽管没有研究证实这一点(1)。
最罕见(< 1%的病例)和最致命的形式是出血性天花。这种类型的天花涉及皮肤和粘膜的大面积出血,随后几乎总是在发病1周内死亡(12)。出血性天花大多发生在成年人中,尤其是孕妇(1)。来自印度住院患者大样本的接种和未接种受试者的临床型天花的相对频率和病死率已有描述(表1)。
天花死亡通常发生在患病的第二周。天花死亡的确切原因仍不清楚;最严重的出血性和扁平型疾病可能具有与普通天花不同的发病机理,可能与潜在的宿主免疫缺陷有关(1,16)。根据对病理记录的回顾性分析,病毒的细胞病变效应引起的肾衰竭、低血容量性休克和呼吸损害等并发症与天花死亡率有关(17)。与血浆中的病毒抗原以及抗原和抗体的免疫复合物相关的毒血症也被认为是导致疾病致死的因素(1,5)。流行病学研究表明皮疹病变的密度具有预后价值,因为较高的皮疹负荷预示着较高的死亡可能性(1)。人群研究表明,非常年轻和较大年龄组的病死率最高(18,19) (表2)。孕妇患严重疾病(尤其是出血性天花)的风险也很高,总病死率为34.3%,未接种疫苗的孕妇的病死率接近70%(1,20–22)。
天花的幸存者似乎有终身保护免于再次感染病毒(1,23)。相比之下,疫苗诱导的免疫在接种疫苗后的前1-3年最有效,完全保护不是终身的(1)。在暴露发生前接种疫苗的有效性接近100%,并且实质性的保护可能持续长达15-20年(1,12,24,25)。即使在暴露后施用,当施用给天花患者的接触者时,针对天花的疫苗接种似乎也能有效地预防和/或改善疾病。这种暴露后预防被认为在病毒暴露后尽快给药是最有效的,特别是在以前接种过疫苗的人能够产生记忆反应的情况下。根除时代的数据表明,暴露于病毒后> 3天接种疫苗的效果较差,但仍可能降低发病率和死亡率(26–29)。
天花传播和控制
天花病毒最常见的传播方式是通过面对面直接接触后的呼吸道飞沫从一个感染者传播给另一个人。口咽损伤的溃疡将大量病毒释放到唾液中(5,30)。病变发生后的前7-10天,病毒脱落率最高;因此,几乎所有的传播都发生在发疹之后(1,31,32)。极少情况下,天花病毒也通过空气传播或直接接触病变或被病变渗出物污染的污染物(如脏衣服或床单)传播(1,16,33)。传播主要发生在家庭、医院和其他卫生保健场所。不充分的感染控制措施可能在卫生保健相关传播病例中发挥了作用(34,35)。由于尚不清楚的原因,疾病的大规模爆发和病毒传播通常与学校、火车、飞机或公共汽车无关(5,36)。
在根除运动期间,监测和遏制战略被确定为应对疫情的关键组成部分。这些方法依赖于通过主动搜索病例快速识别天花患者,对感染风险高的人(如家庭成员和其他密切接触者)进行疫苗接种,严格隔离感染者以阻断传播链,并密切监测患者接触者的疾病发展。当这些措施得到有效实施时,即使在疫苗接种覆盖率低的地区(1,18)。根据暴发的流行病学特征或资源的可利用性,监测和控制有时辅以对受天花影响的当地地理区域的其他人的疫苗接种。虽然这种疫苗接种方法可能在发现和隔离病例之前减少了疾病传播的机会,但监测和遏制活动是实现流行病控制的主要策略。消灭天花这一人类疾病证明了监测和控制的有效性。
控制和预防
降低暴露风险
预计将根据美国疾病控制与预防中心天花应对计划和指南中的建议制定适当的公共卫生和感染控制措施(37)。这些措施可能包括隔离潜在暴露者、隔离感染者和使用个人防护设备。
接种疫苗
在确认一个或多个人类天花病例后,控制疾病传播的主要策略包括结合其他监测和控制活动使用天花疫苗。正如根除运动期间所证明的,天花疫苗接种所产生的免疫反应是阻止天花传播的最有效工具之一(1)。天花疫苗由防止天花疾病的活痘苗病毒制成(1)。它们不含天花病毒,天花的病原体(1)。美国政府在美国SNS中提供三种不同的天花疫苗:ACAM2000、Imvamune和Aventis Pasteur天花疫苗(APSV)。ACAM2000已获FDA许可,而Imvamune和APSV预计将在研究新药(IND)或紧急使用授权(EUA)监管机制下使用。尽管在紧急决定和声明到位之前不能发布EUA,但是FDA可以在正式的EUA申请之前审查提交的产品资料作为EUA前的资料(38)。
ACAM2000和APSV被认为是具有复制能力的痘苗病毒疫苗,因为它们具有在哺乳动物细胞中复制的能力。具有复制能力的疫苗与严重的不良事件相关,并产生感染性病变,这些病变可由于自身接种和无意传播而导致痘苗病毒感染。相反,Imvamune来源于复制缺陷型痘苗病毒株,该痘苗病毒株在组织培养中经多次传代而减毒,并丧失了在哺乳动物细胞中复制的能力(39–42)。开发了复制缺陷型疫苗,用于涉及系统性病毒传播(即进行性牛痘和接种性湿疹)的疫苗接种并发症高危人群(9 ![]() ,43
,43 ![]() )。对这些疫苗进行了描述和总结(表3)。
)。对这些疫苗进行了描述和总结(表3)。
ACAM2000
描述
ACAM2000,天花(牛痘)活疫苗,是一种牛痘病毒疫苗,来源于用于生产Dryvax疫苗的同一纽约市卫生局(NYCBOH)毒株的噬斑纯化克隆。ACAM2000在非洲绿猴肾(Vero)细胞中生长,并经测试不含已知的风险因子(44)。来自ACAM2000临床试验的可用安全性数据表明其安全性与Dryvax相似(45)。
ACAM2000作为纯化活病毒的冻干制剂提供,包含以下非活性赋形剂:6-8mM HEPES(pH 6.5-7.5)、2%人血清白蛋白USP、0.5%-0.7%氯化钠USP、5%甘露醇USP和痕量新霉素和多粘菌素B(46)。ACAM2000稀释剂在注射用水USP中含有50% (v/v)甘油USP和0.25% (v/v)苯酚USP。稀释剂以3毫升透明玻璃小瓶中0.6毫升液体的形式提供(46)。
给药和剂量
ACAM2000以单剂量(~2.5 uL)通过经皮途径(划痕)给药,使用15针浸入疫苗中的不锈钢分叉针头。该疫苗获准在三角肌上方的上臂施用。尽管历史上使用了天花疫苗施用的其他解剖部位,但在其他部位施用ACAM2000的功效尚未研究,也不为人所知。施用ACAM2000后,主要皮肤反应或“服用”的发展表明对疫苗的成功免疫反应(9 ![]() )。主要的皮肤反应的特征是在接种后6-8天内在接种部位出现水疱或脓疱。
)。主要的皮肤反应的特征是在接种后6-8天内在接种部位出现水疱或脓疱。
复溶后,每瓶ACAM2000疫苗包含约100剂(0.0025毫升/剂)。痘苗病毒的浓度为1.0–5.0 X108噬斑形成单位(PFU)/毫升或2.5–12.5 x 105PFU/通过Vero细胞蚀斑试验确定的剂量(46)。
监管状态
ACAM2000已于2007年8月获得FDA许可。使用ACAM2000的许可适应症是对被确定为具有天花感染高风险的人(无论年龄如何)进行天花疾病主动免疫(46)。
功效
ACAM2000的临床疗效基于两项关键的临床试验,证明其对Dryvax(试验时已获许可的天花疫苗)的非劣效性(47) (表4)。这些试验中评估的替代终点包括主要皮肤反应(即“服用”率)和血清中和抗体。ACAM2000符合这些试验中建立的四个主要终点标准中的两个。在未感染痘苗病毒的受试者中,ACAM2000被确定为在引发主要皮肤反应方面不劣于Dryvax。尽管ACAM2000和Dryvax在产生血清中和抗体反应方面表现出相似的趋势(第30天的GMT分别为166和255),但ACAM2000不符合针对该结果的非劣于Dryvax的预定义标准。在以前接种过疫苗的受试者中,ACAM2000在产生血清中和抗体反应方面被确定为不劣于Dryvax,但在引发主要皮肤反应方面不符合非劣性标准。主要的皮肤反应被认为是痘苗病毒未感染受试者有效免疫反应的主要决定因素(47)。然而,血清中和抗体反应可能是对以前接种过疫苗的受试者的免疫反应的更具信息性的测量,因为预先存在的免疫可改变对疫苗接种的皮肤反应,并增加了评估复种者中主要皮肤反应的难度(47)。因此,ACAM2000在两个最相关的替代终点(47)。提供了这些临床试验的总结(表4)。
安全
ACAM2000的安全性在6项临床试验中进行了评估,涉及2983名受试者(1307名未接种过牛痘病毒,1676名以前接种过疫苗) (44,47)。这些试验中施用的剂量范围为3.4×106到2.2 x 108PFU/毫升。没有死亡报告,严重的不良事件也很少发生(< 1%)。FDA将严重不良事件定义为导致永久残疾、住院、危及生命的疾病或死亡的事件(48)。最常见的严重不良事件是心肌炎/心包炎,7名接受ACAM2000的受试者报告了这一事件。由于积极监测这些并发症,3期临床试验提供了ACAM2000心肌炎/心包炎风险的最佳估计。这些研究在总共873名痘苗病毒阴性受试者中发现了5例疑似心肌炎和心包炎病例,发病率为每1000名初级疫苗接种者中5.7例。在先前接种疫苗的受试者中未发现心肌炎或心包炎病例。报告了其他三起被认为可能与ACAM2000有关的严重心脏事件,包括房颤、胸部不适和胸痛的单一报告。单一受试者新发癫痫发作也被报告为可能与ACAM2000相关的严重不良事件。然而,在该受试者中发现了被认为起作用的其他诱发因素。共有5名和1名ACAM2000受试者分别被发现怀孕和感染艾滋病毒。赛诺菲巴斯德赞助的研究仍在对接受ACAM2000的患者进行许可后不良事件监测,见www.clinicaltrials.gov![]() .
.
虽然ACAM2000的安全性尚未在HIV感染者中进行研究,但如果这些人受到免疫抑制,他们很可能会出现严重的疫苗并发症,包括进行性牛痘(接种部位皮肤和其他组织的进行性破坏)。据报告,一例播散性痘苗病毒感染发生在一名接受Dryvax初次疫苗接种的艾滋病毒感染者(49)。接种疫苗后3周对患者进行评估,并对其进行隐球菌性脑膜炎治疗;患者的CD4细胞计数< 25细胞/毫米3这时,又确诊感染了艾滋病病毒。该患者在接受静脉注射牛痘免疫球蛋白(VIGIV)治疗后存活,但第二年死于艾滋病毒的其他并发症。在评估ACAM2000的临床试验中,一名先前接种疫苗的人在接种疫苗时被确定为HIV阳性(50)。此人接受了预防性牛痘免疫球蛋白,并报告在接种疫苗后的3个月内没有明显的并发症。
ACAM2000尚未在孕妇中进行研究。据报道,接种了具有复制能力的天花疫苗的孕妇的胎儿和新生儿中存在胎儿牛痘。据记载,胎儿牛痘的病例不到50例,估计发病率在初级疫苗接种者中为1/10,000至1/100,000(1,51)。虽然胎儿牛痘是天花疫苗接种的一种罕见并发症,但据报道,这种并发症会导致胎儿和新生儿死亡(1,51)。对2003-2006年间因疏忽而接种了Dryvax疫苗的376名妇女的妊娠结局进行的分析未显示妊娠丢失、早产、低出生体重或出生缺陷的发生率高于预期(51)。五名接受ACAM2000的临床试验参与者在接种疫苗后30天内被确定怀孕,导致两名自然流产、一名活产和一名选择性终止妊娠;一名受试者失访(50)。未报告胎儿牛痘、先天性异常或出生缺陷(50)。在2例自然流产中,1例被认为与ACAM2000无关,且不能排除ACAM2000或接种牛痘免疫球蛋白与另1例有因果关系(50)。
ACAM2000在患有心脏病或心脏风险因素的人群中的安全性未知,因为这些人被排除在研究该疫苗的临床试验之外。在最近的疫苗接种活动中,在美国接种天花疫苗的文职和军事人员中,心脏并发症与可复制的天花疫苗(52,53)。尽管在具有复制能力的天花疫苗接受者中观察到了暂时性相关的心脏缺血和心肌梗死,但这些并发症的发生率似乎没有显著超过预期的背景率(54–56)。没有证据表明天花疫苗接种与心脏缺血或心肌梗死有因果关系。相比之下,肌心包炎与可复制的天花疫苗有关,使用ACAM2000的临床试验数据估计其发生率为每1000名初次接种者中有5.7人(44,57,58)。肌心包炎的严重长期后遗症似乎很少见,因为大多数病例都是轻度和自限性的,很少有扩张性心肌病(54,59)。
ACAM2000仅用于接受强化筛查以排除具有已知不良事件风险因素的患者。因为ACAM2000来自用于制造Dryvax疫苗的同一NYCBOH毒株,预计ACAM2000的安全性可能与Dryvax相似,如果不是完全相同的话。严重不良事件,包括脑炎、脑脊髓炎、脑病、进行性牛痘、泛发性牛痘、严重牛痘皮肤感染、多形性红斑(包括史蒂文斯-约翰逊综合征)、心肌炎/心包炎和牛痘性湿疹(牛痘病毒传播引起的湿疹或其他慢性皮肤病引起的严重破坏性皮肤感染),导致永久性后遗症或死亡、眼部并发症、失明和胎儿死亡,发生在初次接种或再次接种具有复制能力的天花疫苗(包括Dryvax)后(9 ![]() ,43
,43 ![]() ,46)。CDC在1968年进行的两项研究是评估常规天花接种Dryvax后不良事件发生率的最全面的研究之一。第一项研究依赖于向七个独立的国家监测系统被动报告疑似天花疫苗接种并发症的患者(60)。第二项研究实施了一个主动监测系统,要求10个州的所有医生记录他们在实践中看到的所有天花疫苗不良事件(61)。然后对医生进行调查,收集这些疫苗不良事件的报告。使用来自10项全州调查的主动监测观察到的不良事件率(表5和6)总体上高于被动国家监测计算的结果。与国家监测系统的被动数据收集相比,基于所采用的主动监测方法,从10次全州范围的调查中报告的比率通常被认为更准确(1,61)。复种后的不良事件发生率远低于初次接种(免疫缺陷患者除外)。
,46)。CDC在1968年进行的两项研究是评估常规天花接种Dryvax后不良事件发生率的最全面的研究之一。第一项研究依赖于向七个独立的国家监测系统被动报告疑似天花疫苗接种并发症的患者(60)。第二项研究实施了一个主动监测系统,要求10个州的所有医生记录他们在实践中看到的所有天花疫苗不良事件(61)。然后对医生进行调查,收集这些疫苗不良事件的报告。使用来自10项全州调查的主动监测观察到的不良事件率(表5和6)总体上高于被动国家监测计算的结果。与国家监测系统的被动数据收集相比,基于所采用的主动监测方法,从10次全州范围的调查中报告的比率通常被认为更准确(1,61)。复种后的不良事件发生率远低于初次接种(免疫缺陷患者除外)。
意外接种(包括自动接种和通过接触传播或污染物接种他人)是1968年期间最常报告的不良事件,发生率为每百万初次接种529.2例,在2002-2005年天花疫苗接种活动期间也有报告(46,53,61)。 (表5和7)由疏忽接种传播的痘苗病毒可导致与接种疫苗后相同的并发症。在某些情况下(例如,接种性湿疹),据报告,由接触传播导致的疾病比接种疫苗后的疾病更严重(60)。
最近的一项研究评估了2002年开始的天花疫苗接种活动期间接种Dryvax的美国军事人员和平民第一反应者的数据,表明严重不良事件的发生率总体低于1968年的发生率,特别是可预防的不良事件(例如,接种性湿疹、接触传播和自动接种) (53)。这些发现可能归因于目前更严格的接种前筛查程序,该程序旨在降低有疫苗禁忌症的成年人(年龄< 18岁的人未接种疫苗)的发病率,与20世纪60年代的常规疫苗接种实践相比,增加了保护性绷带的使用以覆盖疫苗接种部位,并加强了对接种者的教育。在以前的研究中,接种天花疫苗后心肌炎和心包炎并不常见,但最近在这些疫苗接种活动中被认为是一种潜在的严重不良事件。加强对不良事件的监测、更密切的监测和技术进步(例如,监测心电图、心脏超声和血清心肌酶)可能有助于在这些疫苗接种活动中增加心脏事件的检测。几乎所有在军队疫苗接种者中发现的肌心包炎病例都是无症状的。总结了本研究中严重不良事件的发生率(表7)。
安万特巴斯德天花疫苗
描述
APSV,也称为“WetVax”,是一种小牛淋巴来源的痘苗病毒疫苗的液体制剂,自1956年和1957年生产以来一直保持在-4°F(-20°C)(62)。APSV是从衍生自NYCBOH株的痘苗病毒原种(62)。最初的种子#17633是在1947年从密歇根卫生部门收到的。散装材料是在安万特巴斯德公司的许可下生产的,并在此前根据当时可接受的放行标准放行给国防部疫苗储备。该制剂包含在50%甘油、0.4%苯酚和0.00017%亮绿中的活痘苗病毒。不含抗生素或其他添加剂。对14个瓶子进行的生物负荷测试符合每毫升产品< 200个菌落形成单位的规格。这与之前许可的冻干天花疫苗Dryvax的规格相同。
给药和剂量
APSV以单剂量(~2.5 uL)通过经皮途径(划痕)给药,使用已浸入疫苗中的15针不锈钢分叉针。接种疫苗的位置是三角肌上方的上臂(62)。对未稀释疫苗效力的研究发现效价为10×107.6噬斑形成单位(PFU)/mL,并且当比较稀释的(1:5)和未稀释的疫苗(62)。对APSV效力的年度监测仍在进行。
疫苗以0.25毫升等份装在无菌的2毫升玻璃瓶中。每个小瓶必须用适当的配套稀释剂进一步稀释,以达到当前FDA EUA前文件中规定的1:5稀释度。为了达到1:5的稀释度,必须在一小瓶APSV中加入1毫升稀释剂,这样每小瓶可生产大约500剂疫苗。
监管状态
APSV是一种研究产品,储存在美国SNS。CDC持有未稀释和1:5稀释用途的IND申请(CDC法规事务,个人通讯,2014)。CDC还向FDA提交了一份预EUA,用于在涉及天花的公共卫生紧急事件中使用1:5稀释的APSV为人们接种疫苗,以增加天花疫苗的可用剂量。
功效
APSV含有用于生产Dryvax的相同NYCBOH痘苗病毒株,并且预期在未稀释和1:5稀释使用时具有相同的临床效果(62)。从天花根除运动中使用的病毒衍生的具有活复制能力的疫苗,如Dryvax和APSV,当用作暴露前预防时,估计有> 95%的有效性(1)。
安全
APSV的安全状况预计与Dryvax和ACAM2000类似(表5和6)。用牛痘病毒NYCBOH株接种天花疫苗的严重并发症的总体风险较低,并且在接受第一剂疫苗的人和幼儿中更频繁发生(61)。接种疫苗最常见的严重并发症是脑炎、进行性牛痘和接种性湿疹(61)。尚未对APSV的肌心包炎风险进行评估,但预计其发生率与Dryvax和ACAM2000相似。
Imvamune
描述
Imvamune是正在开发的第三代天花疫苗,用于主动免疫以预防天花疾病(39–42)。Imvamune是一种减毒活病毒疫苗,其含有改良的安卡拉痘苗(MVA ),这是一种痘苗病毒株,在原代鸡胚成纤维细胞(40)。与具有复制能力的天花疫苗相比,它被认为在人类中具有良好的安全性(39–42)。Imvamune不含任何佐剂或防腐剂,但可能含有微量的残留宿主细胞DNA和蛋白质、苯并酶和抗生素庆大霉素。Imvamune由巴伐利亚Nordic (BN)生产,并在特殊情况下获得了欧洲委员会针对年龄≥18岁人群的天花感染和疾病主动免疫的上市许可。该适应症包括健康人群以及患有免疫缺陷和皮肤病的人群,如HIV感染者(CD4细胞计数≥200细胞/mm3)以及患有特应性皮炎或过敏性鼻炎的人。
给药和剂量
疫苗的给药途径是皮下(40)。与ACAM2000不同,Imvamune 0.5毫升分两次注射,分别在0周和4周注射给初次接种者(63)。先前接种过天花疫苗的受试者接受一次0.5毫升的剂量。Imvamune给药后不会产生可见的皮肤反应(40)。Imvamune作为无菌冷冻液体产品提供(0.5毫升装于2毫升小瓶中,储存于5°F(-15°C)至-13°F(-25°C)的环境中)。每个小瓶含有1剂Imvamune。每剂最少含1 x 108TCID50(50%组织培养感染剂量)每毫升活减毒痘苗病毒,MVA-BN株。
监管状态
Imvamune是储存在美国SNS的研究产品。CDC已经向FDA提交了一份EUA前的申请,以备在涉及天花的公共卫生紧急事件中使用。根据目前可用的临床试验信息,在紧急情况下提交给FDA审查和授权的预EUA将允许在暴露后、暴露前环境下对所有年龄的诊断为HIV或特应性皮炎的人使用Imvamune。
功效
Imvamune对天花的疗效未经证实,也无法进行临床试验,因为这种疾病已在人类中彻底根除。然而,Imvamune产生免疫反应的临床效果已经在六项已发表的临床研究中进行了评估(39,41,42,63–65)。总的来说,当使用总IgG抗体酶联免疫吸附测定(ELISA)和蚀斑减少中和(PRNT)测定进行评估时,Imvamune被确定为引发体液免疫反应。一项研究确定,30名(100%)未感染痘苗病毒的受试者在施用第二剂Imvamune (1 x 108TCID50)用痘苗病毒特异性总IgG ELISA评价时(几何平均滴度[GMT]> 100);当通过痘苗病毒特异性PRNT (GMT >10)评估时,这些受试者中有25人(83%)血清转化(41)。通过ELISA (GMT 743.37 SC,899.75 IM)和PRNT (GMT 29.30 SC,30.30 IM)检测,皮下和肌内接种疫苗的组间GMT相似(41)。另一项研究报道,52名(100%)未感染痘苗病毒的受试者在注射第二剂Imvamune (1 x 108TCID50)通过痘苗病毒特异性总IgG ELISA(效价> 50)(GMT 813.8);这些受试者中有37人(71.2%)通过痘苗病毒特异性PRNT(滴度> 20) (GMT 19.43)血清转化(42)。一项研究报道了类似的体液免疫反应,该研究还比较了Imvamune与Dryvax(39)。
Imvamune和Dryvax观察到的体液反应总体上是可比的,但是当用Dryvax特异性总IgG ELISA和PRNT测定法评估时,接受Dryvax的受试者中的抗体滴度更高,而当用Imvamune特异性总IgG ELISA和PRNT测定法评估时,接受Imvamune的受试者中的抗体滴度更高(39)。本研究的血清随后通过天花特异性PRNT试验进行了评估,发现与标准Dryvax疫苗接种方案相比,2剂免疫疫苗接种方案引发了相似的天花特异性中和抗体反应(66)。一项亚分析表明,与Dryvax相比,皮下注射Imvamune可能导致天花中和抗体反应增加(66)。在施用Dryvax之前进行免疫接种可降低皮肤反应的程度,缩短愈合时间,并减少Dryvax施用部位的病毒复制(39)。
一项比较体液免疫反应的研究(1 x 108TCID50)第二剂给药后2周,发现在CD4细胞计数≥350细胞/mm的HIV感染受试者中观察到较低的GMT3当与未感染的受试者相比时(GMT分别为779和1,939;p = 0.01)(64)。虽然在用Western Reserve痘苗病毒特异性PRNT试验进行评估时观察到了类似的趋势,但在HIV感染和未感染受试者中,在施用第二剂Imvamune后2周的GMT和血清转换率之间没有发现显著差异(GMT为95和188,血清转换率分别为89%和96%)(64)。一项研究评估了Imvamune的安全性和免疫原性(1 x 107TCID50和1 x 108TCID50)在24名受试者(20名接受Imvamune和4名对照)中,这些受试者在登记前至少2年接受了造血干细胞移植(65)。观察到短暂的局部反应,但未发现严重的不良事件(65)。使用基于荧光素酶的中和抗体活性分析和IFN-γ ELISPOT分析来评估免疫原性,两者在高剂量组都提供了更好的结果(65)。最后,一项比较两种不同Imvamune疫苗接种方案的研究确定,与第7天相比,在第28天使用第二剂Imvamune的推荐方案通过PRNT产生了更高的抗体应答,通过ELISA产生了最大数量的应答者(63)。第二次给药后14天,两组的IFN-γ ELISPOT反应相似(63)。计划进行一项比较Imvamune和ACAM2000的关键III期临床试验。
安全
Imvamune的安全性已在六项已发表的临床试验中进行了评估,共涉及687名受试者(562名未接种过痘苗病毒,125名之前接种过疫苗) (39,41,42,63–65)。受试者的年龄各不相同(范围:18-60岁),除了91名感染HIV的受试者外,所有受试者都是健康的。这些试验中施用的疫苗剂量范围为1×106到1 x 108TCID50。未接种过牛痘的受试者接种了2剂疫苗,而之前接种过的受试者只接种了1剂。疫苗通过皮下或肌肉注射给药。没有死亡报告。发生了一起涉及甲状腺癌病例的严重不良事件,医学监督员认为该事件与疫苗相关,但研究者认为该事件与疫苗无关。报告的常见不良事件是皮下注射疫苗的典型事件(局部[注射部位]和全身反应[疲劳、头痛和肌痛])。几乎所有的反应都是轻度到中度的,并且都解决了,没有后遗症。Imvamune不会在疫苗接种部位造成损伤,也不会带来二次传播的风险。
共有91名HIV-1 RNA <400拷贝/毫升且CD4细胞/毫米≥350的HIV感染受试者(30名未感染牛痘病毒,61名先前接种过疫苗)3在一项已发表的临床试验中收到Imvamune(64)。这些受试者中未报告死亡或疫苗相关的严重不良事件。总体而言,Imvamune在这些HIV感染受试者中的安全性与未感染受试者相当。
由于Imvamune尚未在孕妇或哺乳期妇女中进行研究,因此Imvamune在该人群中的风险和疗效未知。唯一与妊娠相关的Imvamune报告涉及一名27岁的女性,她在接受2剂Imvamune(42)。根据妊娠日期的估计,在接种第二剂疫苗后至少17天受孕,且未确认妊娠暴露于疫苗。最终,妊娠进展到足月,无并发症,并产下一名健康、正常的婴儿。
接种Imvamune疫苗后,未发现任何肌心包炎病例。然而,由于排除了患有已知心脏病或心脏风险因素的临床试验参与者,疫苗接受者总数有限,以及与该并发症的疾病病理生理学相关的不确定性,因此不可能对该疫苗的潜在肌心包炎风险进行完整评估。
用于开发Imvamune的前身MVA毒株于1976年在德国被批准用作在Lister疫苗之前施用的免疫前疫苗,以降低不良事件的可能性(40,67)。超过120 000人接受了低剂量的MVA (1 x 106TCID50)没有严重不良事件的报告,尽管没有对接种者进行严格的随访(40,67)。之前评估MVA安全性的临床试验也显示,在7,098名受试者中,包括5,691名3岁以下儿童(40)。尚未对年龄小于18岁的人进行Imvamune研究。
天花疫苗的推荐用途
主要原则和考虑因素
在涉及天花的突发公共卫生事件中,接种具有复制能力(即ACAM2000和APSV)的天花疫苗将是阻止传播链和实现流行病控制的主要应对策略。暴露于天花病毒的人具有患天花和将病毒传播给他人的高风险,从而允许继续传播(1)。暴露后疫苗接种的有效性是基于这样的原则,即暴露者接种疫苗将提供快速的疾病保护。在根除活动中,ACAM2000和APSV所源自的单剂量可复制天花疫苗被成功用于阻断传播链,并最终从人群中根除该疾病(1)。相比之下,Imvamune中所含的痘苗病毒株在根除天花的过程中并未使用,其预防人类天花的功效也不太确定。此外,Imvamune需要间隔4周给药2次,以获得与复制型天花疫苗相当的免疫应答。尽管接种Imvamune疫苗的人发生严重不良事件的风险可能较低,但这可能被预防疾病和提供快速保护的临床有效性的不确定性所抵消。具有复制能力的天花疫苗并发症高风险的人患严重天花的风险也更高。由于这些原因,已知暴露于天花病毒的人应接种具有复制能力的天花疫苗,除非有严重的免疫缺陷(即,骨髓移植受者在移植后4个月内,感染HIV的人CD4细胞计数< 50细胞/mm3,以及患有严重联合免疫缺陷、完全性迪乔治综合征和其他需要隔离的严重免疫缺陷状态的人) (图1)。暴露于天花病毒的人包括直接暴露于意外或故意天花病毒释放的人,或被确定为与CDC天花应对计划和指南定义的确诊、可能或疑似天花病例接触的人(37) (方框1)。天花患者的接触者包括此类病例的家庭成员、自病例出现发热以来在家中逗留≥3小时的其他人,以及与皮疹病例接触≥3小时< 2米(< 6.5英尺)的非家庭成员(37) (方框2)。
没有接触过天花病毒的人仍可能有感染天花的风险,这取决于疫情的严重程度,以及疾病出现时公共卫生应对措施在成功实施疫苗接种和其他控制措施方面的有效性。因此,一个人的暴露风险取决于多种因素,无法对所有可能的情况进行量化。例如,对涉及少数病例和有限地理传播的有限疫情的反应可能侧重于接触者追踪和通过病例识别获得的有针对性的疫苗接种,以实现流行病控制。相比之下,涉及多个地点多个病例的大范围爆发可能需要不同的公共卫生战略(例如,更广泛的疫苗接种活动以补充这些监测和控制努力)。公共卫生当局将根据疫情的流行病学特征(例如,疫情的严重程度和公共卫生应对措施的有效性)确定应对的范围,并为适当的疫苗接种策略提供指导(方框3)。
公共卫生当局确定的没有已知天花病毒暴露的天花感染高危人群应筛查天花疫苗接种的相对禁忌症(图2)。当Imvamune可用并经FDA批准使用时,这些对天花疫苗接种有相对禁忌症的人应接种Imvamune。在需要广泛接种天花疫苗的情况下,疫苗的供应可能会受到限制。因此,Imvamune应保留给对天花疫苗接种有相对禁忌症的人,因为他们有发生严重不良事件的风险,因此可能受益最大。尽管EUA之前的当前计划是仅允许在患有特应性皮炎或HIV感染的患者中使用Imvamune,但可能需要从FDA获得额外的监管批准,以允许Imvamune用于对天花疫苗接种有相对禁忌症的其他患者。当Imvamune不可用或缺乏其使用的监管授权时,应进行个体风险效益评估,以确定接种ACAM2000的益处是否大于风险。最终,首要关注的是暴露于天花病毒或面临天花感染高风险的人应该接种疫苗;疫苗的选择是次要的考虑因素。
由于它们的相似性(ACAM2000是用于生产APSV的痘苗病毒株的克隆衍生物),ACAM2000和APSV在反应中使用时,预期表现出相似的有效性和安全性。ACAM2000和APSV的临床应用将是相同的,尽管APSV仅在ACAM2000供应耗尽后使用。ACAM2000优于APSV,因为它是使用现代良好生产规范生产的许可疫苗。与使用ACAM2000相关的建议和预期指南也适用于在没有ACAM2000的情况下使用APSV。ACAM2000和APSV目前储存的数量足以为整个美国人口接种疫苗。
预期指导
施用ACAM2000后,需要遵循各种感染控制和疫苗部位护理措施,以将痘苗病毒从疫苗部位传播的机会降至最低。为预防接种疫苗后的接触传播,接种者应在接种疫苗的地方覆盖一块松纱布或类似的吸收材料,以吸收分泌物,并应穿长袖衣服(9 ![]() )。对于所有疫苗现场护理,需要使用肥皂和水/消毒剂进行彻底的手部卫生。与疫苗接种部位接触的衣服、毛巾和其他布料应与其他家庭衣物分开,直到它们可以在肥皂热水中用常规洗涤进行去污(8
)。对于所有疫苗现场护理,需要使用肥皂和水/消毒剂进行彻底的手部卫生。与疫苗接种部位接触的衣服、毛巾和其他布料应与其他家庭衣物分开,直到它们可以在肥皂热水中用常规洗涤进行去污(8 ![]() )。应向接种者提供关于接触/传播到家庭和其他密切接触者的风险的教育,特别是某些活动(如性接触)。尽管由于天花感染的共同风险,一个家庭中的人可能会一起接种疫苗,但应遵循感染控制预防措施,以防止在开始保护前的无意接种,特别是当家庭中的人具有较高的不良事件风险时(例如,特应性皮炎患者)。
)。应向接种者提供关于接触/传播到家庭和其他密切接触者的风险的教育,特别是某些活动(如性接触)。尽管由于天花感染的共同风险,一个家庭中的人可能会一起接种疫苗,但应遵循感染控制预防措施,以防止在开始保护前的无意接种,特别是当家庭中的人具有较高的不良事件风险时(例如,特应性皮炎患者)。
监测对可复制的天花疫苗的疫苗反应的建议先前已经发表(9 ![]() )。应在接种疫苗后6-8天对受试者进行评估,以评估接种部位是否出现主要皮肤反应或“吸收”暴露于天花病毒或具有天花感染高风险的人,如果缺乏主要皮肤反应的证据,应重新接种疫苗,并接受与下述未接种疫苗者相同的患者教育和症状监测信息。如果在重新接种疫苗后没有观察到严重的皮肤反应,应寻求卫生保健提供者和/或公共卫生当局的进一步咨询。
)。应在接种疫苗后6-8天对受试者进行评估,以评估接种部位是否出现主要皮肤反应或“吸收”暴露于天花病毒或具有天花感染高风险的人,如果缺乏主要皮肤反应的证据,应重新接种疫苗,并接受与下述未接种疫苗者相同的患者教育和症状监测信息。如果在重新接种疫苗后没有观察到严重的皮肤反应,应寻求卫生保健提供者和/或公共卫生当局的进一步咨询。
接受ACAM2000的受试者应在1周评估时以及临床指示的任何其他时间评估不良事件。CDC提供了关于体征和症状的指南,以监测疫苗接种后的不良事件(9 ![]() )。为有婴儿的已免疫母亲和已免疫照顾者的婴儿提供医疗服务的人员应强调感染控制预防措施,以避免在哺乳或其他照顾者活动中无意中给婴儿接种疫苗。
)。为有婴儿的已免疫母亲和已免疫照顾者的婴儿提供医疗服务的人员应强调感染控制预防措施,以避免在哺乳或其他照顾者活动中无意中给婴儿接种疫苗。
一旦出现明显的主要皮肤反应,ACAM2000的接受者可被视为成功接种疫苗。因为对Imvamune没有可辨别的皮肤反应,所以很难确定疫苗接种的成功和保护的开始。Imvamune的接受者在两次接种后获得最大的免疫应答,这两次接种是从初始疫苗给药后大约6周(63)。虽然有限的动物研究表明,单剂量Imvamune可能提供一些保护,但2剂量方案提供了最大的保护,在第二剂量(63,68–70)。应教育接种者在接种疫苗后的预期时间内产生保护作用。在获得全面保护之前,所有接种者应避免与天花患者接触,并避免与已知接种了具有活性接种部位病变、卫星病变或可能含有痘苗病毒的皮疹的复制型疫苗的人密切接触,以降低暴露于天花或痘苗病毒的可能性。
应尽一切努力坚持2剂免疫方案的时间表。延迟接种第二剂疫苗的人应立即接种疫苗。应咨询医疗服务提供者和/或公共卫生机构,考虑是否需要额外加强剂量的Imvamune。
根据禁忌症或医疗条件进行疫苗接种的指南
在事后环境中接种天花疫苗没有绝对的禁忌症。然而,在患有某些疾病的人群中存在一些相对禁忌症。CDC关于天花疫苗使用的建议是在考虑了天花感染的风险、接种疫苗后不良事件的风险以及接种疫苗的益处后制定的,并总结如下(表8)。
如果某些情况(如医疗条件、资源限制或其他)阻止了暴露于天花病毒或公共卫生当局确定的天花感染高风险人群的疫苗接种,应向这些未接种人群提供关于前驱症状和疾病特异性表现的明确信息,如何自我评估这些症状,以及在出现这些症状时何时何地寻求护理(9 ![]() ,37)。此外,应监测他们是否有提示天花的体征和症状,包括发烧、虚脱等。如果出现这些症状,应立即隔离这些人(37)。在这些情况下,抗病毒药物有望用于治疗疾病,但这些产品的疗效尚未在人体中确定。抗病毒药物已经在几种动物模型中证明了对抗多种正痘病毒的有效性,并且在迄今为止进行的小型人类安全试验中没有显示出重大的副作用(71)。抗病毒药物使用的临床指导文件正在制定中,目前还没有。应建议有疫苗接种禁忌症的人避免接触天花患者和接种了具有活性疫苗接种部位病变、卫星病变或可能含有痘苗病毒的皮疹的可复制疫苗的人。
,37)。此外,应监测他们是否有提示天花的体征和症状,包括发烧、虚脱等。如果出现这些症状,应立即隔离这些人(37)。在这些情况下,抗病毒药物有望用于治疗疾病,但这些产品的疗效尚未在人体中确定。抗病毒药物已经在几种动物模型中证明了对抗多种正痘病毒的有效性,并且在迄今为止进行的小型人类安全试验中没有显示出重大的副作用(71)。抗病毒药物使用的临床指导文件正在制定中,目前还没有。应建议有疫苗接种禁忌症的人避免接触天花患者和接种了具有活性疫苗接种部位病变、卫星病变或可能含有痘苗病毒的皮疹的可复制疫苗的人。
绝对禁忌症
与事件前疫苗接种计划相比,事件后疫苗接种计划中使用天花疫苗的风险效益分析存在固有的差异。在事后疫苗接种计划中,严重天花疾病的风险往往超过天花疫苗接种不良事件的风险。因此,适用于事件前疫苗接种计划的禁忌症可能不再适用于事件后疫苗接种计划。由于天花的高致死率和严重性,对于暴露于天花病毒或具有天花感染高风险的人,使用天花疫苗(包括可复制疫苗)没有明确的绝对禁忌症。然而,下面讨论的某些医疗条件对风险效益分析有重大影响,应纳入疫苗接种决策过程。(图1和2)。
严重免疫缺陷
推荐
- 患有严重免疫缺陷的人不应该接种任何天花疫苗。
- 暴露于天花病毒的严重免疫缺陷者,在抗病毒药物不能立即获得的情况下,可以接种疫苗。
患有严重免疫缺陷的人在接种天花疫苗后,免疫反应差的可能性很高,发生不良事件的风险也增加。因此,患有严重免疫缺陷的人应该避免接种任何天花疫苗,因为他们预计不会从疫苗中受益。这些人可能包括移植后4个月内的骨髓移植受者、CD4细胞计数< 50细胞/mm的HIV感染者3以及患有严重联合免疫缺陷(SCID)、完全DiGeorge综合征和其他需要隔离以保护个人的严重免疫缺陷状态的人(72) (方框4)。感染艾滋病毒的13岁以下儿童的CD4细胞计数应进行调整(表9) (73 ![]() )。尽管患有严重免疫缺陷的人可能无法从疫苗接种中获益,但当抗病毒药物不能立即使用时,考虑在这些人暴露于天花病毒的情况下使用Imvamune是合理的,因为他们感染天花的风险很高。
)。尽管患有严重免疫缺陷的人可能无法从疫苗接种中获益,但当抗病毒药物不能立即使用时,考虑在这些人暴露于天花病毒的情况下使用Imvamune是合理的,因为他们感染天花的风险很高。
相对禁忌症
有相对禁忌症的人可能有更高的风险发生复制型天花疫苗的不良事件。此类人群包括患有特应性皮炎(湿疹)、CD4细胞计数为50-199的HIV感染者/嗯3, 其他免疫受损状态(即移植后3个月内的实体器官移植受者、移植后4-24个月内的骨髓移植受者、患有活动性移植物抗宿主病的移植受者以及接受免疫抑制治疗的人),以及对疫苗或疫苗成分过敏的人(方框5)。
尽管这些人群发生不良事件的风险更高,但仍建议那些暴露于天花病毒的人群接种具有复制能力的疫苗。发生严重天花的可能性被认为比发生严重不良事件的风险更高,疫苗提供保护的益处超过了疫苗相关不良事件的风险。然而,在这些人群中,在天花风险极小且免疫延迟不会将风险增加到不可接受的水平的情况下,如果可以获得Imvamune的2剂方案并经FDA批准使用,则更可取。针对这些人群的建议和进一步指导将在下面详细讨论。
特应性皮炎患者
推荐
- 暴露于天花病毒的特应性皮炎患者应接种ACAM2000疫苗。
- 患有特应性皮炎的人,在没有已知天花病毒暴露的情况下,具有天花感染的高风险,应接种Imvamune。
- 先前接种过天花疫苗的特应性皮炎患者应接种ACAM2000。
在涉及天花的公共卫生突发事件期间,可以使用公布的临床发现和标准(方框6) (74)。特应性皮炎的病史或存在是接种复制型天花疫苗后发生接种性湿疹的一个危险因素。然而,对于暴露于天花病毒或天花感染高危人群,特应性皮炎并不是接种ACAM2000疫苗的绝对禁忌症。暴露于天花病毒后,患严重天花的风险可能超过经历ACAM2000继发的严重不良事件的风险。预计将提供针对严重不良事件的医疗对策治疗,包括静脉注射疫苗和抗病毒药物。由于这些原因,ACAM2000优选用于暴露于天花病毒的特应性皮炎患者的免疫,因为其能够在单剂量中实现保护。相比之下,患有特应性皮炎的人,在没有已知天花病毒暴露的情况下,具有天花感染的高风险,可能会从Imvamune疫苗接种中受益。在这种情况下,急性发展成天花的风险较低,并且在疾病发展或天花病毒暴露发生之前成功施用两种剂量的免疫并获得更大保护的可能性较高。现有数据表明,以前接种过疫苗的人发生不良事件的风险较低(1,60,61)。因此,ACAM2000对于有既往天花疫苗接种史且无并发症的特应性皮炎患者来说是首选疫苗。
艾滋病毒感染者
推荐
- CD4细胞计数> 200细胞/毫米3的艾滋病毒感染者暴露于天花病毒或具有天花感染高风险但未暴露于天花病毒的人应接种ACAM2000疫苗。
- CD4细胞计数为50–199细胞/毫米3的艾滋病毒感染者暴露于天花病毒的人应接种ACAM2000疫苗。
- CD4细胞计数为50–199细胞/毫米的艾滋病毒感染者3在没有已知天花病毒暴露的情况下,天花感染的高危人群应接种Imvamune疫苗。
- CD4细胞计数< 50细胞/毫米3的艾滋病毒感染者可能不会从天花疫苗中获益。
在引入HIV之前,天花已经在人群中被根除,这使得人们无法直接了解这两种病原体在人体中的潜在相互作用。由于已知的HIV疾病的病理生理学和免疫抑制性质,HIV感染者很可能具有更高的患天花感染的严重疾病的风险。同样,我们对ACAM2000和APSV在HIV感染人群中引起严重疫苗并发症的风险知之甚少,因为没有研究评估这些疫苗在该人群中的作用。IMVAMUNE在有限数量的HIV感染受试者中的安全性和有效性与未感染受试者相当(64)。
对于被公共卫生当局确定为天花感染高危人群的HIV感染者,应仔细评估其天花病毒暴露情况,因为这些人群中存在严重天花的潜在风险。对于CD4细胞计数≥50细胞/mm的HIV感染者,应使用ACAM20003因为在这种情况下,严重天花的风险很可能超过严重疫苗并发症的风险。包括静脉注射疫苗和抗病毒药物在内的医学对策有望用于治疗严重的疫苗并发症,包括进行性牛痘。如果未发现天花病毒暴露,HIV感染者感染天花的风险很高,CD4细胞计数为50-199细胞/毫米3应该接种免疫疫苗。虽然没有关于Imvamune在该人群中的有效性或安全性的数据,但他们很可能受益于复制缺陷型疫苗,因为与CD4细胞计数≥200的HIV感染者相比,其免疫抑制程度更高,导致严重不良事件的风险增加。CD4细胞计数< 50细胞/毫米的艾滋病毒感染者3因为他们不太可能对任何储存的天花疫苗产生足够的免疫反应。然而,当抗病毒药物不能立即获得时,在暴露于天花病毒的情况下,可以考虑接种Imvamune。
暴露于天花病毒的HIV感染者,如果最近(1年内)没有可用的CD4计数,应按照当前监测病例定义的定义进行艾滋病定义条件评估(73 ![]() )。ACAM2000应该使用,除非出现艾滋病定义的条件,因为在这种情况下严重天花的风险很高。在没有已知天花病毒暴露的情况下,具有天花感染高风险的HIV感染者应在接种天花疫苗前进行CD4细胞计数(如果可能的话),因为这种检测在大多数情况下可在24小时内进行。当没有已知的天花病毒暴露时,这种短暂的延迟不太可能导致天花感染风险的显著增加。
)。ACAM2000应该使用,除非出现艾滋病定义的条件,因为在这种情况下严重天花的风险很高。在没有已知天花病毒暴露的情况下,具有天花感染高风险的HIV感染者应在接种天花疫苗前进行CD4细胞计数(如果可能的话),因为这种检测在大多数情况下可在24小时内进行。当没有已知的天花病毒暴露时,这种短暂的延迟不太可能导致天花感染风险的显著增加。
其他免疫缺陷者
推荐
- 暴露于天花病毒的免疫缺陷者应接种ACAM2000疫苗,除非他们患有严重的免疫缺陷,并且预计不会受益于疫苗(方框4; 图1)。
- 移植后3个月内的实体器官移植受者、移植后4-24个月内的骨髓移植受者、患有活动性移植物抗宿主病的移植受者以及接受免疫抑制治疗的天花感染高危人群(未暴露于已知的天花病毒)应接种Imvamune疫苗(如果有Imvamune且经FDA批准使用)。
据信,导致免疫缺陷或免疫抑制的疾病和病症使受影响的人易于发生严重的不良事件。这些相同的疾病和情况也可能增加天花感染引发严重疾病的风险。免疫缺陷或免疫抑制的程度对严重天花和严重不良事件风险的影响很难评估。对于某些具有天花感染高风险的免疫缺陷者,建议接种Imvamune疫苗。尽管目前没有监管机制为没有特应性皮炎或HIV感染的人提供疫苗,但可能需要FDA的额外监管批准,以允许对其他有相对禁忌症的人使用Imvamune。这些人包括移植后3个月内的实体器官移植受者、移植后4-24个月内的骨髓移植受者、患有活动性移植物抗宿主病的移植受者以及接受免疫抑制治疗(包括烷化剂、抗代谢药、放疗、肿瘤坏死因子[TNF]抑制剂和高剂量皮质类固醇[即> 2 mg/kg体重或20mg/天的泼尼松,持续> 2周])的受者。
虽然其他慢性疾病,如心脏病、糖尿病和关节炎可能有一些免疫抑制成分,但由于免疫抑制程度相对较低,接种ACAM2000的益处可能超过严重不良事件的风险。同样,ACAM2000对于患有其他免疫功能低下疾病(如补体或吞噬细胞缺陷)的人来说是优选的,这些人可能对疫苗接种产生足够的免疫反应,但严重不良事件的风险未知增加。
对疫苗或疫苗成分过敏的人
推荐
- 在接种疫苗之前,无论是否接触过天花病毒,都应告知怀疑对天花疫苗或疫苗成分严重过敏的人严重过敏反应的风险。
- 对于暴露于天花病毒的人:
- 对先前剂量的天花疫苗严重过敏的人应在能够治疗过敏反应的设施中接种ACAM2000。
- 如果可能,对ACAM2000或ACAM2000疫苗成分严重过敏的人应接种APSV疫苗。如果APSV不可用,ACAM2000应在能够治疗过敏反应的设施中使用。
- 对于没有已知天花病毒暴露的高天花感染风险人群:
- 对疫苗成分或先前剂量的天花疫苗有严重过敏反应的人应接种任何不含与严重过敏反应相关的疫苗毒株或疫苗成分的可用天花疫苗。
- 如果不含与严重过敏反应相关的疫苗株或疫苗成分的天花疫苗不可用,则应在能够治疗过敏反应的设施中为患者提供任何可用的天花疫苗接种。
在暴露于天花病毒的人群中,严重天花的风险可能超过对疫苗接种产生严重过敏反应的风险。1968年评估天花疫苗并发症的研究发现,严重过敏反应如多形红斑的发生率为每100万次初次接种165例(60,61)。未报告过敏反应或过敏反应导致的死亡病例(60,61)。然而,对先前剂量的天花疫苗或疫苗成分有严重过敏史的人,不能排除过敏反应(一种潜在威胁生命的反应)的风险。用于应急反应的天花疫苗有不同的疫苗成分,详见其各自的产品说明。天花疫苗应在能够治疗过敏反应的设施中接种,以降低这种风险。
其他特殊人群指南
孕妇和哺乳期妇女
推荐
- 暴露于天花或具有天花感染高风险的孕妇和哺乳期妇女应接种ACAM2000疫苗。
- 患有特应性皮炎、HIV感染或其他相对禁忌症的孕妇和哺乳期妇女应根据相对禁忌症进行分类,而不是根据其妊娠或哺乳状态。
天花根除时代的数据表明,孕妇特别容易感染严重疾病,包括出血性天花,并且天花病死率极高(总体为34.3%,未接种疫苗的孕妇接近70%)(1,20,21)。尽管接种具有复制能力的天花疫苗会因胎儿直接感染病毒而对胎儿牛痘造成风险,但根据主动免疫期间报告的病例数,这种风险被认为非常低(1,51)。在接种疫苗的孕妇中,其他严重不良事件的发生率并未增加。
考虑到母亲和胎儿的高疾病相关死亡率,接种ACAM2000疫苗的保护性益处可能超过胎儿牛痘的风险。ACAM2000比Imvamune更适用于暴露于天花病毒或具有天花感染高风险的孕妇,因为Imvamune在该人群中的临床有效性和安全性不确定,并且2剂方案可能会延迟对疾病的完全保护。
与普通人群相比,哺乳期妇女患严重天花或严重不良事件的风险并未增加。然而,与其他密切接触的情况(如性活动)类似,在喂养期间,活痘苗病毒从疫苗接种部位无意中传播给接种疫苗的母亲的婴儿是一种潜在风险(75)。无意传播的风险可能与母乳喂养或奶瓶喂养相似,因为这两种方法都可能导致密切接触。类似于对接种疫苗者之间密切接触的其他建议,这些风险可以通过感染控制预防措施(9 ![]() )。
)。
尚不清楚天花疫苗病毒或抗体是否分泌到人类母乳中,或者通过病毒分泌到母乳中而暴露于痘苗病毒是否会导致新生儿痘苗病毒感染。暴露于天花病毒或面临天花感染高风险的哺乳期妇女应接种ACAM2000疫苗,并接受正确感染控制预防措施的咨询,以避免痘苗病毒从接种部位意外传播给母乳喂养的婴儿(9 ![]() )。众所周知,母乳喂养对婴儿和母亲的益处超过了通过食用母乳将病毒传播给婴儿的微小潜在风险。除非有疑似痘苗病毒感染的乳房皮肤病变,否则不建议停止母乳喂养或用母乳喂养婴儿。因为已经证明婴儿接触乳房皮肤损伤会导致口腔损伤,如果存在这种损伤,在损伤完全消退之前,不建议进行母乳喂养或挤奶。
)。众所周知,母乳喂养对婴儿和母亲的益处超过了通过食用母乳将病毒传播给婴儿的微小潜在风险。除非有疑似痘苗病毒感染的乳房皮肤病变,否则不建议停止母乳喂养或用母乳喂养婴儿。因为已经证明婴儿接触乳房皮肤损伤会导致口腔损伤,如果存在这种损伤,在损伤完全消退之前,不建议进行母乳喂养或挤奶。
儿科和老年人口
推荐
- 无论年龄大小,暴露于天花病毒或天花感染高危人群都应接种ACAM2000疫苗。
- 艾滋病毒携带者、特应性皮炎患者或其他相对禁忌症患者应根据相对禁忌症进行分类,与年龄无关.
ACAM2000应适用于暴露于天花病毒或处于天花感染高风险的人群,无论年龄大小,包括儿童和老年人群,因为非常年轻和年长的年龄组患严重天花的风险增加。对于这些年龄组,ACAM2000优于Imvamune,因为Imvamune在这些人群中的临床疗效和安全性不确定,并且2剂方案可能会延迟对疾病的完全保护。
从天花根除时期开始的人群研究(包括接种疫苗和未接种疫苗的受试者)显示,天花病死率在非常年轻和年长的年龄组中最高(表2) (18,19)。此外,根据其前身疫苗Dryvax(1,60,61)。尚未报告与Imvamune或其他类似痘苗病毒疫苗株相关的痘苗后脑炎病例。然而,迄今为止,在接种Imvamune的人群中观察到这种罕见并发症的可能性非常低,特别是因为没有年龄小于18岁的人接种过这种疫苗。因此,临床数据不足以确定Imvamune是否能为疫苗接种后脑炎高危人群提供额外的安全性益处。老年人群发生严重不良事件的风险可能会增加,因为高龄的相对免疫抑制和较高的共病可能性可能会导致复制型天花疫苗的不良事件。然而,Imvamune在老年人中的有效性和安全性尚未确定,并且由于2剂方案而导致的保护性发展的潜在延迟可能使他们有患严重天花的风险。
患有已知心脏病或心脏风险因素的人
推荐
- 患有已知心脏病或心脏风险因素、暴露于天花病毒或具有天花感染高风险的人应接种ACAM2000疫苗。
已知健康人在接受可复制的天花疫苗(即ACAM2000和Dryvax)后会发生肌心包炎(46,57,59)。与没有这些疾病的人相比,患有已知心脏病或心脏危险因素的人是否有更高的严重不良事件发生频率尚不清楚。尽管天花疫苗接种后发生肌心包炎的具体风险因素尚未确定,但已知有心脏病或心脏风险因素的人发生肌心包炎的后果比没有已知心脏病或心脏风险因素的人更可能严重。这一不良事件的病理生理学仍不清楚,因为在对患有肌心包炎的疫苗接种者的心肌组织进行的组织病理学检查中没有发现病毒损伤(54,55)。尽管迄今为止在Imvamune临床试验中未观察到肌心包炎病例,但在临床试验中接种疫苗的总人数不足以排除这种并发症发生率较低的可能性。由于这两种疫苗仅在健康人群中进行了测试,且ACAM2000试验中的心脏并发症是短暂的,并且没有明显的长期后果,因此对于已知患有心脏病或心脏风险因素的人来说,Imvamune疫苗接种相对于ACAM2000的益处尚不清楚。由于这些原因,ACAM2000在这些人群中比Imvamune更受欢迎。
保健工作者
推荐
- 在涉及天花的公共卫生紧急事件期间,公共卫生当局将确定面临天花感染高风险的卫生保健工作者。
- 这些卫生保健工作者应该接种ACAM2000疫苗,除非他们有严重的免疫缺陷或相对禁忌。
在天花根除时期,发现卫生保健工作者(HCWs)具有感染天花的高风险(1,34)。因为当今社会流动性很大,天花的再次出现将会产生全球性的影响。在世界任何地方发生涉及天花的公共卫生突发事件时,美国公共卫生当局可能会建议选定的hcw接种天花疫苗。除非HCW有严重的免疫缺陷或相对禁忌,否则这些有天花感染高风险的hcw应该接受ACAM2000。在应对天花的情况下,怀孕的hcw不应在最初的应急反应中提供直接的患者护理,除非暴露于天花病毒或被公共卫生当局确定为具有感染天花的高风险,否则不应接种疫苗。过去在美国2002-2004年事件前疫苗接种活动期间接种hcw和第一应答者的经验表明,当对经历不良事件的担忧超过天花暴露的感知威胁时,天花疫苗接种的接受度可能较低(76)。由于潜在有利的安全性,Imvamune的天花疫苗接受度可能高于ACAM2000。然而,HCW人对风险的看法可能会在事件发生后发生变化,因为他们知道已经在人类中发现了天花,这导致了对预防接种的更大需求。对于天花疫苗接种有相对禁忌症的高危天花感染hcw,应使用Imvamune,如所述(图2)。HCW接种Imvamune的资格将取决于疫苗的可用性。虽然Imvamune不能通过接触传播,这使其对HCWs有利,但在医院环境中传播ACAM2000的风险较低,特别是在实施良好的卫生习惯和屏障保护的情况下。接种过天花疫苗的医务工作者不应休假,也不应限制他们的活动。然而,以前接种过的hcw如果没有活动的接种部位病变,将会很好地治疗严重免疫抑制的患者。当先前接种过疫苗的医务人员不可用时,与严重受损患者一起工作的具有活动接种部位病变的医务人员应使用增强的感染控制预防措施和额外的个人防护设备(例如,覆盖疫苗部位的封闭绷带和/或不可渗透的隔离衣) (9 ![]() )。
)。
知识差距和未来研究
这些关于在事件后疫苗接种计划中使用天花疫苗的建议受到了限制,因为最近天花疫苗在选定人群中的使用有限,并且目前缺乏对其他医学对策(包括事件后环境中的抗病毒药物)的临床指导。随着此类指南的制定,这些建议将不断发展,特别是对于严重不良事件风险增加的人或不可能从疫苗接种中受益的严重免疫缺陷者。
因为Imvamune的供应有限,所以可能会出现限制其潜在用途的情况。随着对Imvamune的安全性和有效性(例如,使用1剂疫苗的可能性或在使用ACAM2000之前使用Imvamune以降低不良事件风险)的认识的发展,关于其使用的建议将会改变。
自从天花被根除以来,疫苗的有限使用限制了知识的发展。一旦发生事件,监测所有天花疫苗的安全性和有效性至关重要,尤其是在目前知识有限的人群中(如孕妇、儿童、老年人和免疫缺陷者)。
感谢
本报告的编写得到了以下人员的协助:Laura Aird,MS,Michael Bartenfeld,MA,Caryn Davidson,MA,Sean Diederich,Tracy Eier,Jack Herrmann,MSEd,Jim F. Jones,MD,Sarah Keally,MPH,Steven E. Krug,MD,FAAP,Satish Pillai,MD,Andrew Roszak,JD,大卫·西格尔,MD,FAAP,Daniel M. Sosin,MD,FACP,V. Fan Tait,MD,FAAP。
参考
- 芬纳F,亨德森D,有田I,耶泽克Z,拉德尼I。天花及其根除。瑞士日内瓦:世界卫生组织;1988.
- Koplow DA。天花:根除全球祸害的斗争。加州伯克利:加州大学出版社;2003.
- 疾病控制中心。公共卫生服务关于天花疫苗接种的建议。1971年Morb莫尔博《凡人周刊》;20:339.
- 天花威胁:重新考虑全球政策的时候了。生物安全Bioterror 201412:117–21.
- 亨德森达,英格斯比电视台,巴特利特JG,等民用生物防御工作组。天花作为生物武器:医疗和公共卫生管理。JAMA 1999281:2127–37.
- 疾病控制中心。牛痘(天花)疫苗:免疫实践咨询委员会的建议(ACIP)。MMWR 1991年报告;40(编号RR-14)。
- 罗茨LD,多森达,达蒙IK,贝歇耳JA。牛痘(天花)疫苗:免疫实践咨询委员会的建议(ACIP),2001年。MMWR建议代表2001年;50(编号RR-10)
 .
. - Wharton M,Strikas RA,Harpaz R,等:《在事前疫苗接种计划中使用天花疫苗的建议:免疫实践咨询委员会(ACIP)和医疗保健感染控制实践咨询委员会(HICPAC)的补充建议》。MMWR建议代表2003年;52(编号RR-7)
 .
. - 康诺J,凯西CG,贝尔DM。天花疫苗接种和不良反应。临床医生指南。MMWR建议代表2003年;52(编号RR-4)
 .
. - 世界卫生组织。《国际卫生条例》(2005年)。瑞士日内瓦:世界卫生组织;2006.
- 疾病控制中心。新许可的天花疫苗取代旧的天花疫苗。2008年MMWR莫拉塔尔周报;57:207–8.
- 曼德尔冰川,贝内特JE,多林r曼德尔,道格拉斯和贝内特的原则和实践的传染病。第7版。宾夕法尼亚州费城:丘吉尔·利文斯通/爱思唯尔;2010.
- 世界卫生组织根除天花专家委员会。第二份报告。世界卫生组织器官技术代表Ser 1972493:1–64.
- 拉奥河。天花。第一版。印度孟买:科塔里书店;1972.
- 世界卫生组织。世界卫生组织天花概况介绍。瑞士日内瓦:世界卫生组织;2001.
- 迪克森CW。天花。英国伦敦:丘吉尔;1962.
- 马丁DB。天花的死亡原因:对病理记录的检查。Mil Med 2002167:546–51.
- 福吉WH,米勒法学博士,亨德森DA。西非和中非根除天花。公牛世界卫生组织1975;52:209–22.
- 巴苏RN、耶泽克Z、沃德纳;世界卫生组织。东南亚区域办事处。印度天花的根除。印度新德里:世界卫生组织东南亚区域办事处;1979.
- 妊娠期间的天花和母亲的结局。2006年紧急传染病;12:1119–21.
- Rao AR,Prahlad I,Swaminathan M,Lakshmi A .妊娠和天花。印度医学协会,1963年;40:353–63.
- 莱恩·JM。关于临床天花专业的遗留问题。紧急传染疾病2011;17:676–80.
- 不来梅JG,汉德森达。天花的诊断和治疗。英国医学杂志2002;346:1300–8.
- 多种诊断技术鉴定以前接种过疫苗的个体对猴痘的保护性免疫。Nat Med 200511:1005–11.
- 天花疫苗免疫持续数十年:一项纵向研究。Am J Med 2008121:1058–64.
- 暴露后接种疫苗预防天花的有效性:德尔菲分析的结果。j传染疾病2003年;188:973–6.
- Rao AR,Jacob ES,Kamalakshi S,Appaswamy S,Bradbury BD。天花流行病学研究。254个感染家庭的家庭内传播研究。1968年印度医学研究杂志;56:1826–54.
- 一项关于天花家族内传播的研究。1971年美国流行病学杂志;94:316–26.
- 1972年在孟加拉国库尔纳市爆发的天花。二。监测和遏制在城市流行病控制中的有效性。1974年美国流行病学杂志;99:303–13.
- 萨卡JK,米特拉AC,慕克吉MK,德SK。天花中的病毒排泄。2.家庭接触者咽喉中的排泄物。公牛世界卫生组织1973;48:523–7.
- 对天花急性期漱口液中病毒含量的研究。公牛世界卫生组织1961年;25:49–53.
- Mack TM,Thomas DB,Muzaffar Khan M .西巴基斯坦天花的流行病学。二。获得性免疫之外的膀胱内扩散的决定因素。1972年美国流行病学杂志;95:169–77.
- 韦勒PF,波许J,里希特KH,亨德森达。德国一家医院的天花空气传播爆发及其与欧洲最近其他爆发的关系。公牛世界卫生组织1970年;43:669–79.
- Mack TM。欧洲的天花,1950-1971。J Infect Dis 1972125:161–9.
- 最近在西德梅舍德爆发的天花。1971年美国流行病学杂志;93:234–7.
- 对天花和疫苗接种的不同看法。英国医学杂志2003;348:460–3.
- 疾病控制中心。天花应对计划和指南(3.0版)。佐治亚州亚特兰大市:美国卫生与公众服务部,CDC2002.可从以下网址获得http://www.bt.cdc.gov/agent/smallpox/response-plan.
- 公共卫生突发事件期间促进医疗对策使用的联邦法律准备工具。医学伦理学(马萨诸塞州伯林特),2013年;第41页(补编1):第22至7页。
- Frey SE,纽曼FK,Kennedy JS,等. Dryvax攻击后对多剂量IMVAMUNE(改良安卡拉痘苗)的临床和免疫学反应疫苗2007;25:8562–73.
- 肯尼迪JS,格林伯格RN。IMVAMUNE:作为减毒天花疫苗的改良安卡拉痘苗病毒株。专家Rev疫苗2009;8:13–24.
- Vollmar J,Arndtz N,Eckl KM,等。IMVAMUNE的安全性和免疫原性,IMVAMUNE是一种有希望的第三代天花疫苗。疫苗2006;24:2065–70.
- von Krempelhuber A,Vollmar J,Pokorny R,等。一项评估第三代天花疫苗候选疫苗IMVAMUNE的免疫原性和安全性的随机、双盲、剂量发现II期研究。疫苗2010;28:1209–16.
- Casey C,Vellozzi C,Mootrey GT,等。天花疫苗(牛痘)不良反应监测指南。MMWR建议代表2006;55(编号RR-1)
 .
. - 肯尼迪·格林伯格注册护士。ACAM2000:一种新许可的基于细胞培养的活痘苗天花疫苗。专家意见调查药物2008;17:555–64.
- 弗雷·塞、纽曼·FK、肯尼迪·JS等。ACAM1000、ACAM2000和Dryvax在未接种过牛痘的健康成人中的安全性和免疫原性比较。疫苗2009;27:1637–44.
- 赛诺菲巴斯德。ACAM2000(天花[牛痘]活疫苗)[包装插页]。可从以下网址获得http://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 142572 . pdf

 .
. - Rosenthal S,Merchlinsky M,Chowdhury M. VRBPAC背景文件:ACAM2000(活痘苗病毒天花疫苗)。DC华盛顿:美国食品药品监督管理局;2007.可从以下网址获得http://www . FDA . gov/ohrms/dockets/AC/07/briefing/2007-4292 B2-01 . pdf

 .
. - 美国食品药品监督管理局。什么是严重不良事件?DC华盛顿:美国食品药品监督管理局;2014.可从以下网址获得http://www . FDA . gov/safety/med watch/how toreport/UCM 053087 . htm
 .
. - 雷德菲尔德RR,赖特DC,詹姆斯WD,琼斯TS,布朗C,伯克DS。患有人类免疫缺陷病毒(HIV)疾病的新兵中的播散性牛痘。英国医学杂志1987;316:673–6.
- 美国食品药品监督管理局。Acambis I. ACAM2000天花疫苗:疫苗和相关生物制品咨询委员会(VRBPAC)简报文件。DC华盛顿:美国食品药品监督管理局;2007.可从以下网址获得http://www . FDA . gov/ohrms/dockets/AC/07/briefing/2007-4292 B2-02 . pdf

 .
. - 瑞安·马,苏厄德·JF;妊娠登记小组的天花疫苗。2003-2006年国家妊娠期天花疫苗登记的妊娠、分娩和婴儿健康结果。Clin Infect Dis 200846(补编3):S221–6。
- Casey CG,Iskander JK,Roper MH等,《美国与天花疫苗接种相关的不良事件》, 2003年1-10月。JAMA 2005294:2734–43.
- 波兰GA,格拉本斯坦JD,内夫JM。美国天花疫苗接种计划:一项大型现代天花疫苗接种实施计划的回顾。疫苗2005;23:2078–81.
- 莫拉伊夫,可汗啊,斯珀林。天花疫苗接种后的心脏并发症。南医学杂志2009;102:615–9.
- 埃卡特·雷、洛夫·SS、阿特伍德·JE等人;国防部天花疫苗临床评估小组。天花疫苗接种后炎症性心脏并发症的发生率和随访。J Am Coll Cardiol 200444:201–5.
- Swerdlow DL,Roper MH,Morgan J,等。卫生与公众服务部天花疫苗接种项目期间的缺血性心脏事件,2003。Clin Infect Dis 200846补编3:S234–41。
- 哈尔塞尔JS,里德尔JR,阿特伍德JE等;国防部天花疫苗临床评估小组。未接种过牛痘的美国军人接种天花疫苗后发生肌心包炎。JAMA 2003289:3283–9.
- Arness MK,Eckart RE,Love SS,等。天花疫苗接种后的肌心包炎。美国流行病学杂志2004;160:642–51.
- 美国平民接种天花疫苗后的心肌炎、心包炎和扩张型心肌病,2003年1-10月。Clin Infect Dis 200846(补编第3号):S242–50。
- 莱恩JM,鲁本佛罗里达州,内夫JM,米勒法学博士。1968年天花疫苗接种的并发症。英国医学杂志1969年;281:1201–8.
- 莱恩JM,鲁本佛罗里达州,内夫JM,米勒法学博士。1968年天花疫苗接种的并发症:十项全州调查的结果。J Infect Dis 1970122:303–9.
- 稀释和未稀释天花疫苗的接种成功率和反应特征:一项随机对照试验。JAMA 2004292:1205–12.
- Frey SE,Winokur PL,Salata RA,等。使用不同策略接种天花疫苗的安全性和免疫原性。疫苗2013;31:3025–33.
- Greenberg RN,Overton et al,Haas DW,ET al.《改良安卡拉痘苗作为HIV感染受试者天花疫苗的安全性、免疫原性和临床疗效替代标记》。J Infect Dis 2013207:749–58.
- Walsh SR,Wilck MB,Dominguez DJ,等。改良安卡拉痘苗在造血干细胞移植受者中的安全性和免疫原性:一项随机对照试验。J Infect Dis 2013207:1888–97.
- Damon IK,Davidson WB,Hughes CM,等。天花疫苗的天花中和评估。J Gen Virol 200990:1962–6.
- Mayr A,Danner K .在免疫抑制条件下接种疫苗预防痘病。开发生物站1978;41:225–34.
- Garza NL,Hatkin JM,Livingston V,等.在兔模型中评估改良的安卡拉痘苗(MVA)/IMVAMUNE对雾化的兔痘病毒的功效。疫苗2009;27:5496–504.
- Keckler MS,Carroll DS,Gallardo-Romero NF,等.建立黑尾草原犬鼠(Cynomys ludovicianus)作为一种新的动物模型,用于比较暴露前在高剂量和低剂量猴痘病毒攻击中施用的天花疫苗。病毒学杂志2011;85:7683–98.
- Earl PL,Americo JL,Wyatt LS等通过单次注射复制缺陷型痘苗病毒在猴痘模型中的快速保护作用。美国国家科学院院刊2008;105:10889–94.
- koodziej M,Joniec J,Bartoszcze M,Gryko R,Kocik J,Knap J .对具有抗正痘病毒活性的物质的研究。ann Agric environment Med 2013;20:1–7.
- 疾病控制中心。1994年修订的13岁以下儿童人类免疫缺陷病毒感染分类系统。1994年Morb莫尔布世界周代表;36:1–19.
- Schneider E、Whitmore S、Glynn KM等人修订了成人、青少年和18个月以下儿童感染艾滋病毒以及18个月至13岁以下儿童感染艾滋病毒和艾滋病的监测病例定义——美国,2008年。MMWR建议代表2008;57(编号RR-10)
 .
. - 艾兴菲尔德低频,哈尼芬JM,鲁格TA,老史蒂文斯,骄傲血红蛋白。儿科特应性皮炎共识会议。2003年美国皮肤病学杂志;49:1088–95.
- 加尔德五世,哈珀D,费尔乔克议员。母乳喂养婴儿的三级接触性牛痘。JAMA 2004291:725–7.
- 巴休A;医学研究所。天花疫苗接种计划实施委员会。天花疫苗接种计划:恐怖主义时代的公共卫生。DC华盛顿:美国国家学院出版社;2005.
按组织/机构分列的审查员
美国儿科学会(AAP)胎儿和新生儿委员会;AAP传染病委员会;AAP儿科急救医学委员会;AAP备灾咨询理事会;AAP行政和实践管理科;AAP临床药理学和治疗学分会;AAP皮肤病学分会;AAP急救医学科;AAP流行病科;AAP血液学/肿瘤学分会;AAP医院医学科;AAP传染病科;美国皮肤病学会;美国家庭医生学会;美国妇产科医师学会;美国护士协会;负责准备和反应的助理部长;州和地区卫生官员协会;国防部;国土安全部;备灾咨询委员会;急救护士协会;美国食品药品监督管理局;美国传染病学会;全国儿科护士协会;全国湿疹协会;国家卫生研究所;儿科传染病学会。
专家小组成员
FAAP洛杉机儿童医院Grace Aldrovandi医学博士;约翰·霍普金斯大学公共卫生学院FAAP医学博士安妮·拜罗威茨;Marie Elena Barry,MSN,美国护士协会;匹兹堡大学FACOG医学博士Richard H. Beigi凯瑟琳m .爱德华兹,医学博士,FAAP,范德比尔特大学医学中心;多兰·芬克,医学博士,博士,辛西娅·凯利,理学硕士,美国食品药品监督管理局;Margaret C. Fisher,医学博士,FAAP,蒙茅斯医疗中心的Unterberg儿童医院;圣路易大学医学院莎伦·e·弗雷医学博士;Stephen Gluckman,医学博士,FACP,FIDSA,宾夕法尼亚初级保健中心;Gregory Hale,医学博士,FAAP儿童医院;乔恩·哈尼芬,医学博士,俄勒冈健康与科学大学;Gary D.V. Hankins,医学博士,德克萨斯大学加尔维斯顿医学分部;罗伯特·约翰逊博士,美国国立卫生研究院;Lisa Kaplowitz,医学博士,负责准备和反应的助理国务卿办公室;Gerald Kovacs博士,ASPR;埃默里大学医学院医学博士j·迈克尔·莱恩;明尼苏达州卫生部FAAP FIDSA医学博士Ruth Lynfield纳塞尔·马苏德,医学博士,FACP,科普兰医疗中心;Marguerite A. Neill,医学博士,FIDSA,罗得岛纪念医院;斯科特·诺顿,医学博士,华盛顿特区国家儿童医疗中心;Peck Ong,医学博士,洛杉矶儿童医院和南加州大学凯克医学院;Sarah Y. Park,医学博士,FAAP,夏威夷卫生部和儿科部,约翰A. Burns医学院,夏威夷大学马诺阿分校;安德鲁·T帕维亚医学博士,FAAP,FIDSA,犹他大学医学院;David Rimland,医学博士,弗吉尼亚州医疗中心和埃默里大学医学院;劳里·鲁宾,医学博士,阿尔伯特·爱因斯坦医学院;Margot Savoy,医学博士,FAAFP,Christiana Care家庭医学;珍妮·谢菲尔德,医学博士,德克萨斯大学西南医学院;小乔治·温德尔,医学博士,美国妇产科委员会;罗德尼·威洛比,医学博士,FAAP,威斯康辛儿童医院;Inger Damon博士、FIDSA博士、Susan Gorman博士、PharmD、MS、DABAT、FAACT、Denise Jamieson博士、Hye-Joo Kim博士、PharmD、Dana Meaney-Delman博士、Georgina Peacock博士、FAAP、Rich Schieber博士、Carol Pertowski博士、Brett Petersen博士、Yon Yu pharm d、CDC。
指导委员会成员
Rosemarie Aurigemma博士、Richard Gorman医学博士、FAAP、Mike Kurilla医学博士、国家卫生研究所博士;辛西娅·凯利,美国食品药品监督管理局,硕士;Rebecca Lipsitz博士,负责准备和应对的助理国务卿办公室;医学博士Inger Damon,医学博士Dana Meaney-Delman,医学博士Julie Guarnizo,医学博士Carol Pertowski,医学博士Brett Petersen,医学博士CDC。
节目主持人
FAAP洛杉机儿童医院Grace M. Aldrovandi医学博士;匹兹堡大学FACOG医学博士Richard H. Beigi保罗·卓别林,博士,巴伐利亚北欧;赛诺菲巴斯德生物制品公司医学博士Michael D. Decker凯瑟琳m .爱德华兹,医学博士,FAAP,范德比尔特大学医学中心;Renata J.M. Engler上校,医学博士,美国国防部FACP FAA ai、FACAIIMargaret C. Fisher,医学博士,FAAP,蒙茅斯医疗中心的Unterberg儿童医院;圣路易大学医学院莎伦·e·弗雷医学博士;乔恩·哈尼芬,医学博士,俄勒冈健康与科学大学;辛西娅·l·凯利女士,美国食品药品监督管理局;埃默里大学医学院医学博士j·迈克尔·莱恩;布雷特·彼得森,医学博士,疾病预防控制中心;Andrew Roszak博士,全国县市卫生官员协会;劳里·鲁宾,医学博士,FAAP阿尔伯特·爱因斯坦医学院;珍妮·谢菲尔德,医学博士,德克萨斯大学西南医学院;布拉德·斯珀伯,拱顶石中心;V. Fan美国儿科学会医学博士范泰特;罗德尼·威洛比,医学博士,FAAP,威斯康辛儿童医院;Inger Damon,医学博士,FIDSA,Dana Meaney-Delman,医学博士,Jim F. Jones,医学博士,Daniel M. Sosin,医学博士,FACP疾病预防控制中心。
其他会议参与者
Jack Herrmann,Ed女士,全国县市卫生官员协会;乔治·科尔奇博士,迈克尔·默赫林斯基博士,负责准备和应对的助理国务卿办公室;萨利·菲利普斯博士,美国国土安全部;丹尼尔m .索辛,医学博士,FACP,特雷西特德韦尔,疾病预防控制中心。
表4.接受ACAM2000与Dryvax治疗者的主要皮肤反应(疫苗接种成功)和中和抗体反应——美国,2007年 | ||||
|---|---|---|---|---|
特性 | 痘苗病毒-未免疫的人 | 以前接种过疫苗的人 | ||
ACAM2000 | Dryvax | ACAM2000 | Dryvax | |
主要皮肤反应(疫苗接种成功) | ||||
可评估人口的规模* | 776 | 257 | 1,189 | 388 |
疫苗接种成功率(%) | 747 (96)† | 255 (99) | 998 (84)§ | 381 (98) |
ACAM2000和Dryvax之间%差异的正态近似值的97.5%单侧置信区间 | -4.67%¶ | -17%** | ||
符合Dryvax的非劣性 | 是 | 不 | ||
中和抗体反应(基于PRNT50第30天的滴度) | ||||
可评估人口的规模†† | 565 | 190 | 734 | 376 |
GMT | 166 | 255 | 286 | 445 |
Log10平均值 | 2.2 | 2.4 | 2.5 | 2.6 |
ACAM2000-Dryvax之间差异的ANOVA的97.5%单侧置信区间 | -0.307 | -0.275 | ||
符合Dryvax的非劣性 | 不 | 是 | ||
| 缩写:CI =置信区间;GMT =几何平均中和抗体滴度;斑减少中和试验50痘苗病毒50%蚀斑减少中和试验。 来源:改编自赛诺菲-巴斯德。ACAM2000(天花(牛痘)活疫苗)[包装插页]。可从以下网址获得http://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 142572 . pdf *接受研究疫苗并在方案指定的时间范围内接受局部皮肤反应评估的受试者被纳入疗效可评估人群。 †对于疫苗批次,A、B和C的结果分别为95%、98%和96%。 §对于疫苗批次,A、B和C的结果分别为79%、87%和86%。 ¶因为评估的临界值被声明为-5%,ACAM2000被认为在该参数上不劣于Dryvax。 **由于评估的临界值被声明为-10%,因此ACAM2000在该参数上不劣于Dryvax。 ††接受研究疫苗并在基线和治疗后指定时间点收集中和抗体反应样本的随机选择受试者样本纳入抗体可评估人群。 因为评估的临界值被声明为-0.301,所以ACAM2000在该参数上不劣于Dryvax。 因为评估的临界值被声明为-0.301,ACAM2000被认为在该参数上不劣于Dryvax。 | ||||
表5.1968年美国各年龄组报告的与Dryvax初次接种相关的不良事件发生率* | |||||
|---|---|---|---|---|---|
事件 | 年龄组(岁) | 总发生率† | |||
<1 | 1–4 | 5–19 | ≥20 | ||
意外接种§ | 507.0 | 577.3 | 371.2 | 606.1 | 529.2 |
泛发性牛痘¶ | 394.4 | 233.4 | 139.7 | 212.1 | 241.5 |
接种性湿疹 | 14.1 | 44.2 | 34.9 | 30.3 | 38.5 |
进行性牛痘** | —†† | 3.2 | — | — | 1.5 |
疫苗接种后脑炎 | 42.3 | 9.5 | 8.7 | — | 12.3 |
死亡 | 5 | 0.5 | 0.5 | 未知的 | — |
总数 | 1,549.3 | 1,261.8 | 855.9 | 1,515.2 | 1,253.8 |
| 来源:改编自莱恩·JM,鲁本·弗洛里,内夫·JM,米勒法学博士。1968年天花疫苗接种的并发症:十项全州调查的结果。J Infect Dis 1970122:303–9;赛诺菲巴斯德。ACAM2000(天花[牛痘]活疫苗)[包装插页]。可从以下网址获得http://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 142572 . pdf *每100万人口。 †每个不良事件的总比率包括年龄未知的人。 §被称为意外着床。 ¶本研究中的泛发性牛痘可能包括许多与疫苗接种相关的免疫反应性或过敏性皮疹,而不是由真正的牛痘病毒血症(59)。 **进行性牛痘被称为坏死性牛痘。 ††在1968年10个州的调查中没有发现这种不良事件。 所有不良事件导致的死亡。 按年龄组划分的总体不良事件率包括本表中未提供的不良事件,包括严重的局部反应、疫苗接种部位的细菌双重感染和多形红斑。 | |||||
表6.1968年美国各年龄组报告的与Dryvax复种相关的严重不良事件发生率* | |||||
|---|---|---|---|---|---|
事件 | 年龄组(岁) | 总发生率† | |||
<1 | 1–4 | 5–19 | ≥20 | ||
意外接种§ | —¶ | 109.1 | 47.7 | 25.0 | 42.1 |
泛发性牛痘** | — | — | 9.9 | 9.1 | 9.0 |
接种性湿疹 | — | — | 2.0 | 4.5 | 3.0 |
进行性牛痘†† | — | — | — | 6.8 | 3.0 |
疫苗接种后脑炎 | — | — | — | 4.5 | 2.0 |
死亡 | — | — | — | — | — |
总数 | — | 200.0 | 85.5 | 113.6 | 108.2 |
| 来源:改编自莱恩·JM,鲁本·弗洛里,内夫·JM,米勒法学博士。1968年天花疫苗接种的并发症:十项全州调查的结果。J Infect Dis 1970122:303–9;赛诺菲巴斯德。ACAM2000(天花[牛痘]活疫苗)[包装插页]。可从以下网址获得http://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 142572 . pdf *每100万人口。 †每个不良事件的总比率包括年龄未知的人。 §被称为意外着床。 ¶在1968年10个州的调查中没有发现这种不良事件。 **本研究中的泛发性牛痘可能包括许多与疫苗接种相关的免疫反应性或过敏性皮疹,而不是由真正的牛痘病毒血症引起的皮疹(59)。 ††称为坏死性牛痘的进行性牛痘。 所有不良事件导致的死亡。 按年龄组划分的总体不良事件率包括本表中未提供的不良事件,包括严重的局部反应、疫苗接种部位的细菌双重感染和多形红斑。 | |||||
表7.接种Dryvax疫苗后的严重不良事件—美国,2002–2005 | ||||
|---|---|---|---|---|
不良事件 | 国防部计划 | DHHS计划 | ||
号码 | 发生率/百万 | 号码 | 发生率/百万 | |
肌/心包炎 | 86 | 117.71 | 21 | 519.52 |
疫苗接种后脑炎 | 1 | 1.37 | 1 | 24.74 |
接种性湿疹 | 0 | 0.00 | 0 | 0.00 |
泛发性牛痘 | 43 | 58.86 | 3 | 74.22 |
进行性牛痘 | 0 | 0.00 | 0 | 0.00 |
死亡 | 0 | 0.00 | 0 | 0.00 |
胎儿牛痘 | 0 | 0.00 | 0 | 0.00 |
接触传播 | 52 | 71.18 | 0 | 0.00 |
自动接种(非眼部) | 62 | 84.86 | 20 | 494.78 |
眼部牛痘 | 16 | 21.90 | 3 | 74.22 |
| 缩写:DoD =美国国防部;DHHS =美国卫生与公众服务部。 来源:改编自波兰GA,格拉本斯坦JD,内夫JM。美国天花疫苗接种计划:一项大型现代天花疫苗接种实施计划的回顾。疫苗2005;23:2078–81;赛诺菲巴斯德。ACAM2000(天花[牛痘]活疫苗)[包装插页]。可从以下网址获得http://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 142572 . pdf * 71%的初级疫苗接种;89%男性;年龄中位数:28.5岁。 †36%初次接种疫苗;36%男性;年龄中位数:47.1岁。 | ||||
图1.已知暴露于天花病毒的人群的天花疫苗接种的评估和管理算法
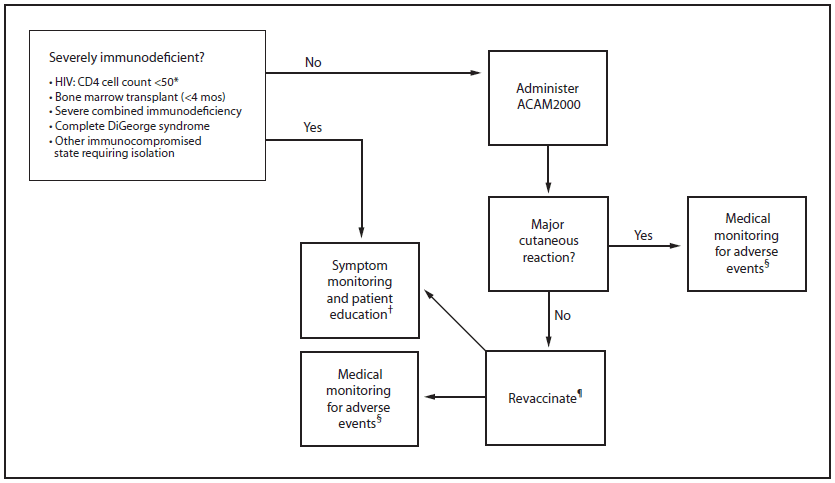
*感染艾滋病毒的13岁以下儿童的CD4细胞计数应根据进行调整表9.
†因医疗条件、资源限制或其他原因未接种疫苗的人,以及未出现主要皮肤反应后再次接种疫苗的人,应获得关于前驱症状和疾病特异性表现、如何自我评估这些症状以及如果出现这些症状何时何地寻求护理的明确信息。此外,应监测他们是否有提示天花的体征和症状,包括发烧和虚脱。虽然患有严重免疫缺陷的人可能无法从疫苗接种中获益,但当抗病毒药物不能立即使用时,在这些人暴露于天花病毒的情况下,考虑使用Imvamune是合理的。
§CDC提供有关体征和症状的指南,以监测疫苗不良事件(9 ![]() )。
)。
¶如果在再次接种后未发现重大皮肤反应,应寻求医疗保健提供者和/或公共卫生当局的进一步咨询。
替代文本:该图显示了用于评估和管理已知暴露于天花病毒的人的天花疫苗接种的算法。该途径因接触者是否有严重的免疫缺陷而异。
图2.评估和管理未暴露于天花病毒的高天花感染风险人群的天花疫苗接种算法
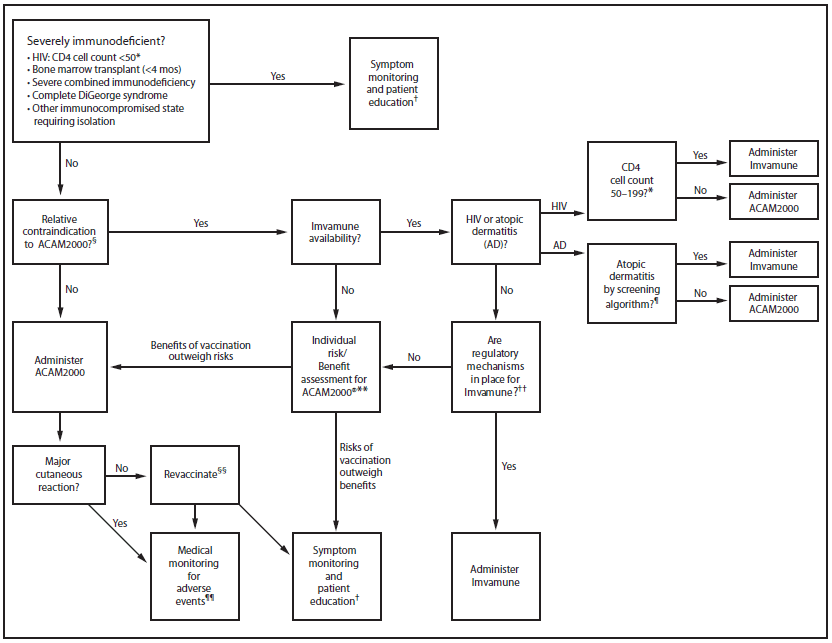
*感染艾滋病毒的13岁以下儿童的CD4细胞计数应根据进行调整表9.
†因医疗条件、资源限制或其他原因未接种疫苗的人,以及未出现主要皮肤反应后再次接种疫苗的人,应获得关于前驱症状和疾病特异性表现、如何自我评估这些症状以及如果出现这些症状何时何地寻求护理的明确信息。此外,应监测他们是否有提示天花的体征和症状,包括发烧和虚脱。虽然患有严重免疫缺陷的人可能无法从疫苗接种中获益,但当抗病毒药物不能立即使用时,在这些人暴露于天花病毒的情况下,考虑使用Imvamune是合理的。
§相对禁忌症:特应性皮炎患者;艾滋病毒感染者;患有其他免疫受损状态的人(即,移植后3个月内的实体器官移植受者、移植后4-24个月内的骨髓移植受者、患有活动性移植物抗宿主病的移植受者以及接受免疫抑制治疗的人);和对疫苗或疫苗成分过敏的人。
¶特应性皮炎,也称为儿童湿疹(或简称湿疹),可定义为慢性或复发性瘙痒性、干燥性、湿疹性皮炎的病史(或存在),每次发作持续(或持续)> 2周,加上以下两种或多种:
1)婴儿和儿童的面部、颈部或伸肌受累或任何年龄组的弯曲损伤,
2)发病年龄≤5岁,
3)个人特应性病史(如哮喘或季节性过敏),或
4)特应性皮炎的一级亲属
**应进行个体风险效益评估,以确定接种ACAM2000疫苗的效益是否大于风险。
††目前的监管机制仅允许在AD或HIV感染者中使用Imvamune,可能需要向FDA申请额外的监管批准,以允许对ACAM2000有相对禁忌症的其他人使用Imvamune。
如果在再次接种后未发现重大皮肤反应,应寻求医疗保健提供者和/或公共卫生当局的进一步咨询。
CDC提供有关体征和症状的指南,以监测疫苗不良事件(9 ![]() )。
)。
替代文本:该图显示了用于评估和管理具有天花感染高风险但未暴露于天花病毒的人的天花疫苗接种的算法。该途径因接触者是否有严重的免疫缺陷而异。
方框2.天花病毒暴露的定义 |
|
方框4.事后接种计划中天花接种的禁忌症 |
_________________________ *应对13岁以下儿童的CD4细胞计数进行调整(表9)。 |
使用商品名称和商业来源仅用于识别,并不意味着美国卫生与公众服务部的认可。
互联网上非CDC网站的参考资料是作为一项服务提供给MMWR读者和不构成或暗示CDC或美国卫生与人类服务部对这些组织或其项目的认可。CDC对这些网站上的网页内容不负任何责任。中列出的URL地址MMWR在出版之日是最新的。
全部MMWR文章的HTML版本是排版文档的电子转换。这种转换可能会导致HTML版本中的字符翻译或格式错误。用户可参考电子PDF版本(http://www.cdc.gov/mmwr)和/或原件MMWR官方文本、图表和表格的印刷版本。可以从DC华盛顿州美国政府印刷局(GPO)的文件主管处(邮编:20402-9371)获得该问题的原始纸质副本;电话:(202) 512-1800。联系GPO了解当前价格。
* *有关格式错误的问题或消息应发送至mmwrq@cdc.gov.
- 上次审阅的页面:2015年2月20日
- 页面上次更新时间:2015年2月20日
- 内容来源:疾病控制和预防中心
Hits: 40
