Contents
五价脑膜炎球菌疫苗 PENBRAYA FDA 2023
PENBRAYA™ (Meningococcal Groups A, B, C, W, and Y Vaccine),
suspension for intramuscular injection
Initial U.S. Approval: 2023
处方信息的重点
这些重点不包括使用所需的所有信息
PENBRAYA安全有效。请参阅PENBRAYA的完整处方信息。
PENBRAYA(A、B、C、W和Y群脑膜炎球菌疫苗),肌肉注射用混悬液
美国首次批准时间:2023年
———适应症和用法———
PENBRAYA适用于主动免疫,以预防由以下原因引起的侵入性疾病脑膜炎奈瑟菌血清群A、B、C、W和Y.PENBRAYA被批准用于10至25岁的个体。(1)
———剂量和用法———
• 仅供肌肉注射使用。(2)
间隔6个月接种2剂PENBRAYA(每剂约0.5 mL)。(2.1)
要制备PENBRAYA,用MenB组分复溶冻干的MenACWY组分。(2.2)
———剂型和强度———
PENBRAYA是一种注射用混悬剂。复溶后的单次剂量约为0.5 mL。(3)
———禁忌症———
对PENBRAYA的任何成分产生严重过敏反应(如过敏反应)。(4)
———不良反应———
最常报告的(≥15%)在第1剂和第2剂后引发的不良反应分别为注射部位疼痛(89%和84%)、疲劳(52%和48%)、头痛(47%和40%)、肌肉疼痛(26%和23%)、注射部位红肿(26%和23%)、注射部位肿胀(25%和24%)、关节痛(20%和18(6)
要报告可疑的不良反应,请致电1-800-438-1985联系辉瑞公司或1-800-822-7967联系VAERS公司或http://vaers.hhs.gov。
有关患者咨询信息,请参见第17节。
| 完整的处方信息:内容* | 8在特定人群中使用 *未列出完整处方信息中省略的章节或小节。 |
完整的处方信息
1适应症和用法
PENBRAYA适用于主动免疫,以预防由以下原因引起的侵入性疾病脑膜炎奈瑟菌血清群A、B、C、W和Y。 PENBRAYA被批准用于10至25岁的个体。
2剂量和接种
仅供肌肉注射使用。
2.1剂量和时间表
间隔6个月接种2剂PENBRAYA(每剂约0.5 mL)。
2.2准备工作
PENBRAYA以试剂盒的形式提供,包括一瓶冻干的MenACWY成分(无菌白色粉末)、一个含有MenB成分的预填充注射器和一个小瓶适配器。
| 冻干小瓶MenACWY
| MenB成分注射器
| 小瓶适配器
|
为了形成PENBRAYA,按照下面的图片中所述,用MenB组分重构冻干的MenACWY组分。
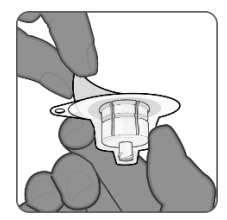 | 第1步.准备样品瓶和样品瓶适配器 •从装有冻干MenACWY成分的小瓶上取下塑料翻盖。 •清洁橡胶塞。 •无需从包装中取出样品瓶适配器,剥去顶盖。 |
 | 第2步.小瓶适配器的附件 •将小瓶底部放在平面上。 •将样品瓶适配器保留在包装中,并将其垂直放置在样品瓶中心上方,使适配器针头与样品瓶橡胶塞的中心对齐。 •直接向下推动将样品瓶适配器连接到样品瓶上。小瓶适配器将锁定到位。 •请勿以一定角度推入样品瓶适配器,因为这可能会导致使用过程中出现泄漏。 •取下样品瓶适配器包装。 |
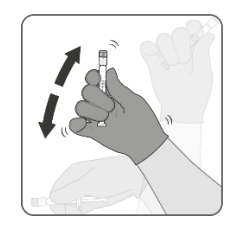 | 第3步.MenB组件的重新悬浮 •用力摇晃注射器,获得白色均质悬浮液。如果内容物无法重新悬浮,请勿使用。 |
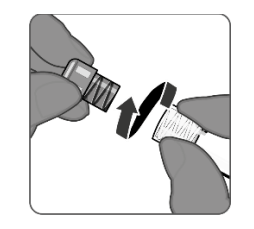 | 第4步.注射器帽的移除 •对于所有注射器组装步骤,仅通过位于注射器尖端的鲁尔锁适配器握住注射器。这将防止鲁尔锁定适配器在使用过程中分离。 •握住鲁尔锁定适配器,逆时针缓慢转动注射器盖,取下注射器盖。 |
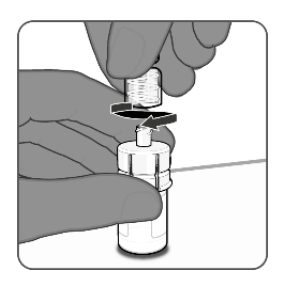 | 第5步.注射器与小瓶适配器的连接 •握住注射器的鲁尔锁适配器,顺时针旋转将其连接到样品瓶适配器。 •感觉到阻力时停止转动,注射器拧得过紧可能会导致使用过程中出现泄漏。 •一旦注射器牢固地连接到样品瓶适配器上,将会出现一个 •小瓶适配器顶部和注射器鲁尔锁定适配器之间的小空间。 |
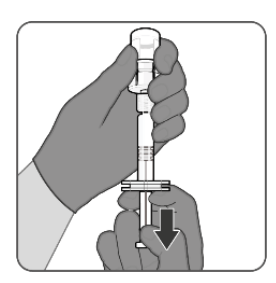
 | 第6步.冻干的MenACWY组分与MenB组分的重构形成PENBRAYA •将含有MenB成分的注射器的全部内容物注入样品瓶。 •不要取出空注射器。 •按住柱塞杆的同时,以圆周运动轻轻旋转小瓶,直到粉末完全溶解(不到1分钟)。 |
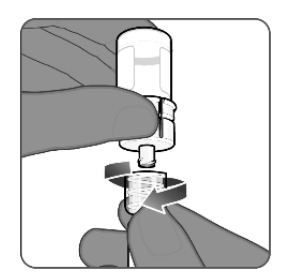
 | 第7步.抽取PENBRAYA •将样品瓶完全倒置,样品瓶适配器和注射器仍保持连接。 •将全部内容物缓慢抽入注射器,以确保大约0.5 mL剂量的PENBRAYA用于接种。 •不要拉出柱塞杆。 |
 | 第8步.注射器断开 •握住注射器的鲁尔锁适配器,逆时针转动注射器,将其从样品瓶适配器上断开。 |
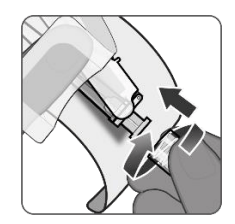 | 第9步.针的连接 •将适用于肌肉注射的无菌针头连接到装有PENBRAYA的注射器上。 |
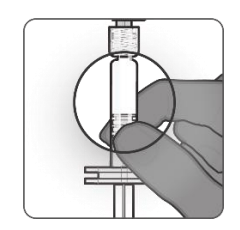 | 第10步.外观检验 •PENBRAYA是一种均匀的白色悬浮液。如果疫苗不是均质悬浮液,接种前应摇匀。 •只要溶液和容器允许,注射用药品在接种前应目视检查是否有颗粒物质和变色。如果出现任何一种情况,则丢弃。 |
2.3接种
仅供肌肉注射使用。
复溶后,立即接种PENBRAYA或储存在2℃至30℃(36℉至86℉)之间,并在4小时内使用。如果未在4小时内使用,请丢弃复溶疫苗。
3剂型和强度
PENBRAYA是一种注射用混悬剂。
复溶后的单次剂量约为0.5 mL。
4禁忌症
请勿将PENBRAYA用于对PENBRAYA的任何成分有严重过敏反应(如过敏反应)史的患者【参见说明(11)】.
5警告和注意事项
5.1急性过敏反应的管理
如果在接种PENBRAYA后出现过敏反应,必须立即采取适当的药物治疗来控制即时过敏反应。
5.2晕厥
注射疫苗(包括PENBRAYA疫苗)可能会导致晕厥(昏厥)。程序应到位,以避免因昏厥而受伤。
5.3免疫活性改变
免疫反应减弱
一些免疫能力改变的个体对PENBRAYA的免疫反应可能降低。
补体缺乏症
患有某些补体缺陷的个体和接受抑制末端补体激活治疗的个体患以下侵袭性疾病的风险增加脑膜炎A、B、C、W和Y群体,即使他们在接种PENBRAYA疫苗后产生了抗体【参见临床药理学(12.1)】.
5.4疫苗有效性的局限性
接种PENBRAYA疫苗可能无法保护所有疫苗接种者。
5.5破伤风免疫接种
接种PENBRAYA疫苗不能替代接种含破伤风类毒素的疫苗来预防破伤风。
5.6格林-巴利综合征
据报道,在使用另一种美国许可的脑膜炎球菌四价多糖结合疫苗后,出现了时间相关的格林-巴利综合征(GBS)。医疗保健专业人员对有GBS病史的人使用PENBRAYA的决定应考虑预期益处和潜在风险。
6不良反应
最常报告的(≥15%)在第1剂和第2剂后引发的不良反应分别为注射部位疼痛(89%和84%)、疲劳(52%和48%)、头痛(47%和40%)、肌肉疼痛(26%和23%)、注射部位红肿(26%和23%)、注射部位肿胀(25%和24%)、关节痛(20%和18
6.1临床试验经验
由于临床试验是在差异很大的条件下进行的,因此在一种疫苗的临床试验中观察到的不良反应率不能直接与另一种疫苗的临床试验中的不良反应率进行比较,并且可能无法反映实际观察到的不良反应率。
在3项临床研究(2项活性对照研究和1项非对照研究)中评估了PENBRAYA在10至25岁个体中的安全性。在对照研究中,2306名参与者接受了至少1剂PENBRAYA。在之前接种过脑膜炎球菌结合疫苗(归类为 MenACWY结合疫苗免疫的)的946名参与者中,802名参与者接种了1剂任何美国许可的A、C、W和Y群脑膜炎球菌结合疫苗,51名参与者接种了非美国许可的单价C群脑膜炎球菌结合疫苗(MenC结合疫苗),93名参与者在入组前至少4年接种了未指明的美国许可或非美国许可的 MenACWY结合疫苗或MenC结合疫苗。在这项非对照研究中,300名参与者接受了单剂量的PENBRAYA。
研究1(NCT 04440163)是一项主动对照、观察者盲法的多中心研究,其中美国和欧洲10至25岁的参与者在0个月和6个月时至少接种1剂PENBRAYA疫苗(N=1763)或B群脑膜炎球菌疫苗(Trumenba)(N = 650)。在第0个月,A、C、Y和W- 135群脑膜炎球菌寡糖白喉CRM197结合疫苗(SRL葛兰素史克疫苗公司生产的 MenACWY-CRM)与Trumenba同时接种。所有参与者都是MenB疫苗未接种者。 MenACWY结合疫苗-未免疫和 MenACWY结合疫苗-免疫的的参与者都是研究的一部分。
研究2(NCT 03135834)是一项主动对照、观察者盲法的多中心研究,其中美国和欧洲10至25岁的参与者在0个月和6个月时接受了至少1剂PENBRAYA(N = 543)或Trumenba(N = 1057)。在第0个月, MenACWY-CRM与Trumenba联合接种。所有参与者都是MenB疫苗未接种者。未接种过 MenACWY结合疫苗和接种过 MenACWY结合疫苗的参与者都是本研究的一部分。
研究3(NCT 04440176)是一项描述性非对照研究,其中美国11至14岁的参与者间隔12个月接受PENBRAYA。所有参与者均未接种任何脑膜炎球菌疫苗。
在研究1和研究2中,使用电子日记在研究疫苗接种后7天内监测请求的局部和全身不良反应。在所有研究中,不良事件(AE)的自发报告是在最后一次疫苗接种后至少1个月以及最后一次严重不良事件(SAE)疫苗接种后6个月内收集的。
在对照研究中,接受PENBRAYA治疗的参与者和接受对照治疗的参与者在性别、种族和民族方面的人口统计学特征基本相似(Trumenba和MenACWY-CRM)。在对照研究中接受PENBRAYA的参与者中,47.4%为男性,79.4%为白人,10.2%为黑人或非裔美国人,2.1%为亚裔,2.6%为其他种族群体,21.6%为西班牙裔/拉丁裔。
引发局部和全身不良反应
表1列出了研究1中每剂PENBRAYA后7天内报告的引发的局部不良反应,表2列出了引发的全身不良反应和退热药物的使用情况。
表1.研究1a中的PENBRAYA或Trumenba疫苗接种7天内报告征集的局部不良反应的参与者百分比
| 注射部位反应 | PENBRAYA | Trumenba+ MenACWY-CRMb | ||
| 剂量1 N=1724-1725 % | 剂量2 N=1456 % | 剂量1 N=630-631 % | 剂量2 N=529 % | |
| 疼痛c | ||||
| 任何d | 89.3 | 84.4 | 85.1 | 78.6 |
| 轻度 | 32.3 | 29.1 | 31.1 | 33.1 |
| 中度 | 49.4 | 48.8 | 47.7 | 40.3 |
| 重度 | 7.5 | 6.5 | 6.3 | 5.3 |
| 发红e | ||||
| 任何d | 25.9 | 23.2 | 19.5 | 14.7 |
| 轻度 | 8.9 | 7.7 | 7.3 | 6.6 |
| 中度 | 14.4 | 12.6 | 10.0 | 7.2 |
| 重度 | 2.6 | 3.0 | 2.2 | 0.9 |
| 肿胀e | ||||
| 任何d | 25.0 | 24.2 | 21.4 | 14.7 |
| 轻度 | 10.6 | 10.4 | 8.3 | 6.4 |
| 中度 | 13.3 | 12.8 | 12.4 | 8.1 |
| 重度 | 1.2 | 1.0 | 0.8 | 0.2 |
缩写:N =参与人数; MenACWY-CRM =脑膜炎球菌(血清群A、C、W 和Y)寡糖白喉CRM197结合疫苗;Trumenba =脑膜炎球菌血清群B因子H结合蛋白。
a.NCT04440163
b.在0个月时接种Trumenba和 MenACWY-CRM,然后在6个月时单独接种Trumenba。仅记录了PENBRAYA和Trumenba注射部位的局部反应。
c.轻度(不妨碍活动);中度(干扰活动);重度(阻止日常活动)。
d.“任何”是指在接种疫苗后7天内报告反应为“轻度”、“中度”或“重度”的参与者的累计频率。
e.轻度(2.0至5 cm);中度(>5至10 cm);严重(>10 cm)。
表2.在研究1中,每次接种疫苗后7天内报告引起全身不良反应和使用退热药物的参与者的百分比
| 全身反应 | PENBRAYA | Trumenba+MenACWY-CRMa | ||
| 剂量1 N=1739-1740 % | 剂量2 N=1459 % | 剂量1 N=638 % | 剂量2 N=532 % | |
| 发烧(≥38℃) | ||||
| ≥38.0℃ | 5.9 | 2.4 | 5.8 | 1.5 |
| 38.0至38.4℃ | 3.7 | 1.9 | 2.0 | 0.4 |
| >38.4至38.9℃ | 1.6 | 0.3 | 2.8 | 0.9 |
| >38.9至40.0℃ | 0.6 | 0.2 | 0.9 | 0.2 |
| >40.0℃ | 0.0 | 0.0 | 0.0 | 0.0 |
| 呕吐b | ||||
| 任何c | 3.2 | 1.5 | 3.0 | 0.9 |
| 轻度 | 2.5 | 1.4 | 2.0 | 0.8 |
| 中度 | 0.6 | 0.1 | 0.9 | 0.2 |
| 重度 | 0.0 | 0.0 | 0.0 | 0.0 |
| 腹泻d | ||||
| 任何c | 11.0 | 8.2 | 13.5 | 8.5 |
| 轻度 | 8.7 | 6.9 | 11.9 | 6.0 |
| 中度 | 2.0 | 1.4 | 1.6 | 2.4 |
| 重度 | 0.3 | 0.0 | 0.0 | 0.0 |
| 头疼e | ||||
| 任何c | 46.8 | 39.8 | 46.9 | 37.8 |
| 轻度 | 25.7 | 21.3 | 24.5 | 21.1 |
| 中度 | 19.2 | 16.8 | 20.4 | 16.2 |
| 重度 | 1.9 | 1.7 | 2.0 | 0.6 |
| 疲痨e | ||||
| 任何c | 52.1 | 47.6 | 54.7 | 43.6 |
| 轻度 | 23.5 | 22.8 | 25.7 | 22.0 |
| 中度 | 25.5 | 21.8 | 25.7 | 19.9 |
| 重度 | 3.2 | 2.9 | 3.3 | 1.7 |
| 寒战e | ||||
| 任何c | 20.1 | 16.4 | 19.6 | 16.2 |
| 轻度 | 12.6 | 9.9 | 10.2 | 8.8 |
| 中度 | 6.7 | 6.0 | 7.8 | 5.8 |
| 重度 | 0.8 | 0.4 | 1.6 | 1.5 |
| 肌肉疼痛(注射部位的肌肉疼痛除外)e | ||||
| 任何c | 25.7 | 22.8 | 27.4 | 22.2 |
| 轻度 | 13.6 | 10.0 | 13.5 | 10.0 |
| 中度 | 10.5 | 11.9 | 11.9 | 11.5 |
| 重度 | 1.6 | 0.8 | 2.0 | 0.8 |
| 关节痛e | ||||
| 任何c | 20.2 | 18.3 | 22.6 | 15.6 |
| 轻度 | 10.7 | 9.6 | 12.9 | 7.9 |
| 中度 | 8.6 | 8.3 | 8.6 | 6.8 |
| 重度 | 1.0 | 0.4 | 1.1 | 0.9 |
| 退烧药的使用药物 | 29.5 | 25.1 | 28.1 | 20.5 |
缩写:N =参与人数; MenACWY-CRM =脑膜炎球菌(血清群A、C、W 和Y)寡糖白喉CRM197结合疫苗;Trumenba=脑膜炎球菌血清群B因子H结合蛋白。
a.在0个月时接种Trumenba和 MenACWY-CRM,然后在6个月时单独接种Trumenba。
b.轻度(24小时内1至2次);中度(24小时内>2次);严重(需要静脉补水)。
c.“任何”是指在接种疫苗后7天内报告反应为“轻度”、“中度”或“重度”的参与者的累计频率。
d.轻度(24小时内2至3次便溏);中度(24小时内有4到5次稀便);严重(24小时内6次或更多次稀便)。
e .轻度(不妨碍活动);中度(干扰活动);严重(阻止日常活动)。
严重不良事件
在研究1中,在接种疫苗后的30天内第1次访视(0个月时),PENBRAYA的<0.1%(1/1763)和Trumenba+MenACWY-CRM的0%(0/649)参与者报告了至少1例SAE。在接种疫苗后的30天内第2次访视(6个月时),0.1%(2/1558)的PENBRAYA参与者和0%(0/562)的Trumenba参与者报告了至少1例SAE。没有一例SAE被确定与PENBRAYA疫苗接种有关。
在研究2中,在疫苗接种第1次访视后的30天内(0个月时),0.4%(2/543)的PENBRAYA和0%(0/1057)的Trumenba+MenACWY-CRM参与者报告了至少1例SAE。在接种疫苗后的30天内第2次访视(6个月时),0.2%(1/486)的PENBRAYA参与者和0%(0/946)的Trumenba参与者报告了至少1例SAE。没有一例SAE被确定与PENBRAYA疫苗接种有关。
在非对照研究3中,任一疫苗接种后30天内(0、12个月)均未报告SAE(0/294)。
6.2上市后体验
Trumenba和非美国许可的A、C、W和Y群脑膜炎球菌多糖破伤风类毒素(TT)结合疫苗(梅纳怀-TT疫苗;辉瑞公司)与PENBRAYA相关,因为PENBRAYA包括相同的A、C、W和Y组TT结合多糖成分和MenB重组蛋白成分。由于这些事件是由规模不确定的人群自愿报告的,因此不可能可靠地估计其频率或建立与疫苗接种的因果关系。以下不良反应是在 Trumenba和MenACWY-TT的上市后使用过程中自发报告的,也可能在PENBRAYA的上市后使用中出现。
免疫系统疾病:过敏反应,包括过敏反应神经系统:晕厥(昏厥)
8在特定人群中使用
8.1怀孕
妊娠免疫的登记处
有一个妊娠免疫的登记处,用于监测妊娠期免疫的于PENBRAYA的个体的妊娠结局。鼓励在怀孕期间接受PENBRAYA治疗的个人联系或让其医疗保健提供者联系1-877-390-2953,以注册或获取有关注册的信息。
风险总结
所有怀孕都有出生缺陷、流产或其他不良后果的风险。在美国普通人群中,临床认可的妊娠中主要出生缺陷和流产的估计背景风险分别为2%至4%和15%至20%。
尚无针对妊娠个体的PENBRAYA临床研究。关于妊娠个体接种PENBRAYA的现有人类数据不足以告知妊娠中疫苗相关风险。
没有对PENBRAYA进行发育毒性研究。
8.2哺乳
风险总结
尚无数据可用于评估PENBRAYA对母乳喂养婴儿或乳汁生产/排泄的影响。母乳喂养的发育和健康益处应与母亲对PENBRAYA的临床需求以及PENBRAYA或潜在母体疾病对母乳喂养的孩子的任何潜在不良影响一起考虑。对于预防性疫苗来说,潜在的母体状况是对疫苗预防的疾病的易感性。
8.4儿科使用
尚未确定PENBRAYA在10岁以下个体中的安全性和有效性。在一项临床研究中,90%小于12个月的婴儿接种了减少剂量的疫苗
Trumenba制剂有发热。PENBRAYA包含与Trumenba相同的MenB成分,数量相同。
8.5老年用药
尚未确定PENBRAYA在年龄大于65岁的个体中的安全性和有效性。
11描述
PENBRAYA(A、B、C、W和Y群脑膜炎球菌疫苗)是一种用于肌肉注射的混悬液。PENBRAYA以无菌冻干MenACWY成分的形式提供,可与无菌MenB成分复溶。
冻干的MenACWY组分包括脑膜炎分别与TT结合的血清群A、C、W和Y多糖。各组的多糖在含有葡萄糖、盐和酵母提取物的培养基中生长,然后通过沉淀和过滤进行纯化。TT是由下列物质发酵而成的破伤风梭菌在葡萄糖、盐和胰蛋白胨中,接着福尔马林解毒,然后通过一系列物理化学步骤纯化。血清组A和C多糖分别被微流化,用1-氰基-4(二甲基氨基)-吡啶鎓四氟硼酸盐(CDAP)活化,用己二酸二酰肼(ADH)衍生,然后在1-乙基-3-(3-二甲基氨基丙基)碳二亚胺存在下与TT缀合(EDAC)。血清群W和Y多糖分别被微流化,用CDAP活化,然后与TT结合。通过一系列物理化学步骤纯化缀合物,然后无菌过滤。加入氨丁三醇/蔗糖缓冲液,并将MenACWY-TT溶液冻干。
MenB成分是一种无菌悬浮液,由2种重组脂质化H因子结合蛋白(fHbp)变体组成,来自脑膜炎血清群B,1个来自fHbp亚家族A和1个来自fHbp亚家族B(分别为A05和B01)。这些蛋白质是在大肠杆菌。生产菌株在不含抗生素或动物源成分的化学成分确定的发酵培养基中生长至特定密度。从生产菌株中提取重组蛋白并通过一系列柱层析步骤纯化。添加了聚山梨醇酯80(PS80),它存在于MenB组分中。
每大约0.5 mL剂量的PENBRAYA含有脑膜炎血清组A、C、W和Y多糖(各5微克;总共20微克)与破伤风类毒素(44微克破伤风类毒素)结合,来自脑膜炎血清组B(每组60微克;总共120微克蛋白质)、L-组氨酸(0.78毫克)、氨丁三醇(0.097毫克)、蔗糖(28毫克)、磷酸铝(0.25毫克铝)、氯化钠(4.65毫克)和PS80 80(0.018毫克)。
PENBRAYA不含任何防腐剂。
12临床药理学
12.1作用机制
对侵袭性脑膜炎球菌病的保护主要是通过补体介导的抗体依赖性杀伤脑膜炎。1接种PENBRAYA疫苗可诱导产生针对下列荚膜多糖的杀菌抗体脑膜炎血清群A、C、W和Y以及fHbp亚家族A和B变异体脑膜炎B群。B群脑膜炎球菌对杀菌抗体的敏感性取决于fHbp亚家族A或亚家族B疫苗抗原与细菌菌株表达的fHbp蛋白的抗原相似性以及细菌表面表达的fHbp量。2
13非临床毒理学
13.1致癌、诱变、生育能力受损
尚未对PENBRAYA的潜在致癌性、遗传毒性或生育能力损害进行评估。
14临床研究
在研究1中通过使用人类补体评估血清杀菌活性(hSBA)的测定法测量抗体来评估PENBRAYA的有效性。对于血清组A、C、W、和Y,每组使用一种菌株。对于血清群B,使用了四种表达不同fHbp变异体的脑膜炎球菌血清群B菌株,它们代表了在美国和欧洲引起侵袭性疾病的脑膜炎球菌血清群B菌株的A和B亚家族。评估了每种菌株hSBA滴度增加4倍或更多的受试者比例,以及所有四种血清群B菌株(复合反应)的滴度大于或等于定量下限(LLOQ)的受试者比例。
14.1免疫原性
研究1是一项3期随机、主动对照、观察者盲法、多中心研究,其中美国和欧洲10至25岁的参与者在0和6个月时接受PENBRAYA或0和6个月时接受Trumenba和0个月时接受 MenACWY-CRM。所有参与者都是MenB疫苗未接种者。 MenACWY结合疫苗-未免疫和 MenACWY结合疫苗-免疫的的参与者都是研究的一部分。
表3和表4列出了研究1中接种2剂PENBRAYA后血清组A、B、C、W和Y的血清反应以及血清组B的综合反应。
在ACWY-未免疫和ACWY免疫的的参与者中,接种2剂PENBRAYA后对血清群A、C、W和Y的血清反应率被证明不劣于单剂 MenACWY-CRM后的血清反应率。在接受2剂PENBRAYA的参与者中,对血清组B主要毒株的血清反应和综合反应率被证明不劣于2剂Trumenba后的血清反应和综合反应率。
表3.接种两剂疫苗后1个月出现血清反应的受试者百分比 PENBRAYA(0和6个月)与单剂MenACWY后1个月的对比 血清群A、C、W和Y的CRM(研究1)a、b
| 血清组 | PENBRAYA % | Trumenba+ MenACWY-CRM % | PENBRAYA– MenACWY-CRM 差异c |
| N=439-451(未免疫)N=376-387(免疫的) | N=244-254(未免疫)N=222-227(免疫的) | 差异% (95%CI) | |
| A | |||
| 未免疫的 | 97.8 | 95.3 | 2.5 (-0.2, 6.0) |
| ACWY免疫的 | 93.8 | 96.9 | -3.2 (-6.5, 0.5) |
| C | |||
| 未免疫的 | 93.3 | 52.4 | 41.0 (34.4, 47.5) |
| ACWY免疫的 | 93.8 | 94.7 | -0.9 (-4.6, 3.3) |
| W | |||
| 未免疫的 | 97.3 | 73.0 | 24.3 (18.8, 30.4) |
| ACWY免疫的 | 97.1 | 96.4 | 0.7 (-2.2, 4.3) |
| Y | |||
| 未免疫的 | 94.4 | 70.6 | 23.8 (18.0, 30.1) |
| ACWY免疫的 | 93.0 | 93.7 | -0.7 (-4.6, 3.8) |
缩写:CI =置信区间;hSBA =使用人补体的血清杀菌试验;LLOQ =定量下限;LOD =检测极限; MenACWY-CRM =脑膜炎球菌(血清群A、C、W 和Y)寡糖白喉CRM197结合疫苗;Trumenba=脑膜炎球菌血清群B因子H结合蛋白。
注:对于A22,LLOQ是hSBA滴度= 1:16,对于A56、B24和B44以及血清群A、C、W和y是1:8。
注:血清反应被定义为4倍增加如下:(1)对于基线hSBA滴度<1:4(LOD)的参与者,4倍反应被定义为hSBA滴度≥1:16。(2)对于基线hSBA滴度≥ LOD且<LLOQ的参与者,缓解定义为hSBA滴度≥LLOQ的4倍。(3)对于基线hSBA滴度≥ LLOQ的参与者,反应定义为hSBA滴度≥基线滴度的4倍。
a.可评估的免疫原性人群。
b.NCT04440163
c.通过评估接种血清组之间的差异,在接种后证明了非劣效性(使用10%的裕度)。
表4.接受2剂PENBRAYA(0个月和6个月)与2剂Trumenba(0个月和6个月) 1个月后达到血清反应和综合反应的参与者百分比 (研究1)a、b
| PENBRAYA % | Trumenba+ MenACWY-CRM % | PENBRAYA– MenACWY-CRM 差异 | |
| 血清组B变异体 | N=755-845 | N=383-419 | 差异% (95%CI) |
| 血清反应c | |||
| A22 | 83.0 | 79.0 | 4.0 (-0.7, 8.9) |
| A56 | 95.9 | 94.5 | 1.4 (- 1.0, 4.3) |
| B24 | 68.1 | 57.2 | 10.9 (5.2, 16.6) |
| B44 | 86.5 | 79.2 | 7.3 (2.9, 11.9) |
| 复合的 | |||
| 第一剂前 | 1.2 | 2.0 | – |
| 第二剂后 | 78.3 | 68.7 | 9.6 (4.2, 15.2) |
缩写:CI =置信区间;hSBA =使用人补体的血清杀菌试验;LLOQ =定量下限;LOD =检测极限; MenACWY-CRM =脑膜炎球菌(血清群A、C、W 和Y)寡糖白喉CRM197结合疫苗;Trumenba=脑膜炎球菌血清群B因子H结合蛋白。
注:对于A22,LLOQ是hSBA滴度= 1:16,对于A56、B24和B44以及血清群A、C、W和y是1:8。
注:血清反应被定义为4倍增加如下:(1)对于基线hSBA滴度<1:4(LOD)的参与者,4倍反应被定义为hSBA滴度≥1:16。(2)对于基线hSBA滴度≥ LOD且<LLOQ的参与者,缓解定义为hSBA滴度≥LLOQ的4倍。(3)对于基线hSBA滴度≥ LLOQ的参与者,反应定义为hSBA滴度≥基线滴度的4倍。a .可评估的免疫原性人群。
b.NCT04440163
c.通过评估接种血清组之间的差异,在接种后证明了非劣效性(使用10%的裕度)。d .对于所有4种主要B型脑膜炎球菌菌株,复合反应= hSBA ≥ LLOQ。
15参考文献
1.人体对脑膜炎球菌的免疫力。一、体液抗体的作用。医学实验。(1969);129:1307- 1326.
2.Wang X等。2011年美国疫苗中侵袭性脑膜炎奈瑟菌分离株候选疫苗抗原的流行率和遗传多样性;29:4739-4744.
16如何供应/储存和搬运
16.1供货方式
PENBRAYA以试剂盒的形式提供,包括一瓶冻干的MenACWY成分(NDC 0069-0271- 01)、一个含有MenB成分的预填充注射器(NDC 0069-0332-01)和一个小瓶适配器。冻干的MenACWY组分与MenB组分复溶形成单剂量的PENBRAYA。
PENBRAYA以1个、5个和10个套件的纸箱包装。
| 纸箱:1套 | 0069-0600-01 |
| 纸箱:5套 | 0069-0600-05 |
| 纸箱:10套 | 0069-0600- 10 |
瓶塞、注射器端帽和柱塞塞不是由天然橡胶乳胶制成的。
16.2复溶前的储存
在原纸箱中以2℃至8℃(36℉至46℉)的温度冷藏储存。在储存期间,在含有MenB组分的预填充注射器中可能会观察到白色沉积物和清澈的上清液。水平存放纸箱,以最大限度地减少复原MenB组件所需的时间。
不要冻结。如果纸箱被冷冻,请丢弃。
16.3复溶后的储存
复溶后,立即接种PENBRAYA或储存在2℃至30℃(36℉至86℉)之间,并在4小时内使用。不要冻结。
17患者咨询信息
接种PENBRAYA前:
告知疫苗接种者接种PENBRAYA疫苗的潜在益处和风险.
建议疫苗接种者向其医疗保健提供者或疫苗不良事件报告系统报告任何不良事件,电话:1-800-822-7967https://vaers.hhs.gov/.
该产品的标签可能已更新。有关最新的处方信息,请访问
https://dailymed.nlm.nih.gov/dailymed/.
制造商:
辉瑞爱尔兰制药公司
爱尔兰科克的林加斯基迪
美国许可证号2060
LAB-1512-0.9
Hits: 91