Contents
第19章:流行性感冒
2022年9月16日
疾病
流感是一种急性呼吸道病毒感染。有3种类型的流感病毒:甲型、乙型和丙型。甲型流感和乙型流感是大多数临床疾病的原因。
流感具有高度传染性,通常潜伏期为1至3天。
这种疾病的特点是突然出现发热、寒战、头痛、肌痛和极度疲劳。其他常见症状包括干咳、喉咙痛和鼻塞。对于其他健康的人来说,流感是一种令人不快但通常自限性的疾病,通常在2至7天内康复。这种疾病可能会并发支气管炎、继发性细菌性肺炎或儿童中耳炎。流行性感冒可因脑膜炎、脑炎或脑膜脑炎而变得更为复杂。6个月以下儿童患流感导致的严重疾病的风险较高((Poehling et al., 2006; Ampofo et al., 2006; Coffin et al., 2007; Zhou et al, 2012),老年人(Thompson et al., 2003 and 2004; Zhou et al, 2012),患有基础健康疾病(如呼吸或心脏疾病、慢性神经疾病和免疫抑制)的患者以及孕妇(Neuzil et al., 1998; O’Brien et al., 2004; Nicoll et al., 2008 and Pebody et al., 2010)。妊娠期流感还可能与围产期死亡率、早产、新生儿体型较小和出生体重较低有关(Pierce et al., 2011; Mendez-Figueroa et al., 2011)和接受重症监护(Vousden et al., 2021)。虽然原发性流感肺炎是一种罕见的并发症,可发生在任何年龄,病死率高(Barker and Mullooly, 1982),但它在2009年疫情和随后的流感季节更为常见。保健专业人员的血清学研究表明,大约30%-50%的流感感染可以是无症状的(Wilde et al., 1999),但是无症状的流感感染的比例可能根据流感毒株的特征而变化。
传播途径是飞沫、气溶胶或通过直接接触感染者的呼吸道分泌物(Killingley and Nguyen-Van-Tam 2013)。流感传播迅速,尤其是在封闭的社区,如疗养院、养老院和学校。英国的大多数病例往往发生在冬季的8至10周内。这种“季节性”流感的时间、范围和严重程度可能各不相同。
甲型流感病毒在大多数年份都会导致爆发,而正是这些病毒通常会导致流行病。大流行时有发生。总体而言,B型流感倾向于导致不太严重的疾病和较小的爆发。当疾病的严重程度与甲型流感相似时,乙型流感疾病的负担主要在儿童身上。
甲型流感主要表面抗原(血凝素和神经氨酸酶)的变化使这些病毒的抗原性变得不稳定。被称为抗原漂移的微小变化随着季节的变化而逐渐发生。抗原转换周期性地发生,导致重大变化和具有不同血凝素蛋白的新亚型的出现。由于对以前病毒的免疫力可能无法完全抵御新的亚型,人群可能很少或没有免疫力,因此这可能导致大范围的流行病,甚至疫情。B型流感病毒也会发生抗原漂移,但变化不太频繁。
上个世纪发生了三次流感大流行(1918年、1957年和1968年)。世界卫生组织(WHO)于2009年6月宣布了本世纪第一次流感疫情。这是由甲型H1N1流感病毒引起的。与“季节性”流感相比,甲型(H1N1)疫情流感导致儿童和年轻成人的发病率较高,而60岁及以上成人的发病率较低(世卫组织疫情(H1N1) 2009流感临床问题咨询委员会,2010年)。对大多数人来说,这种疾病是轻微的。症状与“季节性”流感相似,尽管胃肠道症状(呕吐和腹泻)比“季节性”流感更常见。在疫情期间,英国有不到500例实验室确认的甲型H1N1流感死亡病例,总体估计病死率为0.25/1,000例临床病例(95%置信限为0.13-0.4/1,000例临床病例)((Presanis, et al., 2011)。慢性神经系统疾病、呼吸系统疾病和免疫抑制患者的死亡率最高(Pebody et al., 2010)。还发现,与肥胖个体和正常体重个体相比,患有病态肥胖(身体质量指数> 40)的个体在感染疫情流感后出现严重后果(住院和死亡)的风险更高(Morgan et al.,2010; Fezeu et al.,2011; Van Kerkhove.,2011)。孕妇患并发症的风险也增加了(Jamison et al., 2009)。甲型H1N1流感病毒感染引起的大多数严重并发症发生在有潜在健康问题的人群中,但很大一部分发生在以前健康的人群中(世卫组织疫情(H1N1) 2009流感临床问题咨询委员会,2010年)。
甲型H1N1流感病毒株在2010年至2011年流感季节继续引起广泛疾病,并继续季节性传播(该病毒现在被称为A(H1N1)pdm09)。尽管最近出现了甲型H1N1流感pdm09毒株,但仍存在出现未来流感毒株的条件,有可能导致另一场疫情(例如,来自甲型H2流感、H5N1或H7N9毒株)。
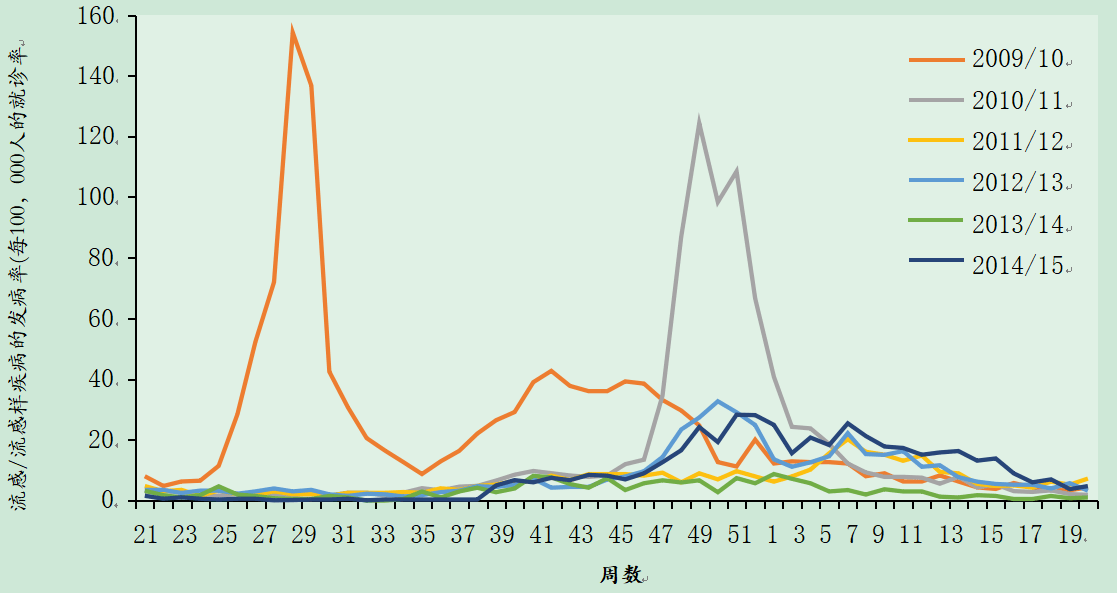
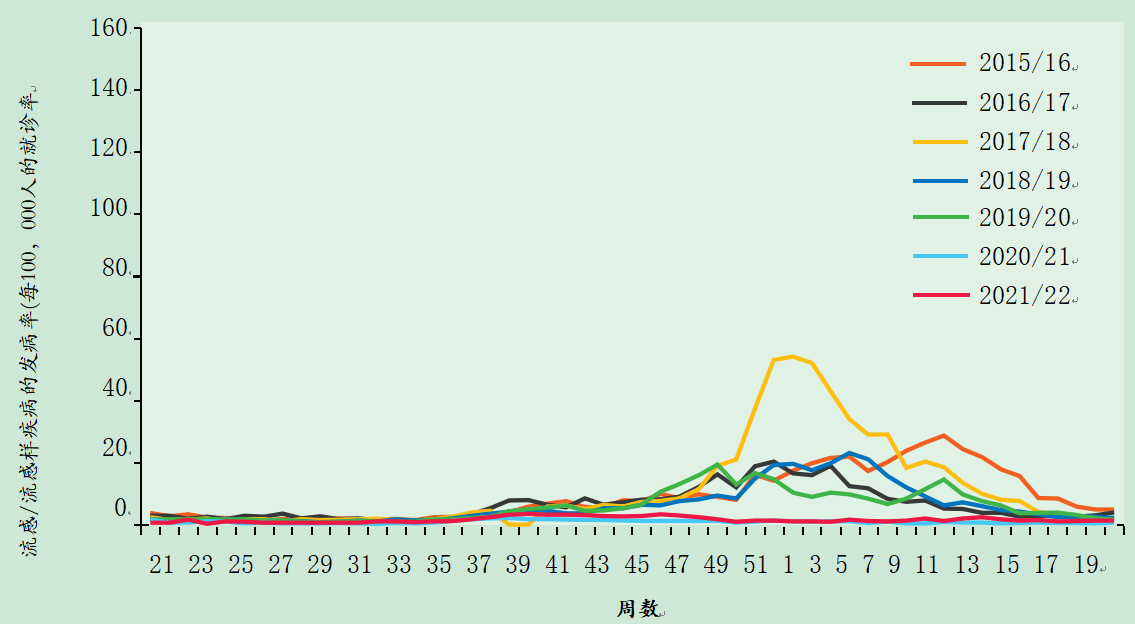
图19.1英国流感/流感样疾病的发病率(每周报告给RCGP皇家全科医师学院),显示了通常在第37周和第15周之间流感活动的时间和形式的变化(图A 2009/11至2014/15,图B 2015/16至2021/22,为清晰起见,数据分开)。然而,大部分甲型H1N1流感病毒疫情活动超出了通常的时间窗口,2009/10年第29周的非季节性高峰就证明了这一点。由于2009年英国引入了国家疫情流感服务,2009/10年的数据可能低估了流感样疾病的程度。在2020/21和2021/22季,针对新冠肺炎的非药物干预一直在进行。英国不同国家之间的流感流行病学可能存在差异。数据由英国健康安全局(UKHSA)(前英国公共卫生部(PHE),前健康保护局(HPA))和RCGP提供。
疾病的历史和流行病学
在英国,通过基于初级和二级保健的各种方案监测流感活动。一个重要的指标是基于来自哨点全科医生实践的流感样疾病新咨询报告,结合病毒学监测。
每周报告由英国健康安全局(UKHSA)(前PHE)整理。英格兰的补充信息由皇家全科医师学院(RCGP)提供,苏格兰的补充信息由苏格兰公共卫生部(前苏格兰健康保护部)提供,威尔士的补充信息由威尔士公共卫生部提供,北爱尔兰的补充信息由公共卫生局提供。
官方对流感死亡人数的估计是由UKHSA提供的。这些数字是从冬季高于预期季节性水平的全因死亡登记数中推断出来的。然而,由于没有直接检查死亡原因,高于预期水平的死亡可能包括流感以外的原因,如与寒冷天气有关的情况。在过去的十年中,英国可能由流感导致的冬季死亡人数的估计值在每年的国家流感报告中公布,其范围为不到1000人(2005年至2006年,2006年至2007年和2008年)2008年到2009年)到大于2万(2014年到2015年和2017年到2018年)。
UKHSA还收集重症监护室入院和实验室确认的流感感染死亡的数据。虽然不可能确定所有涉及流感的死亡病例,但对这些病例的调查可以评估受流感影响最严重的人的特征,包括年龄和负责任的流感类型。PHE(现为UKHSA)对2010年至2011年流感季节(当时甲型H1N1流感pdm09是主要的流行毒株)期间在英国收集的死亡病例数据进行的分析表明,临床风险组中的人死于流感并发症的风险增加(见表19.1)。
表19.1 2010年9月至2011年5月英格兰6个月至65岁以下人群中按临床风险组划分的流感相关人群死亡率和相对死亡风险。
| 致命流感病例数(%) | 每10万人中的死亡率 | 年龄调整相对风险* | |
| 在风险群体中 | 213 (59.8) | 4.0 | 11.3 (9.1-14.0) |
| 不属于任何风险群体 | 143 (40.2) | 0.4 | 基线 |
| 慢性肾病 | 19 (5.3) | 4.8 | 18.5 (11.5–29.7) |
| 慢性心脏病 | 32 (9.0) | 3.7 | 10.7 (7.3-15.7) |
| 慢性呼吸道疾病 | 59 (16.6) | 2.4 | 7.4 (5.5-10.0) |
| 慢性肝病 | 32 (9.0) | 15.8 | 48.2 (32.8-70.6) |
| 糖尿病 | 26 (7.3) | 2.2 | 5.8 (3.8-8.9) |
| 免疫抑制 | 71 (19.9) | 20.0 | 47.3 (35.5-63.1) |
| 慢性神经疾病(不包括中风/短暂性脑缺血发作) | 42 (11.8) | 14.7 | 40.4 (28.7-56.8) |
| 总计(包括22例无临床风险因素信息的病例) | 378 | 0.8 |
*使用2个可用年龄组(从6个月到15岁和从16岁到64岁)计算每个风险组的Mantel-Haenszel年龄调整比率(RR),以及相应的精确95% CI。
表格转载自2010年至2011年英国流感和其他呼吸道病毒的HPA监测报告
流感免疫接种计划
自20世纪60年代末以来,英国一直建议进行流感免疫接种,目的是直接保护那些处于流感相关发病率和死亡率较高风险的临床风险人群。2000年,该政策扩大到包括所有65岁或以上的人(年龄定义见下文)。疫苗接种和免疫联合委员会(JCVI)定期审查构成需要接种流感疫苗的临床风险群体的疾病清单。2010年,怀孕被增加为临床风险类别,2014年10月,JCVI建议病态肥胖(定义为身体质量指数40岁以上)应被视为季节性流感疫苗接种的风险因素。
表19.2显示了英国临床风险人群(不包括孕妇数据)中65岁及以上人群和65岁以下人群的流感疫苗接种率。
| 年 | 英格兰(%) | 苏格兰(%) | 威尔士(%) | 北爱尔兰(%) |
| 2000/01 | 65.4 | 65 | 39 | 68 |
| 2001/02 | 67.5 | 65 | 59 | 72 |
| 2002/03 | 68.6 | 69 | 54 | 72.1 (55.8) |
| 2003/04 | 71.0 | 72.5 | 63 | 73.4 (63.8) |
| 2004/05 | 71.5 (39.9) | 71.7 (39.3) | 63 | 72.7 (65.2) |
| 2005/06 | 75.3 (48.0) | 77.8 (46.3) | 68 | 76.8 (80.9) |
| 2006/07 | 73.9 (42.1) | 75.2 (37.8) | * | 75.1 (71.2) |
| 2007/08 | 73.5 (45.3) | 74.3 (44.4) | 64 | 75.7 (68.3) |
| 2008/09 | 74.1 (47.1) | 76.3 (47.8) | 60 (41) | 76.8 (74.0) |
| 2009/10 | 72.4 (51.6) | 75.0 (53.4) | 64 (49) | 77.0 (80.0) |
| 2010/11 | 72.8 (50.4) | 75.3 (56.1) | 65.8 (48.6) | 74.9 (78.7) |
| 2011/12 | 74.0 (51.6) | 76.6 (59.7) | 67.7 (50.0) | 77.0 (81.7) |
| 2012/13 | 73.4 (51.3) | 77.4 (59.2) | 67.7 (49.7) | 75.0 (80.2) |
| 2013/14 | 73.2 (52.3) | 77% (60.5) | 68.3 (51.1) | 75.4 (76.4) |
| 2014/15 | 72.7 (50.3) | 76.3 (54.0) | 68.1 (49.3) | 73.4 (71.8) |
| 2015/16 | 71.0 (45.1) | 74.5 (48.0) | 66.6 (46.8) | 74.4 (59.9) |
| 2016/17 | 70.5 (48.6) | 72.8 (44.9) | 66.7 (46.9) | 71.9 (57.1) |
| 2017/18 | 72.9 (49.7) | 73.7 (44.8) | 68.8 (47.1) | 71.8 (56.0) |
| 2018/19 | 72.0 (48.0) | 73.7 (42.4) | 68.3 (47.1) | 70.0 (52.4) |
| 2019/20 | 72.4 (44.9) | 74.0 (42.3) | 69.4 (44.1) | 74.8 (58.9) |
| 2020/21 | 80.9 (53.0) | 79.6 (55.9) | 76.5 (51.0) | 79.1 (67.8) |
| 2021/22 | 82.3 (52.9) | 90.2 (62.4) | 78.0 (48.2) | 54.5 ( * ) |
*数据不详
很难估计孕妇对流感疫苗的摄取量,因为更难准确地确定分母。表19.3中显示了可用的数据,但可能低估摄取量。
表19.3自孕妇流感免疫计划开始以来英国的流感疫苗接种情况。流感疫苗接种运动结束估计。
| 年 | 英格兰(%) | 苏格兰(%) | 威尔士(%) | 北爱尔兰(%) |
| 2010/11 | 38.0 | 65.6* | 39.6 | 不适用的 |
| 2011/12 | 27.4 | 41.1 | 31.7 | 58.4 |
| 2012/13 | 40.3 | 54.0 | 61.6 | 64.6 |
| 2013/14 | 39.8 | 49.2 | 43.8 | 58.0 |
| 2014/15 | 44.1 | 50.9 | 45.3 | 56.1 |
| 2015/16 | 42.3 | 51.2 | 47.8 | 55.1 |
| 2016/17 | 44.9 | 50.3 | 45.7 | 58.6 |
| 2017/18 | 47.2 | 49.4 | 72.7** | 56.7 |
| 2018/19 | 45.2 | 44.5 | 74.2** | 44.3 |
| 2019/20 | 43.7 | 42.9 | 78.5** | 46.3 |
| 2020/21 | 43.6 | 53.3 | 81.5** | 50.0 |
| 2021/22 | 37.9 | 55.2 | 78.5** | 45.9 |
*分母不完整
**孕妇疫苗接种率是通过对1月份分娩的孕妇进行调查来衡量的。
英国公共卫生机构在其网页上提供了有关儿童计划疫苗接种的信息,以及对各个临床风险群体和不同年龄组流感疫苗接种的更详细分析。
将流感计划扩展至儿童
2012年,JCVI建议将该方案扩大到所有2岁至17岁以下的儿童(JCVI,2012年)。JCVI建议,鉴于有证据表明在幼儿中具有更高的效力,特别是在单剂量注射后,以及对漂移毒株的潜在保护作用,扩大该方案的首选疫苗应该是鼻内注射减毒活流感疫苗(LAIV)。与注射疫苗相比,接种途径也使LAIV成为更容易接种的疫苗,并且更容易被父母和儿童接受。
2013年开始分阶段将流感方案扩展到儿童。英国每个国家中有资格参加该计划的人群将在每个季度的英格兰年度流感信函和地方政府的首席医疗官信函中更新。
年度流感疫苗接种计划信件
英格兰:
https://www.gov.uk/government/collections/annual-flu-programme
北爱尔兰:https://www.publichealth.hscni.net/search/node?keys=influenza+programme
苏格兰:https://www.sehd.scot.nhs.uk/index.asp?name=&org=&keyword=seasonal+flu
威尔士:https://www.gov.wales/health-circulars
流感疫苗
由于流感病毒的性质不断变化,世界卫生组织(WHO)在全世界监测流感病毒的流行病学。每年,它都会为北半球和南半球即将到来的冬季推荐疫苗毒株(https://www.who.int/teams/global-influenza-programme/vaccines/who-recommendations).
流感疫苗是根据世卫组织建议制备的。目前在英国计划中使用的所有疫苗都是四价的,包含4个毒株:2个流行的甲型流感亚型和2个流行的乙型流感毒株。三价疫苗省略了一个乙型流感病毒。
大多数流感疫苗是从鸡胚中生长的病毒制备的。也有批准的在细胞系上生产的流感疫苗,来自在细胞中生长的病毒(基于细胞的疫苗)或重组疫苗,其使用在昆虫细胞中从DNA序列产生的血凝素抗原。
流感疫苗的生产是复杂的,而且时间安排很紧,受到宣布世卫组织建议和在流感季节前接种疫苗之间时间的限制。制造商可能无法在短时间内对疫苗的意外需求做出反应。
如果出现具有流行或疫情潜力的新甲型流感亚型(如2009年出现的甲型H1N1流感病毒),流感疫苗不太可能与新出现的毒株完全匹配。在这些情况下,正如在2009年第二波疫情期间发生的那样,可以开发和实施针对该毒株的单价疫苗。
在英国,除了一种流感疫苗之外,所有的流感疫苗都是灭活的,不会在接种疫苗的人群中引起临床流感。一种疫苗,减毒活流感疫苗(LAIV),含有减毒(弱化)并适应寒冷的活病毒,因此它们只能在鼻腔通道中的较低温度下复制。这些活病毒不能在身体的其他地方有效复制,但可能会引起轻微的鼻炎症状。灭活疫苗通过肌肉注射接种。LAIV通过鼻腔喷雾接种。
所有授权的流感疫苗都需要符合人类药物委员会制定的安全、有效和质量标准。自2021年1月1日起,欧盟药品法仅在北爱尔兰适用于英国。药品和保健产品管理局(MHRA)负责在英国授予新医药产品的上市许可。在流感季节到来之前,在年度流感规划网页上公布了英国可用的流感疫苗列表(可从以下网址获得:https://www.gov.uk/government/collections/annual-flu-programme).
疫苗中的成分与流通病毒之间的不匹配确实时有发生,并解释了疫苗有效性估计值的大部分差异(Osterholm等人,2012)。当抗原漂移确实发生时,仍然建议接种疫苗,因为可以针对漂移的毒株提供一定程度的保护,并且疫苗仍然应该针对疫苗中的其他毒株提供保护。历史上,对于含有来自单一谱系的B型流感病毒株的三价疫苗,疫苗和B型流感病毒株之间的错配经常发生。然而,除了2014年至2015年,在最近几年中,疫苗与流感季节期间传播的甲型流感病毒密切匹配。
免疫接种后,可在14天内获得保护性免疫应答。尽管在11月中旬之前,英国的流感活动通常不显著,但流感季节可能会提前开始(就像2003年至2004年那样)。因此,理想的免疫时间是9月至11月初。疫苗提供的保护被认为至少可以持续一个流感季节。然而,由于在随后的季节中提供的保护水平可能较低,并且从一个季节到下一个季节,流行毒株可能会发生变化,因此建议每年重新接种疫苗,这一点很重要。
疫苗效力
流感疫苗的有效性和成本效益取决于疫苗的成分、流行毒株、疫苗的类型和接种者的年龄。
一项荟萃分析(包括三价鸡蛋灭活疫苗中的流感病毒株与流通中的流感病毒株漂移或不匹配时的研究)表明,在18至65岁的成人中,对确诊疾病的总体有效性为59% (95%置信区间51-67)(Osterholm et al., 2012)。
LAIV被认为提供了比灭活疫苗更广泛的保护,因此与疫苗中的原始病毒株相比,具有针对经历抗原漂移的毒株提供更好保护的潜力(Ambose et al., 2011; Hoft et al 2011; Subbramanian et al 2010)。LAIV已被证明为儿童提供了比三价灭活流感疫苗更高水平的保护(Belshe et al., 2007);荟萃分析表明对确诊疾病的疗效为83% (95%置信区间69-91) (Osterholm et al., 2012; Ashkenazi et al., 2006; Fleming et al., 2006)。
2016年8月,鉴于美国疾病控制和预防中心(CDC)报告的LAIV低有效性的新证据,JCVI被要求审查英国和其他国家2015至2016赛季的数据。与美国相反,英国2015年至2016年的数据显示了儿童流感疫苗接种的整体有效性和影响,以及接种疫苗者和更广泛人群中流感病例的减少。
JCVI继续推荐使用儿童鼻喷流感疫苗预防儿童流感,并强烈支持在英国继续开展这一重要的公共卫生项目(JCVI,2016年8月)。最近在英国的研究结果也证实了其对LAIV的良好效果(Pebody et al., 2016, Pebody et al., 2017; Pebody et al., 2020c)。此外,在试点全面小学教育方案的地区,对较大和较小年龄组的间接保护都得到了证明。(Pebody et al., 2015, Pebody et al,, 2018a, Sinnathamby et al.,2021)
使用含有来自每个谱系的B株的四价流感疫苗有望改善疫苗的匹配性,从而提供更广泛的针对流行性乙型流感病毒的保护。几项研究表明,与三价疫苗相比,四价疫苗可能更具成本效益(Meir et al., 2015., Thommes et al., 2015)。由于乙型流感在儿童中相对更常见,近年来为儿童方案集中采购的疫苗一直是四价制剂。由于儿童期计划将有助于通过减少人群间的传播来更好地控制乙型流感,PHE进行了建模工作,以了解一旦儿童期计划在小学年龄的儿童中完全建立,四价疫苗在成人中的益处(Thorrington et al., 2017)。该模型表明,与老年人使用三价疫苗相比,使用四价疫苗获得的健康益处相对较小,但这种益处在65岁以下有风险的成年人中更为显著,包括孕妇。在2020年至2022年期间,由于针对新冠肺炎的非药物干预,检出率显著下降,因此正在对B Yamagata谱系进行监测;Yamagata谱系灭绝的证明将预示着三价流感疫苗的回归。
有大量证据表明,随着年龄的增长,对疫苗接种的免疫反应大幅下降(Haralambieva et al., 2015)。老年人的抗体反应低于年轻人,这可能意味着与年轻人相比,流感疫苗的有效性较低(Goodwin et al., 2006; Lang et al., 2012)。在2016年至2017年英国流感季节期间,未能证明老年人初级保健中针对经医学护理、实验室确认的流感的疫苗的有效性(Pebody et al., 2017)。PHE对2010年至2011年、2016年至2017年的汇总初级保健数据进行了年龄分层分析(Pebody et al., 2018b)。在65至74岁年龄组中,该分析显示了对所有流感、甲型H1N1 pdm09、乙型流感的显著效果,以及对甲型H3N2的一些保护证据。然而,在75岁以上的人群中,汇总的估计值无法证明所有季节和所有流感病毒类型的任何显著效果。
认识到标准流感疫苗对甲型(H3N2)流感的低效力,特别是在老年人中,正在使用几种方法来尝试和减轻免疫衰老和/或卵适应(其中疫苗病毒获得突变以使它们能够在卵中良好生长)的影响。2017年8月,一种含佐剂的三价灭活疫苗(aTIV)在英国获得上市许可,可用于65岁及以上的老年人。aTIV自1997年以来在欧洲一些国家获得许可,自2015年以来在美国获得许可。2020年5月,一种四价佐剂疫苗(aQIV)获准在65岁及以上人群中使用。有证据表明,在老年人中,有佐剂疫苗比无佐剂疫苗具有更高的免疫原性和更高的有效性(Van Buynder et al., 2013, Dominich et al., 2017)。自2018年12月以来,一种高剂量TIV (TIV-HD)也已获得该年龄组的许可。
TIV-HD的抗原含量是标准TIV的4倍,自2009年以来已在美国获得许可。与标准剂量疫苗相比,TIV-HD产生更强的免疫反应,在预防65岁及以上成人流感方面更有效(DiazGranados et al., 2014);另一项研究发现,TIV-HD疫苗还与该年龄组住院风险较低有关(Gravenstein et al., 2017)。
2017年10月和2018年6月,JCVI分别审查了aTIV和TIV-HD疫苗的证据,并看到了PHE的数学模型,该模型表明,即使在非常保守的有效性估计下,这两种疫苗在65岁及以上的人群中也比未添加疫苗的鸡蛋疫苗更具成本效益(JCVI,2017年10月;JCVI,2018年6月)。来自英国2018年至2019年监测季节的数据表明,老年人的aTIV提供了针对初级保健护理感染和住院治疗的保护(Pebody et al. 2020a; Pebody et al. 2020b)。
鉴于在接近2017年至2018年的季节中,在所有年龄组中观察到的甲型H3N2流感疫苗有效性下降,在2017年至2018年期间,在所有年龄组中达到无显著效果的顶点,2018年10月,JCVI还审查了关于四价细胞培养灭活疫苗(QIVc)的信息。QIVc被许可用于成人和2岁以上儿童,是一种灭活疫苗,由在哺乳动物细胞中生长的流感病毒制成,不需要使用鸡蛋进行分离和生产。细胞培养的疫苗如QIVc应该克服在使用在卵中生长的病毒(QIVe和TIVe)的疫苗中看到的与卵适应性相关的一些问题,并且与野生型参考毒株相比,其改变了A(H3N2)卵繁殖疫苗病毒的抗原谱。来自2017年至2018年美国流感季节占主导地位的A(H3N2)的数据表明,与老年人的QIVe相比,QIVc在有效性方面略有优势(Izurieta et al., 2019)。然而,美国2018年至2019年流感季节(以甲型H1N1流感pdm09和甲型H3N2流感为主)的数据(Izurieta et al., 2020a)与美国2019年至2020年B-Victoria流感和甲型H1N1流感pdm09为主的季节的数据没有发现差异(Izurieta et al., 2020b)。
另一种在其生产中不需要鸡蛋的疫苗是重组四价流感疫苗(QIVr ),其使用在昆虫细胞中表达的血凝素亚单位的重组蛋白。这种疫苗自2013年以来一直在美国使用。JCVI在2020年6月讨论了QIVr的潜在用途,QIVr现在在英国被许可用于18岁及以上的人。在2014年至2015年的一项美国试验中,QIVr显示出在老年人中提供了优于基于鸡蛋的疫苗的保护,尽管在65岁及以上的老年人中没有定论(Dunkle et al., 2017)。在美国2019年至2020年季节,发现QIVr在老年人中比其他疫苗更有效(Izurieta 2020b)。
JCVI(2021年9月)建议,对于65岁及以上的人群,aQIV、QIVr和QIV-HD是首选疫苗,如果没有这些疫苗,则QIVc被视为可接受的替代疫苗。
JCVI建议使用QIVr和QIVc对高危人群中18岁至65岁以下的成年人进行疫苗接种。如果没有其他选择,也可以考虑在这个年龄组使用QIVe。JCVI建议,对于LAIV不适合的高危人群中2岁至18岁以下的儿童,QIVc是首选,其次是QIVe (JCVI,2020年10月)。
对于接受NHS流感疫苗接种的50至64岁非临床风险群体的成年人,JCVI建议,如果QIVe支持优先考虑更脆弱的队列以获得被认为最有效的疫苗,则QIVe是合适的(2021年12月)。详情请参见“新冠肺炎疫情期间的流感免疫接种计划”一节。
关于新型疫苗有效性的国际证据不断积累(ECDC 2020)。JCVI定期审查其关于季节性流感疫苗的建议。JCVI关于季节性流感疫苗的最新建议可在JCVI的网页上找到:https://www.gov.uk/government/groups/joint-committee-on-vaccination-and-immunisation#influenza-vaccines-jcvi-advice。关于哪些人有资格接种流感疫苗以及哪些疫苗适合每个季节在合格人群中使用的具体建议发布在Annual influenza vaccination programme letters。
存储(参见第3章)
流感疫苗应储存在原包装中,温度为+2℃至+8℃,避光保存。所有疫苗在某种程度上都对冷热敏感。高温加速了大多数疫苗效力的下降,从而缩短了它们的保质期。如果疫苗没有在许可中规定的温度下储存,其功效、安全性和质量可能会受到不利影响(参见单个产品的产品特性概要(SmPC))。冷冻还可能导致某些疫苗的反应原性增加和效力损失,还可能导致容器出现细微裂纹,导致内容物污染。
如SmPC所示,在温度不超过25℃的情况下,可将LAIV置于冰箱之外/从冷链中取出最长12小时。如果疫苗在12小时后没有被使用,就应该被处理掉。
剂型
用于肌肉注射的灭活流感疫苗以预装注射器中的悬浮液形式提供。他们应该在服用前摇匀。
LAIV是在一个特殊的涂药器中以鼻喷雾剂的形式提供的。
剂量和时间表
流感疫苗的剂量和时间表应根据疫苗使用建议(见下文)给出。
6个月至9岁以下的儿童属于临床风险人群,且之前未接种过流感疫苗,应接种第二剂疫苗。之前接种过1剂或1剂以上任何流感疫苗(包括疫情单价流感疫苗)的儿童应被视为之前已接种过疫苗(见后面关于儿童的章节)。
JCVI建议,不属于临床风险人群的2岁至9岁以下儿童,无论之前是否接种过流感疫苗,都只需注射一剂LAIV。该建议不同于LAIV SmPC中的建议。父母要求接种IIV而不是LAIV的9岁以下健康儿童,即使他们以前没有接种过流感疫苗,也应该提供单剂疫苗。这同样适用于因禁忌症而不能接受LAIV的健康儿童。
接种
灭活流感疫苗通常应注射到上臂的三角肌(或婴儿的大腿前外侧),优选通过肌肉注射。
缺乏证据表明,在服用抗凝剂的人群中,皮下注射疫苗比肌肉注射疫苗更安全。皮下途径本身可能与局部反应的增加有关。
正在接受稳定抗凝治疗的个体,包括正在接受华法林治疗的个体,如果其预定的国际标准化比值(INR)测试是最新的,并且其最新的INR低于其治疗范围的上限,则可以接受肌肉注射疫苗。接种时应使用细针(23或25号),然后用力按压(不摩擦)至少2分钟。如果有任何疑问,请咨询负责处方或监测个人抗凝治疗的临床医生。
如果熟悉出血风险的医生认为疫苗或类似的小剂量肌肉注射可以通过这种途径合理安全地施用,则患有出血性疾病的个体可以通过肌肉注射接种疫苗。如果个体接受减少出血的药物/治疗,例如血友病的治疗,可以在给予这种药物/治疗后不久安排肌内疫苗接种。应使用细针(23或25号)接种疫苗,然后用力按压该部位(不摩擦)至少2分钟(ACIP 2022)。应告知个人/父母/护理人员注射后血肿的风险。
减毒活流感疫苗(LAIV)通过鼻内途径接种,并在涂药器中提供,允许每个鼻孔分剂量接种(总剂量为0.2毫升,每个鼻孔0.1毫升)。该装置允许鼻内接种,而不需要额外的专业培训。如果患者在接种后打喷嚏或擤鼻涕,无需重复接种。有关对严重鼻塞患者使用LAIV的建议,请参见本章的注意事项部分。
由于英国市场上每年都有各种各样的流感疫苗上市,因此在患者记录中准确记录疫苗的确切品牌、批号和接种地点尤为重要。如果出于职业原因接种疫苗,建议雇主保留疫苗接种记录。重要的是,在普通诊所或其他地方(例如,在社区药房或产前诊所)接种的疫苗应及时记录在个人的适当健康记录中(使用适当的临床代码)。如果在全科诊所之外进行,疫苗接种记录应返回到患者的全科诊所,以便在需要时进行临床随访,并避免重复接种。电子护理点数据采集系统可以支持这一点。
疫苗使用建议
流感免疫接种计划的目的是保护那些一旦患流感最有可能患重病或死亡的人,并减少感染的传播,从而有助于保护那些对自己的免疫接种反应不佳的脆弱患者。
为此,要求全科医生主动识别所有需要接种流感疫苗的患者,并编制一份建议接种流感疫苗的患者名册。然后可以提前订购足够的疫苗,并邀请患者参加计划好的免疫会议或预约。鉴于某些流感疫苗仅限于在特定年龄组使用,因此在订购疫苗时应始终参考个别产品的SmPCs,以确保这些疫苗适用于特定年龄组的患者。
研究发现,全科医生手术中的流程与流感疫苗的高摄取率相关(Dexter et al., 2012)。这包括在外科指定一个人负责流感免疫接种计划;更新和维护符合流感免疫接种条件的患者的准确登记,并直接联系符合条件的患者,邀请他们进行免疫接种。另见NICE指南(2018年)NG103。
应告知患者,在流感季节,许多其他微生物会导致类似于流感的呼吸道感染,例如新冠肺炎(新型冠状病毒)、普通感冒病毒和呼吸道合胞病毒。流感疫苗不能预防这些疾病。
最好在流感病毒开始传播之前,向以下人群提供流感疫苗:
- 所有年龄在65岁或以上的人(定义请见下一季度的年度流感信函)
- 表19.4中显示的临床风险组中年龄在6个月或以上的所有人
- 作为儿童流感计划的一部分,队列中的其他儿童有资格接种疫苗。(见下文)
在新冠肺炎疫情期间,更多的群体有资格接种流感疫苗。参见上一节新冠肺炎疫情期间的流感疫苗接种。
表19.4应接种流感疫苗的临床风险人群。流感疫苗应提供给下列临床风险类别的人群。
| 临床风险类别 | 示例(此列表并不详尽,决定应基于临床判断) |
| 慢性呼吸道疾病 | 需要持续或重复使用吸入性或全身性类固醇的哮喘,或先前恶化需要住院的哮喘。 慢性阻塞性肺病(COPD ),包括慢性支气管炎和肺气肿;支气管扩张、囊性纤维化、间质性肺纤维化、尘肺和支气管肺发育不良(BPD)。 曾因下呼吸道疾病入院的儿童。 参见LAIV的注意事项部分。 |
| 慢性心脏病和血管疾病 | 先天性心脏病、伴有心脏并发症的高血压、慢性心力衰竭、需要定期药物治疗和/或缺血性心脏病随访的个体。这包括患有心房纤维性颤动、外周血管疾病或有静脉血栓栓塞病史的个体。 |
| 慢性肾脏疾病 | 3、4或5期慢性肾病、慢性肾衰竭、肾病综合征、肾移植。 |
| 慢性肝病 | 肝硬化,胆道闭锁,慢性肝炎。 |
| 慢性神经系统疾病(包含在威尔士DES指南中) | 中风、短暂性脑缺血发作(TIA)。由于神经或神经肌肉疾病而导致呼吸功能受损的情况(例如脊髓灰质炎综合征患者)。临床医生应在个人评估的基础上,为临床上易受伤害的个人提供免疫接种,包括患有脑瘫、严重或深度和多重学习障碍(PMLD)、唐氏综合征、多发性硬化症、痴呆、帕金森病、运动神经元疾病以及相关或类似疾病的个人;或神经系统或肌肉的遗传性和变性疾病;或者严重的神经残疾。 |
| 糖尿病和肾上腺功能不全 | 1型糖尿病、需要胰岛素或口服降糖药的二型糖尿病、饮食控制型糖尿病。阿狄森氏病,继发性或三级肾上腺功能不全,需要类固醇替代。 |
| 免疫抑制(参见流感减毒活疫苗的禁忌症和注意事项部分) | 由于疾病或治疗导致的免疫抑制,包括接受化疗导致免疫抑制的患者、接受根治性放疗的患者、实体器官移植受体、骨髓或干细胞移植受体、艾滋病毒携带者(处于所有阶段)、多发性骨髓瘤或影响免疫系统的遗传疾病(例如IRAK-4、NEMO、补体紊乱、SCID)。正在接受免疫抑制或免疫调节的个体 生物疗法,包括但不限于抗TNF-α-阿仑单抗、ofatumumab、利妥昔单抗、接受蛋白激酶抑制剂或PARP抑制剂的患者,以及用类固醇节约剂如环磷酰胺和霉酚酸酯治疗的个体。 接受或可能接受全身性类固醇治疗超过一个月的个体,剂量相当于泼尼松龙每天20毫克或以上(任何年龄),或对于20公斤以下的儿童,剂量为每天每公斤1毫克或以上。 任何有血液系统恶性肿瘤病史的人,包括白血病、淋巴瘤和骨髓瘤,系统性红斑狼疮和类风湿性关节炎,以及可能需要长期免疫抑制治疗的银屑病。 一些免疫功能低下的患者可能对疫苗产生次优的免疫反应。 |
| 无脾症或脾功能障碍 | 这也包括纯合性镰状细胞病、遗传性球形红细胞增多症、重型地中海贫血和腹腔综合征等可能导致脾功能障碍的疾病。 |
| 无脾症或脾功能障碍 | 这也包括纯合性镰状细胞病、遗传性球形红细胞增多症、重型地中海贫血和腹腔综合征等可能导致脾功能障碍的疾病。 |
| 病态肥胖(三级肥胖)* | 体重指数≥40 kg/m的成年人。 |
*该患者群体中的许多人已经符合资格,因为肥胖并发症使他们处于另一个风险类别
上面的列表并不详尽,医生应进行临床判断,考虑流感加剧患者可能患有的任何基础疾病的风险,以及流感本身导致的严重疾病的风险。在这种情况下,即使患者不属于上述临床风险人群,也应接种流感疫苗。
其他风险群体
还应向免疫缺陷个体的家庭接触者提供疫苗接种,因此这些个体预计在冬季的大部分时间里共享住所,因此对他们来说持续的密切接触是不可避免的。这可能包括护理人员(见下文)。
除上述内容外,应向直接接触患者/客户的医护和社会护理人员提供免疫接种,以保护他们并减少流感在医护和社会护理场所内的传播,有助于保护对自己的免疫接种反应不佳的个人,并避免中断为他们提供护理的服务。这将包括:
- 直接参与病人或客户护理的卫生和社会护理人员
- 居住在长期护理院或其他长期护理机构的人,在这些机构中,感染可能会迅速传播,并导致高发病率和死亡率(这不包括监狱、青少年罪犯机构、大学宿舍等)。)
- 领取照料者津贴的人,或老年人或残疾人的主要照料者,如果照料者生病,他们的福利可能受到威胁。在全科医生的实践中,在其他临床风险群体的背景下,应根据个人情况酌情给予疫苗接种
- 直接参与提供健康和社会护理的其他人,他们和脆弱的患者/客户暴露于流感的风险增加(英国卫生部门的指南中提供了更多信息)
儿童
研究表明,对于以前没有接种过流感疫苗的幼儿,可能需要2剂灭活流感疫苗才能达到足够的抗体水平(Allison et al., 2006; Neuzil et al., 2006; Ritzwoller et al., 2005; Shuler et al., 2007;Wright et al., 1977)。LAIV已被证明为儿童提供了比灭活流感疫苗更好的保护(Belshe et al., 2007; Ashkenazi et al., 2006; Fleming et al.,2006)和研究也表明,在以前未接种疫苗的儿童中,单剂量LAIV后具有有意义的疗效(Bracco Neto et al., 2009; Block et al., 2009)。有鉴于此,如下文所述,JCVI建议根据儿童的年龄、临床症状、提供的疫苗类型以及他们以前是否接种过流感疫苗,对儿童使用不同的流感疫苗方案。该建议不同于某些SmPCs。LAIV和灭活流感疫苗可以互换;如果需要,第二次注射应在第一次注射后至少4周,按照该疫苗制造商的SmPC进行。
不属于临床风险群体的2岁至17岁以下的儿童
英国各个国家的疫苗接种资格可能有所不同。请参见英格兰每年的流感信件和下一个/当前季节有资格接种流感疫苗的儿童队列的权力下放管理。
无论以前是否接种过流感疫苗,除非有禁忌,每个季节都应注射一剂LAIV。
6个月至18岁以下的儿童,他们是免疫缺陷个体的家庭接触者。
与免疫缺陷者有家庭接触的儿童应根据临床风险人群中儿童的建议进行疫苗接种。可能需要注射灭活疫苗来代替LAIV。参见免疫抑制和艾滋病毒携带者一节。
临床风险人群中6个月至2岁以下的儿童
这些儿童提供推荐的灭活四价流感疫苗。那些以前没有接种过流感疫苗的人应该接种第二剂疫苗,至少4周后。灭活流感疫苗是可互换;如果需要,第二次注射应在第一次注射后至少4周,按照该疫苗制造商的SmPC进行。LAIV未经许可或不建议2岁以下儿童使用。QIVc不允许2岁以下儿童使用。对于2岁以下对鸡蛋过敏的儿童,建议在标签外提供QIVc。
有风险因素的早产儿在适当的年龄接种疫苗是很重要的。儿童满6个月大后,应考虑接种流感疫苗。
临床风险群体中2岁至18岁以下的儿童
临床风险人群中2岁至18岁以下的儿童应接受LAIV,除非有医学禁忌或不适合(参见禁忌症和注意事项章节)。从未接种过流感疫苗的2岁至9岁以下儿童应在至少4周后接种第二剂LAIV。如果无法获得第二剂LAIV(由于批次过期),可以接种灭活流感疫苗。
对于LAIV医学上禁用的临床风险群体中的儿童,应提供合适的四价灭活流感疫苗。以前没有接种过流感疫苗的2岁至9岁以下的儿童应在至少4周后接种第二剂疫苗。
表19.5总结了儿童流感疫苗接种的建议。
| 合格队列 | 临床风险人群中的儿童和免疫缺陷个体的家庭接触者 | 不属于临床风险群体的儿童1 |
| 6个月到2岁以下 | 提供合适的四价灭活流感疫苗。 那些以前没有接种过流感疫苗的人应该接种两次(间隔至少4周)。 | 不适用。 |
| 2岁至9岁以下 | 提供LAIV(除非有医学禁忌2) 那些以前没有接种过流感疫苗的人应该接种两次(间隔至少4周)。 | 提供LAIV1 |
| 9岁至18岁以下的儿童 | 提供LAIV(除非有医学禁忌2)。 | 提供LAIV1 |
- 请参见英格兰的年度流感信函,以及不属于临床风险群体但有资格在即将到来的/当前季节接种流感疫苗的儿童队列的权力下放管理。
- 如果LAIV是医学禁忌或不适合,那么提供四价灭活流感疫苗。
新冠肺炎疫情期间有资格接受流感免疫接种的其他人群
2020年7月,JCVI建议增加流感疫苗和延长流感方案,作为2020年至2021年流感季节的临时措施。下文概述的拟议措施的目的是在流感季节保护最弱势群体,并减轻对国民保健制度的潜在压力,因为流感、新型冠状病毒病毒和其他呼吸道病原体可能会共同传播。
委员会强调了尽可能提高最弱势群体以及卫生和社会保健工作者的疫苗接种率的重要性。委员会还支持将儿童计划中的疫苗接种扩大到中学年龄和所有50至64岁的成年人,作为2020年至2021年流感季节的临时措施。此外,资格扩大到受保护人口的家庭接触者,这些人因医学原因被界定为对新冠肺炎极其脆弱。2020年8月,JCVI同意,在下一个冬季(2021年至2022年)继续实施这一强化方案是合理的。
因此,2021年至2022年的流感方案包括向50岁至64岁的人提供疫苗接种,将儿童方案进一步扩展到中学(7至11年级),并尽可能提高包括卫生和社会护理工作者在内的例行提供疫苗接种的群体的覆盖率。
2021年12月,JCVI建议,2022年至2023年的流感活动仍存在不确定性,并赞同之前JCVI关于优先扩大中学规模的建议及其疫情时间的建议,即如果资金可用,所有50至64岁的人都可以接受接种疫苗。
有关更多信息,请参见:www.gov.uk/government/publications/national-flu-immunisation-programme-plan。请参见各主管部门的首席医疗官信函(参见第8页的链接)。
流感和其他疫苗的联合接种
灭活流感疫苗可与其他疫苗同时注射。肌肉注射疫苗应在不同的部位注射,最好是在不同的肢体。如果接种在同一个肢体,它们应该至少分开2.5厘米(美国儿科学会,2003)。
LAIV也可以与其他活疫苗或灭活疫苗同时注射。尽管以前曾建议,在不能同时施用疫苗的情况下;活病毒疫苗之间应间隔4周,JCVI建议LAIV和其他活疫苗之间不需要特定的间隔(见第6章)。
新冠肺炎疫苗和流感疫苗
一项联合使用阿斯利康和辉瑞生物科技新冠肺炎疫苗与灭活流感疫苗的英国研究证实了可接受的免疫原性和反应原性(Lazarus et al, 2021)。相比之下,一项关于诺华新冠肺炎疫苗与灭活流感共同接种的研究显示,对新冠肺炎的抗体反应有所减弱(Toback et al, 2022)。尽管其临床意义尚不清楚,但诺华新冠肺炎疫苗的接种应与流感疫苗的接种间隔至少7天。对于其他新冠肺炎疫苗,如果发生联合用药,应告知患者每种疫苗相关的潜在不良事件的可能时间。如果疫苗没有一起注射,它们可以在任何间隔时间注射,尽管将疫苗间隔一天或两天可以避免对全身副作用的混淆。
LAIV鼻喷疫苗可以在接种新冠肺炎疫苗的同时接种。LAIV在鼻粘膜中引发免疫反应。这不太可能干扰身体对新冠肺炎疫苗的反应。同样,对LAIV的反应不太可能受到对新冠肺炎疫苗的免疫反应的影响。鼻腔流感喷雾剂的副作用非常轻微且短暂,不太可能受到新冠肺炎疫苗的任何影响。
带状疱疹疫苗和流感疫苗
Zostavax可与灭活流感疫苗同时接种。Shingrix可与灭活流感疫苗同时接种。由于缺乏Shingrix疫苗与含佐剂流感疫苗(aQIV)联合接种的数据,因此不应该常规提供与含佐剂流感疫苗同时接种的预约。根据目前的信息,理想情况下,日程安排应间隔至少7天,以避免潜在不良事件的不正确归因。然而,如果患者需要两种疫苗,并且需要快速保护或被认为可能会失去随访,则仍可考虑联合用药。
禁忌症
在决定接种哪种疫苗时,应始终参考单个产品的SmPCs。极少数人不能接种任何流感疫苗。如有疑问,应立即向当地NHS英格兰筛查和免疫团队、传染病控制/健康保护顾问或专业顾问寻求适当的建议,以便最大限度地缩短个人未接种疫苗的时间。
流行性感冒
任何流感疫苗都不应接种给以下人群:
- 确认对先前剂量的疫苗有过敏反应,或
- 对疫苗的任何成分(除卵清蛋白之外——见注意事项)的确认过敏反应
确诊的过敏反应很少见(更多信息见第8章)。其他过敏情况,如皮疹,可能会更常见,并不是进一步免疫接种的禁忌症。仔细的事件史通常会区分真正的过敏反应和其他不是由疫苗引起的或不威胁生命的事件。在后一种情况下,有可能继续免疫过程。必须就疫苗和接种疫苗的情况征求专家意见(更多信息见第6章)。必须考虑到个人未接种疫苗的风险。
LAIV不应用于因以下疾病或免疫抑制治疗而出现严重免疫缺陷的儿童或青少年:急性和慢性白血病;淋巴瘤;细胞免疫缺陷;以及抗逆转录病毒疗法无法抑制的艾滋病毒感染;和高剂量皮质类固醇。它不禁忌用于正在接受抗逆转录病毒治疗并获得病毒抑制的感染艾滋病毒的儿童或青少年;或接受局部皮质类固醇、吸入性皮质类固醇或低剂量全身性皮质类固醇的患者,或接受皮质类固醇作为替代疗法的患者,例如用于肾上腺机能不全的患者。根据LAIV SmPC的描述,由于瑞氏综合征与水杨酸盐和野生型流感感染有关,因此本品禁用于接受水杨酸盐治疗的儿童和青少年(局部疾病的局部治疗除外)。
预防措施
没有发烧或全身不适的小病不是推迟免疫接种的正当理由。如果个人急性不适,免疫接种可能会推迟,直到他们完全康复。这是为了避免由于错误地将任何体征或症状归因于疫苗的副作用而混淆任何急性疾病的鉴别诊断。
没有关于LAIV(当给予因感染或过敏引起的严重鼻塞或流鼻涕(鼻炎)的儿童时)的有效性的数据。由于严重的鼻塞可能会阻碍疫苗向鼻咽粘膜的输送,因此应考虑推迟接种直至鼻塞缓解,或者如果合适,可改为肌肉注射流感疫苗。
植入人工耳蜗的儿童可以安全地接受LAIV,尽管理想情况下不是在植入手术前一周或植入手术后2周内,或者如果有持续脑脊液漏的证据。
怀孕
应向孕妇提供灭活流感疫苗,因为孕妇患严重流感的风险更高(Pebody et al., 2010)。此外,许多研究表明,怀孕期间接种流感疫苗可为出生后最初几个月的婴儿提供针对流感的被动免疫(Benowitz et al., 2010; Eick et al., 2010; Zaman et al., 2008; Poehling et al., 2011)。一项研究表明,流感疫苗接种降低了与流感感染相关的早产和出生时婴儿较小的可能性(Omer et al., 2011)。
流行性感冒
一项关于妊娠期流感疫苗安全性的研究综述得出结论,在妊娠的任何三个月都可以安全有效地施用灭活流感疫苗(Tamma等人,2009)。LAIV的数据更加有限。没有证据表明LAIV有风险(Tamma et al., 2009)。LAIV的活病毒已经被减毒(弱化)并适应了寒冷,因此它们只能在鼻腔通道中的较低温度下复制。这些活病毒不能在身体的其他地方有效复制,因此没有理论基础来担心胎儿或母亲肺部的感染。然而,孕妇最好接种灭活流感疫苗。向符合条件的女孩提供LAIV时,没有必要特别询问或测试怀孕情况,也没有必要建议最近接种过疫苗的女孩避免怀孕。
免疫抑制和艾滋病毒感染者
根据上述建议和禁忌症,患有免疫抑制或感染艾滋病毒(不考虑CD4计数)的个人应接种流感疫苗。这些人可能不会产生完全的抗体反应。
还应考虑免疫功能低下的个人的家庭接触者的流感疫苗接种,这意味着这些个人预计在冬季的大部分时间里共享住所,因此对他们来说持续的密切接触是不可避免的。
在LAIV,接种疫苗后1至2周内,理论上有可能将减毒活流感病毒传播给免疫低下的接触者。在英国广泛使用LAIV(超过1000万剂)的过程中,尚未有免疫功能低下患者因无意中接触疫苗病毒而患病或感染的报告。然而,如果可能或不可避免地与非常严重的免疫缺陷患者(例如需要隔离的骨髓移植患者)密切接触(例如家庭成员),应考虑使用适当的替代性灭活流感疫苗。
皇家儿科和儿童健康学院(https://www.rcpch.ac.uk/), 英国艾滋病毒协会(BHIVA)关于在艾滋病毒阳性成人中使用疫苗的指南(BHIVA,2015)和儿童艾滋病毒协会(CHIVA)免疫指南http://www.chiva.org.uk/guidelines/immunisation/
严重哮喘或活动性喘息
JCVI建议(2019),根据最近的数据,无论处方剂量如何,吸入皮质类固醇的哮喘儿童都可以安全地使用LAIV。
不建议目前正在经历急性加重症状的儿童和青少年使用LAIV,包括那些在过去72小时内喘息加重和/或需要额外支气管扩张剂治疗的儿童和青少年。应为这些儿童提供合适的灭活流感疫苗,以避免保护延迟。
对于需要定期口服类固醇以维持哮喘控制的儿童,或之前因哮喘恶化需要重症监护的儿童,其安全性数据有限——此类儿童应仅在专家的建议下使用LAIV。由于这些儿童感染流感的风险较高,那些不能接种LAIV的儿童应接种合适的灭活流感疫苗。
流行性感冒
患有严重哮喘且未接种过流感疫苗的9岁以下儿童将需要接种第二剂疫苗(根据情况接种LAIV或灭活疫苗)。
鸡蛋过敏
在所有提供疫苗接种的环境中,应具备识别和处理过敏反应的设施和训练有素的工作人员(见第8章)。不含鸡蛋或卵清蛋白含量极低的灭活流感疫苗(< 0.12微克/毫升-相当于0.5毫升剂量< 0.06微克),研究表明,这些药物可安全用于鸡蛋过敏患者((des Roches et al., 2012)。LAIV之前的卵清蛋白上限为1.2微克/毫升,也已被证明(JCVI,2015年)可安全用于鸡蛋过敏儿童。LAIV的卵清蛋白含量从2016年开始进一步降低(每0.2ml剂量≤0.024微克)。流感疫苗的卵清蛋白含量在流感季节之前公布。www.gov.uk/government/publications/influenza-vaccines-marketed-in-the-uk
JCVI建议(JCVI,2015年)对鸡蛋过敏的儿童(包括之前对鸡蛋过敏的儿童)可以在任何情况下(包括初级保健和学校)安全地接种LAIV疫苗。唯一的例外是那些因既往对鸡蛋有严重过敏反应而需要重症监护的儿童,他们没有相关数据;这些儿童最好在医院接种疫苗。在该组2岁及以上的儿童中,LAIV仍然是首选疫苗,因为鼻内途径不太可能引起全身反应。对于这6个月到2年,卵清蛋白含量非常低(低于0.12微克/毫升)的灭活流感疫苗是合适的。JCVI建议两岁以下对鸡蛋过敏的儿童可以接种四价无蛋灭活疫苗QIVc。这是一个标示外的建议,有未发表的数据支持,这些数据表明在小于2岁的儿童中,QIVc的免疫原性无劣效性,并且与QIVe的安全性非常相似。
对鸡蛋过敏(比需要重症监护的过敏反应轻)但同时患有其他LAIV禁忌症的儿童,可在任何情况下提供卵清蛋白含量非常低(低于0.12微克/毫升)的灭活流感疫苗。临床风险组中的儿童和9岁以下以前未接种过流感疫苗的儿童将需要第二剂疫苗(视情况为LAIV疫苗或灭活疫苗)。对鸡蛋过敏的2岁以上儿童也可以接种细胞培养的四价无蛋灭活疫苗(QIVc),该疫苗已获准在该年龄组使用。
患有鸡蛋过敏的成年患者可以在任何情况下使用卵清蛋白含量低于0.12微克/毫升(相当于
每0.5毫升剂量0.06微克),但对鸡蛋有严重过敏反应的人除外,这些人以前需要重症监护。应该给这些成年人提供无蛋疫苗。如果这是不可能的,他们应该被转介到一个专家进行评估,接受免疫接种在医院。在成人中许可的无蛋疫苗是细胞生长四价灭活疫苗(QIVc)和重组四价无蛋疫苗(QIVr)。
与抗流感病毒药物一起使用
流感抗病毒药物有可能降低LAIV的有效性。因此,流感抗病毒药物和LAIV不能同时使用。LAIV应延迟至流感抗病毒药物治疗停止后48小时。
服用LAIV后2周内服用流感抗病毒药物可能会对疫苗的有效性产生不利影响。
医护人员暴露于LAIV病毒
理论上,医护人员可能在接种疫苗期间和/或从最近接种疫苗的患者处低水平暴露于LAIV病毒。疫苗病毒是冷适应和减毒的,不太可能引起有症状的流感。在广泛使用LAIV的美国,从未有过疫苗病毒在医疗机构中传播的报告,也没有因无意中接触疫苗病毒而导致医疗专业人员患病或感染的报告。因此,CDC认为从环境中获得疫苗病毒的风险是未知的,但可能很低(CDC,2013)。然而,作为一项预防措施,非常严重的免疫抑制个体不应使用LAIV。其他免疫抑制不太严重或怀孕的医护人员应遵循正常的临床实践,以避免吸入疫苗,并确保自己适当接种疫苗。
LAIV的疏忽管理
如果免疫功能低下的个体接受LAIV治疗,那么应该评估免疫抑制的程度。如果患者免疫功能严重受损,应考虑抗病毒预防,否则,如果他们在接种疫苗后4天(通常的潜伏期)内出现流感样症状,应建议他们寻求医疗建议。如果抗病毒药物用于预防或治疗,那么为了在即将到来的流感季节最大限度地发挥其保护作用,还应为患者提供灭活流感疫苗。这可以直接给出。
不良反应
注射部位的疼痛、肿胀或发红、低烧、不适、颤抖、疲劳、头痛、肌痛和关节痛是肌内或皮内接种后常见的症状。注射部位也可能会形成一个无痛的小结节(硬结)。如果不进行治疗,这些症状通常会在1至2天内消失。鼻塞/鼻漏、食欲下降、虚弱和头痛是服用LAIV后常见的不良反应。
可能出现荨麻疹、血管水肿、支气管痉挛和过敏反应等即时反应。
在过去30年中,接种流感疫苗后很少报告以下不良事件,但尚未确定因果关系:神经痛、感觉异常、惊厥(见下文注释)和一过性血小板减少症、伴有一过性肾脏受累的血管炎以及脑脊髓炎等神经系统疾病。
据报道,接种流感疫苗后很少出现格林-巴利综合征(GBS),在美国的一项研究中,每100万接种流感疫苗的人中有一例((Laskey et al., 1998)。这种联系在其他研究中没有发现(Hurwitz et al., 1981; Kaplam et al., 1982; Roscelli et al., 1991),包括英国的一项大型研究(Stowe et al., 2009)。后一项研究发现GBS和流感样疾病之间有很强的联系。流感样疾病后GBS的风险增加,如果特异于流感病毒感染,加上缺乏与流感疫苗的偶然联系,表明流感疫苗应预防GBS (Stowe et al., 2009)。
流行性感冒
与流感疫苗Viroflu和Pandemrix相关的副作用和不良反应以前已有记载。Viroflu(让桑-西拉格有限公司,前身为Crucell)可能与5岁以下儿童的发热率高于预期有关。在英国发现接种ASO3佐剂疫情A/H1N1 2009疫苗Pandemrix后发作性睡病的风险增加(Miller et al., 2013),这与芬兰和瑞典首次发现的结果一致(Nohynek et al., 2010; Partinen et al., 2010)。Viroflu和Pandemrix已不再用于英国流感免疫规划。
成人接种流感疫苗后出现的所有严重可疑反应和儿童接种流感疫苗后出现的所有可疑反应都应使用黄卡计划报告接种品和保健品管理局,地址为https://www.mhra.gov.uk/yellowcard。
无论年龄大小,黑三角产品的所有可疑反应也应报告。黑三角是在疫苗推出的早期阶段添加到产品信息中的标准符号,以鼓励报告所有可疑的不良反应。
以下疫苗带有一个黑色三角符号(▲):
- 含佐剂的四价灭活流感疫苗(aQIV,Seqirus制造)
- 四价细胞培养的灭活流感疫苗(Seqirus生产的QIVc),
- 重组四价灭活流感疫苗(QIVr,Supemtek,由Sanofi Pasteur生产)和四价Influvac亚单位Tetra,一种基于鸡蛋的灭活流感疫苗(由Viatris生产的QIVe,以前为Mylan)
- 高剂量四价灭活流感疫苗(QIV-HD)
热性惊厥和发热
在其他国家,一种灭活流感疫苗(由bioCSL生产的Fluvax,由辉瑞公司在英国以Enzira或流感疫苗(裂解病毒体,灭活))与5岁以下儿童高热惊厥的高发生率有关。Enzira的SmPC还显示,5岁至9岁以下年龄组的发烧率较高。由于存在热性惊厥的风险,Enzira的适应症仅限于成人和5岁及以上的儿童。这种疫苗将不再是儿童使用的中央供应的一部分,也不再可以购买。
仍然没有证据表明在英国使用的其他流感疫苗与儿童热性惊厥的类似风险相关(Stowe et al., 2011; Bryan and Seabroke, 2011)。
疑似病例、接触者和疫情的管理
在某些情况下,可以使用抗病毒药物来预防或治疗流感。NICE发布了关于使用抗病毒药物预防和治疗流感的指南:
奥司他韦、金刚烷胺(综述)和扎那米韦用于预防流感
https://www.nice.org.uk/guidance/ta158
金刚烷胺、奥司他韦和扎那米韦用于治疗流感:
http://guidance.nice.org.uk/TA168
鼓励和保持良好的手和呼吸卫生总是很重要的,这有助于减少流感的传播。
供应
由于社区中对流感疾病的猜测,对流感疫苗的需求有时会不可预测地增加。因此,建议诊所根据其“风险”登记,在免疫接种季节之前订购足够的疫苗。
关于供应和如何订购疫苗的信息将在4个英国国家分别提供的指南中给出——详情请参见各自的网站。LAIV和四价灭活疫苗是为6个月至18岁以下符合条件的儿童集中购买的。这些疫苗应按照常规儿童免疫规划的常规机制订购(另见第3章)。
英格兰和地方政府之间的供应安排可能有所不同。
流感疫苗供应商
阿斯利康英国有限公司
葛兰素史克0800 221 441
MASTA 0113 238 7552
赛诺菲巴斯德0845 023 0440
Seqirus英国有限公司08457 451500
Viatris(原迈兰)0800 358 7468
在流感季节到来之前,在英格兰国家流感免疫规划计划中公布了在英国可用的流感疫苗列表(可从以下网址获得:https://www.gov.uk/government/collections/annual-flu-programme).
参考
Advisory Committee on Immunization Practices (ACIP) Special Situations, General Best Practice Guidelines for
Immunization: Best Practices Guidance of the Advisory Committee on Immunization Practices (ACIP) July 12,
2022. https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/special-situations.html
Allison MA Daley MF, Crane LA et al. (2006) Influenza vaccine effectiveness in healthy 6- to 21-month-old
children during the 2003-2004 season. J Pediatr 149: 755-62.
Ambrose CS, Levin MJ, Belshe RB. The relative efficacy of trivalent live attenuated and inactivated vaccines in
children and adults. Influenza And Other Respiratory Viruses 2011;5:67-75.
American Academy of Pediatrics (2003) Active immunization. In: Pickering LK (ed.) Red Book: 2003 Report of
the Committee on Infectious Diseases, 26th edition. Elk Grove Village, IL: American Academy of Pediatrics,
Ampofo K, Gesteland PH, Bender J et al. (2006) Epidemiology, complications, and cost of hospitalization in
children with laboratory-confirmed influenza infection. Pediatrics 118(6):2409-17.
Ashkenazi S, Vertruyen A, Aristegui J. et al. (2006) Superior relative efficacy of live attenuated influenza
vaccine compared with inactivated influenza vaccine in young children with recurrent respiratory tract
infections. Pediatr Infect Dis J 25(10): 870-9. http://www.ncbi.nlm.nih.gov/sites/entrez/17006279
Ashkenazi S, Vertruyen A., Aristegui, J. et al. [2006] Superior relative efficacy of live attenuated influenza
vaccine compared with inactivated influenza vaccine in young children with recurrent respiratory tract
infections. Pediatr Infect Dis J 870-9.
Barker WH and Mullooly JP (1982) Pneumonia and influenza deaths during epidemics. Arch Int Med 142:
Belongia EA, Simpson MD, King JP, Sundaram ME, Kelley NS, Osterholm MT, et al. Variable influenza vaccine
effectiveness by subtype: a systematic review and meta-analysis of test-negative design studies. Lancet Infect
Dis. 2016;16(8):942-51. https://doi.org/10.1016/S1473-3099(16)00129-8 PMID: 27061888
Belshe RB, Edwards KM, Vesikari T et al. (2007) Live attenuated versus inactivated influenza vaccine in infants
and young children. N Engl J Med 356(7): 685-96. http://www.ncbi.nlm.nih.gov/sites/entrez/17301299
Benowitz I, Esposito DB, Gracey KD et al. (2010) Influenza vaccine given to pregnant women reduces
hospitalization due to influenza in their infants. Clin Infect Dis. 51: 1355- 61.
Block S L, Toback SL, Yi T et al. (2009) Efficacy of a single dose of live attenuated influenza vaccine in
previously unvaccinated children: a post hoc analysis of three studies of children aged 2 to 6 years. Clin Ther.
Bracco Neto H, Farhat CK, Tregnaghi MW, et al. (2009) Efficacy and safety of 1 and 2 doses of live
attenuated influenza vaccine in vaccine-naive children. Pediatr Infect Dis J. 28: 365-71
British HIV Association (2015) guidelines on the use of vaccines in HIV-positive adults: https://www.bhiva.org/
file/PYnNXxGAUfVeD/2015-Summary-of-recommendations.pdf
Bryan P and Seabroke S (2011) No increased risk of febrile convulsions after seasonal influenza immunisation
Centers for Disease Control and Prevention. Prevention and Control of Seasonal Influenza with Vaccines:
Recommendations of the Advisory Committee on Immunization Practices — United States, 2013–2014
September 20, 2013 / 62(RR07);1- 43 http://www.cdc.gov/mmwr/preview/mmwrhtml/ rr6207a1.htm?s_cid=rr
6207a1_w#LiveAttenuatedInfluenzaVaccineshttp://
www.cdc.gov/mmwr/preview/mmwrhtml/rr6207a1.htm?s_cid=rr6207a1_w#LiveAttenuatedInfluenzaVaccines
Centers for Disease Control and Prevention (2012) Persons Who Should Not Be Vaccinated Influenza
Prevention and Control Recommendations. http://www.cdc.gov/flu/professionals/acip/shouldnot.htm
Coffin SE, Zaoutis TE, Rosenquist AB et al. (2007) Incidence, complications, and risk factors for prolonged
stay in children hospitalized with community-acquired influenza. Pediatrics 119(4):740-8.
Committee on Safety of Medicines (2003) Further data support safety of thiomersal in vaccines. Available
from: www.mhra.gov.uk/Safetyinformation/Generalsafetyinformationandadvice/
Product-specificinformationandadvice/accinesafetyThiomersal(ethylmercury) containingvaccines/index.htm
Department of Health (2013) Health Technical Memorandum 07-01: Safe management of healthcare waste.
https://www.gov.uk/government/uploads/system/uploads/ attachment_data/file/167976/HTM_07-01_Final.pdf
Des Roches A, Paradis L, Gagnon R, et al. (2012). Egg-allergic patients can be safely vaccinated against
influenza. J Allergy Clin Immunol. 130(5):1213-6.
Dexter LJ, Teare MD, Dexter M et al. (2012) Strategies to increase influenza vaccination rates: outcomes of a
nationwide cross-sectional survey of UK general practice. BMJ Open. 2:e000851.
Domnich A, Arata L, Amicizia D et al. Effectiveness of MF59-adjuvanted seasonal influenza vaccine in the
elderly: A systematic review and meta-analysis. Vaccine 35 (2017) 513–520
DiazGranados CA, Dunning AJ, Kimmel M et al. Efficacy of High-Dose versus Standard-Dose Influenza
Vaccine in Older Adults. N Engl J Med. 2014;371(7):635-645
Dunkle LM, Izikson R, Patriarca P, Goldenthal KL, Muse D, Callahan J, et al. Efficacy of recombinant influenza
vaccine in adults 50 years of age or older. New England Journal of Medicine. 2017;376(25):2427-36
ECDC (2020). Systematic review of the efficacy, effectiveness and safety of newer and enhanced seasonal
influenza vaccines for the prevention of laboratory confirmed influenza in individuals aged 18 years and over.
Stockholm: European Centre for Disease Prevention and Control. https://www.ecdc.europa.eu/en/
publications-data/seasonal-influenza-systematic-review-efficacy-vaccines
Eick AA, Uyeki TM, Klimov A et al. (2010) Maternal influenza vaccination and effect on influenza virus
infection in young infants. Arch Pediatr Adolesc Med. 165: 104-11.
Fezeu L, Julia C, Henegar A, Bitu J et al. Obesity is associated with higher risk of intensive care unit admission
and death in influenza A (H1N1) patients: a systematic review and meta- analysis Obes Rev. 2011
Aug;12(8):653-9.
Fleming DM, Watson JM, Nicholas S et al. (1995) Study of the effectiveness of influenza vaccination in the
elderly in the epidemic of 1989/90 using a general practice database. Epidemiol Infect 115: 581–9.
Fleming DM, Crovari P, Wahn U et al. (2006) Comparison of the efficacy and safety of live attenuated coldadapted influenza vaccine, trivalent, with trivalent inactivated influenza virus vaccine in children and
adolescents with asthma. Pediatr Infect Dis J 25(10): 860-9. http://www.ncbi.nlm.nih.gov/sites/
entrez/17006278
Goddard NL, Kyncl J and Watson JM (2003) Appropriateness of thresholds currently used to describe
influenza activity in England. Common Dis Public Health 6: 238–45.
Goodwin K, Viboud C, Simonsen L. Antibody response to influenza vaccination in the elderly: a quantitative
review. Vaccine. 2006 Feb 20;24(8):1159-69. Epub 2005 Sep 19.
Gravenstein S, Davidson HE, Taljaard M et al. Comparative effectiveness of high-dose versus standard-dose
influenza vaccination on numbers of US nursing home residents admitted to hospital: a cluster-randomised
trial. Lancet Respir Med. 2017 Sep;5(9):738-746
Haralambieva IH, Painter SD, Kennedy RB, Ovsyannikova IG, Lambert ND, Goergen KM, et al. (2015) The
Impact of Immunosenescence on Humoral Immune Response Variation after Influenza A/H1N1 Vaccination in
Older Subjects. PLoS ONE 10(3): e0122282. doi:10.1371/journal.pone.0122282
Hardelid P, Pebody R, Andrews N. Mortality caused by influenza and respiratory syncytial virus by age group
in England and Wales 1999–2010. Influenza and Other Respiratory Viruses 2013; 7(1), 35–45.
Health Protection Agency 2011, Surveillance of influenza and other respiratory viruses in the UK: 2010-2011
report. https://webarchive.nationalarchives.gov.uk/ukgwa/20140714095607/http://www.hpa.org.uk/web/
HPAweb&HPAwebStandard/HPAweb_C/1296687412376
Heinonen OP, Shapiro S, Monson RR et al. (1973) Immunization during pregnancy against poliomyelitis and
influenza in relation to childhood malignancy. Int J Epidemiol 2: 229–35.
Heinonen S, Silvennoinen H, Lehtinen P et al. (2011) Effectiveness of inactivated influenza vaccine in children
aged 9 months to 3 years: an observational cohort study. Lancet Infect Dis 11(1): 23-9.
Hoft DF, Babusis E, Worku S, et al. Live and inactivated influenza vaccines induce similar humoral responses,
but only live vaccines induce diverse T-cell responses in young children. J Infect Dis 2011;204:845–53.
Hurwitz ES, Schonberger LG, Nelson DB et al. (1981) Guillain-Barré syndrome and the 1978-1979 influenza
vaccine. N Eng J Med 304(26):1557-61.
Izurieta HS, Chillarige Y,Kelman J et al. Relative Effectiveness of Cell-Cultured and Egg-Based Influenza
Vaccines Among Elderly Persons in the United States, 2017-2018. JID 2019 doi: 10.1093/ infdis/jiy716.
Izurieta HS, Chillarige Y, Kelman J, et al. (2020a) Relative Effectiveness of Influenza Vaccines Among the
United States Elderly, 2018-2019. J Infect Dis. 2020 Jun 29;222(2):278-287. doi: 10.1093/infdis/jiaa080
Izurieta HS, Lu M, Kelman J, et al. (2020b) Comparative effectiveness of influenza vaccines among U.S.
Medicare beneficiaries ages 65 years and older during the 2019-20 season. Clin Infect Dis. 2020 Nov
19:ciaa1727
Jamieson D, Honein MA, Rasmussen SA et al. (2009) H1N1 2009 influenza virus infection during pregnancy
in the USA. Lancet 374: 451-8.
The Joint Committee for Vaccination and Immunisation statement on the annual influenza vaccination
programme – extension of the programme to children 25 July 2012 Available at: https://www.gov.uk/
government/uploads/system/uploads/attachment_data/file/ 224775/JCVI-statement-on-the-annual-influenzavaccination-programme-25-July-2012. pdf
Joint Committee on Vaccination and Immunisation Minutes of the February 2015 meeting. Available at:
https://www.gov.uk/government/groups/joint-committee-on-vaccination-and- immunisation#minutes
Joint Committee on Vaccination and Immunisation. Statement on the use of nasal spray flu vaccine for the
childhood influenza immunisation programme. August 2016. Available at: https://www.gov.uk/government/
uploads/system/uploads/attachment_data/file/548515/JCVI_statement.pdf
Joint Committee on Vaccination and Immunisation Minutes of the June 2017 meeting. Available at : https://
www.gov.uk/government/groups/joint-committee-on-vaccination-and-immunisation#minutes
Joint Committee on Vaccination and Immunisation Minutes of the October 2017 meeting. Available at :
https://www.gov.uk/government/groups/joint-committee-on-vaccination-and-immunisation#minutes
Joint Committee on Vaccination and Immunisation Minutes of the October 2018 meeting. Available at:
https://www.gov.uk/government/groups/joint-committee-on-vaccination-and-immunisation#minutes
Joint Committee on Vaccination and Immunisation Minutes of the October 2020 meeting. Available at:
https://www.gov.uk/government/groups/joint-committee-on-vaccination-and-immunisation#minutes
Joint Committee on Vaccination and Immunisation Extraordinary Meeting on COVID-19 Immunisation
prioritisation held 6 July 2020. Available at: https://www.gov.uk/government/groups/joint-committee-onvaccination-and-immunisation#minutes
Joint Committee on Vaccination and Immunisation minutes of the August 2020 influenza subcommittee.
Available at: https://www.gov.uk/government/groups/joint-committee-on-vaccination-andimmunisation#minutes
Joint Committee on Vaccination and Immunisation (2021) Advice on influenza vaccines for 2022/23.
Available from https://www.gov.uk/government/groups/joint-committee-on-vaccination-andimmunisation#influenza-vaccines-jcvi-advice
Joint Committee on Vaccination and Immunisation. Minutes of the September 2021 influenza subcommittee
meeting. Available at: https://www.gov.uk/government/groups/joint-committee-on-vaccination-andimmunisation#minutes
Joint Committee on Vaccination and Immunisation. Minutes of the December 2021 meeting. Available at:
https://www.gov.uk/government/groups/joint-committee-on-vaccination-and-immunisation#minutes
Kaplan JE, Katona P, Hurwitz ES et al. (1982) Guillain-Barré syndrome in the United States, 1979-80 and
1980-81. JAMA 248(6):698-700
Killingley B, and Nguyen-Van-Tam J. (2013) Routes of influenza transmission. Influenza and Other Respiratory
Viruses 7( Suppl. 2), 42– 51.
Lang P-O, Mendes A, Socquet J, Assir N, Govind S, Aspinall R. Effectiveness of influenza vaccine in aging and
older adults: comprehensive analysis of the evidence. Clinical Interventions in Aging. 2012;7:55-64.
doi:10.2147/CIA.S25215.
Lasky T, Terracciano GJ, Magder L et al. (1998) The Guillain-Barré syndrome and the 1992–1993 and 1993–
1994 influenza vaccines. N Engl J Med 339: 1797–1802.
Lau LLH, Cowling BJ, Fang VJ et al. (2010) Viral shedding and clinical illness in naturally acquired influenza
virus infections. J Infect Dis 201: 1509-16.
Lazarus R, Baos S, Cappel-Porter H, et al. The Safety and Immunogenicity of Concomitant Administration of
COVID-19 Vaccines (ChAdOx1 or BNT162b2) with Seasonal Influenza Vaccines in Adults: A Phase IV,
Multicentre Randomised Controlled Trial with Blinding (ComFluCOV). https://papers.ssrn.com/sol3/papers.
cfm?abstract_id=3931758
Mangtani P, Cumberland P, Hodgson CR et al. (2004) A cohort study of the effectiveness of influenza vaccine
in older people, performed using the United Kingdom general practice research database. J Infect Dis 190(1):
1–10
Meier G, Gregg M, Poulsen Nautrup B. Cost-effectiveness analysis of quadrivalent influenza vaccination in
at-risk adults and the elderly: an updated analysis in the U.K. J Med Econ. 2015;18(9):746-61.
McNeil SA, Dodds, LA, Fell, DB et al. Effect of respiratory hospitalization during pregnancy on infant
outcomes. Am J Obstet Gynecol 204: [6 Suppl 1.] S54-7, Epub 2011 Apr 24. 2011 Jun.
Mendez-Figueroa H, Raker, C and Anderson, BL. Neonatal characteristics and outcomes of pregnancies
complicated by influenza infection during the 2009 pandemic. Am J Obstet Gynecol 204. 204: [6 Suppl 1.]
S58-63, Epub 2011 Mar 31. 2011 Jun.
Miller E, Andrews N, Stellitano L, et al. Risk of narcolepsy in children and young people receiving AS03
adjuvanted pandemic A/H1N1 2009 influenza vaccine: retrospective analysis. BMJ 2013;346: f794.
Morgan OW, Bramley A, Fowlkes A, et al. Morbid obesity as a risk factor for hospitalization and death due to
2009 pandemic influenza A(H1N1) disease PLoS One. 2010 Mar 15;5(3):
Neuzil KM, Reed, GW, Mitchel, EF et al. Impact of influenza on acute cardiopulmonary hospitalizations in
pregnant women. Am J Epidemiol 148: [11.] 1094-102. 1998 Dec 1.
Neuzil KM, Jackson LA, Nelson J et al. (2006) Immunogenicity and reactogenicity of 1 versus 2 doses of
trivalent inactivated influenza vaccine in vaccine-naive 5-8-year-old children. J Infect Dis 194(8): 1032-9.
http://www.ncbi.nlm.nih.gov/sites/entrez/16991077
NICE 2018. Flu vaccination: increasing uptake. Nice guideline 103. 22 August 2018, updated August 2022.
National Institute for Health and Care Excellence and Public Health England. ISBN: 978-1-4731-2864-4 www.
nice.org.uk/guidance/ng103
Nicoll A, Ciancio B, Tsolova S et al. (2008) The scientific basis for offering seasonal influenza immunisation to
risk groups in Europe. Euro Surveill 13(43). pii: 19018.
Nohynek H, Jokinen J, Partinen M, et al. AS03 adjuvanted AH1N1 vaccine associated with an abrupt increase
in the incidence of childhood narcolepsy in Finland. PLoS One 2012; 7: e33536.
O’Brien MA, Uyeki TM, Shay DK et al. (2004) Incidence of outpatient visits and hospitalizations related to
influenza in infants and young children. Pediatrics 113(3 Pt 1):585-93.
Omer SB, Goodman, D, Steinhoff, MC et al. Maternal influenza immunization and reduced likelihood of
prematurity and small for gestational age births: a retrospective cohort study. PLoS Med. 8: [5.] e1000441
Epub 2011 May 31. 2011 May.
Osterholm, MT, Kelley, NS, Sommer, A and Belongia, EA (2012) Efficacy and effectiveness of influenza
vaccines: a systematic review and meta-analysis. Lancet Infect Dis 12. (1.), 36-44.
Partinen M, Saarenpaa-Heikkila O, Ilveskoski I, et al. Increased incidence and clinical picture of childhood
narcolepsy following the 2009 H1N1 pandemic vaccination campaign in Finland. PLoS One 2012; 7: e33723.
Pebody R et al. Pandemic influenza A (H1N1) 2009 and mortality in the United Kingdom: risk factors for
death, April 2009 to March 2010. Eurosurveillance 2010 15(20): 19571.
Pebody R, Warburton F, Ellis J et al. Effectiveness of seasonal influenza vaccine for adults and children in
preventing laboratory-confirmed influenza in primary care in the United Kingdom: 2015/16 end-of-season
results. Eurosurveillance. 2016;21(38):pii=30348. https://doi.org/10.2807/1560-7917.ES.2016.21.38.30348
Pebody R, Green H, Andrews N et al. Uptake and impact of vaccinating school age children against influenza
during a season with circulation of drifted influenza A and B strains, England, 2014/15. Eurosurveillance.
2015;20(39):pii=30029. https://doi.org/10.2807/1560-7917.ES.2015.20.39.30029
Pebody R, Warburton F, Ellis J et al. End-of-season influenza vaccine effectiveness in adults and children,
United Kingdom, 2016/17. Eurosurveillance 2017, 22, 17-00306 (2017), https://doi.org/10.2807/1560-7917.
ES.2017.22.44.17-00306
Pebody RG, Sinnathamby MA, Warburton F et al (2018a). Uptake and impact of vaccinating primary schoolage children against influenza: experiences of a live attenuated influenza vaccine programme, England,
2015/16. Eurosurveillance, 23, 1700496
Pebody RG, Warburton F, Andrews N, et al. (2018b). Uptake and effectiveness of influenza vaccine in those
aged 65 years and older in the United Kingdom, influenza seasons 2010/11 to 2016/17. Eurosurveillance
23(39): 1800092.
Pebody RG, Whitaker H, Ellis J et al. (2020a) End of season influenza vaccine effectiveness in primary care in
adults and children in the United Kingdom in 2018/19. Vaccine 38(3): 489-497. 10.1016/j.
vaccine.2019.10.071
Pebody R, Whitaker H, Zhao H et al. (2020b). Protection provided by influenza vaccine against influenzarelated hospitalisation in ≥65 year olds: Early experience of introduction of a newly licensed adjuvanted
vaccine in England in 2018/19. Vaccine, 38(2), 173-179. doi:10.1016/j.vaccine.2019.10.032
Pebody RG, Zhao H, Whitaker HJ et al. (2020c). Effectiveness of influenza vaccine in children in preventing
influenza associated hospitalisation, 2018/19, England. Vaccine, 38(2), 158-164. doi.org/10.1016/j.
vaccine.2019.10.035
Pierce M, Kurinczuk, JJ, Spark, P et al. Perinatal outcomes after maternal 2009/H1N1 infection: national
cohort study. BMJ. 342. 342:d3214. doi: 10.1136/bmj.d3214.: d3214. 2011 2011 Jun 14.
Poehling KA, Edwards KM, Weinberg GA et al. (2006) The underrecognized burden of influenza in young
children. N Engl J Med 355(1):31-40.
Poehling KA, Szilagyi, PG, Staat, MA et al. (2011) Impact of maternal immunization on influenza
hospitalizations in infants. Am J Obstet Gynecol 204: [6 Suppl 1.] S141-8. Epub Feb 23. 2011 Jun.
Presanis AM, Pebody RG, Paterson BJ et al. Changes in severity of 2009 pandemic A/ H1N1 in England: A
Bayesian evidence synthesis. BMJ. 343:d5408 doi:10.1136/bmj. d5408. 2011 Sept 8.
Ritzwoller DP, Bridges CB, Shetterly S et al. (2005) Effectiveness of the 2003-2004 influenza vaccine among
children 6 months to 8 years of age, with 1 vs 2 doses. Pediatrics 116: 153-9.
Roscelli JD, Bass JW, Pang L (1991) Guillain-Barré syndrome and influenza vaccination in the US Army 1980-
1988. Am J Epidemiol 133(9):952-5.
Shuler CM, Iwamoto M, Bridges CB, et al. (2007) Vaccine effectiveness against medically attended,
laboratory-confirmed influenza among children aged 6 to 59 months, 2003- 2004.
Pediatrics 119: e587-95.
Sinnathamy MA, Warburton F, Andrews N, et al. (2021) Uptake and impact of vaccinating primary school
children against influenza: Experiences in the fourth season of the live attenuated influenza vaccination
programme, England, 2016/2017. Influenza Other Respir Viruses. 2021 Aug 17. DOI: 10.1111/irv.12898
Stowe J, Andrews N, Wise L and Miller E (2009) Investigation of the temporal association of Guillain-Barré
Syndrome with influenza vaccine and influenza-like illness using the United Kingdom General Practice
Research Database. Am J Epidemiol 169(3):382-8.
Stowe J, Andrews N, Bryan P, et al. (2011) Risk of convulsions in children after monovalent H1N1 (2009) and
trivalent influenza vaccines: a database study. Vaccine 29, 9467-72.
Subbramanian RA, Basha S, Shata MT, et al. Pandemic and seasonal H1N1 influenza hemagglutinin-specific T
cell responses elicited by seasonal influenza vaccination. Vaccine 2010;28:8258–67.
Tamma PD, Ault KA, del Rio C, Steinhoff MC et al. (2009) Safety of influenza vaccination during pregnancy.
Am J Obstet Gynecol 201(6): 547-52.
Therapeutic Goods Administration Australian Government (2010) Investigation into febrile reactions in young
children following 2010 seasonal trivalent influenza vaccination. http://www.tga.gov.au/safety/alertsmedicine-seasonal-flu-100702.htm
Thommes EW, Ismaila A, Chit A, Meier G, Bauch CT. Cost-effectiveness evaluation of quadrivalent influenza
vaccines for seasonal influenza prevention: a dynamic modeling study of Canada and the United Kingdom.
BMC Infect Dis. 2015 Oct 27;15:465
Thompson WW, Price C, Goodson B et al. (2007) Early thiomersal exposure and neuropsychological outcomes
at 7 to 10 years. N Eng J Med 357:1281-92.
Thompson WW, Shay DK, Weintraub E et al. (2003) Mortality associated with influenza and respiratory
syncytial virus in the United States. JAMA 289(2):179-86.
Thompson WW, Shay DK, Weintraub E et al. (2004) Influenza-associated hospitalizations in the United States.
JAMA 292(11):1333-40.
Thorrington D, van Leeuwin E, Ramsay M et al. BMC Medicine (2017) 15:166. DOI 10.1186/s12916-017-
0932-3
Toback SL, Beigi R, Tennis P et al. (2012). Maternal outcomes among pregnant women receiving live
attenuated influenza vaccine. Influenza Other Respi Viruses 6, 44-51.
Toback S, Galiza E, Cosgrove C. Safety, immunogenicity, and efficacy of a COVID-19 vaccine (NVX-CoV2373)
co-administered with seasonal influenza vaccines: an exploratory substudy of a randomised, observer-blinded,
placebo-controlled, phase 3 trial. Lancet 2022; 10: P167-179. DOI: https://doi.org/10.1016/S2213-
2600(21)00409-4
Van Buynder PG, Konrad S, Van Buynder JL et al.The comparative effectiveness of adjuvanted and
unadjuvanted trivalent inactivated influenza vaccine (TIV) in the elderly. Vaccine. 2013 Dec 9;31(51):6122-8.
doi: 10.1016/j.vaccine.2013.07.059. Epub 2013 Aug 6.
Van Kerkhove MD, WHO Working Group for Risk Factors for Severe H1N1pdm Infection. Risk factors for
severe outcomes following 2009 influenza A (H1N1) infection: a global
pooled analysis. PLoS Med. 2011 Jul;8(7):e1001053.
Wilde JA, McMillan JA, Serwint J et al. (1999) Effectiveness of influenza vaccine in health care professionals:
a randomised trial. JAMA 281: 908–13.
Wright PF, Thompson J, Vaughn WK et al. (1977) Trials of influenza A/New Jersey/76 virus vaccine in normal
children: an overview of age-related antigenicity and reactogenicity. J Infect Dis 136 (suppl): S731–41.
Writing Committee of the WHO Consultation on Clinical Aspects of Pandemic (H1N1) 2009 Influenza.
Clinical aspects of pandemic 2009 influenza A (H1N1) virus infection. N Engl J Med 362: 1708-19.
Zaman K, Roy E, Arifeen SE et al (2008) Effectiveness of maternal influenza immunisation in mothers and
infants. N Engl J Med 359: 1555-64.
Zhou H, Thompson WW, Viboud CG et al. (2012) Hospitalizations associated with influenza and respiratory
syncytial virus in the United States, 1993-2008. Clin Infect Dis 54: 1427-36.
Hits: 32

