Contents
RSV疫苗Abrysvo FDA
ABRYSVO® (Respiratory Syncytial Virus Vaccine) for injection, for
intramuscular use
Initial U.S. Approval: 2023
处方信息要点
这些重点不包括使用所需的所有信息
安全有效地进行ABRYSVO。请参阅完整的处方信息ABRYSVO。
————最近的主要变化————
————适应症和用法————
ABRYSVO疫苗适用于
•对孕32至36周的孕妇进行主动免疫接种,以预防下呼吸道疾病(LRTD)和由呼吸道合胞病毒(RSV)引起的严重LRTD。(1.1)
•主动免疫预防60岁及以上老年人因呼吸道合胞病毒引起的LRTD。(1.2)
————剂量和用法————
• 用于肌肉注射。(2)
•复溶后,单次剂量的ABRYSVO约为0.5 mL(小瓶和预装注射器)或0.5 mL(小瓶和小瓶)。(2.1)
————剂型和强度————
注射用的。
对于小瓶和预装注射器,复溶后的单次剂量约为0.5毫升。(3)
对于小瓶和小瓶剂型,复溶后的单次剂量为0.5 mL。(3)
————禁忌症————
对ABRYSVO的任何成分有严重过敏反应(如过敏反应)史。(4)
————警告和注意事项————
•早产的潜在风险。为避免孕32周前使用ABRYSVO可能导致的早产风险,应在孕32至36周的孕妇中使用ABRYSVO。
————不良反应————
•怀孕个体中最常报告的征集的局部和全身不良反应(≥10%)为注射部位疼痛(40.6%)、头痛(31.0%)、肌肉疼痛(26.5%)和恶心(20.0%)。(6.1)
•60岁及以上(≥10%)人群中最常报告的局部和全身不良反应为疲劳(15.5%)、头痛(12.8%)、注射部位疼痛(10.5%)和肌肉疼痛(10.1%)。(6.1)
要报告可疑的不良反应,请致电1-800-438-1985联系辉瑞公司或1-800-822-7967联系VAERS公司或http://vaers.hhs.gov。
有关患者咨询信息,请参见第17节
修订日期:2024年3月
| 完整的处方信息:内容* | 8.2哺乳 14.3同时接种破伤风类毒素疫苗、减少白喉类毒素疫苗和无细胞百日咳疫苗,吸附 *未列出完整处方信息中省略的章节或小节。 |
完整的处方信息
1适应症和用法
1.1孕妇的免疫接种
ABRYSVO是一种疫苗,用于孕32至36周孕妇的主动免疫,以预防出生至6个月婴儿的下呼吸道疾病(LRTD)和由呼吸道合胞病毒(RSV)引起的严重LRTD。
1.2 60岁及以上老年人的免疫接种
ABRYSVO是一种疫苗,用于主动免疫预防60岁及以上人群中由RSV引起的LRTD。
2剂量和用法
2.1剂量和时间表
复溶后,单剂量的ABRYSVO约为0.5 mL(小瓶和预装注射器)或0.5 mL(小瓶和小瓶) [参见剂量和给药(2.2)].
2.2剂型和复溶
ABRYSVO以如下两种形式提供:
小瓶和预装注射器剂型
小瓶和预装注射器以试剂盒的形式提供,其中包括一小瓶冻干抗原成分(无菌白色粉末)、一个含有无菌水稀释剂成分的预装注射器和一个小瓶适配器。
小瓶和小瓶剂型
样品瓶和样品瓶包装在纸盒中,其中包含亲脂性抗原成分(无菌白色粉末)样品瓶和含有无菌水稀释剂成分的样品瓶。
对于两种情况,按照下面的说明,用随附的无菌水稀释剂成分复溶冻干的抗原成分以形成ABRYSVO。
样品瓶和预装注射器剂型的复溶说明
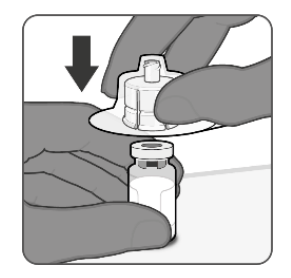 | 第一步.将样品瓶适配器连接到样品瓶 从冻干抗原成分的小瓶上取下翻盖。 从样品瓶适配器包装上撕下顶盖。 将样品瓶适配器保留在包装中,将适配器放在样品瓶瓶塞的中央,然后直接向下推将其连接到样品瓶上。 移除包装。 |
 | 第二步.注射器与样品瓶适配器的连接 通过鲁尔锁定适配器(Luer lock)握住装有无菌水稀释剂成分的注射器。 拧下注射器盖子。 转动鲁尔锁,将注射器连接到样品瓶适配器。 |
 | 第三步.冻干品的复溶 抗原成分与无菌水稀释剂成分混合形成抗体 将注射器的全部内容物注入小瓶。 按住柱塞杆并轻轻旋转小瓶,直到 粉末完全溶解(不到1分钟)。 不要摇晃。 |
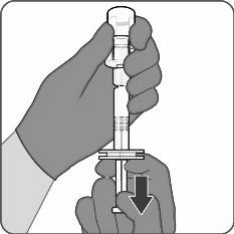 | 第四步.ABRYSVO的抽取 将小瓶完全倒置,并缓慢地将全部内容物抽入注射器,以获得约0.5 mL剂量的ABRYSVO。 扭转以断开注射器与样品瓶适配器的连接。 固定一根适合肌肉注射的无菌针头。 |
样品瓶和样品瓶剂型的复溶说明
| 第一步.无菌水稀释剂的抽取 使用无菌针头和无菌注射器,取出药瓶中含有无菌水稀释剂成分的全部内容物。 | 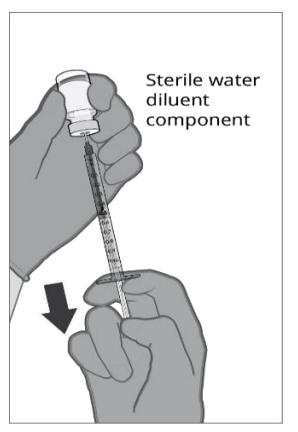 |
| 第二步.用无菌水稀释剂组分复溶冻干的抗原组分以形成ABRYSVO 将全部内容物注入含有冻干抗原的小瓶中成分(白色粉末)。以圆周运动轻轻旋转小瓶,直到粉末完全溶解。不要摇晃。 | 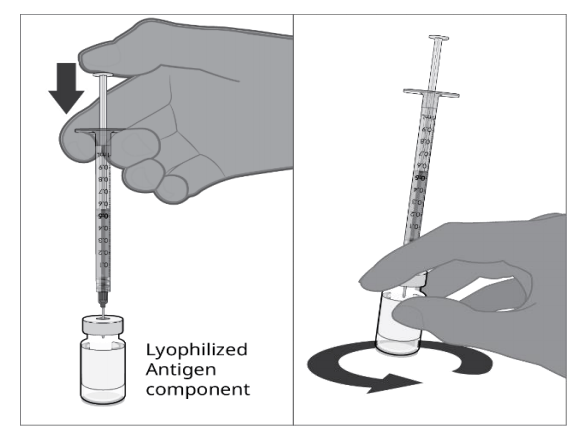 |
| 第三步.ABRYSVO的抽取 从装有重组疫苗的小瓶中抽取0.5毫升。 | 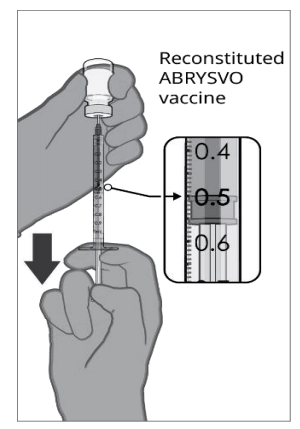 |
2.3给药
用于肌肉注射
复溶后,ABRYSVO是一种清澈无色的溶液。只要溶液和容器允许,注射用药品在给药前应目视检查是否有颗粒物质和变色。如果出现任何一种情况,则丢弃。
立即接种ABRYSVO或储存在室温下 [15℃至30℃(59℉至86℉)],并在4小时内使用。如果未在4小时内使用,请丢弃重组疫苗。
3剂型和强度
ABRYSVO是一种注射用溶液。
对于小瓶和预装注射器,复溶后的单次剂量约为0.5 mL。对于小瓶和小瓶剂型,复溶后的单次剂量为0.5 mL。
4禁忌症
请勿将本品用于对本品任何成分有严重过敏反应(如过敏反应)史的患者 [参见说明(11)].
5警告和注意事项
5.1早产的潜在风险
在两项临床研究中,ABRYSVO受试者与安慰剂受试者相比,早产的数量失衡 [参见不良反应6.1]。现有数据不足以确定或排除早产和ABRYSVO之间的因果关系。为避免孕32周前使用ABRYSVO可能导致的早产风险,应在孕32至36周的孕妇中使用ABRYSVO。早产风险增加的孕妇通常被排除在BRYSVO临床研究之外。
5.2急性过敏反应的管理
如果接种本品后出现过敏反应,必须立即采取适当的药物治疗来控制过敏反应。
5.3晕厥
注射疫苗(包括ABRYSVO)可能会导致晕厥。程序应到位,以避免因昏厥而受伤。
5.4免疫活性改变
免疫功能低下的个体,包括接受免疫抑制治疗的个体,可能对ABRYSVO的免疫反应减弱。
5.5疫苗有效性的局限性
接种ABRYSVO疫苗可能无法保护所有疫苗接受者。
6不良反应
在怀孕个体中,最常报告的(≥10%)不良反应是注射部位疼痛(40.6%)、头痛(31.0%)、肌肉疼痛(26.5%)和恶心(20.0%)。
在60岁及以上的个体中,最常报告的(≥10%)不良反应是疲劳(15.5%)、头痛(12.8%)、注射部位疼痛(10.5%)和肌肉疼痛(10.1%)。
6.1临床试验经验
由于临床试验是在差异很大的条件下进行的,因此在一种疫苗的临床试验中观察到的不良反应率不能直接与另一种疫苗的临床试验中的不良反应率进行比较,并且可能无法反映实际观察到的不良反应率。
从出生到6个月大的孕妇和婴儿
在两项临床研究中评估了ABRYSVO在产妇和婴儿参与者中的安全性,其中约4000名产妇参与者接受了单剂量的ABRYSVO。
研究1(NCT 04424316)是一项正在进行的3期随机双盲多中心安慰剂对照研究,旨在调查年龄≤49岁的孕妇接种本品的疗效和安全性
无并发症的单胎妊娠,以保护其婴儿免受呼吸道合胞病毒感染。高危妊娠的孕妇被排除在本研究之外(孕前身体质量指数>40 kg/m2、体外受精后妊娠、先兆子痫、子痫、未控制的妊娠高血压、胎盘异常、羊水过多或羊水过少、严重出血或凝血障碍、不稳定的内分泌疾病,包括未经治疗的葡萄糖耐受不良或甲状腺疾病)。根据研究者的判断,可以纳入既往有妊娠并发症的孕妇(例如,早产史≤34周妊娠、既往死产、新生儿死亡、既往患有已知遗传疾病或重大先天异常的婴儿),但一般不会纳入研究。在这项1:1随机分组的研究中,3682名受试者接受了ABRYSVO,3675名受试者接受了安慰剂(0.5毫升剂量,含有与单剂量ABRYSVO相同数量的缓冲剂成分 [参见说明(11)])。第一年出生的婴儿将接受长达24个月的随访,第二年出生的婴儿将接受长达12个月的随访以评估安全性。在中位数为8.9个月(范围第1天至23.8个月)后进行数据评估时,ABRYSVO组的产妇参与者生育了3,568名婴儿,安慰剂组生育了3,558名婴儿,其中约45.6%的婴儿随访了12个月。这项多中心研究正在阿根廷、澳大利亚、巴西、加拿大、智利、丹麦、芬兰、冈比亚、日本、韩国、墨西哥、荷兰、新西兰、菲律宾、南非、西班牙、台湾和美国进行。
研究1中接受ABRYSVO治疗的参与者和接受安慰剂治疗的参与者的人口统计学特征在年龄、种族和民族方面基本相似。在这项研究的参与者中,65%是白人,20%是黑人或非裔美国人,13%是亚裔,29%是西班牙裔/拉丁裔。研究接种疫苗时的母亲年龄中位数为29岁(ABRYSVO组为16至45岁,安慰剂组为14至47岁)。接种疫苗时的中位孕周为31周零2天(范围为24-36.9周)。ABRYSVO被批准用于孕32至36周的孕妇 [参见适应症和用法(1.1)]。婴儿出生时的孕周中位数为39周零1天(范围为27周零3天至44周零2天)。在产妇参与者所生的婴儿中,51%为男性,49%为女性。
研究2(NCT 04032093)是一项2期、随机、安慰剂对照、观察者盲法研究,旨在调查孕妇接种ABRYSVO两种剂量水平(120 mcg及更高剂量)的安全性。给115名产妇参与者接种ABRYSVO(120微克),这些产妇参与者生了114名婴儿。这项研究在美国、南非、阿根廷和智利进行。接受ABRYSVO和接受安慰剂的参与者的人口统计学特征在年龄、种族和民族方面基本相似。在这项研究的参与者中,76%是白人,21%是黑人或非裔美国人,28%是西班牙裔/拉丁裔。参与者的中位年龄为27岁(范围为18-42岁)。接种疫苗时的中位孕周为30周(范围为24-36周)。ABRYSVO被批准用于孕32至36周的孕妇 [参见适应症和用法(1.1)]。
对于研究1中的所有产妇参与者,使用电子日记收集研究疫苗接种后7天的征集局部反应和全身事件、1个月的不良事件以及研究期间的产科并发症、严重不良事件和特别关注的不良事件。对于婴儿参与者,非严重不良事件的收集期为出生至1个月。对所有婴儿参与者的严重不良事件监测至少1年,对研究1中一半婴儿的严重不良事件监测长达2年。
研究1中征求的局部和全身反应
在产妇参与者中征集的大多数局部和全身反应在发病2-3天内解决。ABRYSVO组中有0.3%的产妇参与者报告了严重的局部反应,安慰剂组中没有发生严重的局部反应,两组中均有2.3%的产妇参与者报告了接种疫苗后7天内的严重全身反应。
研究1中疫苗接种后7天内报告的引发的局部和全身反应见表1和表2。
表1接种疫苗后7天内按最大严重程度报告的当地反应的产妇参与者百分比-研究1a
| 局部反应 | ABRYSVO N = 3,663b % | 安慰剂 N = 3,639b % |
| 注射部位疼痛c | ||
| 任何d | 40.6 | 10.1 |
| 轻度 | 36.1 | 9.3 |
| 中度 | 4.4 | 0.9 |
| 严重 | 0.1 | 0 |
| 红色e | ||
| 任何d | 7.2 | 0.2 |
| 轻度 | 5.0 | 0.1 |
| 中度 | 2.1 | 0.1 |
| 严重 | 0.1 | 0 |
| 肿胀e | ||
| 任何d | 6.2 | 0.2 |
| 轻度 | 4.1 | 0.1 |
| 中度 | 2.0 | <0.1 |
| 严重 | <0.1 | 0 |
a NCT04424316
b N =提供疫苗接种后特定反应每日数据的参与者人数。
C 轻度:不妨碍活动;中度:干扰活动;严重:阻止日常活动。
d任何包括在接种疫苗后第1天至第7天报告反应为轻度、中度或重度的所有参与者。e轻度:>2厘米至5厘米;中度:>5厘米至10厘米;重度:>10厘米。
表2接种疫苗后7天内以最大严重程度报告全身反应的产妇参与者百分比-研究1a
| 全身反应 | ABRYSVO N = 3,663b % | 安慰剂 n = 3638-3639 b % |
| 发热(≥38.0℃) | ||
| ≥38.0℃ | 2.6 | 2.9 |
| ≥38.0℃至38.4℃ | 1.7 | 1.5 |
| >38.5℃至38.9℃ | 0.8 | 1.2 |
| >39.0℃至40.0℃ | <0.1 | 0.1 |
| >40.0℃ | <0.1 | 0.1 |
| 疲劳c | ||
| 任何d | 46.1 | 43.8 |
| 轻度 | 23.4 | 22.8 |
| 中度 | 21.4 | 19.6 |
| 严重 | 1.3 | 1.4 |
| 头疼c | ||
| 任何d | 31.0 | 27.6 |
| 轻度 | 20.2 | 17.9 |
| 中度 | 10.4 | 9.3 |
| 严重 | 0.4 | 0.4 |
| 肌肉疼痛c | ||
| 任何d | 26.5 | 17.1 |
| 轻度 | 17.6 | 10.0 |
| 中度 | 8.6 | 6.8 |
| 严重 | 0.4 | 0.3 |
| 恶心c | ||
| 任何d | 20.0 | 19.2 |
| 轻度 | 14.4 | 13.8 |
| 中度 | 5.4 | 5.2 |
| 严重 | 0.2 | 0.2 |
| 关节疼痛c | ||
| 任何d | 11.6 | 10.5 |
| 轻度 | 6.5 | 6.0 |
| 中度 | 4.9 | 4.4 |
| 严重 | 0.2 | <0.1 |
| 腹泻e | ||
| 任何 | 11.2 | 11.5 |
| 轻度 | 9.1 | 9.4 |
| 中度 | 2.0 | 1.9 |
| 严重 | 0.1 | 0.2 |
| 呕吐f | ||
| 任何 | 7.8 | 7.0 |
| 轻度 | 6.4 | 5.4 |
| 中度 | 1.3 | 1.5 |
| 严重 | 0.2 | <0.1 |
a NCT04424316
b N =提供疫苗接种后特定反应每日数据的参与者人数。
c级轻度:不妨碍活动;中度:对活动有些干扰;严重:阻止日常活动。
d任何包括在接种疫苗后第1天至第7天报告反应为轻度、中度或重度的所有参与者。
e轻度:24小时内2至3次稀便;中度:24小时内有4到5次稀便;严重:24小时内6次或更多次稀便。
f轻度:24小时内1至2次;中度:24小时内>2次;重度:需要静脉补水。
研究1中主动提供的不良事件
母亲参与者在接种疫苗后1个月内报告的主动不良事件在ABRYSVO组为13.7%,在安慰剂组为13.1%。
在接种疫苗至1个月随访期间,产妇参与者中最常报告的主动不良事件是妊娠、产褥期和围产期疾病(ABRYSVO组为7.0%,安慰剂组为6.2%)。
研究1中的严重不良事件
在研究1中,ABRYSVO组和安慰剂组分别有16.2%和15.2%的产妇参与者报告了在研究期间的任何时间发生的严重不良事件(见表3),其中ABRYSVO组和安慰剂组分别有4.2%和3.7%的严重不良事件发生在疫苗接种后1个月内。大多数的
孕妇参与者的严重不良事件与妊娠并发症有关,发生在接种疫苗后1个月。
表3在研究1中选择在接种疫苗后任何时间发生的与妊娠相关的严重不良反应a
| 严重不良反应 (SAE) | ABRYSVO N = 3,682 n (%) | 95% CI | 安慰剂 N = 3,675 n (%) | 95% CI |
| 所有产妇SAE | 598 (16.2) | (15.1, 17.5) | 558 (15.2) | (14.0, 16.4) |
| 先兆子痫 | 68 (1.8) | (1.4, 2.3) | 53 (1.4) | (1.1, 1.9) |
| 妊娠期高血压 | 41 (1.1) | (0.8, 1.5) | 38 (1.0) | (0.7, 1.4) |
| 胎膜早破 | 15 (0.4) | (0.2, 0.7) | 16 (0.4) | (0.2, 0.7) |
| 早产胎膜早破 膜 | 15 (0.4) | (0.2, 0.7) | 10 (0.3) | (0.1, 0.5) |
| 高血压 | 13 (0.4) | (0.2, 0.6) | 6 (0.2) | (0.1, 0.4) |
| 产妇死亡b | 1 (<0.1) | (0.0, 0.2) | 0 | (0.0, 0.1) |
| 胎儿死亡c | 10 (0.3) | (0.1, 0.5) | 8 (0.2) | (0.1, 0.4) |
a包括从接种疫苗到产后6个月(最长约10个月,取决于接种疫苗时的孕周)的所有严重不良事件。在研究1中,5名参与者出现子痫(ABRYSVO组3名,安慰剂组2名),5名参与者出现HELLP综合征(ABRYSVO组2名,安慰剂组3名)。
b . ABRYSVO组有一例产妇死亡,原因是产后出血,这可能与疫苗接种无关。
c指数妊娠共报告18例宫内死亡:ABRYSVO组10例宫内死亡(0.3%),安慰剂组8例宫内死亡(0.2%)。宫内死亡代表了导致胎儿死亡的各种临床状况和表现,但没有共同病理生理学的明确证据。
研究1和研究2中的早产
在研究1和2中均观察到ABRYSVO受试者与安慰剂受试者相比早产数量上的不平衡。在研究2中,ABRYSVO组的早产发生率为5.3%(114人中的6人),安慰剂组为2.6%(116人中的3人)。在随后的研究1中,ABRYSVO组的早产事件发生率为5.7% [95% CI:4.9,6.5](3568人中的202人),安慰剂组的早产事件发生率为4.7% [95% CI:4.1,5.5](3558人中的169人)。在早产婴儿中,ABRYSVO组的83名婴儿和安慰剂组的80名婴儿在新生儿期(出生后30天内)仍住院或再次入院。现有数据不足以确定或排除早产和ABRYSVO之间的因果关系。
在研究1中,在妊娠32至36周接种疫苗的参与者所生的婴儿亚组中也观察到了早产数量的不平衡,ABRYSVO组为4.2%(68/1,631),安慰剂组为3.7%(59/1,610)。
婴儿的不良反应
在研究1中,ABRYSVO组婴儿从出生到1个月的不良事件发生率为37.1%,而安慰剂组为34.5%。ABRYSVO组有5.1%的参与者出现低出生体重,而安慰剂组为4.4%,ABRYSVO组有7.2%的参与者出现新生儿黄疸,而安慰剂组为6.7%。
60岁及以上的个人
在研究3(NCT 05035212)中评估了ABRYSVO的安全性,其中17,215名参与者接受了ABRYSVO,17,069名参与者接受了安慰剂(0.5 mL剂量,含有与单剂量ABRYSVO相同数量的相同缓冲剂成分 [参见说明(11)])。研究3是一项正在进行的多中心、随机、双盲、安慰剂对照研究,旨在评估60岁及以上人群接种本品的疗效和安全性。这项研究正在美国、阿根廷、日本、荷兰、加拿大、南非和芬兰进行。接受ABRYSVO和接受安慰剂的参与者的人口统计学特征在年龄、性别、种族和民族方面基本相似。在这项研究的参与者中,51%是男性,78%是白人,13%是黑人或非裔美国人,37%是西班牙裔/拉丁裔。参与者的中位年龄为67岁(范围为59-97岁)。
研究疫苗接种后7天,使用电子日记收集了来自一个研究点子集的7,169名参与者(3,630名ABRYSVO参与者和3,539名安慰剂接受者)的请求的局部和全身反应。对于所有参与者,在研究疫苗接种后一个月内收集主动提供的不良事件;在整个研究参与过程中收集严重不良事件(SAE)。
在研究3中征求局部和全身反应
表4和表5列出了研究3中疫苗接种后7天内报告的引发的局部和全身反应。
表4 60岁及以上的参与者在接种疫苗后7天内报告有当地反应的百分比-研究3a
| 局部反应 | ABRYSVO n = 3619-3621 b % | 安慰剂 n = 3532-3539 b % |
| 注射部位疼痛c | ||
| 任何d | 10.5 | 6.0 |
| 轻度 | 9.4 | 5.3 |
| 中度 | 1.1 | 0.7 |
| 严重 | <0.1 | 0 |
| 发红d e | ||
| 任何d | 2.7 | 0.7 |
| 轻度 | 1.5 | 0.5 |
| 中度 | 1.1 | 0.2 |
| 严重 | 0.1 | 0 |
| 肿胀d e | ||
| 任何d | 2.4 | 0.5 |
| 轻度 | 1.5 | 0.2 |
| 中度 | 0.9 | 0.2 |
| 严重 | 0.1 | <0.1 |
a NCT05035212
b N =提供疫苗接种后特定反应每日数据的参与者人数。
c轻度:不妨碍活动;中度:对活动有些干扰;严重:阻止日常活动。
d任何包括在接种疫苗后第1天至第7天报告反应为轻度、中度或重度的所有参与者。
e轻度:2.5厘米至5厘米;中度:>5厘米至10厘米;严重:>10厘米(针对电子日记中报告的数据)。
表5 60岁及以上、在疫苗接种后7天内报告有全身反应的参与者的百分比-研究3a
| 全身反应 | ABRYSVO n = 3619-3621 b % | 安慰剂 n = 3532-3539 b % |
| 发热(≥38.0℃) | ||
| ≥38.0℃ | 1.4 | 1.4 |
| ≥38.0℃至38.4℃ | 0.6 | 0.8 |
| >38.4℃至38.9℃ | 0.8 | 0.6 |
| >38.9℃至40.0℃ | <0.1 | <0.1 |
| >40.0℃ | 0 | <0.1 |
| 疲劳 | ||
| 任何d | 15.5 | 14.4 |
| 轻度 | 9.3 | 8.4 |
| 中度 | 5.9 | 5.8 |
| 严重 | 0.3 | 0.1 |
| 头疼c | ||
| 任何d | 12.8 | 11.7 |
| 轻度 | 9.0 | 8.4 |
| 中度 | 3.7 | 3.2 |
| 严重 | 0.1 | <0.1 |
| 肌肉疼痛c | ||
| 任何d | 10.1 | 8.4 |
| 轻度 | 6.5 | 5.5 |
| 中度 | 3.5 | 2.8 |
| 严重 | 0.2 | <0.1 |
| 关节疼痛c | ||
| 任何d | 7.5 | 6.9 |
| 轻度 | 4.5 | 3.9 |
| 中度 | 2.9 | 2.9 |
| 严重 | <0.1 | <0.1 |
| 恶心c | ||
| 任何d | 3.4 | 3.7 |
| 轻度 | 2.5 | 3.1 |
| 中度 | 0.9 | 0.6 |
| 严重 | 0 | <0.1 |
| 呕吐e | ||
| 任何d | 0.9 | 0.8 |
| 轻度 | 0.7 | 0.7 |
| 中度 | 0.2 | 0.1 |
| 严重 | 0 | <0.1 |
| 腹泻f | ||
| 任何d | 5.9 | 5.2 |
| 轻度 | 4.4 | 4.2 |
| 中度 | 1.3 | 0.9 |
| 严重 | 0.1 | 0.1 |
a NCT05035212
b N =提供疫苗接种后特定反应每日数据的参与者人数。
c轻度:不妨碍活动;中度:对活动有些干扰;严重:阻止日常活动。
d任何包括在接种疫苗后第1天至第7天报告反应为轻度、中度或重度的所有参与者。
e轻度:24小时内1至2次;中度:24小时内>2次;重度:需要静脉补水。
f轻度:24小时内2至3次稀便;中度:24小时内有4到5次稀便;严重:24小时内6次或更多次便溏。
请求的局部和全身反应的平均持续时间为1-2天。
研究3中主动提供的不良事件
在接种疫苗后1个月内发生的主动不良事件在两组之间相似,在接受ABRYSVO和安慰剂的参与者中分别有8.9%和8.5%的报告。
疫苗接种后30天内,10名疫苗接受者和4名安慰剂接受者报告了房颤(其中ABRYSVO组和安慰剂组分别有4例和3例为严重不良事件);接种疫苗后18至30天出现症状。目前关于房颤的可用信息不足以确定与疫苗的因果关系。对于特定类别的主动不良事件,各组之间没有其他值得注意的模式或数字失衡。
研究3中的严重不良事件
在研究3中,ABRYSVO组和安慰剂组均有2.3%的参与者报告了SAE。ABRYSVO组的三名参与者出现了SAE,这些SAE被评估为可能与研究疫苗接种有关:疫苗接种后7天报告的格林-巴利综合征、疫苗接种后8天报告的米勒-费舍尔综合征和疫苗接种后8小时报告的超敏反应。
7药物相互作用
在研究4中,在非孕妇中同时使用ABRYSVO和吸附(Tdap)破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗,未发现安全性问题。对呼吸道合胞病毒A型、呼吸道合胞病毒B型、白喉和破伤风的免疫应答不劣于单独给药后的免疫应答。与Tdap单独给药时的百日咳抗体几何平均浓度相比,当ABRYSVO与Tdap同时给药时,测得的抗无细胞百日咳抗原(百日咳毒素 [PT]、丝状血凝素(FHA)和百日咳抗体几何平均浓度(PRN)较低 [参见临床研究(14.3)].
尚未研究Tdap与ABRYSVO在怀孕个体中的联合给药。
8在特定人群中使用
8.1怀孕
妊娠暴露登记处
有一个妊娠暴露登记处,监测妊娠期间暴露于ABRYSVO的个体的妊娠结局。鼓励在怀孕期间接受ABRYSVO的个人联系或让其医疗保健提供者联系1-800-616-3791,以参加注册或获取有关注册的信息。
风险总结
所有怀孕都有出生缺陷、流产或其他不良后果的风险。在美国普通人群中,临床认可的妊娠中主要出生缺陷和流产的估计背景风险分别为2%至4%和15%至20%,20周后胎儿死亡的估计背景风险为0.6%。
研究1招募了7,358名孕妇,她们以1:1的比例进行随机分组,并接受了单剂量ABRYSVO或安慰剂(0.5毫升剂量,含有与单剂量ABRYSVO相同数量的缓冲剂成分 [参见说明(11)])显示没有证据表明疫苗会增加先天性异常或胎儿死亡的风险。研究2评估了115名接受ABRYSVO的孕妇和117名接受安慰剂的孕妇。在这两项临床研究中,观察到ABRYSVO受试者与安慰剂受试者相比,早产的数量不平衡。现有数据不足以确定或排除早产和ABRYSVO之间的因果关系 [参见警告和注意事项(5.1)、不良反应(6.1)、临床注意事项(8.1)、数据(8.1)和临床研究(14.1)].
在怀孕前和怀孕期间,对雌性兔子进行了一项发育毒性研究,该兔子接种了一种疫苗制剂,其抗原含量是人类单剂量疫苗的两倍。该研究没有证据表明对胎儿或出生后的生存、生长或发育有害(参见动物数据).
临床考虑
母体不良反应
在研究1中,3682名孕妇接受ABRYSVO治疗,3676名孕妇接受安慰剂治疗。ABRYSVO组局部和全身不良反应发生率更高。与安慰剂组相比,ABRYSVO组在怀孕个体中观察到的严重不良反应发生率更高,包括先兆子痫(1.8%对1.4%)和妊娠期高血压(1.1%对1.0%) [参见不良反应(6.1)]。
ABRYSVO尚未在胎龄小于24周的孕妇和早产风险增加的孕妇中进行研究。
胎儿/新生儿不良反应
婴儿安全性人群包括ABRYSVO或安慰剂组分别出生的3568名和3558名婴儿。ABRYSVO组有10例(0.3%)胎儿死亡,安慰剂组有8例(0.2%)。在ABRYSVO组和安慰剂组的婴儿中,分别有202名(5.7%)和169名(4.7%)早产 [参见警告和注意事项(5.1)、不良反应(6.1)和临床研究(14.1)]。ABRYSVO组有5.1%的参与者出现低出生体重,而安慰剂组为4.4%,ABRYSVO组有7.2%的参与者出现新生儿黄疸,而安慰剂组为6.7%。 [参见不良反应(6.1)]。就研究1中孕妇所生婴儿的新生儿期死亡率而言,ABRYSVO组有2例死亡,安慰剂组有5例死亡;就包括新生儿期后的总死亡率而言,ABRYSVO组有5例死亡,安慰剂组有12例死亡。据报告,ABRYSVO组的先天性异常发生率为5.0%,安慰剂组为6.2%。
现有数据不足以确定或排除早产和ABRYSVO之间的因果关系。为避免孕32周前使用ABRYSVO可能导致的早产风险,应在孕32至36周的孕妇中使用ABRYSVO。
数据
人类数据
在研究1中,3682名孕妇在妊娠24至36周接受了ABRYSVO治疗,3676名孕妇接受了安慰剂治疗。婴儿安全性人群包括ABRYSVO或安慰剂组分别出生的3568名和3558名婴儿。在ABRYSVO组和安慰剂组的新生儿中,分别有202例(5.7%)和169例(4.7%)出现早产不良事件,分别有180例(5.0%)和220例(6.2%)报告出现先天畸形或异常。ABRYSVO组有10例(0.3%)胎儿死亡,安慰剂组有8例(0.2%)。
动物数据
在雌性新西兰白兔中进行了胚胎-胎儿发育毒性阶段的产前和产后发育毒性研究。通过肌肉注射给兔子施用4剂:在交配前3周和1周以及在妊娠第10天和24天。每次,兔子接受0.5 mL疫苗制剂,该制剂含有两倍于RSV A和RSV B糖蛋白的抗原含量(120 mcg RSV preF A和120 mcg RSV preF B),其融合前构象稳定,与单次人体剂量的ABRYSVO相同 [参见说明(11)]。未观察到对交配、女性生育能力或胚胎/胎儿或产后存活、生长或发育的不利影响。没有与疫苗相关的胎儿畸形或变异。
8.2哺乳
风险总结
尚不清楚ABRYSVO是否会在人乳中排泄。尚无数据可用于评估ABRYSVO对母乳喂养的婴儿或乳汁生产/排泄的影响。母乳喂养对发育和健康的益处应与母亲对ABRYSVO的临床需求以及ABRYSVO或潜在母体疾病对母乳喂养的孩子的任何潜在不良影响一起考虑。对于预防性疫苗,潜在的母体状况是对疫苗预防的疾病的易感性。
8.4儿科使用
对于10岁以下接种者所生的婴儿,BRYSVO预防RSV LRTD和严重RSV LRTD的安全性和有效性尚未确定。
通过主动免疫预防小于18岁的未怀孕个体感染LRTD病毒的安全性和有效性尚未确定。
8.5老年用药
ABRYSVO被批准用于60岁及以上的老年人。在研究3中,在接受ABRYSVO治疗的17,215名受试者中,62%(n = 10,756)的年龄在60-69岁之间,32%(n = 5,488)的年龄在70-79岁之间,6%(n = 970)的年龄≥80岁 [参见不良反应(6.1)和临床研究(14.1)].
11描述
ABRYSVO(呼吸道合胞病毒疫苗)是一种用于肌肉注射的无菌溶液。疫苗以冻干抗原成分小瓶的形式提供,在使用时用无菌水稀释剂成分重新配制。抗原成分含有重组RSV preF A和RSV preF B。
RSV preF A和RSV preF B重组蛋白在使用化学成分确定的培养基、不含抗生素或动物源性成分的悬浮培养物中生长的基因工程中国仓鼠卵巢细胞系中表达。重组蛋白通过一系列的柱层析和过滤步骤纯化,然后配制、装入小瓶并冻干。
复溶后,每0.5毫升制剂中含有120微克RSV稳定的预融合F蛋白(60微克RSV preF A和60微克RSV preF B)。ABRYSVO还含有以下缓冲剂成分:每0.5毫升含有0.11毫克氨丁三醇、1.04毫克盐酸氨丁三醇、11.3毫克蔗糖、22.5毫克甘露醇、0.08毫克聚山梨醇酯80和1.1毫克氯化钠。ABRYSVO是一种无菌、透明、无色的溶液。
ABRYSVO不含防腐剂。每剂还可能含有生产过程中残留的宿主细胞蛋白(≤0.1% w/w)和DNA(<0.4纳克/毫克总蛋白)。
预充式注射器的瓶塞、顶端盖帽和橡胶柱塞不是由天然橡胶胶乳制成的。
12临床药理学
12.1作用机制
自动免疫接种
ABRYSVO诱导针对RSV pre F的免疫反应,保护免受RSV引起的下呼吸道疾病。
被动免疫
来自怀孕期间接种疫苗的个体的RSV抗原抗体经胎盘转移,以保护6个月以下的婴儿免受RSV引起的LRTD和严重LRTD感染。
13非临床毒理学
13.1致癌、诱变、生育能力受损
尚未评估ABRYSVO是否可能导致致癌性、遗传毒性或男性生育能力受损。在母兔中进行的发育毒性研究显示,在施用含有两倍于人单剂量抗体的抗原含量的疫苗制剂后,没有证据表明雌性生育能力受损 [参见特定人群的使用(8.1)].
14项临床研究
14.1在怀孕个体中研究其婴儿从出生到6个月的疗效
研究1(NCT 04424316)是一项3期研究,旨在评估BRYSVO在预防孕期接种者所生婴儿的RSV相关下呼吸道疾病(LRTD)方面的疗效。该研究评估了BRYSVO在出生后90、120、150和180天内预防婴儿RSV相关LRTD和严重RSV- LRTD的有效性。参与者被随机分组(1:1)接受ABRYSVO(0.5毫升剂量)或安慰剂(0.5毫升剂量,含有与单剂量ABRYSVO相同数量的缓冲剂成分 [参见描述(11)] ).这项研究包括北半球和南半球的地点。疫苗效力(VE)被定义为与接受安慰剂的个体所生婴儿相比,接受ABRYSVO的个体所生婴儿中由RSV引起的严重LRTD和由RSV引起的LRTD终点的相对风险降低。临床试验经验第6.1节描述了研究1的人口统计学特征。
产妇参与者被随机(1:1)接受ABRYSVO(3695人)或安慰剂(3697人)。婴儿呼吸道合胞病毒相关LRTD被定义为通过逆转录-聚合酶链反应(RT-PCR)确诊的呼吸道合胞病毒疾病,并伴有以下一种或多种呼吸道症状:呼吸急促(呼吸频率≥60次/分钟 [<2月龄],≥50次/分钟 [≥2至12月龄],或≥40次/分钟 [≥12至24月龄]);在室内空气中测得的SpO2胸壁内吸。呼吸道合胞病毒相关的严重LRTD是一个子集,定义为符合LRTD呼吸道合胞病毒标准加上至少以下一项:呼吸急促(呼吸频率≥70次/分钟 [<2月龄],≥60次/分钟 [≥2至12月龄],或≥50次/分钟 [≥12至24月龄]);在室内空气中测得的SpO2高流量鼻插管或机械通气(有创或无创)、ICU入院超过4小时和/或无反应/无意识。次要疗效终点包括因呼吸道合胞病毒导致的住院。
在180天内的所有时间点上,VE结果均符合成功减少因呼吸道合胞病毒引起的严重LRTD的统计标准(置信区间下限>20%)。VE结果不符合降低因呼吸道合胞病毒引起的LRTD的统计学成功标准(置信下限>20%);然而,在出生后90天至180天内观察到有临床意义的疗效。
疫苗效力信息见表6至表10。
表6 通过对孕妇的主动免疫,对婴儿出生至6个月大引起的严重LRTD的ABRYSVO疫苗接种效果(研究1)a
| 期间 | ABRYSVO 病例数量 N = 3,495b | 安慰剂 病例数量 N = 3,480b | VE (%) (CI)c |
| 90天 | 6 | 33 | 81.8 (40.6, 96.3) |
| 120天 | 12 | 46 | 73.9 (45.6, 88.8) |
| 150天 | 16 | 55 | 70.9 (44.5, 85.9) |
| 180天 | 19 | 62 | 69.4 (44.3, 84.1) |
CI–置信区间;n——参与人数;呼吸道合胞病毒;VE-疫苗效力
a本次终点评估达到了预先指定的成功标准
b .可评估疗效的人群
c 90天的99.5%置信区间;后期97.58%置信区间
表7孕妇主动免疫对婴儿出生至6个月龄引起的LRTD的ABRYSVO疫苗接种效果(研究1)a
| 期间 | ABRYSVO 病例数量 N = 3,495b | 安慰剂 病例数量 N = 3,480b | VE (%) (CI)c |
| 90天 | 24 | 56 | 57.1 (14.7, 79.8) |
| 120天 | 35 | 81 | 56.8 (31.2, 73.5) |
| 150天 | 47 | 99 | 52.5 (28.7, 68.9) |
| 180天 | 57 | 117 | 51.3 (29.4, 66.8) |
CI–置信区间;n——参与人数;呼吸道合胞病毒;VE-疫苗功效
a90天时的终点评估未达到预先指定的成功标准(可信区间下限>20%)
b有价值的疗效人群
c 90天的99.5%置信区间;后期97.58%置信区间
表8通过对32至36周胎龄孕妇的主动免疫接种,预防出生至6个月龄婴儿引起的严重LRTD的ABRYSVO疫苗效果(研究1)a
| 期间 | ABRYSVO 病例数量 N=1572b | 安慰剂 病例数量 N=1539b | VE (%) (CI)c |
| 90天 | 1 | 11 | 91.1 (38.8, 99.8) |
| 180天 | 6 | 25 | 76.5 (41.3, 92.1) |
CI–置信区间;n——参与人数;n——病例数;呼吸道合胞病毒;VE-疫苗功效
a该描述性亚组分析未进行多重比较控制;显示了90天和180天的结果。
b可评估疗效人群c 95% CI
表9对32至36周龄孕妇的主动免疫接种,对出生至6个月龄婴儿引起的LRTD的ABRYSVO疫苗效果(研究1)a
| 期间 | ABRYSVO 病例数量 N=1572b | 安慰剂 病例数量 N=1539b | VE (%) (CI)c |
| 90天 | 14 | 21 | 34.7 (-34.6, 69.3) |
| 180天 | 24 | 55 | 57.3 (29.8, 74.7) |
CI–置信区间;n——参与人数;n——病例数;呼吸道合胞病毒;VE-疫苗功效
a该描述性亚组分析未进行多重比较控制;显示了90天和180天的结果。
b可评估疗效人群
c 95% CI
表9 对32至36周龄孕妇的主动免疫接种,对出生至6个月龄婴儿引起的LRTD的ABRYSVO疫苗效果(研究1)a
| 期间 | ABRYSVO 病例数量 N = 3,495b | 安慰剂 病例数量 N = 3,480b | VE (%) (CI)c |
| 90天 | 10 | 31 | 67.7 (15.9, 89.5) |
| 120天 | 15 | 37 | 59.5 (8.3, 83.7) |
| 150天 | 17 | 39 | 56.4 (5.2, 81.5) |
| 180天 | 19 | 44 | 56.8 (10.1, 80.7) |
CI–置信区间;n——参与人数;n——病例数;呼吸道合胞病毒;VE-疫苗效力a NCT04424316
b可评估疗效人群
c 99.17%可信区间
14.2在60岁及以上人群中的疗效
研究3(NCT 05035212)是一项正在进行的3期、多中心、随机、双盲、安慰剂对照研究,旨在评估ABRYSVO在预防60岁及以上个体RSV相关下呼吸道疾病方面的有效性和安全性。计划对参与者进行长达两个RSV赛季的随访,约25个月。
参与者随机(1:1)接受ABRYSVO(n=17,197)或安慰剂(n = 17,186)。随机化按年龄分层,60-69岁(n=21,499,63%)、70-79岁(n=10,948,32%)和≥80岁(n=1,934,6%)。健康成年人和患有稳定慢性疾病的成年人包括在内。在登记的参与者中,15%有稳定的慢性心肺疾病,如慢性阻塞性肺病(COPD)、哮喘或充血性心力衰竭(CHF)。
从研究疫苗接种后14天开始(研究第15天),对所有参与者的急性呼吸道疾病(ARI)症状发作进行积极监测:新发或加重的咽痛、鼻塞、流涕、咳嗽、喘息、产痰或气短。如果参与者出现1个或多个急性呼吸道感染症状,则在症状出现7天内收集中鼻甲鼻拭子,并通过逆转录聚合酶链反应(RT-PCR)检测呼吸道合胞病毒。
研究3评估了RSV相关下呼吸道疾病(RSV-LRTD)。呼吸道合胞病毒LRTD病例被定义为经RT-PCR证实的呼吸道合胞病毒疾病,在症状出现后7天内出现以下呼吸道症状中的两种或两种以上,或三种或三种以上,并在同一疾病期间持续1天以上:新的或加重的咳嗽、喘息、痰产生、呼吸急促、呼吸困难(呼吸≥25次/分钟或比静息基线增加15%)。呼吸道合胞病毒相关的严重下呼吸道疾病病例被定义为符合呼吸道合胞病毒-LRTD标准且至少符合以下条件之一的病例:因呼吸道合胞病毒-LRTD而住院、新的或增加的氧气补充或机械通气,包括持续气道正压通气(CPAP)。
60岁及以上人群对呼吸道合胞病毒相关性下呼吸道疾病的疗效观察
评估了针对RSV-LRTD的疫苗效力(VE),定义为在第一个RSV季节,与安慰剂组相比,ABRYSVO组首次发生RSV-LRTD的相对风险降低。
该研究达到了预先指定的成功标准,证明了ABRYSVO对预防出现≥2种症状的RSV-LRTD和出现≥3种症状的RSV-LRTD的主要目标有效。疗效随访的中位持续时间为7个月。
疫苗效力信息见表11。
表11呼吸道合胞病毒疫苗ABRYSVO针对RSV-LRTD的效力-60岁及以上人群 (研究3)a
| 疗效终点 | ABRYSVO N = 16,306b n | 安慰剂 N = 16,308b n | VE(%) (96.66%CI) |
| 伴有≥2种症状的呼吸道合胞病毒相关下呼吸道疾病首次发作 | 11 | 33 | 66.7 (28.8, 85.8) |
| 伴有≥3种症状的呼吸道合胞病毒相关下呼吸道疾病首次发作 | 2 | 14 | 85.7 (32.0, 98.7) |
CI–置信区间;n——参与人数;n =病例数;呼吸道合胞病毒;VE-疫苗效力(基于病例数比率的VE计算为1-(P/ [1-P]),其中P是RSV preF病例数除以病例总数)
a NCT05035212
b .可评估疗效的人群
安慰剂组有2例RSV相关的严重下呼吸道疾病,ABRYSVO组无病例。
14.3与破伤风类毒素、减毒白喉类毒素和 吸附无细胞百日咳疫苗
研究4(NCT 04071158)是一项2期、安慰剂对照、随机、观察者盲研究,旨在评估18至49岁的非怀孕妇女与Tdap同时接种本品(剂量水平为120 g和240 g,含或不含Al(OH)3)的安全性、耐受性和免疫原性。
在未怀孕的成年个体群体中接种疫苗后1个月,评估了对包含在ABRYSVO和Tdap中的抗原的抗体反应。与Tdap单独给药时的百日咳抗体几何平均浓度相比,ABRYSVO与破伤风、白喉和无细胞百日咳疫苗(Tdap)同时给药时,观察到抗无细胞百日咳抗原(百日咳毒素 [PT]、丝状血凝素(FHA)和百日咳抗体几何平均浓度(GMCs)较低。PT的GMC比率(GMC ABRYSVO+Tdap /GMC Tdap)的双侧95% CI下限(LL)为0.64,FHA为0.50,PRN为0.48,不符合预先指定的非劣效性标准(GMC比率的95% CI下限>0.67)。这一发现的临床相关性尚不清楚。破伤风、白喉和呼吸道合胞病毒疫苗抗原符合非劣效性标准 [参见药物相互作用(7)]。
16如何供应/储存和搬运
16.1供货方式
ABRYSVO小瓶和预装注射器以1、5和10个试剂盒的纸盒包装提供,不含针头。每个试剂盒包括一瓶冻干抗原成分(NDC 0069-0207-01)、一个含有无菌水稀释剂成分的预填充注射器(NDC 0069-0250-01)和一个小瓶适配器。
| 纸箱:1套 | NDC 0069-0344-01 |
| 纸箱:5套 | NDC 0069-0344-05 |
| 纸箱:10套 | NDC 0069-0344-10 |
ABRYSVO药瓶和药瓶包装在纸盒中,每盒5和10剂,不含注射器或
针头。每个纸箱包括小瓶的亲脂性抗原成分(NDC 0069-0207-01)和小瓶的无菌水稀释剂成分(NDC 0069-0651-01)。
| 纸箱:5剂 | NDC 0069-1265-10 |
| 纸箱:10剂 | NDC 0069-1265-20 |
预充式注射器的瓶塞、顶端盖帽和橡胶柱塞不是由天然橡胶胶乳制成的。
16.2储存和搬运
复溶前的储存
在原纸箱中以2℃至8℃(36℉至46℉)的温度冷藏储存。不要冻结。如果纸箱被冷冻,请丢弃。
复溶后的储存
复溶后,立即接种ABRYSVO或储存在室温下 [15℃至30℃(59℉至86℉)],并在4小时内使用。不要冷冻重组疫苗。
17患者咨询信息
注射本疫苗前:
告知疫苗接受者接种ABRYSVO疫苗的潜在益处和风险。
建议疫苗接种者向其医疗保健提供者或疫苗不良事件报告系统报告任何不良事件,电话:1-800-822-7967www.vaers.hhs.gov。
该产品的标签可能已更新。有关最新的处方信息,请访问www.pfizer.com。
由辉瑞公司生产。
纽约州纽约市10001
美国许可证号2001
实验室-1498-3.0
Hits: 125
