Contents
- 1 第15章:白喉
- 1.1 疾病
- 1.2 疾病的历史和流行病学
- 1.3 白喉疫苗接种
- 1.4 储存
- 1.5 剂型
- 1.6 剂量和时间表
- 1.7 接种
- 1.8 处理
- 1.9 疫苗使用建议
- 1.10 初级免疫接种
- 1.11 加强免疫
- 1.12 免疫状态未知或不完全的儿童接种疫苗
- 1.13 旅行者和那些要去国外生活的人
- 1.14 实验室和医护人员的白喉疫苗接种
- 1.15 禁忌症
- 1.16 预防措施
- 1.17 先前免疫接种后的全身和局部反应
- 1.18 怀孕和母乳喂养
- 1.19 早产儿
- 1.20 免疫抑制和艾滋病毒感染
- 1.21 神经疾病
- 1.22 图15.2免疫程序流程图(如果在免疫前有神经疾病的证据)
- 1.23 图15.3免疫接种后七天内发生的脑炎或脑病的流程图
- 1.24 免疫接种后的神经异常
- 1.25 推迟免疫接种
- 1.26 不良反应
- 1.27 病例、接触者、携带者和暴发的管理
- 1.28 病例管理
- 1.29 联系人管理
- 1.30 供应
- 1.31 参考
第15章:白喉
白喉 应呈报
疾病
白喉是一种急性传染病,影响上呼吸道,偶尔影响皮肤,由产毒性白喉棒状杆菌或溃疡棒状杆菌产生的白喉毒素的作用引起。影响上呼吸道的白喉最典型的特征是膜性咽炎(通常称为假膜),伴有发热、颈前淋巴结肿大和软组织水肿,呈现“牛颈”外观。假膜可能导致呼吸阻塞。在英国,这种经典疾病现在非常罕见,临床医生可能无法识别。较轻的感染(无毒素产生)类似链球菌性咽炎,假膜可能不会出现,特别是在接种过疫苗的个体中。携带者可能没有症状。白喉毒素影响心肌、神经和肾上腺组织,导致瘫痪和心力衰竭。
潜伏期为二至五天。未经治疗的疾病患者可能会在长达四周的时间内具有传染性,但携带者可能会在更长时间内传播感染。感染的传播是通过飞沫和接触被感染者弄脏的物品(如衣服或床单)进行的。
在卫生条件差的国家,皮肤白喉是主要的临床表现和传染源。正常的C. ulcerans宿主是牛。人类感染与食用生乳制品和接触动物有关。人与人之间的传播不能被排除,尽管它可能是罕见的(Bonnet and Begg, 1999)。
在英国,对亚临床感染产生天然免疫力的可能性很小。根据血清监测研究,大约50%的30岁以上的英国成年人易患白喉。在老年人群中,易感比例增加到70%以上(Edmunds et al., 2000)。必须保持较高的免疫接种率,以防止从海外引入产毒菌株病例或携带者后疾病的复发。
疾病的历史和流行病学
20世纪40年代以前,白喉在英国是一种常见病。20世纪40年代在全国范围内引入白喉免疫接种后,该疾病的报告病例和死亡人数大幅下降。1940年,英国报告了超过61,000例病例,3,283例死亡,而1957年为38例病例和6例死亡(见图15.1)。
从1986年到2002年,英国健康保护局(HPA)链球菌和白喉参考单位(前公共卫生实验室服务)在英格兰和威尔士鉴定了56株产毒白喉杆菌分离株和47株产毒溃疡梭菌分离株。其中,8名患者患有C.白喉杆菌感染和6例溃疡衣原体感染患者表现为典型的咽部白喉:其余患者为轻度咽炎或无症状。1986年至2002年间发生了两起白喉死亡事件:1994年,一名未接种疫苗的14岁女孩在去过巴基斯坦后死于白喉杆菌感染;2000年,英国一名老年妇女死于白喉杆菌感染。
自1992年以来,白喉报告的增加是由于不引起典型白喉疾病的白喉杆菌非产毒性菌株的分离增加(Reacher et al., 2000)。这些症状可能与轻微的喉咙痛有关,但没有中毒迹象。
东南亚、南美洲、非洲和印度继续报告白喉病例。大量英国公民往返于这些地区,保持了白喉杆菌再次传入英国的可能性。近年来在英国发生的大多数白喉病例是从印度次大陆或非洲输入的;据报告,2002年有4例皮肤白喉患者回国(De Benoist et al., 2004)。继发性病例很少见,但在英国确实存在。
白喉在前苏联再度流行,最初在1980年代达到高峰,随后从1990年开始大规模流行(Dittmann et al., 2000)。这种流行病迅速传播,影响到所有新独立的国家,并在1994-95年达到高峰。从1990年到1998年,向世界卫生组织(WHO)报告了超过157,000个病例和5,000例死亡(Dittmann et al., 2000)。这种流行病是由幼儿免疫覆盖率低、成人免疫力下降和大规模人口流动造成的。几次白喉从前苏联国家传入西欧,包括1997年传入英国的一例(CDR,1997)。
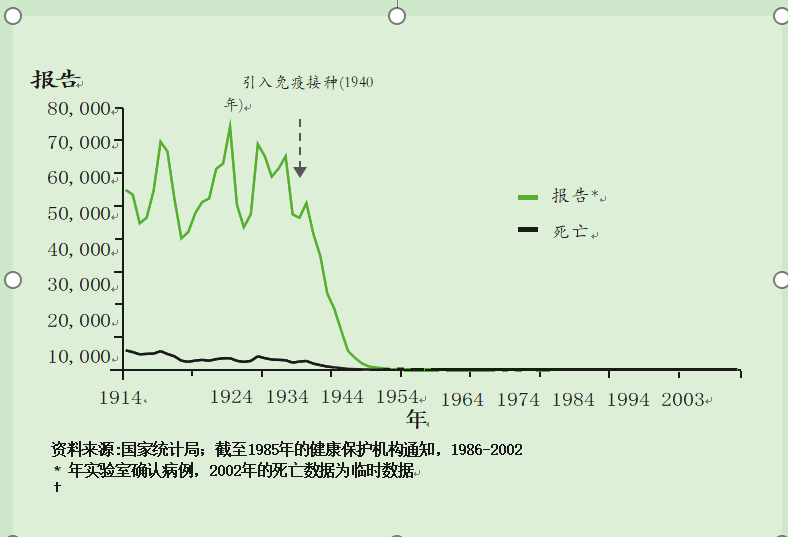
资料来源:国家统计局;截至1985年的健康保护机构通知,1986-2002年实验室确认病例,2002年的死亡数据为临时数据
图15.1英格兰和威尔士白喉病例和死亡人数(1914-2003年)
白喉疫苗接种
这种疫苗是由从一种白喉杆菌菌株中提取的无细胞纯化毒素制成的。这是用甲醛处理,转化为白喉类毒素。它被吸附在佐剂上——磷酸铝或氢氧化铝——以提高其免疫原性。
根据白喉类毒素的含量,白喉疫苗分为两种强度:
- 含有较高剂量白喉类毒素(缩写为“D”)的疫苗含有不少于30IU
- 含有较低剂量白喉类毒素(缩写为“d”)的疫苗大 约含有2IU。
含有较高剂量白喉类毒素(D)的疫苗用于对10岁以下儿童进行令人满意的初级免疫。含有较低剂量白喉类毒素(d)的疫苗应用于10岁或10岁以上个体的初级免疫接种,可提供令人满意的免疫反应,并将反应风险降至最低。
这一预防建议尤其适用于早期免疫接种既往暴露史和可能性不确定。低剂量制剂也被推荐用于加强免疫(见下面的‘加强免疫’一节)。
白喉疫苗仅作为混合产品的一部分提供:
- 白喉/破伤风/无细胞百日咳/灭活脊髓灰质炎疫苗/
b型流感嗜血杆菌(DTaP/IPV/Hib)
- 白喉/破伤风/无细胞百日咳/灭活脊髓灰质炎疫苗(DTaP/IPV或dTaP/IPV)
- 破伤风/白喉/灭活脊髓灰质炎疫苗(Td/IPV)。
上述疫苗不含硫柳汞。它们是灭活的,不含活的有机体,不会引起它们所保护的疾病。
Td/IPV疫苗应在需要预防破伤风、白喉或脊髓灰质炎时使用,以便对所有三种疾病提供全面的长期保护。
单价白喉疫苗不可用。
储存
疫苗应储存在+2℃至+8℃的原包装中,并避光保存。所有疫苗在某种程度上都对冷热敏感。高温加速了大多数疫苗效力的下降,从而缩短了它们的保质期。除非储存在正确的温度下,否则无法保证疫苗的有效性。冷冻可能导致某些疫苗的反应原性增加和效力丧失。它还会在容器中产生细小的裂纹,导致内容物被污染。
剂型
白喉疫苗仅作为联合产品的一部分提供。它以混浊的白色混悬液的形式提供,可以装在单剂量安瓿或预装注射器中。悬浮液在储存期间可能会沉淀,因此在施用前应摇动疫苗以使悬浮液均匀分布。
剂量和时间表
- 首剂0.5ml含白喉成分的疫苗。
- 第二剂0.5ml,第一剂后一个月。
- 第三剂0.5ml,第二剂后一个月。
- 第四次和第五次剂量为0.5ml,应在推荐的时间间隔内给药(见下文)。
接种
疫苗通常通过上臂或大腿前外侧肌肉注射。这是为了降低局部反应的风险,局部反应在皮下注射疫苗时更常见(Mark et al., 1999, Diggle and Deeks, 2000; Zuckerman, 2000)。然而,对于患有出血性疾病的个体,应通过深层皮下注射来接种疫苗,以降低出血的风险。
含白喉的疫苗可与MMR、MenC和乙型肝炎等其他疫苗同时接种。这些疫苗应在不同的部位接种,最好是在不同的肢体。如果给药在同一个肢体,它们应该至少分开2.5厘米(American Academy of Pediatrics, 2003)。应在个人记录中注明每种疫苗的注射地点。
处理
用于接种疫苗的设备,包括用过的小瓶或安瓿,应在每次接种结束后,密封在一个合适的防刺穿“锐器”盒中进行处置(未批准,BS 7320)。
疫苗使用建议
免疫接种计划的目的是在适当的时间间隔内为所有人提供至少五剂含白喉成分的疫苗。在大多数情况下,在适当的时间间隔总共注射五剂疫苗被认为能提供令人满意的长期保护。
为了实现这一目标,每个年龄组的适当疫苗也取决于保护个人免于破伤风、百日咳、Hib和脊髓灰质炎的需要。
初级免疫接种
10岁以下的婴儿和儿童
白喉疫苗接种的主要疗程包括三剂含白喉毒素的产品。DTaP/IPV/Hib建议在两个月、三个月和四个月时接种,但也可以在两个月至十岁的任何阶段接种。如果第一疗程中断,应重新开始,但不能重复,允许剩余剂量之间有一个月的间隔。
十岁或十岁以上的儿童和成人
白喉疫苗接种的主要疗程包括三剂白喉毒素,每剂间隔一个月。Td/IPV推荐给所有10岁以上的人。如果第一疗程中断,应重新开始,但不能重复,允许剩余剂量之间有一个月的间隔。
加强免疫
10岁以下的儿童应接受第一次白喉加强疫苗,同时接种破伤风、百日咳和脊髓灰质炎疫苗。含白喉疫苗的第一次加强注射最好在完成初级疗程三年后进行,通常是在儿童三岁半至五岁之间。当初次疫苗接种延迟时,第一次加强剂量可在预定就诊时给予——前提是第三次初次剂量后一年。这将重新建立孩子的常规时间表。DTaP/ IPV或dTaP/IPV应用于该年龄组。Td/IPV不应常规用于该年龄组的此目的,因为它不含百日咳,且与其他推荐制剂相比,未显示出同等的白喉抗毒素反应。
仅接种过三剂含白喉疫苗的10岁或10岁以上的个人应接种第一剂白喉加强剂与破伤风和脊髓灰质炎疫苗(Td/IPV)。
理想情况下,Td/IPV的第二次加强剂量应在第一次加强剂量10年后给予所有个体。如果先前的剂量被推迟,第二次加强注射应在学校会议或预定的时间进行——前提是第一次和第二次加强注射之间至少间隔五年。这将是确保长期保护的最后一次预定机会。
如果一个人参加了常规加强剂量,并且有在破伤风易发伤口后接种疫苗的历史,应尝试确定接种了哪种疫苗。如果受伤时注射的疫苗与当前就诊时注射的疫苗相同,并且在适当的间隔后注射,则不需要常规加强剂量。否则,在受伤时给予的剂量应该打折扣,因为它可能不能提供针对所有抗原的长期保护,并且应该给予预定的免疫接种。这样的额外剂量不可能产生不可接受的反应速率(Ramsay et al., 1997)。
免疫状态未知或不完全的儿童接种疫苗
如果在英国出生的儿童有不充分的免疫史,应尽一切努力澄清他们可能接种过哪些疫苗(见第11章)。未完成初级疗程的儿童应每月注射一次剩余剂量。儿童可在第三剂首剂疫苗接种一年后接受第一剂加强疫苗接种,以重新建立常规方案。第二次加强剂要在离校的时候打,保证这个时候的长期保护。在可能的情况下,第一次助推器和第二次助推器之间应至少间隔五年。
来到英国的儿童,如果有在原籍国完成免疫接种的历史,可能无法获得针对目前在英国使用的所有抗原的保护。他们很可能在他们的原籍国接受过含白喉成分的疫苗。针对特定国家信息请参考www.who.int/immunization_monitoring/en/glob alsummary/country profile select . cfm
来自发展中国家、冲突地区或难以接触到的人群的儿童可能没有完全免疫。如果没有可靠的既往免疫史,则应假设其未被免疫,并应遵循完整的英国建议(参见第11章疫苗接种计划)。
来到英国的儿童可能已经接种了第四剂含白喉成分的疫苗,在一些国家,这种疫苗在18个月左右接种。这一剂量应打折扣,因为它可能无法提供令人满意的保护,直到青少年加强剂的时间。常规的学前教育和随后的强化教育应该按照英国的时间表进行。
旅行者和那些要去国外生活的人
所有前往流行病或地方病地区的旅行者应确保根据英国的时间表进行全面免疫接种。根据旅行的目的地和性质,可能需要额外剂量的疫苗,例如,对于那些将要在流行病或地方病地区与当地人一起生活或工作的人(Department of Health, 2001)。如果需要破伤风、白喉或脊髓灰质炎保护,并且相关抗原的最终剂量是在十多年前接受的,则应给予Td/IPV。
实验室和医护人员的白喉疫苗接种
在微生物实验室和临床传染病单位工作过程中可能接触白喉的个人处于危险之中,必须受到保护(见第12章)。
禁忌症
很少有人不能接种含白喉疫苗。如有疑问,应向儿科顾问、免疫协调员或传染病控制顾问寻求适当的建议,而不是拒绝接种疫苗。
疫苗不应注射给患有以下疾病的人:
- 对先前剂量的含白喉疫苗的确认过敏反应,或
- 对疫苗的任何成分产生过敏反应。
确诊的过敏反应极少发生。来自英国、加拿大和美国的数据表明,每100万剂疫苗中发生0.65至3次过敏反应事件(Bohlke et al., 2003; Canadian Medical Association, 2002)。其他过敏情况可能更常见,但不是进一步免疫的禁忌症。仔细的事件史通常会区分过敏反应和其他不是由疫苗引起的或不威胁生命的事件。在后一种情况下,有可能继续免疫过程。必须寻求专家对疫苗和接种环境的建议。必须考虑到个人未接种疫苗的风险。
预防措施
没有发烧或全身不适的小病不是推迟免疫接种的正当理由。如果个人急性不适,免疫接种可能会推迟,直到他们完全康复。这是为了避免由于错误地将任何体征或症状归因于疫苗的副作用而混淆任何急性疾病的鉴别诊断。
先前免疫接种后的全身和局部反应
本节就前一次疫苗接种后72小时内有严重或轻度全身或局部反应史的儿童的免疫接种提出建议。应在以下病史后继续接种含白喉疫苗:
- 发烧,不论其严重程度
- 低渗-低反应性发作
- 持续哭闹或尖叫超过三小时
- 严重的局部反应,与程度无关。
出现上述严重反应的儿童继续并完成了含白喉疫苗的免疫接种,没有复发(Vermeer-de Bondt et al., 1998; Gold et al., 2000)。
在加拿大,对DTaP/IPV/Hib的严重全身或局部反应不是进一步接种疫苗的禁忌症(Canadian MedicalAssociation, 1998)。加拿大对儿童免疫接种后的不良事件进行了仔细监测(Le Saux et al., 2003),加拿大的经验表明,进一步的剂量与之前事件的复发或恶化无关(S Halperin and R Pless, pers. comm., 2003)。
怀孕和母乳喂养
当需要保护时,可以立即给孕妇接种含白喉成分的疫苗。没有证据表明给孕妇或哺乳期妇女接种灭活病毒或细菌疫苗或类毒素有风险(Plotkin and Orenstein, 2004)。
早产儿
根据时间表,早产儿在适当的年龄接种疫苗是很重要的。接种疫苗后窒息的发生率在早产婴儿中特别高。
住院的极早产儿(出生于≤28周妊娠)在接受第一次免疫接种时,应进行48-72小时的呼吸监测,尤其是那些先前有呼吸不成熟病史的婴儿。如果儿童在第一次免疫接种后出现呼吸暂停、心动过缓或不饱和,第二次免疫接种也应在医院进行,并进行48-72小时的呼吸监测(Pfister et al., 2004; Ohlsson et al., 2004; Schulzke et al., 2005; Pourcyrous et al., 2007; Klein
et al., 2008)。
由于这一组婴儿接种疫苗的益处很大,因此不应停止或推迟接种疫苗。
免疫抑制和艾滋病毒感染
根据上述建议,应考虑免疫抑制或HIV感染(不考虑CD4计数)的个体接种含白喉疫苗。然而,如果这些人受到免疫抑制,他们可能不会产生完全的抗体反应,而且疫苗的保护效力尚未得到研究。在治疗结束并痊愈后,应考虑重新免疫。可能需要专家的建议。
皇家儿科和儿童健康学院提供进一步的指导(www.rcpch.ac.uk),英国艾滋病毒协会(BHIVA)艾滋病毒感染成人免疫指南(BHIVA,2006)和英国和爱尔兰儿童艾滋病毒协会(CHIVA)免疫指南(www.bhiva.org/chiva)。
神经疾病
原有的神经疾病
神经疾病的存在不是免疫接种的禁忌症。如果有证据表明儿童患有神经疾病,应遵循图15.2流程图中给出的建议。
如果儿童有稳定的先存神经异常,如脊柱裂、先天性大脑异常或围产期缺氧缺血性脑病,他们应根据建议的时间表进行免疫接种。当有记录的新生儿期脑损伤史时,应进行免疫接种,除非有证据表明出现了神经异常。
如果有证据表明目前的神经系统恶化,包括控制不佳的癫痫,应推迟免疫接种,并应将儿童转介给儿童专家进行调查,以确定潜在的原因。如果没有确定病因,应推迟免疫接种,直到病情稳定。如果确定了病因,免疫接种应该照常进行。
癫痫家族史不是免疫接种的禁忌症。当有热性惊厥的个人或家族病史时,在任何发热(包括由免疫接种引起的发热)后发生热性惊厥的风险会增加。与发热相关的癫痫发作在出生后的前六个月很少见,在出生后的第二年最常见。过了这个年龄,频率下降,五岁以后就很少了。
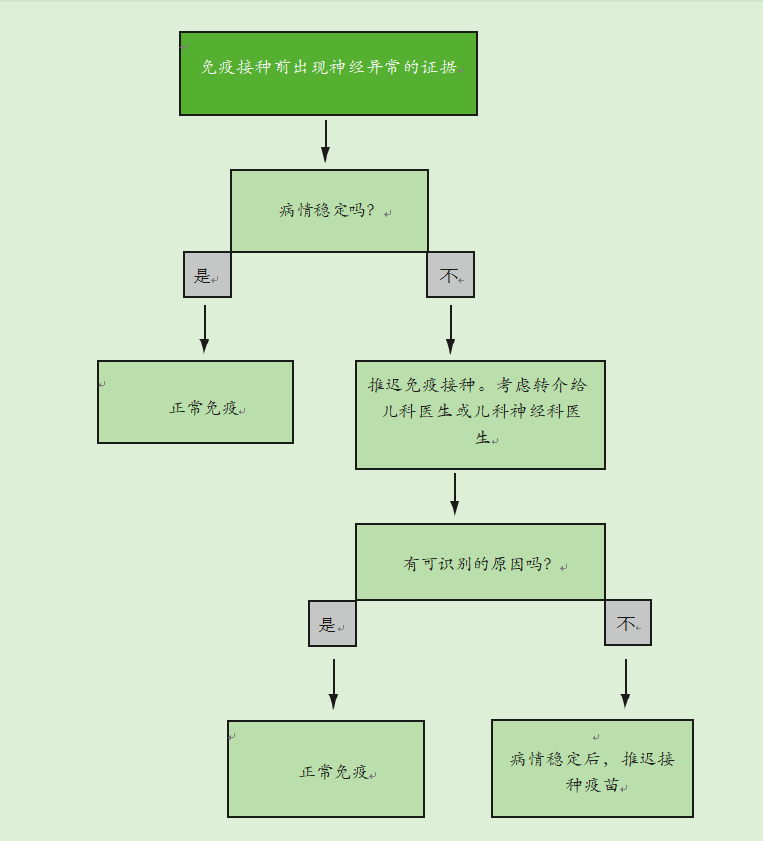
图15.2免疫程序流程图(如果在免疫前有神经疾病的证据)
当儿童在过去有过与发热相关的癫痫发作,没有神经恶化的证据时,应按照建议进行免疫接种。接种疫苗前应提供预防和控制发烧的建议。
当儿童出现与发热无关的癫痫发作,并且没有神经恶化的迹象时,应按照建议进行免疫接种。当接种百白破疫苗时,有癫痫发作家族史或个人史的儿童没有明显的不良事件,他们的发育进程是正常的(Ramsay et al., 1994)。

图15.3免疫接种后七天内发生的脑炎或脑病的流程图
免疫接种后的神经异常
如果儿童在免疫接种后7天内出现脑病或脑炎,应遵循图15.3流程图中的建议。这些情况不太可能是由疫苗引起的,应该由专家进行调查。在未发现潜在病因的儿童中,应推迟免疫接种,直到病情稳定,并且儿童在7天内未完全康复。如果确定了病因或儿童在七天内康复,应按照建议进行免疫接种。
如果在免疫接种后72小时内出现与发烧相关的癫痫发作,如果没有发现潜在原因,并且儿童在24小时内没有完全康复,则应推迟进一步的免疫接种,直到病情稳定。如果查明了病因或儿童在24小时内康复,应按照建议继续进行免疫接种。
推迟免疫接种
需要推迟免疫接种的情况很少(见上文)。延期使孩子得不到保护;应尽量缩短延期时间,以便尽快开始免疫接种。如果专家建议推迟,应明确告知全科医生,一旦孩子适合接种,必须立即告知他或她。
不良反应
注射部位的疼痛、肿胀或发红是常见的,并且可能在后续剂量后更频繁地发生。注射部位可能会形成一个小而无痛的结节;这通常会消失,没有任何后果。与全细胞百日咳疫苗相比,白喉疫苗联合无细胞百日咳疫苗的局部反应发生率较低,与DT疫苗后的局部反应发生率相似(Miller, 1999; Tozzi and Olin, 1997)。
接种DTaP和DT疫苗后,发热、惊厥、高音调尖叫以及苍白、发绀和无力(HHE)的发作很少发生,但频率相同(Tozzi and Olin, 1997)。
确诊的过敏反应极少发生。来自英国、加拿大和美国的数据表明,每100万剂疫苗中发生0.65至3次过敏反应事件(Bohlke et al., 2003; Canadian Medical Association, 2002)。其他过敏情况可能更常见,但不是进一步免疫的禁忌症。
所有疑似疫苗不良反应发生在儿童身上,或任何年龄的人在接种了标有黑三角(▼)的疫苗后,应使用黄卡计划向人类药物委员会报告。成人对疫苗的严重疑似不良反应也应通过黄卡计划进行报告。
病例、接触者、携带者和暴发的管理
由于白喉在英国是一种应报告的疾病,为了对病例、接触者和疫情进行公共卫生管理,所有疑似病例都应立即报告给当地卫生保护单位。
病例管理
白喉抗毒素仅用于医院环境中的白喉疑似病例。应进行排除对马血清过敏的试验。白喉抗毒素不应等待细菌学确认就给予。应根据制造商的说明服用,剂量取决于患者的临床情况。
白喉抗毒素基于马血清,因此比人类免疫球蛋白产品更容易发生严重的速发型过敏反应。如果发生过敏反应,应立即通过肌肉注射(0.5ml1:1000溶液)或静脉注射(1ml1:10,000溶液)给予肾上腺素(0.5ml或1ml等分)。该建议不同于免疫接种后过敏反应的治疗建议,因为抗毒素是在医院环境中使用的。
在大多数皮肤感染中,大规模毒素吸收是不太可能的,因此给予抗毒素的风险通常被认为远大于任何益处。然而,如果皮肤白喉感染的溃疡足够大(即大于2平方厘米),特别是如果它是膜性的,那么更大剂量的抗毒素将是合理的。
需要抗生素治疗来消灭病菌并防止传播。抗生素的选择是红霉素、阿奇霉素、克拉霉素或青霉素(Bonnet and Begg, 1999)。
应确定产毒性白喉病例的免疫史。部分免疫或未免疫的个人应根据英国的时间表完成免疫。完全免疫的个人应根据其年龄接受一次强化剂量的含白喉疫苗。
联系人管理
应立即调查产毒性白喉病例或携带者的接触者,对其进行监测,并给予抗生素预防和疫苗。应确定接触产毒性白喉的所有个人的免疫史。部分免疫或未免疫的个人应根据英国的时间表完成免疫接种(见上文)。完全免疫的个人应根据其年龄接受一次强化剂量的含白喉疫苗。
产毒性白喉病例或携带者的接触者应给予红霉素或青霉素的预防性疗程。产毒性溃疡梭菌病例的接触者确实需要预防,因为尽管这种情况很罕见,但不能排除人与人之间的传播(Bonnet and Begg, 1999)。
供应
疫苗
- Pediacel(白喉/破伤风/五组分无细胞百日咳/灭活脊髓灰质炎疫苗/b型流感嗜血杆菌(DTaP/IPV/Hib)-由赛诺菲巴斯德MSD公司生产。
- Repevax(白喉/破伤风/五组分无细胞百日咳/灭活脊髓灰质炎疫苗(dTaP/IPV))–由赛诺菲巴斯德MSD公司生产。
- Infanrix IPV(白喉/破伤风/三组分无细胞百日咳/灭活脊髓灰质炎疫苗(DTaP/IPV))–由葛兰素史克公司生产。
- Revaxis(破伤风/白喉/灭活脊髓灰质炎疫苗(Td/IPV))–由赛诺菲巴斯德MSD公司生产。
这些疫苗由医疗物流(电话:0870 871 1890)提供,作为国家儿童免疫规划的一部分。
在苏格兰,应该从当地的儿童疫苗储备中心获得供应。详情可从苏格兰保健用品公司(电话:0141 282 2240)获得。
白喉抗毒素由Butantan研究所提供,每10ml小瓶含10,000国际单位。它由英国健康保护局传染病中心免疫部分发(电话:020 8200 6868)。
参考
American Academy of Pediatrics (2003) Active immunization. In: Pickering LK (ed.) Red Book: 2003 Report of the Committee on Infectious Diseases, 26th edition. Elk Grove Village, IL: American Academy of Pediatrics, p 33.
Bohlke K, Davis RL, Marcy SH et al. (2003) Risk of anaphylaxis after vaccination of children and adolescents. Pediatrics 112: 815–20.
Bonnet JM and Begg NT (1999) Control of diphtheria: guidance for consultants incommunicable disease control. CDPH 2: 242–9.
British HIV Association (2006) Immunisation guidelines for HIV-infected adults: www.bhiva.org/pdf/2006/Immunisation506.pdf.
Canadian Medical Association (1998) Pertussis vaccine. In: Canadian Immunisation Guide,5th edition. Canadian Medical Association, p 133.
Canadian Medical Association (2002) – General considerations. In: Canadian Immunisation Guide, 6th edition. Canadian Medical Association, p 14.
CDR (1997) Diphtheria acquired during a cruise in the Baltic sea: update. Communicable Disease Report 7: 219.
De Benoist AC, White JM, Efstratiou A et al. (2004) Cutaneous diphtheria, United Kingdom. Emerging Infectious Diseases 10: 511–13.
Department of Health (2001) Health information for overseas travel, second edition. London: TSO.
Diggle L and Deeks J (2000) Effect of needle length on incidence of local reactions to routine immunisation in infants aged 4 months: randomised controlled trial. BMJ 321: 931– 3.
Dittmann S, Wharton M, Vitek C et al. (2000) Successful control of epidemic diphtheria in the states of the Former Union of Soviet Socialist Republics: lessons learned. JID 181 (Suppl 1): S10 –22.
Edmunds WJ, Pebody RG, Aggerback H et al. (2000) The sero-epidemiology of diphtheria in Western Europe. Epidemiol Infect 125: 113–25.
Gold M, Goodwin H, Botham S et al. (2000) Re-vaccination of 421 children with a past history of an adverse reaction in a specialised service. Arch Dis Child 83: 128–31. Klein NP, Massolo ML, Greene J et al. (2008) Risk factors for developing apnea after immunization in the neonatal intensive care unit. Pediatrics 121(3): 463-9.
Mark A, Carlsson RM and Granstrom M (1999) Subcutaneous versus intramuscular injection for booster DT vaccination in adolescents. Vaccine 17: 2067–72
Miller E (1999) Overview of recent clinical trials of acellular pertussis vaccines. Biologicals 27: 79–86.
Ohlsson A and Lacy JB (2004) Intravenous immunoglobulin for preventing infection in preterm and/or low-birth-weight infants. Cochrane Database Syst Rev(1): CD000361.
Pfister RE, Aeschbach V, Niksic-Stuber V et al. (2004) Safety of DTaP-based combined immunization in very-low-birth-weight premature infants: frequent but mostly benign cardiorespiratory events. J Pediatr 145(1): 58-66.
Plotkin SA and Orenstein WA (eds) (2004) Vaccines, 4th edition. Philadelphia: WB Saunders Company, Chapter 8.
Pourcyrous M, Korones SB, Arheart KL et al. (2007) Primary immunization of premature infants with gestational age <35 weeks: cardiorespiratory complications and C-reactive protein responses associated with administration of single and multiple separate vaccines simultaneously. J Pediatr 151(2): 167-72.
Ramsay M, Begg N, Holland B and Dalphinis J (1994) Pertussis immunisation in children with a family or personal history of convulsions: a review of children referred for specialist advice. Health Trends 26: 23–4.
Ramsay M, Joce R and Whalley J (1997) Adverse events after school leavers received combined tetanus and low-dose diphtheria vaccine. CDR Review 5: R65–7.
Reacher M, Ramsay M, White J et al. (2000) Nontoxigenic Corynebacterium diphtheriae: an emerging pathogen in England and Wales? Emerg Infect Diseases 6: 640–5.
Le Saux N, Barrowman NJ, Moore DL et al. (2003) Canadian Paediatric Society/Health Canada Immunization Monitoring Program – Active (IMPACT). Decrease in hospital
admissions for febrile seizures and reports of hypotonic-hyporesponsive episodes presenting to hospital emergency departments since switching to acellular pertussis vaccine in Canada: a report from IMPACT. Pediatrics 112(5): e348.
Schulzke S, Heininger U, Lucking-Famira M et al. (2005 ) Apnoea and bradycardia in preterm infants following immunisation with pentavalent or hexavalent vaccines. Eur J Pediatr 164(7): 432-5.
Tozzi AE and Olin P (1997) Common side effects in the Italian and Stockholm 1 Trials. Dev Biol Stand. 89: 105–8.
Vermeer-de Bondt PE, Labadie J and Rümke HC (1998) Rate of recurrent collapse after vaccination with whole-cell pertussis vaccine: follow-up study. BMJ 316: 902.
Zuckerman JN (2000) The importance of injecting vaccines into muscle. BMJ 321: 1237–8.
Hits: 195
