Contents
轮状病毒疫苗 ROTARIX FDA
ROTARIX (Rotavirus Vaccine, Live, Oral)
Suspension, for oral use
Initial U.S. Approval: 2008
处方信息的重点
这些重点不包括使用所需的所有信息
ROTARIX安全有效。请参阅完整的处方信息 ROTARIX。
口服轮状病毒活疫苗混悬液
美国首次批准日期:2008年
—————近期主要变化—————
剂量和给药(2.1、2.2、2.3)xx/xxxx
——————适应症和用法—————
ROTARIX疫苗用于预防由G1和非G1型(G3、G4和G9)引起的轮状病毒胃肠炎。ROTARIX获准用于6周至24周大的婴儿。(1)
—————剂量和用法————
仅供口服使用。
ROTARIX有以下两种供应方式:
药瓶和口服给药器介绍:药瓶包含
•冻干疫苗组分和口服给药器含有稀释剂。在给药前,必须用稀释剂重新溶解小瓶中的物质以形成ROTARIX(2.1),或
•仅口服给药涂药器介绍:口服给药涂药器含有ROTARIX,使用前无需复溶或稀释。(2.1)
日程安排
•从6周大的婴儿开始注射第一剂疫苗。(2.3)
•间隔至少4周-24周后注射第二剂。(2.3)
————剂型和强度————
口服混悬液。
—————禁忌症—————
•对疫苗或疫苗的任何成分有明显的过敏史。(4.1, 11)
•未矫正的先天性胃肠道畸形病史,可能使婴儿容易发生肠套叠。(4.2)
•肠套叠病史。(4.3)
•严重联合免疫缺陷病(SCID)病史。(4.4, 6.2)
—————警告和注意事项—————
•预灌装口服给药器的顶端盖帽含有天然橡胶乳胶,可能会引起过敏反应。(5.1)
•患有急性腹泻或呕吐的婴儿应推迟使用ROTARIX疫苗。尚未评估ROTARIX疫苗在患有慢性胃肠道疾病的婴儿中的安全性和有效性。(5.2)
•尚未确定ROTARIX疫苗对患有已知原发性或继发性免疫缺陷的婴儿的安全性和有效性。(5.3)
•在一项上市后研究中,在第一次用药后31天内观察到肠套叠病例的时间相关性,在前7天内病例聚集(5.5, 6.2)。
—————不良反应——————
常见的(≥5%)不良反应包括烦躁/易怒、咳嗽/流鼻涕、发烧、食欲不振和呕吐。(6.1)
要报告疑似不良反应,请联系葛兰素史克公司1-888-825-5249或VAERS公司1-800-822-7967或www.vaers.hhs.gov。
有关患者咨询信息和FDA批准的患者标签,请参见第17节。
修订日期:xx/xxxx
| 完整的处方信息:内容* | 7药物相互作用 *完整处方信息中省略的章节或小节未列出。 |
完整的处方信息
1适应症和用法
ROTARIX疫苗适用于预防由G1和非G1型(G3、G4和G9)引起的轮状病毒胃肠炎,以2剂系列给药【参见临床研究(14.3)】.
ROTARIX获准用于6周至24周大的婴儿。
2剂量和用法仅供口服。
2.1 ROTARIX演示
ROTARIX有两种型号,一种是小瓶和口服给药器剂型,另一种是仅口服给药剂型。
小瓶和口服给药器剂型
小瓶包含冻干疫苗组分,口服给药器包含稀释剂。在给药前,必须用稀释剂将小瓶中的物质重新溶解以形成ROTARIX。
仅口服给药剂型
仅口服给药涂药器包含ROTARIX,使用前不需要复溶或稀释。
2.2制备和给药
小瓶和口服给药器剂型
使用附带的稀释剂重构冻干疫苗成分以形成ROTARIX。复溶后,每剂量1毫升口服给药。
准备和给药步骤见图1。
图1.药瓶和口服给药器演示的准备和给药步骤
 1 1 | 2 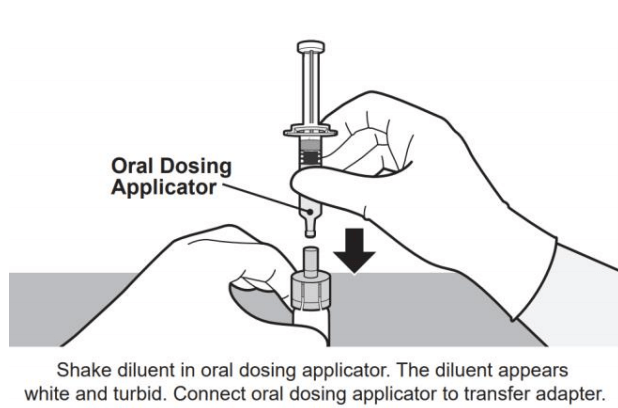 |
3  | 4 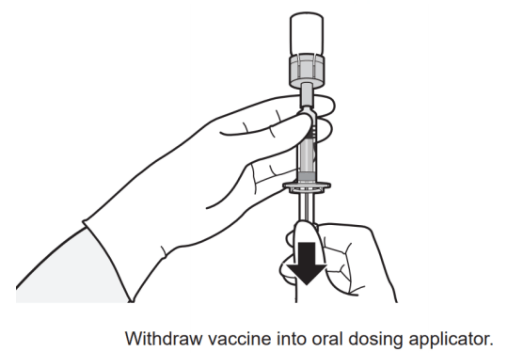 |
5  | 6 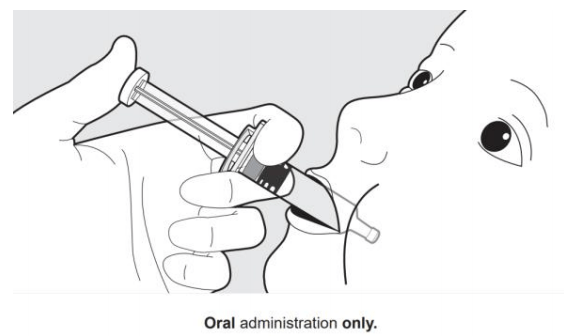 |
 | |
为口服接种。让婴儿斜躺着坐下。将口服给药器朝向内脸颊放置。服用口服剂量的全部内容物将涂药器放入婴儿嘴里。
仅口服给药剂型
ROTARIX口服给药涂药器在使用前不需要重新配制或稀释。每剂1.5毫升口服。
准备和接种步骤见图2。
图2.仅口服给药器的准备和给药步骤演示
1  | 2 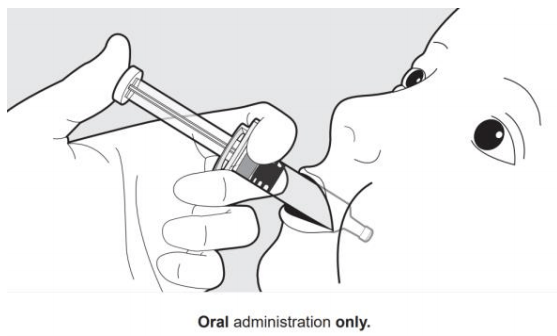 |
 | |
为仅口服。让婴儿斜躺着坐下。将口服给药器朝向内脸颊放置。将口服给药器的全部内容物注入婴儿口中。
2.3剂量和时间表
疫苗接种系列包括两剂口服接种。婴儿应在6周大时开始接种第一剂疫苗。第一剂和第二剂之间应至少间隔4周。2剂系列应在24周龄前完成。
尚未评估第一剂接种ROTARIX疫苗和第二剂接种另一种轮状病毒疫苗的安全性和有效性,反之亦然。
如果婴儿吐出或回吐了大部分疫苗剂量,可考虑在同一接种访视时补充一剂疫苗。
2.4婴儿喂养
临床研究中允许母乳喂养。没有证据表明母乳喂养会降低ROTARIX疫苗对轮状病毒胃肠炎的保护作用。
在接种ROTARIX疫苗之前或之后,对婴儿的液体消费(包括母乳)没有限制。
3剂型和强度
口服混悬液
小瓶和口服给药器介绍:复溶后单次剂量为1 mL。
仅口服给药器介绍:单次剂量为1.5毫升。
4禁忌症
4.1过敏
对疫苗的任何成分有明显的过敏史。
接种一剂ROTARIX疫苗后出现过敏症状的婴儿不应再接种ROTARIX疫苗。
4.2胃肠道先天畸形
有未矫正的胃肠道先天畸形(如梅克尔憩室)病史的婴儿不应该接受ROTARIX疫苗。
4.3肠套叠病史
有肠套叠病史的婴儿不应接种ROTARIX疫苗【参见警告和 注意事项(5.5)】。在上市后经验中,有报告称,在第一剂疫苗接种后出现肠套叠病史后,第二剂疫苗接种后出现肠套叠导致死亡[参见 不良反应(6.2)】.
4.4严重的联合免疫缺陷病
患有严重联合免疫缺陷病(SCID)的婴儿不应接种ROTARIX疫苗。上市后有报告称,接种轮状病毒活疫苗和口服轮状病毒疫苗的婴儿出现胃肠炎,包括严重腹泻和疫苗病毒持续脱落,后来被确认为患有SCID【参见不良反应(6.2)】.
5警告和注意事项
5.1乳胶
预灌装口服给药器的顶端盖帽含有天然橡胶乳胶,可能会引起过敏反应。
5.2胃肠疾病
患有急性腹泻或呕吐的婴儿应推迟使用ROTARIX疫苗。
尚未评估ROTARIX疫苗在患有慢性胃肠道疾病的婴儿中的安全性和有效性。【参见禁忌症(4.2)。]
5.3免疫活性改变
尚未确定ROTARIX疫苗对患有已知原发性或继发性免疫缺陷的婴儿(包括感染人类免疫缺陷病毒(HIV)的婴儿、接受免疫抑制治疗的婴儿或患有影响骨髓或淋巴系统的恶性肿瘤的婴儿)的安全性和有效性。
5.4脱落和传播
轮状病毒在接种疫苗后出现粪便脱落,在第1剂后第7天左右出现排泄高峰。
一项临床试验表明,疫苗接种者会将疫苗病毒传播给健康的血清阴性接触者【参见临床药理学(12.2)】.
接种疫苗后传播疫苗病毒的可能性应与获得和传播天然轮状病毒的可能性进行权衡。在考虑是否对免疫缺陷密切接触者(如恶性肿瘤患者、原发性免疫缺陷患者或正在接受免疫抑制治疗的患者)使用ROTARIX疫苗时,建议谨慎。
5.5肠套叠
在使用一种已获许可的口服活恒河猴轮状病毒疫苗后,一种观察到肠套叠风险增加。1在拉丁美洲和芬兰进行的一项预许可随机安慰剂对照安全性研究(包括63,225名婴儿)评估了ROTARIX疫苗的肠套叠风险。与安慰剂相比,在该临床试验中使用ROTARIX疫苗后未观察到肠套叠风险增加。【参见不良反应(6.1)。]
在墨西哥进行的一项上市后观察性研究中,在接种第一剂ROTARIX疫苗后31天内观察到肠套叠病例,前7天出现病例聚集。【参见不良反应(6.2)。]
在巴西和澳大利亚进行的其他上市后观察研究也表明
接种第二剂疫苗后7天内肠套叠风险增加ROTARIX.2,3【参见不良反应(6.2)。]
在全球被动上市后监测中,有与轮状病毒暂时相关的肠套叠病例报告【参见不良反应(6.2)】.
5.6暴露后预防
尚未评估接触轮状病毒后使用ROTARIX疫苗的安全性和有效性。
6不良反应
6.1临床试验经验
由于临床试验是在差异很大的条件下进行的,因此在一种疫苗的临床试验中观察到的不良反应率不能直接与另一种疫苗的临床试验中的不良反应率进行比较,并且可能不能反映实际观察到的不良反应率。
ROTARIX有两种配方:复溶冻干配方(以小瓶和口服给药器的形式提供)和液体配方(仅以口服给药器的形式提供)【参见说明(11)】。每种配方产生的安全性数据彼此相关,因为每种配方都含有相同的活减毒轮状病毒毒株,并且采用相似的工艺生产。
常见的(≥5%)不良反应包括烦躁/易怒、咳嗽/流鼻涕、发烧、食欲不振和呕吐。
在7项临床研究中收集了请求的不良反应、主动提供的不良事件、严重不良事件(SAE)和肠套叠病例(研究1至7;NCT00729001、NCT00385320、NCT00429481、NCT00757770、NCT00140686、NCT00169455、NCT00137930)。在另一项大型安全性研究中收集了肠套叠和SAE病例(研究8;NCT00140673)对ROTARIX(复溶冻干制剂)和安慰剂进行了比较。在3项临床研究中收集了请求的不良反应、主动提供的不良事件和SAE(研究9至11;NCT02914184、NCT03207750、NCT03954743)对两种ROTARIX配方进行了比较。
ROTARIX(复溶冻干制剂)的临床试验经验
研究1至8共评估了71,209名接受ROTARIX疫苗的婴儿(n = 36,755)或安慰剂(n = 34,454)。这些研究的种族分布如下:西班牙裔73.4%,白人16.2%,黑人1.0%,其他9.4%;51%是男性。
征集的不良反应:在7项临床研究(研究1至7)中,家长/监护人在接种ROTARIX疫苗后连续8天(即接种当天和接下来的7天)收集了详细的安全性信息。在每次服用ROTARIX疫苗或安慰剂后的第一周内,每天填写日记卡,记录烦躁/易怒、咳嗽/流鼻涕、婴儿体温、食欲不振、呕吐或腹泻。ROTARIX疫苗和安慰剂接受者的不良反应发生率相似(表1)。
表1.接种第1剂和第2剂ROTARIX疫苗或安慰剂后8天内出现的不良反应(总接种队列)
| 副反应 | 剂量1 | 剂量2 | ||
| ROTARIX n = 3,284 % | 安慰剂 n = 2,013 % | ROTARIX n = 3,201 % | 安慰剂 n = 1,973 % | |
| 烦躁/不耐烦a | 52 | 52 | 42 | 42 |
| 咳嗽/流鼻涕b | 28 | 30 | 31 | 33 |
| 发烧c | 25 | 33 | 28 | 34 |
| 食欲不振d | 25 | 25 | 21 | 21 |
| 呕吐 | 13 | 11 | 8 | 8 |
| 腹泻 | 4 | 3 | 3 | 3 |
接种疫苗的队列总数=安全性数据可用的所有接种疫苗的婴儿。
n =至少填写了一份症状表的婴儿人数。
a定义为比平时哭得更多。
b 7项研究中有1项未收集数据;剂量1:ROTARIX n = 2583;安慰剂 n = 1,897;剂量2:ROTARIX n = 2522;安慰剂 n = 1,863。
c定义为直肠温度≥100.4℉(≥38.0℃)或口腔温度≥99.5℉(≥37.5℃)。
d定义为比平时吃得少。
主动不良反应:在7项临床研究(研究1至7)中,对婴儿接种疫苗后31天内发生的主动严重和非严重不良事件进行了监测。与安慰剂受试者(n = 2,902)相比,ROTARIX受试者(n = 5,082)发生以下不良反应的概率更高(排除1的相对风险的95%CI):过敏(ROTARIX受试者11.4%,安慰剂受试者8.7%)和胃胀气(ROTARIX受试者2.2%,安慰剂受试者1.3%)。
严重不良反应:在8项临床研究(研究1至8)中对婴儿接种疫苗后31天内发生的SAE进行了监测。与1.9%的安慰剂接受者(n = 34,454)相比,1.7%的ROTARIX接受者(n = 36,755)发生了严重不良反应。在安慰剂接受者中,与ROTARIX疫苗接受者相比,腹泻(安慰剂0.07%,ROTARIX疫苗0.02%)、脱水(安慰剂0.06%,ROTARIX疫苗0.02%)和胃肠炎(安慰剂0.3%,ROTARIX疫苗0.2%)的发生率在统计学上更高(RR的95% CI排除1)。
死亡人数:在8项临床研究(研究1至8)的整个过程中,服用ROTARIX疫苗后有68例(0.19%)死亡(n = 36,755),服用安慰剂后有50例(0.15%)死亡(n = 34,454)。疫苗接种后最常报告的死亡原因是肺炎,在19例(0.05%)ROTARIX疫苗接受者和10例(0.03%)安慰剂接受者中观察到肺炎(RR: 1.74,95% CI: 0.76,4.23)。
肠套叠:在拉丁美洲和芬兰进行的一项对照安全性研究(研究8)中,对63,225名婴儿(31,673名接受ROTARIX疫苗,31,552名接受安慰剂)进行了肠套叠风险评估。通过主动监测(包括独立、补充方法)(前瞻性医院监测和父母在预定研究访视时报告)对婴儿进行监测,以确定疫苗接种后31天内的潜在肠套叠病例,并在20,169名婴儿(10,159名接受ROTARIX疫苗,10,010名接受安慰剂)中进行第一剂疫苗接种后长达一年的监测。
服用ROTARIX疫苗后31天内未观察到肠套叠风险增加,中位时间为100天后,发病率与安慰剂组相当(表2)。在一组20,169名婴儿(10,159名接受ROTARIX疫苗,10,010名接受安慰剂)中,接种第一剂疫苗后随访一年,ROTARIX疫苗组有4例肠套叠,而安慰剂组有14例肠套叠(RR:0.28【95% CI:0.10,0.81】)。所有发生肠套叠的婴儿均痊愈且无后遗症。
表2.ROTARIX疫苗与安慰剂相比的肠套叠和相对风险
| 肠套叠的确诊病例 | ROTARIX n = 31,673 | 安慰剂 n = 31,552 |
| 任何剂量后31天内诊断 相对风险(95%CI) | 6 | 7 |
| 0.85 (0.30, 2.42) | ||
| 第1剂后100天内a 相对风险(95%CI) | 9 | 16 |
| 0.56 (0.25, 1.24) | ||
CI =置信区间。
a第1剂后的中位持续时间(第2剂后30至90天的随访)。
在疫苗接种者中,在接种第一剂疫苗后的0至14天内没有出现肠套叠的确诊病例(表3),这是之前获得许可的口服活恒河猴轮状病毒疫苗的最高风险时期。1
表3.与剂量相关的日范围内的肠套叠病例
| 日期范围 | 剂量1 | 剂量2 | 任何剂量 | |||
| ROTARIX n = 31,673 | 安慰剂 n = 31,552 | ROTARIX n = 29,616 | 安慰剂 n = 29,465 | ROTARIX n = 31,673 | 安慰剂 n = 31,552 | |
| 0-7 | 0 | 0 | 2 | 0 | 2 | 0 |
| 8-14 | 0 | 0 | 0 | 2 | 0 | 2 |
| 15-21 | 1 | 1 | 2 | 1 | 3 | 2 |
| 22-30 | 0 | 1 | 1 | 2 | 1 | 3 |
| 总计(0-30) | 1 | 2 | 5 | 5 | 6 | 7 |
川崎病–对照和非对照临床研究的结果:在16项已完成或正在进行的临床试验中,有18例(0.035%)ROTARIX疫苗接受者和9例(0.021%)安慰剂接受者报告了川崎病(研究1至8;研究12至14,NCT00425737、NCT00346892、NCT00139347研究15至17,3项研究的NCT00197210研究18和19,NCT00334607,NCT00382772)。在这27例病例中,有5例发生在非安慰剂对照或1:1随机临床试验中的ROTARIX之后。在安慰剂对照试验中,17名ROTARIX疫苗接受者和9名安慰剂接受者报告了川崎病(RR:1.71【95% CI:0.71,4.38】)。这27例病例中有3例是在接种后30天内报告的:2例(ROTARIX= 1,安慰剂= 1)来自安慰剂对照试验(RR:1.00【95% CI:0.01,78.35】),1例在ROTARIX之后报告的病例来自非安慰剂对照试验。在接受ROTARIX疫苗的患者中,研究剂量后的发病时间为3天至19个月。
比较两种ROTARIX配方的临床试验
在3项随机临床研究(研究9至11)中评估了ROTARIX液体制剂的安全性。共有4,223名婴儿接受了ROTARIX疫苗(液体制剂,n = 2,507;复溶冻干制剂,n = 1,716)。这三项研究的种族分布如下:亚裔24.4%,白人63.2%,黑人或非裔美国人5.1%,其他7.3%;49.7%为男性。
在研究10中,在美国进行的一项伴随疫苗给药研究中,1,272名婴儿接受了ROTARIX疫苗(液体制剂,n = 632复溶冻干制剂,n = 640)。这项研究的种族分布如下:亚裔3.3%,白人73.8%,黑人或非裔美国人11.9%,其他10.9%;51.5%为男性。
在研究9至11中,父母在每次接种疫苗后的8天内(接种当天和接下来的7天内)在日记卡上记录了请求的一般不良反应(咳嗽/流鼻涕、腹泻、发烧、易怒/烦躁、食欲不振和呕吐)。在每次接种后31天内(接种当天和接种后30天)评估主动不良事件。在最后一次给药后的6个月内评估SAE。
征集的不良反应:在研究10中,两种ROTARIX疫苗的受试者出现的不良反应见表4:
表4.在接种第1剂和第2剂ROTARIX疫苗(液体或复溶冻干制剂)后的8天内出现不良反应,研究10总接种队列
| 不良反应 | 剂量1 | 剂量2 | ||||||
| ROTARIX (液体配方) n = 632 | ROTARIX (复溶冻干配方) n = 640 | ROTARIX (液体配方) n = 607 | ROTARIX (复溶冻干配方) n = 609 | |||||
| 总体百分比 | G3% | 总体百分比 | G3% | 总体百分比 | G3% | 总体百分比 | G3% | |
| 烦躁/不耐烦a | 70.9 | 9.2 | 71.6 | 8.8 | 72.5 | 13.7 | 70.1 | 11.8 |
| 咳嗽/流鼻涕b | 27.2 | 0.5 | 28.1 | 1.3 | 36.9 | 3.8 | 36.5 | 3.6 |
| 发烧c | 5.7 | 0.3 | 5.0 | 0.3 | 10.5 | 0.3 | 12.3 | 0.7 |
| 食欲不振d | 32.3 | 0.2 | 33.4 | 0.9 | 29.5 | 1.2 | 29.2 | 1.8 |
| 呕吐e | 17.4 | 2.8 | 16.4 | 3.4 | 13.7 | 4.0 | 12.8 | 3.3 |
| 腹泻病f | 6.2 | 0.2 | 5.6 | 0.8 | 5.6 | 0.5 | 4.3 | 0.3 |
G3 =三级。
接种疫苗的队列总数=安全性数据可用的所有接种疫苗的婴儿。n =接受特定剂量的婴儿数量。
a总体而言:定义为比平时哭得更多。3级:无法安慰/阻止正常活动的哭闹。
b . 3级咳嗽/流鼻涕:妨碍日常活动的咳嗽/流鼻涕。
c总体温度:定义为温度≥100.4℉(≥38.0℃)。3级:定义为温度>103.1℉(>39.5℃)。
d总体:定义为吃得比平时少。3级:定义为完全不吃东西。
e总体而言:定义为一天内进食后≥1小时出现1次或多次部分消化的胃内容物有力排空..3级:≥3次呕吐/天。
f总体而言:定义为一天内排出3次或3次以上比正常情况下更稀的大便。3级:比正常大便次数/天多≥6次。
主动不良事件:在研究9至11中,监测婴儿在接种疫苗后31天内出现的主动严重和非严重不良事件。两组之间自发不良事件的发生率和频率没有显著差异。
严重不良事件:在研究9至11的整个过程中,4.7%的ROTARIX液体制剂接受者(n = 2,507)发生了SAE,而ROTARIX复溶冻干制剂接受者的SAE发生率为4.4%(n = 1,716)。
在研究9至11的整个过程中,使用ROTARIX液体制剂(研究10)后出现了1例致命SAE(诊断为婴儿猝死综合征)。经评估,该严重不良事件与疫苗接种无因果关系。
在研究9至11的参与者中,报告了2例肠套叠病例。研究10的一名受试者在接受第二剂ROTARIX疫苗(复溶冻干制剂)后8天出现肠套叠。该事件被认为可能与ROTARIX有关。来自研究9的一名受试者在接受第二剂ROTARIX疫苗(液体制剂)后133天出现肠套叠;该事件被认为与ROTARIX无关。两名受试者均住院治疗,肠套叠的结果被报告为已解决。
6.2上市后体验
一项基于医院的主动监测研究评估了轮状病毒疫苗接种与肠套叠之间的时间相关性,该研究识别了肠套叠婴儿在墨西哥的参与医院。采用自身对照病例系列方法,4将接种ROTARIX疫苗后7天内和接种ROTARIX疫苗后31天内的肠套叠发生率与对照期进行比较。控制期从出生到一年,不包括预先确定的风险期(分别为接种疫苗后的前7天或前31天)。
在两年的时间里,参与的医院向大约100万名1岁以下的婴儿提供了保健服务。在750名肠套叠婴儿中,与对照组相比,接种第一剂ROTARIX疫苗后31天内肠套叠的相对发生率为1.96(95.5% CI:1.46,2.63);与对照组相比,接种第一剂ROTARIX疫苗后7天内肠套叠的相对发生率为6.07(95.5% CI:4.20,8.63)。
墨西哥的研究没有考虑到所有可能导致婴儿肠套叠的疾病。这些结果可能不能推广到美国婴儿,因为美国婴儿肠套叠的背景发生率低于墨西哥婴儿。然而,如果在美国婴儿中确实存在与墨西哥研究中观察到的类似程度的轮状病毒感染肠套叠风险的暂时增加,估计在接种第一剂轮状病毒疫苗后的7天内,美国每100,000名接种疫苗的婴儿中约有1至3例肠套叠住院病例。据估计,美国婴儿出生后第一年内肠套叠住院率约为每100,000名婴儿34例。5
在巴西和澳大利亚进行的其他上市后观察研究也表明,接种第二剂ROTARIX疫苗后的前7天内肠套叠风险增加。2,3
全球被动上市后监测数据表明,ROTARIX疫苗接种后报告的大多数肠套叠病例发生在第一剂疫苗接种后的7天内。
在ROTARIX疫苗上市后使用过程中发现了以下不良反应。由于这些反应是由规模不确定的人群自愿报告的,因此并不总是能够可靠地估计其频率或建立与疫苗接种的因果关系。
胃肠疾病
SCID婴儿肠套叠(包括死亡)、复发性肠套叠(包括死亡)、便血、肠胃炎伴疫苗病毒脱落。
血液和淋巴系统疾病
血管疾病川崎病。
全身疾病和给药部位不适
给药部位不舒服
7药物相互作用
7.1免疫抑制疗法
免疫抑制疗法,包括放疗、抗代谢药、烷化剂、细胞毒性药物和皮质类固醇(使用剂量大于生理剂量),可能会降低对ROTARIX的免疫反应。【参见警告和注意事项(5.3)。]
8在特定人群中使用
8.4儿科使用
尚未评估ROTARIX疫苗对小于6周或大于24周的婴儿的安全性和有效性。
尚未确定ROTARIX疫苗对早产儿的有效性。有报告胎龄≤36周的早产儿(ROTARIX = 134,安慰剂= 120)的安全性数据。对这些早产儿进行了第2剂后长达30至90天的SAE随访。ROTARIX疫苗接受者的SAE发生率为5.2%,而安慰剂接受者为5.0%。该人群中无死亡或肠套叠病例报告。
11描述
用于口服给药的ROTARIX(轮状病毒活疫苗,口服)是一种活的、减毒的轮状病毒疫苗,来源于属于G1P【8】型的人89-12株。轮状病毒疫苗株在Vero细胞上繁殖。
ROTARIX有两种配方:复溶冻干配方(以小瓶和口服给药器的形式提供)和液体配方(仅以口服给药器的形式提供)。
药瓶和口服给药器演示配方
冻干疫苗组分重构后,用于小瓶和口服给药涂药器的每1 mL剂量的ROTARIX制剂含有至少106.0中值细胞培养感染剂量(CCID50)的减毒活轮状病毒。
此ROTARIX配方的冻干疫苗成分包含氨基酸、葡聚糖、杜尔贝克改良Eagle培养基(DMEM)、山梨醇和蔗糖。DMEM包含以下成分:氯化钠、氯化钾、硫酸镁、硝酸铁(III)、磷酸二氢钠、丙酮酸钠、D-葡萄糖、浓缩维生素溶液、L-胱氨酸、L-酪氨酸、氨基酸溶液、L-谷氨酰胺、氯化钙和碳酸氢钠。
在制造过程中,使用了猪源材料。猪圆环病毒1型(PCV-1)存在于这种ROTARIX配方中。目前还不知道PCV-1会导致人类疾病。
液体稀释剂包含碳酸钙、无菌水和黄原胶。稀释剂包括抗酸成分(碳酸钙),以在疫苗通过胃的过程中保护疫苗,并防止其因胃的酸性环境而失活。
这种ROTARIX配方采用单剂量瓶装亲脂性疫苗,配有一个预装的口服液体稀释剂涂敷器【参见如何供应/储存和搬运(16)】。预填充口服给药器的顶端盖帽含有天然橡胶胶乳;瓶塞不是由天然橡胶乳胶制成的。这种ROTARIX配方不含防腐剂。
仅用于口服给药器演示的配方
用于仅口服给药器的每1.5 mL剂量的ROTARIX制剂含有至少106.0 CCID50的减毒活轮状病毒。
该ROTARIX配方包含己二酸二钠、杜尔贝克改良Eagle培养基(DMEM)、蔗糖和无菌水。DMEM包含以下成分:氯化钠、氯化钾、硫酸镁、硝酸铁(III)、磷酸二氢钠、丙酮酸钠、D-葡萄糖、浓缩维生素溶液、L-胱氨酸、L-酪氨酸、氨基酸溶液、L-谷氨酰胺、氯化钙和碳酸氢钠。
这种ROTARIX制剂含有抗酸成分(己二酸二钠),可在疫苗通过胃的过程中保护疫苗,并防止其因胃的酸性环境而失活。
这种ROTARIX配方可用于单剂量预填充口服给药器【了解如何供应/储存和搬运(16)】。预填充口服给药器的顶端盖帽含有天然橡胶乳胶。
这种ROTARIX配方不含防腐剂。
12临床药理学
12.1作用机制
轮状病毒预防轮状病毒胃肠炎的确切免疫机制尚不清楚【参见临床研究(14.4)】。ROTARIX含有一种活的减毒人类轮状病毒,可在小肠内复制并诱导免疫。
12.2药效学
脱落和传播
在多米尼加共和国对同一家庭的双胞胎进行了一项前瞻性、随机、双盲、安慰剂对照研究,以评估疫苗病毒是否会从接种疫苗的婴儿传播到未接种疫苗的婴儿(研究20;NCT00396630)。将100对6-14周龄(胎龄≥32周)的健康双胞胎随机分组,其中一对接受ROTARIX疫苗治疗(n = 100),另一对接受安慰剂治疗(n = 100)。每组有20名受试者被排除在外,原因包括基线时有轮状病毒抗体。每次给药当天或给药前1天收集粪便样本,并在每次服用ROTARIX疫苗或安慰剂后连续6周每周收集3次粪便样本。传播被定义为接受安慰剂的双胞胎的任何粪便样本中存在疫苗病毒株。
在80名接受安慰剂的双胞胎中,有15名发现了传播的疫苗病毒(18.8%【95%可信区间:10.9,29.0】)。接受ROTARIX疫苗的双胞胎轮状病毒脱落的中位持续时间为10天,而接受安慰剂的双胞胎为4天,疫苗病毒在安慰剂中传播。在接受安慰剂的15对双胞胎中,没有观察到与传播的疫苗病毒有关的胃肠道症状。
13非临床毒理学
13.1致癌、诱变、生育能力受损
尚未评估ROTARIX的致癌性或致突变性或对生育能力的损害。
14项临床研究
ROTARIX有两种配方:复溶冻干配方(以小瓶和口服给药器的形式提供)和液体配方(仅以口服给药器的形式提供)【参见说明(11)】。使用以下方法评估疗效
复溶冻干制剂【参见临床研究(14.1、14.2、14.3)】。这些数据与液体制剂相关,因为两种制剂都含有相同的活减毒轮状病毒毒株,并且使用相似的工艺生产。
14.1功效研究
证明ROTARIX疫苗预防轮状病毒胃肠炎疗效的数据来自在欧洲和拉丁美洲17个国家进行的两项安慰剂对照研究(研究5和研究8)中随机纳入的24,163名婴儿。在这些研究中,口服脊髓灰质炎疫苗(OPV)没有同时使用;然而,其他常规儿童疫苗可以同时接种。两项研究都允许母乳喂养。
一项随机、双盲、安慰剂对照研究在6个欧洲国家进行(研究5)。共有3,994名婴儿登记接受ROTARIX疫苗(2646名)或安慰剂(1348名)。健康婴儿接种疫苗或安慰剂,分两剂进行,第一剂在6至14周大时口服,然后在第一剂后至少4周再接种一剂。2剂系列在24周龄时完成。对于两个疫苗接种组,98.3%的婴儿为白人,53%为男性。
轮状病毒胃肠炎的临床病例定义是腹泻发作(一天内排出3次或更多稀便或水样便),伴有或不伴有呕吐,其中在粪便样本中发现轮状病毒。胃肠炎的严重程度通过临床评分系统Vesikari量表确定,评估腹泻和呕吐的持续时间和强度、发烧强度、补液治疗的使用或每次发作的住院治疗。分数范围从0到20,分数越高表示严重性越高。一次肠胃炎发作11分或以上被视为严重。6
主要疗效终点是从第二剂疫苗接种后2周至一个轮状病毒季节预防由自然发生的轮状病毒引起的任何严重程度的轮状病毒胃肠炎(根据方案,ATP)。其他疗效评估包括预防严重轮状病毒胃肠炎(根据Vesikari标准定义),以及减少因轮状病毒胃肠炎和全因胃肠炎(无论推测的病因如何)而住院的人数。还对至少接受过一次疫苗接种的婴儿(全部接种队列,TVC)进行了分析,以评估ROTARIX疫苗对轮状病毒胃肠炎的疗效。
在一个轮状病毒季节中,ROTARIX疫苗对任何严重程度的轮状病毒胃肠炎的疗效为87.1%(95% CI:79.6,92.1);TVC疗效为87.3%(95%可信区间为80.3,92.0)。在一个轮状病毒季节中对严重轮状病毒胃肠炎的疗效为95.8%(95% CI:89.6,98.7);TVC疗效为96.0%(95%可信区间为90.2,98.8)(表5)。在第1剂给药后和第2剂给药前立即观察到的ROTARIX疫苗对任何严重程度的轮状病毒胃肠炎的保护效果为89.8%(95% CI:8.9,99.8)。
ROTARIX疫苗在一个轮状病毒感染季节减少轮状病毒胃肠炎住院的疗效为100%(95% CI:81.8,100);TVC疗效为100%(95%可信区间:81.7,100)(表5)。ROTARIX疫苗将所有病因胃肠炎住院率降低了74.7%(95% CI:45.5,88.9)。
表5轮状病毒疫苗在一个轮状病毒季节的疗效评估
| 队列中的婴儿 | 根据协议a | 接种总数b | ||
| ROTARIX n = 2,572 | 安慰剂 n = 1,302 | ROTARIX n = 2,646 | 安慰剂 n = 1,348 | |
| 肠胃炎病例 任何严重程度 | 24 5 | 94 60 | 26 5 | 104 64 |
| 对RV GE疗效评估 任何严重程度(95%CI) 严重c (95%CI) | 87.1%d (79.6, 92.1) 95.8%d (89.6, 98.7) | 87.3%d (80.3, 92.0) 96.0%d (90.2, 98.8) | ||
| 因RV GE住院的病例 | 0 | 12 | 0 | 12 |
| 因RV GE降低住院疗效 (95%CI) | 100%d (81.8, 100) | 100%d (81.7, 100) | ||
RV GE =轮状病毒胃肠炎;CI =置信区间。
a ATP分析包括效力队列中根据随机化接受两剂疫苗的所有婴儿。
b TVC分析包括效力队列中至少接种了一剂疫苗或安慰剂的所有婴儿。
c严重肠胃炎定义为Vesikari评分≥11分。
d与安慰剂相比具有统计学意义(P <0.001).
在拉丁美洲和芬兰的11个国家进行了一项随机、双盲、安慰剂对照研究(研究8)。共有63225名婴儿接受了ROTARIX疫苗(31673名)或安慰剂(31552名)。来自拉丁美洲的20,169名婴儿接受了ROTARIX疫苗(n = 10,159)或安慰剂(n = 10,010)治疗。健康婴儿接种疫苗或安慰剂,分两剂进行,第一剂在6至13周大时口服,然后在第一剂后至少4周再接种一剂。2剂系列在24周龄时完成。对于这两个疫苗接种组,疗效子集的种族分布如下:西班牙裔85.8%,白人7.9%,黑人1.1%,其他5.2%;51%是男性。
严重轮状病毒胃肠炎的临床病例定义为腹泻发作(一天内排出3次或3次以上稀便或水样便),伴有或不伴有呕吐,其中在粪便样本中发现轮状病毒,需要住院治疗和/或在医疗机构接受相当于世界卫生组织(WHO)计划B(口服补液治疗)或计划C(静脉补液治疗)的补液治疗。
主要疗效终点是从第二剂疫苗接种后2周至一年内预防由自然发生的轮状病毒引起的严重轮状病毒胃肠炎(ATP)。
对至少接受过一次疫苗接种的婴儿(TVC)进行分析以评估ROTARIX疫苗对严重轮状病毒胃肠炎的疗效。还评估了因轮状病毒胃肠炎住院的减少情况(ATP)。
ROTARIX疫苗在一年内对严重轮状病毒胃肠炎的疗效为84.7%(95% CI:71.7,92.4);TVC疗效为81.1%(95%可信区间为68.5,89.3)(表6)。
ROTARIX疫苗在一年内减少轮状病毒胃肠炎住院的疗效为85.0%(95%可信区间:69.6,93.5);TVC疗效为80.8%(95%可信区间为65.7,90.0)(表6)。
表6 ROTARIX疫苗一年疗效评估
| 队列中的婴儿 | 根据协议a | 接种总数b | ||
| ROTARIX n = 9,009 | 安慰剂 n = 8,858 | ROTARIX n = 10,159 | 安慰剂 n = 10,010 | |
| 肠胃炎病例 严重 | 12 | 77 | 18 | 94 |
| 对RV GE疗效评估 严重 (95%CI) | 84.7% c (71.7和92.4) | 81.1% c (68.5和89.3) | ||
| 因RV GE住院病例 | 9 | 59 | 14 | 72 |
| 因RV GE降低住院疗效 (95%CI) | 85.0%c (69.6, 93.5) | 80.8%c (65.7, 90.0) | ||
RV GE =轮状病毒胃肠炎;CI =置信区间。
a ATP分析包括效力队列中根据随机化接受两剂疫苗的所有婴儿。
b TVC分析包括效力队列中至少接种了一剂疫苗或安慰剂的所有婴儿。
c与安慰剂相比具有统计学意义(P <0.001).
14.2两个轮状病毒季节的功效
在两项研究中评估了ROTARIX疫苗在两个轮状病毒季节中的效力。
在欧洲研究(研究5)中,ROTARIX疫苗在两个轮状病毒季节对任何严重程度的轮状病毒胃肠炎的疗效为78.9%(95% CI:72.7,83.8)。预防仅在疫苗接种后第二个季节发生的任何严重程度的轮状病毒胃肠炎病例的有效性为71.9%(95% CI:61.2,79.8)。在两个轮状病毒季节中,ROTARIX疫苗对严重轮状病毒胃肠炎的疗效为90.4%(95% CI:85.1,94.1)。预防仅在疫苗接种后第二个季节发生的严重轮状病毒胃肠炎病例的有效性为85.6%(95% CI:75.8,91.9)。
在两个轮状病毒季节中,ROTARIX疫苗减少轮状病毒胃肠炎住院的疗效为96.0%(95% CI:83.8,99.5)。
在拉丁美洲研究(研究8)中,ROTARIX疫苗在两年内对严重轮状病毒胃肠炎的疗效为80.5%(95% CI:71.3,87.1)。预防仅在疫苗接种后第二年发生的严重轮状病毒胃肠炎病例的有效性为79.0%(95% CI:66.4,87.4)。ROTARIX疫苗在两年内减少轮状病毒胃肠炎住院的疗效为83.0%(95% CI:73.1,89.7)。
未评估ROTARIX疫苗接种后第二个季节后的功效。
14.3针对特定轮状病毒类型的功效
在一年中,针对由G1P【8】、G3P【8】、G4P【8】、G9P【8】和组合非G1(G2、G3、G4、G9)型引起的任何严重程度和严重轮状病毒胃肠炎的类型特异性疗效具有统计学意义。此外,针对由G1P【8】、G2P【4】、G3P【8】、G4P【8】、G9P【8】和组合非G1(G2、G3、G4、G9)型引起的任何严重程度和严重轮状病毒胃肠炎的类型特异性疗效在两年内具有统计学意义(表7)。
表7.ROTARIX疫苗对任何严重程度和严重轮状病毒胃肠炎的类型特异性疗效(根据方案)
| 型别a | 一个轮状病毒季节 | 两个轮状病毒季节 | ||||
| 案例数量 | %有效性(95%CI) | 案例数量 | %有效性(95%CI) | |||
| ROTARIX n = 2,572 | 安慰剂 n = 1,302 | ROTARIX n = 2,572 | 安慰剂 n = 1,302 | |||
| 任何严重程度 | ||||||
| G1P〔8〕 | 4 | 46 | 95.6%b (87.9, 98.8) | 18 | 89c d | 89.8% b (82.9,94.2) |
| G2P【4】 | 3 | 4c | NS | 14 | 17c | 58.3% b (10.1,81.0) |
| G3P【8】 | 1 | 5 | 89.9% b(9.5,99.8) | 3 | 10 | 84.8% b (41.0,97.3) |
| G4P【8】 | 3 | 13 | 88.3%b (57.5, 97.9) | 6 | 18 | 83.1% b (55.6和94.5) |
| G9P【8】 | 13 | 27 | 75.6%b (51.1, 88.5) | 38 | 71d | 72.9% b (59.3和82.2) |
| 组合非G1(G2、G3、G4、G9、G12)类型 | 20 | 49 | 79.3%b (64.6, 88.4) | 62 | 116 | 72.9% b (62.9,80.5) |
| 严重 | ||||||
| G1P〔8〕 | 2 | 28 | 96.4%b (85.7, 99.6) | 4 | 57 | 96.4% b (90.4,99.1) |
| G2P【4】 | 1 | 2c | NS | 2 | 7c | 85.5% b (24.0,98.5) |
| G3P【8】 | 0 | 5 | 100% b (44.8,100) | 1 | 8 | 93.7% b (52.8,99.9) |
| G4P【8】 | 0 | 7 | 100% b (64.9,100) | 1 | 11 | 95.4% b (68.3,99.9) |
| G9P【8】 | 2 | 19 | 94.7%b (77.9, 99.4) | 13 | 44d | 85.0% b (71.7,92.6) |
| 组合非G1(G2、G3、G4、G9、G12)类型 | 3 | 33 | 95.4%b (85.3, 99.1) | 17 | 70 | 87.7% b (78.9和93.2) |
CI =置信区间;NS =不显著。
a 由G型机完成的统计分析;如果在一次轮状病毒胃肠炎发作中检测到一种以上的轮状病毒类型,则在每个检测到的轮状病毒类型类别中对该发作进行计数。
b与安慰剂相比具有统计学意义(P <0.05).
c P基因型有一次不能分型。
d 在一次流行中均未检测到P-[8]基因型。
e .在第二季中分离出两例G12P【8】(每组一例)。
14.4免疫原性
对轮状病毒疫苗接种的抗体反应与轮状病毒胃肠炎保护之间的关系尚未确定。血清转化的定义是在接种疫苗后在先前轮状病毒阴性的婴儿血清中出现抗轮状病毒IgA抗体(浓度≥20 U/mL)。
在2项安全性和有效性研究(研究5和8)中,在2剂系列治疗后1至2个月,787名ROTARIX复溶冻干制剂接受者中有86.5%血清转化,而420名安慰剂接受者中只有6.7%血清转化;393名ROTARIX复溶冻干制剂接受者中有76.8%血清转化,而341名安慰剂接受者中只有9.7%血清转化。
研究9评估了2剂系列ROTARIX液体制剂的免疫原性。该研究比较了服用ROTARIX液体制剂(n = 984)或ROTARIX复溶冻干制剂(n = 329)后的血清转化率和几何平均浓度(GMCs)。主要分析表明,与ROTARIX复溶冻干制剂组相比,ROTARIX液体制剂组在疫苗接种后1至2个月的IgA血清转化率和GMCs并不劣于ROTARIX复溶冻干制剂组(血清转化率差异的95% CI下限≥10%;GMC比率≥0.67的95%CI下限)。
在研究10中,2剂系列给药3个月后,服用ROTARIX液体制剂(417例中的76.3%)和ROTARIX复溶冻干制剂(426例中的78.9%)后,具有抗轮状病毒IgA抗体(浓度≥20 U/mL)的受试者百分比相当。
14.5伴随疫苗给药
在临床试验中,ROTARIX疫苗与美国许可和非美国许可的疫苗同时使用。在一项使用ROTARIX(复溶冻干制剂)对484名婴儿进行的美国伴随疫苗给药研究(研究18)中,与单独使用ROTARIX疫苗相比,在同时使用PEDIARIX疫苗【吸附白喉和破伤风类毒素和无细胞百日咳疫苗、乙型肝炎(重组)和灭活脊髓灰质炎病毒疫苗】、美国许可的7价肺炎球菌结合疫苗(惠氏制药公司)和美国许可的嗜血杆菌结合疫苗(赛诺菲巴斯德公司)时,没有证据表明对任何抗原的免疫应答受到干扰
在一项对1,272名婴儿同时进行的疫苗给药研究(研究10)中,证明了PEDIARIX、HIBERIX【嗜血杆菌结合疫苗(破伤风类毒素结合疫苗)】和美国许可的13价肺炎球菌结合疫苗(辉瑞公司)在与下列疫苗同时给药时对每种抗原的免疫应答均具有非劣效性
ROTARIX液体制剂与ROTARIX重构冻干制剂同时给药时相比。
15参考文献
1.口服轮状病毒疫苗婴儿的肠套叠。NEnglJ Med。2001;344:564–572.
2.澳大利亚国家免疫计划中与轮状病毒疫苗相关的肠套叠风险和疾病预防。刑事调查局。2013;57(10):1427-1434.
3.Patel MM,López-Collada VR,Bulhõ es MM等。在墨西哥和巴西接种轮状病毒疫苗的肠套叠风险和健康益处。NEnglJ Med。2011;364:2283-2292.
4.法林顿CP,惠特克HJ,霍西恩MN等。审查、干扰或缩减事后暴露的病例系列分析。生物统计学。2009;10(1):3–16.
5.泰特·JE,西蒙森L,维博德C等。1993-2004年美国婴儿肠套叠住院趋势:监测新轮状病毒疫苗接种计划安全性的意义儿科。2008;121:e1125-e1132。
6.芬兰儿童的轮状病毒疾病:使用数值评分评估腹泻发作的严重程度。ScandJ传染疾病。1990;22:259-267.
16如何供应/储存和搬运
16.1 ROTARIX小瓶和口服给药器剂型
ROTARIX小瓶和口服给药器以冻干疫苗成分单剂量小瓶的形式提供,同时配有一个带活塞塞的液体稀释剂(1 mL)预灌装口服给药器和一个用于复溶的转移适配器。
作为10剂(NDC 58160-854-52)的外包装提供,包含:
10瓶亲液化疫苗成分的内包装(NDC 58160-851-10)
o单瓶冻干疫苗成分(NDC 58160-851-01)
稀释剂口服给药器(NDC 58160-853-02)(10个给药器)复溶前的储存
小瓶中的冻干疫苗成分:在20至8oC(36o至46oF)下冷藏储存。
保护小瓶免受光照。
口服给药器中的稀释剂:在2至8℃(36至46℉)的温度下冷藏储存,或在25℃(77℉)的受控室温下储存。不要冻结。如果稀释剂已经冻结,请丢弃。
复溶后的储存
ROTARIX(小瓶和口服给药器剂型)应在复溶后24小时内给药。复溶后,在2至8℃(36至46℉)或最高25℃(77℉)的受控室温下冷藏储存。如果在24小时内没有使用,请将重新配制的疫苗丢弃在生物废物容器中。不要冻结。如果复溶疫苗已经冷冻,则丢弃。
16.2仅ROTARIX口服给药剂型
ROTARIX口服给药剂型以单个1.5毫升剂量装在一个带活塞塞的预灌装口服给药器(NDC 58160-740-02)中,每盒10个(NDC 58160-740-21)。
储存
在在2至8℃(36至46℉)的温度下冷藏储存。不要冻结。如果疫苗已被冷冻,请丢弃。保持原包装避光。
17患者咨询信息
参见FDA批准的患者标签(患者信息)。完整处方信息末尾附有患者标签,可撕下。
向父母或监护人提供以下信息:
告知使用ROTARIX疫苗进行免疫接种的潜在益处和风险,以及完成免疫接种系列的重要性。
告知服用ROTARIX疫苗或其他含有类似成分的疫苗时暂时出现不良反应的可能性。
指示立即向医务人员报告肠套叠的任何迹象和/或症状。
提供国家儿童基金会要求的疫苗信息声明
1986年疫苗伤害法案规定在免疫接种前接种。这些材料可在疾病控制和预防中心(CDC)网站上免费获得
(www.cdc.gov/vaccines)。
ROTARIX、PEDIARIX和HIBERIX由GSK公司集团所有或获得许可。列出的其他品牌是其各自所有者拥有或许可使用的商标,不归GSK公司集团所有或许可使用。这些品牌的制造商不隶属于GSK集团,也不认可该集团的公司或其产品。
制造商葛兰素史克生物制品公司
比利时Rixensart,美国许可证1617发行商葛兰素史克公司
北卡罗来纳州达勒姆市,邮编27701
xxxx GSK公司集团或其许可方。RTX:xxPI
从这里分开,给病人发传单
————————————————–
| 患者信息 ROTARIX(ROTARIX) 口服轮状病毒活疫苗 |
| 什么是ROTARIX? ROTARIX是一种疫苗,可以保护您的宝宝免受一种可能导致严重腹泻和呕吐的病毒(称为轮状病毒)的感染。轮状病毒会导致腹泻和呕吐,这种情况非常严重,以至于您的宝宝会失去过多的体液,需要去医院。 轮状病毒疫苗是一种通过口服给宝宝接种的液体。这不是注射。 |
| 哪些人不应服用ROTARIX? 如果出现以下情况,您的宝宝不应感染轮状病毒: 他或她在接种一剂ROTARIX疫苗后出现过敏反应。 他或她对该疫苗的任何成分过敏。在这张传单的末尾可以找到成分表。 医生告诉您宝宝的消化系统有缺陷(不正常)。 他或她有肠套叠的严重病史,肠套叠发生在肠道的一部分阻塞或扭曲时。 他或她患有严重的联合免疫缺陷病(SCID),这是一种严重的免疫系统问题。 |
| 如果您的宝宝出现以下情况,请告知医生: 对乳胶过敏。 免疫系统有问题。 患有癌症。 将与免疫系统有问题或正在接受癌症治疗的人密切接触,因为疫苗病毒可能会传播给未接种疫苗的接触者。更换尿布后建议洗手,以帮助防止疫苗病毒的传播。 如果您的宝宝一直腹泻和呕吐,您的医生可能希望在给宝宝服用一剂ROTARIX疫苗之前等待。 |
| ROTARIX是如何给出的? ROTARIX是一种液体,可以滴入宝宝的嘴里并吞咽。
您的宝宝将在6周大时接种第一剂疫苗。 第二剂将在第一剂后至少4周(6月龄前)进行。 请务必与医生一起计划宝宝接种第二剂疫苗的时间,因为在宝宝6个月大之前接种两剂ROTARIX疫苗非常重要。 医生可能会决定在接种ROTARIX疫苗的同时给宝宝接种其他疫苗。接种ROTARIX疫苗后,您的宝宝可以正常进食。 |
| ROTARIX可能有哪些副作用? ROTARIX疫苗最常见的副作用是: 哭泣 烦躁不安 咳嗽 流鼻涕 发烧 食欲不振 呕吐。 如果您的宝宝在接种ROTARIX疫苗后出现以下任何问题,请立即致电您的医生或前往急诊室,即使距离上次接种疫苗已经过去了几周,因为这些可能是称为肠套叠的严重问题的迹象: 严重呕吐 严重腹泻 便血 高烧 严重胃痛(如果您的宝宝在哭泣或尖叫时将膝盖靠近胸部)。研究表明,接种第一剂和第二剂疫苗后,肠套叠的风险增加,尤其是在前7天。 自FDA批准以来,疫苗不良事件报告系统(VAERS)已收到婴儿肠套叠的报告。肠套叠发生在接种疫苗后几天,有时几周。一些婴儿需要住院治疗、肠道手术或特殊灌肠来治疗这个问题。因肠套叠导致的死亡已经发生。 |
| 其他报道的副作用包括:川崎病(一种可能影响心脏的严重疾病;症状可能包括发烧、皮疹、眼睛发红、嘴巴发红、腺体肿胀、手脚肿胀,如果不治疗,可能会导致死亡)。 如果您的宝宝有任何与您有关的问题,请与您的医生交谈。 |
| ROTARIX的成分是什么? Rotarix有两种配方,一种要求您的疫苗接种提供商将冻干成分与液体成分混合,另一种以液体形式提供,不需要混合。 您的医务人员可以告诉您宝宝将接受的配方。 需要混合的配方 ROTARIX的这种配方含有弱化的人轮状病毒。 ROTARIX的这种配方还包含碳酸钙、葡聚糖、山梨醇、蔗糖、氨基酸、黄原胶、杜尔贝克改良Eagle培养基(DMEM)和无菌水。DMEM的成分如下:氯化钠、氯化钾、硫酸镁、硝酸铁(III)、磷酸二氢钠、丙酮酸钠、D-葡萄糖、浓缩维生素溶液、L-胱氨酸、L-酪氨酸、氨基酸溶液、L-谷氨酰胺、氯化钙和碳酸氢钠。 猪圆环病毒1型(PCV-1)是一种在猪中发现的病毒,存在于ROTARIX的这种配方中。目前还不知道PCV- 1会导致人类疾病。 ROTARIX的这种配方不含防腐剂。 用于给宝宝注射ROTARIX疫苗的滴管顶端含有乳胶。 不需要混合的配方 ROTARIX的这种配方含有弱化的人轮状病毒。 ROTARIX的这种配方还包含己二酸二钠、蔗糖、杜尔贝克改良Eagle培养基(DMEM)和无菌水。DMEM的成分如下:氯化钠、氯化钾、硫酸镁、硝酸铁(III)、磷酸二氢钠、丙酮酸钠、D-葡萄糖、浓缩维生素溶液、L-胱氨酸、L-酪氨酸、氨基酸溶液、L-谷氨酰胺、氯化钙和碳酸氢钠。 ROTARIX的这种配方不含防腐剂。 用于给宝宝注射ROTARIX疫苗的滴管顶端含有乳胶。 |
| 制造商葛兰素史克生物制品公司 比利时Rixensart,美国许可证1617发行商葛兰素史克公司 北卡罗来纳州达勒姆市,邮编27701 商标归葛兰素史克集团所有或许可给该集团使用。xxxx GSK公司集团或其许可方。 RTX:xxPIL |
该患者信息已获得美国食品和药物管理局批准,修订日期:xx/xxxx
Hits: 118

