Contents
本指南由相应的 ICH 专家工作组制定,并按照 ICH 程序对各监管机构征询了意见。在 ICH 大会一致通过后,ICH 建议其成员国监管主体施行该指南草案的最终定稿。
| 编码 | 历史 | 日期 |
| Q9 | 在第四阶段获指导委员会批准,并建议 ICH 的 3 个监管机构采纳。 | 2005 年 11 月 9 日 |
| 编码 | 历史 | 日期 |
| Q9(R1) | 在第二阶段中获得ICH 大会成员批准, 并发布以公开征求意见(文件日期 18 日/11 月/2021 年)。 | 2021 年 11 月 18 日 |
| Q9(R1) | ICH 大会成员同意该指南进入第四阶段 | 2023 年 1 月 18 日 |
| Q9(R1) | 第 16 页有微小的印刷错误进行更正 | 2023 年 1 月 26 日 |
法律声明:本文受版权保护,除了 ICH 标志外,在始终承认 ICH 版权的前提下,基于公共许可可以使用、复制、在其他作品中引用、改编、修改、翻译或传播。如对本文件进行改编、修正或翻译,必须采取合理措施来清晰地标识、区分或以其他方式标记对文件进行的修改。必须避免任何对原始文件的改编、调整或翻译是由 ICH 认可或发起的印象。
本文件根据现有内容提供,不附带任何保证。ICH 或本文件的作者在任何情况下均不对使用本文件产生的任何索赔、损失或其他责任负责。
上述许可不适用于由第三方提供的内容。因此,对第三方拥有版权的文件,必须获得版权所有人的复制许可。
目录
|
1. 前言
风险管理的原则已有效应用于众多的商业领域和政府部门,包括金融、保险、职业安全、公共健康、药物警戒,以及这些行业的监管机构。在制药行业,ICH Q9 的原则和框架、以及支持本指南的官方 ICH 培训材料,有助于加强制药行业和监管机构对有效质量风险管理的应用。制药行业已认识到质量体系的重要性,并且质量风险管理作为有效质量体系中有价值的组成部分也日趋明显。
风险通常是指危害发生的可能性和该危害严重性的组合。然而,要使各利益相关方在应用风险管理方面达成共识是很困难的,因为各个利益相关方可能会意识到不同的潜在危害,并且对每个潜在危害的发生可能性和严重性也可能有不同的判断。此外,主观性可直接影响风险管理活动和决策的有效性。因此,管理并最大程度地降低主观性非常重要。在医药领域中,尽管存在患者、医疗机构以及政府部门和企业等多个利益相关方,在管理产品质量和可及性风险,特别是当质量/生产问题可能导致可及性风险时,保护患者是最为重要的。
药品及其各组分的生产和使用必然会存在一定程度的风险。质量方面的风险只是总体风险的一个组成部分,重要的是理解在产品生命周期中根据适当的基于风险的决策确保药品质量,使对药品重要的质量属性得以维持,并且保持产品安全有效。
有效的质量风险管理方法可以通过在药品研发、生产和流通过程中主动识别和控制潜在的质量问题,进一步保证为患者所提供药品的质量。这包括采用适宜的根本原因分析,以识别和解决此类问题的根本原因及其它诱因(如与人员相关原因)。积极主动的质量风险管理方法有益于帮助实现稳健的产品设计和持续改进,且对实现有效的药品质量体系具有战略重要性(有关有效药品质量体系的指南请参见 ICH Q10)。当发生质量问题时,实施质量风险管理可以有助于做出决策。
在开发阶段及验证活动中,质量风险管理是建立知识和理解风险情形的一部分,以便在技术转移期间作出适当的风险控制决策,并在商业化生产阶段使用。由此而言,知识被用于做出基于风险的有依据的决策,触发重新评价,并促进持续改进。而有效和主动的质量风险管理可促进在全生命周期中做出更好、更及时、更有依据的决策,能够向药品监管部门更好地证明公司具有处理潜在风险和避免问题的能力,从而对监管的范围和程度产生有益的影响。
数字化和新兴技术在药品生产和控制中的应用,当与其预期用途相符时,可降低风险。但也可能会带来一些需要进行控制的其它风险。因此,将质量风险管理应用于先进生产工艺和分析方法的设计、验证和技术转移,以及先进的数据分析方法和计算机化系统至关重要。
本文件旨在为质量风险管理提供系统化的方法,使得做出的决策更好、更有依据、更及时。作为基础性或资源性文件,既独立于其他 ICH 质量部分文件,又为其提供支持,也是对制药行业和法规监管范畴内现行相关质量规范、要求、标准和指导原则的补充。本文件为企业和监管部门提供质量风险管理的原则以及一些质量风险管理工具,这些原则和工具促进企业和监管机构对原料药及制剂(药品)在其生命周期中的质量做出更有效和一致的基于风险的决策。本文件的内容未超越现行法规的要求。
对质量风险管理正式性的理解会使资源得到更有效的利用,也就是说,对较低风险的问题采用较低的正式程度方式处理,从而释放出更多的资源处理风险更高、更复杂的问题,这些问题的处理需要更加严谨和更多付出。对正式性的理解也可以支持基于风险的决策,其正式的程度可能反映决策的重要性程度,以及某种情况下不确定性和复杂性的程度。
恰当地使用质量风险管理可以促进但不能免除制药企业遵守法规要求的义务,也不能取代制药企业和监管机构之间必要的沟通。如果法规和/或指南规定了某种做法是不可接受的,则不可以使用质量风险管理作出决定证明这种做法是合理的。
2. 范围
本文件提供的质量风险管理原则和工具示例可应用于药品质量管理的不同方面,包括在原料药、制剂(药品)、生物药及生物技术产品(包括在药品、生物药和生物技术产品中使用的原材料、溶剂、辅料、包装材料和标签)的全生命周期中的开发、生产、流通、检查、注册申报/审评过程。
3. 质量风险管理的原则
质量风险管理的两个基本原则:
- 质量风险的评价应当基于科学知识,最终目的是保护患者(注:质量风险包括产品可及性可能受到影响,导致潜在患者伤害的情况);
- 质量风险管理实施过程的深度、正式程度和文件化程度都应当与风险水平相适应。
4. 质量风险管理基本流程
质量风险管理是对贯穿于药品生命周期中的质量风险进行评估、控制、沟通和回顾的系统过程。在流程图(图 1)中概括展示了一种质量风险管理的模型,也可使用其他的模型。具体应用中,对该模型每一部分的关注点可能不同,但是一个可靠的流程应当考虑该模型中所有要素,其详尽程度与具体风险相适应。
图 1:典型的质量风险管理流程图
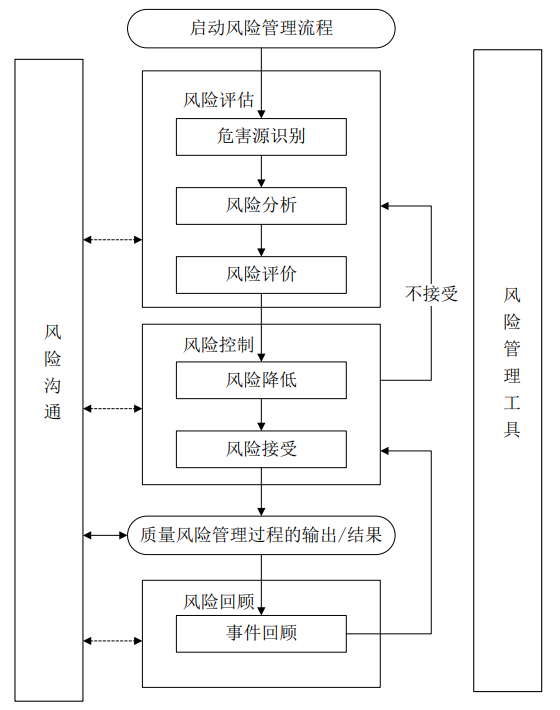
该流程图并未标明决策节点,因为决策可能发生在该流程的任何节点。这些决策可以是返回上一步骤并进一步补充信息,或调整风险模型,甚至可以是在有支持信息的情况下终止风险管理流程。注意:在流程图中“不接受”不仅指不符合法律法规要求,也包括需要重新进行风险评估的情况。
4.1 职责
质量风险管理活动通常但不总是由多学科团队来执行。团队组成应当包括相应领域专家(如:质量、产品开发、商务开发、工程、法规事务、生产运营、销售和市场、供应链、法律、统计和临床)以及熟悉质量风险管理流程的人员。
决策者应:
- 负责协调组织内各职能部门的质量风险管理;
- 确保质量风险管理流程已经制定、实施与回顾,并配置有足够的资源和知识可用。
- 确保质量风险管理活动的主观性得到管理并最大程度地降低,以促进基于风险的决策更加科学稳健。
4.2 启动质量风险管理流程
质量风险管理包括一些系统化流程,设计这些流程是用于协调、促进和改善基于科学的有关风险的决策。启动和计划质量风险管理的步骤可包括:
- 明确问题和/或风险疑问,包括识别潜在风险的相关假设;
- 收集与风险评估相关的潜在危害源、危害或影响人类健康的背景信息和/或数据;
- 确定负责人和必要的资源;
- 规定风险管理流程的时限、交付成果和适当的决策层级。
4.3 风险评估
风险评估包括对危害源的识别,并分析和评价暴露于相应危害源的风险。质量风险评估从明确的问题描述或风险疑问开始,当明确定义所讨论的风险后,更容易识别适当的风险管理工具(见第 5 节中的示例),以及解决问题所需的信息类型。在风险评估中,以下三个基本问题通常可以帮助清晰地定义风险:
- 1、什么可能出错?
- 2、出错的可能有多大(可能性)?
- 3、后果是什么(严重性)?
危害源识别指依据风险问题或问题描述,系统地运用信息来识别危害源。信息可包括历史数据、理论分析、专业观点和利益相关方的关注点等。危害源识别关注“什么可能出错”,包括识别可能的后果,为后续的质量风险管理过程奠定基础。
风险分析是对所识别危害源的相关风险进行估计,是将危害发生可能性和严重性相结合的定性或定量过程。在某些风险管理工具中,对危害的检出能力(可检出性)也是估计风险的一个因素。
风险评价是将已经识别和分析的风险与给定的风险可接受标准进行比较。风险评价要综合考虑上述三个基本问题的证据力度。
在进行有效的风险评估时,数据的可靠程度非常重要,其决定了评估结果的质量。对假设及不确定性的合理来源的揭示,可以增加风险评估结果的可信度和/或有助于识别该结果的局限性。不确定性是由于工艺知识的不完整和工艺中存在预期或非预期波动的共同作用所致,其典型来源包括知识局限、制药科学和工艺理解的差距、危害的来源(如工艺失败模式,波动来源)和检出问题的可能性。
风险评估结果可以是风险的定量估计,也可以是风险范围的定性描述。当定量表达风险时,可用数值表示,当定性描述风险时,如用“高”、“中”、“低”来表述,应尽可能详细地定义。在风险分级中有时使用“风险评分”进一步定义风险等级。当一系列风险产生时,采用定量法进行风险评估,可估计某一特定后果的可能性。因此,风险定量估计对特定后果进行逐一估计时是有用的。另外,也可使用一些风险管理工具把多个水平的风险严重性和可能性组合到一个总的估计中,给出一个相对风险度量。评分过程的中间步骤有时可以使用定量风险估计。
4.4 风险控制
风险控制包括降低风险和/或接受风险的决策。风险控制的目的是降低风险至可接受水平。风险控制所采取的措施应当与该风险的重要程度相适应。决策者可采用包括收益成本分析在内的不同方法来理解最佳的风险控制水平。
风险控制可能会关注以下问题:
- 风险是否高于可接受水平?
- 什么措施可以用来降低或消除风险?
- 什么是利益、风险和资源间合适的平衡点?
- 控制所识别风险时是否会引入新的风险?
风险降低
风险降低是指当风险超出规定的(可接受)水平时(见图 1),减轻或避免质量风险的过程。风险降低可包括减少危害的严重性和发生的可能性所采取的措施。改善危害源及质量风险可检出性的过程也可作为风险控制策略的一部分。风险降低措施的实施可能会在系统中引入新的风险,或者增加其它已知风险的重要程度。因此,在实施风险降低过程后,可能需要重新讨论原有风险评估,以识别和评价风险可能产生的变化。
风险接受
风险接受是指接受风险的决策。对于某些类型的危害,即使最好的质量风险管理实践活动也未必能完全消除风险。这种情况下,可认为已采用了适宜的质量风险管理策略,并且质量风险已降低到规定的(可接受的)水平。(规定的)可接受的水平取决于多种因素,需具体情况具体判定。
4.5 风险沟通
风险沟通是指在决策者和其它人员之间就有关风险和风险管理的信息进行交流。各方可以在风险管理过程任何阶段进行沟通(见图 1 的虚线箭头)。质量风险管理过程的输出/结果应当进行适当的沟通并记录(见图 1 的实线箭头)。沟通可能包括以下相关方:例如,监管者和行业之间、企业和患者之间,以及在公司、行业或监管机构内部等。沟通所包含的信息可能与质量风险的存在、性质、形式、可能性、严重性、可接受性、控制、处理、可检出性或其它方面相关。无需对每项风险的接受进行沟通。在行业和监管机构之间,可以通过法规和指南中规定的途径沟通有关质量风险管理决策。
4.6 风险回顾
风险管理应当是质量管理过程中的一个持续的活动。应当建立对事件回顾和监控的机制。
应当考虑最新的知识和经验对风险管理过程中的输出结果进行回顾。当启动质量风险管理流程后,应当将该流程持续用于可能影响初始质量风险管理决策的事件,无论这些事件是计划内(例如,产品回顾、检查、审计、变更控制的结果)或计划外(例如,失败事件调查的根本原因,召回)。风险回顾的频率应当取决于风险水平。风险回顾可能包括重新考虑风险接受的决策(4.4 节)。
5. 风险管理方法学
质量风险管理为科学和切合实际的决策方法提供支持。质量风险管理提供了文件化、透明化和可重复的方法以实施质量风险管理流程的各个步骤,该方法基于现有知识评估危害源,及其相关风险的可能性、严重性,有时包括可检出性。在某些质量风险管理方法中,可检出性虽然可能并不被作为一项单独的因素,但是检出控制仍非常重要,因为它可以降低危害的发生可能性。
传统上,对质量风险的评估和管理是基于多种方法(经验和/或内部程序),如缺陷项、趋势及其它信息的汇总。这些方法对支持投诉处理、质量缺陷、偏差和分配资源等可以继续提供有用的信息。
此外,制药行业和监管机构可以使用公认的风险管理工具,和/或内部程序(如标准操作规程)来评估和管理风险。下面列举了部分工具(详见附录 1 和第 8 节中介绍):
- 基本风险管理引导方法(流程图,检查表等);
- 失效模式与影响分析(FMEA);
- 失效模式、影响与关键性分析(FMECA);
- 故障树分析(FTA);
- 危害源分析及关键控制点(HACCP);
- 危害源及可操作性分析(HAZOP);
- 初步危害源分析(PHA);
- 风险排序及筛选;
- 支持性统计工具。
上述工具可适用于原料药和制剂(药品)质量等相关的特定领域。质量风险管理方法和支持性统计工具可以组合使用(例如概率风险评估)。这些工具的组合使用有助于质量风险管理原则的灵活应用。
质量风险管理的严谨和正式程度应反映出现有的知识水平,并与需要解决问题的复杂性、不确定性和重要性相适应。
5.1 质量风险管理的正式性
质量风险管理中的正式性不是二元概念(即正式/非正式),在质量风险管理活动期间,包括在做出基于风险的决策时,其正式程度可能有多种水平,其从低到高是一个连续过程(或范围)。
对一个给定的质量风险管理活动,当确定采用何种水平的正式程度时,可以考虑以下方面,例如:
- 不确定性:质量风险管理中的“不确定性”意味着对相关危害源、危害、及其所致风险了解较少。风险评估范围相关的不确定性水平显示了管理潜在风险可能需要的正式程度的高低。系统地获取、分析、储存和传播科学信息的方法对于产生知识至关重要,而知识反过来又为所有质量风险管理活动提供信息。通过有效的知识管理,可以减少不确定性,从而在整个产品生命周期中使用积累的和新的信息(内部和外部)来支持基于风险的决策。
- 重要性:基于风险的决策对产品质量越重要,采用的正式程度应越高,就更需要减少与其相关的不确定性水平。
- 复杂性:为确保产品质量,质量风险管理活动的过程或专业领域越复杂,,应采用的正式程度就越高。
一般来说,更高的不确定性、重要性或复杂性可能需要更为正式的质量风险管理方法来管理潜在风险并支持更有效的基于风险的决策。
应在质量体系中明确描述在质量风险管理活动中应用的正式程度的总体方法。资源的限制不应成为可以进行低正式程度的质量风险管理活动的合理理由。风险评分、分级和评估应基于证据、科学和知识的正确应用。过程中无论采用了何种水平的正式程度,其目标是稳健的风险管理。
较高的正式程度可能具有以下特征:
- 明确执行质量风险管理过程的所有步骤(风险评估、风险控制、风险回顾和风险沟通),可形成独立的质量风险管理报告或相关文件,将过程中所有相关活动予以书面记录(例如,在质量体系内)。
- 在过程的某些或所有部分使用质量风险管理工具,包括附录 1 中所示工具。
- 为质量风险管理活动组建一个跨部门的团队。
- 使用具有质量风险管理流程方面的经验和知识的引导者可能是较高正式程度的流程所不可或缺的。
较低的正式程度可能具有以下特征:
- 一个或多个部分的质量风险管理过程不是作为独立活动执行的,而是在质量体系的其他要素中处理的,可能包含风险评估和风险控制活动。
- 质量风险管理工具可能不会在质量风险管理的某些或全部流程中使用。
- 可能不需要跨部门团队。
- 质量风险管理过程的结果通常记录在质量体系的相关部分中,可能不会生成独立的质量风险管理报告。
注:如前文所述,上述较高与较低级别之间可能还存在其他级别的正式程度,同样也可以使用。
5.2 基于风险的决策
基于风险的决策是所有质量风险管理活动中固有的,它为组织中的决策者提供了必要的基础。有效的基于风险的决策始于对质量风险管理过程实施的深度、正式程度和文件化程度的确定。质量风险管理活动所作的决策包括存在哪些危害源、与这些危害源相关的风险、所需的风险控制、风险控制后残留风险的可接受性、质量风险管理活动和输出的沟通和回顾。
由于所有决策都依靠于知识的使用,请参见 ICH Q10 以获取有关知识管理的指导。确保用于基于风险的决策的数据可靠性也很重要。
基于风险的决策方法:
做出基于风险的决策的可以用不同的流程,这些与质量风险管理过程中采用的正式程度直接相关。(关于质量风险管理正式程度的构成,请参见上文第 5.1 节。)一般来说,质量风险管理中较高的正式程度可能要求较高的基于风险的决策结构。基于风险的决策方法可能存在多种程度的结构。这些程度的结构可以被认为是一个连续体(或范围)。以下是对高度结构化流程与较低结构化流程,以及在做出基于风险的决策时基于规则的流程的描述:
- 一些基于风险的决策过程是高度结构化的,在做出决策之前,可以对现有的可用选项进行正式分析,涉及对与可用选项相关因素的深入考虑。当决策非常重要,同时不确定性和/或复杂性水平较高时,可使用此类流程。
- 另一些基于风险的决策过程是较低结构化的流程,使用更简单的方法做出决策,它们主要利用现有知识支持对危害源、风险和任何必要的风险控制进行评估。当决策非常重要,但不确定性和/或复杂性较低时,仍可使用此类过程。
- 也可以使用基于规则(或标准化)的方法做出决策,这些方法不需要新的风险评估来做出此类决策,即在有 SOP、政策或充分理解需求的地方,就已经决定了必须做出何种决策。这时,可能要有规则(或限制)来管理这些决策,因为这些决定可能是基于以往对相关风险的了解做出的,通常会指向预定的行动和/或预期结果。
上述基于风险的决策制定方法有益于运用知识来解决不确定性,可在众多领域帮助官方监管机构和制药行业做出更有依据的决策。它们还可以帮助识别仍存在不确定性的地方,以便确定适宜的风险控制措施(包括提高的可检出性)以促进对这些变量的理解并进一步降低不确定性程度。
5.3 管理并最大程度地降低主观性
主观性会影响质量风险管理过程的每个阶段,特别是危害源的识别,以及危害发生概率和严重程度的估计。还会影响风险降低的估计和质量风险管理活动决策的有效性。
质量风险管理中主观性来自于不同利益相关方对如何对风险进行评估,以及对危害源、危害和风险的认知的差异(例如,偏见)。主观性还会来自没有充分地定义风险问题以及使用有设计缺陷的风险评分量表的工具。
虽然不能从质量风险管理活动中完全消除主观性,但可以通过降低偏见和假设、正确使用质量风险管理工具和最大限度地运用相关数据和知识来源(见 ICH Q10,1.6.1 部分),以控制主观性。
所有参与质量风险管理活动的人员应认识到、预见并处理主观性发生的可能性。
6. 质量风险管理在制药行业和监管机构的应用
质量风险管理融入质量体系时,它是一个支持基于科学、切实可行决策的过程(见附录Ⅱ)。如前言所述,合理使用质量风险管理不能免除制药行业遵守法规要求的义务。然而,有效的质量风险管理可以促进更全面和更有依据的决策,对于企业处理潜在风险的能力,给予监管机构更多的信心并可能影响到其监管的范围和程度,同时质量风险管理可以促进各方更好地利用资源。
对制药行业和监管机构人员进行质量风险管理的培训有利于他们加深对决策过程的理解,建立对质量风险管理结果的信心。
质量风险管理应当整合到现有操作中并恰当记录。
附录Ⅱ提供了一些适用于制药行业质量风险管理的示例。这些示例仅供参考,并非最佳或详尽的列举,也没有提出超越现行法规的要求。
质量风险管理在制药行业和药品监管机构的应用示例(见附录Ⅱ):
- 质量管理。
质量风险管理在制药行业运行中的应用示例(见附录Ⅱ):
- 研发;
- 厂房、设备和设施;
- 物料管理;
- 生产;
- 实验室控制和稳定性试验;
- 包装和贴签。
- 供应链控制
质量风险管理在药品监管中的应用示例(见附录Ⅱ):
- 检查与评估工作。
尽管监管决策仍将在各自监管区域内进行,对质量风险管理原则的共同理解和应用仍有助于增进药品监管机构之间的互信,并促进基于相同信息做出更加一致的决定。这种合作对于制订用于整合并支持质量风险管理实践的政策与指南具有重要意义。
6.1 质量风险管理在应对因质量/生产问题引起产品可及性风险中的作用
质量/生产问题,包括不符合药品生产质量管理规范(GMP),是产品可及性问题(例如药品短缺)的主要原因。基于风险的药品短缺预防和减缓活动能够帮助积极主动地管理供应链复杂状况并确保所需药品可及性,以服务于患者的利益。
虽然生产和供应链多样性可以为产品可及性赋能,但是越来越复杂的供应链所造成的相互依从关系也会导致系统的质量/生产风险,影响供应链稳健性。应用质量风险管理可以积极主动地识别并实施预防措施来促进产品的可及性。
有效的药品质量体系既可以促进供应链稳健性又可以促进 GMP 持续合规。制药质量体系,包括管理层职责,也会利用质量风险管理和知识管理提供早期预警系统,以支持对制药公司或其外部合作伙伴不断发展变化的质量/生产风险进行有效的监督和响应。在开展基于风险的药品短缺预防和缓解活动时,其正式程度可有所不同(见第 5.1 节)并应与失去产品可及性的相关风险级别相适应。
能够影响供应可靠性,进而影响产品可及性的质量/生产因素包括,但不仅限于:
- a)生产工艺变异性和受控状态:
- 变异性(例如工艺漂移、非均一)过高的工艺存在能力缺陷,这种缺陷可导致不可预测的结果(例如质量、时限性和收率),并可能会给产品可及性带来不良影响。质量风险管理可帮助设计出能够检测到受控状态偏离和生产工艺缺陷的监测系统,这样就可以对其进行调查,来明确其根本原因。
- b)生产厂房设施和设备:
- 稳固可靠的厂房基础设施能够促进可靠的供应,包括为生产(包括包装和测试)所选择适宜的设备和设计良好的厂房设施。可靠性可受多种因素的影响,包括厂房老化、维护不充分或易导致人员差错的操作设计。可通过解决这些因素,及采用如数字化、自动化、隔离技术等现代技术来降低供应风险。
- c)外包活动及供应商监督:
- 质量体系管理包括在产品生命周期中确保供应链合作伙伴的可接受性。通过风险评估、有效的知识管理和有效的供应链合作伙伴绩效监控策略,对外包活动和物料供应商进行审批和监督。适宜的沟通和合作机制可以加强成功的生产合作伙伴关系。如发现所供应物料或所提供服务的质量和安全方面存在重大的变化时,则需要加强审核和监测工作(见 ICH Q10 第 2.7 部分)。在某些情况下,可能需要寻找新的供应链实体(例如经过资质确认的备选选项)来完成某项职能。
- 应注意在监管活动中应用质量风险管理时,可考虑采用附录 II.2 中的指南,有助于考虑产品可及性风险。
7. 术语
决策者:具有能力和职权做出适当和及时的质量风险管理决策的人员。
可检出性:发现或确定危害源存在、出现或作为事实(fact)的能力。
危害:对健康的损害,包括因产品质量或可及性的缺失而可能造成的损害。
危害源:潜在的危害来源(ISO/IEC 指南 51:2014)。
危害源识别:系统地运用信息识别涉及风险疑问或问题描述的潜在危害来源(危害源)。
产品生命周期:从最初的研发到上市,直到产品退市整个产品生命的所有阶段。
质量:产品、系统或工艺的一组固有特性满足要求的程度(见 ICH Q6A 原料药和制剂(药品)中关于“质量”的具体定义。)
质量风险管理:在整个产品生命周期中评估、控制、沟通和回顾药品质量风险的系统化流程。
质量体系:系统实施质量方针并确保实现质量目标的所有方面的总和。
要求:患者或其代理人(如医务人员、监管者和立法者)的明示或隐含需要或期望。在本文件中,”要求”不仅指法律、法规或监管要求,还指此类需要和期望。
风险:危害发生的可能性及其严重性的组合。(ISO/EC 指南 51:2014)。
风险接受:接受某一具体风险的有依据决策(ISO 指南 73:2009)。
风险分析:对已识别的危害源相关风险的估计。
风险评估:组织信息以支持风险管理过程中风险决策的系统化流程。其包含对危害源识别,以及分析和评价接触这些危害源的相关风险。
基于风险的决策:一种考虑了与决策相关风险的知识及风险是否在可接受水平的决策方法或流程。
风险沟通:决策者和其他风险利益相关方之间分享有关风险和风险管理的信息。
风险控制:实施风险管理决策的行动(ISO 指南 73:2009)。
风险评价:用定性或定量尺度对已估计风险与既定风险标准进行比较,以确定风险重要程度。
风险管理:将质量管理方针、程序和实践系统地应用于风险评估、控制、沟通和回顾工作。
风险降低:为降低危害发生的可能性及其严重性所采取的措施。
风险回顾:运用有关风险的新知识和新经验(如适用),对风险管理过程的输出/结果所进行的回顾或监测。
严重性:对于某个危害源可能后果的度量。
利益相关方:影响、受影响或认为自己会受风险影响的任何个人、团体或组织。决策者也可能是利益相关方。就本文件而言,主要利益相关方是患者、医务人员、监管机构和制药行业。
趋势:指变量的变化方向或变化率的统计学术语。
8. 参考文献
1) ICH Q8 Pharmaceutical Development.
2) ICH Q10 Pharmaceutical Quality System
3) ICH Q11 Development and Manufacture of Drug Substances (Chemical Entities and Biotechnological/Biological Entities).
4) ICH Q12 Technical and Regulatory Consideration for Pharmaceutical Product Lifecycle Management.
5) ISO/IEC Guide73: 2009-Risk Management-Vocabulary-Guidelines for use in Standards.
6) ISO/IEC Guide51:2014-Safety Aspects-Guideline for their inclusion in standards.
7) IEC61025-Fault Tree Analysis (FTA).
8) IEC60812:2018 Failure modes and effects analysis(FMEA and FMECA).
9) IEC 61882:2016 – Hazard and operability studies (NAZOP studies) – Application guide.
10) ISO14971:2019- Medical devices – Application of risk management to medical devices.
11) ISO7870-1:2019-Control Charts, General guidelines.
12) ISO7870-4:2021-Cumulative Sum Charts.
13) ISO7870-3:2020-Acceptance Control Charts.
14) ISO7870-2:2013-Shewhart Control Charts.
15) WHO Technical Report Series No 908, 2003, Annex 7 Application of Hazard Analysis and Critical Control Point (HACCP) methodology to pharmaceuticals.
16) What is Total Quality Control?; The Japanese Way, Kaoru Ishikawa (Translated by David J. Liu), 1985, ISBN 0139524339.
17) Failure Mode and Effect Analysis, FMEA from Theory to Execution, 2nd Edition 2003,D. H. Stamatis, ISBN 0873895983.
18) Process Mapping by the American Productivity & Quality Center, 2002, ISBN 1928593739.
19) Parenteral Drug Association. Technical Report No. 54 Implementation of quality risk management for pharmaceutical and biotechnology manufacturing operations. 2012.
20) Parenteral Drug Association. Points to consider for aging facilities. 2017.
21) Parenteral Drug Association. Technical Report No. 68. Risk-based approach for prevention and management of drug shortages. 2014.
22) International Society for Pharmaceutical Engineering. Report on the ISPE Drug shortages survey. 2013.
23) International Society for Pharmaceutical Engineering. Drug shortages prevention plan. 2014.
24) Tabersky D, Woelfle M, Ruess J, Brem S, Brombacher S. Recent regulatory trends in pharmaceutical manufacturing and their impact on the industry. CHIMIA, 2018;72(3):146-150.
25) O’Donnell K, Tobin D, Butler S, Haddad G, Kelleher D. Understanding the concept of formality in quality risk management. J. Valid. Technol, 2020 Jun; 26(3).
附录Ⅰ: 质量风险管理方法与工具
本附录的目的是为制药行业和监管机构提供一些质量风险管理基本工具的概述和参考。这些参考有助于获得某一特定工具的更多知识和细节。本附录给出了部分方法和工具列表。需要说明的是,没有一个或一套工具可以适用于质量风险管理流程的每一种情况。
总是使用高度正式的质量风险管理方法和工具既不适宜也不必要。使用不那么正式的质量风险管理方法和工具也是可以的。有关质量风险管理的指南请见第5.1节。
1 风险管理的基本方法
一些简单技术方法通常是通过组织数据和促进决策来进行质量风险管理,包括:
- 流程图;
- 检查表;
- 过程流程图;
- 因果图(也称为石川图或鱼骨图)。
2 失效模式与影响分析(FMEA)
FMEA(参见IEC60812)用于评价过程潜在失效模式及其对结果和/或产品性能可能的影响。一旦建立了失效模式,就可以采用风险降低措施来消除、限制、降低或控制潜在的失效。FMEA依赖于对产品与过程的理解。FMEA有条理地将复杂流程的分析分解为可操作的一些步骤。在汇总重要的失效模式、引起这些失效的因素以及这些失效带来的可能影响方面,FMEA是一个强有力的工具。
潜在应用领域
FMEA可以用于确定风险的优先级并且监测风险控制活动的有效性。
FMEA可以用于设备与设施,也可用于分析一个生产操作及其对产品和工艺的影响。FMEA可识别出使系统容易出现问题的要素/操作。FMEA的输出/结果可以作为设计或进一步分析或指导资源配置的基础。
3 失效模式、影响与关键性分析(FMECA)
FMEA可以延伸到包括失效模式后果的严重程度,各自发生的可能性以及其可检出性的调查,从而成为失效模式、影响与关键性分析(FMECA,参见IEC60812)。为了进行该分析,应当建立产品或工艺标准。FMECA可以识别出何处需要采取额外预防措施从而使风险最小化。
潜在应用领域
FMECA 在制药行业里主要用于与生产工艺相关的失效以及风险。然而,它不局限于这方面的应用。FMECA 的输出是为每个失效模式给出一个相对风险“分值”,在相对风险的基础上,通过此分值对这些失效模式进行排序。
4 故障树分析(FTA)
FTA工具(参见IEC61025)是假设某一产品或过程的性能失效进行分析的方法。该工具逐一评价系统(或子系统)的失效,也可通过识别因果链,合并考虑引起失效的多种原因。
其结果是用树状图将故障模式展现出来。在该树状图的每一层级,是以逻辑算符(“与”、“或”等)对故障模式的组合进行描述的。FTA依赖于专家对过程的理解以识别起因。
潜在应用领域
FTA 可以被用来建立失效的根本原因的路径。可以用 FTA 来调查投诉或偏差以便全面地了解失效的根本原因,并确保预期改进会完全解决该问题,且不会引发其他问题(即,不能解决了一个问题但引起了另一个问题)。故障树分析是一个有效的工具,用于评价多个因素如何影响一个给定问题。FTA 输出结果包括对失效模式的可视化表述。它对于风险评估以及制定监测程序都非常有用。
5 危害源分析及关键控制点(HACCP)
危害源分析和关键控制点是确保产品质量、可靠性及安全性的一种系统的、主动的和预防的工具(参见WHO Technical Report Series No 908,2003 Annex7)。它是一种结构化的方法,通过采用技术和科学的原则来分析、评价、预防和控制由于产品的设计、开发、生产和使用所带来的危害源的风险或其不利后果。
HACCP由下列七个步骤组成:
- (1)对过程每一个步骤的危害源进行分析并确定预防措施;
- (2)确定关键控制点;
- (3)建立关键限度;
- (4)建立监测关键控制点的系统;
- (5)建立当监测显示关键控制点处于非受控状态时应当采取的纠正措施;
- (6)建立能够确证HACCP系统有效运行的系统;
- (7)建立文件记录系统。
潜在应用领域
HACCP 可用于有关物理、化学和生物危害源(包括微生物污染)的风险识别及管理。当对产品和工艺的理解足以支持识别关键控制点时,HACCP 最为有用。HACCP 分析的结果作为风险管理信息,不仅可促进生产过程中关键点监测,也可促进生命周期中其他阶段的关键点监测。
6 危害源与可操作性分析(HAZOP)
HAZOP(参见IEC61882)基于一种理论,这种理论假定许多风险事件都是由于偏离了设计意图或正确操作所造成的。它是采用所谓的“引导词”来识别危害源的系统性头脑风暴技术。将“引导词”(如不做、超过、其他方式、部分执行等)用于相关参数(如污染、温度)来帮助识别与正常使用或设计意图之间的潜在偏差。它通常需要一组包括了解工艺或产品设计及其应用等专门技术的人员。
潜在应用领域
HAZOP 可以应用于原料药和制剂 (药品)的生产过程,包括委托生产、供应商、设备和设施。在制药行业,它还主要用于评价工艺安全性危害源。与 HACCP 类似,HAZOP 分析的结果列出了风险管理的关键操作,有助于生产过程中关键点的定期监测。
7 初步危害源分析(PHA)
PHA是一种分析工具,运用之前对某个危害源及失效所获得的经验或知识,来识别潜在的危害源、危害状态和可能引起损害的事件,并估计其在某个特定的活动、厂房设施、产品或系统中发生的概率。该工具包含:1)确定风险事件发生的可能性,2)对于可能导致的损伤或健康损害程度的定性评价,3)用严重性和发生可能性的组合对危害源进行排序,4)确定可能的补救措施。
潜在应用领域
在条件不允许采用其他工具时,PHA 有助于对已有系统进行分析或确定危害源的优先级。它可应用于产品、工艺与设施设计,还可应用于评价从产品的基本类型,到产品类别,最终到某一具体产品的危害源类型。PHA 常用于缺乏详细设计或操作规程方面信息的项目研发初期,并经常作为进一步研究的铺垫。对 PHA 所确定的危害源,通常会使用本章节中其它的风险管理工具进一步评估。
8 风险排序及筛选
风险排序及筛选是一个用于对风险进行比较和排序的工具。复杂系统的风险排序通常要求评价每个风险的多重多样的定量和定性因素。该工具通常将一个基本的风险问题根据需要分解成尽可能多的组成部分,用于获取风险所涉及的因素。将这些因素整合到一起得到一个相对的分值,该分值可用于风险排序。“筛选工具”可对该分值采用加权因子或限值的形式,使得风险排序与管理或方针目标相适应。
潜在的应用领域
监管机构或制药行业可采用风险排序及筛选来确定生产场地检查或审计的优先级别。当要处理的风险组成及其潜在后果具有多样性并难以用单个工具进行比较时,风险排序的方法尤其有效。当管理层需要在相同的组织框架内部对风险进行定性和定量地评估时,风险排序将非常有用。
9 支持性统计学工具
统计学工具可支持和促进质量风险的管理,使有效的数据评估成为可能,有助于确定数据的显著性,促进更可靠的决策。下面列出了在制药行业常用的一些基本的统计学工具:
- 控制图,例如:
- 验收控制图(参见ISO 7870-3:2020);
- 累积和图(参见ISO7870-4:2021);
- 休哈特控制图(参见ISO7870-2:2013);
- 加权移动平均控制图。
- 实验设计(DOE);
- 直方图;
- 帕累托图;
- 过程能力分析。
附录Ⅱ: 质量风险管理的潜在应用
本附录旨在使制药行业和监管机构确定质量风险管理的原则与工具的潜在应用。对于特定风险管理工具的选择完全取决于具体的事实与情况。
本附录所举示例仅作为解释说明,仅是质量风险管理潜在应用的建议。本附录并未提出超越现行法规的要求。
1 整体质量管理中的质量风险管理
文件
对现行监管期望的解读及应用的回顾;
确定SOP、指南等的必要性及其内容的撰写。
培训及教育
根据员工的教育、经验及工作习惯,以及对其之前培训的定期评估(如有效性),来确定初始以及持续培训课程是否适合;
确认人员的培训、经验、资质以及体能确实能够胜任某项操作,且不会对产品质量带来负面影响。
质量缺陷
为识别、评价和沟通某一疑似质量缺陷、投诉、趋势、偏差、调查、OOS结果等的潜在质量影响提供依据;
与监管机构一起,在处理重大产品缺陷时,促进风险沟通并确定适当的措施(如召回)。
审计/检查
确定内外部审计的频率和范围时,考虑如下因素:
- 现行法律要求;
- 公司或工厂整体的合规状态及历史;
- 公司质量风险管理活动的稳健性;
- 场地的复杂性;
- 生产工艺的复杂性;
- 产品的复杂性及其临床治疗意义;
- 质量缺陷(如召回)的数量及重要性;
- 以往的审计/检查结果;
- 建筑物、设备、工艺、关键人员的重大变更;
- 产品的生产经验(如频率、产量、批次);
- 官方药品检验机构的检测结果。
定期回顾
在产品质量回顾中选择、评价和解读数据趋势结果;
解读监测数据(如:为再验证或取样变更的适宜性评估提供支持)。
变更管理/变更控制
基于药品研发和生产过程中所积累的知识与信息来管理变更;
评价变更对产品可及性的影响;
评价厂房、设备、物料、生产工艺或技术转移的变更对产品质量的影响;
确定在变更实施之前要采取的适当措施,如额外的测试、确认或再确认、验证或再验证、或与监管机构的沟通。
持续改进
促进整个产品生命周期中过程的持续改进。
2 监管活动中的质量风险管理检查与评估活动
有助于资源分配,例如检查的计划和频率,以及检查和评估的深度(见附录Ⅱ.1 中的“审计”部分);
评价如质量缺陷、潜在的召回及检查发现项等的重要性;
确定检查后跟踪监管措施的类型和适宜性;
评价企业递交的包括药品研发在内的信息;
评价提交的变化或变更带来的影响;
识别检查员和审评员之间需要进行沟通的风险,以更好地理解应如何控制风险及实际风险是如何控制的(例如:参数放行、过程分析技术(PAT))。
3 药品研发中的质量风险管理
设计一个高质量的产品,以及能持续生产出符合其预期质量水平的产品的生产工艺。(参见ICH Q8)
增加在较宽范围内的物料属性(如粒度分布、水分含量、流动性)、工艺可选项及工艺参数方面的产品性能知识;
评估原材料、溶剂、原料药的起始物料、原料药、辅料或包装材料的关键属性;
建立适当的质量标准,确定关键工艺参数,以及建立生产控制(如:利用从药品开发研究中有关临床意义的质量属性以及在生产工艺中对这些质量属性控制能力的信息);
减少质量属性的变异性:
- 减少产品及物料的缺陷;
- 减少生产缺陷。
评估是否需要进行工艺放大和技术转移相关的额外研究(如生物等效性,稳定性);
使用“设计空间”的概念(参见 ICH Q8)。
4 厂房设施、设备和公用系统中的质量风险管理
厂房设施和设备的设计
在设计建筑和厂房时,确定合适的区域划分,例如,
- 人流和物流;
- 污染最小化;
- 虫害控制措施;
- 防止混淆;
- 开放式设备相对于密闭式设备;
- 洁净室相对于隔离器技术;
- 专用的或区隔的厂房设施、设备
确定设备和容器与产品接触部位的适当材质(如不锈钢级别、垫圈、润滑剂的选择);确定适当的公用系统(如蒸汽、气体、电源、压缩空气、水和空调系统);
确定相关设备适当的预防性维护(如:必要的备件库存)。
厂房设施的卫生状况
保护产品免受环境危害源的影响,包括化学、微生物和物理的危害源(如确定适当的工作服和更衣,卫生);
保护环境免受在产产品的相关危害源(如人员,潜在的交叉污染)的影响。
厂房设施、设备和公用系统的确认
确定厂房设施、建筑物、生产设备和实验室仪器确认的范围和程度(包括适当的校准方法)。
设备清洁及环境控制
根据预期用途(如多用途与单一用途、批次生产与连续生产)区分所需的投入及决策;
确定清洁验证可接受(规定)限度。
校准和预防性维护
设定适当的校准和维护计划。
计算机系统及计算机控制的设备
选择计算机硬件和软件的设计(如模块化,结构化,容错系统);
确定验证的程度,例如
- 关键性能参数的识别;
- 要求与设计的选择;
- 源代码的审核;
- 测试程度和测试方法;
- 电子记录及电子签名的可靠性。
5 物料管理中的质量风险管理
对供应商和受托方进行评估和评价
对供应商和受托方进行全面的评价(如审计,供应商质量协议)。
起始物料
评估由起始物料的变化(如年限、合成路线)引发的差异以及可能的质量风险。
物料使用
确定是否可以使用待验物料(如进入后续的内部工序);
确定返工、重新加工以及使用退货的适宜性。
储存、物流以及发运条件
评估用来确保维持适当的储存和运输条件(如温度、湿度和容器设计)的措施是否充分;
结合其它ICH指南,确定偏离储存或运输条件(如冷链管理)对产品质量的影响;
维护基础设施(如,确保适当运输条件、临时储存、危险品和管制物料的处理、清关的能力);
提供确保药品可及性信息(如对供应链风险进行排序)。
6 药品生产中的质量风险管理
验证
确定确证、确认以及验证活动的范围和程度(如分析方法、工艺、设备和清洁方法);
确定后续跟进活动的程度(如取样、监测以及再验证);
区分关键和非关键的工艺步骤,以助于验证研究的设计。
中控取样和检测
评价中控检测的频率和程度(如在证实有效控制的条件下,评估减少测试的合理性);
评价并证明结合参数放行和实时放行中使用过程分析技术(PAT)的合理性。
生产计划
确定适当的生产计划(如,专用的、阶段性的和同步的生产工艺顺序)。
7 实验室控制和稳定性研究中的质量风险管理
检验结果超标(OOS)
在超标结果调查期间,识别潜在的根本原因并制定纠正措施。
复验期/有效期
评价中间体、辅料和起始物料的储存及检测是否充分。
8 包装和贴签中的质量风险管理
包装设计
设计外包装以保护内包完成的产品(如确保产品的真实性,标签可读)。
容器密封系统的选择
确定容器密封系统的关键参数。
标签控制
基于不同产品标签及同一标签的不同版本间潜在的混淆风险,设计标签控制程序。
9 供应链控制中的质量风险管理
关于质量/生产问题相关的产品可及性风险,在供应链的产品生命周期监督中包括维持对质量/生产危害源当前知识的了解,以及确定管理此类风险的工作优先级。了解质量/生产的危害源对维持供应预测性是非常关键的。在充分理解并控制了风险之后,可对保持产品可及性更具信心。
生产工艺变化和受控状态
减少生产工艺的变化性(例如工艺漂移、非均一)和相关的能力差距,这些可能导致不可预测的结果,对质量产生不利影响,从而影响产品及时性、产量和可及性;
设计出能够检测控制状态偏离和生产工艺缺陷的监控系统,以便对这些变化进行适当调查,以确定根本原因和任何所需的风险降低措施。
生产厂房设施和设备
确保厂房的基础设施和设备对稳健的生产(包括包装和测试)而言是适宜且经过良好设计的(见附录II.4);
建立设备和厂房设施维护程序确保设备和厂房设施可靠;
确保设备的操作设计不易导致人员差错;
通过数字化、自动化、隔离技术及其它创新技术等投入来提高质量和效率。
供应商监督和关系
当发现在所供应物料或所提供服务的质量和安全方面存在重大变化时,应加强审核和监控工作(见 ICH Q10 第 2.7 部分)。
管理与质量/生产相关的外部的产品可及性风险(例如原材料供应商、外包组织、服务提供商等)。
Hits: 47
