Contents
- 1 Prevention of Measles, Rubella, Congenital Rubella Syndrome, and Mumps, 2013: Summary Recommendations of the Advisory Committee on Immunization Practices (ACIP)
- 1.0.0.1 摘要
- 1.0.0.2 介绍
- 1.0.0.3 方法
- 1.0.0.4 麻疹的背景和流行病学
- 1.0.0.5 风疹和先天性风疹综合征的背景和流行病学
- 1.0.0.6 流行性腮腺炎的背景和流行病学
- 1.0.0.7 预防麻疹、风疹和腮腺炎的疫苗
- 1.0.0.7.1 麻疹成分
- 1.0.0.7.2 麻疹疫苗的免疫反应
- 1.0.0.7.3 麻疹疫苗效力
- 1.0.0.7.4 接种疫苗后麻疹免疫的持续时间
- 1.0.0.7.5 风疹成分
- 1.0.0.7.6 风疹疫苗的免疫反应
- 1.0.0.7.7 风疹疫苗效力
- 1.0.0.7.8 接种疫苗后风疹免疫的持续时间
- 1.0.0.7.9 腮腺炎成分
- 1.0.0.7.10 流行性腮腺炎疫苗的免疫反应
- 1.0.0.7.11 腮腺炎疫苗效力
- 1.0.0.7.12 接种疫苗后腮腺炎免疫的持续时间
- 1.0.0.7.13 MMR疫苗作为麻疹暴露后预防的效果
- 1.0.0.7.14 使用第三剂MMR疫苗控制流行性腮腺炎爆发
- 1.0.0.7.15 HIV感染者对MMR疫苗的免疫应答
- 1.0.0.8 疫苗剂量、接种和储存
- 1.0.0.9 禁忌症和注意事项
- 1.0.0.10 禁忌症
- 1.0.0.11 预防措施
- 1.0.0.12 MMR和MMRV疫苗的安全性
- 1.0.0.13 预防麻疹的免疫球蛋白
- 1.0.0.14 豁免权的证据
- 1.0.0.15 麻疹、风疹和腮腺炎疫苗接种的基本原理
- 1.0.0.16 麻疹、风疹和腮腺炎疫苗接种建议
- 1.0.0.17 麻疹、风疹或腮腺炎爆发期间的建议
- 1.0.0.18 未来方向
Prevention of Measles, Rubella, Congenital Rubella Syndrome, and Mumps, 2013: Summary Recommendations of the Advisory Committee on Immunization Practices (ACIP)
洪·q·麦克林博士1
艾米·帕克·菲贝尔科恩2
医学博士乔纳森·特姆特3
医学博士格雷戈里·华莱士2
1威斯康星州马什菲尔德马什菲尔德临床研究基金会
2美国疾病预防控制中心国家免疫和呼吸系统疾病中心病毒疾病部
3威斯康星大学麦迪逊分校医学和公共卫生学院
对应编制人:Amy Parker Fiebelkorn,MSN,美国疾病预防控制中心国家免疫和呼吸系统疾病中心病毒疾病部。电话:404-639-8235;电子邮件:aparker@cdc.gov.
摘要
这份报告是目前预防麻疹、风疹、先天性风疹综合征(CRS)和流行性腮腺炎的所有建议的概要。该报告介绍了免疫实践咨询委员会(ACIP)于2012年10月24日通过的最新修订版,并总结了1998年至2011年期间已发布的所有现有ACIP建议(CDC.麻疹、流行性腮腺炎和风疹——消除麻疹、风疹和先天性风疹综合征和控制流行性腮腺炎的疫苗使用和策略:免疫实践咨询委员会的建议[ACIP]。MMWR 1998年;47[编号RR-8];疾病控制中心。接受含风疹疫苗后避免怀孕的修订ACIP建议。MMWR 2001年;50:1117;疾病控制中心。免疫实践咨询委员会[ACIP]关于控制和消除流行性腮腺炎的最新建议。MMWR 2006年;55:629–30;还有疾控中心。保健人员的免疫接种:免疫接种实践咨询委员会的建议(ACIP)。MMWR 2011;60[编号RR-7])。目前,ACIP建议儿童常规接种两剂MMR疫苗,第一剂在12至15个月时接种,第二剂在入学前4至6岁时接种。建议暴露和传播风险高的成人(例如,上大学或其他高中后教育机构的学生、卫生保健人员和国际旅行者)接种两剂,年龄≥18岁的其他成人接种一剂。为预防风疹,建议年龄≥12个月的人接种1剂MMR疫苗。
在2012年10月24日的会议上,ACIP通过了以下首次在此发布的修订内容。其中包括:
- 对于可接受的免疫证据,删除医生诊断疾病的文件作为麻疹和腮腺炎免疫证据的可接受标准,并将疾病的实验室确认作为麻疹、风疹和腮腺炎免疫证据的可接受标准。
- 对于人类免疫缺陷病毒(HIV)感染者,将疫苗接种建议扩大到所有年龄≥12个月的HIV感染者,这些人目前没有严重免疫抑制的证据;一旦确立有效的抗逆转录病毒疗法,建议在确立有效的抗逆转录病毒疗法之前接种疫苗的围产期艾滋病毒感染者重新接种2剂间隔适当的MMR疫苗;以及将针对HIV感染者的2剂MMR疫苗的推荐时间改为12至15个月和4至6岁。
- 对于麻疹暴露后预防,扩大肌肉注射免疫球蛋白的使用建议(IGIM ),以包括暴露于麻疹的出生至6个月的婴儿;增加免疫活性人群的IGIM推荐剂量;并建议对免疫功能严重受损的人和没有麻疹免疫证据但暴露于麻疹的孕妇使用静脉注射免疫球蛋白(IGIV)。
作为预防麻疹、风疹、先天性风疹综合征(CRS)和流行性腮腺炎的所有当前建议的概要,本报告中的信息旨在供临床医生用作针对这些情况安排疫苗接种的基线指导,以及关于特殊人群疫苗接种的考虑。对ACIP建议进行定期审查,并在获得新信息时进行修订。
介绍
麻疹、风疹和腮腺炎是急性病毒性疾病,可导致严重疾病和并发症,但可以通过接种疫苗来预防。20世纪60年代和70年代,美国批准并推荐使用预防麻疹、风疹和腮腺炎的疫苗。由于成功的疫苗接种计划,麻疹、风疹、先天性风疹综合征(CRS)和腮腺炎现在在美国并不常见。然而,最近爆发的麻疹(1)和腮腺炎(2,3)发生在与进口相关的病例中,因为这些疾病在许多其他国家很常见。未接种疫苗的人将自己和他人置于这些疾病和相关并发症的风险之中。
两种减毒活疫苗在美国获得许可并可用于预防麻疹、流行性腮腺炎和风疹:MMR疫苗(麻疹、流行性腮腺炎和风疹[M-M-R II,默克公司]),通常适用于年龄≥12个月的人和年龄≥6个月的婴儿进行国际旅行MMRV疫苗(麻疹、流行性腮腺炎、风疹和水痘[ProQuad,默克公司])获得许可,适用于12个月至12岁的儿童。就本报告而言,MMR疫苗将作为麻疹、腮腺炎和风疹疫苗接种的通称;然而,任何一种许可的疫苗制剂的适龄使用都可以用于实施这些疫苗接种建议。
为预防麻疹、腮腺炎和风疹,建议年龄≥12个月的人接种疫苗。为了预防麻疹和腮腺炎,ACIP建议儿童常规接种两剂MMR疫苗,第一剂在12至15个月时接种,第二剂在入学前4至6岁时接种。建议暴露和传播风险高的成人(例如,上大学或其他高中后教育机构的学生、卫生保健人员和国际旅行者)接种两剂,年龄≥18岁的其他成人接种一剂。为预防风疹,建议年龄≥12个月的人接种1剂MMR疫苗。这份报告是目前预防麻疹、风疹、先天性风疹综合征(CRS)和流行性腮腺炎的所有建议的概要。该报告介绍了免疫实践咨询委员会(ACIP)于2012年10月24日通过的最新修订版,还总结了1998年至2011年期间已经发布的所有现有ACIP建议(4–6)。作为所有当前ACIP建议的概要,本报告中的信息旨在供临床医生使用,作为针对这些情况安排疫苗接种的指导,以及关于特殊人群疫苗接种的考虑。
方法
ACIP定期审查现有信息,为疫苗建议的制定或修订提供信息。2011年5月,ACIP麻疹、风疹和流行性腮腺炎工作组成立,以审查和修订先前公布的疫苗建议。从2011年5月至2012年10月,工作组每月举行电话会议。除了ACIP成员,工作组还包括来自美国家庭医师学会(AAFP)、美国儿科学会(AAP)、美国大学健康协会、免疫管理者协会、CDC、州和地区流行病学家委员会、食品药品监督管理局(FDA)、美国传染病学会、国家免疫咨询委员会(加拿大)、国家卫生研究所(NIH)和其他传染病专家(7)。*
工作组审查和考虑的问题包括美国麻疹、风疹、CRS和流行性腮腺炎的流行病学;在艾滋病毒感染者中使用MMR疫苗,特别是在有效的抗逆转录病毒疗法之前接种疫苗的围产期艾滋病毒感染者的再接种(ART);使用第三剂MMR疫苗控制流行性腮腺炎爆发;疫苗剂量的时间安排;使用免疫球蛋白(IG)进行麻疹暴露后预防;和疫苗安全。工作组制定并讨论了建议选项。当缺乏证据时,建议会纳入工作组成员的专家意见。向ACIP提交了拟议修订和声明草案(2011年10月ACIP会议;2012年2月和6月),并在2012年10月的ACIP会议上获得批准。ACIP会议纪要,包括ACIP成员利益冲突声明,如有,请访问http://www . CDC . gov/vaccines/acip/meetings/meetings-info . html.
麻疹的背景和流行病学
麻疹被归类为该属的一员麻疹病毒在家庭中副粘病毒科。麻疹是一种高度传染性的皮疹疾病,通过直接接触呼吸道飞沫或空气传播在人与人之间传播。接触后,高达90%的易感者会出现麻疹。从暴露于前驱症状开始,麻疹的平均潜伏期为10至12天,从暴露于皮疹开始为14天(范围:7-21天)。麻疹患者在出疹前4天至出疹后4天具有传染性。在美国,从1987年到2000年,最常报道的与麻疹感染相关的并发症是肺炎(6%)、中耳炎(7%)和腹泻(8%)(8)。在美国,每报告1,000例麻疹病例,就有大约1例脑炎病例和2-3例死亡(9–11)。婴儿、幼儿和成人死于麻疹或其并发症的风险大于较大的儿童和青少年。在营养不良常见的中低收入国家,麻疹通常更严重,病死率可高达25%(12)。此外,在免疫功能低下的人群中,尤其是那些患有白血病、淋巴瘤或HIV感染的人群中,麻疹可能会很严重并持续很长时间(13–15)。在这些人中,麻疹可以在没有典型皮疹的情况下发生,并且患者可以在急性疾病后数周内释放麻疹病毒(16–18)。然而,在一名明显具有免疫能力的人(19)。
孕妇也可能面临严重麻疹和并发症的高风险;然而,现有证据并不支持妊娠期麻疹与先天性缺陷之间的联系(20)。妊娠期麻疹疾病可能与自然流产、早产和早产率增加以及受影响婴儿的低出生体重有关(20–23)。
持续的麻疹病毒感染可导致亚急性硬化性全脑炎(SSPE),这是一种罕见且通常致命的神经退行性疾病。发展成SSPE的风险是每100,000例麻疹病例中有4-11例(24,25),但当麻疹发生在< 2岁的儿童中时,死亡率可能会更高(25,26)。SSPE的体征和症状平均在感染麻疹后7年出现,但也可能在几十年后出现(27)。麻疹疫苗的广泛使用导致SSPE在美国几乎消失,但输入性病例仍有发生(28)。可用的流行病学和病毒学数据表明,麻疹疫苗病毒不会导致SSPE(27)。已从报告接种疫苗且无自然感染史的SSPE患者中持续检测到野生型麻疹病毒核苷酸序列(24,29–34)。
前疫苗时代的麻疹流行病学
在1963年实施全国麻疹疫苗接种计划之前,麻疹呈周期性流行,几乎每个人在成年前都感染了麻疹(估计每年有300万至400万人感染麻疹)。在美国,每年报告约500,000人患有麻疹,其中500人死亡,48,000人住院,另外1,000人因麻疹脑炎而永久性脑损伤(28)。
疫苗时代的麻疹流行病学
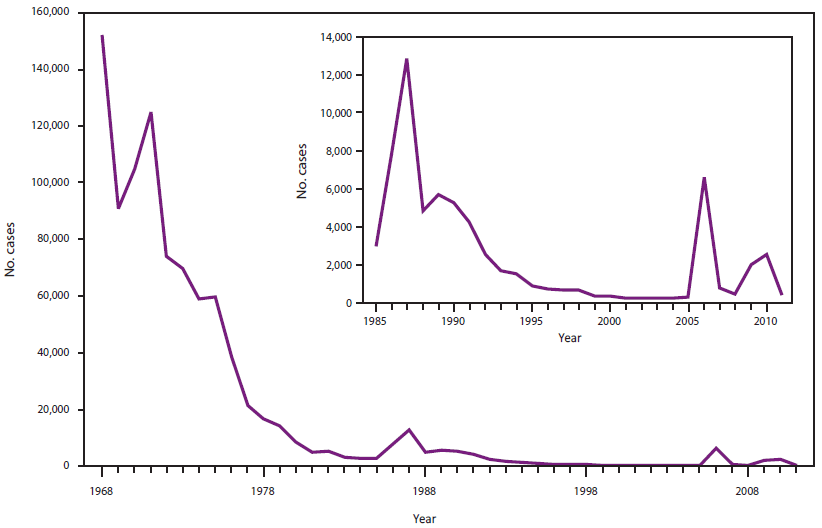
在引入1剂麻疹疫苗接种计划后,20世纪60年代末和70年代初报告的麻疹病例数下降至每年约22,000-75,000例(图1) (35,36)。尽管所有年龄组的麻疹发病率都大幅下降,但下降幅度最大的是10岁以下的儿童。在1984年至1988年期间,平均每年报告3750例(37)。然而,在接种过1剂麻疹疫苗的学龄儿童中爆发的麻疹促使ACIP在1989年建议所有儿童接种2剂含麻疹的疫苗,最好是MMR疫苗(38,39)。第二剂含麻疹成分的疫苗主要用于在接种第一剂疫苗后未血清转化的少数人群中诱导免疫(初次疫苗失败)。
从1989年到1991年,麻疹在美国再次大规模流行。据报告,约有55 000例病例和120例麻疹相关死亡。这种死灰复燃的特点是未接种疫苗的学龄前儿童,特别是居住在城市地区的学龄前儿童(40,41)。提高学龄前儿童疫苗接种覆盖率的努力强调在尽可能接近推荐年龄时接种疫苗。为了提高ACIP推荐疫苗的可获得性,1993年启动了儿童疫苗计划,这是一项联邦资助的计划,免费向19岁以下符合条件的人提供疫苗(42)。
这些努力,加上正在实施的2剂MMR疫苗建议,使1995年报告的麻疹病例减少到309例(43)。在1993年期间,流行病学和实验室证据都表明本土麻疹的传播在美国已经被阻断(44,45)。
随着对麻疹免疫知识的增加和麻疹流行病学在美国的发展,推荐的麻疹疫苗接种时间表发生了变化。1963年推荐接种年龄为9个月,1965年为12个月,1967年为15个月。1989年,由于报告接种疫苗的学龄儿童中爆发麻疹,ACIP和AAFP建议接种2剂;第一剂在15个月大时,第二剂在入学前的4至6岁时。相比之下,AAP建议在中学入学前注射第二剂疫苗,因为爆发发生在年龄较大的儿童中,并有助于加强青少年医生的访问和抵消可能的二次疫苗失败(46)。自1994年以来,ACIP、AAFP和AAP推荐的2剂MMR疫苗接种时间表的年龄是相同的;第一剂应给予12至15个月的儿童,第二剂应给予4至6岁的儿童(47)。
消除麻疹与后消除时代的流行病学
由于麻疹疫苗接种计划成功地在学龄前儿童中实现并维持了1剂MMR疫苗的高覆盖率,在学龄儿童中实现并维持了2剂MMR疫苗的高覆盖率,并且在世界卫生组织(WHO)的美洲地区改善了麻疹控制,2000年美国记录并证实消灭了麻疹(48)。消灭的定义是没有地方性传播(即持续≥12个月的连续传播中断)。2002年,宣布美洲世卫组织地区消灭了麻疹(49)。
根据2007年泛美卫生组织的要求,记录和验证美洲麻疹和风疹病毒地方性传播中断的工作正在进行中(http://www.paho.org/english/gov/csp/csp27.r2-e.pdf )。一个专家小组审查了现有数据,并于2011年12月一致同意,美国一直在消除麻疹(50,51)。然而,与从其他国家输入该病毒相关的麻疹病例仍在继续发生。从2001年到2011年,美国每年报告的麻疹病例中位数为63例(范围:37-220)和4起暴发,定义为在时间或地点上有联系的3起或3起以上病例(范围:2-17)。在这911例病例中,共有372例(41%)为输入性病例,804例(88%)与输入性病例相关,225例(25%)涉及住院治疗。据报道有两人死亡。在2004年至2008年报告的162例符合接种疫苗条件的未接种疫苗的美国居民中,共有110例(68%)已知发生在因哲学、宗教或个人反对而拒绝接种疫苗的人群中(52)。
风疹和先天性风疹综合征的背景和流行病学
风疹被归类为卢比病毒,属于披膜病毒科家庭。风疹是一种通过鼻咽分泌物的直接或飞沫接触传播的疾病,其特征是皮疹、低烧、淋巴结病和不适。症状通常是轻微的,高达50%的风疹感染是亚临床的(53,54)。然而,在感染风疹的成年人中,短暂性关节痛或关节炎经常发生,尤其是在女性中(55)。其他并发症很少发生;血小板减少性紫癜发生在大约每3,000个病例中有一个,并且更可能涉及儿童(56),并且大约每6000个病例中有一个发生脑炎,并且更可能涉及成年人(57,58)。
孕妇感染风疹,尤其是在妊娠早期,可导致流产、死产和CRS,CRS是一组出生缺陷,通常包括白内障、听力损失、智力迟钝和先天性心脏缺陷。此外,患有CRS的婴儿经常表现出宫内和出生后生长迟缓。中度或重度受CRS影响的婴儿在出生时很容易识别,但轻度CRS(如轻度心脏受累或耳聋)可能在出生后几个月或几年内检测不到或根本检测不到。先天性感染和缺陷的风险在妊娠的前12周最高(59–62),在怀孕12周后,任何缺陷的风险都会降低。当感染发生在第20周之后时,缺陷是罕见的(63)。亚临床母体风疹感染也可导致先天性畸形。无CRS临床症状的胎儿感染可发生在妊娠的任何阶段。
风疹再感染可在野生型风疹感染和接受1剂风疹疫苗后发生,并已有报告。妊娠期无症状的母体再感染被认为对胎儿的风险极小(先天性感染< 10%)(64),但已有几个关于胎儿感染和CRS的独立报告,这些婴儿的母亲在怀孕前有风疹免疫的血清学证据,并在妊娠前12周内再次感染(64–68)。妊娠12周后再次感染时未报告CRS(69–71)。
前疫苗时代风疹和CRS的流行病学
在1969年在美国许可接种减毒活风疹疫苗之前,风疹是常见的,并且每6至9年发生一次流行病(72)。大多数风疹病例发生在幼儿中,5至9岁的儿童发病率最高(73)。在1964年至1965年风疹流行期间,估计在美国发生了1250万风疹病例,导致大约2000例脑炎,11250例胎儿死亡可归因于自发或治疗性流产,2100名婴儿死产或出生后不久死亡,以及20000名婴儿出生时有CRS(74)。
疫苗时代风疹和CRS的流行病学
在美国于1969年引入风疹疫苗后,报告的风疹病例下降了78%,从1969年的57,686例降至1976年的12,491例,报告的CRS病例下降了69%,从1970年的68例降至1976年的23例(图2) (73)。所有年龄组的风疹发病率都有所下降,但15岁以下儿童的发病率下降幅度最大。尽管有所下降,但风疹疫情仍继续在年龄较大的青少年和年轻成年人以及未接种疫苗的成年人聚集的场所发生。1977年和1984年,ACIP修改了其建议,将易感青春期后女性、青少年、军人、大学生和某些工作环境中的人员(75,76)。报告的风疹病例从1977年的20,395例下降到1988年的225例,CRS病例从1977年的29例下降到1988年的2例(77)。
在1989年至1991年期间,风疹再次出现,主要是因为在未接种疫苗的青少年和年轻成人中爆发,他们最初不建议接种疫苗,以及在风疹疫苗接种覆盖率低的宗教社区(77)。由于风疹暴发,出现了两群约20例CRS病例(78,79)。20世纪90年代中期的疫情发生在年轻人聚集的场所,涉及属于特定种族/民族群体的未接种疫苗者(80)。随着美洲世卫组织地区其他国家风疹疫苗接种工作的加强,发病率进一步下降。从2001年到2004年,报告的风疹和CRS病例处于历史最低水平,平均每年报告14例风疹病例,4例CRS病例和1例风疹暴发(定义为3例或3例以上病例在时间或地点上相关联) (81)。
风疹和CRS的消除与后消除时代的流行病学
2004年,由CDC召集的一个专家组审查了现有数据,并核实了美国风疹的消除(82)。消除风疹的定义是没有地方性风疹传播(即持续传播≥12个月)。从2005年到2011年,美国每年报告的风疹病例中位数为11例(范围:4-18)。此外,还报告了两起风疹暴发,涉及3例病例,以及总共4例CRS病例。在2005年至2011年报告的67例风疹病例中,共有28例(42%)是已知的输入性病例(83;美国疾病预防控制中心,未公布的数据,2012年)。
2010年,根据监测数据,泛美卫生组织指出,美洲的世卫组织地区已经实现了2003年设定的消除风疹和CRS的目标(84)。正在对该地区维持消除风疹的工作进行核查。然而,一个专家小组审查了现有的数据,并于2011年12月一致同意,美国一直在消除风疹(50,51)。
流行性腮腺炎的背景和流行病学
腮腺炎病毒是该属的一员悬钩子病毒,属于副粘病毒科家庭。流行性腮腺炎是一种急性病毒感染,其特征是发烧和唾液腺发炎。腮腺炎是最常见的表现,平均在接触后16至18天发病(范围:12-25天)。在一些研究中,腮腺炎症状被描述为非特异性的或主要是呼吸性的;然而,这些报告基于每6个月或12个月一次的血清学结果,使得难以证明呼吸道症状是否由腮腺炎病毒感染引起,或者这些症状是否碰巧与腮腺炎感染同时发生(85,86)。在前疫苗时代进行的其他研究中,15%-27%的感染被描述为无症状(85,87,88)。在疫苗时代,很难估计无症状感染的数量,因为疫苗改变临床表现的方式尚不清楚,只有腮腺炎、其他唾液腺受累或腮腺炎相关并发症的临床病例才需要报告。在没有腮腺炎的情况下会发生严重的并发症(89,90)。从2009年到2010年爆发的结果表明,接种疫苗的患者的并发症低于未接种疫苗的患者(6);然而,在2006年爆发期间,疫苗接种状态与并发症没有显著关联(91)。腮腺炎患者在腮腺炎发作时传染性最强(92)。腮腺炎感染的并发症会因年龄和性别而异。
在疫苗流行前的时代,12%-66%感染腮腺炎的青春期后男性报告有睾丸炎(93,94),与美国2006年和2009年至2010年疫苗时代的疫情相比,在此期间,青春期后男性的睾丸炎发病率范围为3%–10%(91,95,96)。在60%-83%的腮腺炎性睾丸炎男性中,只有一个睾丸受到影响(87,90)。腮腺炎性睾丸炎,甚至是双侧睾丸炎引起的不育症很少发生(93)。
在青春期后女性中的疫苗接种前时期,约有5%的青春期后女性感染腮腺炎后报告有卵巢炎(97,98)。乳腺炎包含在病例报告中(99,100)而且在1956-1957年的爆发中被描述为影响31%的青春期后女性(87)。据报道,女性青春期前流行性腮腺炎与不孕症之间存在显著关联;有人认为卵巢炎可能导致卵泡成熟障碍(101)。在疫苗时代,青春期后的女性中,卵巢炎的发病率范围为≤1%(91,95,96)和乳房炎率的范围≤1%(91,95,96)。
在疫苗接种前的时代,在一个社区的342名流行性腮腺炎感染者中,有4%的人在2年期间报告了胰腺炎(85)并在病例报告中描述(102,103)。流行性腮腺炎也是前疫苗时代儿童听力损失的主要原因,可能是突发的、双侧的或永久性的听力损失(104–106)。在前疫苗时代,临床无菌性脑膜炎发生在0.02%-10%的流行性腮腺炎病例中,并且通常是轻度的(85,88,107–109)。然而,在极少数情况下,腮腺炎脑膜脑炎可导致永久性后遗症,包括严重的共济失调(110)。流行性腮腺炎脑炎的发病率为1/6000(0.02%)(107)到流行性腮腺炎病例的300分之一(0.3%)111)。在疫苗时代,胰腺炎、耳聋、脑膜炎和脑炎的报告率均小于1%(91,95,96)。
第一次世界大战期间,流行性腮腺炎的年均住院率为55.8‰,仅次于流行性感冒和淋病(112)。流行性腮腺炎是病毒性脑炎的主要原因,在1967年约占脑炎病例的36(111)。流行性腮腺炎导致的死亡极为罕见,主要是由流行性腮腺炎相关的脑炎(111)。在美国,从1966年到1971年,每10,000例报告的流行性腮腺炎病例中发生两例死亡(111)。在接种疫苗的人群中,腮腺炎的严重并发症并不常见,但在成人中比在儿童中更常见。在2006年或2009-2010年美国疫情中,没有报告与流行性腮腺炎相关的死亡(91,95,96)。
一些研究观察到,在妊娠早期患腮腺炎的孕妇中,自然流产或胎儿宫内死亡的比率增加;然而,没有证据表明腮腺炎会导致出生缺陷(87,113–116)。
流行性腮腺炎流行病学
在1967年引入疫苗之前,流行性腮腺炎是一种普遍的儿童疾病。大多数儿童在14岁时被感染,5至9岁的儿童发病率最高(117,118)。在军队中爆发是常见的,尤其是在动员时期(119,120)。
疫苗时代流行性腮腺炎的流行病学
自1967年引入流行性腮腺炎活疫苗和1977年建议常规接种疫苗后,报告的流行性腮腺炎病例稳步下降(图3) (121)。然而,从1986年到1987年,当一群非疫苗接种对象和因发病率下降而免于自然感染的人群进入高中和大学时,流行性腮腺炎重新出现,导致20,638例报告病例(122,123)。到2000年代初,平均每年报告的病例不到270例;比1968年报告的152,209例减少了约99%,季节性高峰不再存在(124)。在2006年,爆发了6584例病例,集中在美国中西部高度接种2剂疫苗的大学生中(91)。在1989年实施使用MMR疫苗的两剂麻疹疫苗接种政策后,儿童开始接受两剂腮腺炎疫苗(39)。尽管如此,ACIP在2006年规定,某些高危人群中的所有儿童和成人,包括高中后教育机构的学生、卫生保健人员和国际旅行者,都应接种两剂含腮腺炎疫苗(3)。从2009年到2010年,在美国东北部的一个宗教社区爆发了流行性腮腺炎,约有3500例,在美国领土关岛报告了505例。与2006年流行性腮腺炎爆发类似,大多数患者接种了2剂MMR疫苗,并暴露在密集聚集的环境中(88,94)。2011年,加利福尼亚州的一所大学校园报告了29例腮腺炎病例,其中22例(76%)发生在以前接种过推荐的2剂MMR疫苗(5)。
预防麻疹、风疹和腮腺炎的疫苗
两种组合疫苗已在美国获得许可并可用于预防麻疹、风疹和腮腺炎:三价MMR疫苗(麻疹-腮腺炎-风疹[M-M-R II,默克公司])和四价MMRV疫苗(麻疹-腮腺炎-风疹-水痘[ProQuad,默克公司])。MMR疫苗每种成分的效力和有效性描述如下。MMRV疫苗是在抗原成分的免疫原性不劣于MMR疫苗和水痘疫苗(125)。尚未进行评估MMRV疫苗临床疗效的正式研究;MMRV疫苗的效力是根据MMR疫苗和水痘疫苗的效力根据非劣免疫原性(126)。单价麻疹、风疹和腮腺炎疫苗及其他疫苗组合在美国已不再有售。
麻疹成分
目前在美国销售的混合疫苗中的麻疹成分于1968年获得许可,含有活的Enders-Edmonston(以前称为“Moraten”)疫苗株。Enders-Edmonston疫苗株是在鸡胚细胞培养中生长的先前疫苗株(Edmonston B)的进一步减毒制剂。”因为增加效力和减少不良反应、对疫苗含有Enders-Edmonston株疫苗代替以前的疫苗:活Edmonston疫苗(可在美国从1963年通过1967年),减毒活疫苗含有Edmonston B(可用在美国从1963年通过,1975年)、和Schwarz疫苗株(在美国从1965年通过1976年)。
麻疹疫苗的免疫反应
含麻疹的疫苗产生亚临床或轻度的非传染性感染,诱导体液和细胞免疫。在12个月大时接种单剂恩德斯-埃德蒙斯顿疫苗株(表1) (127–134)。几乎所有在年龄≥12个月时对第一剂MMR疫苗的麻疹成分没有反应的人都对第二剂疫苗有反应(135,136)。
早期麻疹疫苗接种的数据表明,与9或12个月龄接种的婴儿相比,6个月龄接种的婴儿对麻疹疫苗的体液免疫应答成熟可能存在年龄相关的延迟,与被动转移的母源抗体无关(137,138)。然而,当婴儿在6、9和12个月时接种麻疹疫苗时,细胞介导的免疫应答的标记物是等同的,不管被动抗体的存在(139)。
虽然单独对第一剂麻疹疫苗的细胞介导的免疫反应可能没有保护性,但它可能引发对第二剂的体液反应(140)。数据表明,早在6个月大时首次接种疫苗的儿童的再接种将导致疫苗诱导的免疫,尽管该反应可能与比9或12个月大时接种疫苗的儿童的滴度更低的抗体滴度有关(139)。
麻疹疫苗效力
在美洲世卫组织地区进行的研究中,在年龄≥12个月时接种一剂含麻疹的疫苗对预防麻疹的有效率约为94%(范围:39%-98%)141,142)。在接种过2剂含麻疹疫苗的人群中爆发麻疹并不常见。在美国进行的两项研究中,两剂含麻疹疫苗的有效性≥99%,在加拿大进行的三项研究中,有效性分别为67%、85%–≥94%和100%142–146)。加拿大研究中2剂疫苗有效性的范围可归因于极少数(即,在2剂疫苗有效性为67%的研究中,报告了1名接种2剂疫苗的麻疹患者和1名未接种疫苗的麻疹患者[145])。这一效力范围也可归因于接种疫苗时的年龄(即85%的疫苗效力代表12个月大的儿童接种疫苗,而≥94%的疫苗效力代表15个月大的儿童接种疫苗[146])。此外,两项研究发现,与1剂含麻疹疫苗(145,147)。澳大利亚和欧洲也报道了类似的疫苗有效性评估(表1) (141)。
接种疫苗后麻疹免疫的持续时间
血清学和流行病学证据均表明,含麻疹的疫苗在大多数人体内诱导了持久的免疫力(148)。大约95%的接种者在初次接种后11年和第二剂MMR(包含Enders-Edmonston毒株)疫苗后15年检测到麻疹抗体(149–152)。在一项研究中,25名4至6岁的适龄接种儿童在再次接种MMR疫苗前通过EIA检测同时具有低水平中和抗体和特异性IgG抗体,其中21名(84%)在再次接种后产生了记忆免疫应答;没有人产生IgM抗体,表明某种程度的免疫力持续存在(153)。
风疹成分
目前在美国销售的组合疫苗中的风疹成分于1979年获得许可,并含有活的Wistar RA 27/3疫苗株。该疫苗是在人二倍体细胞培养物中制备的,并取代了以前的疫苗(HPV-77和森德希尔),因为它诱导了更高和更持久的抗体应答,并且与更少的不良事件(154–158)。
风疹疫苗的免疫反应
风疹疫苗可诱导体液免疫和细胞免疫。大约95%的年龄≥12个月的易感者在接种单剂含RA 27/3株的风疹疫苗后出现了风疹免疫的血清学证据(表1) (127,154,157–164)。接种第二剂MMR疫苗后,约99%的人可检测到风疹抗体,约60%的人滴度增加了四倍(165–167)。
风疹疫苗效力
接种风疹RA 27/3疫苗株的人群中风疹暴发罕见。现有研究表明,含风疹RA 27/3毒株的疫苗在单剂量后预防临床疾病的有效性约为97%(范围:94%–100%)(表1) (168–170)。
接种疫苗后风疹免疫的持续时间
随访研究表明,1剂风疹疫苗可以提供持久的免疫力。大多数人在接种1剂含风疹的疫苗后长达16年仍可检测到风疹抗体,但抗体水平随时间而下降(165,171–174)。虽然疫苗诱导的风疹抗体水平可能会随着时间的推移而下降,但风疹和CRS监测数据表明,不会出现免疫力下降、对风疹疾病的易感性增加的情况。在接受两次剂量的人群中,大约91%–100%的人在接受第二次剂量后12至15年出现可检测的抗体(150,165)。
腮腺炎成分
在美国可获得的疫苗的腮腺炎成分包含减毒腮腺炎Jeryl-Lynn活疫苗株。它是使用来自患腮腺炎儿童的分离物开发的,并在含胚胎的鸡蛋和鸡胚细胞培养物中传代(175)。该疫苗产生亚临床、非传染性感染,副作用很少。
流行性腮腺炎疫苗的免疫反应
大约94%的婴儿和儿童在接种MMR疫苗后产生可检测的腮腺炎抗体(范围:89%–97%)(表1) (127,157,176–184)。然而,与自然感染相比,疫苗接种诱导的抗体水平相对较低(185,186)。在接受第二剂MMR疫苗的人中,大多数产生了二次免疫应答,大约50%的人抗体滴度增加了四倍,低滴度或检测不到滴度的比例从接种第二剂疫苗前的20%显著降低到接种后6个月的4%(187–189)。尽管抗体检测经常被用作免疫的替代性检测,但对于流行性腮腺炎,没有血清学检测能够持续可靠地预测免疫。对流行性腮腺炎疫苗接种的免疫反应可能包括体液和细胞免疫反应,但没有确定的保护相关性。
腮腺炎疫苗效力
在疫苗许可之前对大约7,000名儿童进行的临床研究发现,单剂腮腺炎疫苗在预防腮腺炎疾病方面大约有95%的有效性(186,190,191)。然而,在上市后研究中,疫苗有效性的估计值较低。在美国,在初中和高中环境中,腮腺炎疫苗的有效性估计在81%和91%之间(192–197),而家庭或密切接触者注射一剂含流行性腮腺炎疫苗的比率则在64%至76%之间(196,198)。在欧洲和加拿大进行的基于人群和学校的研究报告了疫苗有效性的可比估计值(49%-92%)(199–210)。
评估两剂含流行性腮腺炎疫苗有效性的研究较少。在美国,高2剂疫苗覆盖率人群中的疫情发现,2剂含腮腺炎疫苗在预防临床疾病方面有80%-92%的有效性(198,211)。在1988年至1989年初中生中爆发的流行性腮腺炎中,接种1剂疫苗的学生比接种2剂疫苗的学生患腮腺炎的风险高5倍(195)。在欧洲和加拿大进行的基于人群和学校的研究估计,两剂含腮腺炎的疫苗有66%-95%的有效性(表1) (201–204,208–210)。尽管2剂疫苗的有效性相对较高,但高2剂疫苗覆盖率可能不足以预防所有疫情(6,91,212)。
接种疫苗后腮腺炎免疫的持续时间
研究表明,1剂MMR疫苗可提供持久性腮腺炎抗体。大多数人(70%–99%)在初次接种疫苗后约10年接受检查时,可检测出腮腺炎抗体(187–189)。此外,70%在儿童期接种疫苗的成人对腮腺炎具有T淋巴细胞免疫力,而80%在儿童期获得自然感染的成人(213)。同样,在接受2剂MMR疫苗的受试者中,大多数人(74%–95%)在接受第二剂MMR疫苗后随访超过12年仍可检测到腮腺炎抗体,但抗体水平随时间而下降(150,187)。在没有可检测到腮腺炎抗体的疫苗接受者中,检测到了腮腺炎抗原特异性淋巴细胞增殖反应,但它们在预防腮腺炎疾病中的作用尚不清楚(214,215)。
MMR疫苗作为麻疹暴露后预防的效果
对于麻疹,MMR或麻疹疫苗作为暴露后预防措施的有效性证据有限且混杂(216–222)。有效性可能取决于接种疫苗的时间和暴露的性质。如果在初次接触麻疹后72小时内接种,MMR疫苗可能会提供一些抗感染保护或改变疾病的临床进程(216–219,222)。
几项已发表的研究比较了接受MMR或单抗原麻疹疫苗(无丙种球蛋白)作为暴露后预防的人群与暴露于麻疹后仍未接种疫苗的人群的发病率。如果在“有限的”接触环境(如学校、托儿所和医务室)中暴露于麻疹后3天内接种疫苗,MMR疫苗的暴露后预防似乎是有效的(218,222)。暴露后预防似乎在具有强烈、长期、密切接触的环境中无效,例如家庭和较小的儿童保育机构,即使在皮疹发作的72小时内接种,因为在这些环境中的人在指示患者具有传染性的前驱期内经常长时间暴露于环境中(219–221)。然而,这些家庭研究受到接受暴露后预防的人数的限制(即,在每个引用的研究中,在皮疹发作的72小时内给予MMR疫苗作为暴露后预防的不到10人) (219–221)。在暴露前接受1剂疫苗的人在暴露后72小时内再次接种疫苗也可能预防疾病(223)。对于风疹和流行性腮腺炎,暴露后接种MMR疫苗并不能预防或改变疾病的临床严重程度。
使用第三剂MMR疫苗控制流行性腮腺炎爆发
关于使用第三剂MMR疫苗控制流行性腮腺炎暴发的数据是有限的。在少数血清反应阴性的大学生中进行的一项研究表明,第三剂MMR疫苗可导致快速的腮腺炎病毒IgG反应,这些大学生曾接种过2剂MMR疫苗。在17名参与者中,共有14名(82%)在再次接种后7-10天IgG阳性,这表明以前接种过MMR疫苗的人在接种第三剂MMR疫苗后有能力产生快速的记忆免疫反应,这可能会将免疫力提高到保护水平(224)。2010年,疾病预防控制中心与当地卫生部门合作,进行了两项机构审查委员会(IRB)批准的研究,以评估纽约奥兰治县(6至12年级就读私立学校的2,688名学生的2剂疫苗覆盖率> 94%)和关岛(4至8年级就读公立小学和中学的3,364名学生的2剂疫苗覆盖率≥95%)高度接种人群在腮腺炎爆发期间接种第三剂MMR疫苗的效果。
在纽约奥兰治县,作为研究的一部分,三所学校6至12年级(11至17岁)总共1755名(81%)符合条件的学生接种了第三剂MMR疫苗(95)。干预后,该村的总体发病率下降了76%,其中11至17岁的疫苗接种目标人群下降幅度最大(与干预前相比,干预后显著下降了96%)。该年龄组的发病率下降了96%,明显高于未接受第三次剂量干预的其他年龄组(95)。然而,干预是在疫情开始下降后进行的。由于疫苗接种率高,且在接种后22-42天内观察到的病例数量少,该研究无法直接评估第三剂疫苗的有效性。
在2010年关岛流行性腮腺炎爆发期间,7所学校共3239名9至14岁符合条件的儿童接种了第三剂MMR疫苗(96)。在符合条件的儿童中,1067名(33%)接种了第三剂MMR疫苗。在第三剂干预后超过一个潜伏期后,接种了3剂MMR疫苗的学生的腮腺炎发病率比接种了2剂MMR疫苗的学生低2.6倍(0.9/1000比2.4/1000),但差异没有统计学意义(相对风险[RR] = 0.40,95%可信区间[CI]= 0.05–3.4,p = 0.67)。干预是在疫情开始下降后和学年结束前一周进行的,这限制了评估干预效果的能力。
数据不足以推荐或反对使用第三剂MMR疫苗控制流行性腮腺炎爆发。CDC已经发布了考虑在特定目标人群中使用第三种剂量的指南,以及公共卫生部门决策时考虑的标准(http://www . CDC . gov/vaccines/pubs/surv-manual/chpt 09-腮腺炎. html)。
HIV感染者对MMR疫苗的免疫应答
在有效的抗逆转录病毒疗法出现之前,HIV感染者对MMR疫苗的反应是次优的。虽然对再接种反应各不相同,但一般都很差(225,226)。此外,感染艾滋病毒的儿童的麻疹抗体下降速度似乎比未感染艾滋病毒的儿童更快(227,228)。
早期(1岁以下)接受有效抗逆转录病毒治疗的HIV感染儿童的记忆B细胞计数和功能似乎正常,对麻疹和风疹疫苗接种的反应似乎足够。与较晚开始有效抗逆转录病毒疗法的HIV感染儿童相比,较早开始有效抗逆转录病毒疗法的HIV感染儿童的麻疹抗体滴度较高(229)。同样,在接种疫苗前开始有效抗逆转录病毒疗法的接种了艾滋病病毒的儿童,其风疹抗体反应类似于在未感染艾滋病病毒的儿童中观察到的反应(230)。
尽管有免疫重建的证据,但有效的ART似乎不能可靠地恢复以前接种疫苗的免疫力。与暴露于艾滋病毒但未感染的人相比,在有效ART前接受MMR疫苗的围产期感染艾滋病毒的青年可能增加对麻疹、腮腺炎和风疹的易感性。在开始有效的抗逆转录病毒疗法后,大约45%–65%以前接种过疫苗的HIV感染儿童有可检测到的麻疹抗体,55%–80%有可检测到的风疹抗体,52%–59%有可检测到的腮腺炎抗体(231–235)。然而,在开始有效的抗逆转录病毒疗法后,接种MMR疫苗增加了可检测到麻疹、风疹和腮腺炎抗体的HIV感染儿童的比例(麻疹为64%-90%,风疹为80%-100%,腮腺炎为78%)(230,234,236–240)。尽管关于有效抗逆转录病毒疗法的再接种反应持续时间的数据有限,但大多数儿童在再接种后1-4年内可检测到麻疹(73%-85%)、风疹(79%)和腮腺炎(61%)抗体(234,238,240)。
疫苗剂量、接种和储存
冻干MMR活疫苗和MMRV疫苗应按照制造商的建议重新复溶和施用(241,242)。在美国,这两种疫苗都应该进行皮下注射。尽管两种疫苗都必须避光,否则可能使疫苗病毒失活,但两种疫苗有不同的储存要求(表2)。注射储存不当的疫苗可能无法预防疾病。稀释剂可以储存在冰箱或室温下,但不要让其冻结。
MMR疫苗
MMR疫苗以冻干形式提供,必须在50℃至8℃(58℉至46℉)下储存,并始终避光。冻干形式的疫苗可以储存在冰箱中。重组MMR疫苗应立即使用或在2℃至8℃(36℉至46℉)的黑暗地方储存长达8小时,并且不应冷冻或暴露于冷冻温度(241)。
MMRV疫苗
MMRV疫苗以冻干形式提供,应储存在50℃至-15℃(58℉至5℉)的可靠冰箱中。重组疫苗可在20℃至25℃(68℉至77℉)的室温下避光保存30分钟。如果未在30分钟内使用,则必须丢弃重组MMRV疫苗,并且不应将其冷冻(242)。
禁忌症和注意事项
在接种MMR或MMRV疫苗之前,提供者应查阅包装说明书,了解注意事项、警告和禁忌症(241,242)。
禁忌症
MMR和MMRV疫苗的禁忌症包括对新霉素的过敏反应史、对疫苗任何成分的严重过敏反应史、妊娠和免疫抑制。
新霉素过敏反应史。
MMR和MMRV疫苗含有微量新霉素;因此,对局部或全身施用新霉素有过敏反应的人不应接种这些疫苗。然而,新霉素过敏通常表现为延迟型或细胞介导的免疫反应(即接触性皮炎),而不是过敏反应。在具有这种敏感性的人群中,对疫苗中新霉素的不良反应是在疫苗接种后48-72小时出现红斑、瘙痒性结节或丘疹(243)。新霉素接触性皮炎病史不是接受含MMR疫苗的禁忌症。
对疫苗的任何成分有严重过敏反应的历史。
对先前剂量的含麻疹、腮腺炎、风疹或水痘(MMRV疫苗)的疫苗或疫苗成分有严重过敏反应的人,不应接种MMR和MMRV疫苗。虽然疫苗的麻疹和腮腺炎成分是在鸡胚成纤维细胞组织培养中生长的,但对鸡蛋过敏并不是疫苗接种的禁忌症。在对鸡蛋过敏的人群中,出现严重过敏反应(如接种MMR疫苗后的过敏反应)的风险极低(即,至少99%的鸡蛋过敏儿童可以接受一次皮下注射,而不会出现严重过敏反应[CI = 99%–100%])(244)。疫苗皮肤试验不能预测对疫苗的过敏反应(244–246)。因此,在对鸡蛋过敏的人接种MMR或MMRV疫苗之前,不需要进行皮肤试验。麻疹或腮腺炎疫苗接种或MMR疫苗接种后罕见的严重过敏反应被认为不是由鸡蛋抗原引起的,而是由疫苗的其他成分(247–249)
怀孕。
已知怀孕或试图怀孕的妇女不应接种MMR疫苗。由于当母亲接种活病毒疫苗时对胎儿的理论风险,应建议妇女在接种MMR疫苗后28天内避免怀孕(2)。如果不小心将疫苗注射给孕妇,或者在接种疫苗后28天内发生妊娠,应告知她对胎儿的理论风险。根据一项研究中144次观察的二项分布的95%置信区间,接种风疹RA 27/3疫苗后CRS的理论最大风险估计为2.6%,观察到的风险为0%(250)。其他报告记录了在大约1000名易感妇女的活产婴儿中没有CRS病例,这些易感妇女在怀孕期间或受孕前无意中接种了风疹RA 27/3疫苗(251–257)。其中,大约100名妇女已知在受孕前1周至受孕后4周内接种了疫苗(251,252),这一时期被认为是病毒血症和胎儿畸形的最高风险期。这些数字大大低于母亲在妊娠早期感染野生风疹病毒的风险≥20%或妊娠期间非CRS诱导的先天性缺陷的风险(250)。因此,孕期接种MMR疫苗不应被视为终止妊娠的指征。
MMR疫苗可以安全地用于儿童或其他没有麻疹、腮腺炎或风疹免疫证据的人,以及与孕妇有家庭接触的人,以帮助保护这些孕妇免于暴露于野生风疹病毒。没有麻疹或腮腺炎疫苗病毒从疫苗接受者传播到易感接触者的报告;尽管在接种疫苗后7至28天,在大多数风疹易感者的鼻子或喉咙中检测到少量风疹疫苗病毒,但没有报告风疹疫苗病毒传播的记录在案的确诊病例。
免疫抑制。
MMR和MMRV疫苗不应用于1)患有原发性或获得性免疫缺陷的人,包括患有与细胞免疫缺陷相关的免疫抑制、低丙种球蛋白血症、异常丙种球蛋白血症和AIDS或与HIV感染相关的严重免疫抑制的人;2)患有血液病、白血病、任何类型的淋巴瘤或影响骨髓或淋巴系统的其他恶性肿瘤的人;3)一级亲属(如父母和兄弟姐妹)中有先天性或遗传性免疫缺陷家族史的人,除非潜在疫苗接受者的免疫能力已得到临床证实或实验室验证;或4)接受全身性免疫抑制治疗的患者,包括体重> 10 kg的患者接受≥2 mg/kg体重的皮质类固醇或≥20 mg/天的泼尼松或等效药物,用药时间≥2周(258)。没有严重免疫抑制的HIV感染者应接种MMR疫苗,而不是MMRV疫苗(见标题为HIV感染者的小节)。免疫抑制人群接种MMR疫苗后,以及野生型病毒自然感染麻疹后,均有麻疹包涵体脑炎的报告(参见MMR和MMRV疫苗的安全性一节) (259–261)。
预防措施
MMR和MMRV疫苗的预防措施包括最近(≤11个月)接受含抗体的血液制品,并发伴有或不伴有发热的中度或重度疾病,血小板减少或血小板减少性紫癜史,以及结核菌素皮肤试验。如果要进行结核菌素试验,应在接种MMR或MMRV疫苗之前、同时或至少4-6周后进行。MMRV疫苗的额外预防措施包括具有任何病因的癫痫发作的个人或家族史的人。
最近(≤11个月)收到含抗体的血液制品。
接受含抗体的血液制品(如免疫球蛋白、全血或浓缩红细胞)可能会在不同时期干扰对麻疹和风疹疫苗的血清学反应,具体取决于免疫球蛋白的接种剂量(262)。含免疫球蛋白制剂对腮腺炎疫苗应答的影响尚不清楚。
MMR疫苗应仅在建议的间隔时间过后才给已接受IG制剂的人接种(258)。然而,对缺乏风疹免疫推定证据的妇女,产后接种MMR疫苗不应延迟,因为抗Rho(D) IG(人)或任何其他血液制品是在妊娠最后三个月或分娩时给药的。这些妇女应在分娩后立即接种疫苗,并至少在3个月后检测,以确保她们有风疹和麻疹免疫的推定证据。
伴有或不伴有发热的中度或重度疾病。
对于同时患有中度或重度疾病(包括未经治疗的活动性肺结核)的患者,应推迟接种疫苗,直至其康复。这种预防措施避免了将疫苗的任何副作用叠加到基础疾病上,或者错误地将基础疾病的表现归因于疫苗。接种疫苗或推迟接种疫苗的决定很大程度上取决于疾病的原因和症状的严重程度。MMR疫苗可用于患有轻度疾病的儿童,无论有无低烧,包括轻度上呼吸道感染、腹泻和中耳炎。数据表明血清转化不受并发或近期轻度疾病的影响(263–265)。医生应警惕疫苗相关的体温升高,这可能主要发生在接种疫苗后的第二周,尤其是接种第一剂MMRV疫苗后。
接受结核病治疗的人在接种MMR疫苗时没有经历疾病恶化。虽然还没有关于MMR或MMRV疫苗对未经治疗的结核病患者的影响的研究报告,但有理论依据表明麻疹疫苗可能会加重结核病。因此,在对未经治疗的活动性结核患者接种MMR疫苗之前,开始抗结核治疗是明智的。潜伏结核感染检测不是MMR疫苗常规接种的先决条件。
血小板减少症或血小板减少性紫癜史。
有血小板减少症或血小板减少性紫癜病史的人在接种MMR或MMRV疫苗后可能会增加发生临床上显著的血小板减少症的风险。有血小板减少症病史的人在接种MMR疫苗后出现过复发(266,267),而其他人在接种MMR疫苗后没有反复发作(268–270)。此外,先前接种MMR疫苗后出现血小板减少症的患者可能会在后续接种MMR疫苗后出现血小板减少症(271,272)。然而,在接受第二剂MMR疫苗前因特发性血小板减少性紫癜入院的33名儿童中,没有人在第二剂MMR疫苗后6周内复发(273)。可以寻找免疫的血清学证据来确定是否需要额外剂量的MMR或MMRV疫苗。
结核菌素试验。
MMR疫苗可能会干扰对结核菌素皮肤试验的反应,导致结核菌素皮肤敏感性暂时降低(274–276)。因此,如果要进行结核菌素皮肤试验,应在MMR或MMRV疫苗之前、同时或至少4-6周后进行。与结核菌素皮肤试验一样,活病毒疫苗也可能影响结核γ干扰素释放试验(IGRAs)的试验结果。然而,还没有研究过活病毒疫苗对IGRAs的影响。在获得更多信息之前,应在接种活病毒疫苗的同一天或接种活病毒疫苗后4-6周进行活病毒疫苗接种背景下的IGRA试验。
任何病因的癫痫发作的个人或家族史。
任何病因的个人或家庭(即兄弟姐妹或父母)癫痫发作史是MMRV首剂疫苗的预防措施,但不是MMR疫苗接种的预防措施。研究表明,有热性惊厥个人或家族史或癫痫家族史的儿童比没有这些病史的儿童患热性惊厥的风险更高。在一项研究中,与同龄未接种MMR疫苗的儿童相比,有热性惊厥个人病史的15-17个月儿童在接种MMR疫苗后14天内发生热性惊厥的风险差异为19.5 %( CI = 16.1-23.6 ),有热性惊厥病史的儿童的兄弟姐妹为4 %( CI = 2.9-5.4)277)。在另一项研究中,有热性惊厥家族史的儿童与无热性惊厥家族史的儿童相比,匹配调整后的优势比为4.8(CI = 1.3-18.6)278)。对于第一剂麻疹疫苗,具有任何病因的癫痫发作个人或家族史的儿童通常应接种MMR疫苗,因为在这类儿童中使用MMRV疫苗的风险通常大于益处。
MMR和MMRV疫苗的安全性
接种MMR或MMRV疫苗后报告的不良事件和其他情况
MMR疫苗通常耐受性良好,很少出现严重的不良事件。MMR疫苗可能导致发热(< 15%)、短暂性皮疹(5%)、短暂性淋巴结病(5%的儿童和20%的成人)或腮腺炎(< 1%)(160,163,279–283)。发热反应通常发生在疫苗接种后7-12天,通常持续1-2天(280)。大多数发烧的人没有其他症状。与学龄儿童接种疫苗前基线相比,接种第二剂MMR疫苗后的四种不良事件(即鼻炎、咳嗽、咽炎和头痛)显著降低,六种不良事件(即结膜炎、恶心、呕吐、淋巴结病、关节痛和下颌肿胀)无显著变化(284)。
医学研究所(IOM)的专家委员会审查了关于MMR疫苗接种和各种不良事件之间因果关系的证据(285–289)。他们的因果关系的评估是基于来自人群研究的流行病学证据,以及主要来自动物和人类的生物学和临床研究的机械学证据;风险没有量化。IOM确定,有证据支持MMR疫苗接种与免疫缺陷患者的过敏反应、热性惊厥、血小板减少性紫癜、短暂关节痛和麻疹包涵体脑炎之间存在因果关系。
过敏反应。
接种MMR疫苗后立即出现过敏反应的情况很少见(每百万剂1.8-14.4)(290–293)。虽然含有麻疹和腮腺炎的疫苗是在鸡胚的组织中培养的,但MMR疫苗接种后罕见的严重过敏反应据信不是由鸡蛋抗原引起的,而是由疫苗的其他成分引起的,如明胶或新霉素(247–249)。
热性惊厥。
接种MMR疫苗可能导致热性惊厥。这种癫痫发作的风险大约是每注射3000至4000剂MMR疫苗就有一例(294,295)。有热性惊厥个人或家族史或癫痫家族史的儿童在接种MMR疫苗后可能会增加热性惊厥的风险(277,278)。热性惊厥通常发生在疫苗接种后6-14天,并且似乎与任何长期后遗症(294–297)。与分别接种MMR和水痘疫苗的儿童相比,接种第一剂MMRV疫苗的12至23个月的儿童患热性惊厥的风险大约增加两倍。与分别接受第一剂MMR和水痘疫苗但在同一就诊时间接受第一剂MMR和水痘疫苗的儿童相比,每2300至2600名接受第一剂MMR和水痘疫苗的儿童在接种疫苗后5至12天多发生一次热性惊厥(298,299)。4至6岁儿童接种MMRV疫苗后,未观察到热性惊厥风险增加(300)。欲了解更多详情,请参见MMRV联合疫苗使用建议(126)。
血小板减少性紫癜。
免疫性血小板减少性紫癜(ITP),一种影响血小板计数的疾病,可能是特发性的或与一些病毒感染有关。接受麻疹减毒活疫苗和野生型麻疹感染后的ITP通常是自限性的,不会危及生命;然而,ITP的并发症可能包括需要输血的严重出血(267,268,270)。在接种MMR疫苗后的6周内,ITP的风险增加,一项研究估计每40,000剂中有一例(270)。接种MMR疫苗后血小板减少症的风险远低于自然感染风疹后的风险(每3000例感染中有一例) (56)。根据病例报告,既往患有ITP的人发生MMR疫苗相关血小板减少症的风险可能会增加(参见注意事项)。
关节痛和关节炎。
关节症状与MMR疫苗的风疹成分有关(301)。在接受含风疹疫苗的无风疹免疫力的人群中,关节痛和短暂性关节炎在成人中比在儿童中更常见,在青春期后的女性中比在男性中更常见(302,303)。接受RA 27/3疫苗的儿童很少出现急性关节痛或关节炎(160,303)。相反,在接种风疹RA 27/3疫苗后,约25%的非免疫青春期后女性出现关节痛,约10%至30%出现急性关节炎样体征和症状(154,160,282,301)。关节痛或关节炎通常在接种疫苗后1-3周开始,通常是轻微的,不会丧失能力,持续约2天,很少复发(160,301,303,304)。
麻疹包涵体脑炎。
麻疹包涵体脑炎是麻疹感染的并发症,发生在先天或后天原因导致细胞免疫缺陷的年轻人中。并发症在初次感染麻疹后1年内发生,死亡率高。在免疫缺陷人群中发表的三份报告描述了麻疹疫苗接种后的麻疹包涵体脑炎,通过对应于麻疹病毒的核内包涵体或在接种疫苗人群中从脑中分离出麻疹病毒(259–261,289)。这些病例从接种疫苗到出现麻疹包涵体脑炎的时间为4-9个月,这与感染野生麻疹病毒后出现麻疹包涵体脑炎的时间一致(305)。在一个案例中,麻疹疫苗株被鉴定为(260)。
其他可能的不良事件。
IOM的结论是,大量证据支持拒绝MMR疫苗与自闭症谱系障碍(ASD)风险之间的因果关系,包括自闭症、炎症性肠病和1型糖尿病。此外,现有证据不足以接受或拒绝MMR疫苗与以下疾病之间的因果关系:急性播散性脑脊髓炎、无热性癫痫发作、臂神经炎、慢性关节痛、慢性关节炎、慢性疲劳综合征、慢性炎性播散性多发性神经病、脑病、纤维肌痛、格林-巴利综合征、听力丧失、肝炎、脑膜炎、多发性硬化、视神经脊髓炎、视神经炎、横贯性脊髓炎、视阵挛肌阵挛综合征或神经根神经炎和其他神经病。
接种第三剂MMR疫苗后的不良事件
在2,130名9至21岁的人群中,在两次流行性腮腺炎爆发期间,在疫苗接种诊所进行了接种第三剂MMR疫苗的短期安全性评估(96,306)。虽然这些研究不包括对照组,但在接种第三剂MMR疫苗后,几乎没有不良事件报告(纽约奥兰治县为7%,关岛为6%)。最常报告的不良事件是注射部位的疼痛、发红或肿胀(2%–4%);关节或肌肉疼痛(2%–3%);和头晕或头昏眼花(2%)。两项研究均未报告严重的不良事件。
MMR疫苗在HIV感染者中的安全性
如果感染麻疹,艾滋病毒感染者出现严重并发症的风险会增加(16,307–310),在接种疫苗后感染艾滋病毒的儿童中报告了几例严重和致命的麻疹病例,包括一名接受MMR疫苗的艾滋病毒感染和严重免疫抑制的人发生进行性麻疹肺炎(311),以及与HIV感染无关的严重免疫抑制人群接种麻疹疫苗后的几例死亡(312–314)。在没有严重免疫抑制证据的HIV感染者中,接种麻疹疫苗后未报告严重或异常的不良事件(315–320)。重度免疫抑制定义为任何年龄的CD4+ T淋巴细胞百分比< 15%,或CD4计数< 200淋巴细胞/mm3对于5岁以上的人(321,322)。此外,在几项对少数有免疫抑制病史的ART儿童接种MMR疫苗的研究中,没有报告严重的不良事件(231,233,238)。MMR疫苗不推荐用于有严重免疫抑制证据的HIV感染者,MMRV疫苗不被批准用于任何HIV感染者。
疫苗不良事件的报告
疫苗接种后出现的具有临床意义的不良事件应报告给疫苗不良事件报告系统(VAERS ),地址为http://vaers.hhs.gov/esub/index。VAERS是一项上市后安全监督计划,旨在收集在美国许可使用的疫苗接种后发生的不良事件(可能的副作用)的相关信息。
报告可以通过在线、邮件或传真安全归档。VAERS表格可从VAERS网站下载或通过电子邮件(info@vaers.org)、电话(800-822-7967)或传真(877-721-0366)。有关VAERS或疫苗安全性的更多信息,请访问http://vaers.hhs.gov/about/index或者拨打电话800-822-7967。
国家疫苗伤害赔偿计划
根据1986年《国家儿童疫苗伤害法案》(经修订)制定的《国家疫苗伤害赔偿计划》( VICP)提供了一种机制,通过这种机制,可以代表被确定因接种VICP承保的疫苗而受伤或死亡的人支付赔偿金(323)。NCVIA要求医疗保健提供者报告任何被制造商列为进一步接种疫苗禁忌症的不良事件,或任何在VAERS疫苗接种后可报告事件表中列出的在疫苗接种后特定时间段内发生的不良事件(324)。疫苗伤害表列出了VICP承保的疫苗以及可能支付赔偿的伤害和情况(包括死亡)。如果伤害或病症未包括在表中,或者未在表中指定的时间段内发生,则人员必须证明是疫苗导致了伤害或病症。对于有资格获得赔偿的人,伤害的一般提交截止日期要求在疫苗伤害的第一个症状出现后3年内提交索赔;对于死亡,索赔必须在疫苗相关死亡发生后2年内提出,且不得超过导致死亡的疫苗相关损伤的第一个症状开始后4年。当VICP承保新疫苗或在表格中添加新的伤害/病症时,不符合一般提交截止日期的索赔必须在疫苗或伤害/病症被添加到表格中之日起2年内提交,因为伤害/病症发生在表格变更前8年内。接种VICP疫苗的人可能有资格提出索赔。有关VICP的更多信息,请访问http://www.hrsa.gov/vaccinecompensation/index.html或致电800–338–2382。
预防麻疹的免疫球蛋白
免疫球蛋白产品
人免疫球蛋白(IG)是一种血液制品,用于提供短期预防传染病(包括麻疹)的抗体。免疫球蛋白产品是从成千上万献血者的血浆库中制备的。患有麻疹疾病的人通常比具有疫苗诱导的麻疹免疫力的人具有更高的麻疹抗体滴度。尽管麻疹抗体在美国人口中的流行率很高(325),免疫球蛋白产品的效力已经下降,因为供体人群从对疾病具有免疫力的人转变为主要具有疫苗诱导的麻疹免疫力的人(326)。
在美国有多种免疫球蛋白制剂,包括肌肉注射(IGIM)、静脉注射(IGIV)和皮下注射(IGSC)。在美国,IGIM使用的最低麻疹抗体效价要求是参考标准(美国参考IG,Lot 176)的0.60,以及IGIV和IGSC的参考标准的0.48。在2007年,FDA血液制品咨询委员会将IGIV和IGSC的麻疹抗体浓度要求从参考标准的0.60降低到0.48,当时测试和计算表明,具有这种最低效力的IGIV和IGSC产品有望提供≥120 mIU/mL的麻疹抗体浓度,这是麻疹中和抗体的估计保护水平(327),持续28-30天,如果以200 mg/kg的最低标签推荐剂量(328)。
从历史上看,IGIM一直是短期麻疹预防的首选血液制品,也是用于证明麻疹暴露后预防功效的产品(329)。IGIM的推荐剂量为0.5毫升/千克。因为抗体浓度较低,所以需要增加剂量。然而,由于容量限制,IGIM的暴露后使用可能会受到限制。最大剂量为15毫升。体重> 30 kg的人接受的剂量将低于推荐剂量,并且滴度将低于推荐值。
IGIV自1981年开始使用,主要用于预防原发性免疫缺陷病患者的常见传染病。尽管与IGIM相比,IGIV可以施用更大的剂量,但是IGIV的临床使用具有重要的缺点,包括高成本和需要熟练专业人员在专门环境(即医院环境)中进行长期观察的施用。
自2006年以来,IGSC一直具有与IGIV相同的主要适应症。然而,管理需要泵和高级培训。此外,需要每周多次连续接种,以建立稳定的保护性抗体水平。
有关IG许可产品的更多信息,请访问http://www . FDA . gov/biologicsbloodvacines/blood products/approved products/LicensedProductsBLAs/fractiondplasmaproducts/UCM 127589 . htm。一种IGIM产品在美国获得许可并上市,包装插页可从以下网址获得http://www.talecris-pi.info/inserts/gamastans-d.pdf .
IGIM暴露后预防的有效性
自20世纪40年代以来,IGIM一直被用作预防或减轻麻疹疾病的药物,当时有证据表明,如果在暴露后6天内注射,IGIM可以降低麻疹风险或缓解疾病(329,330)具有剂量反应效应(331)。然而,在1990年进行的一项研究中,暴露后的IGIM没有效果(220)。尽管在暴露后提供麻疹感染保护所需的IGIM的最佳剂量是未知的,但是从1999年到2000年的一项研究表明了一种依赖于滴度的效应,较高的抗麻疹滴度提供了最大的保护(332)。未发病的儿童接受的平均剂量为10.9 IU/kg,而IGIM暴露后预防失败的儿童接受的平均剂量为5.7 IU/kg。
婴儿麻疹易感性
婴儿通常在出生时通过被动获得的母体抗体而免于麻疹。这种保护的持续时间很大程度上取决于转移的抗体量,该量与孕龄和母体抗体滴度有关(333)。与患有麻疹疾病的妇女相比,具有疫苗衍生的麻疹免疫的妇女具有较低的抗体滴度,并且转移的保护期较短(333–335)。尽管2010年外国出生的母亲占所有新生儿的23%,并且这些出生在西半球以外的母亲中的大多数可能对野生麻疹具有免疫力(336),现在美国大部分育龄妇女都有疫苗衍生的麻疹免疫力。通过暴露于野生型病毒来增强这种免疫力的机会更少。因此,现在出生的婴儿在更小的年龄更容易感染麻疹(337)。血清流行病学研究表明,7%在美国出生的婴儿在出生时可能缺乏抗麻疹抗体,并且高达90%的婴儿在6个月大时可能是血清阴性(139,325)。这些数据表明,婴儿时期麻疹感染的易感性窗口发生了变化,迫切需要保持群体保护,对输入病例保持警惕,以及在需要暴露后预防时快速获得免疫球蛋白产品。
豁免权的证据
制定麻疹、风疹和腮腺炎免疫可接受证据的标准是为了指导临床和公共卫生机构的疫苗接种评估和管理,并提供推定而非绝对的免疫证据。符合可接受的豁免证据标准的人获得豁免的可能性非常高。偶尔,一个符合推定免疫标准的人可以获得和传播疾病。已经为麻疹、风疹和流行性腮腺炎建立了记录免疫的具体标准(表3)。这些标准仅适用于常规疫苗接种。在暴发期间,针对某些群体的免疫推定证据的推荐标准可能有所不同(参见标题为“麻疹、风疹或腮腺炎暴发期间的建议”的章节)。
只有在年龄≥12个月时有书面接种日期记录的疫苗剂量被认为是有效的。由父母或其他护理人员提供的自我报告的剂量和疫苗接种史不被视为免疫的充分证据。因为这些疾病在美国的发病率极低,所以麻疹、风疹和腮腺炎的临床诊断的有效性是值得怀疑的,并且在评估证据时不应予以考虑。没有足够疫苗接种证明或其他可接受的免疫证明的人(表3)应该打疫苗。
如果一个人有其他可接受的对这些疾病免疫的证据(表3)。同样,也不推荐通过疫苗接种后血清学检测来验证免疫反应。
有记录的适龄疫苗接种取代了随后的血清学检测结果。如果一个人接种了2剂记录在案的含麻疹或腮腺炎疫苗,并经血清学检测确定麻疹或腮腺炎效价结果为阴性或可疑,则不建议此人再接种一剂MMR疫苗。这些人应被视为拥有豁免的推定证据。如果接种了1剂含风疹疫苗的人经血清学检测确定风疹效价结果为阴性或可疑,则不建议该人接种额外剂量的MMR疫苗,育龄妇女除外。已接种1剂或2剂含风疹疫苗且风疹特异性IgG水平不明显呈阳性的育龄妇女应再接种1剂MMR疫苗(最多3剂),且无需再次检测风疹免疫的血清学证据。
麻疹免疫的证据
有文件证明年龄≥12个月时进行了充分的麻疹疫苗接种、有麻疹免疫的实验室证据、有疾病的实验室确认或在1957年之前出生的人有可接受的麻疹免疫推定证据(表3)。为学龄前儿童(即年龄≥12个月)和没有暴露或传播高风险的成人接种足够的麻疹疫苗是接种至少1剂含麻疹病毒活疫苗的证明文件。对于从幼儿园到12年级的学龄儿童、高中后教育机构的学生、卫生保健人员和国际旅行者,充足的麻疹疫苗接种是指间隔至少28天接种两剂含麻疹病毒的活疫苗。6至11个月大的婴儿在国际旅行前的充足麻疹疫苗接种量为1剂含麻疹病毒的活疫苗。
具有可通过任何常用血清学试验检测到的麻疹特异性IgG抗体的人被认为具有足够的麻疹免疫实验室证据。血清学试验结果可疑的人没有足够的免疫推定证据,应被视为易感,除非他们有麻疹免疫的其他证据(表3)或后续检测表明麻疹免疫。
风疹免疫的证据
年龄≥12个月时接种过至少1剂含风疹病毒的活疫苗的人,风疹免疫的实验室证据,疾病的实验室确认,或1957年前出生的人(可能怀孕的妇女除外)具有可接受的风疹免疫推定证据(表3)。1957年以前的出生不能作为可能怀孕的妇女获得风疹免疫的证据。风疹免疫的书面证据对可能怀孕的妇女很重要,因为风疹可能发生在1957年以前出生的一些未接种疫苗的人中,先天性风疹和CRS可能发生在怀孕期间感染风疹的妇女的后代中。
风疹特异性抗体水平高于检测的标准阳性临界值的人可被视为具有足够的风疹免疫证据。除育龄妇女外,血清学检测结果可疑的人应被视为易患风疹,除非他们有文件证明接受过1剂含风疹的疫苗或随后的血清学检测结果显示风疹免疫。已接种1剂或2剂含风疹疫苗且风疹血清IgG水平不明显阳性的育龄妇女应再接种1剂MMR疫苗(最多3剂),无需再次检测风疹免疫的血清学证据。
腮腺炎免疫的证据
年龄≥12个月、有腮腺炎免疫的实验室证据、有疾病的实验室确认的人,或出生于1957年之前的人,有可接受的腮腺炎免疫的推定证据(表3)。学龄前儿童(即年龄≥12个月)和没有暴露或传播高风险的成人接种了足够的腮腺炎疫苗,证明接种了至少1剂含腮腺炎病毒的活疫苗。对于幼儿园到12年级的儿童、高中后教育机构的学生、卫生保健人员和国际旅行者,腮腺炎的适当疫苗接种是指间隔至少28天接种两剂含腮腺炎病毒的活疫苗。
具有可通过任何常用血清学试验检测到的腮腺炎特异性IgG抗体的人被认为具有足够的腮腺炎免疫的实验室证据。血清学试验结果可疑的人应被认为易患腮腺炎,除非他们有腮腺炎免疫的其他证据(表3)或后续检测表明腮腺炎免疫。
麻疹、风疹和腮腺炎疫苗接种的基本原理
在美国,预防麻疹、风疹和流行性腮腺炎的安全有效的疫苗已经存在了40多年。在疫苗出现之前,麻疹、风疹和流行性腮腺炎是儿童期常见疾病,并导致显著的发病率和死亡率。由于常规疫苗接种计划,美国分别于2000年和2004年实现了消除麻疹和风疹(阻断长达1年的地方病传播链),腮腺炎病例数减少了约99%(48,82,124)。2011年12月,一个专家小组审查了现有证据,并一致认为美国保持了消除麻疹和风疹(50,51)。此外,一项经济分析发现,美国的2剂MMR疫苗接种计划节省了大量成本(直接成本和社会成本分别约为35亿美元和76亿美元)和较高的效益成本比:每花费1美元,该计划可节省约14美元的直接成本和10美元的额外生产成本(以2001年美元估算值为基础) (338)。
尽管在美国成功地消除和维持了麻疹和风疹的地方性传播,美国的流行性腮腺炎发病率显著下降,并且在全球麻疹和风疹控制方面取得了相当大的进展,但在许多国家,麻疹、风疹、CRS和流行性腮腺炎仍然是常见疾病。输入将继续发生,并在有未接种人群聚集的社区引起疫情。未接种疫苗的人使自己和社区中的其他人,特别是那些无法接种疫苗的人,处于这些疾病及其并发症的风险之中。在美国,需要通过疫苗接种获得高水平的人群免疫力,以防止大规模爆发,保持麻疹和风疹的消除以及低流行性腮腺炎发病率。
麻疹、风疹和腮腺炎疫苗接种建议
麻疹、风疹和腮腺炎疫苗被推荐用于预防麻疹、风疹和腮腺炎。为预防麻疹和腮腺炎,建议年龄≥12个月的学龄前儿童和暴露和传播风险不高的成人接种1剂,建议幼儿园至12年级的学龄儿童和暴露和传播风险高的成人(例如,上大学或其他高中后教育机构的学生、卫生保健人员和国际旅行者)接种2剂。为预防风疹,建议年龄≥12个月的人注射1剂。MMR疫苗或MMRV疫苗均可用于实施预防麻疹、腮腺炎和风疹的疫苗接种建议(126)。MMR疫苗适用于年龄≥12个月的人。MMRV疫苗被许可仅用于12个月至12岁的儿童。MMR疫苗或MMR疫苗和MMRV疫苗的2剂之间的最小间隔为28天,第一剂在年龄≥12个月时施用。2剂MMRV疫苗的最小间隔为3个月。
ACIP建议,12至47个月大的婴儿接种第一剂麻疹、腮腺炎、风疹和水痘疫苗时,可以使用MMR疫苗和水痘疫苗或MMRV疫苗。考虑接种MMRV疫苗的提供者应与父母或护理人员讨论两种疫苗接种方案的益处和风险。除非父母或照顾者表示偏爱MMRV疫苗,否则CDC建议在该年龄组首次接种MMR疫苗和水痘疫苗,因为与12至23个月大的儿童接种MMR疫苗相比,接种MMR疫苗后5至12天出现热性惊厥的风险增加(126,298,299)。
对于任何年龄(15个月至12岁)的第二次接种和48个月至12岁的第一次接种,通常优选使用MMRV疫苗,而不是单独注射其等效组分疫苗(MMR疫苗和水痘疫苗)。使用单独注射代替MMRV疫苗的考虑因素应包括供应商评估(即注射次数、疫苗可用性、提高覆盖率的可能性、患者返回的可能性、储存和成本考虑)、患者偏好和潜在不良事件(参见ACIP MMRV联合疫苗使用建议) (126)。
12个月至18岁儿童的常规疫苗接种
学龄前儿童(年龄≥12个月)
所有符合条件的儿童应在12至15个月时常规接种首剂MMR疫苗。建议所有儿童在12个月大时尽快接种MMR疫苗。
学龄儿童(从幼儿园到12年级)
建议所有4至6岁的儿童在进入幼儿园或一年级前常规接种第二剂MMR疫苗。然而,如果第一剂和第二剂之间的间隔超过28天,MMR疫苗的第二剂可以在更早的年龄施用。
成人疫苗接种(年龄≥18岁)
1957年或以后出生的成年人应接种至少1剂MMR疫苗,除非他们有对这三种疾病免疫的其他可接受的证据(表3)。但是,接受未知类型麻疹疫苗、灭活麻疹疫苗或进一步减毒麻疹疫苗并伴有IG或高滴度麻疹免疫球蛋白(美国不再提供)的人应被视为未接种,应再次接种1或2剂MMR疫苗。在1979年之前接种过流行性腮腺炎灭活疫苗或未知类型的流行性腮腺炎疫苗的高风险人群(如在医疗机构工作的人员)应考虑再次接种2剂MMR疫苗。
1957年之前出生的成年人可以被认为对麻疹、风疹(可能怀孕的妇女除外)和腮腺炎具有免疫力。然而,MMR疫苗(1剂或2剂至少间隔28天接种)可以给任何1957年前出生的人接种,只要他没有MMR疫苗接种的禁忌症。
暴露或传播麻疹、风疹或腮腺炎的风险可能增加且没有免疫证据的成人应特别考虑接种疫苗。上大学或其他高中后教育机构的学生、卫生保健人员和国际旅行者应接种2剂MMR疫苗。
特殊人群疫苗接种
学龄儿童、大学生和其他中学后教育机构的学生
所有进入学校、学院、大学、技术和职业学校以及其他高中后教育机构的学生应接种2剂MMR疫苗(第一剂在年龄≥12个月时接种)或具有麻疹、风疹和腮腺炎免疫的其他证据(表3)入学前。已经接种了2剂间隔适当的MMR疫苗的学生在入学时不需要额外的剂量。
保健人员
为了预防疾病和在卫生保健机构中的传播,卫生保健机构应确保在卫生保健机构中工作的所有人员都有针对麻疹、风疹和腮腺炎的适当疫苗接种证明或对这些疾病免疫的其他可接受证据(表3) (6)。
1957年期间或之后出生的保健人员
1957年期间或之后出生的卫生保健人员的适当疫苗接种包括2剂含麻疹病毒的活疫苗、2剂含腮腺炎病毒的活疫苗和至少1剂含风疹病毒的活疫苗(表3)。第二剂含麻疹病毒或腮腺炎病毒的活疫苗应在第一剂后至少28天接种。卫生保健机构应使用安全的(最好是计算机化的)系统来管理卫生保健人员的疫苗接种记录,以便可以方便地检索记录(6)。
1957年之前出生的保健人员
尽管1957年前出生被认为是麻疹、风疹和腮腺炎免疫的可接受证据,但卫生保健机构应考虑为1957年前出生且没有麻疹、风疹和腮腺炎免疫实验室证据的未接种人员接种疫苗;疾病的实验室确认;或接种2剂适当间隔的麻疹和腮腺炎MMR疫苗和1剂风疹MMR疫苗。疫情期间的疫苗接种建议不同于针对该人群的常规建议(参见“麻疹、风疹或腮腺炎疫情期间的建议”一节)。
保健人员的血清学测试
除非医疗机构认为接种麻疹、风疹或流行性腮腺炎疫苗具有成本效益,否则没有必要对没有足够免疫推定证据的医护人员进行接种前抗体筛查。对于拥有2剂记录在案的含麻疹和腮腺炎疫苗和1剂记录在案的含风疹疫苗或其他可接受的麻疹、风疹和腮腺炎免疫证据的医护人员,不建议进行免疫血清学检测。如果已接种2剂记录在案的麻疹或腮腺炎疫苗的卫生保健人员接受了血清学检测,并且麻疹或腮腺炎的效价结果为阴性或可疑,则不建议他们再接种一剂MMR疫苗。这些人应被视为具有麻疹和腮腺炎免疫力的可接受证据;没有必要重新测试。同样,如果卫生保健人员(育龄妇女除外)已接种了一剂记录的含风疹疫苗,但经血清学检测风疹效价结果为阴性或可疑,则不建议他们再接种一剂MMR疫苗。这些人应被视为具有可接受的风疹免疫证据。
年龄≥6个月的国际旅行者
麻疹、风疹和腮腺炎是许多国家的地方病,在国际旅行前预防麻疹、风疹和腮腺炎是很重要的。所有年龄≥6个月、计划出国旅行或在国外生活的人应确保他们在旅行前有可接受的麻疹、风疹和腮腺炎免疫证据(表3)。年龄≥6个月且没有麻疹、风疹和腮腺炎免疫证据的旅行者应接种MMR疫苗。在离开美国之前,6至11个月的儿童应接种1剂MMR疫苗,年龄≥12个月的儿童和成人应间隔至少28天接种2剂MMR疫苗,第一剂在年龄≥12个月时接种。在12个月之前接种MMR疫苗的儿童应被视为对所有三种疾病都有潜在的易感性,并应接种2剂MMR疫苗,第一剂在儿童12至15个月大时(如果儿童仍生活在疾病风险高的地区,则为12个月大)接种,第二剂至少在28天后接种。
育龄妇女
所有育龄妇女(即青春期少女和绝经前成年妇女),尤其是那些在美国以外可能不进行常规风疹疫苗接种的地区长大的妇女,应接种1剂MMR疫苗或具有其他可接受的风疹免疫证据。没有风疹疫苗接种记录、风疹免疫血清学证据或风疹疾病实验室确认的育龄非妊娠妇女应接种MMR疫苗。1957年以前的出生不能作为可能怀孕的妇女获得风疹免疫的证据。已知怀孕的妇女不应接种MMR疫苗。在完成或终止妊娠后,没有风疹免疫证据的妇女应在出院前接种疫苗。应建议妇女在接种MMR疫苗后28天内避免怀孕。
产前血清学筛查适用于所有缺乏可接受的风疹免疫证据的孕妇(表3)。送去进行免疫筛查的血清应只检测风疹IgG抗体,而不检测风疹IgM抗体,除非怀疑最近有风疹接触史(即与怀疑或确认感染风疹的人接触)。风疹IgM检测可能导致检测到非特异性IgM,从而导致假阳性检测结果和难以解释的长期IgM结果(339)。
免疫缺陷者的家庭和密切接触者
如果感染麻疹,免疫功能低下的人出现严重并发症的风险很高。年龄≥12个月的免疫缺陷者的所有家庭和其他密切接触者应接种2剂MMR疫苗,除非他们有麻疹免疫的其他证据(表3)。
人类免疫缺陷病毒(艾滋病毒)感染者
目前没有严重免疫抑制证据的艾滋病毒感染者接种疫苗
对于所有年龄≥12个月且无麻疹、风疹和腮腺炎免疫证据或严重免疫抑制证据的HIV感染者,建议接种两剂MMR疫苗。对于年龄≤5岁且CD4百分比≥15%且CD4计数≥200个淋巴细胞/mm3的人,无严重免疫抑制被定义为CD4百分比≥15%持续≥6个月,年龄大于5岁的人至少6个月。当只有年龄大于5岁的人的CD4计数或CD4百分比可用时,严重免疫抑制的评估可以基于可用的CD4值(计数或百分比)。当年龄≤5岁的人的CD4百分比不可用时,严重免疫抑制的评估可以基于测量CD4计数时的年龄特异性CD4计数(即,无严重免疫抑制定义为年龄特异性CD4计数标准以上≥6个月:年龄≤12个月,CD4计数> 750淋巴细胞/mm3;在1岁到5岁期间,CD4计数≥500淋巴细胞/mm3)。
MMR疫苗第一剂应在12至15个月大时接种,第二剂应在4至6岁时接种,或在第一剂接种后28天接种。年龄较大的儿童和成人,新诊断为HIV感染,且没有可接受的麻疹、风疹或腮腺炎免疫证据(表3)应在诊断后尽快完成MMR疫苗的2剂方案,除非他们有严重免疫抑制的证据(即CD4百分比< 15%[所有年龄]或CD4计数< 200淋巴细胞/mm3【年龄> 5岁】)。MMRV疫苗尚未在HIV感染者中进行研究,因此不应替代MMR疫苗。
无严重免疫抑制证据的围产期艾滋病毒感染者的再接种
在建立有效的ART前接种了含麻疹、风疹或腮腺炎疫苗的围产期HIV感染者,一旦建立了有效的ART,应接种2剂间隔适当的MMR疫苗(即现在1剂,至少28天后再接种1剂),除非他们有其他可接受的麻疹、风疹和腮腺炎免疫的当前证据(表3)。对于年龄≤5岁且CD4百分比≥15%且CD4计数≥200淋巴细胞/mm3的人,公认有效的抗逆转录病毒疗法被定义为接受抗逆转录病毒疗法≥6个月,同时CD4百分比≥15%持续≥6个月,年龄大于5岁的人至少6个月。当年龄大于5岁的人只有CD4计数或CD4百分比可用时,可根据可用的CD4值(计数或百分比)评估确定的有效抗逆转录病毒疗法。当无法获得年龄≤5岁儿童的CD4百分比时,可根据测量CD4计数时的年龄特异性CD4计数来评估已确立的有效ART(即,已确立的有效ART定义为接受ART≥6个月,同时满足年龄特异性CD4计数标准≥6个月:年龄≤12个月,CD4计数> 750淋巴细胞/mm3;在1岁到5岁期间,CD4计数≥500淋巴细胞/mm3)。
麻疹、风疹或腮腺炎爆发期间的建议
在麻疹、风疹或腮腺炎爆发期间,应努力确保所有有暴露和感染风险的人都接种了疫苗或有其他可接受的免疫证据(表3)。有证据表明,在麻疹和腮腺炎爆发期间有暴露和感染风险的学龄儿童、大学生和其他中学后教育机构的学生接种了足够的疫苗,包括分别间隔至少28天的两剂含麻疹或腮腺炎的疫苗。如果疫情影响学龄前儿童或具有社区传播的成人,应考虑为1至4岁的儿童或已接种1剂的成人接种第2剂。此外,在麻疹爆发期间,涉及年龄< 12个月且有持续暴露风险的婴儿,年龄≥6个月的婴儿可以接种疫苗。在成人流行性腮腺炎爆发期间,应考虑对1957年前出生的人接种MMR疫苗,这些人没有其他免疫证据并可能暴露于MMR疫苗。在风疹爆发期间,对年龄≥12个月的人进行足够的疫苗接种包括1剂含风疹的疫苗。
CDC关于麻疹、风疹、CRS和流行性腮腺炎的监测和暴发控制指南可在疫苗可预防疾病监测手册(http://www.cdc.gov/vaccines/pubs/surv-manual/index.html)。
卫生保健设施中的疫情
在麻疹或腮腺炎爆发期间,卫生保健机构应建议未接种疫苗的卫生保健人员在适当的时间间隔接种2剂MMR疫苗,无论出生年份,这些人员缺乏麻疹或腮腺炎免疫的实验室证据或疾病的实验室确认。同样,在风疹爆发期间,卫生保健机构应建议未接种疫苗的人员接种1剂MMR疫苗,无论出生年份,这些人员缺乏风疹免疫的实验室证据或感染或疾病的实验室确认。在疫情爆发期间,不建议在接种疫苗前进行血清学筛查,因为快速接种疫苗对于阻止疾病传播是必要的(6)。如果尚未收集到足够的免疫证据文件,可能很难在疫情爆发期间或发生暴露时快速获得卫生保健人员的免疫文件。因此,卫生保健机构可能希望确保定期记录卫生保健人员的麻疹、风疹和腮腺炎免疫状态,并且可以方便地获取。
MMR疫苗暴露后预防
如果在初次接触麻疹后72小时内接种MMR疫苗,可能会提供一些保护或改变麻疹的临床病程(216–219,222)。对于暴露于麻疹的年龄≥12个月的符合疫苗接种条件的人,如果在初次暴露后72小时内接种,接种MMR疫苗优于IG疫苗。如果暴露不会导致感染,暴露后接种疫苗应能预防随后的暴露。如果暴露导致感染,没有证据表明在症状前或疾病前驱期接种MMR疫苗会增加疫苗相关不良事件的风险。暴露后接种MMR疫苗不能预防或改变风疹或腮腺炎的临床严重程度,不推荐使用。
用免疫球蛋白进行暴露后预防
如果在暴露后6天内接种,免疫球蛋白可以预防或改善非免疫人群的麻疹。免疫球蛋白不适用于在年龄≥12个月时接种过1剂含麻疹疫苗的人,除非他们患有严重的免疫功能低下(定义见本报告下文“免疫功能低下患者”小节)。免疫球蛋白不应用于控制麻疹爆发,而是用于降低接受者的感染和并发症风险。尚未证明免疫球蛋白能预防暴露后的风疹或腮腺炎感染,因此不推荐用于此目的。
任何暴露于麻疹并接受免疫球蛋白注射的非免疫人群应随后接受MMR疫苗,该疫苗应在IGIM注射后不早于6个月或IGIV注射后不早于8个月接种,前提是该人当时年龄≥12个月且该疫苗无其他禁忌。
暴露后预防的免疫球蛋白推荐剂量
肌肉注射IG的推荐剂量(IGIM)为0.5毫升/千克体重(最大剂量= 15毫升),静脉注射IG的推荐剂量(IGIV)为400毫克/千克。
使用免疫球蛋白进行暴露后预防的建议
以下患者群体有患麻疹严重疾病和并发症的风险,应接受免疫球蛋白治疗:年龄< 12个月的婴儿、无麻疹免疫证据的孕妇和免疫功能严重受损的人。IGIM可用于没有麻疹免疫证据的其他人,但应优先用于在强烈、长期、密切接触的环境中暴露的人(如家庭、托儿所和教室)。对于没有麻疹免疫证据的暴露者,可以使用快速IgG抗体试验来告知免疫状态,前提是不延迟IG的接种。
小于12个月的婴儿.
因为婴儿患严重麻疹和并发症的风险更高,如果母亲没有免疫力或其母亲对麻疹的抗体减弱,婴儿容易感染麻疹(337),应对所有暴露于麻疹的小于12个月的婴儿施用IGIM。对于6至11个月的婴儿,如果在暴露后72小时内接种,MMR疫苗可以代替IG进行接种。
没有麻疹免疫证据的孕妇.
因为孕妇患严重麻疹和并发症的风险更高(20),应对没有麻疹免疫证据但接触过麻疹的孕妇进行IGIV。建议使用足够高的IGIV剂量,以达到估计的麻疹抗体滴度保护水平。
免疫力低下的病人。
暴露于麻疹的严重免疫缺陷患者应接受IGIV预防,无论其免疫或疫苗接种状态如何,因为他们可能不受疫苗保护。严重免疫缺陷患者包括严重原发性免疫缺陷患者;接受骨髓移植的患者,直到完成所有免疫抑制治疗后至少12个月,或发生移植物抗宿主病的患者更长时间;在免疫抑制化疗完成后至少6个月内接受ALL治疗的患者;以及被诊断患有艾滋病的患者或患有严重免疫抑制的HIV感染者,所述严重免疫抑制被定义为CD4百分比< 15%(所有年龄)或CD4计数< 200淋巴细胞/mm3(年龄> 5岁)和自接受有效ART后未接受过MMR疫苗的人。一些专家包括缺乏近期免疫状态或麻疹免疫确认的HIV感染者。
对于已经接受IGIV治疗的人,在暴露于麻疹前的3周内给予至少400 mg/kg体重应足以预防麻疹感染。对于接受皮下免疫球蛋白(IGSC)治疗的患者,在暴露于麻疹前连续2周给予至少200 mg/kg体重就足够了。
未来方向
为了在美国保持消除麻疹、风疹和CRS以及控制流行性腮腺炎,快速检测病例是必要的,以便可以快速实施适当的控制措施。这是为了防止进口病毒株建立地方性传播链。少数未接种疫苗的人群可能会对持续消除麻疹、风疹和CRS以及控制流行性腮腺炎构成风险,因为只要这些疾病在全球范围内仍然流行,它们就会继续传入美国。
在美国保持消除麻疹、风疹和CRS以及控制流行性腮腺炎的关键挑战是1)确保高常规疫苗接种覆盖率,这意味着为12至15个月的儿童接种第一剂MMR疫苗,并确保学龄儿童接种第二剂MMR疫苗(针对麻疹和流行性腮腺炎),2)为高风险群体接种疫苗,如卫生保健人员、国际旅行者,包括6至11个月的婴儿, 以及高中后教育机构的学生;3)保持卫生保健人员和公众对这些疾病的认识;4)与美国政府机构和包括世卫组织在内的国际机构合作,以实现全球麻疹和风疹死亡率降低和消除的目标;以及5)确保公共卫生部门继续进行监测,并在报告疑似病例时启动迅速的公共卫生响应。
致谢
本报告部分基于美国国家免疫和呼吸疾病中心的Preeta K. Kutty医学博士和Susan Redd以及美国国家艾滋病、病毒性肝炎、性病和结核病预防中心的Albert E. Barskey公共卫生硕士的贡献。
参考
1.疾病控制中心。麻疹——美国,2011年。MMWR 2012;61:253–7.
2.疾病控制中心。2011年加州大学校园流行性腮腺炎爆发。MMWR 2012;61:986–9.
3.美国东正教犹太社区流行性腮腺炎爆发。英国医学杂志2012;367:1704–13.
4.疾病控制中心。麻疹、流行性腮腺炎和风疹——消除麻疹、风疹和先天性风疹综合征和控制流行性腮腺炎的疫苗使用和策略:免疫实践咨询委员会的建议(ACIP)。MMWR 1998 22;47(编号RR-8)。
5.疾病控制中心。接受含风疹疫苗后避免怀孕的修订ACIP建议。MMWR 2001年;50:1117.
6.疾病控制中心。保健人员的免疫接种:免疫接种实践咨询委员会的建议(ACIP)。MMWR 2011;60(RR-7):1–45。
7.史密斯JC,斯奈德德,皮克林K;免疫实践咨询委员会。美国免疫政策的发展:免疫实践咨询委员会的作用。Ann实习生Med 2009150:45–9.
8.佩里RT,哈尔茜NA。麻疹的临床意义。j感染疾病信息系统2004年;第189页(补编第1号):S4-16页。
9.戈登·JE。现代麻疹。美国医学博士学位1954年;228:334–61.
10.米勒DL。1963年麻疹并发症的频率。公共卫生实验室服务与卫生医疗官员协会合作进行的全国调查报告。BMJ 1964;2:75–8.
11.1987-2002年美国急性麻疹死亡率。j感染疾病信息系统2004年;第189页(补编1):第69至77页。
12.沃尔夫森LJ,格雷斯RF,卢克罗FJ,伯明翰ME,斯特雷贝尔PM。麻疹病死率的估计:一项基于社区研究的综合综述。国际流行病学杂志2009;38:192–205.
13.疾病控制中心。麻疹监测——美国,1991年。MMWR 1992年;41(编号SS-6)。
14.Kernahan J,McQuillin J,Craft AW。患有恶性疾病的儿童患麻疹。医学博士(临床研究)1987年;295:15–8.
15.格雷MM,汉恩IM,格拉斯S,等:《四个主要治疗中心的恶性疾病患儿中麻疹引起的死亡率和发病率:一项回顾性研究》。医学博士(临床研究)1987年;295:19–22.
16.Markowitz LE,Chandler FW,Roldan EO,等。艾滋病患儿无皮疹的致命性麻疹肺炎。j传染Dis 1988158:480–3.
17.疾病控制中心。美国HIV感染儿童的麻疹。MMWR 1988;37:183–6.
18.逆转录聚合酶链反应检测人类免疫缺陷病毒感染儿童麻疹病毒脱落时间延长。j传染疾病研究所,2001年;183:532–8.
19.Lupo J,Bernard S,Wintenberger C,等。法国免疫功能正常成人中无皮疹的致命性麻疹。紧急传染疾病2012;18:521–3.
20.Manikkavasagan G,Ramsay M .孕妇使用麻疹暴露后预防的基本原理:一项综述。2009年妇产科杂志;29:572–5.
21.埃伯哈特-菲利普斯JE,弗雷德里克PD,男爵RC,马斯科拉l。妊娠麻疹:一项58例的描述性研究。妇产科1993年;82:797–801.
22.西格尔M,富尔斯特HT。低出生体重与母体病毒性疾病。风疹、麻疹、腮腺炎、水痘和肝炎的前瞻性研究。JAMA 1966197:680–4.
23.Atmar RL,Englund JA,Hammill H .妊娠期麻疹并发症。临床感染Dis 199214:217–26.
24.贝利尼·WJ,罗塔·JS,劳·勒等:亚急性硬化性全脑炎:这种致命疾病中,通过麻疹免疫预防的病例比以前认识的要多。j传染疾病2005年;192:1686–93.
25.1970-1989年英格兰和威尔士亚急性硬化性全脑炎的流行病学。国际流行病学杂志1992;21:998–1006.
26.哈尔西·纳,莫德林·JF,雅布尔·JT等:亚急性硬化性全脑炎的危险因素:一项病例对照研究美国流行病学杂志1980年;111:415–24.
27.Campbell H,Andrews N,Brown KE,Miller E .回顾麻疹疫苗接种对SSPE流行病学的影响。国际流行病学杂志2007;36:1334–48.
28.美国麻疹疫苗接种的健康影响。儿科1985;76:524–32.
29.Jin L,Beard S,Hunjan R,Brown DW,Miller E .引起SSPE的麻疹病毒株的特征:对11例病例的研究。神经病毒学杂志2002;8:335–44.
30.通过聚合酶链反应检测接受过麻疹疫苗的SSPE患者脑脊液中的野生型麻疹病毒基因组。临床诊断病毒学1996;5:37–42.
31.川岛H,宫岛T,莫里T,等:采用逆转录-聚合酶链反应检测脑脊液和外周血单核细胞中麻疹病毒基因组阳性的难治性癫痫病例。大脑发展1996;18:220–3.
32.SSPE和巴布亚新几内亚急性麻疹患者麻疹病毒基因组的分子分析。医学病毒学杂志2002;68:105–12.
33.克罗地亚亚急性硬化性全脑炎病例中麻疹病毒株的检测和特征分析。病毒研究2004;99:51–6.
34.1990-2002年英格兰和威尔士亚急性硬化性全脑炎的流行病学。Arch Dis Child 200489:1145–8.
35.欣曼AR,布兰德林-贝内特广告,尼堡PI。在美国消灭麻疹的机会和义务。JAMA 1979242:1157–62.
36.希曼AR,奥伦斯坦华盛顿,木瓜兆焦耳。美国消除麻疹策略的演变。j感染疾病信息系统2004年;189(补编1):S17–22。
37.疾病控制中心。美国1993年法定传染病摘要。MMWR 1994年;42:1–73.
38.1985-1986年美国麻疹暴发的传播模式。英国医学杂志1989;320:75–81.
39.疾病控制中心。麻疹预防。MMWR 1989;第38页(补编第9号):1至18页。
40.阿特金森·WL。麻疹的流行病学和预防。皮肤病学临床1995;3:553–9.
41.国家疫苗咨询委员会。麻疹流行病。问题、障碍和建议。JAMA 1991266:1547–52.
42.疾病控制中心。儿童疫苗计划(VFC)。2012;可从以下网址获得http://www.cdc.gov/vaccines/programs/vfc/index.html。访问时间为2012年3月21日。
43.疾病控制中心。麻疹——美国,1995年。MMWR 1996年;45:305–7.
44.Rota JS,Rota PA,Redd SB,等。1995-1996年美国麻疹病毒的遗传分析。j传染疾病调查,1998年;177:204–8.
45.沃森JC,里德SC,罗兹博士,哈德勒SC。1993年美国本土麻疹传播的中断。儿科传染病杂志1998;17:363–6.
46.美国儿科学会传染病委员会。麻疹:对当前免疫政策的重新评估。儿科1989;84:1110–3.
47.疾病控制中心。关于免疫的一般性建议:免疫实践咨询委员会的建议(ACIP)。MMWR 1994年;43(编号RR-1)。
48.卡茨SL,欣曼AR。摘要和结论:消灭麻疹会议,2000年3月16-17日。j感染疾病信息系统2004年;189:S43–7。
49.疾病控制中心。2002年11月至2003年3月美洲地区无d9麻疹病毒传播。MMWR 2003年;52:228–9.
50.疾病控制中心。记录和核实美洲地区消除麻疹、风疹和先天性风疹综合征的情况。美国国家报告;2012.
51.希曼·阿尔,哈恩·C,马尔多纳多·Y,舒尔特·帕,泰特·JL。美国消除麻疹和风疹地方病的核查和记录:外部专家小组的总结和结论;2011.
52.帕克·菲贝尔科恩A,里德·SB,加拉格尔·K,等:《后消灭时代美国的麻疹》。j传染疾病2010年;202:1520–8.
53.断绝JL。风疹流行病学。科学出版物第147号。DC华盛顿:泛美卫生组织、世界卫生组织;1967:366–70.
54.霍斯特曼DM,赖尔丹JT,Ohtawara M,尼德曼JC。封闭人群中风疹的自然流行:病毒学和流行病学观察。Arch Gesamte Virusforsch 196516:483–7.
55.罗宾斯足球俱乐部。出生后获得性风疹:临床特征和并发症。Am J Dis Child 1969118:12–7.
56.拜尔WL,谢尔曼费,迈克尔RH,司徒伊尔,刘易斯JH。先天性和获得性风疹中的紫癜。英国医学杂志1965年;273:1362–6.
57.谢尔曼FE,迈克尔RH,肯尼FM。风疹并发急性脑病(脑炎):病毒学研究、皮质醇生成测定和尸检观察病例报告。JAMA 1965192:675–81.
58.马戈利斯FJ,威尔逊JL,顶级FH。风疹后脑脊髓炎。1943年《儿科杂志》;23:158–65.
59.米勒E,克拉多克沃森JE,波洛克商标。妊娠各阶段确诊的母体风疹的后果。柳叶刀1982;2:781–4.
60.罗尔斯·韦,德斯米特·J,梅尔尼克·JL。母体风疹的血清学诊断和胎儿受累:流产的标准。JAMA 1968203:627–31.
61.托宾·乔·汤普森。从流产材料中分离风疹病毒。BMJ 1970;2:264–6.
62.哈恩斯,小萌J,范宾南迪克R等,《2004-2005年荷兰风疹爆发:先天性感染的高负担并传播到加拿大》。儿科传染病杂志2009;28:795–800.
63.佩卡姆CS。宫内暴露于母体风疹的儿童的临床和实验室研究。阿奇迪斯儿童1972;47:571–7.
64.摩根-卡普纳P,米勒E,武尔丁JE,拉姆齐我。母亲再次感染风疹后的妊娠结局。1991年英国版CDR1:57–9.
65.母体再感染后的先天性风疹综合征。临床儿科杂志2000;39:113–6.
66.母亲风疹再感染后的胎儿感染:定义再感染的标准。BMJ 1989;299:773–5.
67.班纳吉A,福特-琼斯埃尔,凯利E,罗宾逊JL。尽管母体抗体存在,先天性风疹综合征。CMAJ 2005年;172:1678–9.
68.Aboudy,Fogel A,Barnea B,等。妊娠期亚临床风疹再感染,随后病毒传播给胎儿。j感染1997年;34:273–6.
69.罗宾逊J,勒梅M,沃德里WL。预期母体免疫后的先天性风疹:2例病例及文献回顾。儿科传染病杂志1994;13:812–5.
70.安德鲁斯J,唐JW,赫斯L,潘迪亚P,布林克NS。无胎儿感染迹象的妊娠风疹再感染症状。2004年Prenat Diagn24:227–8.
71.Forsgren M,Soren L.《怀孕期间接种风疹特异性IgM反应的妇女的亚临床风疹再感染和病毒对胎儿的传播》。Scand J Infect Dis 198517:337–41.
72.维特·JJ,卡希默·奥,病例G,等。风疹流行病学。Am J Dis Child 1969118:107–11.
73.疾病控制中心。风疹和先天性风疹监测,1983年。MMWR 1984;33(编号SS-4)。
74.国家传染病中心。风疹监测。马里兰州贝塞斯达:美国卫生、教育和福利部;1969.
75.疾病控制中心。风疹疫苗:公共卫生服务咨询委员会关于免疫实践的建议。安实习医师医学1978;88:543–5.
76.疾病控制中心。风疹预防。MMWR 1984;33:301–10, 15–8.
77.疾病控制中心。风疹和先天性风疹综合征的增加——美国,1988-1990年。MMWR 1991年;40:93–9.
78.Lee SH,Ewert DP,Frederick PD,Mascola L世纪90年代先天性风疹综合征的复发。关于育龄妇女错失机会和预防政策失败的报告。JAMA 1992267:2616–20.
79.梅林格AK,克拉根JD,阿特金森WL,等。风疹爆发后先天性风疹综合征的高发病率。儿科传染病杂志1995;14:573–8.
80.疾病控制中心。风疹和先天性风疹综合征——美国,1991年1月1日至1994年5月7日。MMWR 1994年;43:7–19.
81.Reef SE,Redd SB,Abernathy E,Zimmerman L,Icenogle JP。1998-2004年美国风疹和先天性风疹综合征的流行病学概况:没有地方性传播的证据。Clin Infect Dis 200643:S126–32。
82.礁东南,科奇西南。美国消除风疹和先天性风疹综合征的证据:一项公共卫生成就。Clin Infect Dis 200643:S123–5。
83.Reef SE,Redd SB,Abernathy E,Kutty P,Icenogle JP。用于支持在美国实现和维持消除风疹和先天性风疹综合征的证据。j传染疾病2011年;204:S593–7。
84.疾病控制中心。控制风疹和预防先天性风疹综合征的进展—全球,2009年。MMWR 2010;59:1307–10.
85.福尔克瓦,布坎K,道M,等。1980-1982年艾伯塔省南部流行性腮腺炎的流行病学。1989年美国流行病学杂志;130:736–49.
86.库尼MK,福克斯JP,霍尔CE。副流感、流行性腮腺炎、呼吸道合胞病毒和肺炎支原体感染和疾病的观察。1975年美国流行病学杂志;101:532–51.
87.菲利普注册护士,赖因哈德KR,拉克曼DB。对一起处女流行性腮腺炎的观察。Am J Hyg 195969:91–111.
88.Reed D,Brown G,Merrick R,Sever J,Feltz E .阿拉斯加圣乔治岛流行性腮腺炎。JAMA 1967199:113–7.
89.与腮腺炎感染相关的脑膜炎和脑炎:一项10年调查。阿奇迪斯儿童1972;47:647–51.
90.Beard CM,Benson RC Jr,Kelalis PP,Elveback LR,Kurland lt . 1935年至1974年明尼苏达州罗切斯特流行性腮腺炎睾丸炎的发病率和转归。梅奥临床进展1977;52:3–7.
91.最近流行性腮腺炎在美国死灰复燃。英国医学杂志2008;358:1580–9.
92.美国流行性腮腺炎隔离预防指南:政策变化科学基础的回顾。Clin Infect Dis 201050:1619–28.
93.沃纳加州。腮腺炎睾丸炎和睾丸萎缩;事件。安实习医师医学1950;32:1066–74.
94.兰巴交流。腮腺炎;恢复期血清在预防成人流行性腮腺炎中的应用。Am J Nurs 194848:86.
95.Ogbuanu IU,Kutty PK,Hudson JM等。第三剂麻疹-腮腺炎-风疹疫苗对流行性腮腺炎爆发的影响。儿科2012;130-e 1567–74。
96.Nelson GE,Aguon A,Valencia E,等,《2009-2010年关岛高度接种疫苗的岛屿人口中流行性腮腺炎爆发的流行病学和使用第三剂麻疹-腮腺炎-风疹疫苗控制爆发》。儿科传染病杂志2013;32:374–80.
97.莫里森JC,吉文斯JR,智慧WL,鱼SA。腮腺炎性卵巢炎:绝经过早的一个原因。Fertil Steril 197526:655–9.
98.Taparelli F,Squadrini F,De Rienzo B,米拉G,Fornaciari .从与卵巢炎相关的阴道分泌物中分离腮腺炎病毒j传染1988;17:255–8.
99.韦弗RJ,皮特里总氮。哺乳期女性腮腺炎性乳腺炎一例报告。印第安纳州医学协会,1958年;51:644–5.
100.李CM。腮腺炎引发的原发性病毒性乳腺炎。Va Med Mon 194673:327.
101.陶伯特角普林茨。青春期女性流行性腮腺炎及其对后期生殖功能的影响。妇产科国际月刊1969;167:23–7.
102.腮腺炎引起的胰腺炎。JAMA 1968203:1068–9.
103.Veghelyi PV。继发性胰腺炎。Am J Dis Child 194774:45–51.
104.流行性腮腺炎导致听力丧失。Arch Dis Child 198762:189–91.
105.Vuori M,Lahikainen EA,Peltonen T .与流行性腮腺炎有关的感音性耳聋:一项对298名患流行性腮腺炎的军人的研究。耳鼻喉科学报1962;55:231–6.
106.突发性耳聋后从内耳分离腮腺炎病毒。BMJ 1979;1:14–5.
107.拉塞尔RR,唐纳德JC。腮腺炎的神经并发症。BMJ 1958;2:27–30.
108.流行性腮腺炎的并发症。BMJ 1948;1:94–7.
109.威特·JJ,卡克默·奥。作为疫苗使用背景的美国流行性腮腺炎监测。1968年公共卫生代表;83:5–100.
110.米勒G,斯坦顿JB,吉本斯JL。副传染性脑脊髓炎及相关综合征:对某些特定发热的神经并发症的评论。Q J Med 195625:427–505.
111.疾病控制中心。流行性腮腺炎监测:1972年1月-1974年6月:DC华盛顿州:美国卫生、教育和福利部;1974.
112.普洛特金股份有限公司、鲁宾股份有限公司。腮腺炎疫苗。载于:Plotkin S,Orenstein W,Offit P,eds。疫苗。第五版。费城:桑德斯;2008:435–65.
113.西格尔M,富尔斯特HT,佩雷斯NS。母体病毒性疾病的胎儿死亡率比较:风疹、麻疹、腮腺炎、水痘和肝炎的前瞻性研究。英国医学杂志1966年;274:768–71.
114.妊娠急性腮腺炎感染后自然流产和早产的频率。Gynakol Geburtshilfliche Rundsch,2005年;45:39–43.
115.怀孕期间流行性腮腺炎。《西外科妇产科杂志》1953年;61:72–3.
116.水痘、麻疹、腮腺炎和肝炎后的先天性畸形。队列研究的结果。JAMA 1973226:1521–4.
117.柯林斯湾。儿童常见传染病的年龄发病率。公共卫生代表1929年;44:763–826.
118.疾病控制中心。流行性腮腺炎监测:美国卫生、教育和福利部,公共卫生服务;1972.
119.戈登·JE,《流行性腮腺炎流行病学十年》。Am J医学科学1949;218:338–59.
120.作为军事疾病的流行性腮腺炎。地中海临床北上午1918年;2:492–505.
121.疾病控制中心。腮腺炎疫苗。MMWR 1977;26:393–4.
122.科奇SL,普雷布鲁德SR,奥伦斯坦。美国流行性腮腺炎相对复苏的前景。Am J Dis Child 1988142:499–507.
123.疾病控制中心。流行性腮腺炎——美国,1985-1988年。MMWR 1989;38:101–5.
124.巴斯基AE,格拉瑟JW,勒巴隆CW。美国流行性腮腺炎的复发:意外因素的历史透视。疫苗2009;27:6186–95.
125.美国食品药品监督管理局。MMRV临床综述。可从以下网址获得http://www . FDA . gov/downloads/BiologicsBloodVaccines/vaccines/Approved/Products/UCM 123800 . pdf 。于2013年4月25日访问。
126.疾病控制中心。麻疹、腮腺炎、风疹和水痘联合疫苗的使用:免疫实践咨询委员会的建议(ACIP)。MMWR 2010;59(RR-3):1至12。
127.Redd SC,King GE,Heath JL等。9、12和15月龄接种麻疹-腮腺炎-风疹疫苗的比较。j感染疾病信息系统2004年;189(补编1):S116–22。
128.Mitchell LA,Tingle AJ,Decarie D,Lajeunesse C .健康婴儿对麻疹、流行性腮腺炎和风疹(MMR)疫苗的血清学反应:对麻疹和流行性腮腺炎成分无反应可能影响第二剂MMR的时机决定。Can J公共卫生1998;89:325–8.
129.Krober女士,斯特拉塞纳行政长官,低音JW。感冒婴儿接种麻疹-腮腺炎-风疹疫苗后麻疹抗体反应降低。JAMA 1991265:2095–6.
130.Hilleman MR,Buynak EB,Weibel RE,等。Moraten麻疹病毒疫苗的开发和评价。JAMA 1968206:587–90.
131.印度麻疹免疫的抗体反应。公牛世界卫生组织1984;62:737–41.
132.泛美卫生组织。拉丁美洲6-12个月大儿童麻疹疫苗接种诱导的血清转换率和麻疹抗体滴度。Rev Infect Dis 19835:596–605.
133.海地6-12个月婴儿对麻疹疫苗的反应。母体抗体、营养不良和并发疾病的影响。英国医学杂志1985年;313:544–9.
134.6个月、9个月和12个月婴儿接种麻疹和腮腺炎疫苗的免疫反应。j传染疾病研究所,2001年;184:817–26.
135.Watson JC,Pearson JA,Markowitz LE,等。学龄儿童麻疹疫苗再接种评估。儿科学1996;97:613–8.
136.波兰GA,Jacobson RM,Thampy AM,等。初次免疫后血清反应阴性儿童的麻疹再免疫。JAMA 1997277:1156–8.
137.Kumar ML,Johnson CE,Chui LW,等。麻疹血清阴性母亲的6个月婴儿对麻疹疫苗的免疫应答。1998年疫苗;16:2047–51.
138.甘斯·哈,李北·阿姆,加利纳斯·J,等。6个月大婴儿接种麻疹疫苗后体液免疫应答缺陷。JAMA 1998280:527–32.
139.美国早期2剂麻疹疫苗接种方案的体液和细胞介导免疫应答。j感染疾病信息系统2004年;190:83–90.
140.Johnson CE,Nalin DR,Chui LW,等。麻疹疫苗时代母亲所生6个月与15个月婴儿的麻疹疫苗免疫原性。儿科学1994;93:939–44.
141.Uzicanin A,Zimmerman L .含麻疹减毒活疫苗的现场效力:对已发表文献的综述。j传染疾病2011年;204:S133–48。
142.De Serres G,Boulianne N,Defay F,等。两剂方案的第一剂在12-14个月大时与15个月大时相比,麻疹风险更高。Clin Infect Dis 201255:395–402.
143.Yeung LF,Lurie P,Dayan G,等:美国一所高度接种疫苗的寄宿学校中的有限麻疹爆发。儿科2005;116:1287–91.
144.Vitek CR,Aduddell M,Brinton MJ,Hoffman RE,Redd SC。在麻疹爆发期间对先前接种了第二剂麻疹-腮腺炎-风疹疫苗的儿童增加保护。儿科传染病杂志1999;18:620–3.
145.在高度接种疫苗的中学人群中爆发麻疹。CMAJ 1996年;155:1407–13.
146.德塞勒斯G,布里安N,迈耶F,沃德BJ。麻疹疫苗在高接种率人群中爆发时的效力:接种疫苗至18个月时,保护作用随年龄增加而增加。流行病传染1995年;115:315–23.
147.Lynn TV,Beller M,Funk EA,等。在一次爆发期间,高中生接种2剂含麻疹疫苗与接种1剂疫苗相比的增量效果。j感染疾病信息系统2004年;189:S86–90。
148.马科维兹勒,普雷布鲁德老,罚款体育,奥伦斯坦瓦。麻疹活疫苗诱导免疫的持续时间。儿科传染病杂志1990;9:101–10.
149.勒巴隆·CW,比勒·J,沙利文·BJ,等。在消除后环境中接种2剂麻疹疫苗后麻疹抗体的持久性。2007年儿科和青少年医学;161:294–301.
150.疫苗接种队列中麻疹、腮腺炎和风疹抗体的持续性:20年随访。j传染疾病2008年;197:950–6.
151.Markowitz LE,Albrecht P,Orenstein WA,等。再次接种后麻疹抗体的持久性。j传染疾病1992年;166:205–8.
152.沃德·BJ、布丽安·N、拉特纳姆·S等:麻疹疫苗失败时的细胞免疫:尽管再次接种后血清抗体产生有限,但显示出麻疹抗原特异性淋巴细胞增殖反应。j传染疾病调查1995年;172:1591–5.
153.埃德曼DD,希斯JL,沃森JC,马科维茨勒,贝利尼WJ。初次和二次疫苗接种及自然病毒感染后对麻疹病毒的免疫球蛋白M抗体反应。医学病毒学杂志1993;41:44–8.
153.Gershon AA,Frey HM,Borkowsky W,Steinberg S .风疹减毒活疫苗:对HPV-77–DE5和RA 27/3株反应的比较。Am J医学科学1980;279:95–7.
154.勒布维耶冰川,普洛特金山。风疹疫苗RA 27-3的沉淀素反应。J Infect Dis 1971123:220–3.
155.Weibel RE,Villarejos VM,Klein EB,等。RA 27/3和人乳头瘤病毒77-DE风疹病毒减毒活疫苗的临床和实验室研究。1980年生物医学进展;165:44–9.
156.勒曼SJ,博林杰M,布伦肯JM。麻疹、流行性腮腺炎和风疹(HPV-77:DE-5和RA 27/3)病毒疫苗(单独和联合)的临床和血清学评估。儿科学1981;68:18–22.
157.新分娩妇女接种风疹疫苗后的中和抗体:三种疫苗的比较。Scand J Infect Dis 19757:169–72.
158.弗雷斯通DS,雷诺GM,麦金农JA,Prydie J。女学生接种风疹疫苗。达德利市13岁女学生的血清学状态评估和Wistar RA 27/3与Cendehill株风疹减毒活疫苗的比较试验。Br J Prev Soc Med 197529:258–61.
159.Weibel RE,Carlson AJ Jr,Villarejos VM,等。使用RA 27/3风疹病毒的麻疹、腮腺炎和风疹联合活疫苗的临床和实验室研究。1980年生物医学进展;165:323–6.
160.不同麻疹、流行性腮腺炎和风疹联合疫苗初次和再次接种后的免疫应答。疫苗2000;18:1382–92.
161.Singh R,John TJ,Cherian T,Raghupathy P .在9、12和15个月龄时对麻疹、腮腺炎和风疹疫苗的免疫反应。印度医学研究杂志1994;100:155–9.
162.Gatchalian S,Cordero-Yap L,Lu-Fong M,等:一项随机对比试验,旨在评估一种新型麻疹腮腺炎风疹(MMR)疫苗在12-24个月龄时首次接种时的反应原性和免疫原性。东南亚J Trop Med公共卫生1999;30:511–7.
163.福格尔A,莫什科维茨A,兰农L,法院CB。成年女性和青春期女性接种RA 27–3和Cendehill风疹疫苗的比较试验。1971年美国流行病学杂志;93:392–8.
164.LeBaron CW,Forghani B,Matter L,等。接种2剂麻疹-腮腺炎-风疹疫苗后风疹抗体的持久性。J Infect Dis 2009200:888–99.
165.Johnson CE,Kumar ML,Whitwell JK,等。初次接种麻疹-腮腺炎-风疹疫苗后的抗体持久性以及在4-6岁和11-13岁时接种第二剂疫苗的反应。儿科传染病杂志1996;15:687–92.
166.小克雷默,施耐德F,穆勒CP。麻疹和风疹疫苗接种者的抗体减弱——一项纵向研究。疫苗2006;24:2594–601.
167.意大利军队中的麻疹-腮腺炎-风疹疫苗。JAMA 2000284:2059.
168.台湾流行期间德国麻疹的预防。HPV-77和RA 27–3风疹疫苗,皮下和鼻内接种,HPV-77疫苗与腮腺炎和/或麻疹疫苗混合。Am J Dis Child 1969118:301–6.
169.流行期间的风疹疫苗接种。JAMA 1970213:987–90.
170.RA27/3风疹疫苗的历史。Rev Infect Dis 19857(补编1):S77–8。
171.希拉里IB,格里菲斯啊。皮下注射Wistar 27/3株风疹减毒活疫苗15年后风疹抗体的持久性。疫苗1984;2:274–6.
172.霍斯特曼DM,施吕德伯格A,埃蒙斯JE,等。风疹疫苗诱导免疫反应的持久性:与自然感染的比较。Rev Infect Dis 19857(补编1):S80–5。
173.自然免疫和接种疫苗的年轻人风疹抗体的长期随访研究。1994年疫苗;12:41–5.
174.Buynak EB,Hilleman先生腮腺炎减毒活疫苗。1.疫苗开发。1966年生物医学进展;123:768–75.
175.Klinge J,Lugauer S,Korn K,Heininger U,Stehr K .在9-11、12-14或15-17个月龄接种麻疹、腮腺炎和风疹(MMR)疫苗的德国儿童中免疫原性和反应原性的比较。疫苗2000;18:3134–40.
176.Schwarz AJ,Jackson JE,Ehrenkranz NJ等。新型麻疹-腮腺炎-风疹三价疫苗的临床评价。Am J Dis Child 1975129:1408–12.
177.两种麻疹、腮腺炎和风疹联合疫苗引起的免疫反应的安全性和特征。1998年疫苗;16:298–304.
178.Popow-Kraupp T,Kundi M,Ambrosch F,Vanura H,Kunz C .在幼儿中评估两种腮腺炎-麻疹减毒活疫苗(Urabe Am 9-Schwarz和Jeryl Lynn-Moraten)的对照试验。医学病毒学杂志1986;18:69–79.
179.博格诺·JM,格雷贝尔·R,索拉里·G,等。麻疹-流行性腮腺炎-风疹联合疫苗的现场试验智利188名儿童的免疫接种令人满意。1973年临床儿科杂志;12:170–2.
180.一种新的麻疹-腮腺炎-风疹联合活疫苗在多米尼加共和国的临床评价。公牛世界卫生组织1975;52:81–5.
181.一种新型麻疹、腮腺炎和风疹减毒活疫苗在健康儿童中的反应原性和免疫原性。儿科传染病杂志1999;18:42–8.
182.Usonis V,Bakasenas V,Chitour K,Clemens R .新的和已建立的麻疹、腮腺炎和风疹疫苗在健康儿童中的反应原性和免疫原性的比较研究。感染1998;26:222–6.
183.Feiterna-Sperling C,Bronnimann R,Tischer A,等.一项比较新型麻疹-腮腺炎-风疹疫苗与许可疫苗在12-24个月儿童中的免疫原性和安全性的开放随机试验。儿科传染病杂志2005;24:1083–8.
184.Hilleman先生,Buynak EB,Weibel RE,Stokes J Jr .腮腺炎减毒活疫苗。英国医学杂志1968;278:227–32.
185.Weibel RE,Stokes J Jr,Buynak EB,Whitman JE Jr,Hilleman腮腺炎减毒活疫苗。3.现场评估中的临床和血清学方面。英国医学杂志1967年;276:245–51.
186.LeBaron CW,Forghani B,Beck C,等。接种2剂麻疹-腮腺炎-风疹疫苗后腮腺炎抗体的持久性。J Infect Dis 2009199:552–60.
187.戈瑟福斯L,博格斯特伦E,拜克曼m。12岁儿童接种第二剂麻疹、腮腺炎和风疹疫苗的免疫原性和反应原性。Scand J感染Dis 200133:545–9.
188.Broliden K,Abreu ER,Arneborn M,Bottiger M .第一代12岁儿童接种MMR疫苗前后的腮腺炎免疫接种提供了两剂免疫方案。1998年疫苗;16:323–7.
189.Hilleman先生,Weibel RE,Buynak EB,Stokes J Jr,Whitman JE Jr .腮腺炎减毒活疫苗。四。在现场评估中测量的保护效力。英国医学杂志1967年;276:252–8.
190.建议WC,手指JA,莱文RH,帕加诺JS。流行性腮腺炎病毒活疫苗现场评价。《儿科杂志》1968年;72:461–6.
191.Kim-Farley R,Bart S,Stetler H,等。临床流行性腮腺炎疫苗效力。1985年美国流行病学杂志;121:593–7.
192.Chaiken BP,Williams NM,Preblud SR,Parkin W,Altman R.《入学法对学区内流行性腮腺炎活动得影响》.JAMA 1987257:2455–8.
193.Wharton M,Cochi SL,哈奇森RH,Bistowish JM,Schaffner W .疫苗后时代的流行性腮腺炎大爆发。j传染Dis 1988158:1253–60.
194.Hersh BS,Fine PE,Kent WK,等:高度接种人群中流行性腮腺炎爆发。《儿科杂志》1991年;119:187–93.
195.Sullivan KM,Halpin TJ,Marks JS,Kim-Farley R。学校流行性腮腺炎疫苗爆发的有效性。Am J Dis Child 1985139:909–12.
196.齐克·JE,拜伦·R,阿特拉斯·H,威尔逊·DL,克里德RD Jr .高度接种疫苗的学校人群中流行性腮腺炎爆发。大规模疫苗接种失败的证据。1995年儿科和青少年医学;149:774–8.
196.Marin M,Quinlisk P,Shimabukuro T,等。大学生中流行性腮腺炎疫苗接种覆盖率和疫苗有效性——爱荷华州,2006年。疫苗2008;26:3601–7.
197.Chamot E,Toscani L,Egger P,Germann D,bour quin c .[在(瑞士)日内瓦州流行性腮腺炎期间对三种流行性腮腺炎疫苗的效力的评估]。1998年公共卫生流行病;46:100–7.
198.托斯卡尼L,巴特M,布维耶P,施莱普费尔a。不同株腮腺炎疫苗效力的比较:一项学校调查。Soz Praventivmed 1996年;41:341–7.
199.Harling R,White JM,Ramsay ME,Macsween KF,van den Bosch c . MMR疫苗中腮腺炎成分的有效性:一项病例对照研究疫苗2005;23:4070–4.
200.科恩C,怀特JM,萨维奇EJ等,《2004-2005年英国流行性腮腺炎爆发的疫苗有效性评估》。2007年紧急传染病;13:12–7.
201.Sartorius B,Penttinen P,Nilsson J,等,《2004年2月至4月瑞典流行性腮腺炎爆发》。2005年欧洲监测;10:191–3.
202.Castilla J,Garcia Cenoz M,Arriazu M,等。含Jeryl Lynn疫苗在西班牙儿童中的有效性。疫苗2009;27:2089–93.
203.理查德JL,Zwahlen M,Feuz M,物质HC。1999年和2000年瑞士流行性腮腺炎爆发期间两种疫苗有效性的比较:一项病例队列研究。2003年欧洲流行病学杂志;18:569–77.
204.刘易斯JE,车尔尼斯基马,罗尔斯ML,罗尔斯WE。部分免疫人群流行性腮腺炎。加拿大医学协会杂志1979年;121:751–4.
205.施莱格尔M,奥斯特瓦尔德JJ,加利亚齐RL,韦尔纳扎PL。瑞士东部疾病暴发期间三种流行性腮腺炎疫苗的比较效力:队列研究。BMJ 1999年;319:352.
206.Domínguez A,Torner N,Castilla J,等:《高度免疫人群中流行性腮腺炎疫苗的有效性》。疫苗2010;28:3567–70.
207.Snijders BE,Lier AV,van de Kassteele J,等。流行性腮腺炎疫苗在小学和家庭中的有效性,荷兰,2008年。疫苗2012;2999–3002.
208.Deeks SL,Lim GH,Simpson MA,等。加拿大流行性腮腺炎爆发期间按剂量评估疫苗有效性。CMAJ 2011;183:1014–20.
209.夏令营爆发期间既往接种腮腺炎疫苗的有效性。儿科2007;120:e862–8。
210.流行性腮腺炎爆发期间大学生接种流行性腮腺炎疫苗的效果。Clin Infect Dis 200846:1172–80.
211.汉纳-瓦基姆R,安川二世,宋平,李北AM,甘夏。儿童期接种过流行性腮腺炎疫苗的成人的免疫应答。j传染疾病2008年;197:1669–75.
212.Jokinen S,Osterlund P,Julkunen I,Davidkin I .接种麻疹-腮腺炎-风疹疫苗21年后年轻人对腮腺炎病毒的细胞免疫。j传染疾病2007年;196:861–7.
213.Vandermeulen C,Clement F,Roelants M,等。在末次疫苗接种后16年内,在有或无循环抗体的接种个体中对流行性腮腺炎的细胞免疫的评估。J Infect Dis 2009199:1457–60.
214.暴露于自然麻疹后的麻疹疫苗接种。《儿科杂志》1978年;93:43–6.
215.Sakuta H,Sawada S,Kuroki Y .接触后意外接种疫苗患者的麻疹严重程度。日本传染病学会2008;61:304–6.
216.在新南威尔士州预防麻疹接触的有效性。《2009年新南威尔士州公共卫生报告》;20:81–5.
217.沃森胃肠。不含丙种球蛋白的减毒疫苗对暴露于麻疹后的保护作用。BMJ 1963;1:860–1.
218.国王葛,马科维兹勒,柏特莱卡PA,戴尔LG。1990年麻疹流行期间麻疹疫苗的临床效果。儿科传染病杂志1991;10:883–8.
219.Rice P,Young Y,Cohen B,Ramsay M .接触麻疹病毒后的MMR免疫接种。柳叶刀2004;363:569–70.
220.Barrabeig I,Rovira A,Rius C,等:《麻疹疫苗对控制暴露儿童的有效性》。儿科传染病杂志2011;30:78–80.
221.阿迪斯总干事,伯格JL,戴维斯太平绅士。麻疹爆发期间,对先前接种过疫苗的麻疹患儿兄弟姐妹进行再接种。j传染Dis 1988157:610–1.
222.在大学人群中接种两次麻疹-腮腺炎-风疹(MMR)疫苗后腮腺炎抗体的长期持久性和第三次MMR疫苗后的抗体应答。j传染疾病2008年;197:1662–8.
223.布雷尼亚埃,库珀尔,卡布拉尔HJ,佩尔顿西。HIV感染儿童对麻疹和风疹疫苗的抗体反应。获得性免疫缺陷综合征1993;6:1125–9.
224.莫斯WJ,克莱门茨首席法官,哈尔西纳。对有感染人类免疫缺陷病毒风险的儿童进行免疫接种。公牛世界卫生组织2003;81:61–70.
225.接种人类免疫缺陷病毒1型感染儿童的麻疹抗体。儿科学1996;97:653–7.
226.人类免疫缺陷病毒感染儿童免疫接种后麻疹抗体滴度下降儿科传染病杂志1995;14:149–51.
227.在HIV-1垂直感染的儿童中,HAART的时机决定了记忆B细胞的完整性和体液反应的持久性。美国国家科学院院刊2009;106:7939–44.
228.Lima M,De Menezes Succi RC,Nunes Dos Santos AM,等。人类免疫缺陷病毒1型感染儿童的风疹免疫接种:疫苗接种策略中值得关注的原因。儿科传染病杂志2004;23:604–7.
229.Farquhar C,Wamalwa D,Selig S,等.肯尼亚人类免疫缺陷病毒1型(HIV-1)感染儿童在高效抗逆转录病毒治疗和再接种前后对麻疹和破伤风疫苗的免疫应答儿科传染病杂志2009;28:295–9.
230.扎卡雷利-菲洛·卡,奥诺·E,马查多·DM,等:接受高效抗逆转录病毒治疗的HIV-1感染儿童:三种不同病毒抑制水平的免疫学特征。cytomy B Clin cytom2007;72:14–21.
231.Aurpibul L,Puthanakit T,Siriaksorn S,Sirisanthana T,Sirisanthana V .在高效抗逆转录病毒治疗后免疫恢复的HIV感染儿童中麻疹保护性抗体的患病率。2006年艾滋病毒医学;7:467–70.
232.接受高效抗逆转录病毒治疗的HIV感染儿童麻疹疫苗再接种后的免疫原性、免疫记忆和安全性。J Infect Dis 2012206:512–22.
233.Siberry,Liu L,Bellini,等。美国学龄儿童和青少年感染HIV后对麻疹、腮腺炎和风疹的免疫力。可从以下网址获得http://regis 2 . virology . education . com/2012/4 HIV/Ped/21 _ July . html/ .
234.Aurpibul L,Puthanakit T,Sirisanthana T,Sirisanthana V .高活性抗逆转录病毒治疗后免疫恢复的HIV感染儿童对麻疹、腮腺炎和风疹再接种的反应。Clin Infect Dis 200745:637–42.
235.Bekker V,Scherpbier H,Pajkrt D,等:“接受高效抗逆转录病毒疗法治疗的HIV-1感染儿童的持续性体液免疫缺陷:针对减毒疫苗株和自然病毒感染的特异性抗体的丢失”。儿科2006;118:e315–22。
236.梅尔文AJ,莫汉KM。感染人类免疫缺陷病毒1型并接受高效抗逆转录病毒治疗的儿童对麻疹、破伤风和b型流感嗜血杆菌疫苗的免疫应答。儿科2003;111:e641–4。
237.高效抗逆转录病毒疗法对人类免疫缺陷病毒感染儿童额外麻疹疫苗接种血清学反应的影响。Clin Infect Dis 200132:1090–4.
238.接受抗逆转录病毒治疗的HIV感染儿童再次接种疫苗3年后麻疹、腮腺炎和风疹保护性抗体的持续性。Clin Infect Dis 201050:1415–8.
239.默克公司M-M-R II(麻疹、腮腺炎和风疹病毒活疫苗);2009.
240.默克公司ProQuad(麻疹、腮腺炎、风疹和水痘病毒疫苗活冻干制剂,用于皮下注射)。2011.
241.新霉素敏感性和MMR疫苗。JAMA 1981245:571.
242.詹姆斯JM,伯克苏,罗伯逊峰,桑普森哈。对鸡蛋过敏的儿童安全接种麻疹疫苗。英国医学杂志1995;332:1262–6.
243.法萨诺MB,伍德拉,库克SK,桑普森哈。鸡蛋过敏和对麻疹、腮腺炎和风疹疫苗的不良反应。《儿科杂志》1992年;120:878–81.
244.对鸡蛋蛋白有临床反应的儿童麻疹免疫接种。Am J Dis Child 1990144:33–5.
245.凯尔索JM,琼斯RT,永金格JW。IgE对明胶介导的麻疹、腮腺炎和风疹疫苗过敏反应。变态反应临床免疫学杂志1993;91:867–72.
246.对麻疹和腮腺炎疫苗有立即型反应的儿童中明胶的IgE抗体。变态反应临床免疫学杂志1995;96:563–5.
247.Sakaguchi M,Nakayama T,Inouye S .儿童对明胶的食物过敏,包括对疫苗的过敏反应。变态反应临床免疫学杂志1996;98:1058–61.
248.当前与风疹疫苗相关的一些问题。JAMA 1985254:253–6.
249.疾病控制中心。怀孕期间接种风疹疫苗——美国,1971-1988年。MMWR 1989;38:289–93.
250.图基PA,琼斯G,米勒BH,佩卡姆CS。怀孕期间接种风疹疫苗。1991年英国版CDR1:R86–8。
251.Badilla X,Morice A,Avila-Aguero ML,等。妊娠期接种风疹疫苗与胎儿风险相关。儿科传染病杂志2007;26:830–5.
252.Hamkar R,Jalilvand S,Abdolbaghi MH,等。孕妇意外接种风疹疫苗:对风疹疫苗可能经胎盘感染的评估。疫苗2006;24:3558–63.
253.达席尔瓦和萨GR .卡马乔拉,西奎拉毫米,斯塔沃拉女士,费雷拉达。2001-2002年巴西里约热内卢州意外接种风疹疫苗后孕妇的血清流行病学特征。泛美公共卫生杂志。Am J公共卫生2006;19:371–8.
254.接种风疹疫苗后的妊娠结局:一项前瞻性对照研究。2004年美国医学遗传学博士;130 a:52–4。
255.接种疫苗和未接种疫苗妇女的风疹抗体滴度和孕期接种疫苗的结果。Rev Infect Dis 19857(补编1):S103–7。
256.疾病控制中心。关于免疫接种的一般性建议——免疫接种实践咨询委员会的建议(ACIP)。MMWR 2011;60(编号RR-2)。
257.细针穿刺活检诊断为艾滋病的亚急性麻疹脑炎。一份病例报告。细胞学报1998;42:729–33.
258.麻疹病毒疫苗株引起的麻疹包涵体脑炎。Clin Infect Dis 199929:855–61[案例报告]。
259.巴兰,冈萨雷斯-戈麦斯I,谢,等。婴儿亚急性硬化性全脑炎:病毒基因组分析的诊断作用。Ann Neurol 199436:103–8.
260.免疫球蛋白对麻疹和风疹免疫的干扰。《儿科杂志》1993年;122:204–11.
261.王戈,马科维兹勒,希斯J,等。轻度疾病儿童接种麻疹-流行性腮腺炎-风疹联合疫苗时的抗体反应。JAMA 1996275:704–7.
261.无热上呼吸道感染儿童接种麻疹-腮腺炎-风疹疫苗后的麻疹和风疹抗体反应。《儿科杂志》1995年;127:432–4.
262.上呼吸道感染儿童接种麻疹-流行性腮腺炎-风疹-水痘联合疫苗的血清转换率。儿科学1994;94:514–6.
263.Nieminen U,Peltola H,Syrjala MT,Makipernaa A,Kekomaki R .接种麻疹、腮腺炎和风疹疫苗后的急性血小板减少性紫癜。23例患者报告。1993年《新闻学报》;82:267–70.
264.Beeler J,Varricchio F,Wise R .麻疹疫苗免疫后的血小板减少症:疫苗不良事件报告系统回顾(1990年至1994年)儿科传染病杂志1996;15:88–90.
265.特发性血小板减少性紫癜和MMR疫苗。Arch Dis Child 200184:227–9.
266.慢性特发性血小板减少性紫癜MMR免疫接种安全吗?Arch Dis Child 200893:354–5.
267.France EK,Glanz J,Xu S,等。儿童接种麻疹-腮腺炎-风疹疫苗后发生免疫性血小板减少性紫癜的风险。儿科2008;121:e687–92。
268.德拉克特曼RA,墨菲S,艾丁格LJ。麻疹-腮腺炎-风疹免疫接种后慢性特发性血小板减少性紫癜加重。1994年国际儿科医学;148:326–7.
269.Vlacha V,Forman EN,Miron D,Peter G .反复接种麻疹-腮腺炎-风疹疫苗后复发性血小板减少性紫癜。儿科学1996;97:738–9.
270.Stowe J,Kafatos G,Andrews N,Miller E .特发性血小板减少性紫癜和MMR的第二剂。Arch Dis Child 200893:182–3.
271.贝尔科维奇·斯达尔:麻疹、丙种球蛋白改良麻疹和减毒麻疹疫苗对儿童结核病治疗过程的影响。儿科1965;35:97–102.
272.布里克曼高频,博德里哲学博士,马克米。结核菌素试验的时机与活病毒疫苗免疫接种的关系。儿科1975;55:392–6.
273.1型脊髓灰质炎活疫苗和其他病毒对结核菌素试验的影响。英国医学杂志1966年;274:67–72.
274.维斯特加德M,Hviid A,麦德森KM,等。MMR疫苗接种和热性惊厥:易感亚组和长期预后的评估。JAMA 2004292:351–7.
275.首次热性惊厥的危险因素:一项配对病例对照研究。癫痫1995年;36:334–41.
276.Dos Santos BA,Ranieri TS,Bercini M,等。三种麻疹-腮腺炎-风疹联合疫苗的不良反应潜力评估。泛美公共卫生杂志。Am J公共卫生2002;12:240–6.
277.Peltola H,Heinonen OP .麻疹-腮腺炎-风疹疫苗的真实不良反应频率。在双胞胎中进行的双盲安慰剂对照试验。柳叶刀1986;1:939–42.
278.罗兰兹DF,弗雷斯通ds。在读易感女生接种风疹疫苗。j . Hyg(Lond)1971年;69:579–86.
279.Tingle AJ,Mitchell LA,Grace M,等.关于血清反应阴性妇女风疹免疫副作用的随机双盲安慰剂对照研究。柳叶刀1997;349:1277–81.
280.Grillner L,Hedstrom CE,博格斯特伦,等。新分娩妇女的风疹疫苗接种。Scand J Infect Dis 19735:237–41.
281.勒巴隆·CW,Bi D,沙利文·BJ,贝克C,加尔吉尤罗p .对麻疹-腮腺炎-风疹疫苗第一剂和第二剂相关的潜在常见不良事件的评估。儿科2006;118:1422–30.
282.医学研究所。关于风疹疫苗与关节炎、神经根炎和血小板减少性紫癜的证据。在:豪森CP,豪CJ,Fineberg HV,eds。百日咳和风疹疫苗的副作用:百日咳和风疹疫苗副作用审查委员会的报告。DC华盛顿:国家科学院出版社;1991:187–205.
283.医学研究所。麻疹和腮腺炎疫苗。在:斯特拉顿KR,豪CJ,约翰斯顿RB,Jr,编辑。与儿童疫苗相关的不良事件与因果关系有关的证据。DC华盛顿:国家科学院出版社;1994:118–86.
284.医学研究所。免疫安全性回顾:麻疹-腮腺炎-风疹疫苗与自闭症。Stratton K,Gable A,Shetty P,McCormick M。DC华盛顿:国家科学院出版社;2001.
285.医学研究所。免疫安全评论:疫苗和自闭症。DC华盛顿:国家科学院出版社;2004.
286.医学研究所。麻疹、腮腺炎和风疹疫苗。疫苗的副作用:证据和因果关系。DC华盛顿:美国国家学院出版社;2012: 103–237.
287.Patja A,Makinen-Kiljunen S,Davidkin I,Paunio M,Peltola H .对麻疹-腮腺炎-风疹疫苗接种的过敏反应。儿科2001;107:E27。
288.Pool V,Braun MM,Kelso JM等:美国接种麻疹-腮腺炎风疹疫苗后过敏反应人群中抗明胶IgE抗体的患病率儿科学2002;110:e71。
289.D’Souza RM,Campbell-Lloyd S,Isaacs D,等.与1998年澳大利亚麻疹控制运动相关的免疫接种后不良事件。2000年智力共同体;24:27–33.
290.Bohlke K,Davis RL,Marcy SM,等。儿童和青少年接种疫苗后过敏反应的风险。儿科2003;112:815–20.
291.一种主动监测白喉/破伤风/百日咳和麻疹/腮腺炎/风疹疫苗不良事件的新方法。柳叶刀1995;345:567–9.
292.接受全细胞百日咳或麻疹、腮腺炎和风疹疫苗后癫痫发作的风险英国医学杂志2001;345:656–61.
293.疫苗安全数据链项目:改善美国疫苗安全监控的新工具。疫苗安全数据链团队。儿科学1997;99:765–73.
294.Griffin MR,Ray WA,Mortimer EA,Fenichel GM,Schaffner W .麻疹-腮腺炎-风疹免疫接种后癫痫发作的风险。儿科学1991;88:881–5.
295.Jacobsen SJ,Ackerson BK,Sy LS,等:《在管理保健环境中接种首剂MMRV疫苗后热性惊厥的安全性观察研究》。疫苗2009;27:4656–61.
296.麻疹-腮腺炎-风疹-水痘联合疫苗与热性惊厥的风险。儿科2010;126:E1–8。
297.4-6岁儿童麻疹疫苗和热性惊厥。儿科2012;129:809–14.
298.波尔克BF,莫德林JF,白JA,迪吉罗拉米电脑。接受两种风疹疫苗之一的妇女的关节反应的对照比较。1982年美国流行病学杂志;115:19–25.
299.库珀LZ,Ziring公关,韦斯HJ,事项巴,克鲁格曼s。风疹疫苗接种后的短暂性关节炎。Am J Dis Child 1969118:218–25.
300.Dudgeon JA,Marshall WC,Peckham CS。成人和儿童风疹疫苗试验。三种减毒疫苗的比较。Am J Dis Child 1969118:237–43.
301.马歇尔WC,佩卡姆CS,达比CP,Dudgeon JA,霍金斯GT。成人和儿童风疹疫苗的进一步研究。从业者1971;207:632–8.
302.Mustafa MM,Weitman SD,Winick NJ,等.免疫功能低下的年轻宿主的亚急性麻疹脑炎:聚合酶链反应诊断和利巴韦林治疗的两例病例报告及文献回顾。Clin Infect Dis 199316:654–60[案例报告回顾]。
303.Abedi GR,Mutuc JD,Lawler J,等。在流行性腮腺炎爆发中接种第三剂麻疹、腮腺炎和风疹疫苗后的不良事件。疫苗2012;30:7052–8.
304.Palumbo P,Hoyt L,Demasio K,Oleske J,Connor E .基于人群的人类免疫缺陷病毒感染儿童麻疹和麻疹免疫研究。儿科传染病杂志1992;11:1008–14.
305.人类免疫缺陷病毒感染儿童的麻疹和麻疹免疫。JAMA 1989261:2512–6.
306.卡普兰LJ,道姆RS,斯马龙M,麦卡锡CA。免疫低下患者的严重麻疹。JAMA 1992267:1237–41.
307.纽约市的弗里德曼麻疹。JAMA 1991266:1220.
308.疾病控制中心。1993年1例HIV感染患者接种麻疹-腮腺炎-风疹疫苗后发生麻疹肺炎。MMWR 1996年;45:603–6.
309.米特斯A,霍洛韦A,埃文斯AE,恩德斯JF。急性白血病儿童麻疹减毒疫苗。Am J Dis Child 1962103:413–8.
310.莫纳弗·WJ、哈斯拉姆·DB、罗伯特·RL等在一名先天性免疫缺陷儿童接种疫苗后传播麻疹感染。《儿科杂志》1994年;124:273–6.
311.Mawhinney H,Allen IV,Beare JM等:播散性麻疹并发的异常丙种球蛋白血症。BMJ 1971;2:380–1.
312.人类免疫缺陷病毒感染成人对麻疹-风疹疫苗接种的反应。获得性免疫缺陷综合征1993;6:1013–6.
313.McLaughlin M,Thomas P,Onorato I,等。人类免疫缺陷病毒感染儿童的活病毒疫苗:一项回顾性调查。儿科1988;82:229–33.
314.莫斯·WJ,斯科特·S,穆加拉·N等。标准滴度麻疹疫苗在感染和未感染HIV-1病毒的赞比亚儿童中的免疫原性:一项观察性研究。j传染疾病2007年;196:347–55.
315.对马拉维感染HIV和未感染HIV的儿童在6个月和9个月大时接种两剂麻疹疫苗的免疫反应进行评估。j传染疾病2008年;198:1457–65.
316.大剂量埃德蒙斯顿-萨格勒布麻疹疫苗在HIV-1感染儿童中的安全性和免疫原性。卢旺达基加利的一项队列研究。Am J Dis Child 1992146:550–5.
317.斯科特·P、莫斯·WJ、吉拉尼·Z,《HIV感染儿童的麻疹疫苗接种:安全性和免疫原性的系统综述和荟萃分析》。j传染疾病2011年;204(补编1):S164–78。
318.疾病控制中心。1993年修订的艾滋病毒感染分类系统和扩大的青少年和成人艾滋病监测病例定义。MMWR 1992年;41(RR-17):1–19。
319.疾病控制中心。1994年13岁以下儿童人体免疫缺陷病毒感染订正分类系统;官方授权附录:人类免疫缺陷病毒感染编码和官方指南编码和报告ICD-9-CM。MMWR 1994年;43(RR-12):1–10。
320.美国卫生与公众服务部。国家疫苗伤害赔偿计划。可从以下位置获得:http://www.hrsa.gov/vaccinecompensation/index.html.
321.美国卫生与公众服务部。VAERS疫苗接种后可报告事件表。可从以下网址获得http://vaers . hhs . gov/resources/VAERS _ Table _ of _ Reportable _ Events _ Following _ vaccine . pdf 。访问时间为2013年3月21日。
322.麦克奎蓝GM,克鲁森-莫兰D,海德TB,等。1999-2004年美国人群麻疹抗体血清流行率。j传染疾病2007年;196:1459–64.
323.静脉注射免疫球蛋白中的麻疹病毒中和抗体。j传染疾病2006年;194:781–9.
324.陈RT,马科维兹勒,Albrecht P,等。麻疹抗体:保护性滴度的再评价。j传染疾病,1990年;162:1036–42.
325.美国食品药品监督管理局。血液制品咨询委员会会议纪要。美国免疫球蛋白产品中的麻疹抗体水平。2007.可从以下网址获得http://www . FDA . gov/ohrms/dockets/AC/07/minutes/2007-4317m . htm。访问时间为2013年3月21日。
326.加利福尼亚州Janeway。浓缩人血清丙种球蛋白在预防和减轻麻疹中的应用。布尔纽约医学院1945年;21:202–22.
327.奥德曼CW,詹宁斯CG,珍妮薇CA。对人血浆分离产物的化学、临床和免疫学研究。十二。使用浓缩的正常人血清丙种球蛋白(人免疫血清球蛋白)预防和减弱麻疹。J Clin Invest 194423:541–9.
328.斯托克斯J,马里斯EP,盖利斯SS。对人血浆分离产物的化学、临床和免疫学研究。Xi。浓缩正常人血清丙种球蛋白(人免疫血清球蛋白)在预防和治疗麻疹中的应用。J Clin Invest 194423:531–40.
329.Endo A,Izumi H,宫下M,等。免疫球蛋白暴露后预防麻疹的近期疗效。2001年儿科杂志;138:926–8.
330.列侬JL,佛罗里达州黑人。疫苗保护母亲时代的母系麻疹免疫。《儿科杂志》1986年;108:671–6.
331.詹克斯·PJ,首席执行官,房间美联社。自然感染和接种疫苗的母亲的孩子中母系来源的麻疹免疫。流行病传染1988年;101:473–6.
332.Pabst HF,Spady DW,Marusyk RG等降低了接种良好人群中婴儿的麻疹免疫力。儿科传染病杂志1992;11:525–9.
333.利文斯顿G,科恩DUS。出生率降至历史新低;移民的下降幅度最大。2012.可从以下网址获得http://www . pewssocial trends . org/2012/11/29/u-s-出生率下降创纪录-低下降是移民中最大的/。访问时间为2013年3月21日。
334.消除麻疹时期母亲麻疹抗体的早期减弱:纵向研究。Br Med J. 2010340:c1626。
335.周,Reef S,Massoudi M,等。美国当前麻疹-流行性腮腺炎-风疹两剂疫苗接种计划的经济学分析。j感染疾病信息系统2004年;189(补编1):S131–45。
336.初次风疹病毒感染和疫苗接种后的体液免疫反应。Clin疫苗免疫2007;14:644–7.
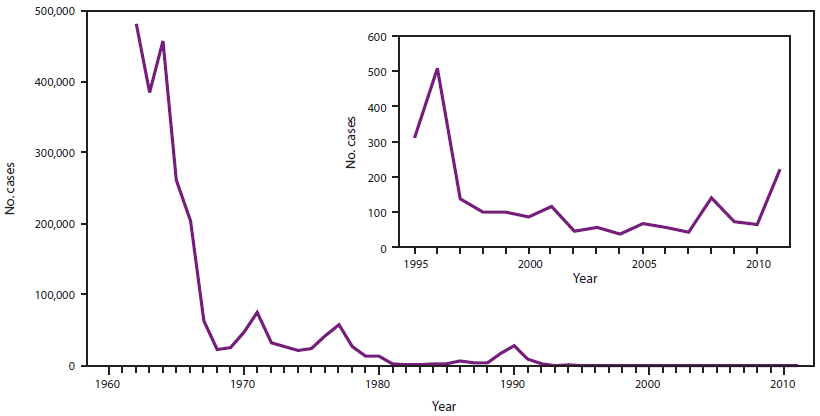
图1.1962年至2011年美国麻疹病例数
来源:提供的麻疹数据由州卫生部门自愿报告给CDC。
替代文本:这个数字提供了美国从1962年到2011年的麻疹病例数。在引入1剂麻疹疫苗接种计划后,20世纪60年代末和70年代初报告的麻疹病例数下降至每年约22,000-75,000例。
图2.1966-2011年美国风疹和先天性风疹综合征(CRS)病例数
来源:提供的风疹和CRS数据由州卫生部门自愿报告给CDC。
*按出生年份。
来源:提供的流行性腮腺炎数据由州卫生部门自愿报告给CDC。
替代文本:该图概述了自1966年以来以锯齿状线条显示的风疹病例数和以实线显示的CRS病例数。在1969年获得许可和推荐使用后,风疹和CRS病例数量急剧下降。然而,在20世纪70年代末和90年代初,由于未接种人群中的暴发,发病率增加。
图3.1968年至2011年美国流行性腮腺炎病例数
替代文本:这个数字提供了美国从1968年到2011年的腮腺炎病例数。自1967年引入流行性腮腺炎活疫苗并于1977年推荐常规疫苗接种后,报告的流行性腮腺炎病例稳步下降。
表1.MMR-II疫苗中麻疹、风疹和腮腺炎成分的免疫应答(血清转换)、疫苗效力和免疫持续时间总结*
表2.麻疹、腮腺炎和风疹(MMR)以及麻疹、腮腺炎、风疹和水痘(MMRV)疫苗的储存要求*
表3.可接受的麻疹、风疹和腮腺炎免疫的推定证据*
| 例行的 | 高中后教育机构的学生 | 保健人员† | 国际旅行者 | |
| 麻疹 | (1)记录适龄接种含麻疹病毒活疫苗的情况§: –学龄前儿童:1剂 学龄儿童(K-12年级):2剂 –没有高风险的成人:1剂,或 (2)免疫的实验室证据,¶或者 (3)疾病的实验室确认,或 (4)1957年以前出生 | (1)接种2剂含麻疹病毒活疫苗的记录,§或者 (2)免疫的实验室证据,¶或者 (3)疾病的实验室确认,或 (4)1957年以前出生 | (1)接种2剂含麻疹病毒活疫苗的记录,§或者 (2)免疫的实验室证据,¶或者 (3)疾病的实验室确认,或 (4)1957年以前出生†† | (1)含活麻疹病毒疫苗的适龄接种记录: –6至11个月的婴儿**: 1剂 –年龄≥12个月的人§:2剂,或 (2)免疫的实验室证据,¶或者 (3)疾病的实验室确认,或 (4)1957年以前出生 |
| 风疹 | (1)接种1剂含活风疹病毒疫苗的记录,§或者 (2)免疫的实验室证据,¶或者 (3)疾病的实验室确认,或 (4)1957年以前出生(育龄妇女除外,她们可能会怀孕) | (1)接种1剂含活风疹病毒疫苗的记录,§或者 (2)免疫的实验室证据,¶或者 (3)疾病的实验室确认,或 (4)1957年以前出生(育龄妇女除外,她们可能会怀孕) | (1)接种1剂含活风疹病毒疫苗的记录,§或者 (2)免疫的实验室证据,¶或者 (3)疾病的实验室确认,或 (4)1957年以前出生††(可能怀孕的育龄妇女除外) | (1)接种1剂含活风疹病毒疫苗的记录,§或者 (2)免疫的实验室证据,¶或者 (3)疾病的实验室确认,或 (4)1957年以前出生(育龄妇女除外,她们可能会怀孕) |
| 腮腺炎 | (1)适龄接种含流行性腮腺炎病毒活疫苗的记录§: –学龄前儿童:1剂 –学龄儿童(K-12年级):2剂 –没有高风险的成人:1剂,或 (2)免疫的实验室证据,¶或者 (3)疾病的实验室确认,或 (4)1957年以前出生 | (1)接种2剂含流行性腮腺炎病毒的活疫苗的记录§,或者 (2)免疫的实验室证据,¶或者 (3)疾病的实验室确认,或 (4)1957年以前出生 | (1)接种2剂含流行性腮腺炎病毒的活疫苗的记录,§或者 (2)免疫的实验室证据,¶或者 (3)疾病的实验室确认,或 (4)1957年以前出生†† | (1)记录施用了2剂含流行性腮腺炎病毒的活疫苗,§或者 (2)免疫的实验室证据,¶或者 (3)疾病的实验室确认,或 (4)1957年以前出生 |
| *可能因当前州或当地要求而异。 † 卫生保健人员包括在卫生保健机构工作的所有有偿和无偿人员,他们有可能接触到患者和/或传染性物质,包括身体物质、受污染的医疗用品和设备、受污染的环境表面或受污染的空气。 § MMR疫苗首剂应在年龄≥12个月时接种;第二剂含麻疹或腮腺炎的疫苗应在第一剂疫苗接种后28天内接种。 ¶血清中的麻疹、风疹或腮腺炎免疫球蛋白G(IgG);可疑的结果应被视为阴性。 **在年龄< 12个月时接种一剂MMR疫苗的儿童应再次接种2剂MMR疫苗,第一剂应在儿童年龄为12至15个月时接种,第二剂至少在28天后接种。如果儿童仍生活在疾病风险高的地区,第一剂疫苗应在12个月大时注射。 ††对于1957年之前出生的未接种疫苗的人员,如果他们缺乏麻疹、风疹或腮腺炎免疫的实验室证据或疾病的实验室确认,卫生保健机构应考虑在适当的时间间隔为他们分别接种2剂MMR疫苗(麻疹和腮腺炎)和1剂MMR疫苗(风疹)。 育龄妇女是少女和绝经前的成年妇女。因为风疹可能发生在1957年之前出生的一些人身上,并且因为先天性风疹和先天性风疹综合征可能发生在怀孕期间感染风疹病毒的妇女的后代身上,所以1957年之前出生的人不能作为可能怀孕的妇女的风疹免疫的可接受证据。 高危成人包括高中后教育机构的学生、卫生保健人员和国际旅行者。 | ||||
*服务至2012年5月。
† 从2012年6月到2012年10月。
使用商品名称和商业来源仅用于识别,并不意味着美国卫生与公众服务部的认可。
互联网上非CDC网站的参考资料是作为一项服务提供给MMWR读者和不构成或暗示CDC或美国卫生与人类服务部对这些组织或其项目的认可。CDC对这些网站上的网页内容不负任何责任。中列出的URL地址MMWR在出版之日是最新的。
全部MMWR文章的HTML版本是排版文档的电子转换。这种转换可能会导致HTML版本中的字符翻译或格式错误。用户可参考电子PDF版本(http://www.cdc.gov/mmwr)和/或原件MMWR官方文本、图表和表格的印刷版本。可以从DC华盛顿州美国政府印刷局(GPO)的文件主管处(邮编:20402-9371)获得该问题的原始纸质副本;电话:(202) 512-1800。联系GPO了解当前价格。
* *有关格式错误的问题或消息应发送至mmwrq@cdc.gov.
上次审阅的页面:2013年6月14日
页面上次更新时间:2013年6月14日
内容来源:疾病控制和预防中心
https://www.cdc.gov/mmwr/preview/mmwrhtml/rr6204a1.htm
Hits: 37