Contents
Live, Attenuated, Tetravalent Butantan–Dengue Vaccine in Children and Adults
布坦坦减毒四价登革热疫苗
摘要
背景
布坦坦-登革热疫苗(Butantan-DV)是一种针对登革热疾病的研究性单剂量减毒活疫苗,但需要有关其总体疗效的数据。
方法
在巴西正在进行的一项3期双盲试验中,我们随机分配受试者接受Butantan-DV或安慰剂,并根据年龄(2至6岁,7至17岁和18至59岁)进行分层;计划进行5年的随访。该试验的目的是评估疫苗对接种疫苗后28天以上发生的任何血清型的有症状、病毒学证实的登革热的总体疗效(主要疗效终点),无论基线时的血清状态如何,并描述截至第21天的安全性(主要安全终点)。在这里,根据每个参与者的2年随访以及注射后第21天报告的疫苗相关不良事件的安全性来评估疫苗效力。关键的次要目标是根据基线时的登革热血清状态和登革热病毒血清型评估受试者的疫苗效力;还根据年龄评估了疗效。
结果
在3年的注册期内,16,235名参与者接受了Butantan-DV(10,259名参与者)或安慰剂(5976名参与者)。2年疫苗总效力为79.6%(95%置信区间[CI],70.0-86.3)——既往无登革热暴露证据的受试者为73.6%(95%CI,57.6-83.7),有暴露史的受试者为89.2%(95%CI,77.6-95.6)。2至6岁受试者的疫苗效力为80.1%(95%CI,66.0至88.4),7至17岁受试者的疫苗效力为77.8%(95%CI,55.6至89.6),18至59岁受试者的疫苗效力为90.0%(95%CI,68.2至97.5)。对DENV-1的疗效为89.5%(95%CI,78.7-95.0),对DENV-2的疗效为69.6%(95%CI,50.8-81.5)。随访期间未检测到DENV-3和DENV-4。注射后21天内与全身疫苗或安慰剂相关的不良事件在注射后21天内发生比安慰剂组更常见(58.3%的参与者,对45.6%)。
结论
通过2年的随访,单剂量的Butantan-DV可预防有症状的DENV-1和DENV-2,无论基线时登革热血清状态如何。(由布坦坦研究所等资助;DEN-03-IBClinicalTrials.gov编号,NCT02406729.在新选项卡中打开和WHOICTRP编号,编号:U1111-1168-8679.在新选项卡中打开.)
四种血清型的登革热病毒(DENV)在世界范围内传播,估计每年造成3.9亿人感染。1-3登革热疾病负担最重的地区是东南亚、中美洲和南美洲。4在巴西,登革热病毒是高度流行性,全国各地的发病率各不相同。5尽管大多数原发性登革热病毒感染是无症状或亚临床的,1登革热病毒可导致严重疾病,2尤其是继发性异型感染。3,6,7登革热疫苗的目标是提供针对所有登革热病毒血清型的保护。
目前有两种获得许可的四价活减毒登革热疫苗。CYD-TDV(Dengvaxia,赛诺菲巴斯德)是一种源自黄热病病毒的三剂登革热疫苗,已在多个国家获得许可,通常适用于9至45岁的人群。8,9已观察到没有登革热感染史的人在接种CYD-TDV疫苗后患严重登革热的风险增加。10,11因此,世界卫生组织(WHO)建议将CYD-TDV的使用限制在既往接触过登革热的人身上,或者在无法进行筛查的情况下,将CYD-TDV的使用限制在登革热流行地区(9岁时血清阳性率至少达到80%)。12最近,TAK-003,也称为Qdenga(武田),一种源自DENV-2的两剂登革热疫苗,13在印度尼西亚获得批准,适用于6至45岁的人,14在欧盟,4岁或以上的人,15在巴西,4至60岁的人16;批准在人群中使用该疫苗,无论其登革热血清状况如何。登革热疫苗的需求仍未得到满足,无论基线时登革热血清状态如何,该疫苗都能在广泛的年龄范围内提供单剂疫苗的保护。
布坦坦-登革热疫苗(Butantan-DV)是一种单剂量、活、减毒、四价登革热候选疫苗,由代表所有四种登革热血清型的疫苗病毒组成,类似于美国国立卫生研究院开发的TV003配方。17TV003的大量1期研究表明,该疫苗具有免疫原性,具有普遍可接受的副作用特征。18-22在一项涉及巴西成年人的2期试验中,Butantan-DV在四种血清型中引发了免疫反应,并且在没有登革热暴露史的人和有登革热暴露史的人中都具有普遍可接受的副作用特征。23
在这里,我们报告了正在进行的3期试验中2年随访的疗效和安全性结果,该试验旨在评估单剂量Butantan-DV预防儿童、青少年和成人有症状、经病毒学证实的登革热感染,无论他们是否有登革热暴露史。
方法
试验设计、受试者和监督
DEN-03-IB是一项正在进行的3期随机、双盲、安慰剂对照试验,计划随访5年,在巴西的16个地点进行。根据试验组分配的个体水平数据被预先指定为在试验结束前保持隐藏;因此,参与者层面的安全数据仅以非盲法提供给研究团队的预先指定成员以及外部独立数据和安全监测委员会。如果参与者年龄在2至59岁之间,并且身体健康或患有临床控制的疾病,则他们符合条件。主要排除标准包括免疫功能低下、怀孕和既往接种过登革热疫苗。所有纳入和排除标准都列在协议中,可在NEJM.org获得本文全文。
参与者根据年龄(2至6岁、7至17岁和18至59岁)以2:1的比例接受单剂量的布坦坦-DV或安慰剂进行随机分组。从2016年2月到2019年7月,从成人组开始,在数据和安全监测委员会进行临时安全分析后,按降序进入其余年龄组。
该试验是根据国际协调良好临床实践会议指南进行的,并得到了巴西卫生部的批准。参与者或其法定代理人提供书面知情同意书;7至17岁的儿童已获得同意。数据和安全监测委员会提供安全监督。试验的进行由布坦坦研究所监督,该研究所设计了协议并管理了数据。研究人员和研究中心工作人员对试验设计提供了反馈并收集了数据。其他数据管理和分析得到了默克夏普和Dohme(默克的子公司)的支持。为了保持受试者和研究者对这项正在进行的试验中数据的盲法,参与受试者随访的作者对试验数据的访问有限。未参与受试者随访的作者可以完全访问数据。作者保证数据的完整性和准确性以及试验对方案的保真度。
随机化和盲法
由独立统计学家将每个年龄层的计算机生成的随机化序列输入电子中央随机化系统。含有疫苗或安慰剂的注射器由试验药剂师制备,该药剂师知道注射器内容并且不参与随后的参与者评估。在试验期间,其他研究中心工作人员、数据管理团队和参与者仍然不知道小组分配和数据。
程序
在注射疫苗或安慰剂之前获得血液样本,以回顾性地确定参与者在基线时的登革热血清状态,使用经过验证的病毒减少中和试验,中和临界值为60%(VRNT60;详情见补充附录的“补充方法”部分,见NEJM.org)。21,24先前暴露于任何DENV血清型被定义为基线VRNT60四种血清型中任何一种的滴度高于定量下限(即DENV-1为≥18、DENV-2为≥15、DENV-3为≥12或DENV-4为≥13)。在同一次就诊(第0天)中,皮下注射单次0.5ml剂量的Butantan-DV或安慰剂。参与者被指示完成患者日记,以记录注射后21天的不良事件。所有参与者在第4周进行了随访。在整个2年的随访期间,至少每月通过电子通信、电话或亲自进行后续接触,以检查不良事件的发生和登革热的可能性。
疫苗说明
Butantan-DV由DENV-1、DENV-3和DENV-4减毒疫苗病毒(rDENV1Δ30、rDENV3Δ30/31和rDENV4Δ30)和含有DENV-2基因的嵌合疫苗病毒组成,这些基因编码减毒的DENV-4背景上的前膜(prM)和包膜(E)蛋白(rDENV2/4Δ30[ME])。17该疫苗是在布坦坦研究所生产、配制和冻干的。冻干产物用磷酸盐缓冲液复溶。每0.5毫升剂量的Butantan-DV靶向递送103每种疫苗病毒株的斑块形成单位。安慰剂剂量含有0.5ml定制的Leibovitz培养基,该培养基以双倍浓度制备、冻干并用磷酸盐缓冲液复溶。
疗效评估和终点
根据注射后28天以上出现有症状、经病毒学证实的登革热来评估疫苗效力。参与者被指示在登革热病例中出现发烧或其他症状时寻找试验团队。最好在症状出现后9天内采集血样,以评估登革热的可能性。使用四重逆转录酶-聚合酶-链反应测定法进行病毒学确认和血清型测定。25根据既往登革热暴露情况计算基线时具有登革热血清状态的参与者(即注射前VRNT60的参与者的疫苗效力结果)。
在这里,我们报告了每个参与者2年随访的预先指定的疫苗功效分析。主要疗效终点是注射后28天以上有症状、经病毒学证实的登革热,无论之前是否接触过登革热。关键的次要终点包括根据基线登革热血清状态和登革热病毒血清型,注射后超过28天经病毒学证实的登革热。亚组分析根据年龄组确定疫苗效力。
安全评估和终点
安全性评估包括监测注射后21天内发生的主动(给药部位和全身)和主动不良事件。在整个随访期间记录了未经请求的不良事件,包括严重不良事件。参与者在注射后21天内在日记中记录不良事件,并通过定期电话报告不良事件;研究人员评估了不良事件的严重程度和与疫苗或安慰剂有关的因果关系。在该试验中,所有与疫苗或安慰剂有合理因果关系的不良事件都被认为是不良反应,在本报告中称为疫苗或安慰剂相关不良事件。
主要安全终点是在2至59岁的参与者中征求(给药部位和全身)和未经请求的疫苗或安慰剂相关不良事件,直到第21天,无论以前是否接触过登革热。关键的次要终点包括截至第21天的主动和主动的疫苗或安慰剂相关不良事件,根据基线和年龄组以及第22天后主动提供的疫苗或安慰剂相关不良事件的频率。
统计分析
为了计算主要终点(疫苗功效)分析的样本量,我们使用了Blackwelder开发的公式26泊松近似(参见协议和补充方法)。主要疗效分析是在符合方案的人群中进行的,其中包括所有未使用限制性药物并提供书面知情同意书、接受随机分组并根据制造商推荐的处理和给药条件接受指定疫苗或安慰剂的合格参与者。
使用以下公式确定疫苗效力:疫苗效力=[1−(1+s)θ]÷[1−θ],其中s是对照组与疫苗组随访时间的比率,θ是疫苗组发生的所有登革热病例的比例。使用Chan和Bohidar描述的条件近似计算疫苗效力,27使用Blaker方法计算置信区间28(参见补充方法)。如果由任何血清型(组合)作为主要终点或由每种血清型(单独)引起的DENV疾病的双侧95%置信区间的下限大于25%,则认为已达到疫苗效力的终点。疫苗效力是根据每个参与者2年的随访来计算的。
在接受治疗的人群中进行安全性分析(所有接受过随机分组并接受至少一剂疫苗或安慰剂的参与者,并根据他们实际接受的注射进行评估)。总结了描述性总结、注射后第21天疫苗或安慰剂相关不良事件的频率以及2年随访期间未经请求的疫苗或安慰剂相关不良事件的频率。
结果
参与者
共有16,235名受试者接受了随机分组,并接受了疫苗(10,259名受试者)或安慰剂(5976名受试者)(图1)。根据方案的疗效人群包括疫苗组的10,215人和安慰剂组的5947人。两组受试者在基线时的特征大致相似(表1),并且通常代表了巴西有登革热疾病风险的人群(补充附录中的表S3)。根据协议,大约三分之一的参与者分别参加了三个年龄组。近一半的参与者(疫苗组为47.3%,安慰剂组为45.2%)没有证据表明以前接触过任何DENV血清型。基线时每个年龄组的特征与总体人群基本一致。然而,在疫苗组和安慰剂组中,年龄较大的年龄组(7至17岁和18至59岁)观察到有登革热暴露证据的参与者比例高于最年轻的年龄组(2至6岁)(表S4)。
有症状的病毒学确诊登革热的发生率
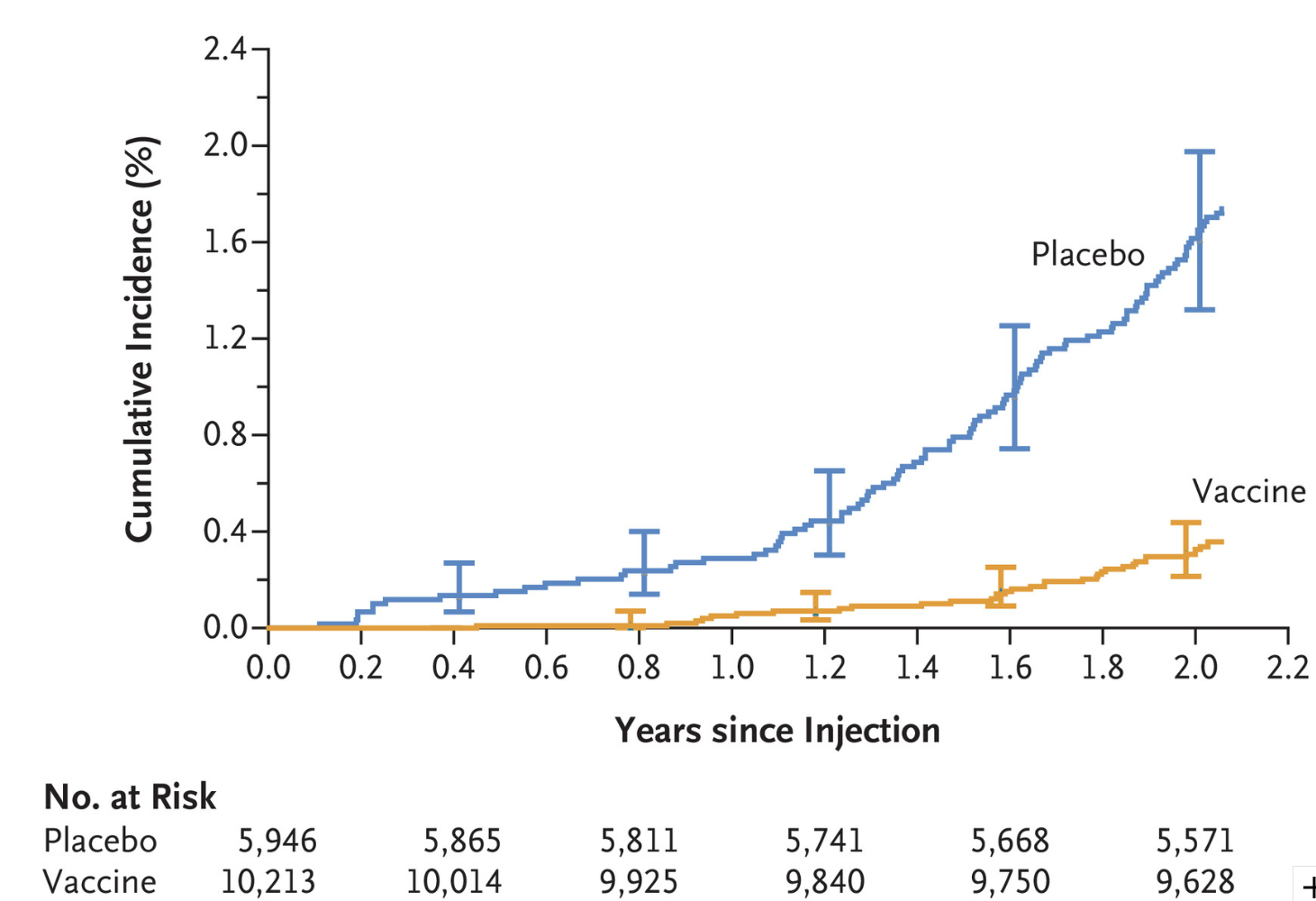
图2.通过2年随访经病毒学证实的登革热的累积发生率。显示的是注射后 28 天以上至 2 年随访期结束期间出现有症状、经病毒学证实的登革热的发生率。分析排除了未遵循逆转录酶-聚合酶-链反应-测定标准操作程序的结果。I 条表示 95% 置信区间。
疗效
在2年的随访中,疫苗对任何DENV血清型的效力为79.6%(95%CI,70.0至86.3)(表2)。血清型特异性疫苗效力的次要终点是针对DENV-1的89.5%(95%CI,78.7-95.0),针对DENV-2的次要终点为69.6%(95%CI,50.8-81.5)。关于基线登革热血清状态,在既往没有登革热暴露证据的受试者(7516名受试者)中,疫苗对任何血清型的效力为73.6%(95%CI,57.6至83.7),在既往有登革热暴露证据的受试者(8017名受试者)中,疫苗对任何血清型的效力为89.2%(95%CI,77.6至95.6)。
表S5显示了根据年龄组和根据基线时登革热血清状态确定的年龄亚组的2年随访疫苗效力。根据年龄组,无论基线时登革热血清状态如何,疫苗对任何登革热血清型的效力在2至6岁的受试者中为80.1%(95%CI,66.0至88.4),在7至17岁的受试者中为77.8%(95%CI,55.6至89.6),在18至59岁的受试者中为90.0%(95%CI,68.2至97.5)。
安全
表3.注射后21天内发生不良事件。
两组在注射后21天内发生严重不良事件的受试者百分比相似。疫苗组有20名受试者(0.2%),安慰剂组有8名受试者(0.1%)发生严重不良事件(表3和表S6)。一例与疫苗或安慰剂无关的死亡(由研究者评估)发生在注射后21天内。在2年的随访期间,疫苗组和安慰剂组分别为3.9%和4.0%的受试者发生严重不良事件的百分比(表S7)。在2年的随访期间,有16例死亡:疫苗组9例,安慰剂组7例。研究人员认为没有一例死亡是由登革热引起的,也与疫苗或安慰剂有关。
在注射后21天内,疫苗组的3名受试者和安慰剂组的2名受试者发生了严重的不良事件,被认为与疫苗或安慰剂有关(表3)。另外两名受试者在注射后22天或更晚发生疫苗或安慰剂相关的严重不良事件,在2年的随访中,总共有7起与疫苗或安慰剂相关的严重不良事件(即贝尔麻痹、支气管痉挛、面瘫、格林-巴利综合征、周围神经病变、横窦血栓形成和病毒感染)。关于参与者级别安全数据的试验组分配仍然被隐藏;然而,数据和安全监测委员会审查了所有严重的不良事件,并且不建议在任何情况下对安全数据进行揭盲。
注射后21天内发生的大多数主动和主动不良事件的严重程度为轻度至中度(表S8和S9)。接种疫苗的受试者中,发生全身性、疫苗或安慰剂相关不良事件的受试者比例(58.3%)高于接受安慰剂的受试者(45.6%)(表3)。报告最多的是报告最多的给药部位、疫苗或安慰剂相关不良事件是给药部位疼痛,疫苗组有14.9%的参与者报告,安慰剂组有11.1%的受试者报告。报告最多的全身性、疫苗或安慰剂相关不良事件是头痛(疫苗组36.4%的参与者报告,安慰剂组30.9%的参与者报告)、疲劳(分别报告19.3%和15.1%)和皮疹(分别报告22.5%和4.2%)。表S10和S11显示了按年龄组和基线登革热血清状态在注射后21天内发生不良事件的参与者百分比。随着受试者年龄的增加,发生全身性、疫苗或安慰剂相关不良事件的受试者百分比往往更高。
讨论
在这项正在进行的3期试验中,单剂量的Butantan-DV对2至59岁年龄段的儿童、青少年和成人有效。我们达到了主要疗效标准,通过2年的随访,疫苗对有症状的、经病毒学证实的登革热的保护作用约为80%。与安慰剂接受者相比,Butantan-DV的接受者更频繁地报告与请求的全身、疫苗或安慰剂相关的不良事件,这一发现与2期试验中描述的安全性相似。23
在我们的试验中,大约一半的参与者在基线时没有以前接触过登革热的证据,这使得对该人群的疫苗功效和安全性进行了强有力的评估。经过2年的随访,在没有既往登革热暴露证据的参与者中,疫苗效力接近74%。先前对基于黄热病的CYD-TDV登革热疫苗的评估表明,以前没有接触过登革热的人接种疫苗后患严重登革热的风险增加,10这一发现强调了将这一人群纳入登革热疫苗研究的必要性。在目前的试验中,我们招募了相当大比例的既往没有登革热暴露史的参与者,我们计划在登革热流行的国家对他们进行预计5年的随访,从而可以仔细评估该人群的疫苗有效性和安全性。
基线时登革热血清状态对疫苗有效性和安全性的影响对幼儿尤为重要,因为他们在接种疫苗时不太可能接触过登革热。在先前对CYD-TDV的研究中,幼儿(<9岁)的疫苗效力低于9岁或以上儿童,后者血清阴性的可能性不大。11此外,血清阴性的2至5岁儿童在接种CYD-TDV疫苗后住院或严重登革热的风险增加。10在目前的试验中,大约三分之一的参与者年龄在2至6岁之间,其中81%的人以前没有接触过登革热,这使得这个年龄组成为接种疫苗的理想目标,以防止首次感染。经过2年的随访,既往未接触登革热的2至6岁儿童的疫苗效力为73%,这一发现与年龄较大的组相似。此外,无论是否接触登革热,所有三个年龄组均未发现安全问题。对最年轻年龄组的长期随访对于评估Butantan-DV提供的保护的持久性以及接种疫苗后任何突破性感染的严重程度非常重要。
在随访期间,单剂量的Butantan-DV可预防有症状、经病毒学证实的登革热。在先前的试验中,在6个月或12个月时给予第二剂Butantan-DV或TV003不会诱导疫苗病毒血症或显着增强抗体反应。19-21,23因此,Butantan-DV的单剂量方案被提前到目前的3期试验。目前尚不清楚在延长时间(>12个月)后给予加强剂量的效用(如果有的话)。单剂登革热疫苗有几个优点。接种一剂疫苗后预防疾病对于旅行者或需要快速保护的疫情应对措施可能尤为重要。单剂方案消除了一个人可能具有部分或不完全免疫力的剂量间隔时间。此外,单剂疫苗可以缓解后勤和经济方面的考虑,简化疫苗计划,并增加接种率。
本文报道的Butantan-DV的安全性与之前的Butantan-DV2期试验一致23以及类似疫苗TV003的大量1期研究。18-22在该试验中,Butantan-DV疫苗接种者的皮疹发生率(23%)低于Butantan-DV的2期试验中观察到的发生率(45%至65%)。23试验之间观察到的皮疹发生率差异的原因尚不清楚,受试者的人口统计学特征或基线时的登革热血清状态可能会影响结果。2期试验是在大多数人群以前没有接触过登革热的地区进行的,在以前没有接触过登革热病毒的参与者中观察到皮疹的频率更高(65%),而不是在有暴露史的参与者中观察到的皮疹(45%)。23此外,观察者的感知可能起作用。在这项试验中,受试者或父母报告了皮疹;在2期试验中,试验医生报告了皮疹。
我们的试验有几个局限性。在随访期间未观察到DENV-3或DENV-4病例,从而阻止了对这些血清型的疫苗功效的评估。DENV-3和DENV-4的缺失与试验期间这些DENV血清型在巴西的较低流通相对应。29-32尽管许多DENV血清型共循环并感染广泛的人群,但DENV-1和DENV-2可能更常与疾病和(在DENV-2的情况下)严重的临床结果相关33,34并且是疫苗试验显示具有保护作用的血清型。需要探索对其他黄病毒(即引起寨卡病毒和黄热病的病毒)的先前免疫力对随后的登革热病毒感染或布坦坦-DV疫苗接种的影响。2016年至2018年,巴西大规模的寨卡疫情可能降低了登革热的发病率。35,36在这次试验开始后不久。在2年的随访期间,疫苗组和安慰剂组的登革热伴有警示体征和重症登革热的发病率都很低,这一发现反映了病毒学确诊的登革热总体发病率较低,排除了有意义的分析,并可能导致这项正在进行的试验中数据的揭盲。登革热血清学检测本身可捕获交叉反应性抗体37-39;因此,目前无法了解基线时类型特异性免疫对疫苗效力的影响。我们报告了试验最初2年的预先指定结果;根据WHO的建议,通过5年的随访进行持续评估,40旨在提供有关安全性和有效性的长期见解。
在这项3期试验中,单次给药Butantan-DV被证明具有良好的安全性,并且在整个2年的随访期间可有效预防由DENV-1和DENV-2引起的有症状的、经病毒学证实的登革热,无论之前是否接触过登革热。这些数据支持继续开发Butantan-DV预防成人和儿童登革热。
得到了布坦坦研究所、默克夏普和Dohme(默克的子公司)、巴西卫生部、巴西国家经济和社会发展银行、圣保罗研究基金会和布坦坦基金会的支持。
卡斯特罗·布洛斯博士的联系方式为 fernanda.boulos@fundacaobutantan.org.br 或巴西圣保罗市布坦坦大道1500-布坦坦研究所。
参考资料 (40)
1.BhattS、GethingPW、BradyOJ 等。登革热的全球分布和负担。自然 2013;496:504-507。
2.登革热:诊断、治疗、预防和控制指南。日内瓦:世界卫生组织,2009 年。
3.西蒙斯CP, 法拉尔JJ, 范永洲N, 威尔斯B.登革热。NEnglJMed 2012 年;366:1423-1432。
4.StanawayJD、ShepardDS、UndurragaEA 等。登革热的全球负担:2013年全球疾病负担研究的分析。柳叶刀感染 Dis2016;16:712-723。
5.少年JBS、马萨德 E、洛博-内托A、卡斯特纳R、奥利弗L、加拉格尔E。巴西登革热的流行病学和成本:系统文献综述。国际感染杂志 2022;122:521-528。
6.霍尔斯特德SB的。登革热的发病机制:分子生物学的挑战。科学 1988;239:476-481。
7.KatzelnickLC、GreshL、HalloranME 等。人类严重登革热疾病的抗体依赖性增强。科学 2017;358:929-932。
8.CapedingMR、TranNH、HadinegoroSR 等。新型四价登革热疫苗在亚洲健康儿童中的临床疗效和安全性:一项3期、随机、观察者屏蔽、安慰剂对照试验。柳叶刀 2014;384:1358-1365。
9.VillarL、DayanGH、Arredondo-GarcíaJL 等。四价登革热疫苗对拉丁美洲儿童的疗效。NEnglJMed 2015 年;372:113-123。
10.SridharS、LuedtkeA、LangevinE 等人。登革热血清状态对登革热疫苗安全性和有效性的影响。NEnglJMed 2018 年;379:327-340。
11.HadinegoroSR、Arredondo-GarcíaJL、CapedingMR 等。登革热疫苗在地方病流行地区的疗效和长期安全性。NEnglJMed 2015 年;373:1195-1206。
12.登革热疫苗:世卫组织立场文件,2018年9月——建议。疫苗2019;37:4848-4849。
13.BiswalS、ReynalesH、Saez-LlorensX 等人。四价登革热疫苗对健康儿童和青少年的疗效。NEnglJMed 2019 年;381:2009-2019.
14.武田。武田的Qdenga(登革热四价疫苗[减毒活疫苗])在印度尼西亚获准使用,无论之前是否接触过登革热。8月 22, 2022 (https://www.takeda.com/newsroom/newsreleases/2022/takedas-qdenga-dengue-tetravalent-vaccine-live-attenuated-approved-in-indonesia-for-use-regardless-of-prior-dengue-exposure.在新选项卡中打开).
15.武田。武田的Qdenga(登革热四价疫苗[减毒活疫苗])获准在欧盟使用。12月 8, 2022 (https://www.takeda.com/newsroom/newsreleases/2022/takedas-qdenga-dengue-tetravalent-vaccine-live-attenuated-approved-for-use-in-european-union.在新选项卡中打开).
16.AgênciaNacionaldeVigilânciaSanitária(Anvisa).Anvisaaprovanovavacinacontraadengue.3月 2, 2023 (https://www.gov.br/anvisa/pt-br/assuntos/noticias-anvisa/2023/anvisa-aprova-nova-vacina-para-a-dengue.在新选项卡中打开).
17.小布莱尼JE、德宾AP、墨菲BR、怀特黑德SS。使用反向遗传学开发登革热减毒活疫苗。病毒免疫学 2006;19:10-32。
18.DurbinAP、KirkpatrickBD、PierceKK 等。四种不同的四价登革热减毒活疫苗中的任何一种的单剂在黄病毒初治成人中都是安全的和免疫原性的:一项随机、双盲临床试验。JInfectDis 2013 年;207:957-965。
19.DurbinAP、KirkpatrickBD、PierceKK 等。一项间隔12个月的成人给药研究表明,单剂美国国家过敏和传染病研究所四价登革热疫苗可诱导强烈的中和抗体反应。JInfectDis 2016 年;214:832-835。
10分钟KirkpatrickBD、DurbinAP、PierceKK 等。对健康、未感染黄病毒的成年人接种单剂四价登革热减毒活疫苗后,对所有4种登革热病毒血清型产生强大而平衡的免疫反应。JInfectDis 2015 年;212:702-710。
11分钟RussellKL、RuppRE、Morales-RamirezJO 等。一项I期随机、双盲、安慰剂对照研究,旨在评估减毒四价登革热减毒活疫苗在黄病毒初治和黄病毒经历的健康成人中的安全性、耐受性和免疫原性。嗡嗡声Vaccin免疫 2022;18:2046960-2046960。
12分钟WhiteheadSS、DurbinAP、PierceKK 等。在一项随机试验中,减毒四价登革热减毒疫苗TV003在接种疫苗前暴露于黄病毒的受试者中具有良好的耐受性和高度免疫原性。PLoSNeglTropDis 2017;11(5):e0005584-e0005584.
23.KallasEG、PreciosoAR、Palacios R 等。四价减毒活登革热疫苗Butantan-DV在巴西成人中的安全性和免疫原性:一项两步、双盲、随机安慰剂对照的2期试验。柳叶刀感染 Dis2020;20:839-850。
14分钟WhitemanMC、BogardusL、GiaconeDG 等。病毒减少中和试验:登革热的单细胞成像高通量病毒中和试验。AmJTropMed Hyg2018 年;99:1430-1439。
15分钟约翰逊BW、罗素BJ、兰西奥蒂RS。在四重实时逆转录酶PCR测定中对登革热病毒进行血清型特异性检测。临床微生物学杂志 2005;43:4977-4983。
26.黑焊机WC。相对风险前瞻性分析的样本量和功效。StatMed 1993 年;12:691-698。
27.ChanISF,Bohidar NR的。疫苗功效研究的确切功效和样本量。CommunStatTheory Methods,1998 年;27:1305-1322。
18分钟布莱克H.离散分布的置信曲线和改进的精确置信区间。CanJStat 2008 年;28,783-798。
29.Brasil,MinistériodaSaúde,SecretariadeVigilânciaemSaúde.ÓbitoporarbovirosesnoBrasil,2008a2019.BoletimEpidemiol 2020;51(33):1-28 (http://plataforma.saude.gov.br/anomalias-congenitas/boletim-epidemiologico-SVS-33-2020.pdf.在新选项卡中打开).
30.Brasil,MinistériodaSaúde,SecretariadeVigilânciaemSaúde.Monitoramentodoscasosdearbovirosesurbanastransmitidaspelo埃及伊蚊(登革热、基孔肯雅热和寨卡病毒),流行病学1a50,2020年。BoletimEpidemiol 2020;51(51):1-33 (https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/boletins/epidemiologicos/edicoes/2020/boletim_epidemiologico_svs_51.pdf.在新选项卡中打开).
31.Brasil,MinistériodaSaúde,SecretariadeVigilânciaemSaúde.Monitoramentodoscasosdearbovirosesurbanascausadosporvírustransmitidospelomosquitoaedes(dengue,chikungunyaezika),semanasepidemiológicas1a48,2021.BoletimEpidemiol 2021;52(45):1-13 (https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/boletins/epidemiologicos/edicoes/2021/boletim_epidemiologico_svs_45.pdf.在新选项卡中打开).
32.OnedaRM、BassoSR、FrassonLR、MottecyNM、SaraivaL、BassaniC.2014年至2019年巴西登革热的流行病学概况。RevAssocMedBras(1992) 2021;67:731-735。
33.袁玲, 陈莹, 钟敏, 林莹, 刘玲.重症登革热感染的风险和预测因素:系统评价和荟萃分析。PLoS一号 2022;17(4):e0267186-e0267186.
34.SangkaewS、MingD、BoonyasiriA 等人。登革热发热期进展为重症的风险预测因素:系统评价和荟萃分析。柳叶刀感染 Dis2021;21:1014-1026。
35.BritoAF、MachadoLC、OidtmanRJ 等。等待:巴西寨卡病毒流行后登革热病毒的卷土重来。NatCommun 2021 年;12:2619-2619。
36.穆加贝VA、博尔哈LS、卡多佐CW 等。南美洲和中美洲登革热发病动态的变化可能是由于寨卡病毒流行后的跨人群免疫。TropMedIntHealth 2021 年;26:272-280。
37.HammontWM和SatherGE。登革热病毒的分型问题。MilMed 1964 年;129:130-135。
38.罗素PK,尼萨拉克A.通过牙菌斑减少中和试验识别登革热病毒。免疫学杂志 1967;99:291-296。.
39.ThomasSJ、NisalakA、AndersonKB 等。原发性和继发性登革热病毒感染中的登革热斑块减少中和试验(PRNT):检测条件的改变如何影响性能。AmJTropMedHyg 2009 年;81:825-833。
40.VanniceKS、Wilder-SmithA、BarrettADT 等。第二代登革热减毒活疫苗的临床开发和监管要点。疫苗2018;36:3411-3417。
N Engl J Med 2024;
390:397-408 DOI: 10.1056/NEJMoa2301790
Hits: 92

Excellent write-up
Отдых у моря: выбираем лучшие отели с прямым доступом к пляжу
лучшие отели на море https://reitin-otelei.ru/ .
Каркасные дома под ключ: цены в СПб без переплат
каркасный дом цена http://www.karkasnye-doma77.ru .