Contents
b型流感嗜血杆菌结合疫苗(HIBERIX)FDA
HIBERIX [Haemophilus b Conjugate Vaccine (Tetanus Toxoid Conjugate)] for injection, for intramuscular use
Initial U.S. Approval: 2009
处方信息的重点
这些重点不包括使用所需的所有信息
安全有效地使用HIBERIX。请参阅HIBERIX的完整处方信息。
b型流感嗜血杆菌结合疫苗(破伤风类毒素结合物))用于注射,用于肌肉注射
美国首次批准日期:2009年
————近期主要变化————
剂量和接种(2) 2023年12月
————适应症和用法————
HIBERIX是一种用于主动免疫的疫苗,用于预防由b型流感嗜血杆菌引起的侵入性疾病,HIBERIX获准用于6周至4岁的儿童(5岁生日前)。(1)
————剂量和用法————
仅用于肌肉注射。
通过肌肉注射(2.1)接种的4剂系列(每剂0.5 mL或约0.5 mL,视情况而定):
•初级系列:2、4和6个月大时各一剂。第一剂可在6周龄时接种。
•加强剂:15至18个月大时接种一剂。
HIBERIX以两种形式提供:
•小瓶和小瓶剂型:一小瓶冻干抗原成分和一小瓶无菌生理盐水稀释液。(2.2)
•小瓶和预装注射器剂型:冻干抗原成分小瓶和无菌生理盐水稀释液预装注射器。(2.2)
————剂型和强度————
注射液。
•小瓶和小瓶介绍:复溶后的单次剂量为0.5 mL。(3)
•小瓶和预装注射器介绍:复溶后的单次剂量约为0.5 mL。(3)
————禁忌症————
前一剂含b型流感嗜血杆菌或破伤风类毒素的疫苗或HIBERIX的任何成分任何药物后出现严重过敏反应(如过敏反应)。(4)
————警告和注意事项————
•如果在接种含破伤风类毒素的疫苗后6周内出现吉兰-巴雷综合征,则应根据潜在益处和风险决定是否接种HIBERIX。(5.1)
•注射疫苗(包括HIBERIX)可能会导致晕厥。应制定程序以避免跌倒伤害并恢复晕厥后的脑灌注。(5.2)
•在一些早产婴儿中观察到肌肉注射疫苗后出现呼吸暂停。关于何时对早产婴儿接种包括HIBERIX在内的肌肉疫苗的决定应基于对婴儿个人医疗状况以及疫苗接种的潜在益处和可能风险的考虑。(5.3)
————不良反应————
常见的不良反应(≥20%)为注射部位疼痛和发红、易怒、困倦、发烧、食欲不振、烦躁和不安。(6.1)
要报告疑似不良反应,请联系 葛兰素史克公司1-888-825-5249或VAERS公司1-800-822-7967或www.vaers.hhs.gov.
有关患者咨询信息,请参见第17节。
修订日期:2023年12月
完整的处方信息:内容*
*未列出完整处方信息中省略的章节或小节。
完整的处方信息
1适应症和用法
HIBERIX适用于主动免疫,以预防由b型流感嗜血杆菌引起的侵入性疾病。HIBERIX获准用于6周至4岁的儿童(5岁生日前)。
2剂量和用法
仅供肌肉注射使用。
2.1剂量和时间表
复溶后,单剂量HIBERIX为0.5 mL或约0.5 mL,具体取决于接种方式【参见剂量和接种(2.2)].
HIBERIX以4剂系列接种。该系列包括在2、4和6个月大时接种3剂的初级免疫疗程,随后在15至18个月大时接种加强剂量。第一剂可在6周龄时接种。
2.2 剂型和 复溶
HIBERIX以如下两种形式提供:
小瓶和小瓶剂型
小瓶和小瓶剂型包括一小瓶冻干抗原成分和一小瓶无菌生理盐水稀释液。
小瓶和预装注射器剂型
小瓶和预装注射器包括一小瓶冻干抗原成分和一个预装无菌生理盐水稀释液的注射器。
对于两种呈递,仅用随附的无菌生理盐水稀释液复溶冻干的抗原成分以形成HIBERIX。
样品瓶和样品瓶剂型说明
| 图1.清洗两个瓶塞。用带刻度的注射器从附带的小瓶中抽取0.6 mL无菌生理盐水稀释液。
| 图2.将0.6 mL无菌生理盐水稀释液转移至冻干抗原成分小瓶中。
|
| 图3.充分摇晃小瓶,直到粉末完全溶解。
| 图4.复溶后,抽取0.5 mL将 复溶疫苗注入同一注射器并肌肉注射
|
小瓶和预装注射器剂型说明
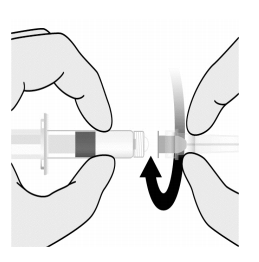
| 图1.握住未分级的无菌盐水稀释剂注射器,逆时针拧开注射器盖。将针对准注射器的轴,并将针毂轻轻连接到Luer锁定适配器(LLA)上,顺时针旋转四分之一圈,直到你感觉它锁定。
| 图2.清洗冻干的抗原成分瓶塞。将预填充注射器的全部内容物转移到小瓶中。
|
| 图3.充分摇晃小瓶,直到粉末完全溶解。
| 图4.复溶后,将复溶疫苗的全部内容物抽入同一注射器,更换针头后肌肉注射疫苗。
|
2.3接种
复溶疫苗应该是透明无色的溶液。只要溶液和容器允许,注射用药品在接种前应目视检查是否有颗粒物质和变色。如果存在上述任何一种情况,就不应该接种疫苗。
复溶后立即肌肉注射HIBERIX。
3剂型和强度
HIBERIX是一种注射用溶液。
对于小瓶和小瓶包装,复溶后的单次剂量为0.5 mL。
对于小瓶和预装注射器,复溶后的单次剂量约为0.5 mL。
4禁忌症
前一剂任何药物后出现严重过敏反应(如过敏反应)H.流感含b型或破伤风类毒素的疫苗或疫苗的任何成分是以下药物的禁忌症
HIBERIX的管理【参见说明(11)】.
5警告和注意事项
5.1格林-巴利综合征
如果在接种含破伤风类毒素的疫苗后6周内出现格林-巴利综合征,则应在仔细考虑潜在益处和可能风险的基础上决定是否接种任何含破伤风类毒素的疫苗,包括HIBERIX。
5.2晕厥
晕厥(昏厥)可能与注射疫苗(包括HIBERIX)有关。晕厥可伴有短暂的神经系统体征,如视觉障碍、感觉异常和强直阵挛性肢体运动。应制定程序以避免跌倒伤害并恢复晕厥后的脑灌注。
5.3早产儿呼吸暂停
在一些早产婴儿中观察到肌肉注射疫苗后出现呼吸暂停。关于何时对早产婴儿接种包括HIBERIX在内的肌肉疫苗的决定应基于对婴儿个人医疗状况以及疫苗接种的潜在益处和可能风险的考虑。
5.4预防和管理疫苗过敏反应
接种前,医疗保健提供者应审查患者的免疫史,以了解可能的疫苗超敏反应。肾上腺素和其他适当的药物用于
如果发生急性过敏反应,必须立即控制即时过敏反应。
5.5免疫活性改变
尚未评估HIBERIX在免疫抑制儿童中的安全性和有效性。如果给免疫抑制儿童(包括接受免疫抑制治疗的儿童)使用HIBERIX,可能无法获得预期的免疫反应。
5.6对实验室测试的干扰
在接种含b型流感嗜血杆菌疫苗后1至2周内,尿液抗原检测对因b型流感嗜血杆菌引起的疑似疾病可能没有诊断价值,包括HIBERIX【参见药物相互作用(7.1)】.
5.7破伤风免疫接种
HIBERIX免疫不能替代常规破伤风免疫。
6不良反应
6.1临床试验经验
由于临床试验是在差异很大的条件下进行的,因此在一种疫苗的临床试验中观察到的不良反应率不能直接与另一种疫苗的临床试验中的不良反应率进行比较,并且可能不能反映实际观察到的不良反应率。HIBERIX的广泛使用可能会揭示临床试验中未观察到的不良反应。
在临床试验中,常见的不良反应(≥20%)是注射部位疼痛和发红、易怒、困倦、发烧、食欲不振、烦躁和不安。
研究1:在美国进行的一项随机对照临床试验中,儿童在2、4和6个月大时接种了HIBERIX疫苗(n = 2,963)、美国许可的单价b型嗜血杆菌结合疫苗(对照PRP-T)(赛诺菲巴斯德公司)(n = 520)或美国许可的白喉和破伤风类毒素与无细胞百日咳吸附灭活脊髓灰质炎病毒和b型嗜血杆菌结合疫苗(DTaP-IPV/Hib)(赛诺菲巴斯德公司)。HIBERIX和对照PRP-T(赛诺菲巴斯德有限公司)与PEDIARIX(DTaP-HBV-IPV)【吸附白喉和破伤风类毒素和无细胞百日咳、乙型肝炎(重组)和灭活脊髓灰质炎病毒疫苗】和肺炎球菌13价结合疫苗(PCV13)(惠氏制药公司)同时接种,剂量分别为1、2和3,以及ROTARIX【轮状病毒疫苗,口服活疫苗,剂量为1和2。DTaP- IPV/Hib与PCV13和ENGERIX-B(乙型肝炎疫苗( 重组))一起接种,剂量为1、2和3,ROTARIX的剂量为1和2。如果接种了出生剂量的乙型肝炎疫苗,则接种第1剂和第3剂ENGERIX-B疫苗。在总人口中,男性占51.2%;61%是白人,8%是亚洲人,9%是黑人,22%是其他种族/民族。
在研究1中,儿童在15至18个月大时(平均年龄:15.6个月)接受第一次疫苗接种后,在第2、4和6个月大时接受加强剂量的HIBERIX(n = 2,336)、b型嗜血杆菌结合疫苗(对照PRP-T)(赛诺菲巴斯德公司)(n = 435)或白喉和破伤风类毒素与无细胞百日咳吸附的灭活脊髓灰质炎病毒和b型嗜血杆菌结合疫苗(DTaP-IPV/加强剂量的HIBERIX和对照PRP-T(赛诺菲巴斯德公司)与INFANRIX(DTaP)【吸附白喉和破伤风类毒素和无细胞百日咳疫苗】同时接种。
在另外7项临床研究中,1,008名儿童在初次接种HIBERIX(n = 530)、b型嗜血杆菌结合疫苗(对照PRP-T)(赛诺菲巴斯德公司)(n = 235)、b型嗜血杆菌结合疫苗(默克公司)(n = 26)或b型嗜血杆菌结合疫苗(惠氏制药公司)(不再在美国获得许可,n = 217 )没有一项研究包括接受美国许可的b型嗜血杆菌结合疫苗加强剂量的对照组。研究在欧洲、加拿大和拉丁美洲进行。在这些研究中,接受HIBERIX疫苗强化接种的受试者的平均年龄在16至19个月之间。在接种疫苗时,172名(17.1%)受试者的年龄为11至14个月,642名(63.7%)受试者的年龄为15至18个月,194名(19.2%)受试者的年龄为19至25个月。大约一半的受试者是男性。在有种族/民族信息的受试者中,几乎所有受试者都是白人。
在这7项研究中,HIBERIX与下列美国许可的疫苗之一的非美国制剂(每剂含2.5 mg2-苯氧乙醇防腐剂)同时接种:INFANRIX(DTaP)【吸附白喉和破伤风类毒素及无细胞百日咳疫苗】、KINRIX(DTaP-IPV)【吸附白喉和破伤风类毒素及无细胞百日咳及灭活脊髓灰质炎病毒疫苗】或PEDIARIX(DTaP-HBV-IPV)。在这些研究中,DTaP-IPV和DTaP-HBV-IPV的接种方案在美国未获批准。一些受试者同时接受DTaP-HBV(葛兰素史克生物制剂,未在美国获得许可)和 HIBERIX。
引发的不良反应
表1和表2分别列出了研究1中初次接种和加强接种后引发的局部反应和一般不良反应的报告频率。
表1.在接种HIBERIXb、对照PRP-Tb、2、4、6个月)初级系列接种后4天内引起局部反应和一般不良反应a的儿童百分比
| 不良反应 | HIBERIX % | 对照PRP-T % | DTaP-IPV/Hib % | ||||||
剂量 | 剂量 | 剂量 | |||||||
| 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | |
| 局部c | |||||||||
| n | 2,828 | 2,668 | 2,553 | 498 | 481 | 463 | 492 | 469 | 443 |
| 疼痛 | 49 | 45 | 43 | 57 | 53 | 48 | 58 | 50 | 49 |
| 疼痛,3级f | 4 | 3 | 2 | 9 | 5 | 4 | 9 | 3 | 3 |
| 红色 | 19 | 25 | 29 | 24 | 32 | 30 | 26 | 31 | 37 |
| 发红度>20 mm | 1 | 1 | 1 | 2 | 1 | 0 | 2 | 2 | 2 |
| 肿胀 | 13 | 15 | 19 | 19 | 22 | 20 | 20 | 24 | 24 |
| 肿胀,>20 mm | 2 | 1 | 1 | 4 | 3 | 1 | 4 | 2 | 2 |
| 一般 | |||||||||
| n | 2,830 | 2,669 | 2,553 | 499 | 480 | 463 | 492 | 469 | 443 |
| 易怒 | 69 | 70 | 67 | 76 | 71 | 67 | 73 | 67 | 69 |
| 易怒,3级g | 4 | 6 | 5 | 8 | 8 | 5 | 6 | 5 | 3 |
| 嗜睡 | 60 | 54 | 49 | 66 | 56 | 50 | 61 | 52 | 50 |
| 嗜睡,3级h | 2 | 3 | 2 | 4 | 2 | 1 | 4 | 3 | 3 |
| 食欲不振 | 29 | 28 | 28 | 33 | 32 | 27 | 34 | 24 | 24 |
| 食欲不振,3级i | 1 | 2 | 2 | 2 | 1 | 0 | 1 | 0 | 1 |
| 发热 | 14 | 19 | 19 | 16 | 19 | 16 | 12 | 11 | 18 |
| 发热,3级j | 0 | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 1 |
n =安全性数据可用的所有受试者。
a接种疫苗后4天内(定义为接种当天和接下来的3天)。
b .每剂(第1、2和3剂)HIBERIX或对照PRP-T(赛诺菲巴斯德公司)与PEDIARIX(DTaP-HBV-IPV)和PCV13同时接种。剂量1和2与ROTARIX同时接种。
c每剂(第1、2和3剂)DTaP-IPV/Hib与第1、2和3剂的PCV13和ENGERIX-B以及第1和2剂的ROTARIX同时接种。如果接种了出生剂量的乙型肝炎疫苗,则接种第1剂和第3剂ENGERIX-B疫苗。
d研究1: NCT01000974。
e HIBERIX、对照PRP-T或DTaP-IPV/Hib注射部位的局部反应。
f 3级疼痛定义为肢体移动时疼痛/自发疼痛。
g 3级易怒定义为无法安慰/阻止正常活动的哭闹。
H 3级嗜睡定义为妨碍正常的日常活动。
i3级食欲不振定义为完全不进食。
j发烧定义为直肠温度≥100.4℉(≥38.0℃);3级发烧定义为直肠温度>103.1℉(>39.5℃)。
表2.在使用HIBERIXb、对照PRP-Tb或DTaP-IPV/Hib接种加强疫苗a(15至18个月时接种第4剂)后4天内总疫苗接种队列c引起局部反应和一般不良反应的儿童百分比
| 不良反应 | HIBERIX % | 对照PRP-T % | DTaP-IPV/Hib % | |||
任何 | 3级d | 任何 | 3级d | 任何 | 3级d | |
| 局部e | n = 2,224 | n = 416 | n = 379 | |||
| 疼痛 | 41 | 1 | 43 | 1 | 43 | 2 |
| 红色 | 30 | 0 | 31 | 1 | 30 | 3 |
| 肿胀 | 18 | 1 | 20 | 1 | 20 | 3 |
一般 | n = 2,225 | n = 416 | n = 379 | |||
| 易怒 | 58 | 2 | 60 | 5 | 53 | 2 |
| 嗜睡 | 39 | 1 | 39 | 3 | 31 | 0 |
| 食欲不振 | 28 | 1 | 34 | 2 | 22 | 1 |
| 发烧f | 15 | 1 | 14 | 1 | 18 | 1 |
n =安全性数据可用的所有受试者。
受试者在2、4和6个月大时接受与加强剂量相同的疫苗初次接种。
a接种疫苗后4天内(定义为接种当天和接下来的3天)。
b加强剂量的HIBERIX和对照PRP-T(赛诺菲巴斯德公司)与INFANRIX(DTaP)同时接种。
c研究1: NCT01000974。
d 3级疼痛定义为肢体移动时疼痛/自发疼痛。
3级发红、肿胀定义为>20 mm
3级易怒定义为无法安慰/阻止正常活动的哭闹。
3级嗜睡定义为妨碍正常的日常活动。
3级食欲不振定义为完全不进食。
3级发热定义为腋下温度>102.2℉(>39.0℃)。
e . HIBERIX、对照PRP-T或DTaP-IPV/Hib注射部位的局部反应。
f发热定义为腋窝温度≥99.5℉(≥37.5℃)。
在德国进行的一项开放标签、多中心研究(研究2)中,371名儿童接受了与DTaP-HBV-IPV联合用药的强化剂量HIBERIX。接种疫苗时的平均年龄为16个月。本研究中的受试者之前接受过一系列的HIBERIX疫苗(n = 92)、对照PRP-T疫苗(赛诺菲巴斯德公司)(n = 96)或b型嗜血杆菌结合疫苗(惠氏制药公司)(不再在美国获得许可)(n = 183)。所有受试者之前都接受了3剂DTaP-HBV-IPV。表3列出了所报告的引发局部反应和一般不良反应的频率。
表3.DTaP-HBV-IPVc联合用药的HIBERIXb疫加强疫苗接种a(强化第4剂)后4天内出现局部反应和全身不良反应的儿童百分比,意向性治疗队列(n = 371)
不良反应 | % 任何 | % 三级 |
| 局部d | ||
| 红色 | 25 | 2e |
| 疼痛 | 21 | 1f |
| 肿胀 | 15 | 2e |
| 一般 | ||
| 发烧g | 35 | 4 |
| 易激 | 26 | 1h |
| 食欲不振 | 23 | 1i |
| 心神不定 | 22 | 1i |
| 瞌睡 | 20 | 1i |
| 腹泻 | 15 | 1i |
| 呕吐 | 5 | 1i |
n =安全性数据可用的所有受试者。
a接种疫苗后4天内(定义为接种当天和接下来的3天)。
b在这项研究中,92名受试者此前接受了3剂HIBERIX疫苗,96名受试者此前接受了3剂对照PRP-T疫苗(赛诺菲巴斯德公司),183名受试者此前接受了3剂美国不再许可的b型嗜血杆菌结合疫苗
c在本研究中,DTaP- HBV-IPV用于之前接受过3剂DTaP-HBV-IPV的受试者。在美国,PEDIARIX被批准用作3剂主要系列;美国未批准连续用作第四剂
D HIBERIX注射部位的局部反应。
e 3级发红或肿胀定义为>20 mm
f 3级疼痛定义为肢体移动时引起哭闹。
g .定义为直肠温度≥100.4℉(≥38.0℃)或腋窝、口腔或鼓膜温度≥99.5℉(≥37.5℃)的发热;3级发烧定义为直肠温度>103.1℉(>39.5℃)或腋窝、口腔或鼓膜温度>102.2℉(>39.0℃)。
h 3级烦躁定义为持续哭闹且无法得到安慰。
i这些症状被定义为妨碍正常日常活动3级。
严重不良反应
在研究1中,2,963名在2、4和6个月大时接种HIBERIX和联合疫苗的受试者中有一名出现了严重的不良反应,该反应与疫苗接种暂时相关,且没有其他可能的原因(第1剂后第14天出现痉挛)。在2,336名接受强化剂量HIBERIX并同时接受INFANRIX的受试者中,有一名受试者出现了严重的不良反应,该不良反应在时间上与
接种疫苗,且没有其他可能的原因(第4剂后第1天出现新的高热惊厥)。
在另外7项研究中,1,008名受试者中有2名报告了在使用HIBERIX加强免疫后的31天内发生的严重不良反应。一名受试者在接种疫苗后9天出现双侧肺炎,一名受试者在接种疫苗后18天意外服药后出现乏力。
6.2上市后体验
除了HIBERIX的临床试验报告外,在HIBERIX的上市后使用过程中还发现了以下不良反应。由于这些反应是由规模不确定的人群自愿报告的,因此无法可靠地估计其频率或建立与疫苗接种的因果关系。
全身疾病和接种部位条件
接种疫苗的肢体广泛肿胀,注射部位硬结。
免疫系统紊乱
过敏反应(包括过敏性和过敏样反应)、血管性水肿。
神经系统疾病
抽搐(伴或不伴发热)、低渗-低反应性发作(即突然出现低渗、低反应性和苍白或发绀)、嗜睡、晕厥或注射后的血管迷走神经反应。
呼吸、胸腔和纵隔疾病
窒息【参见警告和注意事项(5.3)】.
皮肤和皮下组织疾病
皮疹荨麻疹。
7药物相互作用
7.1对实验室测试的干扰
在一些疫苗接种者的尿液中检测到源自b型嗜血杆菌结合疫苗的b型嗜血杆菌荚膜多糖。1在接种含b型流感嗜血杆菌疫苗后1至2周内,尿液抗原检测对因b型流感嗜血杆菌引起的疑似疾病可能没有诊断价值,包括HIBERIX【参见警告和注意事项(5.6)】.
7.2伴随疫苗接种
在临床研究中,HIBERIX与常规推荐的儿科疫苗同时使用【参见临床研究(14.2)】。
7.3免疫抑制疗法
免疫抑制疗法(包括放疗、抗代谢药、烷化剂、细胞毒性药物和皮质类固醇(使用剂量超过生理剂量))可能会降低对HIBERIX的免疫反应。
8在特定人群中使用
8.4儿科使用
尚未确定HIBERIX在6周以下儿童和5至16岁儿童中的安全性和有效性。
11描述
HIBERIX【b型嗜血杆菌结合疫苗(破伤风类毒素结合疫苗)】是一种肌肉注射用溶液,以无菌冻干粉末形式提供,使用时用随附的生理盐水稀释液复溶。HIBERIX含有b型嗜血杆菌荚膜多糖(聚核糖基核糖醇磷酸酯【PRP】),一种由b型流感嗜血杆菌菌株20,752制备的高分子量聚合物,在经过热失活和纯化的合成培养基中生长。破伤风毒素,由在半合成培养基中生长的破伤风梭菌制备,用甲醛解毒并纯化。荚膜多糖与破伤风类毒素共价结合。纯化后,在乳糖作为稳定剂的存在下冻干缀合物。HIBERIX的稀释剂是一种无菌盐溶液(0.9%氯化钠),以小瓶或预装注射器形式提供。
复溶后,每份约0.5 mL剂量的HIBERIX含有10 μg与约25 μg破伤风类毒素结合的纯化荚膜多糖、12.6 mg乳糖和≤0.5 μg残留甲醛。
HIBERIX不含防腐剂。
含有冻干抗原成分或无菌生理盐水稀释液的小瓶的塞子和含有无菌生理盐水稀释液的预填充注射器的顶端盖帽和橡胶柱塞塞子不是由天然橡胶胶乳制成的。
12临床药理学
12.1作用机制
流感嗜血杆菌是一种革兰氏阴性球虫芽孢杆菌。引起侵袭性疾病的大多数流感嗜血杆菌菌株都是b型。b型流感嗜血杆菌可引起侵袭性疾病,如败血症和脑膜炎。
聚核糖基核糖醇磷酸酯(抗PRP)抗体的特定水平已被证明与针对侵袭性疾病的保护相关b型流感嗜血杆菌。基于被动抗体研究2和一项非偶联物临床疗效研究的数据嗜血杆菌b多糖疫苗3,0.15 μg/ mL的抗PRP浓度已被接受为最低防护等级。来自一项功效研究的数据嗜血杆菌b多糖疫苗表明,抗PRP浓度≥1.0 μg/ mL预示着至少1年的保护期。4,5这些抗体水平已用于评估b嗜血杆菌结合疫苗(包括HIBERIX)的有效性。
13非临床毒理学
13.1致癌、诱变、生育能力受损
尚未对HIBERIX的致癌性或致突变性或对生育能力的损害进行评估。
14 临床研究
14.1免疫学评估
初级系列疫苗接种(第1剂、第2剂和第3剂)
在一项随机对照试验(研究1)中评估了HIBERIX的免疫原性。HIBERIX或对照疫苗与美国许可的疫苗同时接种【参见不良反应(6.1)】.
表4列出了接种第3剂HIBERIX、对照PRP-T(赛诺菲巴斯德公司)或DTaP-IPV/Hib后1个月的抗PRP几何平均浓度(GMCs)和血清保护率。
表4.在2月龄、4月龄和6月龄接种HIBERIX、对照PRP-Ta或DTaP-IPV/Hibb,3剂后1个月的抗PRP GMCs和血清保护率, ATP免疫原性队列c
| 疫苗 | n | 抗PRP GMC ( μg/ mL) (95% CI ) | %抗PRP ≥0.15 μg/ mL (95% CI ) | %抗PRP ≥1.0 μg/ mL (95% CI ) |
| HIBERIX | 1,590 | 5.19 (4.77, 5.66) | 96.6 (95.6, 97.4) | 81.2 (79.2, 83.1) |
| 对照PRP-T | 274 | 6.74 (5.59, 8.13) | 96.7d (93.9, 98.5) | 89.8e (85.6, 93.1) |
| DTaP-IPV/Hib | 253 | 3.64 (2.89, 4.58) | 92.5f (88.5, 95.4) | 78.3f (72.7, 83.2) |
a美国许可的单价b型流感嗜血杆菌结合疫苗(对照PRP-T)(赛诺菲巴斯德公司)。
b美国许可的DTaP-IPV/Hib疫苗(赛诺菲巴斯德有限公司)。
c研究1: NCT01000974。
就抗PRP抗体≥0.15 μg/ mL的受试者百分比而言,HIBERIX不劣于对照PRP-T(HIBERIX减去对照PRP-T的差值的95%可信区间下限≥预定义的-5%)。
e未达到非劣效性标准(两组间抗PRP抗体≥1.0 mcg/mL的受试者百分比差异的95% CI 下限为-12.28%(HIBERIX减去对照PRP-T,低于预定义的下限-10%)。
f对DTaP-IPV/Hib疫苗接种后的抗PRP免疫反应的分析是探索性的。
加强疫苗接种(第4剂)
在研究1的一部分儿童(n = 336)中,评估了在15至18个月大时作为加强剂量使用的HIBERIX的免疫原性,并与在2、4和6个月大时初次接种的美国许可疫苗进行了比较【参见不良反应 (6.1)]。强化剂量的HIBERIX和对照药物PRP-T(赛诺菲巴斯德公司)与INFANRIX同时接种。
在用HIBERIX疫苗或对照疫苗进行加强接种之前和之后1个月获得的血清中测量了PRP抗体。表5显示了抗PRP GMCs和血清保护率。
表5.接种(15至18月龄时的第4剂)HIBERIX、对照PRP-Ta或DTaP-IPV/Hibb接种前和接种后1个月的抗PRP GMCs和血清保护率,ATP队列的免疫原性c
| 疫苗 | n | 抗PRP GMC ( μg/ mL) (95% CI ) | %抗PRP ≥0.15 μg/ mL (95% CI ) | %抗PRP ≥1.0 μg/ mL (95% CI ) | |||
| 免前 | 免后 | 免前 | 免后 | 免前 | 免后 | ||
| HIBERIX | 329-336 | 0.50 (0.42, 0.59) | 48.78 (42.0, 56.66) | 75.1 (70.0, 79.7) | 100.0 (98.9, 100.0) | 32.2 (27.2, 37.6) | 99.1 (97.4, 99.8) |
| 对照PRP-T | 226-236 | 0.47 (0.38,0.57) | 40.29 (33.39,48.63) | 76.1 (70.0,81.5) | 99.6 (97.7,100.0) | 27.0 (21.3,33.3) | 97.9d (95.1,99.3) |
| DTaP-IPV/Hib | 175-186 | 0.38 (0.30,0.48) | 37.54 (30.53,46.16) | 66.3 (58.8,73.2) | 100.0 (98.0,100.0) | 25.1 (18.9,32.2) | 98.9e (96.2,99.9) |
a美国许可的单价b型流感嗜血杆菌结合疫苗(对照PRP-T)(赛诺菲巴斯德公司)。
b美国许可的DTaP-IPV/Hib疫苗(赛诺菲巴斯德有限公司)。
c研究1: NCT01000974。
d在加强剂量接种后1个月,达到抗PRP抗体≥1.0 μg/ mL的受试者百分比(HIBERIX减去对照PRP-T≥预定限值-10%的差值的97.5%置信下限)方面,HIBERIX不劣于对照PRP-T。
e对DTaP-IPV/Hib疫苗接种后的抗PRP免疫反应的分析是探索性的。
在另外6项临床研究中,共评估了415名12至23个月大的儿童对HIBERIX加强剂量的免疫反应。在接种疫苗时,30名儿童年龄在12至14个月之间,316名儿童年龄在15至18个月之间,69名儿童年龄在19至23个月之间。在受试者中,43%至60%为男性。在有种族/民族信息的受试者中,几乎所有受试者都是白人。没有一项研究包括接受美国许可的b型嗜血杆菌结合疫苗加强剂量的对照组。表6列出了其中3项研究的特征。
表6.3项HIBERIX疫苗开放性强化免疫研究的特点
研究 | 国家 | 按方案排列的免疫原性队列n | 初免历史 | HIBERIX加强疫苗接种 | |
| 接种疫苗 (月龄) | 同时接种疫苗a | ||||
| 3 | 加拿大 | 42 | 在2、4和6月龄时接种DTaP-HBV-IPVb+b嗜血杆菌结合疫苗c | 16- 18 | DTaP-HBV- IPVb |
| 4 | 加拿大 | 64 | 2月龄、4月龄和6月龄的DTaP-IPVd + HIBERIX | 16- 19 | DTaP-IPVd |
| 5 | 德国 | 108 | 3、4和5月龄的DTaP-HBVe + HIBERIX | 16-23 | DTaP-HBVe |
a在单独的地点接种。
b相当于PEDIARIX的非美国配方,不同之处在于每剂含有2.5 mg 2-苯氧基乙醇作为防腐剂。在美国,PEDIARIX被批准用作3剂主要系列;美国未批准连续第四次使用。
c美国许可的b型流感嗜血杆菌结合疫苗(对照PRP-T)(赛诺菲巴斯德公司)。
d非美国的配方,相当于KINRIX,但每剂含有2.5 mg 2-苯氧乙醇作为防腐剂除外。在美国,KINRIX被批准用于第五剂DTaP和第四剂IPV,用于4-6岁儿童,之前已批准的婴儿和/或儿科剂量方案。DTaP-IPV的接种方案在美国还未获得批准
e由葛兰素史克生物制品公司生产(未在美国获得许可)。
在HIBERIX加强疫苗接种前和接种后1个月获得的血清中检测了PRP抗体。表7显示了几何平均浓度和抗PRP血清保护率。
表7.加强剂量HIBERIX之前和之后1个月的抗PRP GMCs和血清保护率,符合方案的免疫原性队列
研究 | n | 抗PRP GMC( μg/ mL) | %抗PRP ≥0.15 μg/ mL | %抗PRP ≥1.0 μg/ mL | |||
| 免前 | 免后 | 免前 | 免后 | 免前 | 免后 | ||
3a | 42 | 0.46 | 59.07 | 76.2 | 100 | 35.7 | 97.6 |
| 4b | 63-64 | 0.25 | 47.78 | 71.4 | 100 | 12.7 | 100 |
| 5c | 108 | 0.59 | 96.12 | 77.8 | 100 | 32.4 | 100 |
GMC =几何平均抗体浓度。
n =在接种前和接种后免疫评估中获得血清学结果的儿童人数。
研究3、4和5分别对应于表6中的研究3、4和5。
a加拿大的一项研究针对16至18个月大的儿童,这些儿童之前接种过3剂DTaP- HBV-IPV和b型嗜血杆菌结合疫苗(对照PRP-T)(赛诺菲巴斯德公司)。加强剂量的 HIBERIX与DTaP-HBV-IPV联合接种(第四次连续接种的PEDIARIX未获美国批准)。在这项研究中,接种前血清可能在使用HIBERIX加强接种前1周获得。
b加拿大在16至19个月的儿童中进行的研究,这些儿童以前接种过3剂DTaP- IPV和HIBERIX疫苗。加强剂量的HIBERIX与DTaP-IPV共同接种。DTaP-IPV接种方案在美国未获批准
c德国在16至23个月的儿童中进行的研究,这些儿童之前接受过3剂DTaP- HBV(葛兰素史克生物制剂,未在美国获得许可)和HIBERIX。加强剂量的HIBERIX与DTaP-HBV共同接种。
14.2伴随疫苗接种
初级系列疫苗接种(第1剂、第2剂和第3剂)
在美国研究1中,在2、4和6个月大时同时接受HIBERIX疫苗和PEDIARIX疫苗(DTaP-HBV- IPV)和PCV13疫苗的受试者,相对于同时接受对照PRP-T疫苗(赛诺菲巴斯德公司)和PEDIARIX疫苗(DTaP-HBV-IPV)和PCV13疫苗的对照组受试者,没有证据表明其对百日咳抗原(百日咳毒素的GMC、丝状血凝素和pertactin)、白喉类毒素(抗体水平≥0.1 IU/mL 6 和3(对每种病毒的抗体水平≥1:8)、PCV13(对每种血清型的抗体水平≥0.2 mcg/mL和GMC)或乙肝(抗乙肝表面抗原≥10 mIU/mL)。 在第3剂后1个月评估对PEDIARIX(DTaP-HBV-IPV)和PCV13的免疫反应。两组受试者在2个月和4个月大时接受ROTARIX疫苗注射。
加强疫苗接种(第4剂)
在美国研究1中,在15至18个月大时接受强化剂量的HIBERIX疫苗和INFANRIX疫苗的受试者没有证据表明对以下疫苗的抗体反应降低,百日咳抗原(百日咳毒素的GMC、丝状血凝素和百日咳杆菌素)、白喉类毒素(抗体水平≥0.1 IU/mL)和破伤风类毒素(抗体水平≥0.1 IU/mL),相对于与INFANRIX同时接种对照PRP-T(赛诺菲巴斯德公司)的对照受试者的反应。
在另外7项研究中,加强剂量的HIBERIX与非美国配方的INFANRIX、KINRIX和PEDIARIX同时接种。非美国配方的KINRIX和PEDIARIX药物的接种方案在美国未获批准。
没有足够的数据证实与加强剂量的HIBERIX同时接种对除INFANRIX以外的其他疫苗的免疫反应没有干扰。
15参考文献
1.Rothstein EP,Madore DV,Girone JAC等。三种b型流感嗜血杆菌结合疫苗免疫后抗遗尿症的比较。儿科传染病杂志。1991;10:311-314.
2.“自然”和免疫诱导的定量测量b型流感嗜血杆菌荚膜多糖抗体。儿科水库1973;7:103-110.
3.佩尔托拉·H、凯希·H、西沃宁·A等。流感嗜血杆菌儿童b型荚膜多糖疫苗:在芬兰对100,000名3个月至5岁的接种者进行的双盲现场研究。儿科。1977;60:730-737.
4.凯希H,佩尔托拉H,卡兰科V,等。猪荚膜多糖的血清抗体保护水平b型流感嗜血杆菌。传染疾病。1983;147:1100.
5.血清抗体对荚膜多糖的保护水平b型流感嗜血杆菌。传染疾病。1984;149:1034.
16如何供应/储存和搬运
HIBERIX药瓶和药瓶包装在纸箱中,不含注射器或针头(NDC 58160-818-11),内含:
10瓶单剂量的亲脂性抗原成分(NDC 58160-816-01)装在一个纸箱中:NDC 58160-816-05。
10瓶单剂量无菌生理盐水稀释液(NDC 58160-817-01)装在一个纸箱中:NDC 58160- 817-05。
HIBERIX药瓶和预充式注射器装在一个纸箱(NDC 58160-726-15)中,纸箱内装有:
10瓶单剂量亲脂性抗原成分:NDC 58160-816-03。
10支无针头包装的单剂量、预灌装、无梯度TIP-LOK注射器(Luer Lock注射器)NDC 58160-817-02。
TIP-LOK注射器将与Luer Lock兼容针头一起使用。
含有冻干抗原成分或无菌生理盐水稀释液的小瓶的塞子和含有无菌生理盐水稀释液的预填充注射器的顶端盖帽和橡胶柱塞塞子不是由天然橡胶胶乳制成的。
16.1复溶前的储存
冻干抗原成分小瓶:在2至8℃(36至46℉)之间冷藏储存。保护小瓶免受光照。
无菌生理盐水稀释液预灌装注射器和小瓶:冷藏或在2至25℃(36至77℉)的受控室温下储存。不要冻结。如果稀释剂已经冻结,请丢弃。
17患者咨询信息
告知父母或监护人接种HIBERIX疫苗的潜在益处和风险。
告知父母或监护人接种HIBERIX或其他含有类似成分的疫苗可能会出现暂时的不良反应。
向父母或监护人提供疫苗信息声明,这是1986年《国家儿童疫苗伤害法>要求在免疫接种前提供的。疾病控制和预防中心免费提供这些材料
美国疾病预防控制中心网站(www.cdc.gov/vaccines).
商标归葛兰素史克集团所有或许可给该集团使用。
葛兰素史克生物制品公司生产
比利时Rixensart美国许可证1617和
葛兰素史克公司分销
北卡罗来纳州达勒姆市,邮编27701
2023 GSK集团公司或其许可方。
HRX:9PI
Hits: 85