Contents
- 0.1 疾病
- 0.2 疾病的病史和流行病学
- 0.3 孩子
- 0.4 孕妇和新生儿
- 0.5 COVID-19疫苗
- 0.6 疫苗有效性
- 0.7 加强免疫接种
- 0.8 突变株疫苗
- 0.9 真实世界的有效性
- 0.10 安全
- 0.11 存储
- 0.12 包装
- 0.13 剂量和时间表
- 0.14 接种
- 0.15 COVID-19大流行免疫接种计划
- 0.16 与 COVID-19疫苗接种一起生活计划
- 1 特殊说明:
COVID-19: the green book, chapter 14a
2025年9月1日
COVID-19–SARS-CoV-2 应通报
疾病
COVID-19是由SARS-CoV-2病毒引起的呼吸道疾病,SARS-CoV-2病毒是冠状病毒科和β冠状病毒属的RNA病毒(Zhuetal,2020)。与其他冠状病毒一样,SARS-CoV-2编码四种主要结构蛋白,刺突蛋白(S)、膜(M)、包膜(E)和螺旋核衣壳(N)(Dhama等人,2020年)S糖蛋白被认为是主要抗原靶标,包括与宿主细胞上的血管紧张素转换酶2(ACE2)结合的受体结合域(RBD)(Kaur等人,2020年,Amanat等人,2020)。
SARS-CoV-2主要通过呼吸道飞沫和气溶胶以及人与人之间的直接接触传播。污染物的作用似乎在传播中起着次要作用。(Goldman等人,2020年)。病毒RNA可在症状出现后7-12天在呼吸道样本中持续存在,病毒载量在症状出现后不久最高。
家庭内的继发性发病率很高(LopezBernal等人,2020年)。原始野生型毒株的估计繁殖数(R0)为2.8,随后的毒株变得更具传染性。Delta毒株的R0估计为5.1,而2021年底出现的Omicron毒株的R0估计为9.5(Liu等人,2022年)。
常见症状包括头痛、疲劳、咳嗽和肌肉酸痛。在严重的情况下,COVID-19会导致肺炎、急性呼吸窘迫综合征、多器官衰竭和死亡。与以前的突变株相比,Omicron不太可能导致嗅觉丧失(嗅觉丧失),而更有可能引起喉咙痛(Menni等人,2022年,Pachetti等人,2020年)。
COVID-19感染的长期后遗症,被称为长期COVID或SARS-CoV-2急性后遗症(PASC)感染,是一个正在进行的研究领域。在英国,4.5%的病例在初次感染后12-16周报告出现长期症状。报告的症状多种多样,涉及大多数器官系统,影响身心健康(Crook等人,2022年)。
由于先前感染引起的自然免疫力持续长达1年,然后开始减弱(Halletal,2022),尽管新的毒株和突变株(如Omicron)似乎表现出更大的免疫逃逸能力,使再次感染更加普遍。
疾病的病史和流行病学
2019年底,中国武汉首次出现了不明原因严重呼吸道感染的初步报告(WHO,2020年),随后测序的下呼吸道样本检测到了一种新型冠状病毒(Huangetal,2020)。2020年3月,世界卫生组织(WHO)宣布SARS-CoV-2大流行(WHO总干事,2020年)。截至2022年10月,英格兰已确诊超过2000万例COVID-19发作,全球超过6亿例。
第一批COVID病例最初于2020年1月在英国发现,并于2月发现更多病例。整个3月,病例持续上升,直到2020年3月23日实施全国封锁。
在英国的第一波疫情期间,COVID-19的感染死亡率(IFR)是通过将死亡率数据与血清阳性率研究中的感染率相结合得出的,显示最年长年龄组的IFR明显更高(Ward等人,2020年)。在大流行的第一年,当预计大多数人都易感时,75岁以上人群感染COVID后的累积死亡率最高;男性的死亡率高于女性(表1)。
2020年秋季,Alpha突变株首次在肯特郡被发现,该突变株因其对野生型的传播性增加而著称。到2020年12月,Alpha已成为英国的主要毒株。2021年4月,首次在印度观察到的Delta突变株在英国被发现,并在2021年7月成为主导突变株。2021年12月3日,首次在南非观察到的Omicron突变株到达英国,到2021年12月17日成为主要突变株。总体而言,奥密克戎已被证明引起的疾病比以前的毒株轻,尽管在人群因接种疫苗和先前感染而具有免疫力的背景下。与Delta相比,Omicron导致住院的可能性是40%,导致死亡的可能性是30%。Nybergetal.,2022)。
2022年期间,奥密克戎变异株的连续亚谱系(BA.1、BA.2、BA.4、BA.5)传播,通常与发病率增加有关(图1)。近期毒株与较低严重结局发生率相关(表1),但明显的年龄差异很明显。
在2023年1月至2023年12月期间,出现了以XBB表示的Omicron亚谱系的衍生毒株,并且与发病率的任何重大增加无关。一种新型Omicron毒株,命名为BA.2.86,于2023年8月首次被发现,其基因组与主要的XBB毒株非常不同。到2024年初,BA.2.86没有发生重大出现,但一种名为JN.1的相关毒株已开始占主导地位,并与活动的适度增加有关,成为2023年12月和2024年1月的主要突变株。JN.1突变株的亚突变株随后流行率增加,KP.1/KP.2(称为“FLiRT”突变株)和KP.3(“FLuQE”突变株)与2024年中期COVID-19活动的增加有关。
在整个2024年底和2025年初,两种病毒的患病率有所增加,即KP.3.1.1,这是先前流行的KP.3突变株的进一步亚谱,以及XEC,KP3.3和KS.1.1的重组体,都是JN.1的亚系。
有关正在调查的新变种的信息包含在每周的全国流感和COVID-19监测报告中。https://www.gov.uk/government/statistics/national-flu-and-covid-19-surveillance年2023年至2024年赛季报告
表1:2023年9月至2024年9月按年龄组划分的COVID-19结果
| A&E出勤率 | 收治住院 | 严重 住院治疗 | 死亡 | |||||
| n | 比率 | n | 比率 | n | 比率 | n | 比率 | |
| <6月龄 | 5,424 | 1,819.1 | 4,753 | 1,594.1 | 80 | 26.8 | 6 | 2 |
| 6月龄–<1岁 | 1,241 | 394.4 | 869 | 276.2 | 15 | 4.8 | 2 | 0.6 |
| 1-4 | 2,099 | 77.4 | 1,497 | 55.2 | 37 | 1.4 | 4 | 0.1 |
| 5-9 | 862 | 25.7 | 615 | 18.4 | 19 | 0.6 | 5 | 0.1 |
| 10-19 | 1,634 | 23.6 | 919 | 13.3 | 34 | 0.5 | 14 | 0.2 |
| 20-29 | 3,331 | 46 | 1,783 | 24.6 | 35 | 0.5 | 13 | 0.2 |
| 30-39 | 4,079 | 51.2 | 2,399 | 30.1 | 41 | 0.5 | 29 | 0.4 |
| 40-49 | 3,871 | 53.6 | 2,442 | 33.8 | 83 | 1.1 | 99 | 1.4 |
| 50-59 | 5,863 | 76.4 | 4,459 | 58.1 | 208 | 2.7 | 358 | 4.7 |
| 60-69 | 8,325 | 131 | 7,492 | 117.9 | 390 | 6.1 | 892 | 14 |
| 70-79 | 14,217 | 285.6 | 14,561 | 292.6 | 571 | 11.5 | 2,610 | 52.4 |
| ≥80 | 21,795 | 745.6 | 25,321 | 866.2 | 423 | 14.5 | 7,029 | 240.5 |
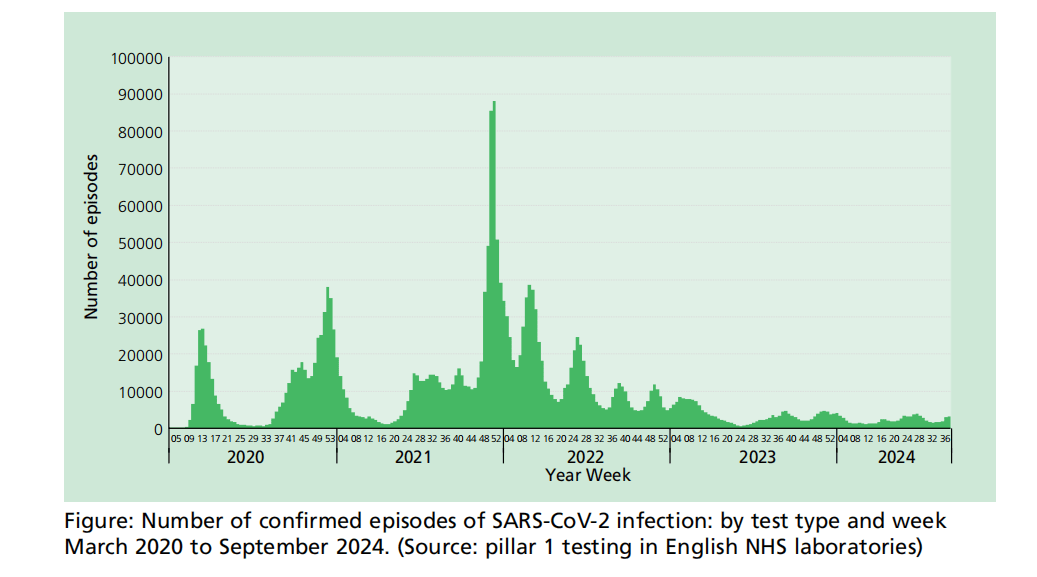
图:确诊的SARS-CoV-2感染发作次数:按检测类型和2020年3月至2024年9月的每周分列。(资料来源:英国NHS实验室的第一支柱测试)
孩子
一般来说,SARS-CoV-2感染儿童保持无症状或发展为轻度疾病,通常伴有上呼吸道症状,但症状可能是非特异性和非典型的,影响其他器官系统。自2021年11月以来,随着Omicron突变株和亚突变株的出现和快速传播,英国几乎所有儿童现在都有针对SARS-CoV-2的抗体;主要是由于最年轻年龄组的自然感染。
需要住院治疗的严重COVID-19在儿童中很少见,死亡更是如此,在0-19岁儿童中,感染死亡率不到1/100,000感染(Bertran等人,2022年)。
与SARS-CoV-2暂时相关的儿科多系统炎症综合征感染(PIMS-TS),在美国被称为儿童多系统炎症综合征(MIS-C),一种类似于川崎病的表现,于2020年4月首次被发现,估计每3,000名儿童中约有1名受到影响。这种综合征最常见于6至12岁的男性儿童,并且病例的出现比COVID-19病例晚了4周左右。(Feldstein等人,2021年)。
英国的PIMS-TS风险在Delta浪潮期间下降,在Omicron浪潮之后进一步下降,这可能是由于儿童对病毒的自然免疫力和疫苗诱导的免疫力以及最近的SARS-CoV-2突变株的关键突变(Shingleton等人,2022年;Cohenetal.,2022)。
大多数儿童在急性SARS-CoV-2感染后完全康复,任何持续性系统都会随着时间的推移而改善(Rytter等人,2021年)。从急性SARS-CoV-2感染中恢复后出现严重的长期并发症在儿童中也很少见,并且正在进行研究以评估纵向随访研究中的风险和结果。
孕妇和新生儿
与非育龄妇女相比,患有COVID-19的孕妇和最近怀孕的妇女更有可能入住重症监护病房,接受有创通气或体外膜肺氧合(Allotey等人,2021年)。
英国早期研究表明,受感染妇女的死产率高于背景(Allotey等人,2020年,Gurol-UrganCI 等人,2021年)。患有有症状的COVID-19女性早产的风险也会增加(Vousden等人,2021年),通常是由于医学建议提前分娩以改善产妇氧合。
如果孕妇超重或肥胖、具有黑人和亚裔少数民族背景、患有糖尿病、高血压和哮喘等合并症,或者年满35岁,则更有可能感染严重的COVID-19(Vousden等人,2021年,Allotey等人,2020年)。
在英国,感染COVID-19后孕妇和新生儿面临的风险似乎在大流行过程中发生了变化。在野生型SARS-CoV-2优势期到Delta优势期之间,重症监护病房收治的孕妇比例、孕产妇死亡率、死产率和新生儿死亡人数都有所增加。(Vousden等人,2021a,Knight等人,2022年)。
1NICE指南25,2019 https://www.nice.org.uk/guidance/ng25
相比之下,感染SARS-CoV-2的孕妇在Omicron期间早产或产妇重症监护入院的可能性远低于Delta时期;在Omicron时期观察到较少的死产和无新生儿死亡(Stock等人,2022年)。尽管如此,即使在Omicron时代,未接种疫苗的女性COVID-19的严重程度似乎高于接种疫苗的女性(Engjom等人,2022年)。
COVID-19疫苗
对大流行的认识加速了几种疫苗的开发和测试,利用在以前的紧急情况下调查的平台,例如SARS大流行(Amanat等人,2020年)和西非的埃博拉病毒。候选疫苗包括核酸疫苗、灭活病毒疫苗、减毒活疫苗、蛋白或肽亚单位疫苗和病毒载体疫苗。
大多数候选疫苗侧重于针对刺突(S)蛋白的免疫,刺突(S)蛋白是中和抗体的主要靶标。通过阻止刺突蛋白受体结合基序(RBM)和宿主细胞血管紧张素转换酶2(ACE2)之间的相互作用来阻止病毒进入宿主细胞的中和抗体有望具有保护作用(Addetia等人,2020年,Thompson等人,2020年)。
英国最初获准用于初级免疫接种的所有疫苗都针对原始SARS-CoV-2毒株的S蛋白;两项使用mRNA平台(辉瑞-BioNTech COVID-19 BNT162b2疫苗(Comirnaty®)和莫德纳mRNA-1273 COVID-19疫苗(Spikevax®)),两项使用腺病毒载体(阿斯利康COVID-19 ChAdOx1-S疫苗/Vaxzevria®和 COVID-19疫苗杨森Ad26.COV2-S[重组]),一种使用重组S蛋白(在杆状病毒感染的昆虫细胞中生长)作为基质-MTM佐剂(NovavaxNuvaxovid®)的抗原。后一种佐剂包括两种来源于树皮的皂苷。最近批准的加强疫苗(赛诺菲巴斯德、VidPrevtynBeta®)也使用重组S蛋白,但针对Beta突变株并使用不同的佐剂(参见突变株疫苗部分)。
阿斯利康COVID-19 ChAdOx1-S疫苗/Vaxzevria®在首次疫苗接种活动期间被广泛使用,但未常规用作加强剂,在英国也不再可用。 COVID-19疫苗杨森从未在英国供应过常规使用。NHS计划为那些mRNA不耐受的人使用了少量的Nuvaxovid®(他们的突变株适应疫苗Nuaxovid®XBB.1.5将于2024年在英国私人市场上市)。
辉瑞-BioNTech 和Moderna COVID-19疫苗已用于英国计划的大部分,是核苷修饰的信使RNA(mRNA)疫苗。mRNA疫苗使用病原体的遗传密码作为疫苗;然后利用宿主细胞翻译代码,然后制备目标刺突蛋白。然后,该蛋白质充当细胞内抗原以刺激免疫反应(Amanatetal,2020)。然后mRNA通常会在几天内降解。ModernamRNA-1273和辉瑞-BioNTech COVID-19 BNT162b2疫苗都完全在体外产生,并配制在被宿主细胞吸收的脂质纳米颗粒中(Vogel等人,2020年,Jackson等人,2020年)。在1期研究中,辉瑞疫苗在18-55岁和65-85岁的健康成年人中进行了测试,辉瑞选择了30微克剂量的 BNT162b2疫苗产品作为2/3期试验的主要候选者(Walsh等人,2020年)。ModernamRNA-1273疫苗在18-55岁的人群中进行了三个剂量水平的测试,并为100期研究选择了3微克剂量(Jackson等人,2020年)。
阿斯利康 COVID-19疫苗使用复制缺陷型黑猩猩腺病毒(ChAd)作为载体,将全长SARS-CoV-2刺突蛋白基因序列递送到宿主细胞中(VanDoremalen等人,2020年)。腺病毒载体在人细胞系(HEK293)中生长(参见第1章)。ChAd是一种无包膜病毒;糖蛋白抗原不存在于载体中,而只有在载体内的遗传密码进入靶细胞后才会表达。载体基因也被修饰以使病毒复制无效,并增强免疫原性(Garafalo等人,2020年)。一旦载体进入细胞核,就会产生编码刺突蛋白的mRNA,然后进入细胞质。然后导致靶蛋白的翻译,靶蛋白充当细胞内抗原。
疫苗有效性
辉瑞-BioNTech COVID-19 BNT162b2疫苗(Comirnaty®)
在1/2期人体试验中,在初免和加强疫苗接种后,中和抗体与恢复期患者相当或更高。与65至85岁年龄组相比,18至55岁年龄组的中和抗体反应通常更高,但反应与两个年龄组的恢复期患者的水平相当(Vogel等人,2020年)。
一项3期研究在大约44,000名12岁及以上的人中进行,第二剂在19至42天内接种。作为3期研究的一部分进行的初步分析表明,两剂疫苗对16岁及以上人群以及野生型病毒症状性疾病的有效性为 95% 。疗效在年龄、性别和种族以及存在合并症(包括哮喘、肥胖、糖尿病、高血压和肺病)的情况下是一致的。在65至75岁和75岁及以上的未免疫参与者中,疗效分别为94.7%( 95% CI 66.7-99.9%)和100%( 95% CI -13.1-100%)。当分析包括那些有先前免疫证据的患者时,疗效仍然很高。已公布的辉瑞-BioNTech 疫苗第1剂和第2剂之间的疗效为52.4%( 95% CI 29.5-68.4%)。根据3期研究中累积的病例时间,两剂之间的大多数疫苗失败发生在接种疫苗后不久,这表明从接种疫苗后第10天开始,第1剂的短期保护作用非常高(Polack等人,2020年)。使用第15天至第21天之间观察到的病例的数据,首次给药后对有症状的COVID-19的疗效估计为89%( 95% CI 52-97%)。(https://www.fda.gov/media/144246/download)
辉瑞-BioNTech COVID-19疫苗BNT162b2于2020年12月2日获得英国药品和保健产品监管局(MHRA)的批准在英国供应。
在对2000多名12-15岁儿童进行研究并产生额外的安全性和有效性数据后,2021年6月批准将30微克剂量扩大到该年龄段的人群。
2021年9月,MHRA批准在完成mRNA或腺病毒载体疫苗的基本疗程后至少8周,使用30微克剂量的辉瑞-BioNTech 疫苗作为第三剂或加强剂。
在5-11岁儿童中使用10微克剂量的儿童疫苗的试验显示,与16-25岁儿童的成人/青少年全剂量(30μg)相比,抗体反应相当,反应原性略低。2021年12月,MHRA批准了10微克剂量的儿科配方,用于5-11岁儿童的初级疫苗接种。
已经对6个月至4岁的人群使用3μg剂量进行了研究,结果表明,在未接受治疗的参与者中,需要三剂才能提供与原始毒株相似水平的抗体,这与在成人中观察到的两剂疗程后观察到的抗体水平相似。这与在占主导地位的Omicron时代超过70%的疫苗有效性(主要是针对轻度疾病)有关。2022年12月,MHRA批准了3微克剂量的婴儿配方,用于6个月至4岁儿童的初级疫苗接种。
阿斯利康 COVID-19疫苗(Vaxzevria®)
在1/2期人体试验中,在18-55岁的健康成年人中将阿斯利康 COVID-19疫苗与脑膜炎球菌结合疫苗(MenACWY)对照进行了比较(Folegatti等人,2020年)。初步研究结果表明,在第一次接种疫苗后的第14天和第28天诱导了中和抗体,并且在第二次接种后滴度增加。单次免疫后也诱导了特异性T细胞反应,并在第二次免疫后维持。最终数据显示,第二剂后28天的IgG刺突抗体反应和中和抗体在三个年龄组(18-55岁、56-69岁和≥70岁)中相似。超过99%(208/209)的参与者在第二剂后两周出现中和抗体反应。第一次给药后14天观察到T细胞反应峰值,并且在三个年龄组中大致相同(Ramasamy等人,2020年)。在3期研究中对11,000多名患者的分析中,疫苗对有症状疾病的总体疗效为70.4%( 95% CI :54.8–80.6%)(Voysey等人,2020年)。有10例因COVID-19住院,其中2例病情严重,都在对照组中,这表明对严重疾病的保护作用非常高。从第1剂后21天到第2剂后两周,可以看到对住院的高保护,这表明单剂将提供对严重疾病的高短期保护(Voysey等人,2020年)。对接受过一剂标准剂量疫苗的参与者的探索性分析表明,对有症状的COVID-19的疗效为73.0%( 95% CI :48.79-85.76%)。
阿斯利康 COVID-19疫苗于2020年12月30日获得MHRA批准在英国供应。
2021年9月,MHRA批准在完成阿斯利康疫苗基础疗程后至少8周使用阿斯利康疫苗作为第三剂或加强剂。
莫德纳 COVID-19疫苗(Spikevax®)
在ModernamRNA-1273疫苗的1期测试中,所有患者在第一剂疫苗后通过酶联免疫吸附测定(ELISA)血清转化为IgG。在两次100μg剂量的ModernamRNA-1273后,在所有参与者中检测到假中和和野生病毒中和反应。对30,000多名志愿者进行的3期安慰剂对照测试显示,疫苗对野生型病毒引起的症状性疾病的有效性为94.1%。65岁以上患者的疗效相似。疫苗对严重COVID-19的有效性为100%( 95% CI :87.0-100%)(Baden等人,2020年)。
3期研究的累积病例数显示,从第一剂后约14天开始,疫苗组和安慰剂组之间存在明显差异。对从第一次给药后15天到第二次给药时间的3期数据进行重新分析,表明单次给药对有症状疾病的疗效为92.1%。
莫德纳疫苗(Spikevax®)于2021年1月在英国获准使用。在进一步研究儿童的安全性和有效性后,批准于2021年8月扩大到12-17岁。2022年,半剂(50微克)莫德纳 COVID-19疫苗(Spikevax®)随后被批准用于6至11岁的人群。
Novavax COVID-19疫苗(Nuvaxovid®)
在一项2期研究中,选择了5微克重组S蛋白剂量和50微克Matrix-M™佐剂(Mallory等人,2021年)。英国(Heath等人,2021年)和美国(Dunkle等人,2021年)的大型疫苗功效研究表明,对有症状感染的效力为90%,对重症的效力为100%。在Beta突变株传播期间,南非的一项试验也显示了49%的疗效(Shinde等人,2021年)。
Novavax疫苗于2022年2月被批准用于初级疫苗接种。该疫苗于2022年11月被批准作为异源加强剂,针对XBB.1.5毒株的更新形式于2023年12月获得批准(见下文)。
加强免疫接种
英国的加强研究表明,第三剂成人阿斯利康、诺瓦瓦克斯、莫德纳和辉瑞-BioNTech 疫苗成功地加强了大约3个月前接种两剂辉瑞-BioNTech 或阿斯利康疫苗的个体(Munro等人,2021年)。当mRNA疫苗用作异源或同源加强针,或在辉瑞-BioNTech 初次疗程后使用阿斯利康作为异源加强针时,IgG和中和抗体(包括针对Delta突变株的抗体)水平通常较高。尽管在接种相同疫苗的人中,阿斯利康加强针后的抗体水平最低,但水平与第二剂后一样好或更好;这些抗体水平与对严重疾病和死亡的高水平保护相关。这一发现在一项研究中得到证实,该研究在第二剂后六个多月给予第三剂阿斯利康。(Flaxman等人,2021年)。一项单独的研究在接受Moderna初次疗程(100μg)的患者中使用半剂量Moderna(50μg)显示良好的免疫原性,反应率与第二剂Moderna相似。(Choi等人,2021年)。
突变株疫苗
在认识到Omicron突变株成为2022年全球主要流行的毒株后,许多疫苗制造商迅速开发了第二代疫苗,这些疫苗对SARS-CoV-2突变株具有更广泛的覆盖范围。那些获得批准或即将获得许可的人最初是作为加强剂开发的,并且已经用另一种毒株取代了原始疫苗株的刺突蛋白,或者开发了一种针对较新突变株的刺突蛋白序列的配方,加上或减去来自祖先毒株的刺突蛋白序列。那些使用成熟形式的疫苗,例如mRNA疫苗,已根据免疫桥接获得许可,即显示中和抗体反应对祖先毒株的非劣效性,对变异毒株的中和抗体反应可能更高。二价原疫苗和OmicronBA.1mRNA疫苗获得批准,并于2022年秋季在英国首次用于加强疫苗接种。到目前为止,新变种的出现太快了,无法及时掺入新毒株以抢先预防疾病的增加。2022年底,发病率主要是由OmicronBA.4和BA.5感染驱动的。根据动物研究数据,根据动物研究数据,针对BA.4/5毒株的mRNA疫苗于2022年11月在英国获得批准。Moderna二价疫苗(Spikevax®二价原始/Omicron疫苗)于2022年8月被MHRA批准用作加强剂。该疫苗含有25微克针对祖先毒株的mRNA和25微克针对奥密克戎BA.1的mRNA。辉瑞-BioNTech 制造的类似制剂(原始/OmicronBA.1Comirnaty®)含有15微克针对祖先毒株的mRNA和15微克针对OmicronBA.1的mRNA,于2022年9月获得MHRA批准。
总体而言,与等效的原始疫苗相比,第一剂二价突变株mRNA疫苗(靶向BA.1)的加强剂量对匹配的毒株显示出优异的免疫原性,对历史毒株的免疫原性略有提高。这些二价BA.1疫苗在2022年秋季计划中使用,尽管它们对2022年底出现的下一个突变株(BA.4/5)产生的抗体水平较低。然后将这些二价疫苗更新为靶向BA.4/5。靶向BA.4/5的成人二价mRNA疫苗于2023年初获得批准,并在2023年春季计划中使用。
赛诺菲巴斯德 COVID-19疫苗(VidPrevtynBeta®)
2022年12月,一种基于Beta突变株重组刺突蛋白的疫苗在英国获得批准。该疫苗(VidPrevtynBeta®)由赛诺菲巴斯德生产,并使用AS03佐剂系统。这种佐剂是为在大流行期间使用而开发的,并在2010-2011年被用作H1N1v流感疫苗的一部分。它与佐剂流感疫苗中使用的MF59相似,因为它含有角鲨烯,但也含有DL-a-生育酚——一种维生素E形式,有助于调节先天免疫系统,从而进一步增强免疫反应。VidPrevtynBeta®已显示出作为初级疫苗的有效性,然后在接受mRNA或腺病毒疫苗初级疫苗接种的成年人中作为加强剂进行了研究。
虽然针对Beta突变株,但赛诺菲巴斯德 COVID-19疫苗(VidPrevtynBeta®)的加强剂量实现了与针对BA.1的二价mRNA疫苗后看到的相似水平的针对原始、Beta、Delta、BA.1和BA.4/5毒株的假中和抗体水平。因此,该疫苗在2023年春季计划中使用,特别是在疗养院,但在2023年春季之后,英国不再提供该疫苗。
HIPRA二价Beta/Alpha COVID-19疫苗(BIMERVAX®)
2023年3月,一种含有来自Beta和Alpha突变株的两种重组RBD蛋白二聚体的疫苗在欧盟被批准作为加强剂。该疫苗(BIMERVAX®)由HIPRA生产,并使用SQBA佐剂。该佐剂类似于用于佐剂流感疫苗的MF59,因为它含有角鲨烯,
但它也包含PS80。BIMERVAX®基于免疫桥接获得许可,因为它与最初的辉瑞-BioNTech 疫苗(Comirnaty®)具有相似或优越的免疫原性。虽然针对Beta和Alpha突变株,但与辉瑞-BioNTech 疫苗(Comirnaty®)后在14天和一些更晚的时间点观察到的相比,BIMERVAX®的加强剂量在针对原始、Beta、Delta和BA.1毒株的中和抗体方面显示出非劣效性或优势。该疫苗尚未用于英国的常规计划,但预计将于2024年进入英国私人市场。
NovavaxXBB COVID-19疫苗(Nuvaxovid®XBB.1.5)
Novavax的 COVID-19疫苗的更新版本已重新配制,以针对OmicronXBB.1.5亚突变株,并于2023年12月获得MHRA的批准。它是一种基于蛋白质的疫苗,含有更新的重组蛋白纳米颗粒,并辅以Matrix-M™。
该疫苗尚未用于英国的常规计划,但已于2024年春季进入英国私人市场。
真实世界的有效性
来自英国的疫苗有效性数据现在已经通过连续的SARs-CoV-2突变株生成。单剂成人辉瑞-BioNTech 或阿斯利康疫苗被证明对Alpha突变株引起的症状性疾病提供适度的保护;单次接种疫苗的病例需要住院或死亡的可能性降低了约40%(LopezBernal等人,2021a)。这与当地研究中看到的约80%的住院保护一致(Vasileiou等人,2021年,AvonCAP,2021年)。在医护人员中也观察到了对感染的保护,其中单剂辉瑞-BioNTech 疫苗对有症状和无症状感染提供了超过70%的保护(Hall等人,2021a),在护理院居民中,单剂辉瑞-BioNTech 或阿斯利康疫苗将感染风险降低了约60%(Shroti等人,2021)。观察到的有症状和无症状感染人数的减少表明,疫苗接种有可能减少传播;这得到了前Delta时代苏格兰一项研究的支持,该研究显示,与未接种疫苗的医护人员相比,接种疫苗的家庭成员在接种单剂辉瑞-BioNTech 疫苗后感染风险降低了30%(Shah等人,2021年)。
辉瑞-BioNTech (LopezBernaletal,2021b)和阿斯利康疫苗在第二剂后观察到对Alpha突变株引起的症状性疾病的更高水平的保护。
在2021年4月将Delta突变株引入英国后,对现实世界有效性的分析进行了进一步更新(LopezBernal等人,2021b)。Delta突变株对有症状感染的保护作用略低于对Alpha的保护作用,尤其是在单剂后。然而,两剂阿斯利康和辉瑞-BioNTech 疫苗维持了对住院的保护,对这种结果提供了超过90%的短期保护(Stowe等人,2021年)。
自Omicron突变株出现以来,疫苗有效性数据证实,当前疫苗对有症状疾病的保护作用低于Delta。(Andrews等人,2022a)。接种疫苗确实提供了更高水平的保护,防止因Omicron而住院。现在发布并定期更新有关每种突变株的实际有效性的最新数据摘要。https://www.gov.uk/政府/出版物/covid-19-vacCI ne-surveillance-report。
保护期限
以色列是第一个证明辉瑞-BioNTech 疫苗的保护作用减弱的国家,即使在6个月左右对严重疾病的保护作用也显示出下降(Goldberg等人,2021年)。在美国,辉瑞-BioNTech 和Moderna疫苗在3到6个月内对住院的保护率仍然很高(约84%)(Tenforde等人,2021年)。
截至2021年8月下旬的更新英国分析表明,接种第二剂后,对Delta突变株引起的有症状感染的保护作用似乎有所下降,尽管5个月后总体上仍高于50%。(Andrews等人,2022b)阿斯利康的保护水平低于辉瑞-BioNTech 之后的保护水平,并且在20个月后仍低5%左右。相比之下,对Delta突变株住院和死亡的保护似乎持续得很好,在初次接种阿斯利康和辉瑞-BioNTech 疫苗后6个月仍保持在85%左右。对于Omicron,
在英国使用所有三种疫苗后6个月内,初级疫苗接种的保护作用似乎下降到非常低的水平。加强免疫一节将讨论加强接种后保护作用的减弱。
加强剂量
在以色列,对接受过相同疫苗基础疗程的成年人接种辉瑞-BioNTech 加强剂与因COVID-19确诊和严重疾病的风险显着降低有关(Bar-On等人,2021年)。
在英国,早期数据显示,在第一次加强剂量后,针对Delta突变株引起的有症状疾病和住院治疗的保护水平显着提高(Andrews等人,2022c)。Omicron的疫苗有效性数据证实,无论主要疫苗系列如何,在mRNA加强剂量后不久对有症状疾病的保护作用就增加到70-75%左右。接受与基础疗程相同的疫苗的人在阿斯利康加强针后的保护水平仅略低于mRNA加强针后看到的保护水平(Andrews等人,2022b)。最近的分析证实,在给予剂量后3个月内,mRNA加强剂后对有症状疾病的保护作用会大幅下降。对于少数接受阿斯利康加强针的个体,对有症状的Omicron感染的保护水平似乎与mRNA加强针后相似或略低。
接种mRNA加强针后住院保护作用在接种疫苗后两周内增加,然后在6个月内下降。定期发布和更新更严重结果的真实世界有效性数据。https://www.gov.uk/government/出版物/covid-19-疫苗监测报告。
突变株疫苗
尽管目前的疫苗对刺突蛋白突变变异株引起的轻度疾病的保护水平较低,但对更严重的COVID-19的保护作用似乎相对较小。针对原始刺突蛋白的更高水平的抗体似乎确实提供了更高水平的保护,以防止由于远距离变异引起的症状感染。
与原始疫苗相比,mRNA突变株疫苗最初是基于中和抗体获得批准的。总体而言,二价和单价突变株疫苗似乎都能提高对原始毒株的抗体水平,这表明流感疫苗也具有反向增强作用,同时为匹配的突变株和其他匹配较差但新出现的突变株提供更高的中和抗体水平。然而,与原始疫苗相比,抗体水平的改善是适度的,并且可能转化为对新变种的保护作用的小幅改善。
在2023年春季计划中,赛诺菲beta疫苗或两种二价疫苗mRNA疫苗(原始/奥密克戎BA.4-5)中的任何一种加强针在短期内可提供约50%的住院保护。这与之前针对不匹配毒株的加强剂后观察到的情况相似。在2023年秋季的计划中,二价和单价XBB加强疫苗对住院的增量有效性相似(两周后在45%到55%之间),并且在3个月时开始减弱。XBB和BA.4/BA.5疫苗之间没有显着差异。与对其他流行突变株(EG5.1和JN.1)的有效性相比,疫苗对XBB亚系的有效性更高。在2024年春季活动中,初步分析显示,XBB单价疫苗的疫苗有效性提高了约40%。
安全
辉瑞-BioNTech COVID-19 mRNA疫苗(Comirnaty®)
接种辉瑞-BioNTech COVID-19疫苗后注射部位的局部反应相当常见,主要是注射部位疼痛,通常没有发红和肿胀。报告的全身事件通常是轻微且短暂的(Walsh等人,2020年)。在对超过21,000名16岁及以上参与者的最终安全性分析中,最常见的事件是注射部位疼痛(>80%)、疲劳(>60%)和头痛(>50%)。肌痛、关节痛和发冷也很常见,发烧的10-20%主要是在第二剂后。大多数被归类为轻度或中度。据报道,与注射相同的一侧腋窝、锁骨上或颈部淋巴结肿大的比例不到1%(Polack等人,2020年)。
与16至55岁的人群相比,55岁以上人群的副作用更少见。严重的全身影响,定义为干扰日常活动的影响,包括4%的疲劳和2%的头痛。没有迹象表明先前的疫苗接种会导致疾病增强,在1次疫苗失败中只有19例严重COVID-8病例(Polack等人,2020年)。
在上市后监测期间,据报道,辉瑞-BioNTech 疫苗后发生了多例心肌炎和心包炎病例。据报道,25岁以下人群和男性以及第二剂后感染率似乎最高。在接种疫苗后几天内发病,大多数病例较轻,并且已经康复,没有任何后遗症。MHRA建议,对于大多数人来说,接种疫苗的好处仍然大于任何风险。
自疫苗广泛使用以来,已报告了接种疫苗后出现的许多其他情况,并已添加到商品特性摘要(SmPC)中。
这包括月经量过多(在大多数情况下是暂时的和非严重的)和接种疫苗的肢体广泛肿胀的报告。罕见的是,据报道,良性和自限性多形性红斑病例在接种疫苗后相关。(https://www.gov.uk/government/publications/regulatory-approval-of-covid-19-vacCI ne-moderna)。一个非常小的辉瑞-BioNTech疫苗接种后报告了吉兰-巴雷综合征(GBS)病例数,但这些报告尚未达到预期在免疫人群中偶然发生的数量。
在常规使用儿科剂量的辉瑞-BioNTech 疫苗后,其他国家报告的安全数据证实,与全剂量相比,年龄较大的儿童和年轻人的所有反应发生率较低。
ModernaCOVID-19mRNA疫苗(Spikevax®)
很大一部分(超过75%)的疫苗接种者在接种ModernamRNA-1273疫苗的第1剂和第2剂后,注射部位出现局部疼痛。第二次给药后也出现发红和肿胀,局部疼痛往往持续更长时间(约3天)。轻度全身影响也很常见,包括头痛、疲劳、关节和肌肉酸痛和发冷。第2剂后全身事件更严重,仅在第2剂后出现发热。局部和全身反应在老年参与者中都不太常见(Baden等人,2020年)。在预先存在SARS-CoV-2抗体的患者中,不良事件不太常见。在与注射部位相同的一侧检测到腋气淋巴结肿大,超过十分之一的受者。
疫苗组没有严重的COVID-19疾病病例,因此没有疾病增强的信号(Baden等人,2020年)。
在上市后监测期间,据报道,接种Moderna疫苗后发生了多例心肌炎和心包炎病例。据报道,25岁以下人群和男性以及第二剂后感染率似乎最高。在接种疫苗后几天内发病,大多数病例较轻,并且已经康复,没有任何后遗症。MHRA建议,对于大多数人来说,接种疫苗的好处仍然大于任何风险。
自疫苗广泛使用以来,接种疫苗后还报告了许多其他情况,最近已添加到产品特性摘要(SmPC)中,其中包括月经量过多(在大多数情况下是暂时的和非严重的)、毛细血管渗漏综合征、接种疫苗的肢体广泛肿胀和荨麻疹。
罕见的是,据报道,良性和自限性多形性红斑病例在接种疫苗后相关。(https://www.gov.uk/government/publications/regulatory-批准covid-19-vacCI ne-moderna)。在Moderna疫苗接种后报告了极少数吉兰-巴雷综合征(GBS)病例,但这些报告尚未达到预期在免疫接种人群中偶然发生的数量。
阿斯利康 COVID-19疫苗(Vaxzevria®)
从早期试验来看,阿斯利康 COVID-19疫苗的注射部位轻度疼痛和压痛很常见,88%的18-55岁人群、73%的56-69岁人群和61%的70岁或以上人群;每次给药后报告了相似的水平。包括疲劳和头痛在内的短期全身症状也很常见,但随着年龄的增长而减轻,在18-55岁、56-69岁和70岁或以上的人群中,分别有86%、77%和65%报告;其中大多数被归类为轻度或中度。这些反应在第二剂后是不寻常的(Ramasamy etal,2020)。大约四分之一的年轻参与者在前48小时内记录到轻度发烧(>38℃),但在55岁以上的人或第二剂后的任何年龄组中都没有报告(Ramasamy等人,2020年)。预防性使用扑热息痛会改变发烧,这不会影响对这种疫苗的免疫反应(Folegatti等人,2020年)。在3期研究中,超过10%的疫苗接种者出现注射部位反应、轻度发热、头痛、肌痛和关节痛。不到1%的患者报告淋巴结肿大或瘙痒皮疹。仅报告了1例可能与疫苗有关的严重不良事件;这是一例横贯性脊髓炎,发生在第2剂后14天。没有迹象表明先前的疫苗接种会导致疾病加剧(Voysey等人,2020年)。
在上市后监测期间,据报道,在阿斯利康疫苗接种后,出现了一种非常罕见的涉及严重血栓栓塞事件并伴有血小板减少症的情况。该病表现为不常见的静脉血栓形成,包括脑静脉窦血栓形成、门静脉血栓形成,有时还有动脉血栓形成,血小板计数低,D-二聚体测量值高。该病与肝素诱导的血小板减少症和血栓形成(HITT或HIT2型)有相似之处,患者通常具有血小板因子4抗体阳性。大多数事件发生在接种疫苗后5到16天之间(Greinacher等人,2021年)。
目前在英国报告的这一事件的发生率约为第一剂后每百万人15例,尽管年轻人的发病率更高。接种第二剂后,报告的发生率要低得多,尤其是在年轻人中。总体而言,疫苗接种和免疫联合委员会(JCVI)、MHRA和WHO得出结论,对于40岁及以上的成年人和临床风险较高的人,接种疫苗的好处超过了这种小风险。
在阿斯利康疫苗接种后6周内很少报告GBS,并且发生率似乎高于背景发生率。根据一项未发表的英国研究(https://www.ucl.ac.uk/ion/news/2022/may/rise-阿斯利康疫苗后格林-巴利综合征),这种风险相当于在接种第一剂阿斯利康疫苗后的六周内每百万剂中增加约5.8例GBS。没有证据表明既往有过GBS发作的个体的报告率更高。
在接种阿斯利康疫苗后4天内,欧洲报告了少量毛细血管渗漏综合征病例。大约一半的患者有毛细血管渗漏综合征的病史。
在接受阿斯利康疫苗接种后的前4周内很少报告血小板减少症病例(不伴有血栓形成)。其中一些病例发生在有免疫性血小板减少症(ITP)病史的个体中。
Novavax COVID-19疫苗(Nuvaxovid®)
接种疫苗后的副作用与其他 COVID-19疫苗相似,与mRNA疫苗相比,局部反应和全身反应的发生率略低。大约50%的第1剂和70%的第2剂接受者报告注射部位疼痛和/或压痛,大约40-50%报告全身症状,包括疲劳、不适、头痛和肌肉疼痛,发烧率低于10%。总体而言,年轻组(18-64岁)的不良反应发生率较高。
在试验和上市后随访中报告了少量心肌炎或心包炎病例。心肌炎和心包炎现已添加到SmPC中可能的副作用列表中。
澳大利亚报告的心肌炎和心包炎发病率似乎与mRNA疫苗接种后的情况相似,澳大利亚已使用超过250,000剂Novavax疫苗。
https://www.tga.gov.au/news/covid-19-vacCI ne-safety-reports/covid-19-vacCI ne-safety-
report-29-06-2023#COVID19疫苗接种后心肌炎和心包炎
加强免疫接种
在英国的研究中,所有加强针都会导致短期局部和全身反应,类似于初次疗程后出现的反应,包括局部疼痛、疲劳、头痛和肌肉疼痛。与老年接受者相比,异源加强针的反应率高于同源加强针,并且70岁以下的人群的反应率更高。当使用全剂量(100微克)Moderna来加强那些在初级课程中接受AstraZeneca或PfizerBioNTech的人,以及当使用阿斯利康来加强那些以PfizerBioNTech作为主要免疫程序的人时,局部和全身性发生率症状更高,与诺瓦瓦克斯或辉瑞-BioNTech 相比,在任一初级疫苗接种后。预计使用50微克剂量的Moderna的副作用(包括心肌炎)的发生率低于100微克剂量。
二价和单价突变株mRNA疫苗后的总体反应原性似乎与原始疫苗加强剂量后的反应原性相似。
实施加强剂后,报告的不良事件性质与前两剂 COVID-19疫苗后报告的不良事件相似。同时给予COVID-19加强剂后疑似不良事件的报告
季节性流感疫苗也类似于单独接种疫苗时接种的疫苗。有少量报告称,在接种辉瑞/BioNTech和Moderna COVID-19疫苗加强剂后疑似心肌炎和心包炎。
HIPRA二价Beta/Alpha COVID-19疫苗(BIMERVAX®)和赛诺菲巴斯德 COVID-19疫苗(VidPrevtynBeta®)在之前接种过mRNA或腺病毒载体疫苗的个人中作为加强剂进行了测试。报告的最常见不良反应是注射部位疼痛、头痛、不适/疲劳和肌痛。大多数局部和全身反应发生在几天内,持续时间短,严重程度为轻度至中度。
存储
辉瑞-BioNTech 突变株成人和青少年加强剂制剂(Comirnaty®JN.1)以10瓶装冷冻形式提供,应储存在–90℃至-60℃之间。包装可在2℃至8℃下解冻6小时,或单个样品瓶可在室温下解冻30分钟。解冻后,疫苗不应重新冷冻,但可以在2℃至8℃下储存和运输10周(在整个保质期内)。
辉瑞-BioNTech 儿科制剂(Comirnaty10 JN.1和Comirnaty®®3 JN.1)以10瓶装冷冻形式供应。
Comirnaty®10 JN.1 10样品瓶包装可在2℃至8℃下解冻2小时,或单个样品瓶可在室温(最高30℃)下解冻30分钟。解冻的未开封样品瓶可在2℃至8℃下储存长达10周。使用前,未开封的样品瓶可在8℃至30℃的温度下储存长达12小时。
Comirnaty®3 JN.110瓶装可在2℃至8℃下解冻2小时,或单个样品瓶可在室温(最高30℃)下解冻30分钟。解冻的未开封样品瓶可在2℃至8℃下储存长达10周。使用前,未开封的样品瓶可在8℃至30℃的温度下储存长达12小时。
Moderna COVID-19突变株疫苗(Spikevax®JN.1)小瓶应冷冻储存(在-50ºC至-15ºC之间)。解冻后,疫苗可以在2℃至8℃的温度下避光冷藏30天,如果没有刺破,则可以减少到14天(如果小瓶已冷冻储存超过9个月)。未开封的样品瓶在8℃至25℃下可稳定保存24小时。
包装
成人和青少年辉瑞-BioNTech 单价突变株疫苗(Comirnaty®JN.1)每包10瓶,带灰色瓶盖。该疫苗不需要稀释,每瓶含有2.25毫升,足够6剂0.3毫升。第一次拆包装后,应尽快使用疫苗,在2℃至30℃下储存并在12小时内使用。
辉瑞-BioNTech 儿科单价变异疫苗(Comirnaty®10JN.1)以10瓶装的形式提供,带有蓝色瓶盖。该疫苗不需要稀释,每个小瓶含有足够1剂0.3mL的疫苗。
辉瑞-BioNTech 婴儿和学龄前儿童(6个月至4岁)单价突变株疫苗(Comirnaty®3JN.1)每包10瓶,带黄色瓶盖。它与0.9%氯化钠稀释剂一起提供,用于塑料安瓿瓶注射。稀释后,每个小瓶的含量足以用于3剂0.3mL。稀释后,这些疫苗应尽快使用,并在SmPC中概述的最长时间内使用。
Moderna突变株疫苗(Spikevax®JN.1)以多剂量小瓶形式提供,其中包含5剂0.5毫升的成人剂量,并带有蓝色瓶盖。
剂量和时间表
所有 COVID-19疫苗
到2022年底,据估计,英国大多数年龄较大的儿童和成人都有SARS-CoV-2抗体,要么来自自然感染,要么来自疫苗接种,或两者兼而有之(https://www.gov.uk/government/publications/covid-19-vacCI ne-weekly-surveillance-reports)。与接种两剂疫苗的幼稚个体相比,那些自然获得免疫力的人对单剂疫苗产生的免疫反应(vanGils等人,参考文献4)预计会一样好。因此,从2023年秋季开始,JCVI建议所有英国批准的 COVID-19疫苗都可以作为单剂疫苗提供给5岁及以上的人。
由于自2023年秋季以来,基础疫苗接种和加强疫苗接种的资格已经一致,因此可以向任何5岁及以上符合条件的个人提供单剂疫苗,无论之前的疫苗接种状态如何,前提是距离上一剂疫苗至少有三个月的时间。开始或完成初级免疫接种的符合条件的个体(包括自上一个季节性活动以来接受额外剂量的严重免疫抑制者)理想情况下应间隔三个月。对于腺病毒载体和mRNA疫苗,有证据表明,在基础方案中,如果剂量之间使用更长的间隔,免疫反应和/或保护效果会更好。(Amirthalingam等人,2021年,Payne等人,2021年,Voysey等人,2021年)。因此,所有第二剂和后续剂量的间隔为三个月,将有助于最大限度地延长保护的持续时间。
对于那些有资格在季节性活动期间接种疫苗的人,在之前接种任何疫苗后至少三个月提供单剂疫苗。此间隔适用于任何疫苗,无论前几剂接种的产品如何。时间应遵循JCVI针对该活动的建议,该活动旨在在最佳时间为最弱势群体提供保护。
符合条件的5岁以下儿童可能已在2023年夏季开始接种婴儿配方奶粉。欧洲监管机构建议根据感染史确定该年龄组初次疗程的剂量数。最近的UKHSA血清阳性率研究表明,英国绝大多数5岁以下儿童都感染了COVID。然而,由于这些儿童的免疫状况不太确定,并且可能会因未来的出生队列而发生变化,JCVI认为6个月至4岁的儿童应继续接种两剂基础疫苗。仍然符合条件的儿童也应在季节性运动中接种疫苗,与上一剂疫苗至少间隔三个月。在运营方面,对所有商品和年龄组使用相同的最短间隔和时间将简化供应和预订,并有助于确保更持久和最佳定时的保护。
对于年龄在6个月及以上且患有严重免疫抑制的个体,可以考虑在前一剂的基础上间隔8至12周进行额外剂量治疗,如“严重免疫抑制患者的额外剂量”部分所述。
根据专科医生的临床判断,可能会建议例外,例如,对于那些即将接受或增加免疫抑制治疗强度的患者,如果在治疗开始前进行免疫接种,会产生更好的反应。如果专家建议例外情况,则任何疫苗产品的间隔时间都可以缩短至至少三周。
国家计划中提供的疫苗剂量如下:
辉瑞-BioNTech COVID-19疫苗(Comirnaty®JN.1
对于12岁及以上的人,单价辉瑞-BioNTech 突变株疫苗的剂量为30微克。疫苗以即用型多剂量小瓶形式提供,含有6剂0.3mL。
无论之前的 COVID-19疫苗接种状态如何,都应接种单剂0.3mL,并且距离前一剂至少三个月。
儿科辉瑞-BioNTech COVID-19疫苗(Comirnaty®10JN.1
对于5-11岁的儿童,辉瑞-BioNTech COVID-19疫苗的剂量为10微克。儿科单价变异疫苗以即用型单剂量小瓶形式提供,含有1剂0.3mL。
无论之前的 COVID-19疫苗接种状态如何,都应接种单剂0.3mL,并且距离上一剂至少三个月。
婴儿辉瑞-BioNTech COVID-19疫苗(Comirnaty®3JN.1
对于6个月至4岁的儿童,辉瑞-BioNTech COVID-19疫苗的剂量为3微克。婴儿配方奶粉(Comirnaty®3JN.1)以多剂量小瓶形式提供,每个小瓶含有3剂0.3mL(稀释后)。
无论之前的 COVID-19疫苗接种状态如何,都应接种单剂0.3mL,并且距离前一剂至少三个月。
莫德纳 COVID-19疫苗(Spikevax®JN.1)
对于18岁及以上的人,单价Moderna突变株疫苗的剂量为50微克。无论之前的 COVID-19疫苗接种状态如何,都应接种单剂0.5mL,并且距离上一剂至少三个月。
接种
疫苗通常肌肉注射到上臂或大腿前外侧。这是为了降低局部反应的风险,当皮下接种疫苗时,局部反应更为常见(Marketal,1999;Zuckerman,2000;Diggle和Deeks,2000年)。
辉瑞-BioNTech COVID-19疫苗(Comirnaty®)应作为一岁或以上的人肌肉注射到三角肌或大腿前外侧。对于6至12个月以下的婴儿,推荐的注射部位是大腿前外侧。
将提供一个带有23克或25克x25毫米针头的1毫升注射器用于给药。为了从多剂量小瓶中获得指定数量的剂量,应使用节省剂量的注射器和针头组合。应为每个人使用单独的针头和注射器。如果溶液变色或观察到可见颗粒,则应丢弃样品瓶。
Moderna COVID-19疫苗(Spikevax)应通过肌内注射到三角肌中给药。为了从多剂量小瓶中获得指定数量的剂量,应使用节省剂量的注射器和针头组合。将提供一个带有23克或25克x25毫米针头的1毫升注射器用于给药。应为每个人使用单独的针头和注射器。撤回最终剂量后,液体残留在小瓶中是正常的。
如果熟悉出血风险的医生认为可以通过这种途径以合理的安全性接种疫苗或类似的小容量肌肉注射,则患有出血性疾病的个体可以肌肉注射。如果个人接受药物/治疗以减少出血,例如血友病治疗,则可以在接受此类药物/治疗后不久安排肌肉注射疫苗。接受稳定抗凝治疗的个体,包括服用华法林的个体,如果按照预定的INR检测进行最新检测,并且最近的INR低于治疗范围的上限,可以接受肌内注射
接种疫苗。应使用细针(23或25号)进行疫苗接种,然后对该部位施加压力,至少2分钟不要摩擦(免疫实践咨询委员会2019年)。应告知个人/父母/照护者注射血肿的风险。
处理
用于疫苗接种的设备,包括用过的小瓶、安瓿或注射器,应根据地方当局的规定和卫生技术备忘录07-01:医疗废物的安全管理(卫生部,2013年)中的指导,将它们放入适当的、防刺穿的“锐器盒”中进行处理。
COVID-19大流行免疫接种计划
COVID-19大流行免疫计划的主要目标是保护那些最有可能患严重疾病或死亡的人。JCVI根据风险对符合条件的群体进行了排名。第一阶段该排名基于COVID-19特定死亡率的风险,第二阶段涉及预防住院。
第一阶段免疫接种建议
来自英国的证据表明,健康成人和有潜在健康状况的成年人因COVID-19感染而出现不良结果的风险会随着年龄的增长而急剧增加。到目前为止,65岁以上的人风险最高,并且风险随着年龄的增长而急剧增加。老年人护理院的居民受到COVID-19大流行的影响尤为严重。表2列出了JCVI关于初级 COVID-19疫苗接种优先群体的初步建议。
表2–疫苗接种和免疫接种联合委员会建议的第一阶段基础疫苗接种优先群体
| 优先组 | 风险组 |
| 1 | 老年人护理院的居民 在老年人护理院工作的工作人员 |
| 2 | 所有80岁及以上的人 一线卫生和社会照护工作者 |
| 3 | 所有75岁及以上的人 |
| 4 | 所有70岁及以上的人 16至69岁的高危人群1 |
| 5 | 所有65岁及以上的人 |
| 6 | 高危人群中16至65岁的成年人(表3) |
| 7 | 所有60岁及以上的人 |
| 8 | 所有55岁及以上的人 |
| 9 | 所有50岁及以上的人 |
16岁及以上临床高危人群(优先群体4和6)的定义
以前被定义为临床上极度脆弱(CEV)的人被认为处于COVID-19重病高风险中(https://www.gov.uk/government/publications/指南-屏蔽和保护极度脆弱的人免受covid-19的伤害/指南屏蔽和保护极度脆弱的人免受COVID-19#cev的影响),这些患者最初被标记在GP记录上,并建议保护自己免受感染。医院临床医生或全科医生能够根据他们的临床判断将患者添加到名单中,因为他们认为他们患COVID-19严重疾病的风险非常高。原始CEV名单上的所有患者也属于第6组,其中包括JCVI建议的更广泛的疾病类别,这些疾病类别将构成更高的 COVID-19疫苗接种临床风险(表3和表4)。屏蔽计划结束后,第4组和第6组正式合并。
表3和表4中的例子并不详尽,在这些大类中,处方者可能需要进行临床判断,以考虑COVID-19加剧患者可能患有的任何潜在疾病的风险,以及COVID-19本身导致严重疾病的风险。更全面的可能符合条件的诊断列表和相应的临床代码可以在本章末尾的链接中找到。
2021年12月,在认识到怀孕是Delta浪潮期间严重COVID-19感染和不良妊娠结局的危险因素后,怀孕被添加到临床风险组(见表3)。
1以前称为临床上极度脆弱
16岁及以上一线工作人员的定义
第一阶段还建议某些工作人员群体接种疫苗(见下面的定义)。卫生和社会保健人员职业免疫的目标是保护那些暴露风险高的工人,他们在提供护理时也可能暴露于弱势群体。有限的证据表明疫苗接种可以减少传播,尽管很小的影响可能会对可能接触多名易感患者和其他工作人员的工作人员产生重大的额外好处。
参与直接患者护理的工作人员
这包括经常与患者进行面对面临床接触的工作人员,以及在二级或初级保健/社区环境中直接参与患者护理的工作人员。这包括医生、牙医、助产士和护士、护理人员和救护车工作人员、药剂师、验光师、职业治疗师、物理治疗师和放射技师。它还应包括那些在独立、自愿和非标准的医疗保健环境中工作的人,例如临终关怀机构,以及基于社区的心理健康或成瘾服务。从事 COVID-19疫苗接种计划的工作人员、临时工作人员、学生、实习生和与患者一起工作的志愿者也包括在内。
二级或初级保健/社区医疗保健环境中的非临床工作人员
这包括可能与患者有社会接触但不直接参与患者护理的非临床辅助工作人员。该组包括接待员、病房文员、搬运工和清洁工。
实验室和病理学工作人员
经常处理SARS-CoV-2或收集或处理可能受感染的标本(包括呼吸道、胃肠道和血液标本)的医院实验室和太平间工作人员应符合资格,因为他们也可能与患者有社交接触。这也可能包括清洁工、搬运工、秘书和实验室的接待员。一线殡仪师和太平间技术人员/防腐师都有暴露的风险,并且可能在护理院和医院环境中花费大量时间,他们也可能在那里暴露多名患者。
在非医院实验室工作的工作人员以及处理临床标本或可能感染样本的学术或商业研究实验室将能够在工作中使用有效的防护设备,并且应保持较低的暴露风险,并应降低暴露于易感患者的风险。
16岁及以上的一线社会护理工作者(优先群体1和2)
这包括在长期住宿和护理院或其他长期护理机构工作的人员,这些机构可能在感染后迅速传播并导致高发病率和死亡率。
它还包括其他一线社会护理工作者,他们定期为临床脆弱人群提供密切的个人护理。
那些临床上易感染COVID-19的人由JCVI优先群体定义:
a)患有严重神经障碍、严重或极重和多重学习障碍(包括唐氏综合症和学习障碍登记册上的儿童)或免疫抑制(定义见表4)的任何年龄的儿童,
b)患有基础健康状况导致表3中定义的更大疾病或死亡风险的成年人,
c)高龄人士。
其他高危人群的定义
家庭联系人
希望在大多数日子里与免疫抑制者(在表3或表4中定义为免疫抑制)的人同住(因此不可避免地继续密切接触)的个体。
老者
有资格获得护理人员津贴的人,或16岁及以上的人,他们是COVID-19死亡风险较高且因此临床脆弱的老年人或残疾人的唯一或主要照顾者。
临床上易感染COVID-19的人由以下JCVI优先群体定义:
a)患有严重神经障碍、严重或极重和多重学习障碍(包括唐氏综合症和学习障碍登记册上的儿童)或免疫抑制(定义见表4)的任何年龄的儿童,
b)患有基础健康状况导致表3中定义的更大疾病或死亡风险的成年人,
c)高龄人士。
第2阶段免疫接种建议
16至50岁的非高危人群的成年人
COVID-19免疫计划第二阶段的目标是保护那些有患严重疾病或死亡风险的人,并通过降低住院和重症监护入院的风险来保护NHS。该计划的第2阶段伴随着持续的努力,以最大限度地提高第1阶段优先但仍未接种疫苗的人的覆盖率,并完成向第1阶段接种第一剂的所有人群提供第二剂疫苗。
有充分的证据表明,COVID-19住院和重症监护收治的风险随着年龄的增长而增加。因此,JCVI建议,第2阶段的疫苗接种提议按以下顺序提供:
所有40-49岁的人
所有30-39岁的人
所有18-29岁的人
所有16-17岁的人
16岁以下的儿童和青少年风险较高
2021年和2022年,初级免疫接种范围扩大到5至15岁的儿童和青少年,他们受COVID-19影响的风险较高,包括:
●年龄在5至15岁之间的公认临床群体中,COVID-19重症风险较高(见表4)
●5至15岁(后来仅限于12至15岁)的人(预计在大多数日子里与任何年龄的免疫抑制者(在表3或表4中定义为免疫抑制)共享生活住宿的人(因此不可避免地继续密切接触的人)
JCVI对重症COVID风险较高的儿科临床组的初步建议基于临床审查和初级保健数据分析(Williamson等人,2021年)。在副首席医疗官委托的专家组下进行进一步分析,然后确定了在2020-21年期间儿科重症监护入院绝对风险高(大于100/百万)的更大数量的诊断组(Harwood等人,2021年,Smith等人,2021年,Ward等人,2021年)。除了这些不同的诊断之外,分析还表明,根据2013年皇家儿科和儿童健康学院对死亡率审查所使用的代码,患有慢性病的儿童的入院率很高。因此,JCVI决定一组潜在的健康状况——类似于优先用于成人疫苗接种的健康状况,肥胖和精神疾病除外——也可以合理地适用于儿童和年轻人(总结见表4)。哮喘儿童的入院率仅略高于健康儿童的入院率,这表明,根据成人的证据,只有控制不佳的哮喘才会构成COVID-19感染并发症的临床风险。
2021年12月,在认识到妊娠是Delta浪潮期间严重COVID-19感染和不良妊娠结局的危险因素后,妊娠被添加到成人和16岁以下年轻人的临床风险组中(表4)。
2023年初,JCVI建议将基础疫苗接种范围扩大至6个月至4岁的公认临床风险人群的儿童(表4)。该计划于2023年春季和夏季在所有英国国家实施。
怀孕
2021年12月,在认识到妊娠是Delta浪潮期间严重COVID-19感染和不良妊娠结局的危险因素后,妊娠被添加到成人和16岁以下年轻人的临床风险人群中(表4)。
16岁以下且不属于高危人群的儿童和青少年
在2021年和2022年,初级疫苗接种的提供也扩展到所有5至17岁的儿童和青少年。由于儿童和年轻人感染COVID-19并发症的风险较低,JCVI在每个阶段都仔细考虑了有关疫苗接种对年轻人的风险和益处的新证据。对于12至15岁的人,委员会采取了预防措施来减轻罕见的心肌炎风险,建议应间隔12周接种第二剂初剂。这个年龄组的较长间隔反映了第一剂对严重疾病的短期保护作用高的证据,以及来自时间表较长(8至12周)的国家的早期证据表明第二剂后心肌炎的发生率较低(Buchan等人,2022年)。该委员会还建议父母和年轻人应充分了解接种疫苗的好处和风险。
1https://www.rcpch.ac.uk/sites/default/files/CHR-UK_-_Retrospective_Epidemiological_Review_of_All-cause_Mortality_in_CYP.pdf
在2021年底出现Omicron之后,还为5至11岁的儿童提供了一次性计划。由于Omicron感染特别轻微,疫苗诱导对轻度Omicron感染的保护是短暂的,而且这个年龄段的几乎所有儿童都感染了COVID-19,JCVI还建议提供儿科非COVID-19免疫接种计划应是更高的优先事项。在大流行期间,这些其他计划的覆盖率落后,这可能加剧了健康不平等。
表3:16岁及以上个体的临床风险组。
| 临床风险人群 | |
| 慢性呼吸系统疾病 | 患有严重肺部疾病的个体,包括哮喘控制不佳1和慢性阻塞性肺病(COPD)包括慢性支气管炎和肺气肿的患者;支气管扩张、囊性纤维化、间质性肺纤维化、尘肺病和支气管肺发育不良(BPD)。 |
| 慢性心脏病 疾病和血管疾病 | 先天性心脏病、高血压伴心脏并发症、慢性心力衰竭、需要定期药物治疗和/或随访缺血性心脏病的个体。这包括患有心房颤动、 外周血管疾病或静脉血栓栓塞病史。 |
| 慢性肾病 | 3、4或5期慢性肾病、慢性肾功能衰竭、肾病综合征、肾移植。 |
| 慢性肝病 | 肝硬化、胆道闭锁、慢性肝炎。 |
| 慢性神经系统疾病 | 卒中、短暂性脑缺血发作(TIA)。由于神经或神经肌肉疾病而可能影响呼吸功能的情况(例如脊髓灰质炎综合征患者)。该群体还包括患有脑瘫、严重或极重度和多重学习障碍(PMLD)的个体,包括学习障碍登记册上的所有个体、唐氏综合症、多发性硬化症、癫痫、痴呆、帕金森病、运动神经元疾病和相关或类似疾病;或神经系统或肌肉的遗传性和退行性疾病;或严重的神经功能障碍。 |
| 糖尿病和其他内分泌疾病 | 任何糖尿病,包括饮食控制糖尿病、当前妊娠糖尿病和Addison病。 |
| 免疫抑制 | 因疾病或治疗引起的免疫抑制,包括接受化疗导致免疫抑制的患者、接受根治性放疗的患者、实体器官移植受者、骨髓或干细胞移植受者、各个阶段的HIV感染、多发性骨髓瘤或影响免疫系统的遗传疾病(例如IRAK-4、NEMO、补体病、SCI D)。 正在接受免疫抑制或免疫调节生物治疗的个体,包括但不限于抗TNF、阿仑单抗、奥法木单抗、利妥昔单抗、接受蛋白激酶抑制剂或PARP抑制剂的患者,以及接受类固醇保留剂治疗的个体,例如环磷酰胺和吗替麦考酚酯。 接受或可能接受全身性类固醇治疗超过一个月,剂量相当于成人每天20毫克或更多泼尼松龙的个体。 任何有血液系统恶性肿瘤病史的人,包括白血病、淋巴瘤和骨髓瘤。 那些需要长期免疫抑制治疗的人,包括但不限于系统性红斑狼疮、类风湿性关节炎、炎症性肠病、硬皮病和牛皮癣。 |
1哮喘控制不佳定义为:
–在过去24个月内服用≥2个疗程的口服皮质类固醇或
–维持口服皮质类固醇或
–过去24个月内≥1次因哮喘入院
| 一些免疫抑制患者可能对疫苗的免疫反应欠佳(免疫抑制和HIV)。 | |
| 无脾或 脾功能障碍 | 这还包括可能导致脾功能障碍的疾病,例如纯合子镰状细胞病、重型地中海贫血和乳糜泻。 |
| 病态肥胖 | 体重指数(BMI)≥40kg/m²的成年人。 |
| 严重的精神疾病 | 患有精神分裂症或双相情感障碍,或任何导致严重功能障碍的精神疾病的个体。 |
| 长期护理和住宿护理环境中的年轻人 | 许多住在寄宿护理机构的年轻人将有资格接种疫苗,因为他们属于上述临床风险群体之一(例如学习障碍)。鉴于在这些环境中可能存在很高的暴露风险,其中很大一部分人口被认为符合条件,建议对所有常住人口进行疫苗接种。 老年护理院的年轻居民将面临高风险暴露,尽管他们的死亡风险可能低于老年居民,但不应被排除在疫苗接种计划之外(见上文优先事项1)。 |
| 怀孕 | 所有阶段(孕早期、孕中期和孕晚期) |
1临床上易感染COVID-19的人由JCVI优先群体定义:a)患有严重神经残疾、严重或极重以及多重学习障碍(包括唐氏综合症
和学习障碍登记册上的人)或免疫抑制(定义见表4),b)患有潜在健康状况导致疾病或死亡风险增加的成年人,如表3所定义,
c)高龄人士。
表4:16岁以下个体的临床风险组
| 慢性呼吸系统疾病 | 包括那些哮喘控制不佳1需要持续或重复使用全身性类固醇或既往恶化需要住院、囊性纤维化、纤毛运动障碍和支气管肺发育不良的患者 |
| 慢性心脏病 | 血流动力学显著的先天性和后天性心脏病,或伴有其他合并症的较轻的心脏病。这包括: •单心室患者或接受Fontan(全腔肺连接)循环缓解的患者 •患有慢性紫绀的人(血氧饱和度持续<85%) •需要药物治疗的心肌病患者 •先性心脏病患者服用改善心脏功能的药物 •需要药物治疗的肺动脉高压(肺部高血压)患者 |
| 肾脏、肝脏或消化系统的慢性疾病 | 包括与器官先天性畸形、代谢紊乱和肿瘤相关的疾病,以及可能易患呼吸道感染的严重胃食管反流等病症 |
| 慢性神经系统疾病 | 呼吸功能可能受损的情况;这包括那些具有以下特点的人: •可能因脑瘫、自闭症、癫痫和肌肉萎缩症等疾病而发生的神经残疾和/或神经肌肉疾病 •神经系统或肌肉的遗传性和退行性疾病,与通气不足相关的其他情况 •严重或极重和多重学习障碍(PMLD)、唐氏综合症,包括学习障碍登记册上的所有患者 •脑肿瘤 |
| 内分泌紊乱 | 包括糖尿病、Addison综合征和垂体功能减退综合征 |
| 免疫抑制 | 疾病或治疗引起的免疫抑制,包括: •接受化疗或放疗者、实体器官移植受者、骨髓或干细胞移植受者 •影响免疫系统的遗传疾病(例如IRAK-4或NEMO缺陷、补体病、SCI D) •患有血液系统恶性肿瘤的人,包括白血病和淋巴瘤 •接受免疫抑制或免疫调节生物治疗的人 •接受或可能接受高剂量或中等剂量皮质类固醇治疗的患者 •接受任何剂量的非生物口服免疫调节药物的人,例如甲氨蝶呤、硫唑嘌呤、6-巯基嘌呤或麦考酚酯 •可能需要长期免疫抑制治疗的患者 即将接受计划免疫抑制治疗的儿童在开始治疗前应考虑接种疫苗。 |
| 无脾或脾功能障碍 | 包括遗传性球形红细胞增多症、纯合镰状细胞病和重型地中海贫血 |
| 影响许多系统的严重遗传异常 | 包括线粒体疾病和染色体异常 |
| 怀孕 | 所有阶段(孕早期、孕中期和孕晚期) |
1哮喘控制不佳定义为:
–在过去24个月内服用≥2个疗程的口服皮质类固醇或
–维持口服皮质类固醇或
–过去24个月内≥1次因哮喘入院
加强2021年和2022年的免疫接种建议
加强免疫接种的初步建议
2021年9月,JCVI建议应为以下群体提供COVID-19加强疫苗。
这包括:
●住在长者院舍的人
●所有50岁或以上的成年人
●一线卫生和社会保健工作者
●所有年龄在16至49岁之间,患有基础疾病的人,这些疾病使他们面临更高的COVID-19重症风险(表3)
●所有16岁及以上的照顾者
●所有16岁及以上且与任何年龄的免疫抑制个体(在表3或表4中定义为免疫抑制)的家庭接触者
第一批接受加强剂的群体是在COVID-19计划第1阶段优先考虑的群体(表2,第1-9组),在完成主要课程后六个月提供加强剂。JCVI还建议,作为运营灵活性的一部分,可以向所有成年人提供加强针优惠,无论年龄大小,在某些封闭环境中或无家可归者等人群中。
Omicron突变株出现后的其他激增建议
在2021年11月出现Omicron突变株后,JCVI建议按年龄和风险状态排序加快加强针的部署。50岁以上和高危人群首先接种加强疫苗,然后是18-49岁非高危人群,按年龄降序排列。在完成主要疗程后三个月内不应给予加强剂量。
2021年12月,JCVI建议16-17岁的人、12-15岁的儿童和青少年是COVID-19风险较高的人(表4)或12-15岁的人,他们是任何年龄免疫抑制者的家庭接触者(在表3或表4中定义为免疫抑制)也应提供加强剂。这些孩子也有资格在2022年秋季活动中获得加强针(见下文)。
有关加强剂量的其他注意事项
2021年12月,在认识到怀孕是Delta浪潮中严重COVID-19结局和妊娠不良的危险因素后,怀孕被添加到临床风险组。
JCVI建议,那些5岁及以上患有严重免疫抑制(方框1和2)但尚未接种第三剂疫苗的人应在加强接种期间接种第三剂,以避免进一步延误。随后的加强剂安排在该剂量后至少三个月进行,这与免疫抑制个体最佳时间的临床建议一致。请参阅后面关于严重免疫抑制患者额外剂量的部分。
2022年春季加强活动
2022年2月,鉴于在加强剂量后观察到的疫苗对COVID-19住院的有效性略有下降,JCVI建议为严重COVID-19风险较高的个体开展春季加强运动。许多最年长的成年人在2021年9月或10月接种了加强疫苗,预计到2022年秋季,对重症的保护作用将继续逐渐减弱。作为一项预防措施,建议额外接种春季剂量,以维持保护,直到2022年秋季的加强计划。
委员会建议,应在最后一剂疫苗后6个月左右接种加强剂,以:
●75岁及以上的成年人
●老年人护理院的居民,以及
●12岁及以上免疫抑制的个体(在表3或表4中定义为免疫抑制)。
绝大多数75岁以上的人在2022年3月至6月期间达到了与上一剂疫苗相隔约6个月的间隔。然而,对于护理院的个人和足不出户的患者,只要距离上一剂至少三个月,就可以灵活作。最近接受过额外基础剂量的免疫抑制个体也在春季活动期间接受了加强剂,前提是距离前一剂至少三个月。
符合条件的群体中已接受完整基础疫苗接种(两剂或三剂)但在2022年3月之前尚未接种第一剂加强针的人,如果距离上一剂疫苗至少有三个月的时间,则有资格在活动中接种春季加强针。因此,在秋季之前不建议额外剂量。
2022年秋季补充加强活动
继春季活动之后,JCVI建议转向定期、有计划和有针对性的加强,作为控制COVID-19的最重要策略。对于2022年秋季加强计划,主要目标是增强COVID-19高风险人群的免疫力,从而在2022/23年冬季优化对严重COVID-19的保护,特别是住院和死亡。
以下群体在2022年秋季获得了COVID-19加强疫苗:
●老年人护理院的居民
●在老年人护理院工作的工作人员
●一线卫生和社会保健工作者
●所有50岁及以上的成年人
●临床风险组中5至49岁的人,如表3和表4所示
●5至49岁免疫抑制患者(定义见表3和表4)的家庭接触者
●16至49岁的照顾者(定义见表3)
加强剂从9月开始提供,从上一剂开始至少需要三个月的时间。该计划优先向75岁以上的人和老年人护理院提供分娩,但认识到需要根据可能的分娩模式灵活运营。目标是在12月之前完成活动,以便及时为预期的其他季节性病毒的冬季高峰期提供额外的保护,但在1月期间有机会进行清理。
上述符合条件的群体中已接受完整基础疫苗接种(两剂或三剂)但在2022年9月之前未接种加强针的人,如果距离上一剂疫苗至少有三个月的时间,则有资格在活动中接种秋季加强针。然后不需要额外的剂量。在2022年8月之后年满5岁的高危人群儿童有资格进行初级疫苗接种,并可能在秋季计划期间获得加强剂,前提是他们的第二剂(或第三剂)初级免疫接种至少三个月。
与 COVID-19疫苗接种一起生活计划
英国COVID-19大流行疫苗计划于2020年12月启动,主要目标是预防严重疾病、住院和死亡。现在,绝大多数英国成年人口已经接种了疫苗,血清阳性率研究表明,大多数成人和儿童人口已经自然感染,英国 COVID-19疫苗接种计划将在2023年过渡到更长期、更可持续的计划。
有证据表明,目前所有疫苗都只能提供适度的短期感染保护,因此也只能防止传播。对轻度症状性疾病的保护是中等的,但也只能在短期内持续。随着新出现的突变株,对轻度疾病的保护水平较低,在初次疫苗接种后4到6个月内和加强剂量后3到4个月内下降到可以忽略不计的水平。对更严重疾病和死亡的保护似乎更高,并在中期保持。
长期 COVID-19疫苗接种计划的目标
使用目前的疫苗,该计划无法有效地用于阻断传播或对短期疾病产生显著影响。因此,该计划的目标是减少严重疾病(住院和死亡率),从而保护NHS的能力。
老年人群、老年人护理院的居民以及患有某些潜在健康状况的人因COVID-19住院的风险仍然不成比例地高。由于Omicron突变株的高传播性,以及可能无症状或仅有轻微症状的感染,许多因非COVID-19原因需要住院治疗的人可能巧合地感染了SARS-CoV-2。这种住院治疗不能通过 COVID-19疫苗接种来可持续地预防,因此未来的计划需要相称地关注。
大流行 COVID-19疫苗接种优惠的限制
JCVI建议,随着2022年秋季疫苗接种活动的结束,应关闭为不属于临床或其他高风险人群的16至49岁人群提供大流行加强剂(自2021年起实施)。自2023年春季活动结束以来,疫苗接种已成为仅针对COVID-19重症高风险人群的针对性服务。预计这项优惠将在未来的季节性活动中继续提供,旨在减轻NHS在因其他病毒和寒冷天气而承受压力期间与COVID相关的入院负担。在COVID-19感染的季节性更加可预测之前,将在春季提供额外的活动。
老年人和临床风险人群(表3和表4)将是有资格接种疫苗的个体,并且任何疫苗接种都将仅在计划的季节性加强针活动期间进行。
JCVI正在定期审查其他风险群体的疫苗接种,包括护理院的工作人员、卫生和社会护理人员以及严重免疫抑制者的家庭接触者,在未来的秋季活动中可能不再有资格接种疫苗。
否则,健康人如果出现新的健康状况,使其处于临床风险组,通常有资格在随后的季节性运动或任何激增反应期间接种单剂疫苗。
出现严重免疫抑制(方框1和2)的个体可能处于严重COVID-19的高风险中,并且无法承受先前疫苗接种或暴露的任何保护。根据临床判断,在下一次季节性活动之前,应考虑这些个体进行补种疫苗接种或额外剂量的疫苗接种。有关此类剂量的建议将在下一节关于重度免疫抑制的章节中概述,包括有关最佳时机的建议。
2023年起的JCVI建议
2023年春季
委员会建议应为以下人员接种加强剂:
●75岁及以上的成年人
●老年人护理院的居民,以及
●5岁及以上免疫抑制的个体(在表3或表4中定义为免疫抑制)。
绝大多数75岁以上的人在2023年3月下旬至6月期间达到了与最后一剂疫苗相隔约6个月的间隔。允许运营灵活性,为预期达到目标年龄的符合条件的个人提供加强针
在春季竞选期间。加强剂比上一剂疫苗提供大约6个月,但可以在前一剂疫苗的基础上至少提供三个月;这对于促进向护理院的居民和足不出户的人提供该计划尤为重要。
由于仅在2023年初才建议对6个月至4岁临床高危儿童进行基础疫苗接种,因此5岁以下严重免疫抑制的儿童没有资格在2023年春季接种加强针。这些儿童可以考虑在以后的时间点进行额外剂量治疗(参见严重免疫抑制个体的额外剂量部分)。
2023年秋季
对于2023年秋季加强计划,以下群体接种了 COVID-19疫苗:
–在老年人护理院工作的居民和工作人员
–所有65岁及以上的成年人
–临床风险组中6个月至64岁的人,如表3和表4所定义
–一线卫生和社会护理工作者
–12至64岁且与免疫功能抑制患者有家庭接触者(定义见表3和4)的人
–16至64岁的照顾者
为了在冬季优化保护,JCVI建议秋季计划的目标是在2023年12月初完成。由于接种疫苗后的前3个月内接种疫苗的保护作用最高,因此委员会建议,在作可行的情况下,应为入院风险最高的人提供更接近冬季最大压力时期的疫苗。当BA.2.86突变株出现时(https://www.gov.uk/government/news/flu-and-covid-autumn-vacCI ne-programmes-brought-forward)审查了这一时间。
2024年春季
委员会建议应为以下人员接种加强剂:
●75岁及以上的成年人
●老年人护理院的居民,以及
●6个月及以上免疫抑制的个体(在表3或表4中定义为免疫抑制)
绝大多数75岁以上的人将在2024年3月中旬至6月期间达到最后一次剂量间隔约6个月。允许作灵活性,以便为预计在春季活动期间达到目标年龄的符合条件的个人提供加强针。加强针应在前一剂后六个月左右提供,但可以在前一剂后至少三个月提供;这对于促进向护理院的居民和足不出户的人提供该计划尤为重要。
2024年秋季
委员会建议应为以下人员接种加强剂:
●65岁及以上的成年人
●老年人护理院的居民,以及
●临床风险组(定义见表3或表4)中6个月及以上的个体
与之前的秋季活动相比,免疫抑制者的家庭接触者以及一线卫生和社会护理工作者不再被纳入符合条件的队列。这是因为对轻度和无症状疾病的保护作用似乎有限且持续时间短,尤其是对于高度传播的Omicron突变株。因此,为家庭接种疫苗的间接好处不如往年明显。如果认为合适,卫生和社会保健提供者可能会为一线工作人员提供职业健康免疫接种计划。
2025年春季
该委员会建议有资格接种 COVID-19疫苗的人是:
●75岁及以上的成年人
●老年人护理院的居民
●6个月及以上免疫抑制的个体(定义见表3和表4的“免疫抑制”行)
与之前的秋季活动相比,在2025年春季活动中,75岁以下有临床风险因素的人将不再符合资格。在审查之前疫苗接种活动的数据后,发现很大一部分具有风险因素的人已经通过基于年龄的标准符合条件,并且疫苗的接种率和COVID-19的严重后果率在处于风险中的年轻人远低于老年人组。因此,继续为具有免疫抑制以外的临床危险因素的年轻人接种疫苗的益处是有限的。
与2024年秋季活动一样,免疫抑制者的家庭接触者以及一线卫生和社会护理工作者不包括在符合条件的队列中。这是因为对轻度和无症状疾病的保护作用似乎有限且持续时间短,尤其是对于高度传播的Omicron突变株。因此,为家庭接种疫苗的间接好处不如往年明显。
2025 年秋季
浪涌响应
与先前SARS-CoV-2突变株引起的感染相比,当前的Omicron突变株的疾病严重程度较低。出现一种新型的、毒性更强、令人担忧的突变株,可能需要紧急激增疫苗响应。由于这种突变株之所以有可能出现,是因为它逃避了现有的人群免疫力,因此使用当前疫苗的加强计划的价值可能会受到限制。可能需要有针对性的疫苗反应,为高风险人群(例如通常在季节性运动中针对的人群)提供现成的疫苗,以增强背景免疫力,同时等待更紧密匹配的疫苗。由于使用不匹配的疫苗进行任何加强接种都可能只能提供短期保护,因此可能需要在最脆弱的老年人群中进行后续计划。
6个月及以上患有严重免疫抑制的个体的额外剂量(另见后面关于特定人群的部分)
一些因潜在健康状况或药物治疗而免疫抑制的个体可能无法对 COVID-19疫苗接种产生完全的免疫反应。英国对免疫抑制人群真实世界疫苗有效性(VE)研究的初步总体结果表明,针对有症状的COVID-19的VE仅略有降低(Whitaker等人,2022年)。测量结合或中和抗体和/或细胞反应的免疫原性研究表明,在免疫抑制组中,一些免疫抑制形式更严重的个体产生的反应较低或没有可检测的反应。已发表的描述第三剂mRNA疫苗对免疫抑制者影响的研究报告称,不同比例的人群免疫反应增加。(Hall等人,2021b,Kamar等人,2021年,Werbel等人,2021年)。因此,JCVI认为应该为一小群免疫抑制更严重的个体提供额外的疫苗接种剂量。
额外剂量的疫苗接种
6个月及以上患有严重免疫抑制的个体在方框1和2中定义。大多数因急性发作(例如哮喘/COPD/COVID-19)而接受短暂免疫抑制(每天≥40毫克泼尼松龙或儿童同等药物)的个体以及因肾上腺皮质功能不全而服用替代皮质类固醇的个体被认为没有严重的免疫抑制足以阻止对疫苗接种的反应。
JCVI最初建议,应向在主要计划中接种第一剂或第二剂COVID-19时或之后两周内被认为严重免疫抑制的个体提供第三剂疫苗。然后,这些人有资格接种补种剂或加强剂(2021年秋季、2022年春季、2022年秋季、2023年春季和2023年秋季),并有望在随后的所有季节性活动中有资格定期接种疫苗。
2023年,对于大多数5岁及以上的人来说, COVID-19疫苗的主要疗程变成了有针对性的单剂疫苗供应,仅在季节性活动期间提供。从那时起,变得或最近变得严重免疫抑制的个体(即开始免疫抑制治疗或已经发展为免疫抑制状况的个体)应考虑额外剂量(如下所述)。
以前未接种疫苗的个体如果变得或最近变得严重免疫抑制,无论一年中的什么时候,都应考虑进行第一剂疫苗接种。然后应根据专科医生的临床判断提供更多剂量(见下文)。
接种疫苗的个体如果变得或最近变得严重免疫抑制,无论他们过去的免疫史和一年中的时间如何,都应考虑额外接种一剂 COVID-19疫苗。应与之前的任何剂量至少间隔三个月提供额外剂量的疫苗,以将保护延长至下一个季节性活动。
应使用临床判断来决定哪些人在诊断后应尽快给予额外剂量,而不是等待下一次运动,从而在季节获得额外保护,尤其是在冬季,与其他高危人群同时。最佳时机还应考虑免疫抑制的程度(参见时机部分)。理想情况下,第二剂应在前一剂后8-12周内接种,以延长保护。根据专科医生的临床建议,此间隔可能会缩短至3周,以最大限度地提供短期保护,但请记住,反应可能不太持久。如上所述,后续剂量可能会在下一次常规活动中最佳给药。
与其他符合条件的风险群体相比,那些因严重免疫抑制而有资格接种疫苗但在活动期间错过疫苗接种的人,可能会根据个人临床判断考虑在以后的日期接种加强针,平衡他们的直接风险水平与等到下一个季节性活动的优势。
额外剂量的时间
一般来说,在免疫抑制程度最低的时期接种疫苗更有可能产生更好的免疫反应。因此,理想情况下,应给予任何计划的额外剂量,并特别注意当前或计划的免疫抑制治疗。
例如:
●对于即将接受计划免疫抑制治疗的少数患者
治疗,疫苗接种可以提前到开始治疗之前(最好至少在两周前),此时他们的免疫系统能够更好地做出反应。为了最大限度地发挥益处,不应在前一剂疫苗后三周内接种疫苗
●在可能的情况下,除了清除治疗剂的时间外,还应将额外的加强剂量推迟到免疫抑制期后两周
●或者,应考虑在治疗“假期”期间或免疫抑制程度最低时接种疫苗
任何推迟免疫抑制治疗或将疫苗接种可能获益推迟到免疫抑制治疗后的决定,都应在适当考虑加剧其潜在疾病的风险以及COVID-19的风险后做出。
https://www上提供了对化疗患者的具体建议。ukchemotherapyboard.org/publications。
方框1:12岁及以上人群额外接种 COVID-19疫苗的标准
由于以下情况,在接种疫苗时患有原发性或获得性免疫缺陷状态的个体:
●急性和慢性白血病,以及临床侵袭性淋巴瘤(包括霍奇金淋巴瘤),他们在接种疫苗时正在接受治疗或在治愈后12个月内
●正在接受慢性淋巴组织增生性疾病随访的个体,包括血液系统恶性肿瘤,如惰性淋巴瘤、慢性淋巴白血病、骨髓瘤、华氏巨球蛋白血症和其他浆细胞恶液质(注意:此列表并不详尽)
●因HIV/AIDS导致免疫抑制的成人和12岁及以上儿童,当前CD4计数为<200个细胞/μl
●原发性或获得性细胞和联合免疫缺陷–患有淋巴细胞过敏(<1,000个淋巴细胞/μ升)或功能性淋巴细胞疾病的患者
●接种疫苗前24个月内接受过干细胞移植或嵌合抗原受体(CAR)-T细胞治疗者
●接种疫苗前24个月以上接受过干细胞移植但患有持续免疫抑制或移植物抗宿主病(GVHD)的人
●由于原发性免疫缺陷(例如普通变异型免疫缺陷)或继发于疾病/治疗的持续性无丙种球蛋白血症(IgG<3g/L)
接种疫苗时接受免疫抑制或免疫调节治疗的个体包括:
●接种疫苗时正在接受实体器官移植免疫抑制治疗的人
●正在或在过去3个月内接受过自身免疫性疾病靶向治疗的人,例如JAK抑制剂或生物免疫调节剂,包括B细胞靶向治疗(包括利妥昔单抗,但在这种情况下,接受者将被视为免疫抑制6个月)、T细胞共刺激调节剂、单克隆肿瘤坏死因子抑制剂(TNFi),可溶性TNF受体、白细胞介素(IL)-6受体抑制剂、IL-17抑制剂、IL12/23抑制剂、IL23抑制剂。(注意:此列表并不详尽)
●接种疫苗前6个月内正在或曾经接受任何适应症的免疫抑制化疗或放疗者
在接种疫苗前正在接受或曾经接受免疫抑制治疗的慢性免疫介导的炎症性疾病个体包括:
●接种疫苗前一个月服用高剂量皮质类固醇(相当于每天≥20毫克泼尼松龙)超过10天
●接种疫苗前3个月内长期服用中等剂量皮质类固醇(相当于每天≥10毫克泼尼松龙,持续4周以上)
●非生物口服免疫调节药物,如甲氨蝶呤>每周20毫克(口服和皮下注射)、硫唑嘌呤>3.0毫克/公斤/天;接种疫苗前3个月内6-巯基嘌呤>1.5mg/kg/天,麦考酚酯>1g/天)
●某些个体剂量低于上述剂量的联合疗法,包括
每天≥7.5毫克泼尼松龙与其他免疫抑制剂(羟氯喹或柳氮磺吡啶除外)联合使用,以及接种疫苗前3个月内接受甲氨蝶呤(任何剂量)和来氟米特治疗的患者
在接种疫苗前一个月因任何原因接受高剂量类固醇(相当于每天>40毫克泼尼松龙,持续一周以上)的个体
方框2:6个月至11岁儿童额外接种 COVID-19疫苗的标准
由于以下情况,在接种疫苗时患有原发性或获得性免疫缺陷状态的个体:
●急性和慢性白血病,以及临床侵袭性淋巴瘤(包括霍奇金淋巴瘤),他们在接种疫苗时正在接受治疗或在治愈后12个月内
●接受慢性淋巴组织增生性疾病(包括血液系统恶性肿瘤)随访的个体
●因HIV/AIDS而免疫抑制的儿童(当前CD4计数为<500个细胞/μ升,6-11岁<200个细胞/μ升的儿童)
●原发性或获得性细胞和联合免疫缺陷–淋巴细胞缺乏症(<1,000个淋巴细胞/μ)或功能性淋巴细胞疾病患者
●接种疫苗前24个月内接受过干细胞移植或嵌合抗原受体(CAR)-T细胞治疗者
●接种疫苗前24个月以上接受过干细胞移植但患有持续免疫抑制或移植物抗宿主病(GVHD)的人
●由于原发性免疫缺陷(例如普通变异型免疫缺陷)或继发于疾病/治疗的持续性无丙种球蛋白血症(IgG<3g/L)
接种疫苗时接受免疫抑制或免疫调节治疗的个体包括:
●接种疫苗时正在接受实体器官移植免疫抑制治疗的人
●正在或在过去3个月内接受过自身免疫性疾病靶向治疗的人,例如JAK抑制剂或生物免疫调节剂,包括B细胞靶向治疗(包括利妥昔单抗,但在这种情况下,接受者将被视为免疫抑制6个月)、T细胞共刺激调节剂、单克隆肿瘤坏死因子抑制剂(TNFi),可溶性TNF受体、白细胞介素(IL)-6受体抑制剂、IL-17抑制剂、IL12/23抑制剂、IL23抑制剂。(注意:此列表并不详尽)
●接种疫苗前6个月内正在或曾经接受任何适应症的免疫抑制化疗或放疗者
在接种疫苗前正在接受或曾经接受免疫抑制治疗的慢性免疫介导的炎症性疾病个体包括:
●接种疫苗前一个月服用高剂量皮质类固醇(相当于每天每公斤≥1毫克泼尼松龙)超过10天
●接种疫苗前3个月内长期服用中等剂量皮质类固醇(相当于每天每公斤≥0.5毫克泼尼松龙,持续4周以上)
●接种疫苗前3个月内服用任何剂量的非生物口服免疫调节药物(羟氯喹和柳氮磺嘧啶除外),如甲氨蝶呤、硫唑嘌呤、6-巯基嘌呤或麦考酚酯。(注意:此列表并不详尽)
在接种疫苗前一个月因任何原因接受高剂量类固醇(相当于每天每公斤>2毫克泼尼松龙,持续一周以上)的个体
针对特定年龄的疫苗类型建议
在认识到大多数英国人口对先前的疫苗接种和/或自然暴露具有免疫力后,JCVI建议5岁及以上符合条件的个人只需要接种一剂疫苗,无论之前的疫苗接种状态如何。因此,基础剂量和加强剂量的疫苗供应是一致的,应在季节性期间提供活动,距离上一剂至少三个月。唯一的例外是患有严重免疫抑制的个体,他们可能需要额外的剂量(参见严重免疫抑制部分)。符合条件的5岁以下儿童应继续接种两剂基础疫苗,间隔三个月。
在目前的流行病学中,由于所有流行的毒株都是Omicron谱系的一部分,并且过去疫苗接种和自然暴露的人群免疫力很高,针对较新毒株的疫苗也将增强对历史毒株的免疫力,因此可用于初级和加强疫苗接种。
对于mRNA疫苗,JCVI考虑了针对历史突变株和较新突变株的疫苗之间中和抗体差异的证据。总体而言,委员会认为,中和抗体的改进可能转化为对紧密匹配的毒株的保护仅得到适度的改善,而这些毒株对不太匹配的突变株具有较小的优势。
因此,委员会同意,在获得授权、可用且可在正确年龄组中部署的情况下,针对最新突变株的单价产品是首选,但这种偏好并不能成为向风险最高人群提供疫苗的任何实质性延迟的理由。一般来说,在冬季或即将到来的感染浪潮之前使用匹配性较差的疫苗进行疫苗接种的最佳时间,比起使用匹配性稍好的疫苗进行疫苗接种,更可取。遵循这些原则,2024年春季计划部署了单价XBBmRNA疫苗,预计2024年秋季计划部署了针对JN.1毒株的单价mRNA疫苗。
2025年春季
对于所有疫苗剂量,包括严重免疫抑制患者的额外剂量,应遵循以下适合年龄的建议,无论接种的是作为基础剂量的疫苗还是之前的加强剂。
18岁或以上的合资格成年人(包括65岁以上的安老院舍居民)
–0.3毫升剂量(30微克)的辉瑞-BioNTech COVID-19疫苗(Comirnaty®JN.1)
–0.5毫升(50微克)莫德纳 COVID-19疫苗(Spikevax®JN.1)符合条件的12-17岁儿童和年轻人
–0.3毫升剂量(30微克)的辉瑞-BioNTech COVID-19疫苗(Comirnaty®JN.1)
辉瑞-BioNTech 疫苗是儿童的首选疫苗,因为心肌炎的报道发生率略低。
符合条件的5-11岁儿童
–0.3毫升(10微克)剂量的辉瑞-BioNTech 儿科 COVID-19疫苗(Comirnaty®10JN.1)辉瑞-BioNTech 疫苗是儿童的首选疫苗,因为心肌炎的报告率略低。
符合条件的6个月至4岁儿童
–0.3毫升(3微克)剂量的辉瑞-BioNTech 婴儿 COVID-19疫苗(Comirnaty®3JN.1)。那些之前没有接种疫苗的人可能需要第二剂。
辉瑞-BioNTech 疫苗是儿童的首选疫苗,因为心肌炎的报道发生率略低。
不适合接种mRNA疫苗的患者接种疫苗需要个体临床判断(参见有过敏史的患者的免疫接种部分)。
2025 年秋季
特殊说明:
其他注意事项
既往疫苗接种不完全
如果课程中断或延迟,可以在下一个季节性活动期间恢复,然后不需要额外的剂量。有证据表明,那些接受混合时间表(包括mRNA和腺病毒载体疫苗)的人会产生良好的免疫反应(Liuetal,2021),尽管异源第二剂的副作用发生率更高。(Shaw等人,2021年)。积累的证据现在支持对初次免疫和加强免疫使用异源方案。
在海外接种疫苗或作为临床试验的一部分接种疫苗的个体
在国外或临床试验中接种疫苗的个体可能已经接种了基于刺突蛋白的疫苗或灭活全病毒疫苗。预计这些人将受到英国目前使用的疫苗的加强。UKHSA提供有关在海外接种 COVID-19疫苗的人接种疫苗的具体建议。
https://www.gov.uk/government/publications/covid-19-vacCI nation-programme-guidance-for-医疗保健从业者。
与其他疫苗同时接种
最初,关于COVID-19与其他疫苗共同接种的数据有限。在没有此类数据的情况下,第一原则表明,具有不同抗原含量的灭活疫苗之间的干扰可能是有限的(见第11章)。根据其他疫苗的经验,任何潜在的干扰都极可能导致对其中一种疫苗的免疫反应略有减弱。没有证据表明存在任何安全问题,尽管这可能会使任何不良事件的归因更加困难。类似的注意事项适用于灭活(或非复制) COVID-19疫苗与MMR等活疫苗的同时接种。特别是,在粘膜中复制的活疫苗,例如减毒活流感疫苗(LAIV),不太可能受到伴随 COVID-19疫苗接种的严重影响。
英国一项关于阿斯利康和辉瑞-BioNTech COVID-19疫苗与灭活流感疫苗同时接种的研究证实了可接受的免疫原性和反应原性(Lazarus等人,2021年)。尽管一项关于诺瓦瓦克斯 COVID-19疫苗与灭活流感联合接种的研究确实显示对COVID-19的抗体反应有所减弱(Toback等人,2022年),但在3期研究中,联合接种仍然与对COVID-19的高效相关(Heath等人,2022年)。最近的一项研究表明,与序贯给药相比,COVID-19与灭活带状疱疹疫苗联合接种时,COVID-19具有可接受的安全性,不良事件的频率、严重程度或持续时间没有差异,并且免疫反应非常相似(Naficy等人,2023年)。
根据上述证据,并且由于 COVID-19疫苗被认为是灭活的(包括非复制腺病毒疫苗),如果符合条件的队列中的个体最近接种了一种或多种灭活疫苗或另一种活疫苗,则仍应接种 COVID-19疫苗。这同样适用于首先接种 COVID-19疫苗或患者需要两种或多种疫苗的其他活疫苗和灭活疫苗。通常,最好继续接种疫苗,以避免进一步延误保护,并避免患者稍后不返回就诊的风险。这包括但不限于通常在同一时间或相同环境中接种的疫苗(包括65岁以上人群的肺炎球菌多糖疫苗和带状疱疹疫苗,孕妇接种含百日咳疫苗和流感疫苗,以及学龄儿童的LAIV、HPV、MenACWY和Td-IPV疫苗)。
SARS-CoV-2的单克隆抗体最近被批准用于治疗和预防COVID-19感染。灵长类动物数据表明,阿斯利康联合单克隆抗体产品的给药不会干扰随后对主动疫苗接种的反应。因此,基于这些有限的证据,在收到这些产品和接种 COVID-19疫苗之间不需要特定的时间间隔,反之亦然。由于这些产品可能优先用于对疫苗接种反应较弱的人群,例如免疫抑制者,因此可能需要如上所述额外剂量的疫苗。
特定人群
怀孕
在怀孕或母乳喂养期间给予灭活的重组病毒或细菌疫苗或类毒素没有已知的风险(Kroger等人,2013年)。由于灭活疫苗无法复制,因此它们不会在母亲或胎儿中引起感染。尽管阿斯利康 COVID-19疫苗含有活的腺病毒载体,但这种病毒不会复制,因此不会在母亲或胎儿中引起感染。与大多数药品一样, COVID-19疫苗在怀孕期间的大型临床试验尚未进行。
辉瑞-BioNTech 、Moderna和AstraZeneca疫苗在动物中的发育和生殖测试没有引起任何担忧。腺病毒载体类似于阿斯利康 COVID-19疫苗中使用的载体,已被广泛用于为女性接种埃博拉疫苗,而没有引起任何担忧;这些疫苗在怀孕期间的正式试验即将进行。
来自美国妊娠期接种疫苗的妇女的大量观察数据并未显示不良妊娠结局的增加。https://www.cdc.gov/coronavirus/2019-ncov/vacCI nes/safety/vsafepregnancyregistry.html
根据COVID-19感染导致孕产妇和新生儿结局不良的证据,JCVI建议怀孕被认为是季节性运动的临床风险群体。对英格兰至少接种过一剂疫苗的女性的出生结局分析显示,与未接种疫苗的女性相比,良好分娩结局率相似或更高。https://www.gov.uk/government/出版物/covid-19-疫苗-周刊-监测报告。
在接种疫苗之前,不需要定期询问末次月经和/或妊娠试验。计划怀孕或产后立即的妇女应接种适合其年龄和风险状况的产品。
不应建议在意外免疫接种后终止妊娠。英国卫生安全局不再对英国在怀孕早期无意中接种 COVID-19疫苗进行监测。
进行这项监测是为了记录在怀孕早期不知情的情况下接种疫苗的妇女的安全性,以告知妇女和卫生专业人员。
母乳喂养
在母乳喂养期间接种非活疫苗没有已知的风险。JCVI建议应为母乳喂养的妇女提供任何合适的 COVID-19疫苗。新出现的安全数据令人放心:在最近接种疫苗的女性的母乳中未检测到mRNA(Golan等人,2021年),并且在母乳中检测到保护性抗体(Gray等人,2021年)。
母乳喂养对发育和健康的益处是显而易见的,应与女性讨论,以及她对COVID-19免疫接种的临床需求。
儿童
与成人相比,儿童和年轻人因SARS-CoV-2而患COVID-19、重病或死亡的风险非常低。为学龄儿童接种疫苗可以防止缺勤提供短期保护2。
16岁以下儿童的COVID-19死亡风险较低,住院风险主要限于临床风险人群。一些儿童,例如患有深度和多重LD(PMLD)和严重LD的儿童,包括患有唐氏综合症和脑瘫的儿童,因COVID-19住院的风险更高(Williamson等人,2021年)。一个专家组最近进行的分析得出结论,在大流行的第一年,患有各种潜在疾病的儿童的重症监护入院率超过每百万人100人。因此,建议符合条件的6个月及以上患有这些疾病的儿童接种辉瑞-BioNTech COVID-19疫苗(参见儿童部分以及表3和表4)。
免疫抑制和HIV(另见前面关于严重免疫抑制个体的额外剂量)
免疫抑制和HIV感染者(无论CD4计数如何)应根据上述建议和禁忌症接种 COVID-19疫苗。
免疫抑制的个体可能无法对疫苗接种产生完全的免疫反应。由于关于每种特定免疫抑制疗法或病症的反应的证据有限,因此需要一般原则来告知最佳给药时间。预计在免疫抑制最小期间接种的疫苗更有可能产生更好的免疫反应。因此,理想情况下应接种疫苗,并特别注意当前或计划的免疫抑制疗法。
研究表明,在接种疫苗前至少两周接受化疗的癌症患者的免疫反应更好(Monin-Aldama等人,2021年),或者服用甲氨蝶呤的人在接种疫苗后两周暂时停止治疗时(Abhishek等人,2022年)。
1https://www.gov.uk/guidance/vacCI nation-in-pregnancy-vip
专家可能会根据患者对免疫状态和对疫苗接种的可能免疫反应的知识和理解为患者提供建议,但也应考虑COVID-19的风险和患者暴露的可能性。
任何推迟免疫抑制治疗或将疫苗接种可能获益推迟到治疗后的决定,都应在适当考虑加剧其潜在疾病的风险以及COVID-19的风险的情况下做出。
新出现的证据表明,许多免疫抑制患者在接种疫苗后确实获得了保护。(Whitaker等人,2022年)。然而,对于免疫功能正常的个体,接种疫苗的保护作用确实会随着时间的推移而下降。由于免疫抑制者因COVID-19感染而出现严重并发症的风险仍然较高,因此这群人有资格在季节性活动中接种疫苗,并且有望有资格参加未来的季节性活动。为了降低接触风险,免疫抑制个体的青少年和成人家庭接触者有资格在季节性活动中接种加强针。
一些免疫抑制更严重的个体对完整的初次疫苗接种没有良好的免疫反应。这包括但不限于对实体器官移植进行免疫抑制的个体(Prendecki等人,2021年)、完成治愈性治疗后六个月内的血液系统癌症患者(Lim等人,2021年),以及接受某些单克隆抗体疗法的个体(Mahil等人,2021年)。因此,JCVI建议一些个体需要额外剂量(见方框1和2),而严重免疫抑制的个体可以考虑在两次运动之间增加剂量(参见额外剂量部分)。
管理严重免疫抑制个体的专家可能会考虑进行疫苗接种后刺突抗体检测。可检测到的抗体水平低可能表明对轻度感染的保护作用较差,但由于T细胞和B细胞免疫记忆,可能仍然存在对严重疾病的保护作用。考虑到他们潜在的免疫缺陷,专家可能会使用这些信息来建议个人采取额外的预防措施以避免暴露或接收有关获得早期抗病毒治疗的信息。接受骨髓移植的个体以及许多因某些情况接受CAR-T治疗的个体可能会因治疗前接受的疫苗接种和潜在疾病的发展而失去免疫记忆。在治疗和康复后,应考虑这些个体对常规计划中使用的所有疫苗进行完整疗程的再接种(见第7章)。应遵循专家建议,了解可以安全接种哪些疫苗以及开始再次接种的最佳时机。无论一年中的什么时候,都应考虑从骨髓移植中康复的个体接种第一剂 COVID-19疫苗。然后最好间隔8至12周提供后续剂量,以延长保护持续时间。根据专家的临床建议,此间隔可能会减少到至少3周。那些仍然免疫抑制的人将继续有资格参加季节性活动。
禁忌
很少有人无法接种英国批准的 COVID-19疫苗。如有疑问,应向相关专家或当地免疫或健康保护团队寻求适当的建议,而不是拒绝接种疫苗。
以下是接种 COVID-19疫苗的相对禁忌症:
●以前对 COVID-19疫苗有过过敏反应的人
–接种阿斯利康、赛诺菲巴斯德或诺瓦瓦克斯疫苗的人可以接种与任何环境中涉及的产品不同的产品,观察30分钟
–一些最初对mRNA疫苗有明显过敏反应的个体可以耐受第二剂相同的疫苗。在没有过敏反应的客观迹象且症状迅速消退(不超过1剂IM肾上腺素)的情况下,可以在任何疫苗接种环境中再接种一剂相同的疫苗。如果反应可能是全身过敏反应,请寻求专家建议;如果决定接种相同的疫苗,则应在医院的医疗监督下进行。有关更多信息,请参阅流程图。
●先前对 COVID-19疫苗的任何成分(赋形剂)有过敏反应的个体,例如聚乙二醇
–现在发表的数据显示,一些先前对含PEG的药物有过敏反应的个体(例如。PEG-天冬酰胺酶)可以耐受辉瑞-BioNTech 疫苗(尽管历史反应可能是由于非PEG成分)(Mark等人,2021年)。应获得专家建议,如果决定接种mRNA疫苗,则只能在医院的医疗监督下进行
预防措施
没有发热或全身不适的轻微疾病不是推迟免疫接种的有效理由。如果一个人出现急性不适,免疫接种可以推迟到他们完全康复。这是为了避免错误地将任何体征或症状归因于疫苗的不良反应,从而混淆任何急性疾病(包括COVID-19)的鉴别诊断。
有COVID-19感染史的人
为既往有COVID-19感染史或具有可检测COVID-19抗体的个体接种疫苗没有安全问题。
为可能感染或无症状或潜伏型COVID-19感染的个体接种疫苗不太可能对疾病产生不利影响,但疑似COVID-19感染者不应参加免疫接种,以免感染他人。从最近的相容症状中恢复后,无需推迟个人的免疫接种,无论他们是否接受了COVID-19检测。在护理院疫情爆发期间,如果居民临床情况稳定且可以维持感染控制程序,则可以继续为确诊COVID-19的居民接种疫苗。这些人群可能非常脆弱,这项政策应该有助于最大限度地提高疫苗接种覆盖率,而无需多次就诊。
长期存在COVID-19症状并不是接种 COVID-19疫苗的禁忌症,但如果患者严重虚弱、仍在积极调查中或有近期恶化的证据,则可以考虑推迟接种疫苗,以避免将人潜在状况的任何变化错误归因于疫苗。
有过敏史的人
极少数人在接种 COVID-19疫苗时出现过敏反应。任何对 COVID-19疫苗中的赋形剂有过敏反应史的人都不应接种该疫苗(除非有专家建议),但有任何其他过敏症(如食物过敏)的人——包括既往有过敏反应的人——可以接种疫苗。
辉瑞-BioNTech 和ModernamRNA疫苗含有聚乙二醇(PEG)。PEG(也称为聚乙二醇)是一组已知的过敏原,常见于药物、许多家用产品和化妆品中。含有PEG的药物包括一些片剂、泻药、长效类固醇注射剂和一些用于结肠镜检查的肠道制剂。已知对PEG过敏的情况很少见。现在的证据表明,PEG过敏仅与 COVID-19疫苗后报告的少数过敏反应有关。
迄今为止,阿斯利康疫苗后报告的过敏反应发生率与非COVID疫苗的预期过敏反应发生率一致。阿斯利康、诺瓦瓦克斯、海博拉和赛诺菲巴斯德疫苗不含PEG,但含有一种称为聚山梨酯80的相关化合物。极少数情况下,对PEG过敏的人也可能对聚山梨酯80过敏。
然而,聚山梨酯80广泛用于药物和食品中,并存在于许多药物中,包括单克隆抗体制剂。一些注射流感疫苗(包括用于65岁以上人群的主要疫苗)含有聚山梨酯80。耐受含有聚山梨酯80的注射剂(包括佐剂流感疫苗Fluad®和葛兰素史克疫苗Fluarix®)的个体可能耐受阿斯利康、HIPRA和诺瓦瓦克斯疫苗。
赛诺菲巴斯德疫苗还含有比这些流感疫苗更高水平的PS80,以及少量的聚山梨酯20(一种类似的化合物)。尽管使用这种疫苗的经验非常有限,但对PEG过敏的人不太可能对赛诺菲巴斯德疫苗产生反应,特别是如果他们耐受过以前的流感疫苗和/或阿斯利康或诺瓦瓦克斯疫苗。表5总结了过敏患者管理的建议。
接种 COVID-19疫苗后,应观察个人在接受任何口头疫苗接种后信息和离开中心时是否有任何即时反应。所有疫苗接种点都应提供全身过敏反应管理设施(见第8章)。复苏委员会也发布了建议。
根据产品特性摘要,建议辉瑞-BioNTech 、Moderna、Novavax和HIPRA疫苗的所有接种者保持观察和监测至少15分钟。鉴于需要加快实施该计划以应对Omicron突变株的出现,英国首席医疗官建议在NHS计划中暂停对儿童和成人的两种mRNA疫苗(辉瑞-BioNTech 和Moderna)的这一要求。此后,人类药物委员会同意暂停无过敏史个体的观察期。此后,暂停常规15分钟观察期的建议已扩展到所有目前可用的 COVID-19疫苗,当用于NHS计划时。
MHRA将继续密切监测 COVID-19疫苗接种后的过敏反应;强烈鼓励通过黄卡计划报告不良事件(www.mhra.gov.uk/yellowcard)。
应告知接种疫苗的人如何在出现任何症状时立即获得医疗保健建议。在某些情况下,例如家庭疫苗接种,这可能需要负责任的成年人在接种疫苗后至少15分钟在场。有过敏个人史的患者应按表5进行管理。对于有过敏家族史的患者,不需要特殊管理。
1www.resus.org.uk/about-us/news-and-events/rcuk-publishes-anaphylaxis-guidance-vacCI nation-settings
2https://www.gov.uk/government/publications/coronavirus-covid-19-vacCI ne-adverse-reactions/coronavirus-黄卡报告疫苗摘要
由于接种疫苗后可能会出现昏厥,因此所有接种任何 COVID-19疫苗的人在接种疫苗后15分钟内不应开车。
表5:有过敏史患者的管理
| 继续接种疫苗 (无特殊注意事项) | 特别注意事项 | 接种疫苗 禁忌 | |
| 患者特征 | ●既往对食物、昆虫叮咬和大多数药物(已确定触发因素)的过敏反应(包括过敏反应) ●既往对疫苗的非全身反应 ●对非甾体抗炎药过敏,例如阿司匹林、布洛芬 ●肥大细胞增多症 | ●既往对 COVID-19疫苗有非过敏反应 ●对多种不同药物类别的速发型过敏反应史,触发因素不明(这可能表明PEG过敏) ●对疫苗、注射抗体制剂或可能含有PEG的药物(例如长效类固醇注射剂、泻药) ●特发性过敏反应史 | ●既往对 COVID-19疫苗的过敏反应 ●先前对疫苗成分的全身过敏反应(有关已知的PEG过敏,请参见上文) |
| 行动 | ●在任何情况下进行疫苗接种 ●有些人可以通过观察15分钟来放心(如果以前耐受相同的疫苗,则可能不需要) ●一些患者(例如肥大细胞增多症患者)可能会受益于抗组胺药预处理以减轻过敏症状 | ●考虑PEG过敏的可能性,如有需要,请寻求过敏建议 ●一个人以前曾耐受过一剂相同的疫苗,在任何情况下都可以安全接种。 否则 –考虑接种疫苗并观察30分钟 | ●转介给过敏症专科医生或其他合适的专科医生 ●考虑在医院的医疗监督下接种相关的mRNA疫苗,或者,如果对非mRNA疫苗有反应,则在任何情况下给予替代疫苗 ●考虑观察30分钟 |
未确诊的PEG过敏患者通常有速发型不明原因的过敏反应或对多种药物的过敏反应的病史。这些人通常耐受辉瑞、BioNTech或Moderna疫苗,但建议向过敏专家寻求专家建议(除非之前至少耐受过一剂相同的疫苗。非mRNA疫苗(如Novavax或HIPRA)可用作替代品(除非另有禁忌),特别是如果他们以前耐受佐剂流感疫苗。疫苗应在有完整复苏设施的环境中(例如医院)进行接种,并建议观察30分钟。对于可能正在接受含PEG药物的癌症儿童,请访问https://www.cclg.org.uk/Coronavirus-advice。
英国过敏与临床免疫学会(BSACI )建议,对第一剂 COVID-19疫苗有反应的人可以接种第二剂疫苗,如下图所示。许多人耐受了相同疫苗的后续剂量,这是首选,因为它可以避免个人被错误地贴上终生过敏的标签。
对第一剂 COVID-19疫苗有非过敏反应(血管迷走神经发作、非荨麻疹皮肤反应或非特异性症状)的个体可以在任何免疫接种环境中接种第二剂疫苗。建议观察15分钟。
管理对先前剂量的 COVID-19疫苗有过敏反应的患者的流程图
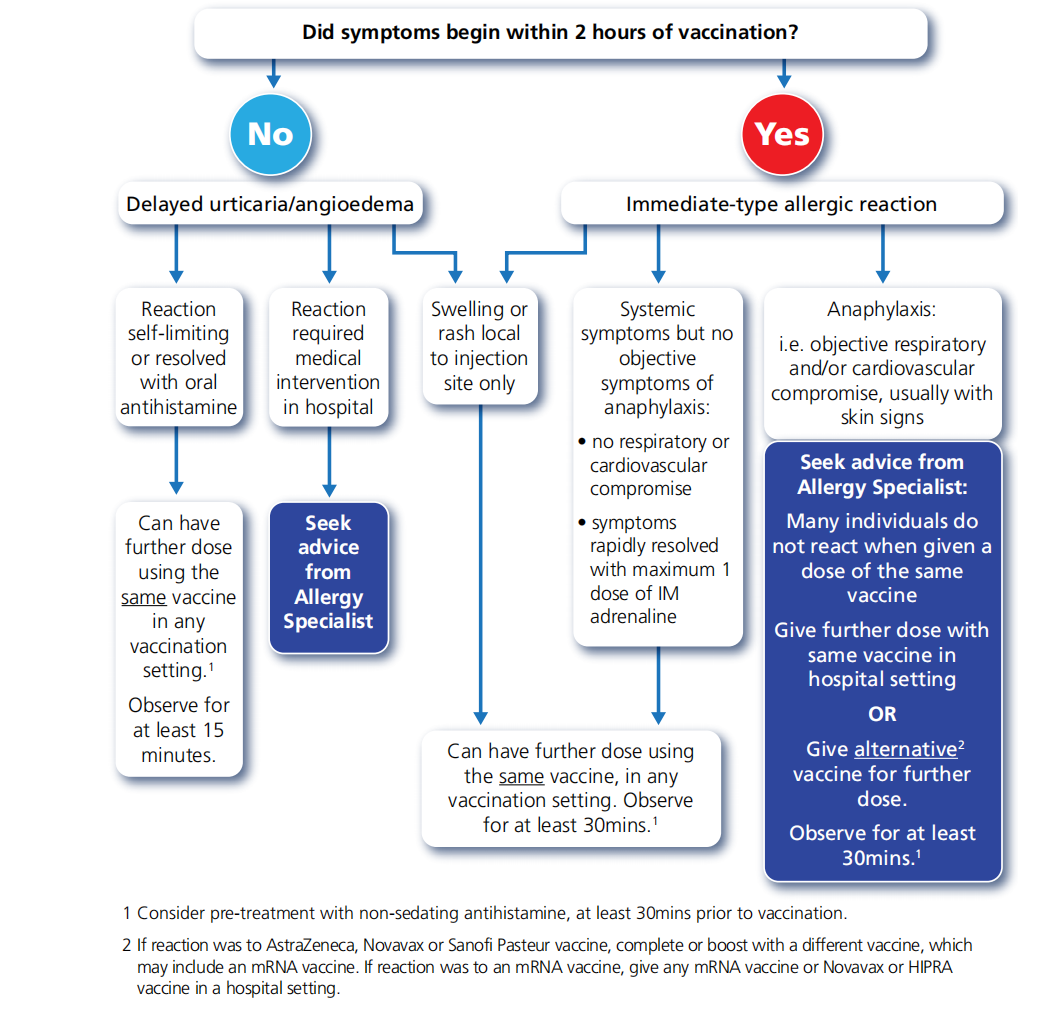
1考虑在接种疫苗前至少30分钟使用非镇静性抗组胺药进行预处理。
2如果对阿斯利康、诺瓦瓦克斯或赛诺菲巴斯德疫苗有反应,请用其他疫苗(可能包括mRNA疫苗)完成或加强接种。如果对mRNA疫苗有反应,请在医院接种任何mRNA疫苗或Novavax或HIPRA疫苗。
COVID-19疫苗接种后发生的血栓形成和血小板减少综合征(TTS)
据报道,在阿斯利康疫苗接种后,出现了一种涉及严重血栓栓塞事件并伴有血小板减少症的病症。
没有证据表明受这种疾病影响的个体有任何潜在的风险因素,他们以前主要是健康的。这种情况很罕见,往往表现为不寻常的凝血形式,其机制被认为是与对阿斯利康疫苗的免疫反应有关的特殊反应。由于这种可能的免疫机制,没有理由相信过去有血栓病史或某些血栓形成倾向的个体患这种非常罕见的情况的风险会增加。
同样,尽管怀孕会增加凝血病症的风险,但没有证据表明孕妇、产后妇女或服用避孕药的妇女在接种阿斯利康疫苗后患血栓形成合并血小板减少症的特定情况的风险更高。迄今为止,尚未报告孕妇确诊病例。但是,在为既往有肝素诱导的血小板减少症和血栓形成(HITT或HIT2型)病史的个体接种疫苗时,应谨慎使用。
对于在接种第一剂阿斯利康疫苗后出现凝血发作并伴有血小板减少症的个体,应进行适当评估。如果认为他们患有报告的疾病,则应推迟进一步接种疫苗,直到他们的凝血完全稳定。在英国,许多确诊为TTS的患者(n=23)现在已经耐受了第二剂辉瑞-BioNTech ,少数人耐受了莫德纳(n=2)或阿斯利康(n=1)疫苗(LacyJ等人,2021年)。最近的一项研究记录了第一剂疫苗后12周抗PF4抗体下降;对5名确诊TTS的患者进行随访,这些患者以至少10周的间隔接受辉瑞-BioNTech 进行第二剂治疗,没有进一步的发作(Schönborn等人,2021年)。因此,目前的证据将支持决定完成初级疗程或对有TTS病史的患者接种mRNA疫苗,前提是相关剂量至少已过去12周。
建议已接种第一剂阿斯利康疫苗但没有出现这种罕见病症的人按目前建议的时间间隔接种第二剂相同疫苗。迄今为止,没有迹象表明第二剂后这种情况的风险增加,并且第二剂时其他反应的发生率低于第一剂该疫苗后。
根据目前的证据,JCVI建议40岁以下的健康人优先选择替代疫苗,包括卫生和社会护理工作者、无薪护理人员和免疫抑制个体的家庭接触者。
过去有凝血发作的个体和被诊断患有易栓症的个体,无论他们是否长期接受抗凝治疗,都仍然面临患COVID-19疾病的风险。没有证据表明那些有血栓形成既往史或已知血栓形成危险因素的人在接种阿斯利康疫苗后更容易患上这种免疫介导的血栓形成病症并伴有血小板减少症。对于这些人中的大多数人来说,由于COVID-19感染而导致血栓复发的风险仍然远大于这种综合征的风险。因此,40岁及以上有此类病史的人应该接种任何可用的疫苗(前提是没有其他禁忌证)。同样的考虑也适用于那些在接种第一剂阿斯利康疫苗后出现常见凝血发作但没有伴随血小板减少症的患者。
其他罕见病症
心肌炎和心包炎
接种 COVID-19疫苗后很少报告心肌炎和心包炎病例。如果一个人在第一次接种 COVID-19疫苗后出现心肌炎或心包炎,则应由适当的临床医生对他们进行评估,以确定是否可能与疫苗有关https://www.gov.uk/government/publications/myocarditis-and-pericarditis– COVID-19疫苗接种后/心肌炎和心包炎- COVID-19疫苗接种后-针对医疗保健专业人员的指导.由于正在研究心肌炎和心包炎的作用机制和复发风险,目前的建议是应推迟个体的第二次或后续剂量,等待进一步调查和仔细考虑风险和益处。对于那些在首次接种mRNA疫苗后两周内出现心肌炎或心包炎的人,N抗体检测可能表明之前曾接触过COVID-19。这些人可能受到很好的保护,因此第二次或后续剂量的益处可能更加有限。如果N抗体呈阴性或在认为需要进一步剂量的其他情况下,例如在COVID-19感染并发症风险较高的人群中,一旦患者完全康复,应考虑接种第二剂或加强剂辉瑞-BioNTech 疫苗。新出现的证据表明,应与之前的剂量间隔至少12周。辉瑞-BioNTech 优于Moderna,因为据报道,后者疫苗后心肌炎的发生率略高。
虽然不是mRNA疫苗,但在接种Novavax COVID-19疫苗后也有心肌炎和心包炎的报道。https://www.tga.gov.au/news/covid-19-vacCI ne-safety-reports/covid-19-vacCI ne-safety-report-29-06-2023#covid19-vacCI nation后心肌炎和心包炎
吉兰-巴雷综合征
COVID-19疫苗接种后GBS的报告非常罕见,因此医疗保健专业人员应警惕GBS的体征和症状,以确保正确诊断并排除其他原因,以便开始适当的支持性护理和治疗。
有GBS病史的个体应根据其年龄和潜在风险状况的建议接种疫苗。接种疫苗后报告的GBS病例可能是偶然发生的(GBS的背景率为每年人群中每100,000人中有2例),并且尚未证实 COVID-19疫苗接种的因果机制。有证据表明,先前被诊断出患有GBS不会使个体在接种其他疫苗(Baxter等人,2012年)和辉瑞-BioNTech COVID-19疫苗(ShapiroBenDavid等人,2021年)时易患GBS进一步发作。对于那些在第一剂疫苗接种后被诊断患有GBS的人,风险收益平衡有利于完成完整的 COVID-19疫苗接种计划。然而,在预防的基础上,如果GBS在接种阿斯利康疫苗后6周内发生,则对于未来的任何剂量,辉瑞或莫德纳 COVID-19疫苗都是首选。如果在接种任何一种mRNA疫苗后发生GBS,一旦康复,可以照常进行进一步的疫苗接种。
血小板减少症
在接受阿斯利康疫苗接种后的前4周内很少报告血小板减少症病例(不伴有血栓形成)。其中一些病例发生在有免疫性血小板减少症(ITP)病史的个体中。既往ITP不是疫苗接种的禁忌证,但建议接受阿斯利康疫苗的有ITP病史的患者进行血小板监测。尽管有证据表明接种阿斯利康疫苗后ITP风险增加(Simpson等人,2021年),但其他 COVID-19疫苗也报道了ITP(Lee等人,2021年)。英国ITP论坛制定的指南
因此,工作组建议讨论有ITP病史的患者接受任何 COVID-19疫苗后血小板计数下降的可能性,并建议在接种疫苗后2-5天进行血小板计数检查(https://b-s-h.org.uk/about-us/news/covid-19-updates/)。对于在接种第一剂阿斯利康疫苗后4周内出现ITP的个体,应由血液科医生进行评估,并评估进一步接种疫苗的风险获益,以及应根据个体情况考虑使用哪种产品。如果接受进一步疫苗接种,应监测血小板计数。
毛细血管渗漏综合征
在接种AstraZeneca和Moderna疫苗后,在既往有毛细血管渗漏病史的个体中,报道了极其罕见的毛细血管渗漏综合征报告。对于有毛细血管渗漏综合征病史的个体,应仔细咨询接种疫苗的风险和益处,并应寻求专科医生的建议。
多形红斑
在Moderna和PfizermRNA疫苗接种后,已报告了许多多形性红斑(EM)病例。(https://www.gov.uk/government/publications/regulatory-批准辉瑞-BioNTech -疫苗用于covid-19)这些报告似乎与轻度EM一致,没有死亡病例。据报道,Pfizer疫苗再次攻击后复发。MHRA咨询了皮肤病学专家,他们认为EM是一种罕见的、良性的和自限性疾病,很可能是由 COVID-19疫苗接种引发的;尽管由于误诊而过度报告是可能的。多形性红斑的既往史在这两种疫苗的产品信息中都不是禁忌症。
报告过敏反应和其他过敏反应
过敏反应是大多数疫苗非常罕见且公认的副作用,疑似病例应通过黄卡计划(www.mhra.gov.uk/yellowcard)报告。绿皮书第8章详细指导了区分昏厥、惊恐发作和过敏反应的体征和症状。如果疑似过敏反应病例符合第8章中描述的临床特征,则应通过黄卡计划将其报告为“过敏反应”病例。较轻的过敏反应病例(即不包括过敏反应的临床特征)不应报告为过敏反应,而应报告为“过敏反应”。
由于这些疫苗标有黑色三角形,因此接种疫苗后任何年龄的个体发生的所有不良反应都应使用黄卡计划报告给MHRA。任何人都可以使用黄卡报告计划(www.mhra.gov.uk/yellowcard)。还应根据当地程序记录任何不良反应。
疑似病例和接触者的管理
目前支持使用 COVID-19疫苗作为暴露后预防或在疫情爆发期间阻断传播的证据有限。应与当地卫生保护团队讨论在长期社区暴发中使用疫苗为弱势群体提供直接保护。
有关出现COVID-19和其他呼吸道感染症状的人的当前管理指南和建议,请访问以下链接:
https://www.gov.uk/guidance/people-with-symptoms-of-a-respiratory-infection-including-COVID-19
https://www.gov.scot/collections/coronavirus-covid-19-guidance/
https://www.gov.wales/guidance-people-symptoms-respiratory-infection-including-covid-19
https://www.publichealth.hscni.net/covid-19-coronavirus/guidance-hsc-staff-healthcare工人和护理提供者
其他资源
供应
NHS授权提供该计划的 COVID-19疫苗将在ImmForm网站上提供,https://portal.immform.ukhsa.gov.uk/致电02071838580或通过英格兰的Foundry订购平台订购。
苏格兰、威尔士和北爱尔兰的安排可能有所不同,请联系各自政府的公共卫生机构了解当地详细信息。
在NHS计划之外使用的供应
辉瑞
一般查询,请致电01304616161联系辉瑞。
私人 COVID-19疫苗查询可发送至vacCI nesUK@pfizer.com
辉瑞ComirnatyJN.130mcg–预装注射器–冰箱稳定包装尺寸–10个预装注射器
最小订购量–1包
莫德纳
一般咨询、联系ukmarketing@modernatx.com或订购请联系
ModernaSpikevaxJN.150mcg–预装注射器
关键链接
符合 COVID-19疫苗接种条件的诊断和相关临床代码的完整规范已经制定,https://www可在PRIMIS网站上获得。nottingham.ac.uk/primis/projects/covid-19/covid-19.aspx。NHS专业人员可以访问该链接,并且需要在线注册。
引用
Abhishek A, Boyton R, McKnight Á, et al. Effect of a 2-week interruption in methotrexate treatment versus
continued treatment on COVID-19 booster vaccine immunity in adults with inflammatory conditions (VROOM study): a randomised, open label, superiority trial. Lancet Respir Med 2022;10: 840–50. https://doi.
org/10.1016/S2213-2600(22)00186-2
Addetia A, Crawford KHD, Dingens A, et al (2020) Neutralizing antibodies correlate with protection from SARS-CoV-2 in humans during a 1 fishery vessel outbreak with high attack rate. J Clin Microbiol 58(11):
e2107-20
Advisory Committee on Immunization Practices (2019). General Best Practice Guidelines for Immunization:
Best Practices Guidance of the Advisory Committee on Immunization Practices (ACIP). Special Situations
https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/special-situations.html
Allotey J,Bonet M, Kew T,. et al. (2020) Clinical manifestations, risk factors, and maternal and perinatal
outcomes of coronavirus disease 2019 in pregnancy: Living systematic review and meta-analysis. Br Med J
370:m3320.
Amirthalingam G, Lopez Bernal J, Andrews NJ et al. Higher serological responses and increased vaccine effectiveness demonstrate the value of extended vaccine schedules in combatting COVID-19 in England.
https://medrxiv.org/cgi/content/short/2021.07.26.21261140v1
Amanat F, Krammer F. SARS-CoV-2 Vaccines: Status Report. Immunity. 2020 Apr 14; 52(4):583-589. doi:
10.10.16/j.immuni.2020.03.007.Epub 2020 Apr 6.
Andrews N, Stowe J, Kirsebom F, et al. Covid-19 Vaccine Effectiveness against the Omicron (B.1.1.529) Variant. N Engl J Med. 2022 Apr 21;386(16):1532-1546. doi: 10.1056/NEJMoa2119451.
Andrews N, Tessier E, Stowe J, et al. Duration of Protection against Mild and Severe Disease by Covid-19 Vaccines. N Engl J Med. 2022 Jan 27;386(4):340-350. doi: 10.1056/NEJMoa2115481.
Andrews N, Stowe J, Kirsebom F et al. Effectiveness of COVID-19 booster vaccines against COVID-19-related symptoms, hospitalization and death in England. Nat Med. 2022 Apr;28(4):831-837. doi: 10.1038/s41591- 022-01699-1. Epub 2022 Jan 14.
Baden LR, El Sahly HM, Essink B et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. NEJM
- doi:10.1056/NEJMoa2035389.
Bar-On YM, Goldberg Y, Mandel M et al. Protection of BNT162b2 Vaccine Booster against Covid-19 in Israel. N Engl J Med 2021; 385:1393-1400. DOI: 10.1056/NEJMoa2114255
Baxter R, Lewis N, Bakshi N, Vellozzi C, Klein NP; CISA Network. Recurrent Guillain-Barre syndrome following vaccination. Clin Infect Dis. 2012 Mar;54(6):800-4. doi: 10.1093/cid/cir960.
Bertran M, Amin-Chowdhury Z, Davies HG et al. COVID-19 deaths in children and young people in England, March 2020 to December 2021: An active prospective national surveillance study. PLoS Med 2022 Nov
8;19(11):e1004118. doi: 10.1371/journal.pmed.1004118. eCollection 2022 Nov.
Bielicki JA, Duval X, Gobat N, et al. Monitoring approaches for health-care workers during the COVID-19 pandemic. Lancet Infect Dis. 2020 Oct;20(10):e261-e267. doi: 10.1016/S1473-3099(20)30458-8.
Buchan SA, Seo CY, Johnson C, et al. Epidemiology of Myocarditis and Pericarditis Following mRNA
Vaccination by Vaccine Product, Schedule, and Interdose Interval Among Adolescents and Adults in Ontario, Canada. JAMA Netw Open. 2022 Jun 1;5(6):e2218505. doi: 10.1001/jamanetworkopen.2022.18505. PMID: 35749115; PMCID: PMC9233237.
Chalkias S, Whatley J, Eder F et al, Safety and Immunogenicity of Omicron BA.4/BA.5 Bivalent Vaccine Against Covid-19. https://doi.org/10.1101/2022.12.11.22283166
Choi, A., Koch, M., Wu, K. et al. Safety and immunogenicity of SARS-CoV-2 variant mRNA vaccine boosters in healthy adults: an interim analysis. Nat Med (2021). https://doi.org/10.1038/s41591-021-01527-y
Cohen JM, Carter MJ, Ronny Cheung C, et al. Lower Risk of Multisystem Inflammatory Syndrome in Children (MIS-C) with the Delta and Omicron variants of SARS-CoV-2. Clin Infect Dis. 2022 Jul 5:ciac553. doi:
10.1093/cid/ciac553.
Crook H, Raza S, Nowell J, Young M, Edison P. Long covid—mechanisms, risk factors, and management BMJ 2021; 374 :n1648 doi:10.1136/bmj.n1648
Department of Health, 2013. Health Technical Memorandum 07-01 – Safe management of healthcare waste.
https://www.gov.uk/government/publications/guidance-on-the-safe-management-of-healthcare-waste
Dhama, K, Sharun K, Tiwari R, et al. Coronavirus Disease 2019 – COVID-19. Clinical Microbiology Reviews 2020, 33(4): DOI: 10.1128/CMR.00028-20
Diggle L and Deeks J (2000). Effect of needle length on incidence of local reactions to routine immunisation in infants aged 4 months: randomised controlled trial. BMJ 321(7266): 931-3.
Docherty A B, Harrison EM, Green CA, Hardwick HE, Pius R, Norman L et al. Features of 20 133 UK patients in hospital with covid-19 using the ISARIC WHO Clinical Characterisation Protocol: prospective observational cohort study BMJ 2020; 369 :m1985
Dunkle LM, Kotloff KL, Gay CL et al. Efficacy and Safety of NVX-CoV2373 in Adults in the United States and Mexico. N Engl J Med. 2022 Feb 10;386(6):531-543. doi: 10.1056/NEJMoa2116185. Epub 2021 Dec 15.
PMID: 34910859; PMCID: PMC8693692.
ECDC. Surveillance of COVID-19 at long term care facilities in the EU/EEA. https://www.ecdc.europa.eu/en/ publications-data/surveillance-COVID-19-long-term-care-facilities-EU-EEA
Engjom HM, Ramakrishnan R, Vousden N, et al, Severity of maternal SARS-CoV-2 infection and perinatal outcomes of women admitted to hospital during the omicron variant dominant period using UK Obstetric Surveillance System data: prospective, national cohort study BMJ Medicine 2022;1:e000190. https://
bmjmedicine.bmj.com/content/bmjmed/1/1/e000190.full.pdf
Feldstein LR, Tenforde MW, Friedman KG, et al. Characteristics and Outcomes of US Children and
Adolescents With Multisystem Inflammatory Syndrome in Children (MIS-C) Compared With Severe Acute COVID-19. JAMA. 2021; 325: 1074-1087. doi: 10.1001/jama.2021.2091. PMID: 33625505; PMCID:
PMC7905703.
Flaxman A, Marchevsky NG, Jenkin D et al. Reactogenicity and immunogenicity after a late second dose or a third dose of ChAdOx1 nCoV-19 in the UK: a substudy of two randomised controlled trials (COV001 and
COV002). Lancet 2021;398 :981-990. doi: 10.1016/S0140-6736(21)01699-8.
Folegatti, P. M. et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a
preliminary report of a phase 1/2 single-blind, randomised controlled trial. (2020) Lancet 396:467-8
Garafalo M, Staniszewska M, Salmaso S, et al. Prospects of Replication-Deficient Adenovirus Based Vaccine
Development against SARS- CoV-2. Vaccines (Basel). 2020 Jun 10;8(2):293. doi: 10.3390/vaccines8020293. Golan Y, Prahl M, Cassidy AG, et al. COVID-19 mRNA Vaccination in Lactation: Assessment of Adverse Events and Vaccine Related Antibodies in Mother-Infant Dyads. Front Immunol. 2021 Nov 3;12:777103. doi:
10.3389/fimmu.2021.777103.
Goldberg Y, Mandel M, Bar-On YM et al. Waning immunity of the BNT162b2 vaccine: A nationwide study
from Israel. https://doi.org/10.1101/2021.08.24.21262423
Goldman E. Exaggerated risk of transmission of COVID-19 by fomites. Lancet Infect Dis. 2020; 20 :892-893. doi: 10.1016/S1473-3099(20)30561-2.
Graham NSN, Junghans C, Downes R, et al. SARS-CoV-2 infection, clinical features and outcome of COVID- 19 in United Kingdom nursing homes. J Infect. 2020 Sep;81(3):411-419. doi: 10.1016/j.jinf.2020.05.073.
Grant MC, Geoghegan L, Arbyn M, et al. The prevalence of symptoms in 24,410 adults infected by the novel coronavirus (SARS- CoV-2; COVID-19): A systematic review and meta-analysis of 148 studies from 9
countries. PLos One 2020 Jun 23;15(6): e0234765. doi: 10.1371/journal.pone.0234765.
Gray KJ, Bordt EA, Atyeo C et al. Coronavirus disease 2019 vaccine response in pregnant and lactating women: a cohort study. American Journal of Obstetrics and Gynecology Volume 225, 303.e1-303.e17.
https://doi.org/10.1016/j.ajog.2021.03.023
Greinacher A, Thiele T, Warkentin TE et al. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19
Vaccination. NEJM, 2021. DOI: 10.1056/NEJMoa2104840
Gurol-Urganci I, Jardine Je, Carroll F, Draycott T, Dunn G, Fremeaux A, et al. Maternal and perinatal outcomes of pregnant women with SARS-CoV-2 infection at the time of birth in England: national cohort study. Am J Obstet Gynecol 2021;S0002-9378(21)00565)
Hall V, Foulkes S, Insalata F et al. The SIREN Study Group. Protection against SARS-CoV-2 after Covid-19
vaccination and previous infection. New England Journal of Medicine 2022; 386:1207-1220. DOI: 10.1056/ NEJMoa2118691.
Hall VJ, Foulkes S, Saei A, Andrews N, Oguti B et al. COVID-19 vaccine coverage in health-care workers in England and effectiveness of BNT162b2 mRNA vaccine against infection (SIREN): a prospective, multicentre, cohort study. Lancet 2021; 397, 1725-1735. https://doi.org/10.1016/S0140-6736(21)00790-X
Hall VG, Ferreira VH, Ku T et al. Randomized Trial of a Third Dose of mRNA-1273 Vaccine in Transplant Recipients. N Engl J Med. 2021 Aug 11. doi: 10.1056/NEJMc2111462. https://www.nejm.org/doi/
Harwood R, Yan H, Talawila Da Camara N. Which children and young people are at higher risk of severe disease and death after SARS-CoV-2 infection: a systematic review and individual patient meta-analysis.
https://doi.org/10.1101/2021.06.30.21259763
Heath PT, Galiza EP, Baxter DN et al. Safety and Efficacy of NVX-CoV2373 Covid-19 Vaccine. New England journal of medicine 2021; 385: 1172-1183. doi:10.1056/NEJMoa2107659.
Heath PT, Galiza EP, Baxter DN, et al. Safety and Efficacy of the NVX-CoV2373 COVID-19 Vaccine at
Completion of the Placebo-Controlled Phase of a Randomized Controlled Trial. Clin Infect Dis. 2022 Oct 10:ciac803. doi: 10.1093/cid/ciac803.
Huang C, Wang Y, Li X, Ren L, Zhao et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020 Feb 15;395 (10223):497-506. doi: 10.10.16/S0140-6736(20) 30183-5.
Hyams C, Marlow R, Maseko Z, King J and Ward, L. Assessing the Effectiveness of BNT162b2 and
ChAdOx1nCoV-19 COVID-19 Vaccination in Prevention of Hospitalisations in Elderly and Frail Adults: A Single Centre Test Negative Case-Control Study. Available at SSRN: https://ssrn.com/abstract=3796835 or http://
dx.doi.org/10.2139/ssrn.3796835
Jackson LA, Anderson EJ, Rouphael NG et al. An mRNA vaccine against SARS-CoV-2 – preliminary report. NEJM 2020; 383: 1920-31.
Kamar, N et al. Three Doses of an mRNA Covid-19 Vaccine in Solid-Organ Transplant Recipients. N Engl J Med 2021 Aug 12;385(7):661-662. doi: 10.1056/NEJMc2108861.
Karimi-Zarchi M, Neamatzadeh H, Dastgheib SA, et al. Vertical Transmission of Coronavirus Disease 19 (COVID-19) from Infected Pregnant Mothers to Neonates: A review. Fetal Pediatr Pathol. 2020 Jun;39(3):
246-250. doi: 10.1080/15513815.2020.
Kaur SP, Gupta V. COVID-19 Vaccine: A comprehensive status report. Virus Res. 2020 Oct 15; 288:198114.
Doi: 10.1016/j.viruses.2020.198114.
Kennedy s, Bolay F, Keih M, et al (2017) Phase 2 Placebo-Controlled Trial of Two Vaccines to Prevent Ebola in Liberia. N Eng J Med 377: 1438-1447.
Kroger AT, Atkinson WL, Pickering LA. General immunization Practices. in Plotkin SA, Orenstein WA, Offit PA. Vaccines (6th Edition). Elsevier Saunders 2013.
Lacy J, Pavord S, Brown K. VITT and second doses of COVID-19 vaccine. NEJM 2021 in press.
Lazarus R, Baos S, Cappel-Porter H et al. The safety and immunogenicity of concomitant administration of COVID-19 vaccines (ChAdOx1 or BNT161b2) with seasonal influenza vaccines in adults: a phase IV,
multicentre randomised controlled trial with blinding (ComFluCOV). https://papers.ssrn.com/sol3/papers. cfm?abstract_id=3931758
Lee E-J, Cines DB, Gernsheimer T et al. Thrombocytopenia following Pfizer and Moderna SARS-CoV-2 vaccination. Am J Hematol. 2021 Mar 9 : https://doi.org/10.1002/ajh.26132.
Lim SH, Campbell N, Johnson M, et al. Antibody responses after SARS-CoV-2 vaccination in patients with
lymphoma. Lancet Haematol. 2021 Aug;8(8):e542-e544. doi: 10.1016/S2352-3026(21)00199-X. Epub 2021 Jul 2.
Liu Y, Rocklöv J. The effective reproductive number of the Omicron variant of SARS-CoV-2 is several times relative to Delta. J Travel Med 2022; 29 :taac037. doi: 10.1093/jtm/taac037.
Lopez Bernal J, Panagiotopoulos N, Byers C et al. Transmission dynamics of COVID-19 in household and community settings in the United Kingdom. (2020) https://doi.org/10.1101/2020.08.19.20177188.
Lopez Bernal J, Andrews N, Gower C et al. Effectiveness of the Pfizer-BioNTech and Oxford-AstraZeneca vaccines on covid-19 related symptoms, hospital admissions, and mortality in older adults in England: test negative case-control study BMJ 2021; 373 :n1088 doi:10.1136/bmj.n1088
Lopez Bernal J, Andrews N, Gower C et al. Effectiveness of Covid-19 Vaccines against the B.1.617.2 (Delta) Variant. N Engl J Med. 2021 Aug 12;385(7):585-594. doi: 10.1056/NEJMoa2108891. Epub 2021 Jul 21.
PMID: 34289274; PMCID: PMC8314739.
Lui X, Shaw RS, Stuart ASV et al. Safety and immunogenicity report from the Com-COV study – A single- blind randomised non-inferiority trial comparing heterologous and homologous prime-boost schedules with an adenoviral vectored and mRNA COVID-19 vaccine. https://papers.ssrn.com/sol3/papers.cfm?abstract_
Mahil SK, Bechman K, Raharja A et al. The effect of methotrexate and targeted immunosuppression on humoral and cellular immune response to the COVID-19 vaccine BNT1462b: a cohort study. Lancet
Rheumatol 2021. https://doi.org.10.1016/S2665-9913(21)00212-5
Mallory R, Formica N, Pfeiffer S et al. Immunogenicity and Safety Following a Homologous Booster Dose of a SARS-CoV-2 recombinant spike protein vaccine (NVX-CoV2373): A Phase 2 Randomized Placebo-Controlled
Trial doi: https://doi.org/10.1101/2021.12.23.21267374.
Mark A, Carlsson RM and Granstrom M (1999) Subcutaneous versus intramuscular injection for booster DT vaccination of adolescents. Vaccine 17(15-16): 2067-72.
Mark C, Gupta S, Punnett A, et al. Safety of administration of BNT162b2 mRNA (Pfizer-BioNTech) COVID-19 vaccine in youths and young adults with a history of acute lymphoblastic leukemia and allergy to PEG-
asparaginase. Pediatric Blood and Cancer, 2021. https://doi.org/10.1002/pbc.29295
Menni C, Valdes AM, Polidori L et al. Symptom prevalence, duration, and risk of hospital admission in
individuals infected with SARS-CoV-2 during periods of omicron and delta variant dominance: a prospective observational study from the ZOE COVID Study. Lancet 399 (2022): 1618-1624. https://doi.org/10.1016/
Munro APS, Jalani L, Cornelius V et al. Safety and immunogenicity of seven COVID-19 vaccines as a third dose (booster) following two doses of ChAdOx1-nCov19 (AZD1222) or BNT162b2: A blinded, randomised controlled trial (COV-BOOST). Lancet 2021 (in press).
Monin-Aldama L, Laing AG, Muñoz-Ruiz M. Interim results of the safety and immune-efficacy of 1 versus 2
doses of COVID-19 vaccine BNT162b2 for cancer patients in the context of the UK vaccine priority guidelines.
https://doi.org/10.1101/2021.03.17.21253131
Naficy, Abdi, et al. “No Immunological Interference or Safety Concerns When Adjuvanted Recombinant
Zoster Vaccine Is Coadministered With a Coronavirus Disease 2019 mRNA-1273 Booster Vaccine in Adults Aged 50 Years and Older: A Randomized Trial.” Clinical Infectious Diseases 77.9 (2023): 1238-1246. https:// doi.org/10.1093/cid/ciad361
Neutel, Joel M., et al. “Safety and Immunogenicity of Concomitant Administration and Combined
Administration of Bivalent BNT162b2 COVID-19 Vaccine and Bivalent RSVpreF Respiratory Syncytial Virus
Vaccine with or Without Quadrivalent Influenza Vaccine in Adults≥ 65 Years of Age.” Vaccines 13.2 (2025):
Nguyen LH, Drew DA, Graham MS et al. Risk of COVID-19 among front-line health-care workers and the general community: a prospective cohort study. Lancet Public Health. 2020 Sep:5(9): e475-e483. doi:
10.1016/S2468-2667(20) 30164-X. Epub 2020 Jul 31.
Nyberg T, Ferguson NM, Nash SG, et al. Comparative analysis of the risks of hospitalisation and death
associated with SARS-CoV-2 omicron (B.1.1.529) and delta (B.1.617.2) variants in England: a cohort study.
Lancet 2022; 399: 1303-1312. doi: 10.1016/S0140-6736(22)00462-7. Epub 2022 Mar 16. PMID: 35305296; PMCID: PMC8926413.
Pachetti M, Marini B, Giudici F, et al. Impact of lockdown on COVID-19 case fatality rate and viral mutations spread in 7 countries in Europe and North America. J Transl Med. 2020 Sep 2;18(1):338. doi: 10.1186/
s12967-020-02501-x.
Payne RP, Longet S, Austin JA et al. Sustained T cell immunity, protection and boosting using extended dosing intervals of BNT162b2 mRNA vaccine. https://www.pitch-study.org/PITCH_Dosing_Interval_23072021.pdf
Polack, FP, Thomas SJ, Kitchin N et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. NEJM
- DOI:10.1056/NEJMoa2034577
Powell AA, Power L, Westrop S et al. Real world data demonstrating increased reactogenicity in adults receiving heterologous compared to homologous prime-boost COVID-19 vaccination: March-May 2021,
England. https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3880967
Prendecki M, Thomson T, Clarke CL, et al. Comparison of humoral and cellular responses in kidney transplant recipients receiving BNT162b2 and ChAdOx1 SARS-CoV-2 vaccines medRxiv 2021.07.09.21260192; doi:
https://doi.org/10.1101/2021.07.09.21260192
Rytter MJH. Difficult questions about long COVID in children. Lancet Child Adolesc Health. 2022
Sep;6(9):595-597. doi: 10.1016/S2352-4642(22)00167-5. Epub 2022 Jun 23.PMID: 35752193
Ramasamy MN, Minassian AM, Ewer KJ, et al. Safety and immunogenicity of ChAdOx1 nCoV-19 vaccine administered in a prime-boost regimen in young and old adults (COV002): a single-blind, randomised,
controlled, phase 2/3 trial. Lancet 2020 Nov 18: S0140-6736(20)32466-1. doi: 10.1016/S0140- 6736(20)32466-1.
Schönborn L, Thiele T, Kaderali L, Greinacher A. Decline in Pathogenic Antibodies over Time in VITT. https:// www.nejm.org/doi/pdf/10.1056/NEJMc2112760?articleTools=true
Shah A, Gribben C, Bishop J et al. Effect of vaccination on transmission of COVID-19: an observational
study in healthcare workers and their households View ORCID Profile doi: https://doi.org/10.1101/2021.03.
Shapiro Ben David S, Potasman I, Rahamim-Cohen D. Rate of Recurrent Guillain-Barré Syndrome After mRNA COVID-19 Vaccine BNT162b2. JAMA Neurol. 2021;78(11):1409–1411. doi:10.1001/jamaneurol.2021.3287
Shaw RH, Stuart A, Greenland M, et al. Heterologous prime-boost COVID-19 vaccination: initial
reactogenicity data. Lancet 2021; published online May 12. http://dx.doi.org/10.1016/S0140-6736(21)01115-6. Shinde V, Bhikha S, Hoosain Z et al. Efficacy of NVX-CoV2373 Covid-19 Vaccine against the B.1.351 Variant. N Engl J Med 2021; 384:1899-1909. DOI: 10.1056/NEJMoa2103055
Shingleton J, Williams H, Oligbu G, et al. The changing epidemiology of PIMS-TS across COVID-19 waves:
prospective national surveillance, January 2021 to July 2022, England. J Infect. 2022 Oct 20:S0163-
4453(22)00617-X. doi: 10.1016/j.jinf.2022.10.017.
Shrotri M, Krutikov M, Palmer T et al. Vaccine effectiveness of the first dose of ChAdOx1 nCoV-19 and
BNT162b2 against SARS-CoV-2 infection in residents of Long-Term Care Facilities (VIVALDI study). medRxiv [preprint], doi: 10.1101/2021.03.26.21254391
Simpson CR, Shi T, Vasileiou E et al. First-dose ChAdOx1 and BNT162b2 COVID-19 vaccines and
thrombocytopenic, thromboembolic and hemorrhagic events in Scotland. Nature Medicine 2021: 27; 1290–
Smith C, Odd D, Harwood R et al. Deaths in Children and Young People in England following SARS-CoV-2 infection during the first pandemic year: a national study using linked mandatory child death reporting data. 10.21203/rs.3.rs-689684/v1
Stock SJ, Moore E, Calvert C et al. Pregnancy outcomes following Delta and Omicron SARS-CoV-2 infection in Scotland: a population-based cohort study. https://papers.ssrn.com/sol3/papers.cfm?abstract_id=4144534 Stowe J, Andrews N, Gower C et al. Effectiveness of COVID-19 vaccines against hospital admission with the Delta (B.1.617.2) variant https://khub.net/web/phe-national/public-library/-/document_library/v2WsRK3ZlEig/ view/479607266
Tenforde MW Self WH, Naioti EA, et al. Sustained Effectiveness of Pfizer-BioNTech and Moderna Vaccines
Against COVID-19 Associated Hospitalizations Among Adults — United States, March–July 2021. MMWR
70(34);1156-1162. https://www.cdc.gov/mmwr/volumes/70/wr/mm7034e2.htm?s_cid=mm7034e2_w
Thompson CP, Grayson NE, Paton RS, et al. Detection of neutralising antibodies to SARS-CoV-2 to determine population exposure in Scottish blood donors between March and May 2020. Euro Surveill. 2020
Oct;25(42):2000685. doi: 10.2807/1560-7917.ES.2020.25.42.2000685
Toback S, Galiza E, Cosgrove C. Safety, immunogenicity, and efficacy of a COVID-19 vaccine (NVX-CoV2373) co-administered with seasonal influenza vaccines: an exploratory substudy of a randomised, observer-blinded, placebo-controlled, phase 3 trial. Lancet 2022; 10: P167-179. DOI: https://doi.org/10.1016/S2213-
van Doremalen N, Lambe T, Spencer A, et al. ChAdOx1 nCoV-19 vaccination prevents SARS-CoV-2
pneumonia in rhesus macaques. 2020 Oct;586 (7830):578. doi: 10.1038/s41586-020-2608-y.
van Gils MJ, van Willigen HDG, Wynberg E, et al; RECoVERED Study Group. A single mRNA vaccine dose in COVID-19 patients boosts neutralizing antibodies against SARS-CoV-2 and variants of concern. Cell Rep Med. 2021 Dec 14;3(1):100486. doi: 10.1016/j.xcrm.2021.100486. PMID: 35103254; PMCID: PMC8668345.
Vasileiou E, Simpson CR, Robertson C, et al. Effectiveness of First Dose of COVID-19 Vaccines against hospital admissions in Scotland: National prospective cohort study of 5.4 million people. Available at: https://papers. ssrn.com/sol3/papers.cfm?abstract_id=3789264 (pre-print)
Vogel, A. et al. A prefusion SARS-CoV-2 spike RNA vaccine is highly immunogenic and prevents lung
infection in non-human primates. (2020) https://www.biorxiv.org/content/10.1101/2020.09.08.280818v1
Vousden N, Bunch K, Morris E, et al. The incidence, characteristics and outcomes of pregnant women
hospitalized with symptomatic and asymptomatic SARS-CoV-2 infection in the UK from March to September
2020: A national cohort study using the UK Obstetric Surveillance System (UKOSS). PLoS One. 2021 May 5;16(5):e0251123. doi: 10.1371/journal.pone.0251123.
Vousden N, Ramakrishnan R, Bunch K, et al. Severity of maternal infection and perinatal outcomes during
periods of SARS-CoV-2 wildtype, alpha, and delta variant dominance in the UK: prospective cohort studyBMJ Medicine 2022;1:e000053. doi: 10.1136/bmjmed-2021-000053.
Voysey M, Clemens S, Shabir AM et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222)
against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the
- Lancet2020. https://doi.org/10.1016/ S0140-6736(20)32661-1
Voysey M, Costa Clemens SA, Madhi SA, et al. Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled
analysis of four randomised trials. Lancet. 2021 Mar 6;397(10277):881-891. doi: 10.1016/S0140- 6736(21)00432-3. Epub 2021 Feb 19.
Walsh EE, Frenck RW Jr, Falsey AR, et al. Safety and Immunogenicity of Two RNA-Based COVID-19 Vaccine Candidates. N Engl J Med 2020 Oct 14:NEJMoa2027906. doi: 10.1056/NEJMoa2027906
Ward H, Atchison C, Whitaker M, et al. SARS-CoV-2 antibody prevalence in England following the first peak of the pandemic. Nat Commun. 2021 Feb 10;12(1):905. doi: 10.1038/s41467-021-21237-w.
Ward JL, Harwood R, Smith C et al. Risk factors for intensive care admission and death amongst children and young people admitted to hospital with COVID-19 and PIMS-TS in England during the first pandemic year.
https://doi.org/10.1101/2021.07.01.2125978
Werbel, WA et al. Safety and Immunogenicity of a Third Dose of SARS-CoV-2 Vaccine in Solid Organ
Transplant Recipients: A Case Series. Ann Intern Med 2021 Jun 15;L21-0282. doi: 10.7326/L21-0282.
Whitaker HJ, Tsang RSM, Byford R, et al. Pfizer-BioNTech and Oxford AstraZeneca COVID-19 vaccine
effectiveness and immune response amongst individuals in clinical risk groups. J Infect. 2022 May;84(5):675- 683. doi: 10.1016/j.jinf.2021.12.044. Epub 2022 Jan 3.
WHO Director-General’s opening remarks at the media briefing on COVID-19-11 March 2020. Available at:
https://www.who.int/director-general/speeches/detail/who-director-general-s-opening-remarks-at-the-media- briefing-on-covid-19—11-march-2020. (Accessed: 1st October 2020)
WHO I Novel Coronavirus – China. Available at: https://www.who.int/csr/don/12-january-2020-novel- coronavirus-china/en/. (Accessed 1 October 2020)
Williamson EJ, Walker AJ, Bhaskaran K, et al. Factors associated with COVID-19-related death using OpenSAFELY. Nature. 2020 Aug;584(7821):430-436. doi: 10.1038/s41586-020-2521-4.
Williamson EJ, McDonald H I, Bhaskaran K, Walker A J, Bacon S, Davy S et al. Risks of covid-19 hospital admission and death for people with learning disability: population based cohort study using the
OpenSAFELY platform BMJ 2021; 374 :n1592 doi:10.1136/bmj.n1592
Zhu N, Zhang D, Wang W, et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med. 2020 Feb 20;382(8):727-733. doi: 10.1056/NEJMoa2001017.
Zou J, Kurhade C, Patel S et al. Improved Neutralization of Omicron BA.4/5, BA.4.6, BA.2.75.2, BQ.1.1, and XBB.1 with Bivalent BA.4/5 Vaccine doi: https://doi.org/10.1101/2022.11.17.516898
Zuckerman JN (2000) The importance of injecting vaccines into muscle. Different patients need different needle sizes. BMJ 321(7271): 1237-8.
Hits: 22
