Contents
- 1 更新历史记录
- 2 摘要
- 3 摘要和背景
- 4 方法和搜索结果
- 5 建议1:对有症状个体进行核酸扩增检测
- 6 建议2:标本采集的解剖部位
- 7 建议3:自行采集拭子样本
- 8 建议 4:有症状个体中快速核酸扩增检测与标准实验室核酸扩增检测的比较
- 9 建议5:单次核酸扩增检测与重复核酸扩增检测
- 10 建议 6:对接触过 SARS-CoV-2 的无症状个体进行核酸扩增检测
- 11 建议7:无症状个体中快速核酸扩增检测与实验室核酸扩增检测的比较
- 12 建议8:入院前对无症状个体进行核酸扩增检测
- 13 建议9:对接受手术的无症状个体进行核酸扩增检测
- 14 建议 10:对需要进行手术的 COVID-19 患者进行重复检测
- 15 建议 11:使用核酸扩增检测(NAAT)解除 SARS-CoV-2 感染患者的隔离
- 16 建议12:居家分子检测
- 17 讨论
- 18 结论
- 19 笔记
- 20 参考
COVID-19 Guideline, Part 3: Molecular Diagnostic Testing 2023
美国传染病学会 (IDSA) 关于 COVID-19 诊断的指南:分子诊断检测
尼马替韦/利托那韦(Paxlovid®)药物相互作用的管理:临床医生资源
Mary K. Hayden、* Kimberly E. Hanson、Janet A. Englund、Mark J. Lee、Mark Loeb、Francesca Lee、Daniel J Morgan、Robin Patel、Ibrahim K El Mikati、Shahad Iqneibi、** Farouk Alabed、** Justin Z. Amarin、** Razan Mansour、** Payal Patel、** Yngve Falck-**M。哈桑·穆拉德、** 沙纳兹·苏丹、** 阿达尔什 Bhimraj、雷姆·穆斯塔法**
* 通讯作者 ** 方法学家
2023年9月5日
3.0 版本已经发布,其中包含基于对诊断文献的最新系统评价而提出的 SARS-CoV-2 核酸检测建议。
本次更新已获得美国医疗保健流行病学会、儿科传染病学会和美国微生物学会的认可。
更新历史记录
2020年12月23日
该指南的 2.0.0 版本已发布。
2020年5月6日
该指南 1.0.1 版已发布。
摘要
背景: 准确的分子诊断检测对于确诊 2019 冠状病毒病(COVID-19)至关重要。直接检测呼吸道标本中的严重急性呼吸综合征冠状病毒 2(SARS-CoV-2)核酸,可为患者、医疗机构和公共卫生部门的决策提供依据。目前,SARS-CoV-2 核酸检测方法的数量以及 COVID-19 诊断相关文献均在快速增长。因此,美国传染病学会(IDSA)认识到需要定期更新文献系统评价,以指导循证最佳实践指南的制定。
目标: IDSA 的目标是制定循证诊断指南,以帮助临床医生、临床实验室人员、患者和政策制定者就 SARS-CoV-2 核酸扩增检测的最佳使用做出决策。此外,我们还提供了一个理解分子诊断检测性能的概念框架,讨论了在各种实践环境中解读检测结果的细微差别,并强调了与 COVID-19 诊断检测相关的重要未满足的研究需求。
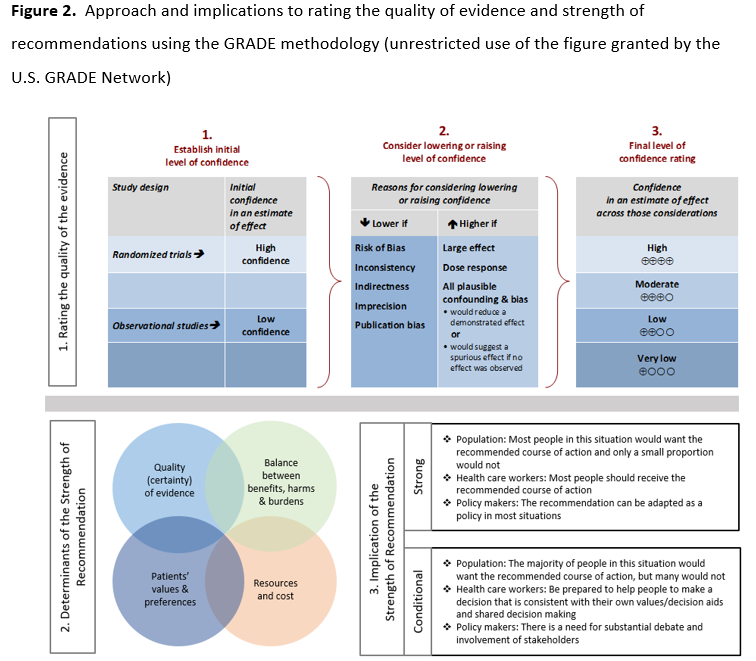
方法: 美国传染病学会(IDSA)召集了一个由传染病临床医生、临床微生物学家和系统文献综述专家组成的多学科小组,以确定并优先考虑与 SARS-CoV-2 分子诊断应用相关的临床问题和结果。采用推荐意见分级评估、制定和评价(GRADE)方法评估证据的确定性并提出检测建议。
结果: 专家组就 12 项诊断建议达成一致。
结论: 获得准确的 SARS-CoV-2 核酸检测对于患者护理、医院感染预防以及公众应对 COVID-19 疫情至关重要。现有检测方法的临床性能信息不断增加,但支持本次更新分子诊断指南的证据质量仍然处于中等至极低水平。鉴于这些局限性,IDSA 专家组权衡了现有的诊断证据,建议对所有疑似 COVID-19 的症状患者进行核酸检测。此外,对于已知或疑似接触过 COVID-19 病例的无症状患者,如果检测结果会影响隔离/检疫/个人防护装备(PPE)的使用决策,也建议进行检测。现有证据支持快速检测以及对除鼻咽拭子以外的其他上呼吸道标本进行检测,这些方法具有后勤优势,因此有条件地推荐采用这些方法。
关键词: 冠状病毒、SARS-CoV-2、COVID、COVID-19、肺炎、诊断、RNA 检测、样本
摘要和背景
执行摘要
分子诊断检测,即核酸扩增检测(NAAT),在全球应对 COVID-19 疫情中发挥了至关重要的作用。准确的 SARS-CoV-2 NAAT 检测对于指导患者管理决策、医院感染防控措施和公共卫生应对至关重要。在感染过程中检测和定量 SARS-CoV-2 RNA 对于理解疾病生物学也至关重要。鉴于 COVID-19 分子诊断文献的迅速增长以及检测手段的日益普及,美国传染病学会(IDSA)认识到需要制定经常更新的、基于循证医学的指南,以支持临床医生、临床微生物学家、患者和政策制定者在 SARS-CoV-2 诊断相关决策中做出正确的选择。
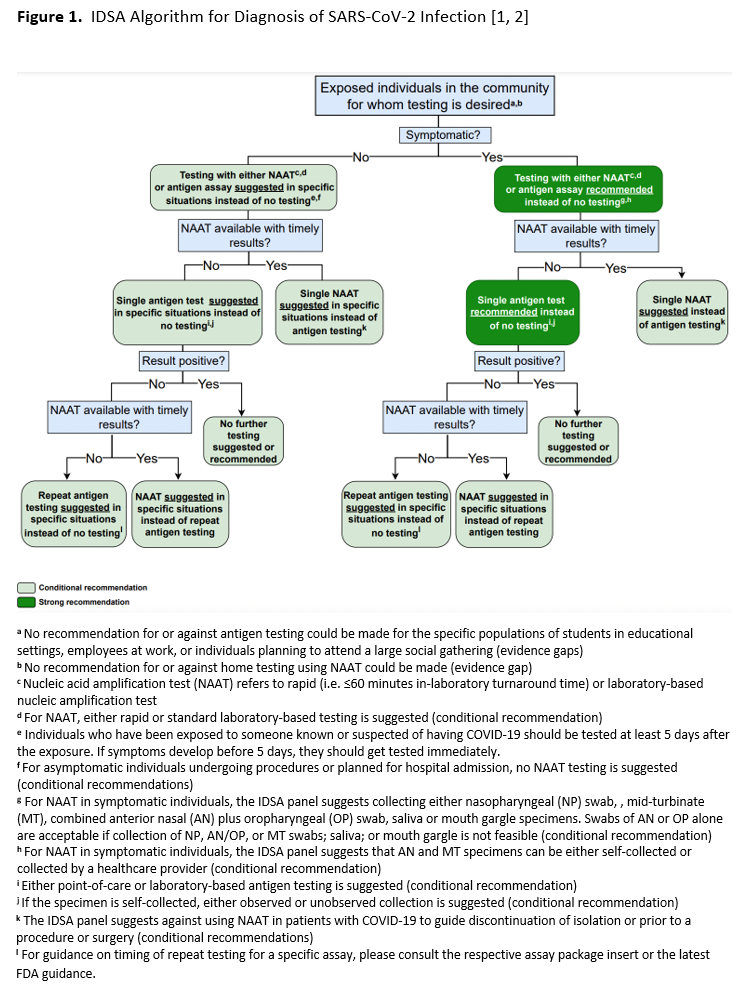
在本次更新中,IDSA 专家组重点关注了具有临床意义的问题,这些问题可能因新数据的出现而产生新的建议,或需要调整先前建议的方向或强度。专家组撤销了关于下呼吸道疾病患者上呼吸道标本与下呼吸道标本检测的建议,以及关于免疫功能低下者检测或免疫抑制治疗前检测的建议。新增的问题包括:分子检测是否有助于指导近期有 SARS-CoV-2 感染史的人员何时解除隔离,或是否符合手术或医疗程序的条件( 建议 10 和 11 )。IDSA 专家组还新增了一个关于无症状感染者重复检测准确性的问题,以及一个关于居家检测的问题。关于对先前建议的重新评估,尽管大多数建议的证据确定性有所提高,但只有一项建议的方向发生了改变。在之前的更新中,建议对计划接受手术的无症状个体进行 RNA 检测,而本次更新则不建议对这些个体进行常规检测(见下文建议 9)。对于大多数建议,缺乏或缺乏关于 SARS-CoV-2 核酸扩增检测(NAAT)在免疫功能低下或已接种疫苗者、既往感染过 SARS-CoV-2 者、儿童以及感染新型 SARS-CoV-2 变种(例如 Omicron)的患者中的临床或分析性能的数据。IDSA 专家组基于对诊断文献的最新系统评价,共提出了 12 项关于 SARS-CoV-2 核酸检测的建议。 根据这些建议,我们提供了一个更新的算法来辅助决策( 见图 1 )。这些建议的前提是诊断测试和样本采集设备均可用。基于对基线风险的评估,我们对社区中 COVID-19 的患病率和/或个体患者的检测前概率做出了假设,这两项假设均影响了检测建议。
全文中提供了关于背景、方法、证据总结、每项建议的依据以及研究需求的详细描述。简而言之,由临床医生、医学微生物学家和方法学家组成的专家组采用推荐意见分级评估、制定与评价(GRADE)方法,对 COVID-19 诊断文献进行了严格评估,以评估证据的确定性。根据 GRADE 方法,建议分为“强推荐”和“有条件推荐”。“推荐”表示强推荐,“建议”表示有条件推荐。
建议
建议 1 :IDSA 专家组建议对疑似患有 COVID-19 的有症状个体进行 SARS-CoV-2 NAAT 检测 (强烈推荐,证据确定性中等) 。
- 评论 :
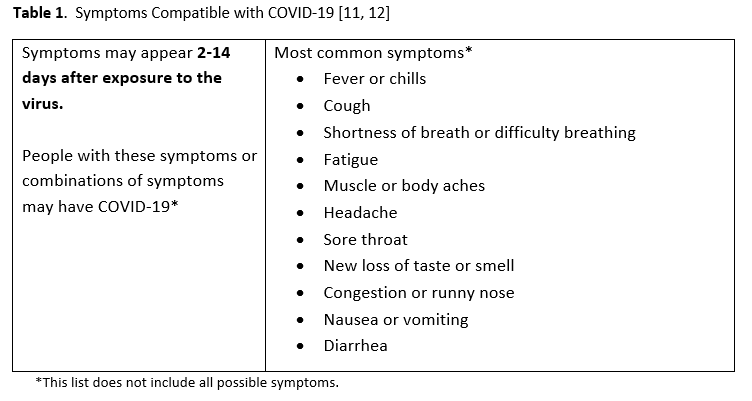
- 专家组认为有症状的患者至少具有一种与 COVID-19 相符的最常见症状( 表 1 )。
- 由于仅凭临床评估无法准确预测 COVID-19 的诊断,因此建议进行检测。阳性检测结果可为治疗、隔离以及可能的密切接触者追踪等决策提供依据。
- 关于 SARS-CoV-2 NAAT 在免疫功能低下或接种过疫苗的个体、曾经感染过 SARS-CoV-2 的个体、儿童或感染 SARS-CoV-2 变种(例如 Omicron)的患者中的分析性能,目前可用的数据有限。
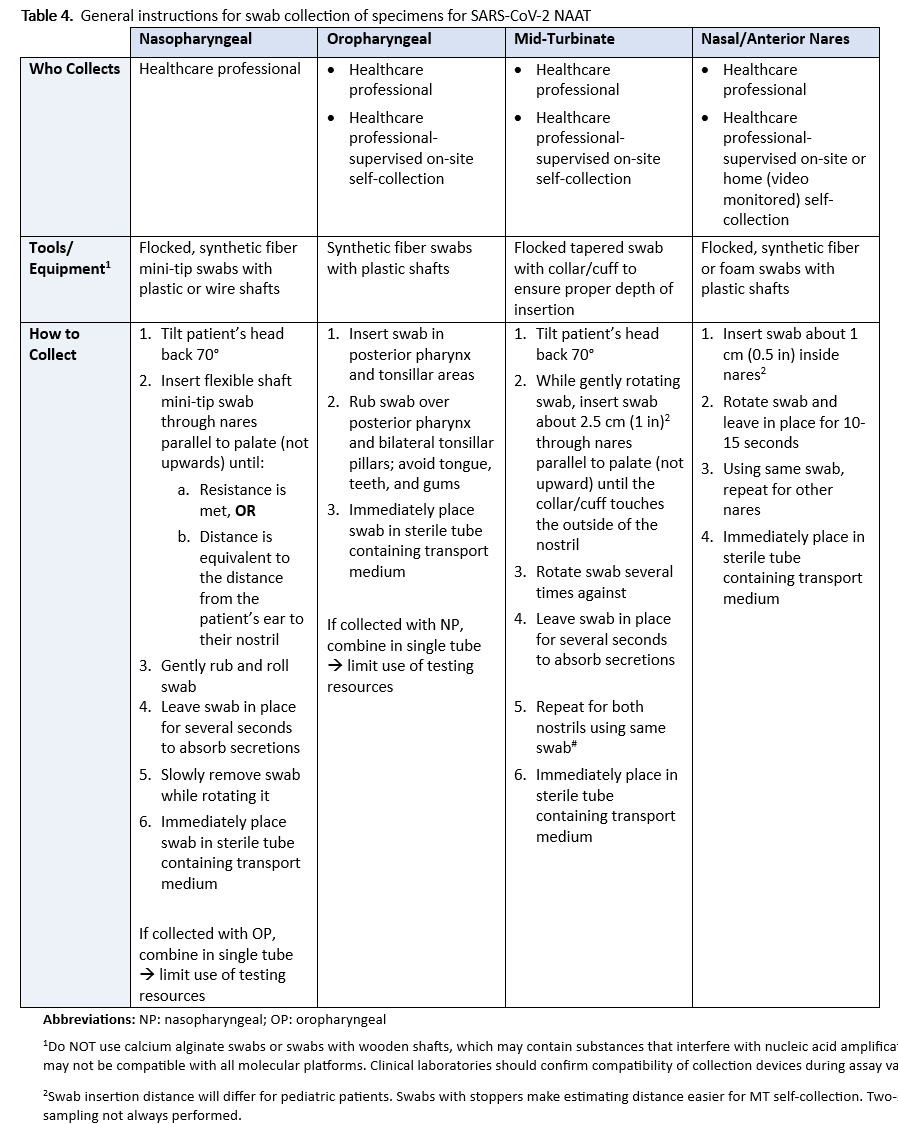
建议 2 :对于疑似患有 COVID-19 的有症状个体,IDSA 专家组建议采集并检测来自鼻咽、前鼻孔、口咽或中鼻甲 (MT) 区域的拭子样本;唾液或漱口液 (有条件建议,证据确定性低) 。
- 评论 :
- 与鼻咽拭子相比,鼻咽拭子或口咽拭子比鼻咽/口咽联合拭子、咽拭子、唾液或漱口液更容易出现假阴性结果( 表 2 )。如果无法采集鼻咽拭子、鼻咽/口咽联合拭子或咽拭子、唾液或漱口液,则单独采集鼻咽拭子或口咽拭子是可以接受的。
- 样本采集方法没有标准化(例如,流出的口水或唾液,无论是否伴有咳嗽,都被报告为唾液)。
- 应考虑患者能否遵照指示并配合标本采集的要求(例如,将唾液吐入容器中,在采集唾液前一段时间内禁食)。
- FDA 对特定核酸扩增检测(NAAT)的批准会明确指出采集方法和样本类型。除非通过实验室自建检测(LDT)验证获得批准,或经 FDA 后续紧急使用授权(EUA)批准用于不同的采集方法或样本类型,否则不遵守标签要求可能导致结果不准确,并被拒付。
建议 3 :IDSA 专家组建议,对于疑似患有 COVID-19 的有症状个体,可由患者或医疗保健提供者采集前鼻拭子 (AN) 和 MT 拭子样本进行 SARS-CoV-2 RNA 检测 (有条件建议,中等确定性证据) 。
- 评论:
- 现有数据的一个重要局限性在于,不同比较组的样本类型存在差异。也就是说,虽然自取样本均为 AN 和 MT 样本,但医护人员采集的样本均为 NP 样本。这或许可以解释医护人员采集的样本灵敏度更高的原因。
建议 4 :IDSA 专家组建议对疑似患有 COVID-19 的有症状个体使用快速或标准实验室 NAAT 检测 (有条件建议,证据确定性中等) 。
- 评论 :
- 正确的样本采集和运输至实验室或检测点对于确保高质量的检测结果至关重要; IDSA 网站提供相关资源。快速核酸扩增检测 (NAAT) 的定义各不相同;一些机构,包括美国 FDA,将周转时间≤30 分钟定义为快速 NAAT,而其他机构则使用≤60 分钟甚至更长的周转时间。本指南将快速检测定义为周转时间≤60 分钟。此时间仅指检测时间(包括核酸提取),不包括样本采集到检测的时间或检测到报告的时间。快速检测通常操作步骤少,可进行在患者附近甚至床旁进行的检测,且无需实验室人员操作。快速检测方法包括快速逆转录聚合酶链式反应 (RT-PCR) 和快速等温核酸扩增检测 (NAAT)。标准检测需要仪器和/或处理,通常必须由训练有素的实验室人员在临床实验室进行。
- 本建议仅适用于纳入研究中评估的检测方法。其中一项检测方法,即雅培 IDNow 检测,被纳入本建议评估的大多数研究,这可能导致结果偏向较低的灵敏度。不同样本类型下检测性能的差异可能很重要。所评估的检测方法采用了不同的技术(例如,等温和非等温扩增),这些技术理论上可能会影响结果。关于核酸扩增检测(NAAT)在免疫功能低下或已接种疫苗的个体、既往感染过 SARS-CoV-2 的个体或感染了当前 SARS-CoV-2 变异株的个体中的分析性能,目前数据有限。
建议 5 :IDSA 专家组建议对疑似感染 COVID-19 的有症状或无症状个体进行一次 NAAT 检测,如果其首次 NAAT 检测结果为阴性,则不应常规重复检测 (有条件建议,证据确定性非常低) 。
- 评论 :
- 专家组认为有症状的患者至少具有一种与 COVID-19 相符的最常见症状( 表 1 )。
- 虽然重复检测的阳性率较低,因此通常不建议进行重复检测,但在某些情况下,可以考虑进行重复检测。例如,如果出现新的症状或症状加重,且没有其他解释,则应考虑重复检测。此外,症状出现的时间也可能是需要重复检测的原因之一。样本采集不当可能导致假阴性结果,这也是需要进行重复检测的另一个原因。
- 如果需要进行复检,通常应在初次核酸扩增检测(NAAT)结果为阴性后 24-48 小时进行。如果患者出现下呼吸道感染的体征/症状,则应考虑使用另一种标本类型进行复检,最好是下呼吸道标本。
建议 6 :对于有临床或流行病学原因可能需要进行检测的个人,IDSA 专家组建议对已知或疑似接触过 COVID-19 的无症状个体进行 SARS-CoV-2 RNA 检测 (有条件建议,中等确定性证据) 。
- 评论 :
- 专家组承认目前缺乏证据支持对无症状感染者进行治疗,也未见获得紧急使用授权(EUA)批准的用于治疗无症状 COVID-19 的药物,但同时也承认,个别临床情况可能促使临床医生进行检测并考虑治疗。对于存在临床或流行病学原因可能需要进行检测的人员(例如,高危人群,如患有肺部疾病或免疫功能低下者,或与免疫功能低下者密切接触者),可考虑进行检测。检测应在暴露后至少 5 天进行。如果症状在 5 天内出现,暴露者应立即接受检测。了解某人是否感染 SARS-CoV-2 有助于指导适当的隔离措施[3]。是否对无症状感染者进行检测应取决于检测资源的可用性。本文中,已知暴露定义为在 24 小时内与实验室确诊 COVID-19 患者密切接触至少 15 分钟。疑似暴露可能定义为在发生 COVID-19 疫情的集体场所(例如,长期护理机构或惩教机构、游轮、工厂)工作或居住。感染 SARS-CoV-2 的风险可能因暴露条件而异,例如暴露时间长短、室内或室外环境、是否经常佩戴口罩等。家庭成员接触者的风险可能尤其高。此建议的前提是暴露者未佩戴合适的个人防护装备 (PPE)。
建议 7 :对于有临床或流行病学原因可能需要进行检测的个人,IDSA 专家组建议对已知接触过 SARS-CoV-2 感染的无症状个体使用快速或标准实验室核酸扩增检测 (NAAT) (有条件建议,证据确定性中等) 。
- 评论 :
- 正确的样本采集和运输至实验室或检测点对于确保检测结果的质量至关重要; IDSA 网站提供相关资源。快速核酸扩增检测 (NAAT) 的定义各不相同;一些机构,包括美国 FDA,将周转时间≤30 分钟定义为快速 NAAT,而其他机构则使用≤60 分钟甚至更长的时间。此时间仅指检测时间(包括核酸提取),不包括样本采集到检测的时间或检测到报告的时间。快速检测通常操作步骤较少,并且可以在患者附近甚至床旁进行,由非实验室人员操作。快速检测方法包括快速 RT-PCR 和快速等温 NAAT。标准检测需要仪器和/或处理,通常必须在临床实验室由训练有素的实验室人员进行。
- 本建议仅适用于纳入研究中评估的检测方法。其中一项检测方法,即雅培 IDNow 检测,被纳入本建议评估的大多数研究,这可能导致结果灵敏度偏低。不同样本类型下检测性能的差异可能很重要。所评估的检测方法采用了不同的技术(例如,等温和非等温扩增),理论上这些技术可能会影响结果。关于核酸扩增检测(NAAT)在免疫功能低下或已接种疫苗者、既往感染过 SARS-CoV-2 者或感染不同 SARS-CoV-2 变异株者中的分析性能,目前数据有限。
建议 8 :IDSA 专家组建议不要对无症状且无已知 COVID-19 接触史的住院患者进行常规 SARS-CoV-2 NAAT 检测(有条件建议,证据确定性非常低) 。
- 评论 :
- 这项建议的重要考量因素是,IDSA 专家组在文献回顾期间未能找到任何已发表的研究表明,入院前检测能够降低 SARS-CoV-2 在医护人员或其他患者之间的传播。现有证据均为间接证据,且仅评估了有症状患者或无症状患者联合检测中诊断试验的准确性。鉴于证据有限,专家组也考虑到了对所有计划入院患者进行检测的负担。最后,还应考虑其他有效的感染预防干预措施,例如使用个人防护装备和接种疫苗。
- 专家组承认,在某些情况下,入院前进行 NAAT 检测可能是有益的,例如入住多人病房;入住设有集体治疗区的病房,例如行为健康病房;或者入住正压病房或病房。
- 此建议仅适用于急性护理医院环境。
建议 9 :IDSA 专家组建议不要对无症状且未接触过 COVID-19 的个体进行常规 SARS-CoV-2 NAAT 检测,这些个体正在接受医疗或外科手术 (有条件建议,证据确定性非常低) 。
- 评论 :
- NAAT 用于检测 SARS-CoV-2 RNA 的存在,但这可能并不代表具有传染性的病毒。
- 已有大量报道指出,在呼吸道标本中检测到 SARS-CoV-2 RNA,但未发现传染性病毒。
- IDSA 专家组得出结论,根据非标准化的仪器信号值(例如循环阈值 (Ct) 值)来确定患者的 SARS-CoV-2 传染性的数据不足。
- 对于曾感染过 SARS CoV-2 的患者,决定何时进行手术必须权衡患者的风险与延迟或避免计划手术的风险,并且应考虑与患者相关的因素(例如,疫苗接种情况、症状状况、年龄)、与手术相关的因素(例如,紧急程度、手术是否产生气溶胶)以及手术区域的感染控制措施。
- 鉴于对于 SARS-CoV-2 感染检测呈阳性后不久接受大型手术的无症状者而言,缺乏不良预后的证据,因此在社区传播高峰期可以考虑进行检测。
- 在进行实体器官移植、造血干细胞移植或 CAR-T 细胞治疗之前,也可以考虑进行检测。
- 此建议适用于提供并严格遵守个人防护装备(PPE)等防护措施的场所。其他需要考虑的因素包括医护人员和患者的疫苗接种情况,以及患者在术前或术后是否会与其他患者同住一间病房。此建议基于社区的一般暴露情况,而非特定的已知暴露情况。
建议 10 :IDSA 专家组建议不要对近期有 COVID-19 病史的患者在进行医疗或外科手术前常规重复进行 NAAT 检测 (有条件建议,证据确定性非常低) 。
- 评论 :
- NAAT 用于检测 SARS-CoV-2 RNA 的存在,但这可能并不代表具有传染性的病毒。
- 已有大量报道指出,在呼吸道标本中检测到 SARS-CoV-2 RNA,但未发现传染性病毒。
- 相反,IDSA 专家组未能找到确凿证据证明,NAAT 结果为阳性后出现阴性结果,就证明患者不再具有传染性。
- IDSA 专家组得出结论,根据 Ct 值结果,数据不足以确定患者是否具有 SARS-CoV-2 传染性。
- 对于曾感染过 SARS CoV-2 的患者,决定何时进行手术必须权衡患者的风险与延迟或避免计划手术的风险,并且应考虑与患者相关的因素(例如,疫苗接种情况、症状状况、年龄)、与手术相关的因素(例如,紧急程度、手术是否产生气溶胶)以及手术区域的感染控制措施。
建议 11 :IDSA 专家组建议不要常规地对 COVID-19 患者重复进行 NAAT 检测以指导解除隔离( 有条件建议,证据确定性非常低 )。
- 评论 :
- NAAT 用于检测 SARS-CoV-2 RNA 的存在,但这可能并不代表具有传染性的病毒。
- 已有大量报道指出,在呼吸道标本中长期检测到 SARS-CoV-2 RNA,但未发现传染性病毒。仅凭 SARS-CoV-2 核酸扩增检测(NAAT)阴性结果就解除隔离,可能会不必要地延长隔离时间。
- 相反,IDSA 专家组未能找到确凿证据证明,NAAT 结果为阳性后出现阴性结果,就证明患者不再具有传染性。
- IDSA 专家组得出结论,根据 Ct 值结果,数据不足以确定患者是否具有 SARS-CoV-2 传染性。
建议 12 :IDSA 专家组既不建议支持也不反对对 SARS-CoV-2 进行居家检测(证据不足)。
背景
2019 年 12 月下旬,中国湖北省武汉市报告了不明原因肺炎疫情[4]。随后,研究人员利用从患者下呼吸道样本中采集的样本,通过无偏倚的二代测序(NGS)技术,鉴定出一种新型冠状病毒是导致该疾病的病原体,该疾病现被称为 2019 冠状病毒病(COVID-19)。几天之内,该病毒的完整基因组序列便在网上公布,系统发育分析表明,它与人类严重急性呼吸综合征冠状病毒(SARS-CoV)以及其他几种类似 SARS 的蝙蝠冠状病毒密切相关[4, 5]。基于基因相似性,这种新型冠状病毒被正式命名为 SARS-CoV-2[6]。截至 2020 年 3 月 11 日 ,该病毒已传播至至少 114 个国家,造成 4000 多人死亡,促使世界卫生组织(WHO)正式宣布其为全球大流行病[7]。
SARS-CoV-2 基因组的公开是开发精准分子诊断检测方法的关键第一步。核酸扩增检测旨在检测 SARS-CoV-2 特有的一个或多个基因序列,对于确诊 COVID-19 至关重要。2020 年 2 月 4 日,美国卫生与公众服务部部长宣布,目前的情况符合授权紧急使用 SARS-CoV-2 分子检测的条件[8]。这意味着商业生产商和临床实验室必须向美国食品药品监督管理局(FDA)提交其 SARS-CoV-2 检测方法的详细信息,以供审查和紧急使用授权(EUA)审批。
迄今为止,包括学术医疗中心在内的多家商业检测厂商和临床实验室已获得针对 SARS-CoV-2 的分子诊断检测的紧急使用授权(EUA),其中包括面向消费者的家用非处方检测[9]。一种多重核酸扩增检测(NAAT)已根据传统的上市前审查流程获得 FDA 的全面批准[10]。需要注意的是,EUA 指南与标准的 FDA 审批流程有所不同。在公共卫生紧急情况下,FDA 仅要求检测开发商证明其检测的分析准确度可接受。临床检测性能(即临床灵敏度和特异性)尚未确定,也未在不同 EUA 平台之间进行全面比较。
鉴于检测手段日益普及,以及学术期刊上发表的以核酸扩增检测(NAAT)为重点的研究数量迅速增长,美国传染病学会(IDSA)成立了一个多学科专家组,旨在对现有文献进行严格评估,并制定循证诊断检测建议。该专家组确定并优先考虑了与有症状患者和无症状个体相关的实际诊断问题,以此指导文献综述。 表 1 列出了与 COVID-19 相符的症状。
预计随着实质性新信息的出现,这些指导方针将不断更新。
方法和搜索结果
本指南采用推荐意见分级评估、制定与评价(GRADE)方法进行证据评估。此外,鉴于需要快速应对紧急公共卫生危机,方法论根据指南国际网络/麦克马斯特大学快速推荐意见制定清单进行了调整[13]。本指南是对 IDSA COVID-19 诊断指南[1]的第二次更新。本次更新解答了之前指南中已讨论过的 8 个问题,并新增了 4 个临床上重要的问题。问题列表见表 S1 。
面板组成
该专家组由八名成员组成,包括一线临床医生、传染病专家、医疗流行病学家和临床微生物学家,他们均为美国传染病学会 (IDSA)、美国微生物学会 (ASM)、美国医疗流行病学会 (SHEA) 和儿科传染病学会 (PIDS) 的成员。他们代表了成人和儿科传染病、医学微生物学以及肾脏病学和胃肠病学等领域。循证基金会为本指南的制定提供了技术支持和指南方法学专家。
潜在利益冲突的披露与管理
利益冲突审查小组由两名来自美国传染病学会 (IDSA) 的代表组成,负责审查、评估和批准所有披露信息。专家组所有成员均遵守利益冲突审查和管理流程,该流程要求披露任何可能被视为构成实际、潜在或表面利益冲突的财务、知识产权或其他利益,无论其是否与指南主题相关。对已披露关系是否存在潜在利益冲突的评估基于财务关系的相对重要性(即金额)和关系的相关性(即独立观察者在多大程度上可能合理地将该关联解读为与待审议的主题或建议相关)。利益冲突审查小组确保专家组大多数成员和主席不存在潜在的相关(与主题相关)利益冲突。主席和技术团队的所有成员均被认定不存在利益冲突。
问题生成
在最初的指南中,临床问题在第一次专家组会议之前就被制定成人群、干预、比较、结果(PICO)框架[14]( 表 S1 )。IDSA 专家组成员优先考虑了符合最低可接受标准(即,至少基于检测准确性结果的证据可应用于目标人群)且有现有证据的问题。专家组成员优先考虑了与 SARS-CoV-2 检测相关的以患者为中心的结果,例如是否需要自我隔离、是否符合 COVID-19 治疗条件以及择期手术或操作的时间安排。我们还考虑了 SARS-CoV-2 检测结果对感染预防和公共卫生措施的影响,包括个人防护装备的使用和接触者追踪。在本次更新中,由于缺乏相关数据,专家组撤销了关于下呼吸道疾病患者上呼吸道标本与下呼吸道标本检测的问题,以及关于免疫功能低下人群检测的问题。第三版指南力求聚焦于具有临床意义的问题,以便获得新的数据,从而提出新的建议,或调整先前建议的方向或强度。专家组还探讨了其专业范围内的问题(例如,避免涉及免疫学专业知识的问题)。(见表 S1 )
搜索策略
英国国家卫生与临床优化研究所 (NICE) 和疾病控制与预防中心 (CDC) 的高敏感性检索策略经方法学家与技术团队信息专家协商后,被认定为具有高敏感性。除 PICO 问题中确定的术语外,检索策略中还添加了“COVID”这一术语( 表 S2 )。我们检索了 Ovid Medline、Embase 和 Cochrane 数据库中 2019 年至 2022 年 7 月 1 日期间的研究。在证据评估和推荐过程中,我们还进行了前瞻性研究,并咨询了相关领域专家,以查找更多文献。这对于回答那些缺乏检测准确性结果的 PICO 问题尤为重要。我们关注预印本的最终发表,但除非预印本已发表,否则不将其纳入文献综述,因为审稿团队已确定了足够数量的已发表研究。我们还审查了专家组成员推荐的参考文献列表和文献,以确定是否纳入。
筛选和研究选择
审稿团队成员筛选了标题和摘要,以及符合条件的全文研究。我们纳入了报告诊断试验准确性数据的研究(队列研究、横断面研究和病例对照研究)。当问题比较不同试验(例如,不同的检测或抽样方法)或检测策略的性能时,我们纳入了提供同一人群中所有试验直接准确性数据的研究,即直接比较试验准确性研究。在本分析中,如果并非所有患者都接受了所有试验,则排除该研究。当缺乏此类直接比较研究时,我们纳入了评估单一试验并将其结果与参考标准进行比较的研究。
我们排除了以下研究:未获得 EUA 或 CE 认证的指标测试研究;由于未报告测试名称而无法确认 EUA/CE 认证状态的测试研究;样本量少于 30 例患者/样本的研究;机器学习研究;方案研究;测试准确性信息不完整的研究(例如,仅报告灵敏度而未报告特异性);报告非典型样本采集部位的研究(例如,废水、结膜拭子、粪便/肛门拭子、精液、腹膜拭子、环境表面、空气样本、呼吸冷凝物);使用不常用检测方法的研究(例如,CRISPR-Cas9 基因组编辑、生物电识别检测 (BERA)、衰减全反射傅里叶变换红外 (ATR-FTIR) 光谱);以及比较两种 RT-PCR 组件试剂盒(探针、引物、酶、拭子类型、主混合物)的研究。如果检测结果显示至少一个目标基因呈阳性,我们就假定患者确实感染了 SARS-CoV-2。
对于直接比较检测准确性的研究(包括快速检测与标准检测),数据提取以每项检测为指标检测,以检测组合为参考标准。专家组确定,检测组合参考标准至少需要至少有阳性检测结果。例如,如果四项检测中有一项为阳性,则该患者被判定为阴性;如果四项检测中有两项为阳性,则该患者被判定为阳性。对于某些比较,我们建立了不同的参考标准以减少潜在的偏倚。例如,在比较患者自采和医护人员采集的样本时,任何单一的阳性结果均被视为参考标准。
也就是说,如果仅通过自采集检测出样本呈阳性,则该样本被视为阳性,并成为灵敏度计算中阳性样本总数的一部分。
数据收集与分析
评审小组的一名成员使用标准化的数据提取表格完成了数据提取。IDSA 专家组成员对与样本采集点相关的结果进行了二次审核,未发现重大差异。提取的数据包括研究的一般特征(作者、发表年份、国家、研究设计)、诊断指标测试和参考标准、SARS-CoV-2 感染的流行率以及用于确定测试准确性的参数(即指标测试的灵敏度和特异性)。
对于每项研究,我们计算了诊断指标测试的敏感性和特异性,并使用 Clopper-Pearson 方法估计 95% 置信区间。然后,我们使用 R 语言(版本 4.1.2)lme4 包中的 glmer 函数,拟合 Chu 和 Cole (1) 的随机效应二元二项式模型来合并准确性估计值。对于纳入研究少于 5 项的分析,我们使用 R 语言(版本 4.1.2)meta 包中实现的固定效应模型来合并准确性估计值。我们使用森林图绘制个体估计值和汇总估计值,并进行亚组分析以探索异质性。
为了计算不同检测或抽样策略的绝对效应差异,我们将灵敏度和特异性的结果应用于一系列合理的患病率。然后,我们计算了真阳性、真阴性、假阳性和假阴性。为了确定每个问题的患病率,我们参考了已发表的文献并咨询了临床专家。患病率由社区监测检测的结果定义,并且已被证明会随时间变化。为了本指南的目的,我们使用了 1%、5% 和 10% 的预检概率,以反映无症状人群中一系列的社区患病率。
偏倚风险和证据确定性
我们使用诊断准确性研究质量评估工具(QUADAS-2 修订版)( 表 S3 )[15]对诊断试验准确性研究进行了偏倚风险评估。采用 GRADE 框架评估总体确定性,通过评估每个结局指标在以下几个方面的证据:偏倚风险、不精确性、不一致性、间接性和发表偏倚[16, 17]。GRADE 结果汇总表使用 GRADEpro 指南制定工具生成[18]。
从证据到建议
专家组在决策过程中考虑了 GRADE 证据的核心要素,包括证据的确定性以及预期效果与不良效果之间的平衡。在适用的情况下,专家组也考虑了其他领域(例如可行性、资源利用、可接受性)。所有建议均由专家组成员达成共识。在专家组会议召开前,已就无法达成共识的情况制定了投票规则。
根据 GRADE 方法,推荐意见被标记为“强推荐”或“有条件推荐”。“我们推荐”表示强推荐,“我们建议”表示有条件推荐。 图 2 为患者、临床医生和医疗政策制定者提供了强推荐和弱推荐的建议解读。极少数情况下,低确定性证据也可能导致强推荐。在这些情况下,我们遵循 GRADE 工作组普遍推荐的方法,这些方法在五个典型情境中进行了概述(例如,避免灾难性伤害)[19]。对于与良好实践声明相关的推荐意见,我们遵循 GRADE 工作组的指导,选择合适的标识和措辞[20]。“良好实践声明”是指指南小组认为对医疗实践至关重要的信息,它由大量难以概括的间接证据支持,并表明实施该推荐意见将明显带来显著的净积极后果。对于未正式说明比较对象的推荐意见,我们隐含地将感兴趣的比较对象称为“不使用该检测”。一些建议承认目前存在“知识差距”,旨在避免过早地提出有利于测试使用的建议,并避免鼓励可能不准确的测试的快速传播。
修订过程
该指南草案经指南制定小组以外的 IDSA 董事会执行委员会快速审查批准。指南经 ASM、SHEA 和 PIDS 审查,并获得 ASM 和 PIDS 的认可。IDSA 董事会执行委员会在指南发布前对其进行了审查和批准。
修订过程
该指南草案经 IDSA 理事会执行委员会(独立于指南制定小组)快速审核批准。指南随后经 ASM、SHEA 和 PIDS 审阅,并获得这三个学会的认可。IDSA 理事会执行委员会在指南发布前对其进行了审核和批准。
更新过程
我们将定期、频繁地查阅文献,以确定是否需要根据新数据对建议产生影响的可能性进行修订。如有必要,我们将再次召集专家组讨论可能的修改方案。
搜索结果
对三个数据库进行系统性检索,共检索到 22,586 篇参考文献。筛选标题和摘要后,1,275 篇参考文献被认为能够回答分子 PICO 问题。其中,88 项研究至少回答了 12 个 PICO 问题中的一个。此外,针对缺乏检测准确性研究的 PICO 问题,通过定向检索又纳入了 15 项研究,最终共有 103 项研究为本次指南更新提供了依据( 图 S1 )。纳入研究的特征见表 S4 。新增研究的叙述性总结见表 S5 。
建议1:对有症状个体进行核酸扩增检测
建议 1 :IDSA 专家组建议对疑似患有 COVID-19 的有症状个体进行 SARS-CoV-2 NAAT 检测( 强烈推荐,证据确定性中等 )。
- 评论 :
- 专家组认为有症状的患者至少具有一种与 COVID-19 相符的最常见症状( 表 1 )。
- 阳性检测结果可为治疗、隔离以及可能的接触者追踪等决策提供依据。
- 关于 SARS-CoV-2 NAAT 在免疫功能低下或已接种疫苗的个体、曾感染过 SARS-CoV-2 的个体、儿童或感染了近期 SARS-CoV-2 变种(例如 Omicron)的患者中的分析性能,目前可用的数据有限。
证据概要
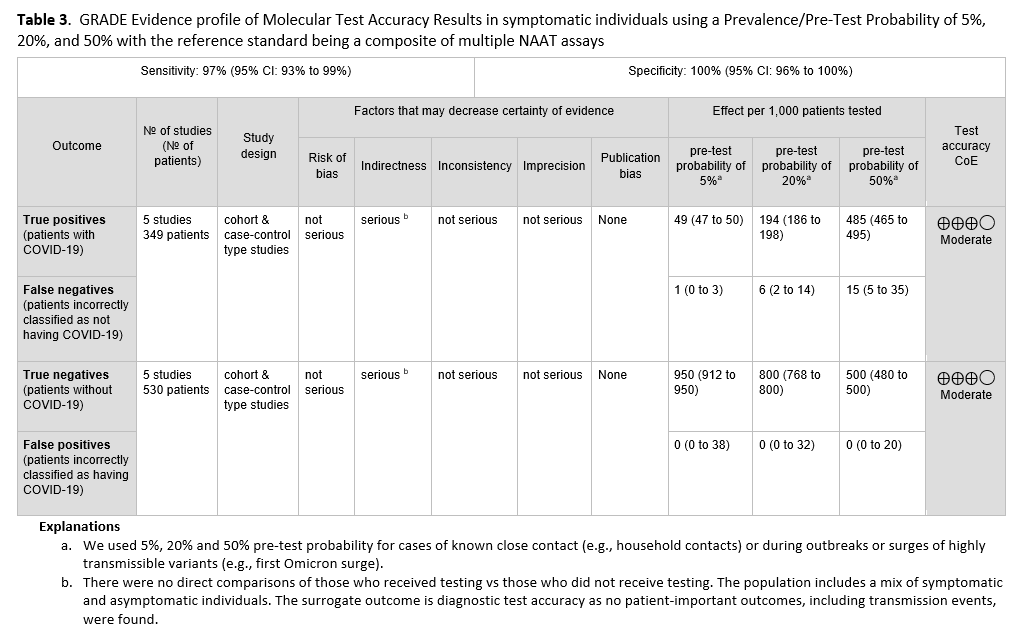
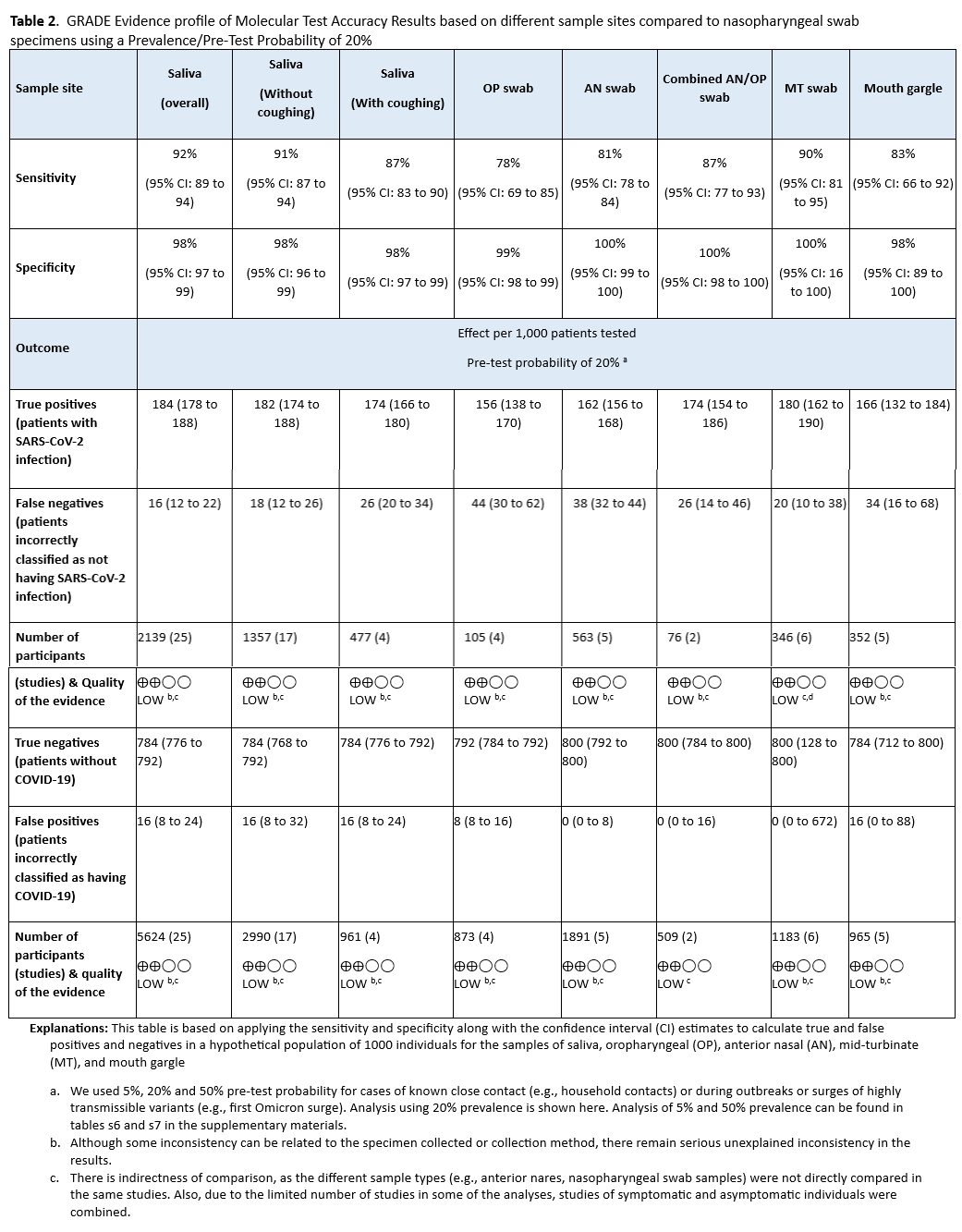
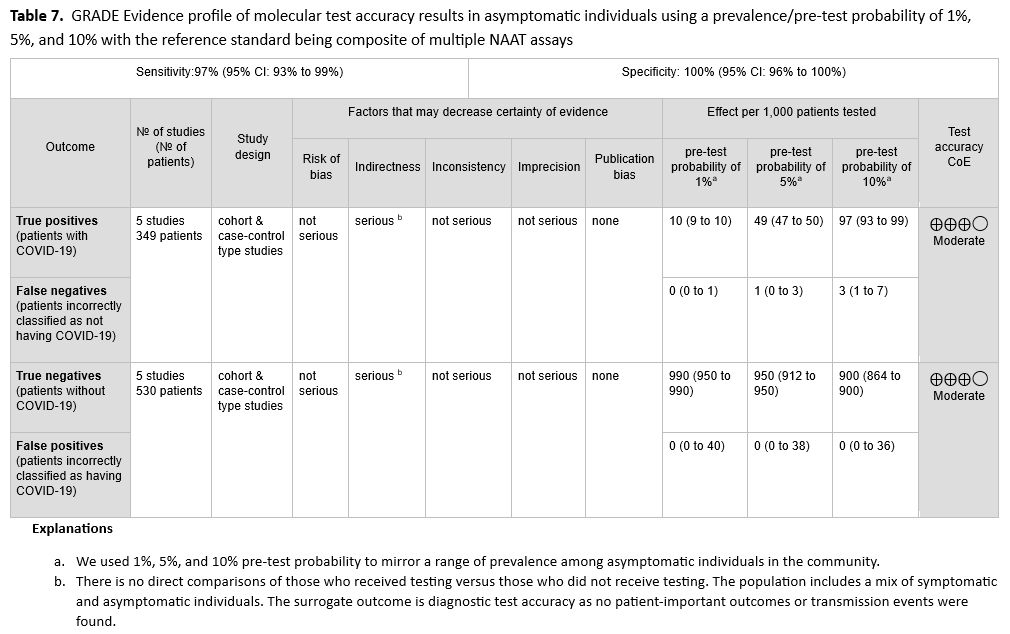
未发现直接证据评估有症状患者接受检测与不接受检测对患者或人群的影响。因此,专家组依据诊断试验准确性数据提出此项建议。本建议基于五项研究[21-25],共纳入 349 例阳性患者和 530 例阴性患者,这些研究均采用标准核酸扩增检测(NAAT)(见图 s2a-s2b )。参考标准为两种以上标准 NAAT(即快速 RT-PCR 和实验室 NAAT)的组合,使用鼻咽拭子或鼻腔拭子。汇总灵敏度为 97%(95% CI:93%至 99%),汇总特异性为 100%(95% CI:96%至 100%)。IDSA 专家组考虑了有症状患者(即至少出现一种 COVID-19 常见症状的患者)中 5%、20%和 50%的患病率(见表 2 )。在这一患病率范围内,每 1000 人中预测有 1-15 例假阴性结果,预测无假阳性结果(见表 3 )。由于间接性导致证据确定性降低,因此证据确定性为中等。间接性源于缺乏对接受检测者和未接受检测者之间的直接比较。此外,大多数研究报告的检测结果来自有症状和无症状人群的混合群体,或者没有明确说明受检人群的症状状况。由于本研究问题针对的是有症状个体,这进一步增加了间接性。
益处和危害
对有症状的 SARS-CoV-2 感染者进行诊断检测是必要的,因为仅凭临床评估无法准确预测 COVID-19 的诊断。一些感染者可能错误地认为,既然他们已经感染过 SARS-CoV-2 和/或接种过疫苗,就不需要检测,因为他们没有感染 SARS-CoV-2 的风险;这些人可能不会采取适当的感染预防措施,从而导致 SARS-CoV-2 的传播,或者他们可能因为没有接受检测而无法获得医疗随访或必要的治疗。同样,假阴性结果也是检测的潜在危害;假阴性结果可能导致有症状者传播 SARS-CoV-2,并使这些患者无法获得适当的治疗。假阳性结果的潜在危害包括:隔离未感染 COVID-19 的人,造成不必要的焦虑,延误进一步的症状病因检查,给予不必要的 COVID-19 治疗,增加请假或请假天数,以及不必要的接触者追踪。标准 NAAT 的特异性非常高(即在 5% 到 50% 的患病率范围内不会出现预测的假阳性),从而最大限度地减少了这些潜在的危害。
其他考虑因素
SARS-CoV-2 检测通常被患者和医疗服务提供者所接受。在美国,拥有医疗保险的个人无需自费进行 COVID-19 检测。一些社区还提供免费项目,可进行核酸扩增检测 (NAAT)。这种情况未来可能会发生变化,并可能影响患者寻求检测的可能性。
本建议的结论和研究需求
建议对社区中出现症状且具有相符临床综合征的个体进行 SARS-CoV-2 NAAT 检测( 表 1 )。
建议2:标本采集的解剖部位
建议 2 :对于疑似患有 COVID-19 的有症状个体,IDSA 专家组建议采集并检测来自鼻咽 (NP)、前鼻孔 (AN)、口咽 (OP) 或中鼻甲区域 (MT) 的拭子样本;唾液或漱口液( 有条件建议,证据确定性低 )。
- 评论
- 与鼻咽拭子相比,单独采集鼻咽拭子或口咽拭子比联合采集鼻咽/口咽拭子、口腔拭子、唾液或漱口液更容易产生假阴性结果( 表 2 )。如果无法采集鼻咽拭子、鼻咽/口咽拭子、口腔拭子、唾液或漱口液,则可单独采集鼻咽拭子或口咽拭子。
- 样本采集方法没有标准化(例如,流出的口水或唾液,无论是否伴有咳嗽,都被报告为唾液)。
- 应考虑患者能否遵照指示并配合标本采集的要求(例如,将唾液吐入容器中,在采集唾液前一段时间内禁食)。
- FDA 对特定核酸扩增检测(NAAT)的批准会明确指出采集方法和样本类型。除非通过实验室自建检测(LDT)验证获得批准,或经 FDA 后续紧急使用授权(EUA)批准用于不同的采集方法或样本类型,否则不遵守标签要求可能导致结果不准确,并被拒付。
证据概要
我们回顾了已发表的文献,以确定评估不同样本类型相对于鼻咽拭子(NP)检测 SARS-CoV-2 RNA 性能的研究。样本类型分为鼻咽拭子、口腔拭子(MT)、鼻咽拭子(AN)、口咽拭子(OP,也称为“咽拭子”)、唾液、漱口液(也称为口腔冲洗液、漱口水、生理盐水漱口液)或鼻咽拭子和口咽拭子混合样本。鼻咽拭子样本的定义为拭子插入深度不超过 0.5 英寸,以此将其与口腔拭子样本区分开来。由于采集方法存在差异,唾液样本根据研究方法是否要求受试者在采集唾液前咳嗽,进一步分为咳嗽唾液和非咳嗽唾液。
44 项研究[28-70]报告了以鼻咽拭子为参考的不同样本类型的检测准确性,其敏感性范围从口咽拭子的 78%(95% CI:69%-85%)到唾液的 92%(95% CI:89%-94%)(见图 s3a 至 s11b )。单独使用口咽拭子和鼻咽拭子(81%,95% CI:78-84%)的敏感性低于其他样本类型,假阴性结果也相应增加( 表 2 , 表 s6-s7 )。所有样本类型的特异性范围为 98%至 100%。唾液是最常被评估的指标样本类型(见表 2 , 表 s6-s7 )。
不同样本采集点的证据质量参差不齐,间接性、不一致性和不精确性导致证据质量降低。间接性与比较对象(每个样本采集点来自不同的群体)和群体本身(一些研究纳入了有症状和无症状个体)有关。即使对异常值研究进行严格审查,来自某些相同样本采集点的样本检测结果不一致的原因仍然无法解释。研究中纳入的患者数量较少,导致部分分析的精确性降低。
益处和危害
专家组认识到,与鼻咽拭子相比,某些替代样本类型(例如鼻咽拭子和口咽拭子)的分析灵敏度可能较低( 见表 2 ),尽管相关报道不一。例如,一项在完成本指南文献检索后发表的儿科人群研究发现,在 Delta 毒株和 Omicron 毒株初期疫情高峰期间,有症状儿童的鼻咽拭子和鼻咽拭子样本的 SARS-CoV-2 Ct 值分布相似,这表明对于较新的病毒变种,这两种样本类型的灵敏度可能相当[71]。与其他研究的样本采集方法相比,鼻咽拭子采集更具侵入性且更令人不适,并且需要经过培训的医护人员进行采集。简便、无创的样本采集方法,只需医护人员接受最少的培训和时间,并允许患者自行采集,可能会增加检测量。在制定此项建议时,专家组认为,增加检测的益处大于假阴性结果数量增加的潜在危害。
其他考虑因素
采集上呼吸道标本存在一些固有的挑战,包括病原体脱落的解剖部位、拭子采集技术的一致性,以及在采集唾液标本时,进食/饮水后的时间间隔、咳嗽情况以及漱口水等其他因素的影响。虽然鼻咽拭子采集已成为首选的参考方法,但目前尚无真正的金标准来比较鼻咽拭子与其他标本(如鼻咽拭子、支气管拭子、口咽拭子、唾液或漱口液)的优劣。此外,实际采集方法差异很大;参见表 4 ,了解标本采集说明示例。与抽血或尿液采集不同,上呼吸道拭子采集并不统一。因此,即使是鼻咽拭子采集,也无法确定其标本是否最佳。最后,FDA 批准的核酸扩增检测(NAAT),包括可检测其他呼吸道病原体的多重检测,均明确规定了采集方法和标本类型。除非通过实验室开发的测试 (LDT) 验证获得批准,或通过 FDA 后续的 EUA 授权用于不同的采集或样本类型,否则不遵守标签要求可能会导致结果不准确和报销被拒绝。
本建议的结论和研究需求
对于社区和门诊检测而言,其优势支持使用替代采集方法和标本类型。需要开展研究,采用更全面的参考方法,将鼻咽拭子与其他上呼吸道标本采集方法进行比较。
建议3:自行采集拭子样本
建议 3 :IDSA 专家组建议,对于疑似患有 COVID-19 的有症状个体,患者或医疗保健提供者可以采集 AN 和 MT 拭子样本进行 SARS-CoV-2 RNA 检测( 有条件建议,中等确定性证据 )。
- 评论:
- 现有数据的一个重要局限性在于,不同比较组的样本类型存在差异。也就是说,虽然自取样本均为 AN 和 MT 样本,但医护人员采集的样本均为 NP 样本。这或许可以解释医护人员采集的样本灵敏度更高的原因。
证据概要
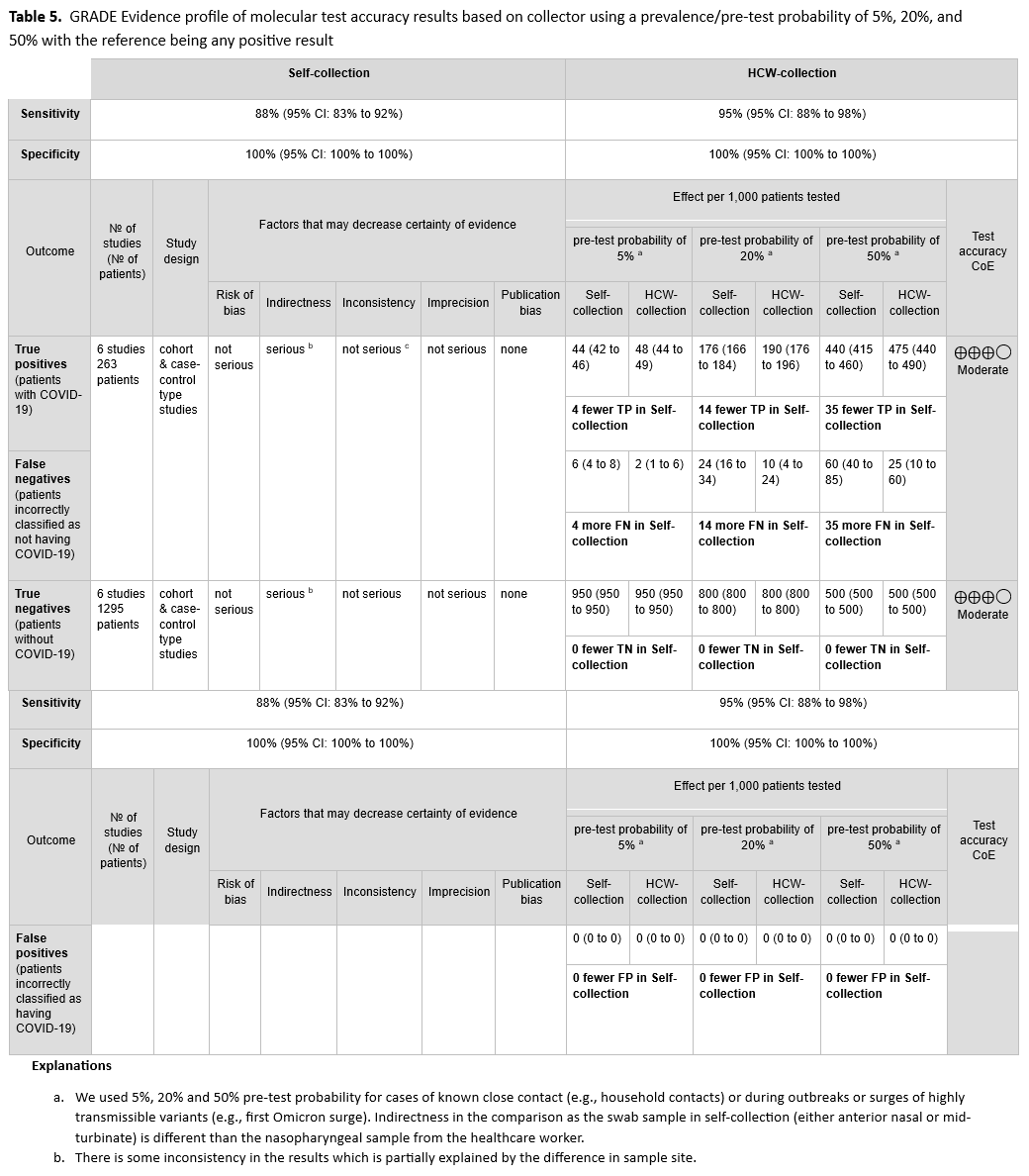
我们检索到六项队列研究,共纳入 263 例阳性患者和 1295 例阴性患者,这些研究报告了自取样本与医护人员采集样本的检测结果[38, 59, 64, 65, 72, 73]。(见图 S12a 至 S13b )。自取样本的采集部位为鼻咽部(AN)和鼻中隔(MT)。我们排除了未采用拭子采集样本(例如唾液、漱口液、痰液)的研究。在本分析中,我们未将医护人员采集的样本作为参考标准,而是将任何阳性结果(无论自取或医护人员采集)均视为真阳性。自取鼻咽部或鼻中隔样本的合并敏感性为 88%(95% CI:83%至 92%),医护人员采集的鼻咽部样本的合并敏感性为 95%(95% CI:88%至 98%)。 (见表 5 )
由于比较方法的间接性和结果的不一致性,证据的确定性被评为低。在所有六项研究中,医护人员采集的是鼻咽拭子样本,而所有自取样本均为鼻咽拭子或鼻咽拭子样本。对同一种样本类型进行检测却出现无法解释的不一致结果,也进一步降低了证据的确定性。
益处和危害
自行采集标本的优势包括为患者提供便利(例如可在家中采集),以及减轻医护人员和其他医疗资源的负担。专家组认为,自行采集标本的人员必须接受过良好的培训,能够遵循分步操作流程,但培训对标本采集质量的影响并未进行评估。专家组认为,提供教育材料和易于理解的说明(包括多语言版本)是有益的,但同样,在制定此项建议时,并未对此进行专门评估。
其他考虑因素
在本指南证据审查截止日期之后发表的一项研究中,幼儿园年龄段的儿童能够成功地自行采集鼻前拭子样本进行 SARS-CoV-2 核酸扩增检测(NAAT);与医护人员采集的鼻前拭子样本相比,其阳性符合率和阴性符合率分别为 97.8%(95% CI,94.7%-100.0%)和 98.1%(95% CI,95.6%-100.0%)。这支持了以下假设:在本指南文献检索所纳入的研究中,医护人员采集的样本比自行采集的样本具有更高的敏感性,这可能很大程度上是由于样本来源不同(即,医护人员采集的鼻咽拭子与患者自行采集的鼻前拭子)。此外,还应注意的是,大多数自行采集样本的研究都是在医护人员在场的情况下进行的。这些研究均基于有症状的患者,因此缺乏无症状个体自行采集样本的数据。此外,并非所有检测方法都获得了 FDA 批准用于自行采集样本。
本建议的结论和研究需求
对于社区中疑似感染新冠病毒的有症状个体,自行采集拭子样本的诊断准确性与医护人员采集的样本相似。需要开展在没有医护人员监督的情况下,对无症状个体进行自行采集样本的研究。
建议 4:有症状个体中快速核酸扩增检测与标准实验室核酸扩增检测的比较
建议 4 :IDSA 专家组建议对疑似患有 COVID-19 的有症状个体使用快速或标准实验室 NAAT 检测 (有条件建议,证据确定性中等) 。
- 评论 :
- 正确的样本采集和运输至实验室或检测点对于确保高质量的检测结果至关重要; IDSA 网站提供相关资源。快速核酸扩增检测 (NAAT) 的定义各不相同;一些机构,例如美国 FDA,将周转时间≤30 分钟定义为快速 NAAT,而其他机构则使用≤60 分钟甚至更长的周转时间。此时间仅指检测时间(包括核酸提取),不包括样本采集到检测的时间或检测到报告的时间。快速检测通常操作步骤较少,并且可以在患者附近甚至床旁进行,由非实验室人员操作。快速分子检测方法包括快速逆转录聚合酶链式反应 (RT-PCR) 和快速等温核酸扩增检测 (NAAT)。标准检测需要仪器和/或处理,通常必须由训练有素的实验室人员在临床实验室进行。
- 本建议仅适用于纳入研究中评估的检测方法。其中一项检测方法,即雅培 IDNow 检测,被纳入本建议评估的大多数研究,这可能导致结果偏向较低的灵敏度。不同样本类型下检测性能的差异可能很重要。所评估的检测方法采用了不同的技术(例如,等温和非等温扩增),这些技术理论上可能会影响结果。关于核酸扩增检测(NAAT)在免疫功能低下或已接种疫苗的个体、既往感染过 SARS-CoV-2 的个体或感染了当前 SARS-CoV-2 变异株的个体中的分析性能,目前数据有限。
证据概要
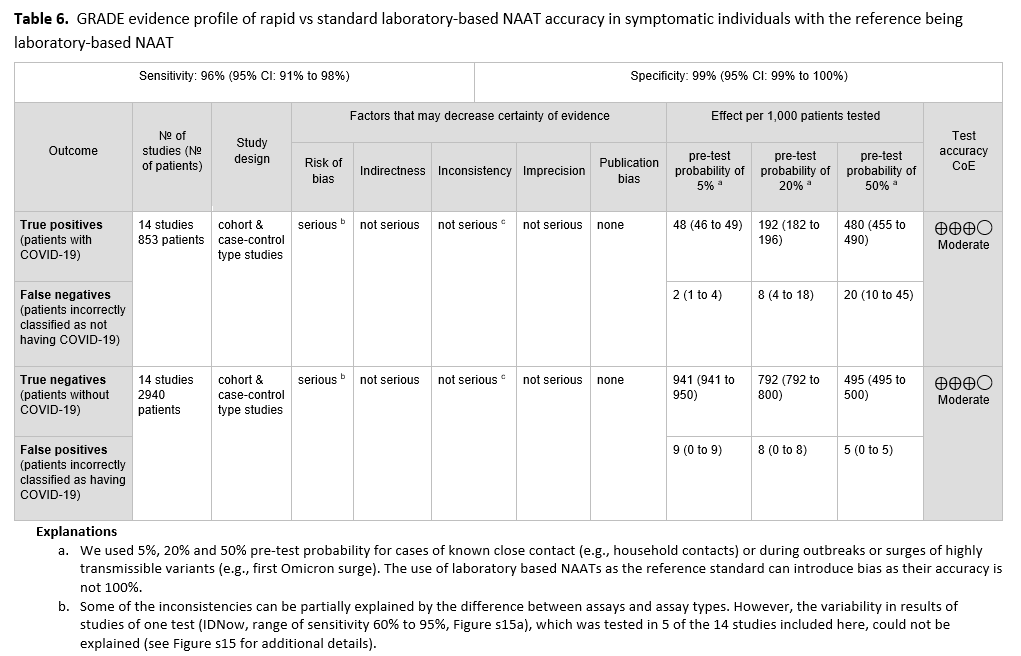
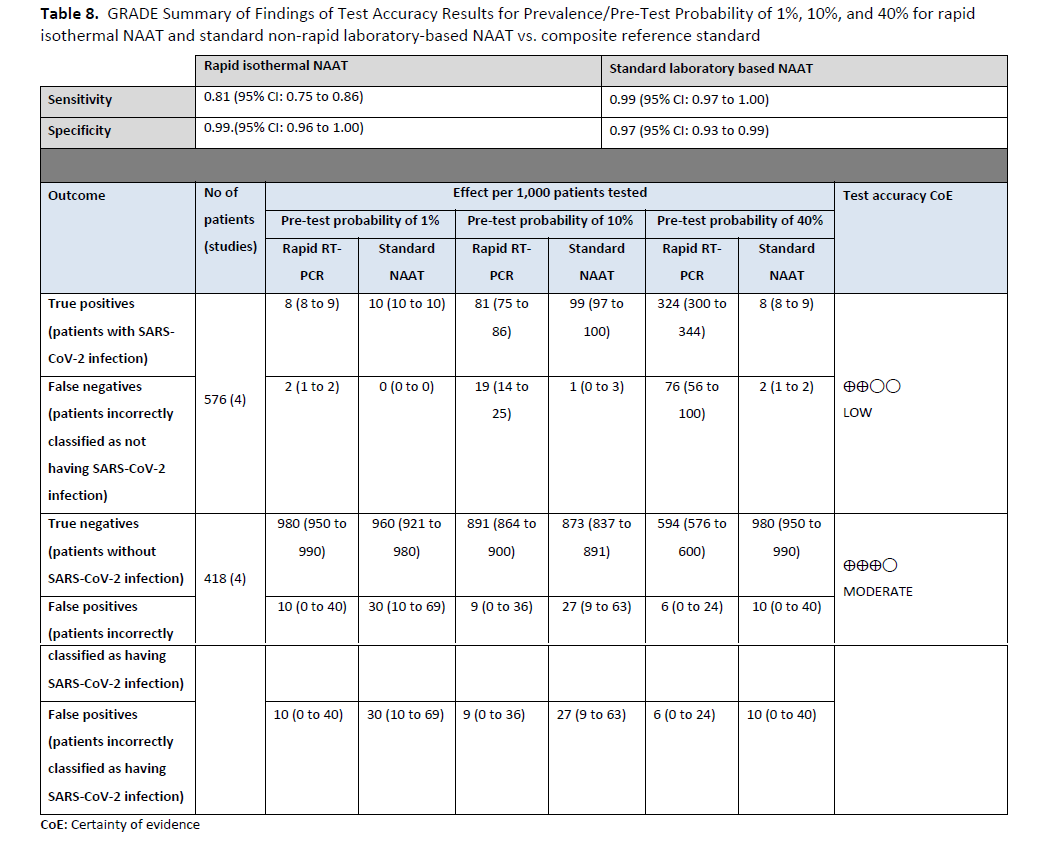
本建议基于 14 项研究[74-87],这些研究评估了快速分子诊断检测和实验室检测,共纳入 853 例阳性患者和 2940 例阴性患者。参考检测为实验室核酸扩增检测(NAAT)。所评估的快速 NAAT 的汇总灵敏度为 96%(95% CI:91%至 98%),汇总特异性为 100%(95% CI:98%至 100%)(见图 s14a 至 s15b )。我们考虑了 5%、20%和 50%作为有症状患者(即至少出现一种 COVID-19 常见症状的患者)中 COVID-19 的患病率(检测前概率)。在所考虑的患病率范围内,预计每 1000 名受检患者中假阴性结果为 2 至 20 例,假阳性结果为 5 至 9 例。由于使用基于实验室的 NAAT 作为参考标准存在偏倚风险,并且某些检测的灵敏度结果存在一些不一致,因此证据的确定性为中等。(见表 6 )
益处和危害
快速分子诊断检测的价值在于,理想情况下应在患者在场的情况下完成检测,这样可以迅速制定并实施与治疗和隔离相关的管理决策。快速检测可以缩短患者等待检测结果期间的焦虑期。快速获得结果可以减少患者失访的风险,并简化后续随访流程。
一项重要发现是,快速诊断检测能够得出准确的结果。所有快速分子检测都具有极高的特异性,最大限度地减少了假阳性结果。假阳性结果的潜在危害包括:隔离未感染新冠病毒的人员、造成不必要的焦虑、延误对症状真正原因的进一步调查、对新冠病毒进行不必要的治疗、增加工作或学习的缺勤天数以及不必要的接触者追踪。快速核酸扩增检测(NAAT)的阳性结果通常无需通过标准实验室 NAAT 进行确认。此外,快速检测的汇总灵敏度为 96%,这意味着快速分子检测,尤其是 RT-PCR 检测,与标准实验室分子检测的性能相当。这表明,快速分子检测的阴性结果无需常规确认。
其他考虑因素
检测时间与症状出现时间的相对关系可能会影响快速和标准实验室核酸扩增检测(NAAT)的敏感性。目前关于快速 NAAT 在儿童中的表现数据有限。此外,无论采用快速 NAAT 还是标准 NAAT,具体的检测方法、样本采集部位、样本采集质量以及是否使用病毒转运培养基都可能影响检测性能。最后,目前尚无研究直接比较快速等温 NAAT 和快速 RT-PCR 检测的性能。
本建议的结论和研究需求
快速核酸扩增检测(NAAT)和标准实验室核酸扩增检测的特异性和灵敏度似乎相当。针对 SARS-CoV-2 和其他微生物的快速 NAAT 是医疗保健领域的一项重要进步,并为医疗保健服务开辟了新的途径。
建议5:单次核酸扩增检测与重复核酸扩增检测
建议 5 :IDSA 专家组建议对疑似感染 COVID-19 的有症状或无症状个体进行一次 NAAT 检测,如果其首次 NAAT 检测结果为阴性,则不应常规重复检测 (有条件建议,证据确定性非常低) 。
- 评论 :
- 专家组认为有症状的患者至少具有一种与 COVID-19 相符的最常见症状( 表 1 )。
- 虽然通常不建议在初次检测结果为阴性时进行重复检测,但在某些情况下,可以考虑进行重复检测。例如,如果出现新的或加重的与新冠肺炎相符的症状,且没有其他解释,则应考虑重复检测。此外,症状出现的时间也可能是需要重复检测的原因之一。样本采集不当可能导致假阴性结果,这也是需要重复检测的原因之一。
- 如果需要进行重复检测,一般应在初次检测后 24-48 小时进行,并且一旦初次 NAAT 结果为阴性。
证据概要
这些建议基于两项研究,其中 57 名患者的检测结果呈阳性,2041 名患者的检测结果呈阴性[88, 89]。在这些报告中,使用从有症状患者和症状状态未报告的患者身上采集的鼻咽拭子进行核酸扩增检测(NAAT)并重复检测。在接受重复检测的患者中,2%至 3.5%的患者在初次检测结果为阴性后一周内检测结果呈阳性。未发现评估重复检测对个体患者或人群结局的益处和危害的研究。鉴于缺乏对单次检测与重复检测影响的直接评估,专家组认为证据的总体确定性极低。
益处和危害
新冠病毒感染者若核酸扩增检测(NAAT)结果为假阴性,可能无法获得有效的治疗。被错误地诊断为未感染新冠病毒的有症状或无症状个体,可能构成在社区、医疗机构或人群聚集场所将 SARS-CoV-2 病毒传播给未感染者的风险。假阳性结果的潜在危害包括:隔离未感染新冠病毒的个体、造成不必要的焦虑、延误进一步的症状病因检查、给予不必要的新冠病毒治疗、增加缺勤或缺课天数以及不必要的接触者追踪。当新冠病毒感染的预检可能性为中等或高,但初始 NAAT 结果为阴性时,有时可能需要重复进行分子检测,以指导治疗或隔离。
其他考虑因素
考虑到疾病流行率越低,诊断试验的阴性预测值越高,因此考虑疾病流行率至关重要。也就是说,在疾病流行率低的地区,一次新冠病毒检测阴性结果的预测价值高于在疾病流行率高的地区。已发表的研究中使用了多种检测方法,这些方法目前也在临床实践中使用;研究假设所有检测方法的性能相当。研究仅使用了鼻咽拭子样本,并未直接评估这些发现对其他样本类型的适用性。第二次检测的诊断率可能受到症状持续时间和采样部位(包括下呼吸道样本)的影响。
本建议的结论和研究需求
在 SARS-CoV-2 RNA 检测结果为阴性后 7 天内重复检测很少出现阳性结果,但支持这一结论的证据质量极低。考虑重复检测时,应仔细评估样本采集的地点和质量。有必要开展进一步研究,评估在住院和门诊环境中,重复检测相对于症状出现时间的潜在益处和时机,以及对除鼻咽拭子以外的其他样本类型进行重复检测的价值。
建议 6:对接触过 SARS-CoV-2 的无症状个体进行核酸扩增检测
建议 6 :对于有临床或流行病学原因可能需要进行检测的个人,IDSA 专家组建议对已知或疑似接触过 COVID-19 的无症状个体进行 SARS-CoV-2 RNA 检测 (有条件建议,中等确定性证据) 。
- 评论 :
- 专家组承认目前缺乏证据支持对无症状感染者进行治疗,也未见获得紧急使用授权(EUA)批准的用于治疗无症状 COVID-19 的药物,但同时也承认,个别临床情况可能促使临床医生进行检测并考虑治疗。对于存在临床或流行病学原因可能需要进行检测的人员(例如,高危人群,如患有肺部疾病或免疫功能低下者,或与免疫功能低下者密切接触者),可考虑进行检测。检测应在暴露后至少 5 天进行。如果症状在 5 天内出现,暴露者应立即接受检测[3]。了解某人是否感染 SARS-CoV-2 有助于指导适当的隔离。是否对无症状感染者进行检测应取决于检测资源的可用性。本文中,已知暴露的定义为在 24 小时内与实验室确诊 COVID-19 患者密切接触至少 15 分钟。疑似暴露可能定义为在发生 COVID-19 疫情的集体场所(例如,长期护理机构或惩教机构、游轮、工厂)工作或居住。感染 SARS-CoV-2 的风险可能因暴露条件而异,例如暴露时间长短、室内或室外环境、是否经常佩戴口罩等。家庭成员接触者的风险可能尤其高。此建议的前提是暴露者未佩戴合适的个人防护装备 (PPE)。
证据概要
未发现直接证据评估对无症状个体进行检测与不进行检测的患者或人群结局。因此,专家组依据诊断试验准确性数据制定了此项建议。参考标准为两种以上标准核酸扩增检测(NAAT)(即快速 RT-PCR 和实验室 NAAT)的综合结果。本建议基于五项研究[21-25],共纳入 349 例阳性受试者和 530 例阴性受试者,这些研究均基于标准 NAAT。汇总敏感性为 97%(95% CI:93%至 99%),汇总特异性为 100%(95% CI:96%至 100%)(见图 s2a-s2b )。我们考虑了已知暴露史的无症状个体中 COVID-19 的患病率分别为 1%、5%和 10%。在这一患病率范围内,预测的假阳性结果为零,每 1000 人中预测的假阴性结果为 0 至 3 例(见表 7 )。由于间接性导致证据确定性降低,因此证据确定性为中等。间接性源于缺乏对接受检测者和未接受检测者之间的直接比较。此外,研究人群包括有症状者和无症状者。
益处和危害
对接触过或疑似接触过 SARS-CoV-2 的无症状人员进行检测,可以隔离检测结果呈阳性者。无论是在机构聚集性疫情还是更广泛的社区暴发中,隔离都有助于减少 SARS-CoV-2 的传播。阳性结果将强化隔离的重要性,并为接触者追踪、分组隔离或其他缓解策略提供信息。从已感染的接触者身上采集的核酸扩增检测(NAAT)结果出现假阴性可能造成潜在危害;这些人可能错误地认为自己未感染,从而在不知情的情况下将 SARS-CoV-2 传染给他人。一些检测结果呈阴性的人在接受检测时可能处于疾病的潜伏期。他们随后可能发展为活动性感染并开始排出病毒,但却错误地认为自己未感染。
其他考虑因素
对无症状接触者进行检测会产生相关费用;由于无论检测结果如何,仍可能需要隔离,因此此类检测可能会增加成本,而不会改变现有做法。目前数据有限,难以界定密切接触者或高风险暴露的定义。评估已知接触者的风险时,应考虑的因素包括暴露持续时间和指标病例的某些临床症状(例如咳嗽)。可与公共卫生部门协商,对特定暴露进行风险分层。目前尚不清楚对已知或疑似 COVID-19 病例的无症状接触者进行检测的最佳时机。对于持续暴露的家庭成员,何时进行检测或是否需要重复检测也变得复杂。
本建议的结论和研究需求
对于已知或疑似接触过病毒的无症状者,应与当地公共卫生官员协调进行检测。在需要了解无症状或症状前感染情况以确定后续医疗措施、评估家庭成员、集体居住场所或医院中其他易感人群风险的情况下,此项检测尤为重要。此外,还应特别关注在医疗机构中未采取适当个人防护措施而暴露于病毒的医护人员。
需要开展比较研究(最好是随机对照试验)以及针对无症状人群检测策略的成本效益分析。应研究对接触过新冠病毒的无症状个体进行检测的最佳时间和样本采集方法。此外,何为需要检测的暴露情况也需要进一步研究。目前尚不清楚早期诊断新冠病毒是否能提供治疗干预的机会,从而改变感染的最终进程(例如,预防重症肺炎)。如果证实如此,那么对接触过病毒的个体进行筛查就具有治疗干预的合理性。获益可能因接触者的基础疾病、免疫状态、年龄和疫苗接种情况,以及他们接触到的特定病毒变种和既往新冠病毒感染史(可能未知)而异。最后,随着新冠病毒病例数量和类型的变化,对无症状个体的检测建议也可能随之改变。
建议7:无症状个体中快速核酸扩增检测与实验室核酸扩增检测的比较
建议 7 :对于有临床或流行病学原因可能需要进行检测的个人,IDSA 专家组建议对已知接触过 SARS-CoV-2 感染的无症状个体使用快速或基于实验室的 NAAT 检测 (有条件建议,证据确定性中等) 。
- 评论 :
- 正确的样本采集和运输至实验室或检测点对于确保检测结果的质量至关重要; IDSA 网站提供相关资源。快速核酸扩增检测 (NAAT) 的定义各不相同;一些机构,包括美国 FDA,将周转时间≤30 分钟定义为快速 NAAT,而其他机构则使用≤60 分钟甚至更长的周转时间。此时间仅指检测时间(包括核酸提取),不包括样本采集到检测的时间或检测到报告的时间。快速检测通常操作步骤较少,并且可以在患者附近甚至床旁进行,由非实验室人员操作。快速检测方法包括快速 RT-PCR 和快速等温 NAAT。标准检测需要仪器和/或处理,通常必须在临床实验室由训练有素的实验室人员进行。
- 此建议仅适用于纳入研究中评估的检测方法。不同样本类型检测性能的差异可能很重要。所评估的检测方法采用了多种技术(例如,等温和非等温扩增),理论上可能会影响结果。关于核酸扩增检测(NAAT)在免疫功能低下或已接种疫苗者、既往感染过 SARS-CoV-2 者或感染不同 SARS-CoV-2 变异株者中的分析性能,目前数据有限。
证据概要
本建议参考了三项研究[85, 90, 91],这些研究共纳入 181 例阳性受试者和 3088 例阴性受试者,均采用了快速核酸扩增检测(NAAT)和实验室核酸扩增检测(NAAT)( 图 S16a-S16b )。本分析的参考检测为标准实验室核酸扩增检测。快速核酸扩增检测的汇总灵敏度为 88%(95% CI:81%至 92%),汇总特异性为 99%(95% CI:95%至 100%)。美国传染病学会(IDSA)专家组考虑了 1%、5%和 10%作为已知 SARS-CoV-2 暴露的无症状个体中 SARS-CoV-2 感染的患病率。在这些患病率下,每 1000 名受检者中假阴性人数为 1 至 12,假阳性人数为 9 至 10。由于存在无法解释的不一致性,以及使用实验室核酸扩增检测(NAAT)作为参考标准可能存在的偏倚风险,因此证据的确定性较低。(见表 8 )
益处和危害
快速检测的价值在于,理想情况下应在患者在场时完成检测,这样可以迅速做出关于治疗、隔离和接触者追踪的决定。快速检测可以减轻患者在等待检测结果期间的焦虑。快速获得结果可以减少对患者失访的担忧,并通常简化后续随访流程。
这项研究的重要发现是,检测周转时间与诊断检测准确性之间并无必然联系。所有快速核酸扩增检测(NAAT)均具有极高的特异性,最大限度地减少了假阳性结果。假阳性结果的潜在危害包括:隔离未感染 SARS-CoV-2 病毒的人员,这可能造成不必要的焦虑;可能导致不必要的 COVID-19 治疗;增加缺勤或缺课天数;以及浪费时间和精力进行接触者追踪。快速 NAAT 的阳性结果无需常规使用标准实验室 NAAT 进行确认。此外,快速检测的汇总灵敏度为 88%,表明快速 NAAT(尤其是 RT-PCR 检测)与非快速 NAAT 的性能相当,这意味着快速 NAAT 的阴性结果无需常规使用标准实验室 NAAT 进行确认。
其他考虑因素
关于快速核酸扩增检测(NAAT)在儿童中的应用数据有限。此外,无论检测是快速的还是标准的,具体的检测方法、采样部位、是否使用病毒转运培养基以及样本采集质量都可能影响检测结果。最后,目前尚无研究直接比较快速等温核酸扩增检测和快速逆转录聚合酶链式反应(RT-PCR)检测的性能。
本建议的结论和研究需求
快速核酸扩增检测(NAAT)和标准实验室核酸扩增检测的特异性相当。快速核酸扩增检测(尤其是 RT-PCR)和标准实验室核酸扩增检测的灵敏度也相似。针对 SARS-CoV-2 和其他微生物的快速核酸扩增检测是医疗保健领域的一项重要进步,并为医疗保健服务开辟了新的途径。
建议8:入院前对无症状个体进行核酸扩增检测
建议 8 :IDSA 专家组建议不要对无症状且无已知 COVID-19 接触史的住院患者进行常规 SARS-CoV-2 NAAT 检测(有条件建议,证据确定性非常低) 。
- 评论 :
- 这项建议的重要考量因素是,IDSA 专家组在文献回顾期间未能找到任何已发表的研究表明,入院前检测能够降低 SARS-CoV-2 在医护人员或其他患者之间的传播。现有证据均为间接证据,且仅评估了有症状患者或无症状患者联合检测中诊断试验的准确性。鉴于证据有限,专家组也考虑到了对所有计划入院患者进行检测的负担。最后,还应考虑其他有效的感染预防干预措施,例如使用个人防护装备和接种疫苗。
- 专家组承认,在某些情况下,入院前进行 NAAT 检测可能是有益的,例如入住多人病房;入住设有集体治疗区的病房,例如行为健康病房;或者入住正压病房或病房。
证据概要
我们未找到任何研究直接评估在非 COVID-19 相关诊断入院的患者中,入院前进行 SARS-CoV-2 核酸检测与不进行检测的策略。我们也未找到任何评估 SARS-CoV-2 病毒 RNA 检测在无症状个体中与综合参考标准相比的准确性研究。因此,我们将有症状和混合(有症状和无症状,或症状状态未明确)患者人群研究中报告的检测准确性应用于入院概率分别为 1%、5%和 10%的无症状患者人群。所使用的参考合并灵敏度为 97%(95% CI:93%至 99%),参考合并特异性为 100%(95% CI:96%至 100%)。(见图 s2a-s2b )。然而,这些检测准确率值,尤其是灵敏度值,可能高于无症状个体检测的真实准确率,因此代表的是最佳情况。如果参考值来自三项队列研究[92-94],这些研究对两种核酸扩增检测(NAAT)进行了直接比较,则在将单一 NAAT 与任何阳性检测结果进行比较时,灵敏度范围在 85%至 93%之间。现有证据的显著局限性导致基于非常严重的间接性和不一致性,检测的总体效果的确定性非常低。
益处和危害
尽管隔离和集中收治无症状 SARS-CoV-2 感染患者可能有助于降低医疗机构内 SARS-CoV-2 的传播,但尚无直接证据表明入院前对无症状感染者进行常规筛查能带来显著益处。相反,延迟入院会给医疗机构带来沉重的后勤和经济负担,并可能对患者造成伤害。在拥有大量多人病房的医疗机构、精神健康机构、正压病房(例如造血干细胞移植病房)或个人防护装备有限的情况下,尤其是在社区传播水平中等或较高时,筛查的益处可能更大。
其他考虑因素
鉴于有证据表明佩戴口罩和其他个人防护装备可以预防 SARS-CoV-2 的传播,并考虑到其他因素,例如私人病房的可用性以及患者和医护人员的疫苗接种情况,在入院前对无症状者进行常规筛查可能不会带来额外的好处。
本建议的结论和研究需求
对无症状个体进行常规入院前筛查可能不会比已采取的缓解措施(例如医护人员普遍佩戴口罩)带来额外益处。需要开展专门研究,探讨在不同情况下使用核酸扩增检测(NAAT)对无症状患者进行常规入院前筛查的潜在益处。
建议9:对接受手术的无症状个体进行核酸扩增检测
建议 9 :IDSA 专家组建议不要对无症状且未接触过 COVID-19 的个体进行常规 SARS-CoV-2 NAAT 检测,这些个体正在接受医疗或外科手术 (有条件建议,证据确定性非常低) 。
- 评论 :
- NAAT 用于检测 SARS-CoV-2 RNA 的存在,但这可能并不代表具有传染性的病毒。
- 已有大量报道指出,在呼吸道标本中检测到 SARS-CoV-2 RNA,但未发现传染性病毒。
- IDSA 专家组得出结论,根据非标准化的仪器信号值(例如循环阈值 (Ct) 值)来确定患者的 SARS-CoV-2 传染性的数据不足。
- 对于曾感染过 SARS CoV-2 的患者,决定何时进行手术必须权衡患者的风险与延迟或避免计划手术的风险,并且应考虑与患者相关的因素(例如,疫苗接种情况、症状状况、年龄)、与手术相关的因素(例如,紧急程度、手术是否产生气溶胶)以及手术区域的感染控制措施。
- 鉴于对于 SARS-CoV-2 感染检测呈阳性后不久接受大型手术的无症状者而言,缺乏不良预后的证据,因此在社区传播高峰期可以考虑进行检测。
- 在进行实体器官移植、造血干细胞移植或 CAR-T 细胞治疗之前,也可以考虑进行检测。
- 此建议适用于提供并严格遵守个人防护装备(PPE)等防护措施的场所。其他需要考虑的因素包括医护人员和患者的疫苗接种情况,以及患者在术前或术后是否会与其他患者同住一间病房。此建议基于社区的一般暴露情况,而非特定的已知暴露情况。
证据概要
我们未发现任何研究直接评估在医疗操作前对无症状个体进行 SARS-CoV-2 感染检测与不进行检测相比,能否降低 SARS-CoV-2 传播风险。我们也未发现任何研究直接评估 SARS-CoV-2 核酸扩增检测(NAAT)在接受医疗操作的无症状个体中的检测准确性。
我们检索到两项研究[95, 96],这两项研究均发现,在对未接受术前 SARS-CoV-2 核酸扩增检测(NAAT)的无症状患者进行上消化道或下消化道内镜检查后,医护人员或患者中几乎没有 SARS-CoV-2 感染病例。这两项研究均在 Omicron 变异株出现之前开展。在第一项研究[95]中,研究人员对 29 名在内镜中心每周至少工作 2 天、持续至少 6 个月的工作人员进行了 20 个月的随访,期间未对患者进行任何术前检测,结果显示 29 名工作人员中无一人感染 COVID-19。该团队的疫苗接种率为 97%。在第二项研究[96]中,研究人员回顾性分析了 214 例因不明原因接受内镜检查的患者,这些患者在术后接受了 SARS-CoV-2 检测,结果仅发现 1 例患者在术后 29 天 SARS-CoV-2 NAAT 检测呈阳性。
我们还检索到六项不同的研究[96-101],这些研究在内镜检查前对无症状患者进行了术前检测。在这些研究中,不到 1%的患者在术前 SARS-CoV-2 检测呈阳性,随后他们的手术被推迟。此外,在这些研究中,据报道,0-4%的医护人员在术后某个时间点 SARS-CoV-2 检测呈阳性。这些研究涵盖了疫情的不同阶段,报告的个人防护装备供应情况和疫苗接种情况也各不相同。
由于现有证据存在重大局限性,专家组一致认为,支持该建议的证据总体确定性非常低。
益处和危害
对无症状感染者进行筛查的潜在益处包括减少医护人员和其他患者接触 SARS-CoV-2 病毒的机会,从而降低 SARS-CoV-2 的传播。潜在危害包括不必要地延误患者的诊疗程序,以及医护人员可能因接触到在诊疗程序前检测呈阴性但随后检测呈阳性且具有传染性的患者而产生错误的自信。要求进行术前筛查的机构通常要求在预定诊疗程序前 72 小时内进行检测。缩短筛查窗口期或许能更准确地预测诊疗程序时的感染风险,但这对于大多数机构而言可能并不现实,尤其是在院外实验室进行检测的情况下。考虑到检测物流、供应链问题以及适用于无症状感染者的检测方法有限,在许多情况下,更广泛地使用即时核酸扩增检测(NAAT)也可能存在困难。
如果检测结果呈阳性,根据具体手术流程,在已采取其他风险缓解措施(包括医护人员接种疫苗和使用合适的个人防护装备)的情况下推迟手术,可能会对患者造成不必要的伤害,并且对降低首例患者的传播风险几乎没有影响。对于已从新冠肺炎中康复且不再具有传染性,但仍会排出可通过高灵敏度核酸扩增检测(NAAT)检测到的非活性 SARS-CoV-2 病毒的患者而言,情况尤其如此。专家组特别强调了重新安排手术的后勤保障问题以及延迟手术带来的额外风险。即使医护人员或其他患者感染了新冠肺炎,也很难将 SARS-CoV-2 的感染与无症状感染者联系起来,尤其是在社区传播水平较高的情况下。
其他考虑因素
专家组认识到,不同的操作可能带来不同的传播风险。虽然缺乏直接证据,但一项对 1990 年至 2010 年间 SARS 传播相关文献的系统性回顾显示,某些会产生气溶胶的操作会增加医护人员的传播风险。具体而言,研究人员发现气管插管的风险最高,其次是无创通气、气管切开术和人工通气。相比之下,研究人员发现其他插管、气管内吸痰、支气管镜检查、体液吸痰、雾化治疗、辅助氧气面罩或双水平呼吸面罩的使用和操作、除颤、胸外按压、鼻胃管插入或痰液收集等操作并未显著增加传播风险。研究人员强调,使用合适的个人防护装备(PPE)是重要的缓解因素,并且在他们的分析中,无法评估和排除因不遵守或不当使用 PPE 而导致的传播事件。
尽管证据有限,但目前一些专业医学协会建议在进行实体器官移植或细胞治疗(造血细胞移植或 CAR-T 细胞治疗)之前对无症状个体进行检测[102]。
本建议的结论和研究需求
根据专家组提供的证据,对于 SARS-CoV-2 感染概率极低的个体,常规术前筛查可能并无益处。在考虑术前筛查时,应考虑疫苗接种情况、合适的个人防护装备(PPE)的可用性以及手术风险评估等因素。开展比较这些风险和缓解措施的研究将有助于更明确地回答这个问题。
建议 10:对需要进行手术的 COVID-19 患者进行重复检测
建议 10 :IDSA 专家组建议不要对近期有 COVID-19 病史的患者在进行医疗或外科手术前常规重复进行 NAAT 检测 (有条件建议,证据确定性非常低) 。
- 评论 :
- NAAT 用于检测 SARS-CoV-2 RNA 的存在,但这可能并不代表具有传染性的病毒。
- 已有大量报道指出,在呼吸道标本中检测到 SARS-CoV-2 RNA,但未发现传染性病毒。
- 相反,IDSA 专家组未能找到确凿证据证明,NAAT 结果为阳性后出现阴性结果,就证明患者不再具有传染性。
- IDSA 专家组得出结论,根据 Ct 值结果,数据不足以确定患者是否具有 SARS-CoV-2 传染性。
- 对于曾感染过 SARS CoV-2 的患者,决定何时进行手术必须权衡患者的风险与延迟或避免计划手术的风险,并且应考虑与患者相关的因素(例如,疫苗接种情况、症状状况、年龄)、与手术相关的因素(例如,紧急程度、手术是否产生气溶胶)以及手术区域的感染控制措施。
证据概要
我们未发现任何研究直接评估对既往确诊 COVID-19 的患者进行 SARS-CoV-2 核酸扩增检测 (NAAT) 与不进行检测的策略。我们关注的以患者为中心的结局指标包括与 SARS-CoV-2 感染相关的并发症风险或不良手术结局,以及将病毒传播给医护人员和其他患者的风险。
我们检索到五项队列研究[103-107],这些研究探讨了接受手术的 SARS-CoV-2 感染者的预后。这些研究纳入的手术均为外科医生在手术室常规进行的手术,手术难度可能有所不同。部分研究将急诊手术排除在分析之外[106, 107],而其余研究则纳入了急诊和非急诊手术[103-105]。所有研究均将结局与 COVID-19 确诊后的时间进行关联分析。各研究对 SARS-CoV-2 感染的诊断标准不尽相同,从核酸扩增检测(NAAT)到胸部影像学检查加症状均有涉及。未发现重复检测策略。
疫情早期的数据表明,围手术期 SARS-CoV-2 核酸扩增检测(NAAT)阳性的患者术后并发症风险可能增加[103, 104]。患者的症状状况可能在其中发挥作用,有症状的患者并发症报告风险更高[105]。在 SARS-CoV-2 感染患者中,如果在确诊后 0-8 周内进行手术,并发症风险可能增加,但在 8 周后则不会[105-107]。接种疫苗者术后并发症风险可能降低[106]。相比之下,一项在本指南的文献综述完成后发表的研究(该研究纳入了 COVID-19 大流行早期的患者)发现,术后主要心血管事件的风险随着首次 SARS-CoV-2 检测结果呈阳性的时间而降低(调整后 OR [aOR],0.99 [SARS-CoV-2 感染诊断后每 10 天];95% CI,0.98-1.00;P = .006。)[108] 这种关联在至少接种过一剂 SARS-CoV-2 疫苗的患者中仍然成立。
这些研究均未探讨重复 SARS-CoV-2 分子检测的结果能否帮助预测近期有 SARS-CoV-2 感染史的患者术后并发症的风险。由于现有证据存在诸多局限性,IDSA 专家组一致认为,证据的总体确定性非常低。
益处和危害
SARS-CoV-2 感染,尤其是在疫情早期,与不良术后结局相关,包括血管血栓形成风险增加、胸外科手术患者插管时间延长以及死亡率升高[103, 109, 110]。IDSA 专家组未发现证据表明,对近期确诊 SARS-CoV-2 感染的患者重复进行核酸扩增检测(NAAT)有助于降低上述风险。检测的潜在危害包括:由于检测结果呈阳性而导致患者不必要的手术延误;或者,如果在护理检测结果呈阴性但仍具有传染性的患者时未采取适当的传播预防措施,则可能导致医护人员或其他患者感染。
其他考虑因素
没有任何。
本建议的结论和研究需求
目前关于近期感染 SARS-CoV-2 患者术后并发症的证据主要来源于基于时间的研究,且感染的定义各不相同。鉴于核酸扩增检测(NAAT)等分子检测方法已知存在长期阳性的情况,因此需要开展进一步研究,以探究分子检测结果与患者预后之间的相关性。
建议 11:使用核酸扩增检测(NAAT)解除 SARS-CoV-2 感染患者的隔离
建议 11: IDSA 专家组建议不要常规地对 COVID-19 患者重复进行 NAAT 检测以指导解除隔离 (有条件建议,证据确定性非常低) 。
- 评论 :
- NAAT 用于检测 SARS-CoV-2 RNA 的存在,但这可能并不代表具有传染性的病毒。
- 已有大量报道指出,在呼吸道标本中长期检测到 SARS-CoV-2 RNA,但未发现传染性病毒。仅凭 SARS-CoV-2 核酸扩增检测(NAAT)阴性结果就解除隔离,可能会不必要地延长隔离时间。
- 相反,IDSA 专家组未能找到确凿证据证明,NAAT 结果为阳性后出现阴性结果,就证明患者不再具有传染性。
- IDSA 专家组得出结论,根据 Ct 值结果,数据不足以确定患者是否具有 SARS-CoV-2 传染性。
证据概要
我们未发现任何研究直接评估通过检测 SARS-CoV-2 病毒与不检测病毒来解除患者隔离的策略。也没有任何研究纳入关键的患者结局指标,例如传播事件、解除隔离或重返工作岗位。
我们检索到四项队列研究[111-114],这些研究通过对患者进行连续检测,评估了 Omicron 系统应用前 SARS-CoV-2 核酸扩增检测(NAAT)阳性结果的演变过程。在一项针对美国国家橄榄球联盟(NFL)球员的研究中,最初 NAAT 检测呈阳性的球员中,146 人(84%)在第 10 天前检测结果转阴(定义为阴性结果或 Ct 值>35)[111]。在一项评估家庭传播的研究中,超过 50%接受连续 NAAT 检测的个体在第 20 天仍呈阳性[112]。在另一项研究中,一家 COVID 护理中心的 207 名门诊和住院患者中有 61 人(29%)的 NAAT 检测结果在第 15-30 天仍呈阳性[113]。一项涉及家庭和非家庭接触者的研究指出,RNA 分子检测阳性的平均持续时间为 14.6 天[114]。两项研究[112, 114]报告称,核酸扩增检测(NAAT)阳性持续时间始终长于病毒培养阳性持续时间。所有研究在研究人群、疫情的不同阶段、病毒变异株以及参与者的疫苗接种情况方面均存在异质性。由于现有证据存在显著局限性,IDSA 专家组一致认为,证据的总体确定性非常低。
风湿病学综述
在七项风湿病患者的研究中,SARS-CoV-2 感染的患病率介于 0.2%至 47.2%之间(中位数为 0.8%)。住院率介于 58.5%至 70.0%之间(中位数为 68.8%,四项研究),重症监护室入院率为 3.4%至 9.8%(中位数为 5.9%,三项研究),死亡率介于 0.0%至 26.3%之间(中位数为 9.8%,七项研究)。我们检索到三项回顾性队列研究,比较了患有和未患有风湿病的患者以及正在接受和未接受风湿病治疗的患者的 COVID-19 预后[150, 160, 161]。总体而言,风湿病的存在或其治疗与 COVID-19 患者的不良预后之间无关联。
益处和危害
使用核酸扩增检测 (NAAT) 解除患者隔离的潜在益处在于,它能确凿地证明患者不具有传染性。然而,目前尚无此类确凿证据。使用 NAAT 解除患者隔离的潜在危害包括不必要地延长隔离期及其相关后果(例如,不必要的缺勤、缺学或缺席娱乐活动)。此外,还会产生不必要的经济成本,这些成本也应予以考虑。
其他考虑因素
解除隔离的决定需要评估该人员的传染风险。虽然病毒培养检测到的具有复制能力的病毒有时被用作传染性病毒的替代指标,但已知病毒培养对 SARS-CoV-2 感染的诊断敏感性低于核酸扩增检测(NAAT),且 SARS-CoV-2 的病毒培养方法尚未标准化。NAAT 检测结果呈阳性的时间比病毒培养结果长数天至数周。除了是否存在具有复制能力的病毒外,还有许多因素会影响传播风险,包括指标病例及其接触者的免疫状态和疫苗接种史,以及是否佩戴单向或双向口罩;暴露时间的长短以及暴露场所的通风情况。在户外散步时,即使两名佩戴口罩的人之间存在具有复制能力的病毒,其感染风险也远低于两人在通风不良的房间内不戴口罩相遇的情况。此外,虽然在 NAAT 结果呈阳性后出现阴性结果似乎与病毒清除和不再具有传染性相关,但这种“治愈测试”的概念尚未得到证实。
本建议的结论和研究需求
缺乏传染性的金标准是评估任何用于检测传染性的诊断测试方法的主要障碍。开发传染性的实验室替代指标和治愈试验(即非传染性试验)将具有重要价值。
建议12:居家分子检测
建议 12 :IDSA 专家组既不建议支持也不反对 SARS-CoV-2 的家庭检测。(证据不足)。
- 评论 :
- 专家组将时效性手术定义为需要在三个月内完成的、具有医学必要性的手术 。
- 理想情况下,测试应尽可能接近计划手术的时间进行(例如,在 48-72 小时内)。
- 为减少潜在的不良后果,对于 SARS-CoV-2 检测呈阳性的患者,应考虑推迟非紧急手术。
- 在个人防护装备(PPE)供应有限的情况下,对于这些操作中会产生气溶胶的部分,是否使用 PPE 的决定可能取决于检测结果。然而,存在假阴性检测结果的风险,因此,那些将与上呼吸道密切接触/暴露的人员(例如,麻醉人员、耳鼻喉科手术人员)应谨慎行事。
- 是否对无症状患者进行检测将取决于检测资源的可用性。
- 该建议并未解决患者在一段时间内需要接受多次手术时进行重复检测的必要性。
证据概要
我们未发现任何研究直接比较居家检测策略与标准实验室核酸扩增检测(NAAT)在 SARS-CoV-2 检测中的准确性。“居家检测”的定义是指研究作者声明患者在家中进行检测。我们仅发现一项研究[64]使用 SARS-CoV-2 NAAT 评估了居家检测。该研究报告的结果为诊断准确性。在该研究中,医护人员在门诊医疗机构采集鼻咽拭子样本并进行检测。患者在医护人员采集样本并检测后的 1 天内在家中采集了第二个咽拭子样本。以医护人员采集的鼻咽拭子样本检测结果作为参考检测结果时,居家检测的敏感性为 28/35(80.0%),特异性为 140/143(97.9%)。由于未考虑其他因素(例如采样部位),因此难以单独评估居家检测的效果。
益处和危害
目前支持居家核酸扩增检测(NAAT)SARS-CoV-2 的证据尚不足以得出关于该方法益处或危害的结论。主要担忧在于居家采样是否会导致检测灵敏度降低。
其他考虑因素
尽管市面上已有非处方家用分子检测试剂盒,但其单次检测费用通常高于抗原检测;部分家用分子检测试剂盒还需要额外购买读数仪[9]。这些操作上的挑战和成本增加,使得家用分子检测的益处受到质疑,尤其是在与便捷且成本更低的家用抗原检测进行比较时。
本建议的结论和研究需求
如果人们对居家 SARS-CoV-2 分子检测的需求增加(例如,如果发现新的病毒变种需要进行广泛的居家采样),并且样本类型、快速运输和/或居家检测及结果的后勤挑战能够得到解决,那么研究需要仔细评估这种方法与在医疗机构中采集和检测样本的准确性。
讨论
用于检测 SARS-CoV-2 核酸的分子检测已成为确诊 COVID-19 的金标准技术。尽管美国在疫情初期曾因检测资源有限而受到阻碍,但目前市面上已有超过 275 种不同的 SARS-CoV-2 分子检测方法,包括实验室检测、快速检测、即时检测和非处方家用检测,SARS-CoV-2 核酸扩增检测(NAAT)已在美国大部分地区普及。大多数检测方法已获得美国 FDA 的紧急使用授权(EAU);迄今为止,仅有一种分子检测方法获得了全新的 510(k)许可[115],这是 FDA 批准体外医疗器械的常规途径。尽管 SARS-CoV-2 NAAT 目前仍处于 EAU 状态,但它们已展现出高度的准确性和可重复性,使得诊断检测在 COVID-19 患者的临床管理以及指导旨在遏制疫情的公共卫生应对措施中发挥着至关重要的作用。尽管美国卫生与公众服务部计划于 2023 年 5 月 11 日结束联邦新冠肺炎公共卫生紧急状态[116],但尚未发布类似声明终止 SARS-CoV-2 诊断测试的独立紧急使用授权(EUA),预计该授权在此日期之后仍将继续有效[117]。如果 EUA 声明终止,将在联邦公报上发布提前通知,这将启动向正常运营的过渡程序。
通过紧急使用授权(EUA)批准 SARS-CoV-2 诊断测试可能间接影响了诊断测试的建议。EUA 要求向 FDA 提交分析性能数据,但不需要临床性能数据。或许正是由于这些要求,IDSA 专家组发现报告测试临床性能的研究很少;该指南中的大多数建议都基于诊断测试的准确性。衡量诊断测试准确性的指标包括灵敏度(即测试正确识别感染者的能力)和特异性(即测试正确识别未感染者的能力)。测试的阳性预测值和阴性预测值对于解释测试结果也至关重要。预测值的计算需要 SARS-CoV-2 感染的流行率或检测前概率信息。然而,在实践中,COVID-19 在社区的真实流行率可能难以确定,并且在检测资源有限或检测结果未上报公共卫生机构时可能被低估。考虑到这些复杂性,IDSA 专家组根据现有文献和公共仪表板,在我们的分析中对患病率/检测前概率以及检测灵敏度和特异性进行了不同的估计,以反映临床实践中可能遇到的情况。
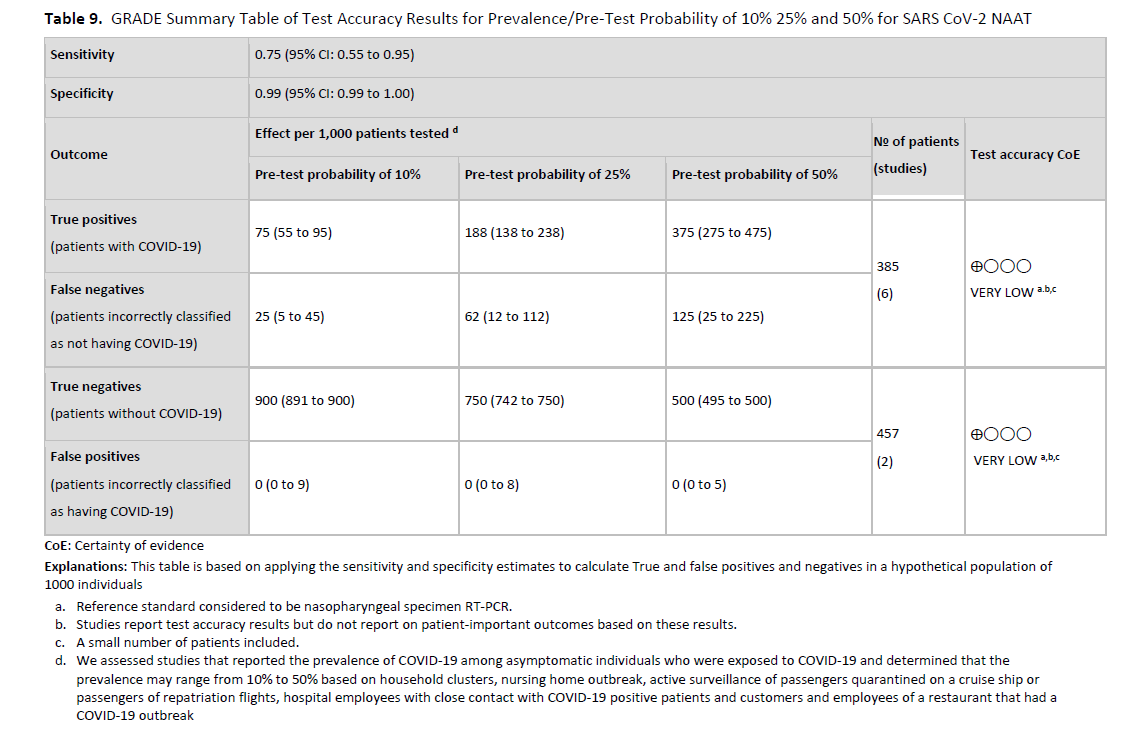
与 2021 年发布的第二版指南相比,目前第三版 IDSA 关于 SARS-CoV-2 分子诊断检测指南所依据的已发表同行评审研究数量显著增加。文章数量的增加使得专家组能够从文献综述中排除未经同行评审的预印本,从而提高了部分建议的证据确定性。例如,2021 年,对于疑似 COVID-19 症状患者推荐进行核酸扩增检测(NAAT)的证据确定性被认为极低,而如今则为中等。尽管如此,本指南中的大多数建议仍为条件性建议,其证据确定性极低或较低。尤其缺乏或质量较差的证据支持儿童、免疫功能低下者、既往接种过 SARS-CoV-2 疫苗或感染过 SARS-CoV-2 的人群以及感染新型 SARS-CoV-2 变种(如 Omicron)的人群进行检测的证据。专家组还认识到其他研究需求,包括确定一种可用于指导有症状或无症状 COVID-19 患者解除隔离的传染性实验室标志物,以及研究在住院时或进行内科或外科手术前进行无症状 SARS-CoV-2 感染检测的价值。此外,还需要更多关于居家检测准确性以及除鼻咽拭子以外的其他样本来源检测的数据。理想情况下,应采用明确的参考标准作为检测比较的基准,通过前瞻性多中心研究来确定临床检测的性能。 表 9 概述了解决 COVID-19 诊断知识方面最紧迫的差距所需的临床研究类型。
结论
指南制定小组采用严谨的方法,对现有诊断文献进行批判性评估,并更新了 SARS-CoV-2 分子检测建议。大多数建议的证据仍然匮乏或质量较低。基于中等确定性的证据,IDSA 小组建议对所有疑似 COVID-19 的症状患者进行核酸扩增检测(NAAT)。IDSA 小组还建议对医护人员或患者采集的鼻咽或其他上呼吸道标本进行一次检测,而非重复检测。此外,当检测结果对隔离/检疫/个人防护装备(PPE)的使用产生重大影响时,建议对部分无症状患者进行检测。IDSA 小组不建议在无症状患者住院或接受医疗/外科手术前进行常规 NAAT 检测,但小组也承认,在个人防护装备有限、患者必须入住半私人或多人病房、精神健康机构、实体器官或造血干细胞移植前或社区传播水平较高的情况下,进行检测可能是有益的。鉴于已知 COVID-19 患者体内病毒 RNA 会持续脱落,而脱落的病毒可能并非活病毒,且缺乏证据表明阴性核酸扩增检测(NAAT)结果总是与零传播风险相关,专家组建议不要重复进行 NAAT 检测来指导解除隔离。由于证据不足,专家组无法就居家检测提出建议。未来 COVID-19 诊断研究的关键要素包括:使用定义明确的参考标准,并详细描述样本类型、采集方法以及在症状出现或接触实验室确诊病例后的时间范围。
笔记
致谢
专家组感谢美国传染病学会(IDSA)对指南制定工作的支持,尤其感谢 IDSA 理事会执行委员会以及 IDSA 工作人员 Dana Wollins、Genet Demisashi、Sheila Tynes、Hannah Rehm 和 Imani Amponsah 在整个指南制定过程中给予的持续支持。专家组也对美国卫生经济学会(SHEA)、美国传染病学会(PIDS)和美国微生物学会(ASM)的成员表示感谢,感谢他们提供的周到而全面的审阅意见。
财政支持
本项目部分资金来源于与美国疾病控制与预防中心 (CDC) 的合作协议(拨款编号 6 NU50CK000477-04-01)。CDC 是美国卫生与公众服务部 (HHS) 下属机构。本指南的内容并不一定代表 CDC 或 HHS 的政策,也不应被视为联邦政府的认可。
利益冲突摘要
以下列表显示了已向美国传染病学会 (IDSA) 报告的内容。为确保完全透明,IDSA 要求全面披露所有关系,无论其是否与指南主题相关。此类关系是否构成潜在利益冲突的评估,由审查流程决定,该流程包括董事会联络员对标准与实践指南委员会的评估,以及必要时由利益冲突 (COI) 和伦理委员会的评估。对已披露关系是否存在潜在利益冲突的评估,基于财务关系的相对重要性(即金额)和关系的相关性 (即独立观察者在多大程度上可能合理地将该关联解读为与所考虑的主题或建议相关)。读者在审阅披露列表时应注意这一点。MH 担任赛诺菲临床裁决小组的成员;接受美国疾病控制与预防中心 (CDC) 和 CDC 基金会的研究资助;担任美国医疗保健流行病学学会 ( SHEA ) 董事会成员和 SHEA 教育与研究基金会主席;还从 Sage、Medline 和 Molnylycke 获得了其他编号;并担任 IDSA 诊断委员会主席 。KH曾担任 Quidel、BioFire、辉瑞和武田的顾问;从 Quidel、辉瑞和武田获得其他资助;曾任美国微生物学会 (ASM) 编辑和临床与实验室标准协会抗真菌委员会成员;获得美国国立卫生研究院 (NIH) 的研究资助;曾任美国内科医学委员会考试委员会成员和《开放论坛传染病 》 副主编。JE 担任赛诺菲巴斯德、辉瑞和阿斯利康的顾问;担任 Meissa Vaccines 的顾问;获得美国疾病控制与预防中心 (CDC)、辉瑞、Brotman Baty 研究所、默克、Novavax、葛兰素史克和阿斯利康的研究资助;曾担任梯瓦制药的顾问;曾任儿科传染病学会 (PIDS) 出版委员会和移植传染病委员会成员。 ML 担任赛诺菲、Seqirus、Medicago、葛兰素史克、强生、Novavax、辉瑞、MD Brief 的顾问;接受加拿大卫生研究院、世界卫生组织(WHO)、英国医学研究理事会的研究经费;接受赛诺菲提供的疫苗实物供应;因就机构和工作场所疫苗政策提供专家证词而获得报酬;曾担任康希诺生物的数据安全监测委员会(DSMB)成员和默克公司的顾问。R .P 拥有已颁发的百日咳杆菌/副百日咳杆菌 PCR 专利、三星向梅奥诊所支付专利费的超声处理装置/方法专利以及已颁发的抗生物膜物质专利;担任 PhAST、Torus Biosystems、Day Zero Diagnostics、Mammoth Biosciences、Netflix、雅培实验室、牛津纳米孔技术公司、CARB-X、Qvella 和 HealthTrackRx 的顾问;获得 NBME、UpToDate 和传染病委员会复习课程的其他编号;获得 CD Diagnostics、默克、和记黄埔生物膜医疗解决方案、Accelerate、ContraFect、TenNor Therapeutics Limited、盐野义制药、美国国立卫生研究院、BIOFIRE、Adaptive Phage Therapeutics、美国国家科学基金会和美国国防部的资助;并曾担任 Curetis、Specific Technologies、NextGen Diagnostics、Pathoquest、Selux Diagnostics 和 1928 Diagnostics 的顾问。SS 是循证基金会的董事会成员,并从循证基金会获得证据审查、方法学支持和教学方面的酬金;担任美国胃肠病学会 (AGA) 指南专家组成员;并获得美国退伍军人事务部证据综合计划的研究经费。YFY 是循证基金会的董事会成员;并从循证基金会、AGA 和临床与经济评价研究所 (ICER) 获得证据审查、方法学支持和教学方面的酬金;担任循证基金会和美国 GRADE 网络的董事;并曾担任 ICER 独立评估委员会成员。R .M 担任循证基金会理事会成员,并因循证基金会提供的证据审查、方法学支持和教学工作而获得酬金 。MHM 担任循证基金会理事会成员,并因循证基金会提供的证据审查、方法学支持和教学工作而获得酬金;同时,她还从医疗保健研究与质量署、内分泌学会和血管外科协会获得研究经费;曾获得美国血液学会和世界卫生组织的研究经费;并曾担任世界卫生组织的指南方法学家 。AB 曾获得 ICER 的酬金。RAM 担任循证基金会理事会成员,并因循证基金会提供的证据审查、方法学支持和教学工作以及参加 ICER 的委员会会议而获得酬金; 她还从美国国立卫生研究院、世界卫生组织、美国风湿病学会、美国血液学会和勃林格殷格翰公司获得研究经费;同时,她还担任 ICER 中西部比较效果公共咨询委员会主席。担任改善全球肾脏病预后工作组方法委员会委员;担任加拿大肾脏病学会临床指南委员会委员;曾任美国内科医师学会(ACP)临床指南委员会委员。所有作者均已提交 ICMJE 利益冲突披露表。编辑认为与稿件内容相关的利益冲突均已披露。其他所有作者均声明无潜在利益冲突。
IDSA 免责声明
必须认识到,指南并非总能考虑到患者个体差异。指南是对当前科学和临床信息的评估,旨在提供教育服务;它们并非持续更新,也可能无法反映最新证据(新的证据可能在信息制定到发布或被阅读之间出现);不应被视为涵盖所有适当的治疗方法和护理方法,也不应被视为护理标准的声明;指南不强制要求任何特定的医疗方案;也不旨在取代医生对特定患者或特殊临床情况的判断。是否遵循指南以及遵循的程度完全出于自愿,最终是否应用指南应由医生根据每位患者的具体情况决定。尽管美国传染病学会 (IDSA) 尽一切努力提供准确、完整和可靠的信息,但这些指南“按原样”提供,不作任何明示或暗示的保证。 IDSA(及其官员、董事、成员、员工和代理人)对因这些指南或依赖所提供的信息而产生的任何损失、损害或索赔,包括直接、特殊、间接或后果性损害,不承担任何责任。
本指南为美国传染病学会 (IDSA) 的专有财产,受版权保护。版权所有 © 2023 美国传染病学会。保留所有权利。未经 IDSA 事先书面许可,不得以任何形式或任何方式(包括复印、录音或其他电子或机械方法)复制、分发或传播本指南的任何部分。仅允许医生和医疗保健提供者在其专业实践和临床决策中复制和使用本指南。任何个人或实体均无权出售、分发或修改本指南,或制作衍生作品或将其纳入任何产品(包括但不限于临床决策支持软件或任何其他软件产品),且必须事先获得 IDSA 的书面授权。除上述许可外,任何希望以任何方式使用本指南的个人或实体必须联系 IDSA 并获得批准,并遵守第三方使用条款和条件,尤其是在任何软件产品中使用本指南时。
参考
Hits: 7