Contents
Comparison of protection against mpox following mRNA or modified vaccinia Ankara vaccination in nonhuman primates
突出
摘要
图形摘要
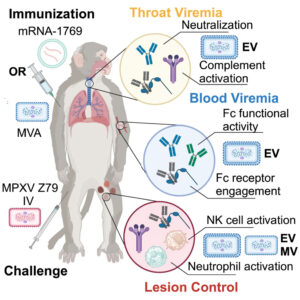
关键词
介绍
结果
基于mRNA的疫苗和MVA疫苗在致死性NHP mpox病毒感染模型中的功效
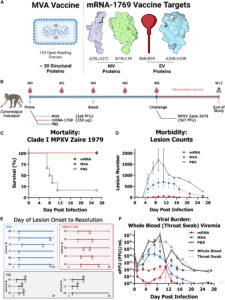

跨疫苗模式的不同结合和中和抗体反应


不同疫苗形式的抗体Fc-效应子谱不同


抗体与抗病毒控制和损伤预防相关


讨论
研究的局限性
资源可用性
铅接触
材料可用性
数据和代码可用性
感谢
作者投稿
利益申报
STAR★方法
关键资源表
| 试剂或资源 | 来源 | 标识符 |
|---|---|---|
| 抗体 | ||
| 抗豚鼠补体C3 | MP生物医学 | Cat # MP0855385RRID AB _ 2334913 |
| 单克隆抗体,抗痘病毒L1 | USAMRIID | 7D11 |
| 抗CD66b细胞蓝 | 生物遗传 | 目录号305112;RRID AB _ 2563294 |
| 单克隆抗体,抗痘病毒A33 | Mucker等人。52 | C6C |
| 单克隆抗体,抗痘病毒B5 | Mucker等人。52 | C8a |
| 抗CD107a BV605(克隆H4A3) | 生物遗传 | 目录号328634;RRID AB _ 2563851 |
| 抗CD56抗原提呈细胞(克隆MEM-188) | 生物遗传 | 目录号304610;RRID AB _ 314452 |
| 抗CD3 APC-Cy7(克隆UCHT1) | 生物遗传 | 目录号300426;RRID: AB_830755 |
| 抗MIP1b-BV421(克隆D21-1351) | BD生物科学 | 目录编号562900;RRID AB _ 2737877 |
| 抗IFNg-PE(克隆B27) | 生物遗传 | 目录编号506507;RRID AB _ 315440 |
| 山羊反人类 | 适马·奥尔德里奇 | 目录编号401954;RRID: AB_212016 |
| 抗恒河猴IgG-PE | 南方生物技术公司 | 目录编号6200-09;RRID AB _ 2796270 |
| 抗恒河猴IgA-生物素(克隆10F12) | NHP试剂资源 | 目录号PR-0126;RRID AB _ 2819304 |
| 抗恒河猴IgG 1-生物素(克隆7H11) | NHP试剂资源 | 目录号PR-7116;RRID AB _ 2819311 |
| 抗恒河猴IgG 2-生物素(克隆dio) | NHP试剂资源 | 目录号PR-0003;RRID AB _ 2895608 |
| 抗恒河猴IgG 3-生物素(克隆tria) | NHP试剂资源 | 目录号PR-0006;RRID AB _ 2895616 |
| 抗恒河猴IgG 4-生物素(克隆7A8) | NHP试剂资源 | 目录号PR-7186;RRID AB _ 2819323 |
| 细菌和病毒菌株 | ||
| 1979年扎伊尔第一期MPXV(v 79-I-005) | Mucker等人。53 | 不适用的 |
| 美国IIA分会第十五届会议,2003年 | Likos等人。54 | USAMRIID |
| 重组痘苗病毒株WR-GFP | 厄尔等人。55 | 尼亚伊德 |
| 重组MPXV-GFP | 弗雷恩等人。20 | 尼亚伊德 |
| 痘苗病毒,WR株(BEI NR-55) | Mudhasani等人。56 | 生物防御参考材料库 |
| MVA改良安卡拉痘苗病毒 | 怀亚特等人。34 | 不适用的 |
| 兔痘病毒,乌特勒支(ATCC VR1591) | Mudhasani等人。56 | 生物防御参考材料库 |
| 骆驼痘病毒,索马里株 | Smee等人。57 | USAMRIID |
| 莫斯科鼠痘病毒 | 贝资源 | 类别编号VR-1374 |
| 生物样本 | ||
| 人类补体 | 雪松烷 | Cat# CL6600 |
| 豚鼠补体 | 雪松烷 | 类别编号CL5000 |
| 化学品、肽和重组蛋白 | ||
| 正痘病毒mRNA-LNP疫苗 | 弗雷恩等人。20 | mRNA-1769 |
| Magpix痘苗病毒和MPXV抗原 | 胡珀等人。14,15还有赫罗等人。19 | A27/A29、A33/A35、B5/B6和L1 |
| VACV、MPXV和VARV重组蛋白 | 弗雷恩等人。20 | A27/A29/A31、A33/A35/A36、B5/B6/B7和L1/M1/M1 |
| 恒河猴Fcγ受体IIa-生物素 | 中国生物 | 目录号90016-K49H-B |
| 恒河猴Fcγ受体IIIa-生物素 | 中国生物 | 目录号90013-C27H-B |
| 关键商业分析 | ||
| xMAP耦合套件 | Luminex | 目录号4050016 |
| TaqPath 1步RTqPCR主混音 | ThermoFisher科技公司 | 目录号A15299 |
| 荧光微球中性链亲和素标记的微球 | 英杰公司 | 目录号F8776 |
| 存放的数据 | ||
| 数据可用性 | 门德利数据 | https://doi.org/10.17632/7pwgvpwf9b.2 |
| 代码可用性 | 芝诺多 | https://doi.org/10.5281/zenodo.12865619 |
| 实验模型:细胞系 | ||
| Vero E6 | ATCC | 目录号CRL-1586;RRID: CVCL_0574 |
| HEK293T | ATCC | 目录号CRL-3216;RRID: CVCL_0063 |
| Vero 76 | ATCC | 目录号CRL-1587;RRID: CVCL_0603 |
| 海拉·S3 | ATCC | Cat # CCL2.2RRID CVCL _ 0058 |
| 实验模型:生物体/菌株 | ||
| 食蟹猴(食蟹猴) | 全球灵长类公司 | 不适用的 |
| 寡核苷酸 | ||
| MPXV qRT-PCR正向引物 | 5 ‘-ctcattgattttcgcgggata | MPOX-F3L-F290 |
| MPXV qRT-PCR反向引物 | 5 ‘-acgatactcctctmgttggtc | MPOX-F3L-R396a |
| MPXV qRT-PCR探针 | FAM-CATCAGAATCTGTAGGCCGT-MGBNFQ) | MPOX-F3L-p333 |
| 软件和算法 | ||
| 制图板棱镜 | GraphPad软件有限责任公司 | 版本9.4 |
| 流动作业 | BD科学 | 不适用的 |
| Flexmap 3D | Luminex | 不适用的 |
实验模型和研究参与者详情
非人灵长类动物
细胞
病毒
方法详细信息
疫苗组合物
非人灵长类动物的疫苗接种
非人灵长类动物的损伤MPXV模型
传染性病毒滴定
MPXV核酸的定量
Luminex分析
MAGPIX和重组抗原
裂解MVA酶联免疫吸附试验
痘病毒MV型PRNT
痘病毒EV型的预防
表达GFP的VACV和MPXV中和
抗体依赖性补体沉积
抗体依赖性细胞吞噬作用
抗体依赖性中性粒细胞吞噬作用
抗体依赖性NK细胞激活
量化和统计分析
疫苗签名的无监督聚类
相关分析
相关网络分析
参考
J. Infect. Dis. 1979; 140:440-441
Bull. World Health Organ. 1980; 58:165-182
Proc. Natl. Acad. Sci. USA. 2010; 107:16262-16267
N. Engl. J. Med. 2023; 388:2434-2443
MMWR Morb. Mortal. Wkly. Rep. 2023; 72:559-563
MMWR Morb. Mortal. Wkly. Rep. 2023; 72:553-558
EClinicalmedicine. 2024; 68, 102407
Nat. Med. 2023; 29:748-752
Annu. Rev. Med. 2022; 73:17-39
Nat. Rev. Drug Discov. 2018; 17:261-279
Virology. 2003; 306:181-195
J. Virol. 2004; 78:4433-4443
J. Virol. 2005; 79:13454-13462
Virol. J. 2011; 8:441
Nat. Med. 2005; 11:740-747
J. Immunol. 2006; 177:2552-2564
Sci. Transl. Med. 2023; 15, eadg3540
Signal Transduct. Target. Ther. 2023; 8:172
MMWR Morb. Mortal. Wkly. Rep. 2022; 71:1560-1564
Virology. 1998; 244:365-396
Vaccine. 2020; 38:6007-6018
J. Comp. Pathol. 2013; 148:6-21
Future Virol. 2013; 8:129-157
J. Virol. 2009; 83:1201-1215
Cell. 2024; 187:1363-1373.e12
Cell Host Microbe. 2023; 31:937-948.e4
PLoS Pathog. 2020; 16, e1008505
BMC Infect. Dis. 2022; 22:928
Vaccine. 2007; 25:1513-1525
Proc. Natl. Acad. Sci. USA. 2004; 101:4590-4595
Eurosurveillance. 2022; 27, 2200894
Lancet Infect. Dis. 2023; 23:1216-1218
N. Engl. J. Med. 2020; 383:2603-2615
N. Engl. J. Med. 2020; 383:1920-1931
Front. Microbiol. 2023; 14, 1255935
Lancet. 2022; 400:661-669
PLoS Pathog. 2015; 11, e1004904
Cell. 2016; 167:684-694.e9
Emerging Infect.Dis. 2024; 30:172-176
Euro Surveill. 2024; 29, 2400106
Science. 2021; 374, abm0829
J. Virol. 2022; 96, e01504-21
N. Engl. J. Med. 2020; 383:1782-1784
N. Engl. J. Med. 2007; 357:1903-1915
Lancet Infect. Dis. 2023; 23:621-633
Immunity. 2024; 57:587-599.e4
Cell. 2022; 185:113-130.e15
Virology. 2020; 544:42-54
Viruses. 2022; 14, 1741
J. Gen. Virol. 2005; 86:2661-2672
J. Virol. 2003; 77:10684-10688
Microbiol. Spectr. 2024; 12, e03586-23
Antimicrob. Agents Chemother. 2002; 46:1329-1335
Antiviral Res. 2002; 54:113-120
Viruses. 2022; 14, 1993
Virology. 2000; 266:329-339
J. Immunol. Methods. 2019; 473, 112630
J. Immunol. Methods. 2019; 471:46-56
Nat. Commun. 2022; 13, 3571
Hits: 98
相关文章:
- Mpox正在迅速蔓延。以下是研究人员竞相回答的问题
- 天花的终结是…mpox的开端
- 从天花到mpox:根除病毒的惊人成本
- 潜在的单剂量天花和Mpox疫苗进展
- Bavarian Nordic宣布推出猴痘疫苗的商业化
- 猴痘病毒:新数据表明,危险毒株获得通过性行为传播的能力
- Jynneos 估计显示对 mpox 有很强的保护作用
- 接种 2 剂 JYNNEOS 疫苗暴露前后的猴痘病毒感染——美国
- 世界卫生组织宣布新的Mpox爆发为全球公共卫生紧急事件
- 世卫组织寻求扩大mpox诊断;FDA批准ACAM2000用于mpox预防
- 疫苗概况:mpox
- 改良安卡拉-巴伐利亚北欧痘苗疫苗对mpox感染的有效性:一项目标试验的模拟
- 猴痘临床表现、诊断方法和治疗策略
- 刚果的猴痘危机
- 后天花时代猴痘的崛起
Powered by YARPP.
