Chapter 20: Japanese encephalitis
第20章:日本脑炎
2024年2月20日
日本脑炎
疾病
日本脑炎(JE)是一种由黄病毒引起的蚊媒病毒性脑炎。它是亚洲儿童脑炎的主要原因。全球JE发病率未知,然而,在有JE风险的24个国家中,估计每年发生68,000例临床病例(世界卫生组织,2019年)。
它在农村地区流行,特别是在水稻种植和养猪业并存的地方流行病发生在农村地区,偶尔发生在城市地区。出现最高的传播速率,蚊子最活跃的雨季期间和刚过。然而,季节性的各国内部和每年的模式都有所不同,在正常的季节性高传播期之外也报告了JE病例。这种疾病不是在人与人之间传播。
潜伏期为4至14天。大多数JE病毒感染是轻微或无症状的。估计每250例感染中约有一例会导致严重疾病(快速发病
高烧、头痛、颈部僵硬、定向障碍、昏迷、癫痫发作)。有症状者的病死率可高达30%。据报道,20-30%的幸存者有永久性后遗症(智力、行为和其他神经系统问题,如瘫痪、帕金森样运动障碍、反复发作或不能说话)(世界卫生组织,2019年)。
疾病的历史和流行病学
日本早在1871年就记录了疫情;日本第一次大流行是在描述于1924年,涉及6000个案例。JE教遍及整个亚洲,但却是全国性的20世纪60年代的免疫运动和城市发展导致日本、韩国、新加坡和台湾几乎消灭了JE病毒。然而,JE在亚洲其他大部分地区仍然流行:中国(不包括台湾)占病例的50%以及其他人, 2011).2022年,澳大利亚大陆首次报告JE疫情(澳大利亚政府,2023年)。
该病毒是在20世纪30年代分离出来的,第一批灭活的鼠脑衍生疫苗也是在同一十年生产的。
JE在英国旅行者中很少见,但2014/2015年诊断出三例病例,导致严重的神经疾病和长期后遗症。这些旅行者都没有接种过JE疫苗,尽管有迹象表明他们接种过疫苗以及其他人, 2019).
日本脑炎疫苗接种
目前有一种被推荐在英国使用的许可疫苗——IXIARO®。IXIARO®在英国获得许可,适用于两个月及以上的个人。
IXIARO®是一种在Vero细胞中生产的灭活疫苗,吸附在氢氧化铝佐剂上以提高其免疫原性。由于疫苗不含活生物体,它不会导致它所保护的疾病。
储存
疫苗应储存在+2℃至+8℃的原包装中,并避光。所有疫苗都在一定程度上对热和冷敏感。高温会加速大多数疫苗效力的下降,从而缩短其保质期。除非疫苗储存在正确的温度下,否则无法保证其有效性。冰冻可能导致某些疫苗的反应原性增加和效力丧失。它还会导致容器出现细微裂纹,导致内容物污染。
剂型
IXIARO®以预装注射器(1型玻璃)中的0.5毫升混悬剂形式提供,配有活塞塞(氯丁基弹性体)。
剂量和时间表
| IXIARO® | |
| 两个月至36个月以下的儿童 | 第0天第一剂0.25毫升 第一剂后28天注射第二剂0.25毫升 |
| 三岁及以上的儿童和成人 | 第0天第一剂0.5毫升 第一剂后28天接种第二剂0.5毫升 |
18-64岁的成年人也可以在第0天和第7天进行快速计划。抗体反应不逊于标准疫苗接种计划(Jelinek T。等等。,2015年,克莱姆J. P。以及其他人, 2016)。
对于儿童(从两个月大开始)和65岁及以上的成人,尽管由于缺乏数据而未获得这些年龄组的许可,但快速计划可用于旅行前确实没有足够时间完成标准时间表的情况。没有数据表明快速的时间表会对这些旅行者有害。
按照这两种时间表,初次免疫接种最好应在可能暴露于日本脑炎病毒前至少一周完成。
在初级接种和初始强化接种被中断的情况下,应恢复计划,而不是重新开始。
种
IXIARO®应通过肌肉注射给药。然而,对于那些出血障碍,IXIARO®应通过皮下深层注射给药以降低出血风险。
IXIARO®可以与其他旅行或常规疫苗同时接种。疫苗应该在不同的部位注射,最好是在不同的肢体。如果在同一个肢体,他们应至少相隔2.5厘米(美国儿科学会,2003年)。
处理
用于疫苗接种的设备,包括用过的小瓶、安瓿或部分排出的应根据地方当局的法规和指南,在疗程结束时将疫苗密封在适当的防穿刺“锐器”盒中进行处置卫生技术备忘录07-01:医疗废物的安全管理(卫生部,2013年)。
疫苗使用建议
JE疫苗接种的目的是保护在旅行期间或职业生涯中面临高风险的个人。关于有害健康物质控制(COSHH)条例下的雇主责任的指南见第12章。
初级免疫接种
两个月以下的婴儿
没有关于两个月以下儿童使用IXIARO®的安全性或有效性数据。在英国,通常不建议两个月以下的儿童使用IXIARO®。
IXIARO®已获得许可,建议以下年龄组使用。
两个月至36个月以下的儿童
许可的疫苗计划是两剂IXIARO®:第0天和第28天0.25毫升。注意这是标准剂量的一半,有关丢弃一半疫苗的说明,请参见制造商的患者信息传单(Valneva UK Ltd,2023)。接种第二剂疫苗后,需要长达一周的时间才能形成完全免疫。
3岁至17岁的儿童
许可的疫苗计划是两剂IXIARO®:0.5毫升,第0天和第28天。接种第二剂疫苗后,需要长达一周的时间才能形成完全免疫。
18岁及以上的成年人
标准疫苗接种计划是在第0天和第28天接种两剂IXIARO® 0.5ml毫升疫苗。
或者,可以使用第0天和第7天两剂的快速方案。
快速计划可用于旅行前没有足够时间完成标准计划的所有年龄组(从两个月大开始)。2个月至17岁的儿童和65岁及以上的成人无需许可证。
强化免疫接种
第1次加强
儿童(两个月以上)和65岁以下成人:
a.对于那些处于持续风险中的人(如实验室工作人员和预计在JE流行区居住相当长时间的长期旅行者),应在初次免疫接种后12个月给予加强剂量。
b.对于其他旅行者,应在初次免疫接种后12-24个月内,在可能再次接触JE病毒之前给予加强剂量。
65岁及以上的成年人:
初级接种的保护期限不确定。对于有持续/进一步风险的患者,应考虑12个月加强剂量。
第2次加强
儿童:
在第一次加强免疫接种后三年以上没有长期血清保护数据。一项调查生活在危险区域的儿童抗体持久性的研究估计,保护持续时间为第一次加强剂后的9年(卡德莱克诉以及其他人, 2018)。没有研究估计生活在风险地区以外的人群的保护时间。
18-64岁的成年人:
第二次加强剂量(第四次剂量)应在10年后提供给仍有风险的人。
65岁及以上的成年人:
加强剂量(第三剂)后的保护时间未知。该年龄组对疫苗的反应可能会降低,免疫力可能会在10年前减弱。
IXIARO®可能用于以前接种过绿色交叉疫苗或Biken疫苗的人的加强剂。
旅行者和打算定居国外的人
所有旅行者都应接受仔细的风险评估,评估应考虑到他们的行程、旅行季节、停留时间和计划的活动。JE的风险应与疫苗接种的不良事件风险相平衡(见图20.1)。
建议那些将要居住在JE流行或流行地区的人接种JE疫苗。
传播期从全年到季节都有地理变化。在亚洲的温带地区,大多数病例发生在温暖的季节,此时可能会发生大规模的流行病(世界卫生组织,2019年)。乙病例也可能发生在正常的高传播季节之外(Buhl和林德奎斯特,2009)。在热带和亚热带地区,乙可全年发生,但在水稻种植区,雨季和收获前传播往往加剧(世界卫生组织,2019年)。
前往亚洲和西太平洋地区危险地区的旅行者,如果在传播季节在流行地区停留一个月或更长时间,特别是如果旅行将包括农村地区,则应接种疫苗。如果风险被认为足够,其他暴露时间较短的旅行者应接种疫苗。例如,应考虑让那些在稻田(蚊媒繁殖地)或靠近养猪场(病毒的宿主)停留较短时间的人接种疫苗。
图20.1前往流行性日本脑炎地区的英国旅行者的疫苗建议
流程图显示了符合当前英国建议的日本脑炎疫苗接种决策过程。
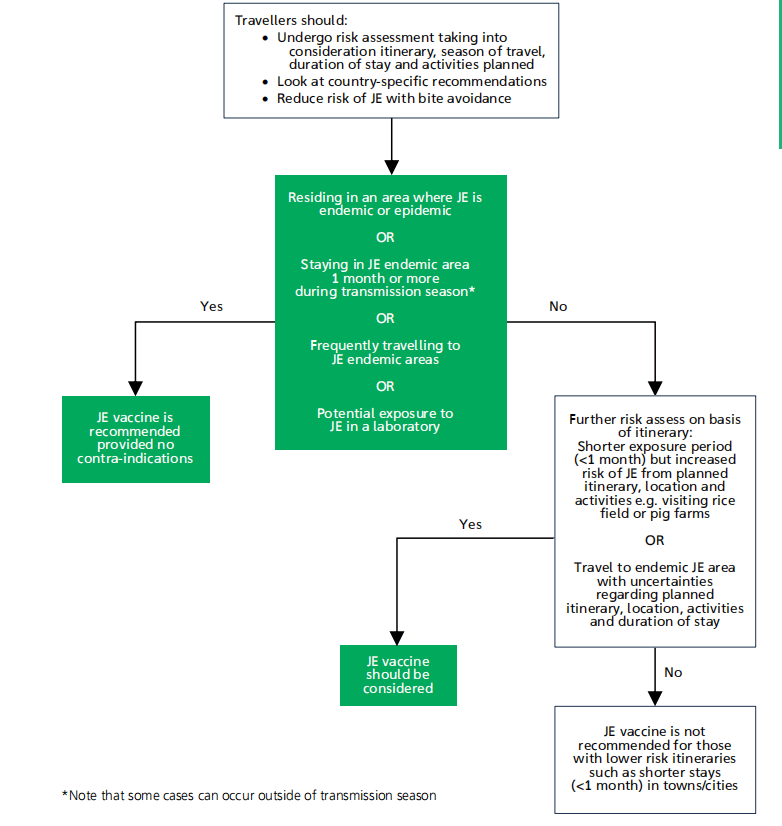
关于JE全球流行病学的国别建议和信息可在以下网站上找到https://travelhealthpro.org.uk和www.travax.nhs.uk。
实验室工作人员
建议所有可能接触该病毒的研究实验室工作人员进行免疫接种。全世界有22例实验室获得的JE病毒感染病例(霍尔斯特德以及其他人, 2013)。
禁忌症
很少有人不能接受IXIARO®。如有疑问,应向旅行健康专家寻求适当的建议。
IXIARO®不应用于以下患者:
●确认对先前剂量的IXIARO®疫苗有过敏或严重的全身反应,或
●确认对疫苗的任何成分产生过敏反应。
预防措施
已有过敏症的人
没有已知的对IXIARO®疫苗过敏反应的额外风险。
怀孕和母乳喂养
作为预防措施,在怀孕或哺乳期间应该避免使用IXIARO®。然而,旅行者及其医疗顾问必须对妊娠期乙蚊疫苗的理论风险与获得乙蚊的潜在风险进行风险评估。妊娠前两个月获得的流产与乙病毒感染有关(加拿大医学协会,2002)。
不良反应
接种IXIARO®后观察到的最常见不良反应是疼痛和
注射部位的压痛、头痛、疲劳和肌痛。其他常见的反应包括注射部位红斑、硬化、肿胀和瘙痒、流感样疾病、发热和恶心。
病例管理
JE没有特效疗法。支持性治疗可以显著降低发病率和死亡率。诊断测试可通过稀有和外来病原体
实验室英国健康安全局。
供应
●www.valneva.co.uk瓦尔内瓦英国有限公司可提供IXIARO®(电话:01506 446 608)
参考
American Academy of Pediatrics (2003) Active immunization. In: Pickering LK (ed.) Red Book: 2003 Report of
the Committee on Infectious Diseases 26th edition. Elk Grove Village, IL: American Academy of Pediatrics,
p33.
Australian Government (2023) Statement on the end of Japanese encephalitis virus emergency response, 16
June 2023.
https://www.health.gov.au/news/statement-on-the-end-of-japanese-encephalitis-virus-emergency-response
Buhl MR, Lindquist L (2009), Japanese encephalitis is travelers: review of cases and seasonal risk. J. Trav Med
2009. 16, 3: 217-219.
Canadian Medical Association (2002) General considerations. In: Canadian Immunization Guide, 6th edition.
Canadian Medical Association, p 14. https://publications.gc.ca/Collection/H49-8-2002E.pdf
Campbell GL, Hills SL, Fischer M, Jacobson JA, Hoke CH, Hombach JM, Marfin AA, Solomon T, Tsai TF, Tsui
VD & Ginsburg AS (2011) Estimated global incidence of Japanese encephalitis: a systematic review. Bull
World Health Organ 2011;89:766–774E. https://apps.who.int/iris/handle/10665/271003
Cramer JP, Jelinek T, Paulke-Korinek M et al., (2016) One-year immunogenicity kinetics and safety of a
purified chick embryo cell rabies vaccine and an inactivated Vero cell-derived Japanese encephalitis vaccine
administered concomitantly according to a new, 1-week, accelerated primary series. J Trav Med, 2016, 23, 3:
1–8.
Department of Health (2013) Health Technical Memorandum 07-01: Safe and sustainable management of
healthcare waste.
https://www.england.nhs.uk/publication/management-and-disposal-of-healthcare-waste-htm-07-01
Accessed: February 2024.
Henderson A (1984) Immunization against Japanese encephalitis in Nepal: experience of 1152 subjects. J R
Army Med Corps 130: 188–91.
Jelinek T, Burchard GD, Dieckmann S, Bühler S, Paulke-Korinek M, Nothdurft HD, Reisinger E, Ahmed K,
Bosse D, Meyer S, Costantini M, Pellegrini M (2015) Short-Term Immunogenicity and Safety of an Accelerated
Pre-Exposure Prophylaxis Regimen With Japanese Encephalitis Vaccine in Combination With a Rabies Vaccine:
A Phase III, Multicenter, Observer-Blind Study J Trav Med. 22 4: 225–231.
Kadlecek V, Borja-Tabora CF, Eder-Lingelbach S, et al., (2018) Antibody Persistence up to 3 Years After
Primary Immunization With Inactivated Japanese Encephalitis Vaccine IXIARO in
Philippine Children and Effect of a Booster Dose. Pediatr Infect Dis J 2018;37:e233–e240.
Ohtaki E, Matsuishi T, Hirano Y, and Maekawa K (1995) Acute disseminated encephalomyelitis after
treatment with Japanese B encephalitis vaccine (Nakayama-Yoken and Beijing strains). J NeurolNeurosurg
Psychiatry 59: 316-7.
Plesner AM, Soborg PA and Herning M (1996) Neurological complications and Japanese encephalitis
vaccination. Lancet 348: 202–3.
Poland JD, Cropp CB, Craven RB and Monath TP (1990) Evaluation of the potency and safety of inactivated
Japanese encephalitis vaccine in US inhabitants. J Infect Dis 161: 878–82.
Turtle L, Easton A, Defres S, Ellul M, Bovill B, Hoyle J, Jung A, Lewthwaite P, Solomon T (2019) ‘More than
devastating’—patient experiences and neurological sequelae of Japanese encephalitis. J Trav Med, 2019 1-7.
Valneva UK Ltd (2023) Ixiaro patient information leaflet. March 2023,
https://www.medicines.org.uk/emc/product/6534/pil Accessed: February 2024.
World Health Organization (2019) Japanese encephalitis factsheet.
https://www.who.int/news-room/fact-sheets/detail/japanese-encephalitis Accessed: February 2024.
Hits: 86
