Contents
- 1 第13章:轮状病毒
- 1.1 疾病描述
- 1.2 背景
- 1.3 接种疫苗
- 1.3.1 轮状病毒疫苗说明和临床试验结果:
- 1.3.1.1 RotaTeq:
- 1.3.1.2 Rotarix:
- 1.3.1.3 图2.19-35个月大的美国儿童接受全程轮状病毒疫苗的百分比:2009-2015年全国免疫调查。
- 1.3.1.4 疫苗覆盖率
- 1.3.1.5 许可后疫苗影响
- 1.3.1.6 图3.使用被动报告的实验室轮状病毒检测数据(NREVSS)分析2001-2015年轮状病毒发病率趋势
- 1.3.1.7 图4.州住院患者数据库中报告的2000-2012年出院编码住院轮状病毒胃肠炎住院人次下降
- 1.3.1.8 图5.从2003年到2013年,根据州急诊就诊数据库,轮状病毒胃肠炎导致的急诊就诊下降
- 1.3.1.9 图6.2007年至2018年市场扫描中,美国因接种轮状病毒疫苗而住院的累计估计数:5岁以下儿童
- 1.3.1.10 许可后疫苗效力
- 1.3.1.11 图7.评估美国儿童轮状病毒疫苗效果的七项积极的前瞻性监测研究;2007年至2013年[改编自佩恩·DC等人的《临床感染疾病2015》]
- 1.3.1 轮状病毒疫苗说明和临床试验结果:
- 1.4 轮状病毒疫苗接种的其他意想不到的好处
- 1.5 监测的重要性
- 1.6 疾病减少目标
- 1.7 病例定义
- 1.8 实验室测试
- 1.9 报告和病例通知
- 1.10 病案调查
- 1.11 控制
- 1.12 参考
- 1.12.1 1.佩恩·DC、文杰·J、齐拉吉·PG等人在美国儿童中发现了诺如病毒并接受了肠胃炎治疗。新英格兰医学杂志2013;368:1121–30.doi: 10.1056/NEJMsa1206589
- 1.12.2 2.疾病控制中心。预防婴幼儿轮状病毒胃肠炎:免疫实践咨询委员会的建议(ACIP). MMWR代表2009;58(RR-2):1–25。
- 1.12.3 3.Gurwith M,Wenman W,Hinde D,Feltham S,Greenberg H .婴幼儿轮状病毒感染的前瞻性研究。感染疾病1981;144(3):218–24.doi: 10.1093/infdis/144
- 1.12.4 4.卡皮肯阿兹,查诺克RM。轮状病毒。作者:斯特劳斯·塞,编辑。病毒学领域:第2卷。第三版。费城:利平科特-瑞文;1996.第1657-708页。
- 1.12.5 5.罗德里格兹·WJ,金HW,布兰特·CD等:儿科医疗服务家庭轮状病毒感染和胃肠炎的纵向研究:临床和流行病学观察。儿科传染病杂志1987;6(2):170–6.
- 1.12.6 6.美国轮状病毒腹泻的流行病学:疾病负担的监测和评估。感染疾病1996;174(补编1):S5–11。doi: 10.1093/infdis/174。补充_1。表面抗原-5
- 1.12.7 7.卡尔森JAK,米德尔顿PJ,希曼斯基山,胡伯J,彼得里奇m。致命性轮状病毒胃肠炎:21例分析。我是孩子吗1978;132(5):477–9.
- 1.12.8 8.Butz AM,Fosarelli P,Kick J,Yolken R .日托设施高危污染物中轮状病毒的流行率。小儿科1993;92(2):202–5.
- 1.12.9 9.丹尼希博士,纳尔逊SM,克劳利巴,萨拉森CL。聚合酶链反应检测医院空气样本中轮状病毒RNA。儿科研究1998;43:143.doi:10.1203/00006450-199804001-00849
- 1.12.10 10.美国儿科学会。轮状病毒感染。在:皮克林LK,编辑。红皮书:传染病委员会2003年报告。第26版。伊利诺伊州埃尔克格罗夫村:美国科学院小儿科;2003.第534–6页。
- 1.12.11 11.Mrukowicz J,Szajewska H,Vesikari T .除疫苗接种外预防轮状病毒疾病的选择。儿科胃肠螺母2008;46:S32–7。doi:10.1097/mpg . 0 b 013 e 31816 f 79 b 0
- 1.12.12 12.Jin S,Kilgore PE,Holman RC,Clarke MJ,Gangarosa,Glass RI。1979-1992年美国儿童腹泻住院趋势:轮状病毒相关发病率的估计。儿科传染病杂志1996;15(5):397–404.
- 1.12.13 13.帕拉沙UD,霍尔曼钢筋混凝土,克拉克兆焦耳,布雷西JS,玻璃里。美国1993-1995年与轮状病毒腹泻相关的住院治疗:基于新的ICD-9-CM轮状病毒特异性诊断编码的监测。感染疾病1997;177(1):13–7.doi: 10.1086/513808
- 1.12.14 14.世界卫生组织。轮状病毒疫苗世卫组织立场文件:2013年1月-建议。疫苗2013;31:6170–1.doi: 10.1016/j .疫苗2013.05.037
- 1.12.15 15.Pickering LK,Bartlett AV III,Reves RR,Morrow A .日托中心儿童轮状病毒腹泻前后轮状病毒的无症状排泄。儿科杂志1988;112(2):361–5.
- 1.12.16 16.索尔斯伯里英尺,温克尔斯坦JA,约肯RH。免疫缺陷中的慢性轮状病毒感染。儿科杂志1980;97(1):61–5.
- 1.12.17 17.约肯RH,主教CA,汤森TR。骨髓移植受者的传染性胃肠炎。新英格兰医学杂志1982;306(17):1009–12.doi:10.1056/nejm 198204846586
- 1.12.18 18.Troussard X,Bauduer F,Gallet E,等。骨髓移植患者粪便中的病毒回收。骨髓移植1993;12(6):573–6.
- 1.12.19 19.轮状病毒是同种异体骨髓移植后长期腹泻和发病的重要原因。骨髓移植2005;36:691–4.
- 1.12.20 20.Bresee JS,Marcus R,Venezia RA,等:《美国急诊就诊成人中严重急性胃肠炎的病原学》。感染疾病2012;205:1374–81.doi: 10.1093/infdis/jis206
- 1.12.21 21.成人轮状病毒感染的流行病学。Rev传染疾病1987;9(3):461–9.doi: 10.1093/clinids/9.3.461
- 1.12.22 22.佩恩·DC,爱德华兹·柯,鲍文·医学博士,等.与轮状病毒胃肠炎相关的疫苗衍生轮状病毒(RotaTeq)的同胞间传播小儿科2010;125(2):e438–41。doi: 10.1542/peds
- 1.12.23 23.在一名患有急性肠胃炎的7岁儿童中检测到Rotateq疫苗衍生的双重重配轮状病毒。儿科传染病杂志2014;33:655-6.doi:10.1097/INF . 000000000000221
- 1.12.24 24.Boom JA,Sahni L,Payne DC等。5名儿童的症状性感染和疫苗及疫苗重配轮状病毒株的检测:病例系列。感染疾病2012;206(8):1275–9.doi: 10.1093/infdis/jis490
- 1.12.25 25.人类和动物轮状病毒株的血清型多样性和重配:轮状病毒疫苗计划的意义。感染疾病2005;192(补编1):S146–59。doi: 10.1086/431499
- 1.12.26 26.Bowen MD,Mijatovic-Rustempasic S,Esona MD,等,《上市后疫苗时代的轮状病毒毒株趋势:美国,2008–2013》。感染疾病2016;214(5):732–8.doi: 10.1093
- 1.12.27 27.赫尔·JJ,蒂尔·恩,张铠麟·泰克,等。2005-2008年美国轮状病毒毒株监测:疫苗引入前后的基因型流行率。儿科传染病杂志2011;30(1):S42–7。doi:10.1097/INF . 0b 013 e 3181 fefd 78
- 1.12.28 28.Boom JA,泰特·JE,Sahni LC,等:《五价轮状病毒疫苗在美国大城市人群中的有效性》。小儿科2010;125(2):e199–207。doi: 10.1542/peds
- 1.12.29 29.佩恩·DC、斯塔特·马、爱德华兹·KM等:2006-2009年美国3个县轮状病毒疫苗接种对儿童住院的直接和间接影响。临床感染疾病。2011;53(3):245–53.doi: 10.1093/cid/cir307
- 1.12.30 30.Block SL,Vesikari T,Goveia MG,等.五价人-牛(WC3)重组轮状病毒疫苗在保质期结束时的功效、免疫原性和安全性。小儿科2007;119(1):11–8.doi: 10.1542/peds
- 1.12.31 31.Vesikari T,Matson DO,Dennehy P,等。五价人-牛(WC3)重组轮状病毒疫苗的安全性和有效性。英国医学杂志2006;354(1):23–33.doi: 10.1056/NEJMoa052664
- 1.12.32 32.Ruiz-Palacios GM,Pérez-Schael I,Velázquez FR,等.抗严重轮状病毒胃肠炎减毒疫苗的安全性和有效性。英国医学杂志2006;354(1):11–22.doi: 10.1056/NEJMoa052434
- 1.12.33 33.维斯卡里T,卡尔沃宁A,普乌斯蒂宁L,等。RIX 4414人轮状病毒减毒活疫苗在芬兰婴儿中的效力。儿科传染病杂志2004;23(10):937–43.
- 1.12.34 34.维斯卡里T,卡尔沃宁A,普雷穆拉R,等。欧洲婴儿出生后2年内人类轮状病毒疫苗对轮状病毒胃肠炎的疗效:随机双盲对照研究。柳叶刀2007;370(9601):1757–63.doi:10.1016/s 0140-6736(07)61744-9
- 1.12.35 35.Hill HA,Elam-Evans LD,Yankey D,等。19-35个月儿童的疫苗接种覆盖率——美国,2015年。 Morb莫尔布凡人周代表2016;65(39):1065-71.doi: 10.15585/mmwr.mm6539a4
- 1.12.36 36.帕拉沙尔UD,吉布森CJ,布雷西JS,等。轮状病毒和严重的儿童腹泻。急诊传染病2006;12(2):304–6.多伊:10.3201/开斋节
- 1.12.37 37.阿利亚巴迪N,泰特JE,海恩斯AK等;疾病控制中心。实施常规疫苗接种后,轮状病毒实验室检测持续下降——美国,2000–2014年. Morb莫尔布凡人周代表 2015;64:337–42.
- 1.12.38 38.柯恩斯在,斯坦纳CA,巴雷特M,亨特K,威尔逊E,帕拉沙UD。引入轮状病毒疫苗后,美国儿童急性胃肠炎住院率降低:对美国18个州出院数据的分析。感染疾病2010;201(11):1617–24.doi: 10.1086/652403
- 1.12.39 39.实施轮状病毒疫苗后美国儿童的急性胃肠炎住院。睡衣裤2015;313(22):2282–4.doi:10.1001/jama
- 1.12.40 40.2003年至2013年实施轮状病毒疫苗接种后,美国10个州儿童急性胃肠炎急诊就诊率下降儿科传染病杂志2016;35(7):782–6.doi: 10.1097/INF
- 1.12.41 41.佩恩·DC。记录美国轮状病毒疫苗接种影响的十年:理解后轮状病毒疫苗引入时代。在第5届泰国(Thailand)欧洲轮状病毒疫苗专家会议;2017年3月21日,荷兰乌得勒支。
- 1.12.42 42.Pitzer VE,Viboud C,Simonsen L,等。轮状病毒流行的人口统计学可变性、疫苗接种和时空动力学。科学2009;325(5938):290–4.doi:10.1126/科学
- 1.12.43 43.Cortese MM,Dahl RM,Curns AT,等:《美国接受轮状病毒疫苗儿童家庭的肠胃炎预防》。感染疾病2015;211(4):558-62.doi: 10.1093/infdis/jiu503
- 1.12.44 44.轮状病毒相关的住院和急诊费用以及轮状病毒疫苗计划的影响。疫苗2013;31(38):4164–71.doi: 10.1016/j .疫苗2013.06.085
- 1.12.45 45.Leshem E,Moritz RE,Curns AT,等。美国腹泻的轮状病毒疫苗和医疗保健利用(2007-2011)。 小儿科2014;134(1):15–23.doi: 10.1542/peds
- 1.12.46 46.Boom JA、泰特·JE、Sahni LC等在美国一家大型城市儿科医院进行了为期两年的五价轮状病毒疫苗持续保护研究。儿科传染病杂志2010;29(12):1133–5.doi:10.1097/INF . 0b 013 e 3181 ed 18 ab
- 1.12.47 47.斯塔特马,佩恩DC,多瑙尔S,等。五价轮状病毒疫苗对轮状病毒疾病的有效性。小儿科2011;128(2):e267–75。doi: 10.1542/peds
- 1.12.48 48.Desai SN,Esposito DB,Shapiro ED,Dennehy PH,Vázquez M .轮状病毒疫苗预防美国康涅狄格州幼儿轮状病毒胃肠炎住院的有效性。疫苗2010;28(47):7501–6.doi:10.1016/日本疫苗
- 1.12.49 49.佩恩·DC、塞尔瓦兰根·R、阿兹米·PH等,《美国轮状病毒疫苗保护的长期一致性:RV5和RV1疫苗在美国儿童中的有效性》, 2012–2013年。临床感染疾病2015;61(12):1792–9.doi: 10.1093/cid/civ872
- 1.12.50 50.Immergluck LC,Parker TC,Jain S,等。单价和五价轮状病毒疫苗在儿童中的持续有效性。儿科杂志2016;172:116-20.doi:10.1016/j . jped . 2016 . 01 . 042
- 1.12.51 51.佩恩·DC,苏莱马纳一世,帕拉沙·UD。轮状病毒混合疫苗治疗重症轮状病毒胃肠炎的效果评价。JAMA儿科杂志, 2016;170(7):708–10.doi:10.1001/JAMA pediatrics . 2016.0014
- 1.12.52 52.澳大利亚国家儿童疫苗计划中引入轮状病毒疫苗后轮状病毒相关急性胃肠炎的减少。儿科传染病杂志2011;30(1):S25–9。doi: 10.1097
- 1.12.53 53.Lopman BA,Curns AT,Yen C,等。在美国,婴儿轮状病毒疫苗可能为较大的儿童和成人提供间接保护。感染疾病2011;204(7):980–6.doi: 10.1093/infdis/jir492
- 1.12.54 54.Dickey M,Jamison L,Michaud L,等。以前健康儿童的轮状病毒脑膜脑炎和文献回顾。儿科传染病杂志2009;28(4):318–21.doi:10.1097/INF . 0b 013 e 31818 ddbe 9
- 1.12.55 55.itur iza-góMara M,Auchterlonie IA,Zaw,Molyneaux P,Desselberger U,Gray J .轮状病毒胃肠炎和中枢神经系统(CNS)感染:从患有CNS疾病的儿童的配对粪便和脑脊液样本中分离的轮状病毒株的VP7和VP4基因的特征。临床微生物学杂志2002;40(12):4797–9.2002年12月40日
- 1.12.56 56.用逆转录聚合酶链反应检测惊厥和胃肠炎患者脑脊液和血液中的轮状病毒。大脑发育1993;15(6):457–9.doi:10.1016/0387-7604(93)90088-P
- 1.12.57 57.Abe T,Kobayashi M,Araki K,等。轻度胃肠炎伴婴儿惊厥。大脑发育2000;22(5):301–6.doi:10.1016/0387-7604(00)00111-X
- 1.12.58 58.王,香港。良性癫痫发作伴轻度腹泻20例临床分析。犯罪行为 1993;34(6):451–7.
- 1.12.59 59.Contino MF,Lebby T,Arcinue EL。引起婴儿和儿童无热性癫痫发作的轮状病毒胃肠道感染。我是急救医生 1994;12(1):94–5.
- 1.12.60 60.林世春,许海燕,王,等。小儿轮状病毒胃肠炎伴无热惊厥。中华郭敏小可儿一薛辉杂碎1996;37(3):204–7.
- 1.12.61 61.洪,温海燕,颜明辉,等。小儿轮状病毒胃肠炎伴无热惊厥40例临床分析。长庚医学杂志 2003;26(9):654–9.
- 1.12.62 62.良性无热丛集性惊厥伴胃肠炎:一项观察性研究。BMC儿科2004;4:2.doi: 10.1186/1471-2431-4-2
- 1.12.63 63.汤普森MJ,高迪PJ,柯克伍德·丹尼尔CD,等。轮状病毒小脑炎:一个老敌人的新观点?Ped神经元2012;46(1):48–50.doi: 10.1016/j .儿科神经病学. 2011.10.002
- 1.12.64 64.佩恩·DC,贝格斯J,泽尔D,柯恩斯AT,温特劳布E,帕拉沙尔·UD。美国儿童接种轮状病毒疫苗后一年内与儿童期癫痫发作之间的保护性关联。临床信息诊断2013;58(2):173–7.doi: 10.1093/cid/cit671
- 1.12.65 65.帕尔多-塞科J、塞贝-洛佩斯M、马丁农-托雷斯等。轮状病毒疫苗接种对儿童癫痫住院的影响。 儿科传染病杂志2015;34(7):769–73.doi: 10.1097/INF
- 1.12.66 66.谢里登SL,Ware RS, 格林伍德K轮状病毒疫苗时代的热性惊厥。儿科感染疾病学会2016;5(2):206–9.doi: 10.1093/jpids/piu097
- 1.12.67 67.DiFazio MP,Braun L,Freedman S,等.儿童轮状病毒引起的癫痫发作。儿童神经病学杂志2007;22(12):1367–40.土井:10/08870 . 48888888881
- 1.12.68 68.轮状病毒感染神经元中内质网相关蛋白靶向轴突和树突。大脑研究公牛 1998;46(4):353–60.
- 1.12.69 69.Morris A,Scott J,Ball J,Zeng,O’Neal WK,Estes MK. NSP4引起年龄依赖性腹泻和Ca(2+)介导的I(-)流入CF小鼠的肠隐窝。美国生理学杂志1999;277(2):G431–4。
- 1.12.70 70.轮状病毒非结构糖蛋白NSP4具有膜去稳定活性。j病毒 1996;70(10):6973–81.
- 1.12.71 71.轮状病毒所致惊厥患者的血清和脑脊液亚硝酸盐/硝酸盐水平。生命科学 2004;74(11):1397–1405.
- 1.12.72 72.张军,Dawson V,Dawson T,等。一氧化氮在神经毒性中对聚ADP-核糖合成酶的激活作用。科学 1994;263(5147):687–9.
- 1.12.73 73.疾病控制中心。添加严重联合免疫缺陷作为轮状病毒疫苗的禁忌症. Morb莫尔布凡人周代表 2010;59(22):687–8.
- 1.12.74 74.Dennehy PH,Cortese MM,Begue RE,等:一项确定美国儿童轮状病毒胃肠炎住院风险因素的病例对照研究。儿科传染病杂志2006;25(12):1123–31.doi: 10.1097/01.inf
- 1.12.75 75.霍夫斯特特·阿姆,拉康姆猪·K,克莱恩·EJ等,《住院婴儿轮状病毒疫苗摄入和无院内传播》。小儿科2017;已提交。
- 1.12.76 76.诺沃克病毒感染和疾病与ABO组织血型有关。感染疾病2002;185(9):1335–7.doi: 10.1086/339883
- 1.12.77 77.庄女,吴,李,黄平,蒋X,杨丹。越南儿童诺如病毒和轮状病毒感染与组织血型抗原类型的关系。临床微生物学杂志2014;52(2):1366–74.doi: 10.1128/JCM.02927-13
- 1.12.78 78.Imbert-Marcille BM,Barbé L,Dupé M等. FUT2基因常见多态性决定对P[8]基因型轮状病毒A的抗性。感染疾病2014;209(8):1227–30.doi: 10.1093/infdis/jit655
- 1.12.79 79.Lewis和分泌状态以轮状病毒基因型依赖的方式介导对轮状病毒感染的易感性。临床感染疾病2014;59(11):1567–73.doi: 10.1093
- 1.12.80 80.佩恩·DC,库里耶·R,斯塔特·马等。美国儿童中FUT2分泌状态与严重轮状病毒胃肠炎之间的流行病学联系。JAMA儿科杂志2015;169(11):1040–5.doi:doi:10.1001/牙买加儿科杂志2015.2002
- 1.12.81 81.坎汉帕蒂A,佩恩DC,康斯坦丁五世,洛普曼巴。宿主对肠道病毒的遗传易感性:系统综述和荟萃分析。临床感染疾病2016;62(1):11–8.doi: 10.1093/cid/civ873
- 1.12.82 82.大规模轮状病毒疫苗接种的自然动力学。发表于2010年9月4日在南非约翰内斯堡举行的第9届国际轮状病毒研讨会。
- 1.12.83 83.单价轮状病毒疫苗接种后肠套叠的风险。英国医学杂志2014;370(6):513–9.doi: 10.1056/NEJMoa1311738
- 1.12.84 84.美国婴儿接种五价轮状病毒疫苗后发生肠套叠的风险。睡衣裤2012;307(6):598–604.doi:2012年10月10日
- 1.12.85 85.美国卫生与公众服务部。IID-7.10。在19至35个月的儿童中实现并保持2剂或更多剂或3剂或更多剂轮状病毒疫苗的有效覆盖率。2020年健康人。DC华盛顿州:美国卫生与公众服务部;2017.
- 1.12.86 86.使用血清1型、2型、3型和4型VP7特异性单克隆抗体对粪便中的人轮状病毒进行直接血清分型。感染疾病1987;155(1):1159–66.doi: 10.1093/infdis/155.6.1159
- 1.12.87 87.库尔森,乙,尤尼康勒,皮特森加,主教射频。用单克隆抗体进行简单而特异的酶免疫测定对人轮状病毒进行血清分型。临床微生物学杂志1987;25(3):509–5.
- 1.12.88 88.10年间(1982-1991)从日本腹泻儿童中发现的人类轮状病毒中VP4基因等位基因的相对频率。临床微生物学杂志1993;31(8):2195–97.
- 1.12.89 89.粪便标本中轮状病毒核酸的聚合酶链反应扩增和分型。临床微生物学杂志1990;28(2):276–82.
- 1.12.90 90.聚合酶链反应鉴定A组轮状病毒基因4型。临床微生物学杂志1992;30(6):1365–73.
第13章:轮状病毒
疾病描述
背景
接种疫苗
监测的重要性
疾病减少的目标
病例定义
实验室测试
报告和病例通知
病例调查
控制
疫苗可预防疾病监测手册
作者:丹尼尔·c·佩恩博士,MSPH;梅什·d·帕拉沙尔
疾病描述
在轮状病毒疫苗出现之前,轮状病毒是婴幼儿严重肠胃炎的最常见原因。接种轮状病毒疫苗的人群经历了轮状病毒感染和传播的急剧下降,因此诺如病毒现在是最常见的小儿病毒性胃肠炎[1]。轮状病毒疾病的临床范围从持续时间有限的轻度水样腹泻到伴有呕吐和发热的严重腹泻,可导致脱水伴休克、电解质失衡,在极少数情况下,美国儿童会死亡。在1-3天的潜伏期后,疾病通常突然开始,呕吐通常先于腹泻。胃肠道症状通常在3-7天内消失。多达三分之一的患者体温超过102℉(> 39℃)。严重脱水轮状病毒感染主要发生在3-35个月大的未接种疫苗的儿童中[2,7]。
轮状病毒在受感染儿童的粪便中以高浓度排出,主要通过粪-口途径传播,既可以通过人与人的密切接触,也可以通过污染物传播[8]。轮状病毒也可能通过其他方式传播,如呼吸道飞沫和被粪便污染的食物和水[9]。轮状病毒传染性强,感染剂量小< 100个病毒颗粒[10];因此,世界卫生组织报告说,卫生措施[11]和改善卫生条件[12,13]不太可能导致未接种人群中轮状病毒负担的显著下降。由于这个原因,轮状病毒疫苗已被确定为减轻全球严重和致命轮状病毒腹泻相关负担的最佳策略[14]。
从出生到老年都会重复暴露,但自然免疫和/或疫苗诱导的免疫使大多数感染在自然感染或疫苗接种后变得轻微或无症状[15]。免疫功能低下的儿童有时会经历严重、持久甚至致命的轮状病毒胃肠炎[16-19]。轮状病毒感染在美国成人中确实存在,但往往是轻度甚至无症状的感染。在一些成年人中,特别是那些有潜在疾病的人或老年人,轮状病毒仍然可以导致严重的胃肠炎,需要医疗护理[20, 21]。
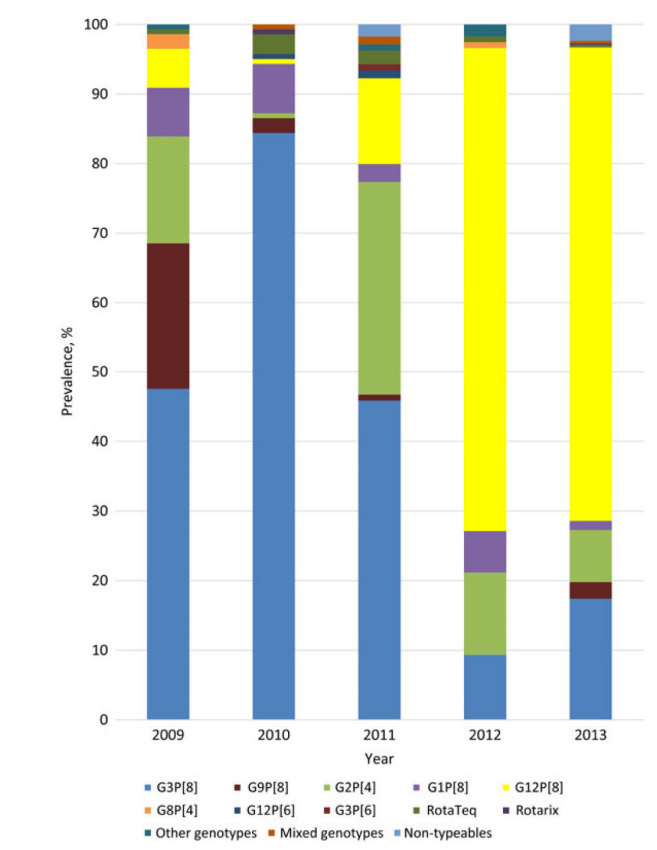
图1.2009-2013年< 5岁儿童轮状病毒基因型流行率:新疫苗监测网络(NVSN )[26]
背景
轮状病毒是属于呼肠孤病毒科的无包膜RNA病毒。病毒核衣壳由3个同心外壳组成,外壳包裹11个双链RNA片段。最外层包含2种结构病毒蛋白(VPs): VP4,蛋白酶切割蛋白(P蛋白)和VP7,糖蛋白(G蛋白)。这两种蛋白定义了病毒的血清型,并被认为对疫苗开发至关重要,因为它们是中和抗体的靶标,而中和抗体可能对保护很重要。因为编码这些蛋白质的2个基因片段可以独立分离,所以已经开发了一个由P和G类型组成的分型系统。一些动物物种(例如,灵长类、牛、马、猪、羊)易受轮状病毒感染并患有轮状病毒腹泻,但常见的动物轮状病毒血清型不同于流行的人类毒株。虽然已经鉴定出与动物株具有高度遗传同源性的人轮状病毒株,但完整病毒体在动物间的传播似乎并不常见。大多数与动物轮状病毒有某种遗传相似性的人类轮状病毒似乎是在体内混合感染过程中,由一种或多种动物轮状病毒基因重配到人类轮状病毒中而形成的。
在极少数情况下[22],基因型P7[5]G1和P1A[8]G6的RotaTeq疫苗组分菌株之间的重配已被观察到在人类体内复制期间发生。这种疫苗衍生的重配已被证明是可传播的,能够引起有症状的胃肠炎[22,23]。典型地,在上市后疫苗时代,在1-3%的轮状病毒监测病例中已经检测到这种重配,这些病例已经进行了测序[24]。
在美国,包含6种不同的P和G组合的病毒最流行:P[8]G1、P[4] G2、P[8] G3、P[8] G4、P[8] G9和P[6] G9,尽管在美国和全球已经鉴定了40多种罕见的或地区性的毒株[25]。近年来P[8],G12[26]已成为美国严重轮状病毒胃肠炎病例中的主要毒株,尽管地理区域的长期变异可能仍然存在(图1)[27,29]。
接种疫苗
轮状病毒疫苗说明和临床试验结果:
RotaTeq:
2006年,免疫实践咨询委员会(ACIP)推荐默克公司(新泽西怀特豪斯站)生产的RotaTeq(一种口服人牛重组轮状病毒活疫苗)用于美国婴儿的常规疫苗接种。建议在2、4和6个月大时接种三剂该疫苗,同时在该年龄接种其他疫苗[2]。RotaTeq包含5种重配轮状病毒,它们是从人类和牛的亲代轮状病毒株发展而来,表达5种常见循环毒株(G1、G2、G3、G4和P[8][亚组P1A])的人类外壳蛋白。
RotaTeq已经在2个III期试验中进行了测试[30,31],包括主要在美国和芬兰登记的超过70,000名婴儿的大规模临床试验。3剂RotaTeq对任何严重程度的G1-G4轮状病毒胃肠炎的疗效为74% (95%可信区间[CI] = 67%,80%),对严重的G1-G4轮状病毒胃肠炎的疗效为98% (CI = 88%,100%)。据观察,RotaTeq对每种目标血清型均有效,并减少了86% (CI = 74%,93%)的诊所就诊率、94% (CI = 89%,97%)的急诊(ed)就诊率和96% (CI = 91%,98%)的轮状病毒胃肠炎住院率。在给药后开始的期间,对任何病因的所有胃肠炎住院的疗效为59% (CI = 52%,65%)[2]。
Rotarix:
2008年,ACIP建议将Rotarix(由葛兰素史克生物制品公司生产)用于美国婴儿的常规疫苗接种。这种活疫苗含有减毒单价G1 P[8]人轮状病毒株,制造商建议对2个月和4个月大的婴儿分两次口服给药。
在一项对来自11个拉丁美洲国家的63,000多名婴儿进行的大型临床试验中,发现Rotarix疫苗是安全的且具有高度免疫原性。在接种疫苗后的第一年内,两剂Rotarix疫苗对严重轮状病毒引起的住院治疗的疗效(根据Vesikari 20分评分系统定义)为85%,对更严重的轮状病毒胃肠炎的疗效为100%[32]。在2年的随访后,该疫苗在预防轮状病毒相关住院方面显示出83% (CI=73%,90%)的有效性。Rotarix疫苗可防止因各种原因引起的胃肠炎住院(第一年的保护率为42%,置信区间为27%,54%)。在2年的研究期间,Rotarix提供了针对广泛轮状病毒血清型的保护,包括针对不太常见的G9,P[8]株。
在6个欧洲国家进行的一项随机、双盲、安慰剂对照研究中,观察到Rotarix具有高度免疫原性。Rotarix疫苗在1个轮状病毒季节中对任何严重程度的轮状病毒胃肠炎的疗效为87% (CI = 80%,92%),对严重轮状病毒胃肠炎(根据Vesikari评分≥11分定义)的疗效为96% (CI=90%,99%)。Rotarix减少了75%的各种原因引起的胃肠炎住院率(不考虑推测的病因)(CI = 46%,89%)。Rotarix疫苗在两个轮状病毒季节对严重轮状病毒胃肠炎的疗效为90% (CI= 85%,94%),在减少住院方面的疗效为96% (CI= 84%,100%)[33,34]。
还没有临床试验比较Rotarix和RotaTeq的疗效,ACIP也没有提供疫苗偏好。为了统一疫苗接种的时间安排,ACIP现在建议,对于这两种疫苗,第一剂的最大年龄为14周零6天(以前的建议:12周),最后一剂轮状病毒疫苗的最大年龄为8个月零0天(以前的建议:32周)[2]。
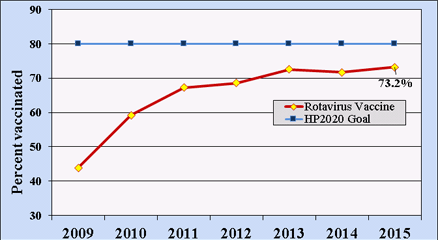
图2.19-35个月大的美国儿童接受全程轮状病毒疫苗的百分比:2009-2015年全国免疫调查。
疫苗覆盖率
自2009年以来,美国国家免疫调查使用系统抽样方法对19-35个月大的美国儿童的轮状病毒疫苗接种率(任一疫苗)进行了估计。到2015年,这一年龄范围内近四分之三的美国儿童接受了全程轮状病毒疫苗接种,低于健康人2020 80%覆盖率的目标(图2)[35]。
许可后疫苗影响
在前轮状病毒疫苗时代,估计有410,000名医生就诊;205-272,000次ED访问;55,000–70,000例住院治疗可归因于美国儿童的轮状病毒感染,每年花费约10亿美元(图2)[36]。ACIP对轮状病毒疫苗的许可和批准(RotaTeq在2006年,Rotarix在2008年)使美国儿童的轮状病毒疾病负担总体大幅下降,这在各种监测工作中都得到了一致观察。
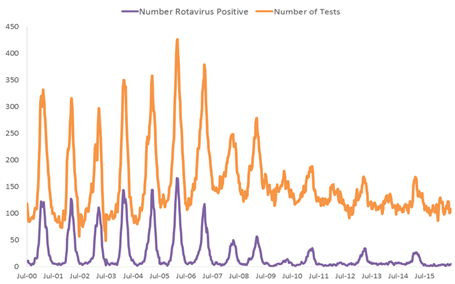
图3.使用被动报告的实验室轮状病毒检测数据(NREVSS)分析2001-2015年轮状病毒发病率趋势
大量记载轮状病毒疫苗影响的上市后出版物已证明轮状病毒胃肠炎的发病率大幅下降。自2000年以来,国家呼吸道和肠道病毒监测系统(NREVSS),一个由17个实验室组成的网络,不断提供轮状病毒检测的实验室报告和阳性结果,表明自轮状病毒疫苗引入以来,实验室检测到的轮状病毒感染数量急剧下降(图3) [37]。在一项对2000年至2008年18个州的出院数据(占美国人口的49%)的分析中,计算了< 5岁儿童的急性、全因胃肠炎住院率。与2000-2006年轮状病毒感染季节的中位比率相比,2007年和2008年的比率分别降低了16%和45%。这些分析是第一批发现RotaTeq疫苗的引入与美国儿童轮状病毒胃肠炎的显著减少有关的分析之一,几乎是在轮状病毒疫苗引入后立即进行的[38]。
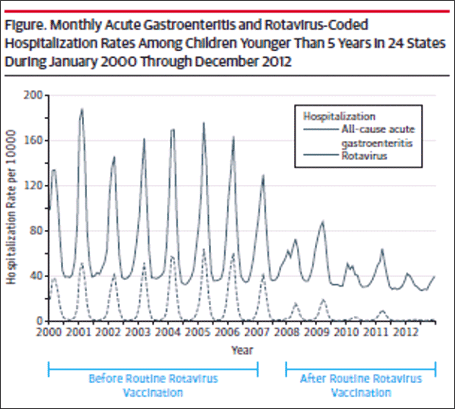
图4.州住院患者数据库中报告的2000-2012年出院编码住院轮状病毒胃肠炎住院人次下降
随后在其他数据库和临床环境中的分析加强了这些发现。使用轮状病毒胃肠炎医院出院代码,Leshem等人[39]评估了州住院患者数据库,这是一个管理数据集,代表了美国24个州74%的5岁以下儿童住院情况。与疫苗前时代(2000-2006年)相比,在疫苗后时代(2008-2012年)观察到轮状病毒编码的住院率下降了63-94%(图4)[39]。在轮状病毒胃肠炎急诊(ed)就诊中也观察到疫苗后减少。对州急诊科就诊数据库中轮状病毒胃肠炎急诊就诊的评估,代表了美国10个州13,350例5岁以下儿童急诊就诊[40]。同样,在2003-2006年疫苗接种前的时代,轮状病毒编码的急诊就诊率大幅下降(尽管不太明显)(图5)。来自NVSN的积极监测观察到,2011年至2015年,在实验室确认的3岁以下儿童轮状病毒住院治疗中,许可后比疫苗许可前基线期减少了73%-99%[41]。
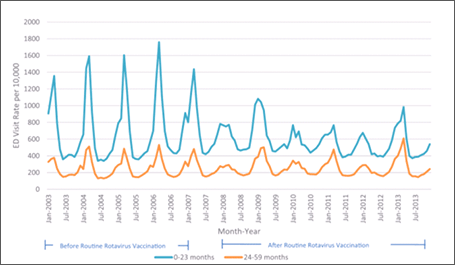
图5.从2003年到2013年,根据州急诊就诊数据库,轮状病毒胃肠炎导致的急诊就诊下降
这些分析都揭示了一个有趣的两年一次的疾病趋势,不管临床背景如何。这种两年一次的趋势在轮状病毒疫苗引入后立即出现,轮状病毒发病率在偶数年(如2008年、2010年、2012年)的冬季急剧下降,在奇数年(2009年、2011年、2013年等)再次上升。),尽管仍低于疫苗出现前的水平。在轮状病毒建模分析中预测[42],这种在临床和实验室报告中观察到的两年一次的趋势被认为是由于易感儿童的年度波动和轮状病毒传播的效率。符合条件的美国儿童轮状病毒疫苗接种率似乎很高,足以暂时限制疾病传播,但由于不到80%的儿童接种了疫苗,这些未接种疫苗的儿童仍然容易感染疾病,随着时间的推移,直到轮状病毒在人群中再次有效传播的时期[29]。
已经观察到轮状病毒疫苗提供了间接的保护性益处,甚至在那些没有接种疫苗的人中也是如此。对大型医院出院数据库的分析显示,在有接种疫苗儿童的家庭成员中,轮状病毒或不明肠胃炎住院率在统计学上显著降低[43]。
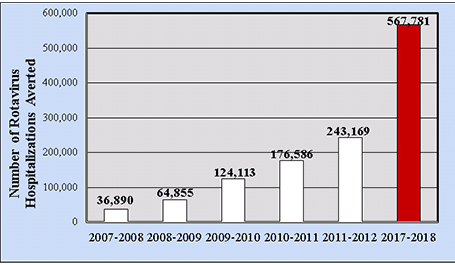
图6.2007年至2018年市场扫描中,美国因接种轮状病毒疫苗而住院的累计估计数:5岁以下儿童
就直接医疗成本而言,根据对积极收集的实验室确认的美国病例账单记录的分析,在疫苗出现之前的时代,每个住院儿童的医疗成本中值为3,581美元[44]。2006年轮状病毒住院率为22.1/10,000,估计每年国家费用为9,100万美元。成本增加与研究地点、年龄< 3个月、基础医疗条件和非典型急性胃肠炎表现相关。就急诊就诊而言,接种疫苗前每个儿童的医疗费用中位数为574美元,急诊就诊率为291/10,000,因此估计每年国家费用为1.92亿美元(2009年美元)。在对来自市场扫描管理数据库的商业保险医院索赔数据的队列分析中,到2017-2018年,美国5岁以下儿童因接种轮状病毒疫苗而避免的轮状病毒所致住院的累计人数应超过567,000例住院(图6)[45]。
许可后疫苗效力
类似于在美国证明轮状病毒疫苗影响的一致结果,在美国进行了几项现场研究以确定疫苗有效性(VE)。至少有7项评估疫苗性能的研究涉及在实验室确认轮状病毒病例的临床环境中进行积极的前瞻性监测。对RotaTeq和Rotarix疫苗的这些研究表明,总体而言,疫苗的有效性约为70-90%(图7)。
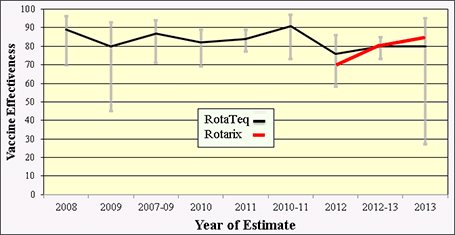
图7.评估美国儿童轮状病毒疫苗效果的七项积极的前瞻性监测研究;2007年至2013年[改编自佩恩·DC等人的《临床感染疾病2015》]
Boom等人在德克萨斯州进行的病例对照研究[35]在2007-08年和2008-09年轮状病毒疫苗接种季节,3剂RotaTeq疫苗对适龄儿童的有效性显示合并VE为84% (CI = 70%,92%)。 在该机构对2008年2月至6月期间登记的15天至23个月大的儿童进行的一项随访病例对照研究中,即使是RotaTeq的部分免疫也能提供对轮状病毒疾病的保护,单剂的有效率为69% (CI = 13%,89%),两剂的有效率为81% (CI = 13%,96%),3剂全疗程的有效率为88% (CI = 68%,96%)[46]。
在Staat等人和NVSN获得许可后的前3年,在一项多点研究中评估了RotaTeq疫苗的有效性[47],发现3剂对G1-G4轮状病毒住院和ED的有效性为94.5% (CI = 91%,97%)。婴儿出生后第一年和第二年的疫苗效力估计值具有可比性,在观察到的轮状病毒毒株之间也具有相似性。
德赛等人[48]在2006年1月至2009年8月期间对康涅狄格州8周至3岁的儿童进行了一项病例对照研究。当使用住院对照组计算时,RotaTeq的完整3剂疗程的校正VE为96% (CI=29%,100%),使用社区对照组计算时,校正VE为99% (CI=78%,100%)[48]。
随着全国各地严重轮状病毒的发病率下降,评估轮状病毒疫苗的有效性越来越需要多地点、积极的病例监测。佩恩等人的研究报告[49,51],科尔特斯等人[43],和Immergluck等人[50]利用大型监测系统对两种已获许可的轮状病毒疫苗的性能进行了可靠的分层评估。
在为期两年(2012年至2013年)的涉及7家美国医疗机构的地理多元化NVSN研究中,Payne等人[49]报告了≥1剂任何轮状病毒疫苗相对于轮状病毒住院和急诊就诊的总VE为80% (95% CI = 74%,85%)。在该汇总分析中,RotaTeq的完整3剂疗程的VE为80% (CI = 74%,84%),RV1的完整2剂疗程的VE为80% (CI = 68%,88%)。按住院病人和急诊临床环境分层的结果与这些总体估计相似。研究人员没有发现完全接种疫苗的儿童或接受任何疫苗剂量的儿童在疫苗类型方面有任何统计学差异。RotaTeq婴儿在出生后第七年和Rotarix婴儿在出生后第三年观察到具有统计学意义的VE,RotaTeq婴儿在出生后大约两年获得ACIP批准。轻度、中度和重度轮状病毒感染的有效性估计值分别为67% (CI = 48%、79%)、78% (CI = 70%、85%)和84% (CI = 71%、92%)。此外,这两种疫苗似乎都可以预防4种主要的循环轮状病毒毒株,包括最近成为美国主要毒株的轮状病毒毒株G12P[9][26],没有统计学差异。
Immergluck等人于2013年在佐治亚州的一个大型监测点研究了在医院或ED登记的儿童[50]。发现RotaTeq和Rotarix疫苗的完整疗程对8-23个月大的儿童轮状病毒住院或急诊分别具有80% (CI = 27%,95%)和84% (CI = 38%,96%)的保护作用。对于年龄大于24个月的儿童,RotaTeq和Rotarix疫苗对这些临床就诊的保护率分别为87% (CI = 22%,98%)和82% (CI = 41%,95%)。
ACIP建议,儿童轮状病毒疫苗系列应尽可能使用相同的产品,但如果前一剂所用的产品不可用或未知,则允许更换疫苗类型。在这种情况下,ACIP建议“如果系列中的任何剂量为RV5或系列中任何剂量的疫苗产品未知,则应施用总共3剂轮状病毒疫苗。”在一项比较这两种疫苗在儿童人群中同时给药的研究中,RotaTeq和Rotarix混合疫苗的完整3疗程轮状病毒疫苗接种方案保留了对严重轮状病毒胃肠炎的显著保护水平,这与完整的单一疫苗类型方案几乎相同[51]。
轮状病毒疫苗接种的其他意想不到的好处
间接保护利益
在目前已获许可的轮状病毒疫苗的临床试验中,未研究轮状病毒疫苗对未接种个体的间接保护性益处。然而,美国轮状病毒监测的经验表明,年龄较大、未接种疫苗的儿童轮状病毒疾病负担的减少可能是由于家庭和社区中年龄较小、接种疫苗的儿童提供的间接保护。这些间接的益处甚至可能延伸到年龄较大的儿童和成人,这些群体以前被认为没有大量轮状病毒负担[29,52,53]。
轮状病毒疫苗接种与癫痫发作的预防性关联
轮状病毒感染不限于肠道;它与抗原血症和病毒血症有关,并存在全身性疾病的可能性[7]。在伴有腹泻的癫痫发作病例的脑脊液(CSF)中检测到野生型轮状病毒[54-57]和神经系统疾病在许多研究和病例报告中被归因于轮状病毒感染[57–63]。
美国[64],西班牙[65],和澳大利亚[66]证明接种轮状病毒疫苗的儿童与未接种疫苗的儿童相比,在接种疫苗后一年内需要住院或急诊治疗的癫痫发作风险降低。在美国,这代表与轮状病毒疫苗接种相关的癫痫发作风险(发热和无发热)降低了约20%。。
几种机制可以解释轮状病毒疫苗接种和癫痫发作之间的这种保护性联系,尽管几乎没有临床信息来告知我们对这种途径的理解。最可能的机制是疫苗接种直接预防全身性轮状病毒感染,包括涉及中枢神经系统的肠外并发症[67]。接种疫苗还可以预防轮状病毒感染的继发效应,包括导致神经递质失调的钙通道波动[68–70]和/或引起神经毒性的脑脊液中一氧化氮的轮状病毒相关升高[71,72]。
弱势群体:2009年和2010年,ACIP分别明确禁止在诊断为严重联合免疫缺陷的婴儿中使用RotaTeq和Rotarix疫苗。对于已知或怀疑免疫能力改变的婴儿,建议在接种轮状病毒疫苗前咨询免疫学家或传染病专家[73]。ACIP建议不包括对有肠套叠史或既往轮状病毒疫苗接种后有严重过敏反应史的人、疫苗成分或胶乳(如果施用人减毒轮状病毒疫苗)进行常规轮状病毒疫苗接种[2]。
此外,ACIP规定,在从新生儿重症监护室(或托儿所)出院时或出院后,应给符合实足年龄要求(即第1剂为6周到14周零6天)的临床稳定早产儿接种疫苗。然而,早产或患有基础疾病的婴儿患严重轮状病毒疾病和相关并发症的风险增加,并且在出院时可能不符合接种疫苗的年龄[74]。最近的数据表明,没有证据表明新生儿重症监护室中存在轮状病毒疫苗株的院内传播(IR = 0.0[95% CI = 0.0–1.3]例/1,000患者-日风险),这表明,在具有可接受的感染控制标准的机构中,可能没有必要将轮状病毒疫苗接种延迟到出院时(由于理论上存在活轮状病毒疫苗病毒的院内传播风险)[75]。
影响轮状病毒免疫的先天宿主因素
组织-血型抗原(HBGAs)是在人类呼吸道、泌尿生殖道和消化道粘膜上皮上表达的碳水化合物,作为细菌/病毒附着和细胞进入并因此感染所必需的宿主受体位点。分泌抗原产物(包括FUT2)在HBGA氏病上的表达可以通过单核苷酸多态性(SNPs)来灭活,并且那些个体已经遗传灭活FUT2生产被称为非分泌者。
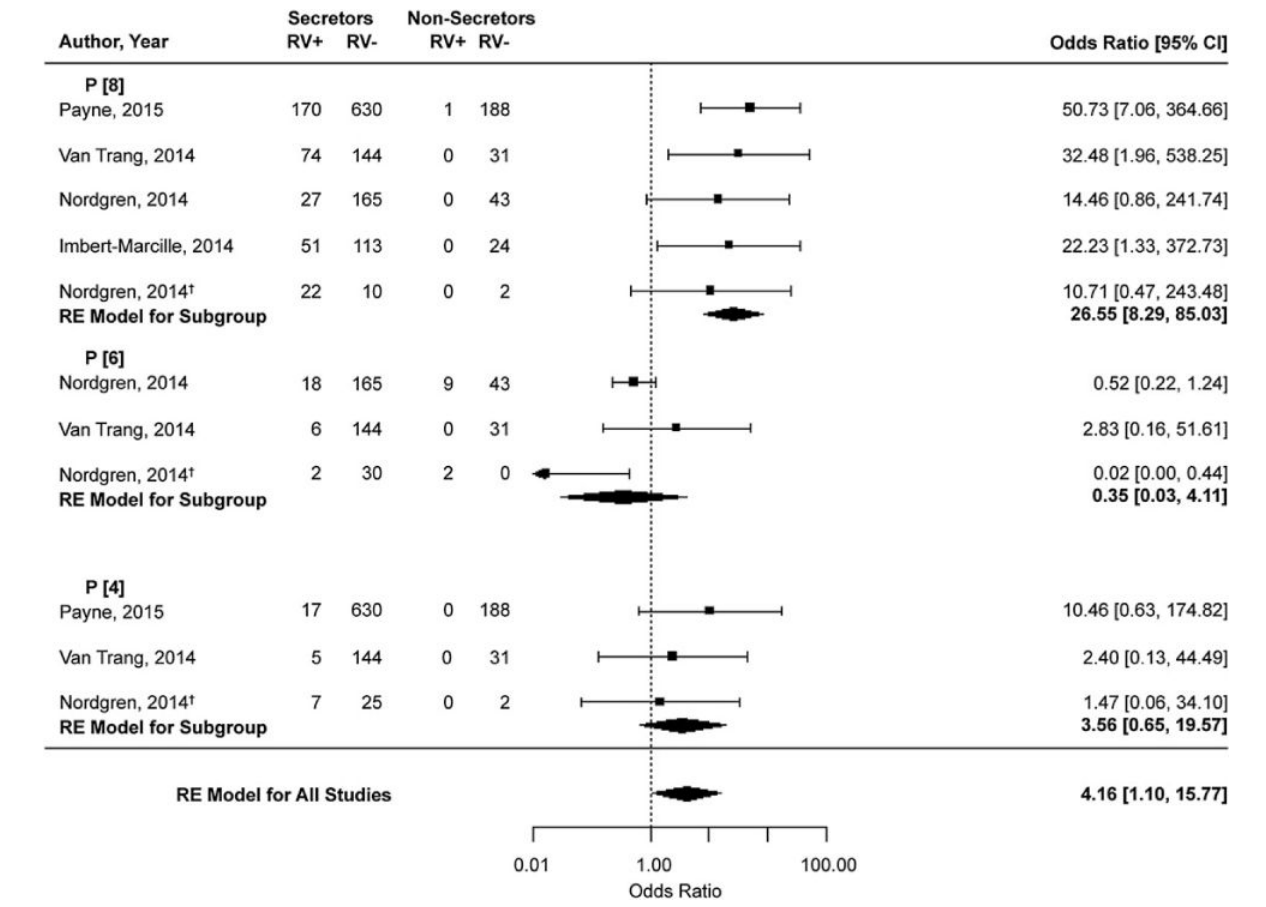
图8.宿主对肠道病毒的遗传易感性:系统综述和荟萃分析[81]
诺如病毒的HBGA功能和肠道感染之间的关系是可以接受的[76],最近,在越南人中观察到轮状病毒感染和分泌状态之间的相关性[77],法国人[78],布基纳法索[79],尼加拉瓜人[79],和美国[80]因急性胃肠炎住院的儿童,每个都显示出这些HGBA多态性与轮状病毒胃肠炎的缺失之间强有力的、统计上显著的相关性[79]。随后的荟萃分析表明,这种相关性(优势比=25)是由分泌者感染P[8]轮状病毒的可能性增加引起的[81]。对P[8]轮状病毒易感性的差异也可能表明非分泌型对疫苗接种的反应较差,这是一个正在进行进一步评估的课题(图8)。
轮状病毒趋势的数学模型
为了更好地了解轮状病毒疫苗接种对疾病趋势的影响,已经进行了一些数学建模分析。在发达国家环境中使用确定性的年龄结构模型,Atchinson等人[82]计算出轮状病毒发病率和年龄分布的短期年龄特异性波动是轮状病毒疫苗接种计划的结果,与免疫力下降或疫苗覆盖率下降无关。Pitzer等人[42]计算出严重轮状病毒病例的平均年龄会随着疫苗覆盖率的增加而增加,这是由于原发性轮状病毒感染的延迟;轮状病毒流行的时空特征在很大程度上与地理位置上完全易感个体的积累有关;轮状病毒流行率的降低会比单独接种疫苗的直接效果所预测的更大。这些模型预测与发表的经验观察相匹配[36]。
疫苗安全
在一些国际环境和美国,轮状病毒疫苗接受者中肠套叠的风险略有增加(每100,000名疫苗接受者中约1-2例)。在美国州住院患者数据库中,观察到在8-11周龄的儿童中肠套叠住院率增加,这是大多数第一剂疫苗接种的时间。这一发现与美国的其他研究一致。疫苗安全数据链(VSD)分析发现,接种2剂Rotarix疫苗后,肠套叠的归因风险为每100,000名接种疫苗的婴儿中有5.3人[83]。VSD还发现了每65,287名RotaTeq剂量-1受者发生1例肠套叠的归因风险上限[84]。鉴于与肠套叠的小幅增加相比,轮状病毒疾病的下降幅度较大,轮状病毒疫苗接种的益处被认为超过了肠套叠风险的增加。
监测的重要性
由于美国儿童免疫计划常规使用轮状病毒疫苗,因此对以下方面进行监测仍然很重要:
1.随着时间的推移,监测疫苗接种对降低轮状病毒疾病发病率和死亡率的影响;
2.评估疫苗在现场使用中的有效性,并识别和确定疫苗可能失效的原因;
3.监测可能逃脱疫苗接种的轮状病毒株的可能出现;
4.确定疫苗接种可能未充分覆盖的人群;和
5.继续监测轮状病毒疫苗的安全性。
监测工作应侧重于监测严重轮状病毒疾病的趋势,如轮状病毒住院或急诊室就诊,在国家一级并通过在哨点的更密集努力。除了严重疾病和需要医疗护理的疾病监测外,病毒株监测对于评估病毒株变异是否是一种长期现象或是否是通过疫苗压力对轮状病毒血清型进行潜在选择的结果也很重要。
目前主动、被动和基于实验室的国家轮状病毒监测包括以下内容:
1.NVSN:NVSN积极的轮状病毒监测活动始于2005年至2006年轮状病毒季节,最初有3个监测点,预计将在7个监测点继续开展。确定急性胃肠炎病例,并从父母访谈和病历审查中收集额外的流行病学和临床信息。在每个研究点对粪便标本进行轮状病毒抗原检测,CDC实验室对所有阳性标本进行分型。进行分析以估计疾病负担和评估轮状病毒疫苗在现场使用的有效性。
2.NREVSS和国家轮状病毒株监测系统通过NREVSS开展的以实验室为基础的哨点监测活动,监测与检测包括轮状病毒在内的几种病毒相关的时间和地理模式。自2000年以来,位于州和地方卫生部门、大学和医院的大约17个实验室参与了NREVSS。参与实验室每周向CDC报告提交用于轮状病毒检测的粪便标本总数和轮状病毒检测呈阳性的数量。10-12个NREVSS实验室参与了NRSSS。这些NRSSS实验室向CDC提交轮状病毒阳性粪便标本的代表性样本,以通过分子方法进行毒株表征。
3.国家卫生利用数据集的二次分析:轮状病毒疾病负担的国家估计值主要是通过对国家卫生统计中心收集的腹泻死亡率、住院率和门诊就诊率的被动监测数据进行审查得出的(例如,国家医院出院调查、国家门诊护理调查)。在这种方法中,一套国际疾病分类第九卷和第十卷临床模块(ICD-9和10-CM)代码首次用于识别急性胃肠炎事件。然后,轮状病毒胃肠炎独特的流行病学特征(即好发于4-35个月大的儿童,明显的冬季季节性)被用来估计轮状病毒引起的腹泻事件的比例。1992年引入了轮状病毒特有的ICD编码。一项验证研究发现,该代码具有较高的阳性预测值(即,编码事件极有可能是真实病例),但灵敏度小于50%。然而,通过对这些大型数据库应用各种与急性胃肠炎相关的ICD编码,并考虑轮状病毒发病率的季节性和年龄特异性分布,有可能推断出大规模轮状病毒疾病模式和影响。
疾病减少目标
健康人2020规定轮状病毒疫苗接种覆盖率达到80%的目标[85]。
病例定义
轮状病毒胃肠炎的明确诊断需要实验室确认感染。目前,州和地区流行病学家委员会(casewww.cste.org)。CDC在哨点进行的主动监测将轮状病毒胃肠炎确诊病例定义为儿童腹泻(≥24小时内3次稀便)或呕吐(≥24小时内1次发作),并通过标准检测(如市售酶免疫检测)在粪便标本中检测到轮状病毒。
实验室测试
不可能通过临床表现来诊断轮状病毒感染,因为轮状病毒胃肠炎的临床特征与其他病原体引起的胃肠炎没有区别。通过实验室检测确认轮状病毒感染对于可靠的轮状病毒监测是必要的,并且可以在临床环境中用于避免不适当的抗菌治疗。
轮状病毒在患有肠胃炎的儿童的粪便中以高浓度排出,粪便标本是诊断的优选标本。检测粪便中轮状病毒抗原最常用的方法是针对所有A组轮状病毒共有抗原的酶免疫测定(EIA)。有几种市售EIA试剂盒价格低廉、易于使用、快速且灵敏度高(约90-100%),使其适用于轮状病毒监测和临床诊断[50]。聚丙烯酰胺凝胶电泳和银染法与EIA一样灵敏,但劳动强度很大[51。乳胶凝集反应不如EIA灵敏和特异,但仍用于某些场合[50]。其他技术,包括电子显微镜、逆转录聚合酶链反应(RT-PCR)、核酸杂交、序列分析和培养,主要用于研究环境。
标本收集
标本采集和运送是获得实验室诊断或疾病确认的重要步骤。已经公布了病毒和微生物制剂的标本采集和处理指南。也有关于使用疾病控制中心实验室作为参考和疾病监测支持的信息;这包括
一个中央网站申请实验室测试;
向CDC提交标本所需的表格(见附录23,表格# CDC 0.5034);
病原体运输的一般要求信息(附录24[4页])—虽然是为了指导向CDC提交标本而编写的,但该信息可能适用于向其他实验室提交标本);和
这CDC传染病实验室测试目录,其中不仅包含该机构的可订购检测列表,还包含有关适当标本类型、采集方法、标本量和联系点的详细信息。
轮状病毒血清型可以使用EIA和RT-PCR方法从轮状病毒阳性粪便标本中直接确定。基于单克隆抗体的EIA技术在定义4种全球常见血清型(G1-G4)方面具有不可估量的价值,这4种血清型代表了90%以上的流通毒株,并构成了RotaTeq疫苗中的4/5血清型[86,87]。最近,分子方法-包括多重、半巢式RT-PCR基因分型和核苷酸测序-已被开发为血清型的替代方法,并被广泛用于鉴定最常见和几种不常见的轮状病毒G和P基因型。88-90]核苷酸测序已被广泛用于鉴定不常见的毒株和不能通过RT-PCR基因分型鉴定的遗传变异体,并确认基因分型方法的结果。
报告和病例通知
轮状病毒胃肠炎不是国家报告的疾病,CDC不要求通知。请联系州卫生部门了解您所在州的报告要求。
病案调查
通常不需要进行病例调查,除非是在轮状病毒感染暴发或出现死亡或其他严重表现的情况下。由于腹泻暴发可由多种病原体引起,对于寻求医疗护理的胃肠炎病例,应考虑对病原体进行实验室调查,包括病毒、细菌和寄生虫。
控制
婴儿的常规免疫接种被认为是控制人群轮状病毒感染的最有效的公共卫生干预措施。暴露后疫苗预防不是应对轮状病毒胃肠炎爆发的推荐策略。
参考
1.佩恩·DC、文杰·J、齐拉吉·PG等人在美国儿童中发现了诺如病毒并接受了肠胃炎治疗。新英格兰医学杂志2013;368:1121–30.doi: 10.1056/NEJMsa1206589
2.疾病控制中心。预防婴幼儿轮状病毒胃肠炎:免疫实践咨询委员会的建议(ACIP). MMWR代表2009;58(RR-2):1–25。
3.Gurwith M,Wenman W,Hinde D,Feltham S,Greenberg H .婴幼儿轮状病毒感染的前瞻性研究。感染疾病1981;144(3):218–24.doi: 10.1093/infdis/144
4.卡皮肯阿兹,查诺克RM。轮状病毒。作者:斯特劳斯·塞,编辑。病毒学领域:第2卷。第三版。费城:利平科特-瑞文;1996.第1657-708页。
5.罗德里格兹·WJ,金HW,布兰特·CD等:儿科医疗服务家庭轮状病毒感染和胃肠炎的纵向研究:临床和流行病学观察。儿科传染病杂志1987;6(2):170–6.
6.美国轮状病毒腹泻的流行病学:疾病负担的监测和评估。感染疾病1996;174(补编1):S5–11。doi: 10.1093/infdis/174。补充_1。表面抗原-5
7.卡尔森JAK,米德尔顿PJ,希曼斯基山,胡伯J,彼得里奇m。致命性轮状病毒胃肠炎:21例分析。我是孩子吗1978;132(5):477–9.
8.Butz AM,Fosarelli P,Kick J,Yolken R .日托设施高危污染物中轮状病毒的流行率。小儿科1993;92(2):202–5.
9.丹尼希博士,纳尔逊SM,克劳利巴,萨拉森CL。聚合酶链反应检测医院空气样本中轮状病毒RNA。儿科研究1998;43:143.doi:10.1203/00006450-199804001-00849
10.美国儿科学会。轮状病毒感染。在:皮克林LK,编辑。红皮书:传染病委员会2003年报告。第26版。伊利诺伊州埃尔克格罗夫村:美国科学院小儿科;2003.第534–6页。
11.Mrukowicz J,Szajewska H,Vesikari T .除疫苗接种外预防轮状病毒疾病的选择。儿科胃肠螺母2008;46:S32–7。doi:10.1097/mpg . 0 b 013 e 31816 f 79 b 0
12.Jin S,Kilgore PE,Holman RC,Clarke MJ,Gangarosa,Glass RI。1979-1992年美国儿童腹泻住院趋势:轮状病毒相关发病率的估计。儿科传染病杂志1996;15(5):397–404.
13.帕拉沙UD,霍尔曼钢筋混凝土,克拉克兆焦耳,布雷西JS,玻璃里。美国1993-1995年与轮状病毒腹泻相关的住院治疗:基于新的ICD-9-CM轮状病毒特异性诊断编码的监测。感染疾病1997;177(1):13–7.doi: 10.1086/513808
14.世界卫生组织。轮状病毒疫苗世卫组织立场文件:2013年1月-建议。疫苗2013;31:6170–1.doi: 10.1016/j .疫苗2013.05.037
15.Pickering LK,Bartlett AV III,Reves RR,Morrow A .日托中心儿童轮状病毒腹泻前后轮状病毒的无症状排泄。儿科杂志1988;112(2):361–5.
16.索尔斯伯里英尺,温克尔斯坦JA,约肯RH。免疫缺陷中的慢性轮状病毒感染。儿科杂志1980;97(1):61–5.
17.约肯RH,主教CA,汤森TR。骨髓移植受者的传染性胃肠炎。新英格兰医学杂志1982;306(17):1009–12.doi:10.1056/nejm 198204846586
18.Troussard X,Bauduer F,Gallet E,等。骨髓移植患者粪便中的病毒回收。骨髓移植1993;12(6):573–6.
19.轮状病毒是同种异体骨髓移植后长期腹泻和发病的重要原因。骨髓移植2005;36:691–4.
20.Bresee JS,Marcus R,Venezia RA,等:《美国急诊就诊成人中严重急性胃肠炎的病原学》。感染疾病2012;205:1374–81.doi: 10.1093/infdis/jis206
21.成人轮状病毒感染的流行病学。Rev传染疾病1987;9(3):461–9.doi: 10.1093/clinids/9.3.461
22.佩恩·DC,爱德华兹·柯,鲍文·医学博士,等.与轮状病毒胃肠炎相关的疫苗衍生轮状病毒(RotaTeq)的同胞间传播小儿科2010;125(2):e438–41。doi: 10.1542/peds
23.在一名患有急性肠胃炎的7岁儿童中检测到Rotateq疫苗衍生的双重重配轮状病毒。儿科传染病杂志2014;33:655-6.doi:10.1097/INF . 000000000000221
24.Boom JA,Sahni L,Payne DC等。5名儿童的症状性感染和疫苗及疫苗重配轮状病毒株的检测:病例系列。感染疾病2012;206(8):1275–9.doi: 10.1093/infdis/jis490
25.人类和动物轮状病毒株的血清型多样性和重配:轮状病毒疫苗计划的意义。感染疾病2005;192(补编1):S146–59。doi: 10.1086/431499
26.Bowen MD,Mijatovic-Rustempasic S,Esona MD,等,《上市后疫苗时代的轮状病毒毒株趋势:美国,2008–2013》。感染疾病2016;214(5):732–8.doi: 10.1093
27.赫尔·JJ,蒂尔·恩,张铠麟·泰克,等。2005-2008年美国轮状病毒毒株监测:疫苗引入前后的基因型流行率。儿科传染病杂志2011;30(1):S42–7。doi:10.1097/INF . 0b 013 e 3181 fefd 78
28.Boom JA,泰特·JE,Sahni LC,等:《五价轮状病毒疫苗在美国大城市人群中的有效性》。小儿科2010;125(2):e199–207。doi: 10.1542/peds
29.佩恩·DC、斯塔特·马、爱德华兹·KM等:2006-2009年美国3个县轮状病毒疫苗接种对儿童住院的直接和间接影响。临床感染疾病。2011;53(3):245–53.doi: 10.1093/cid/cir307
30.Block SL,Vesikari T,Goveia MG,等.五价人-牛(WC3)重组轮状病毒疫苗在保质期结束时的功效、免疫原性和安全性。小儿科2007;119(1):11–8.doi: 10.1542/peds
31.Vesikari T,Matson DO,Dennehy P,等。五价人-牛(WC3)重组轮状病毒疫苗的安全性和有效性。英国医学杂志2006;354(1):23–33.doi: 10.1056/NEJMoa052664
32.Ruiz-Palacios GM,Pérez-Schael I,Velázquez FR,等.抗严重轮状病毒胃肠炎减毒疫苗的安全性和有效性。英国医学杂志2006;354(1):11–22.doi: 10.1056/NEJMoa052434
33.维斯卡里T,卡尔沃宁A,普乌斯蒂宁L,等。RIX 4414人轮状病毒减毒活疫苗在芬兰婴儿中的效力。儿科传染病杂志2004;23(10):937–43.
34.维斯卡里T,卡尔沃宁A,普雷穆拉R,等。欧洲婴儿出生后2年内人类轮状病毒疫苗对轮状病毒胃肠炎的疗效:随机双盲对照研究。柳叶刀2007;370(9601):1757–63.doi:10.1016/s 0140-6736(07)61744-9
35.Hill HA,Elam-Evans LD,Yankey D,等。19-35个月儿童的疫苗接种覆盖率——美国,2015年。 Morb莫尔布凡人周代表2016;65(39):1065-71.doi: 10.15585/mmwr.mm6539a4
36.帕拉沙尔UD,吉布森CJ,布雷西JS,等。轮状病毒和严重的儿童腹泻。急诊传染病2006;12(2):304–6.多伊:10.3201/开斋节
37.阿利亚巴迪N,泰特JE,海恩斯AK等;疾病控制中心。实施常规疫苗接种后,轮状病毒实验室检测持续下降——美国,2000–2014年. Morb莫尔布凡人周代表 2015;64:337–42.
38.柯恩斯在,斯坦纳CA,巴雷特M,亨特K,威尔逊E,帕拉沙UD。引入轮状病毒疫苗后,美国儿童急性胃肠炎住院率降低:对美国18个州出院数据的分析。感染疾病2010;201(11):1617–24.doi: 10.1086/652403
39.实施轮状病毒疫苗后美国儿童的急性胃肠炎住院。睡衣裤2015;313(22):2282–4.doi:10.1001/jama
40.2003年至2013年实施轮状病毒疫苗接种后,美国10个州儿童急性胃肠炎急诊就诊率下降儿科传染病杂志2016;35(7):782–6.doi: 10.1097/INF
41.佩恩·DC。记录美国轮状病毒疫苗接种影响的十年:理解后轮状病毒疫苗引入时代。在第5届泰国(Thailand)欧洲轮状病毒疫苗专家会议;2017年3月21日,荷兰乌得勒支。
42.Pitzer VE,Viboud C,Simonsen L,等。轮状病毒流行的人口统计学可变性、疫苗接种和时空动力学。科学2009;325(5938):290–4.doi:10.1126/科学
43.Cortese MM,Dahl RM,Curns AT,等:《美国接受轮状病毒疫苗儿童家庭的肠胃炎预防》。感染疾病2015;211(4):558-62.doi: 10.1093/infdis/jiu503
44.轮状病毒相关的住院和急诊费用以及轮状病毒疫苗计划的影响。疫苗2013;31(38):4164–71.doi: 10.1016/j .疫苗2013.06.085
45.Leshem E,Moritz RE,Curns AT,等。美国腹泻的轮状病毒疫苗和医疗保健利用(2007-2011)。 小儿科2014;134(1):15–23.doi: 10.1542/peds
46.Boom JA、泰特·JE、Sahni LC等在美国一家大型城市儿科医院进行了为期两年的五价轮状病毒疫苗持续保护研究。儿科传染病杂志2010;29(12):1133–5.doi:10.1097/INF . 0b 013 e 3181 ed 18 ab
47.斯塔特马,佩恩DC,多瑙尔S,等。五价轮状病毒疫苗对轮状病毒疾病的有效性。小儿科2011;128(2):e267–75。doi: 10.1542/peds
48.Desai SN,Esposito DB,Shapiro ED,Dennehy PH,Vázquez M .轮状病毒疫苗预防美国康涅狄格州幼儿轮状病毒胃肠炎住院的有效性。疫苗2010;28(47):7501–6.doi:10.1016/日本疫苗
49.佩恩·DC、塞尔瓦兰根·R、阿兹米·PH等,《美国轮状病毒疫苗保护的长期一致性:RV5和RV1疫苗在美国儿童中的有效性》, 2012–2013年。临床感染疾病2015;61(12):1792–9.doi: 10.1093/cid/civ872
50.Immergluck LC,Parker TC,Jain S,等。单价和五价轮状病毒疫苗在儿童中的持续有效性。儿科杂志2016;172:116-20.doi:10.1016/j . jped . 2016 . 01 . 042
51.佩恩·DC,苏莱马纳一世,帕拉沙·UD。轮状病毒混合疫苗治疗重症轮状病毒胃肠炎的效果评价。JAMA儿科杂志, 2016;170(7):708–10.doi:10.1001/JAMA pediatrics . 2016.0014
52.澳大利亚国家儿童疫苗计划中引入轮状病毒疫苗后轮状病毒相关急性胃肠炎的减少。儿科传染病杂志2011;30(1):S25–9。doi: 10.1097
53.Lopman BA,Curns AT,Yen C,等。在美国,婴儿轮状病毒疫苗可能为较大的儿童和成人提供间接保护。感染疾病2011;204(7):980–6.doi: 10.1093/infdis/jir492
54.Dickey M,Jamison L,Michaud L,等。以前健康儿童的轮状病毒脑膜脑炎和文献回顾。儿科传染病杂志2009;28(4):318–21.doi:10.1097/INF . 0b 013 e 31818 ddbe 9
55.itur iza-góMara M,Auchterlonie IA,Zaw,Molyneaux P,Desselberger U,Gray J .轮状病毒胃肠炎和中枢神经系统(CNS)感染:从患有CNS疾病的儿童的配对粪便和脑脊液样本中分离的轮状病毒株的VP7和VP4基因的特征。临床微生物学杂志2002;40(12):4797–9.2002年12月40日
56.用逆转录聚合酶链反应检测惊厥和胃肠炎患者脑脊液和血液中的轮状病毒。大脑发育1993;15(6):457–9.doi:10.1016/0387-7604(93)90088-P
57.Abe T,Kobayashi M,Araki K,等。轻度胃肠炎伴婴儿惊厥。大脑发育2000;22(5):301–6.doi:10.1016/0387-7604(00)00111-X
58.王,香港。良性癫痫发作伴轻度腹泻20例临床分析。犯罪行为 1993;34(6):451–7.
59.Contino MF,Lebby T,Arcinue EL。引起婴儿和儿童无热性癫痫发作的轮状病毒胃肠道感染。我是急救医生 1994;12(1):94–5.
60.林世春,许海燕,王,等。小儿轮状病毒胃肠炎伴无热惊厥。中华郭敏小可儿一薛辉杂碎1996;37(3):204–7.
61.洪,温海燕,颜明辉,等。小儿轮状病毒胃肠炎伴无热惊厥40例临床分析。长庚医学杂志 2003;26(9):654–9.
62.良性无热丛集性惊厥伴胃肠炎:一项观察性研究。BMC儿科2004;4:2.doi: 10.1186/1471-2431-4-2
63.汤普森MJ,高迪PJ,柯克伍德·丹尼尔CD,等。轮状病毒小脑炎:一个老敌人的新观点?Ped神经元2012;46(1):48–50.doi: 10.1016/j .儿科神经病学. 2011.10.002
64.佩恩·DC,贝格斯J,泽尔D,柯恩斯AT,温特劳布E,帕拉沙尔·UD。美国儿童接种轮状病毒疫苗后一年内与儿童期癫痫发作之间的保护性关联。临床信息诊断2013;58(2):173–7.doi: 10.1093/cid/cit671
65.帕尔多-塞科J、塞贝-洛佩斯M、马丁农-托雷斯等。轮状病毒疫苗接种对儿童癫痫住院的影响。 儿科传染病杂志2015;34(7):769–73.doi: 10.1097/INF
66.谢里登SL,Ware RS, 格林伍德K轮状病毒疫苗时代的热性惊厥。儿科感染疾病学会2016;5(2):206–9.doi: 10.1093/jpids/piu097
67.DiFazio MP,Braun L,Freedman S,等.儿童轮状病毒引起的癫痫发作。儿童神经病学杂志2007;22(12):1367–40.土井:10/08870 . 48888888881
68.轮状病毒感染神经元中内质网相关蛋白靶向轴突和树突。大脑研究公牛 1998;46(4):353–60.
69.Morris A,Scott J,Ball J,Zeng,O’Neal WK,Estes MK. NSP4引起年龄依赖性腹泻和Ca(2+)介导的I(-)流入CF小鼠的肠隐窝。美国生理学杂志1999;277(2):G431–4。
70.轮状病毒非结构糖蛋白NSP4具有膜去稳定活性。j病毒 1996;70(10):6973–81.
71.轮状病毒所致惊厥患者的血清和脑脊液亚硝酸盐/硝酸盐水平。生命科学 2004;74(11):1397–1405.
72.张军,Dawson V,Dawson T,等。一氧化氮在神经毒性中对聚ADP-核糖合成酶的激活作用。科学 1994;263(5147):687–9.
73.疾病控制中心。添加严重联合免疫缺陷作为轮状病毒疫苗的禁忌症. Morb莫尔布凡人周代表 2010;59(22):687–8.
74.Dennehy PH,Cortese MM,Begue RE,等:一项确定美国儿童轮状病毒胃肠炎住院风险因素的病例对照研究。儿科传染病杂志2006;25(12):1123–31.doi: 10.1097/01.inf
75.霍夫斯特特·阿姆,拉康姆猪·K,克莱恩·EJ等,《住院婴儿轮状病毒疫苗摄入和无院内传播》。小儿科2017;已提交。
76.诺沃克病毒感染和疾病与ABO组织血型有关。感染疾病2002;185(9):1335–7.doi: 10.1086/339883
77.庄女,吴,李,黄平,蒋X,杨丹。越南儿童诺如病毒和轮状病毒感染与组织血型抗原类型的关系。临床微生物学杂志2014;52(2):1366–74.doi: 10.1128/JCM.02927-13
78.Imbert-Marcille BM,Barbé L,Dupé M等. FUT2基因常见多态性决定对P[8]基因型轮状病毒A的抗性。感染疾病2014;209(8):1227–30.doi: 10.1093/infdis/jit655
79.Lewis和分泌状态以轮状病毒基因型依赖的方式介导对轮状病毒感染的易感性。临床感染疾病2014;59(11):1567–73.doi: 10.1093
80.佩恩·DC,库里耶·R,斯塔特·马等。美国儿童中FUT2分泌状态与严重轮状病毒胃肠炎之间的流行病学联系。JAMA儿科杂志2015;169(11):1040–5.doi:doi:10.1001/牙买加儿科杂志2015.2002
81.坎汉帕蒂A,佩恩DC,康斯坦丁五世,洛普曼巴。宿主对肠道病毒的遗传易感性:系统综述和荟萃分析。临床感染疾病2016;62(1):11–8.doi: 10.1093/cid/civ873
82.大规模轮状病毒疫苗接种的自然动力学。发表于2010年9月4日在南非约翰内斯堡举行的第9届国际轮状病毒研讨会。
83.单价轮状病毒疫苗接种后肠套叠的风险。英国医学杂志2014;370(6):513–9.doi: 10.1056/NEJMoa1311738
84.美国婴儿接种五价轮状病毒疫苗后发生肠套叠的风险。睡衣裤2012;307(6):598–604.doi:2012年10月10日
85.美国卫生与公众服务部。IID-7.10。在19至35个月的儿童中实现并保持2剂或更多剂或3剂或更多剂轮状病毒疫苗的有效覆盖率。2020年健康人。DC华盛顿州:美国卫生与公众服务部;2017.
86.使用血清1型、2型、3型和4型VP7特异性单克隆抗体对粪便中的人轮状病毒进行直接血清分型。感染疾病1987;155(1):1159–66.doi: 10.1093/infdis/155.6.1159
87.库尔森,乙,尤尼康勒,皮特森加,主教射频。用单克隆抗体进行简单而特异的酶免疫测定对人轮状病毒进行血清分型。临床微生物学杂志1987;25(3):509–5.
88.10年间(1982-1991)从日本腹泻儿童中发现的人类轮状病毒中VP4基因等位基因的相对频率。临床微生物学杂志1993;31(8):2195–97.
89.粪便标本中轮状病毒核酸的聚合酶链反应扩增和分型。临床微生物学杂志1990;28(2):276–82.
90.聚合酶链反应鉴定A组轮状病毒基因4型。临床微生物学杂志1992;30(6):1365–73.
相关页面
上次审阅时间:2018年5月18日
来源:国家免疫和呼吸疾病中心
Hits: 113

