Contents
RSV单抗BEYFORTUS FDA
BEYFORTUS (nirsevimab-alip) injection, for intramuscular use
Initial U.S. Approval: 2023
处方信息要点
这些重点不包括使用所需的所有信息
安全有效的BEYFORTUS。请参阅BEYFORTUS的完整处方信息。
肌肉注射用BEYFORTUS(nirsevimab-alip)
美国首次批准时间:2023年
————适应症及用法————
BEYFORTUS是一种呼吸道合胞病毒F蛋白定向融合抑制剂,用于预防呼吸道合胞病毒下呼吸道疾病
在:
在第一个呼吸道合胞病毒流行季出生或进入该流行季的新生儿和婴儿。( 1)
在第二个呼吸道合胞病毒流行季仍易患严重呼吸道合胞病毒疾病的24个月以下儿童。( 1)
————剂量和用法————
肌肉注射给药。(2.1)
推荐剂量:
在第一个呼吸道合胞病毒流行季出生或进入该流行季的新生儿和婴儿:
体重不足5公斤者为50毫克。(2.1)
如果体重大于或等于5公斤,则为100毫克。(2.1)
在第二个呼吸道合胞病毒流行季仍然脆弱的儿童:
200毫克(2次100毫克注射)。(2.1)
————剂型和强度————
注射:
单剂量预装注射器中的50毫克/0.5毫升。(3)
单剂量预装注射器中的100毫克/毫升。(3)
————禁忌症————
BEYFORTUS禁用于对nirsevimab-alip或任何辅料有严重过敏反应(包括过敏反应)史的婴儿和儿童。(4)
————警告和注意事项————
包括过敏反应在内的超敏反应:在其他人IgG1单克隆抗体中观察到严重的超敏反应,包括过敏反应。开始适当的药物治疗和/或支持疗法。(5.1)
————不良反应————
最常见的不良反应是皮疹(0.9%)和注射部位反应(0.3%)。(6.1)
1-855-239-3678或FDA 1-800-FDA-1088或www.fda.gov/medwatch.
BEYFORTUS对24个月以上儿童的安全性和有效性尚未确定。(8.4)
有关患者咨询信息和FDA批准的患者标签,请参见第17节
修订日期:2023年7月
| 完整的处方信息:内容* | 12临床药理学 14.2预防胎龄≥29至<35周出生的婴儿感染马呼吸道合胞病毒LRTI(03号试验) 14.3预防胎龄≥35周出生的婴儿感染马呼吸道合胞病毒LRTI(04号试验) 胎龄和患有早产儿CLD或血流动力学显著冠心病的婴儿(05号试验) *未列出完整处方信息中省略的章节或小节。 |
完整的处方信息
1适应症和用法
BEYFORTUS适用于预防呼吸道合胞病毒(RSV)下呼吸道疾病:
在第一个呼吸道合胞病毒流行季出生或进入该流行季的新生儿和婴儿。
在第二个呼吸道合胞病毒流行季仍易患严重呼吸道合胞病毒疾病的24个月以下儿童。
2剂量和用法
2.1推荐剂量
新生儿和婴儿:第一个呼吸道合胞病毒流行季
对于在RSV流行季期间或进入RSV流行季出生的新生儿和婴儿,从出生时开始使用BEYFORTUS。对于在RSV流行季之外出生的婴儿,考虑到BEYFORTUS提供的保护持续时间,在RSV流行季开始之前给药一次BEYFORTUS【参见临床药理学(12.2)】.
在第一个呼吸道合胞病毒流行季出生或进入第一个呼吸道合胞病毒流行季的新生儿和婴儿的BEYFORTUS推荐剂量基于体重(见表1),以单次肌肉注射(IM)的方式给药。
表1新生儿和婴儿出生时或进入第一个RSV流行季
| 给药时的体重 | 建议用量 |
| 不到5公斤 | 肌肉注射50毫克 |
| 5公斤及以上 | 肌肉注射100毫克 |
仍处于严重呼吸道合胞病毒病高风险中的儿童:第二个呼吸道合胞病毒流行季
对于在第二个呼吸道合胞病毒感染流行季患严重呼吸道合胞病毒病的风险仍然较高的24个月大的儿童,BEYFORTUS的推荐剂量为一次200 mg剂量,分两次肌肉注射(2 x 100 mg)。
接受体外循环心脏手术的儿童
对于接受体外循环心脏手术的儿童,建议在手术后儿童病情稳定后立即给予额外剂量的BEYFORTUS,以确保足够的nirsevimab-alip血清水平。BEYFORTUS的推荐剂量为肌肉注射。
第一个RSV流行季:
如果手术是在接受BEYFORTUS后90天内进行的,则额外剂量应基于额外剂量时的体重。有关基于重量的剂量,请参考表1。
如果接受BEYFORTUS后已超过90天,无论体重如何,额外剂量应为50 mg。
第二个RSV流行季:
如果在接受BEYFORTUS后90天内进行手术,则无论体重如何,额外剂量都应为200 mg。
如果自接受BEYFORTUS以来已过去90天以上,则无论体重如何,额外剂量应为100 mg。
2.2注射说明
BEYFORTUS必须由医疗服务提供者注射。
只要溶液和容器允许,注射用药品在给药前应目视检查是否有颗粒物质和变色。BEYFORTUS是一种透明至乳白色、无色至黄色的溶液。如果液体混浊、变色或含有大颗粒或异物,请勿注射BEYFORTUS。
如果BEYFORTUS预装注射器掉落或损坏,纸箱上的安全密封被破坏或过期,请不要使用。
BEYFORTUS有50毫克和100毫克的预装注射器。检查BEYFORTUS纸盒和预装注射器上的标签,确保使用正确的50 mg或100 mg产品。
与儿童疫苗和免疫球蛋白产品合用
BEYFORTUS可以与儿童疫苗同时接种【参见临床药理学(12.3)】。当与注射疫苗同时使用时,应使用单独的注射器在不同的注射部位注射。不要在同一个注射器或小瓶中将BEYFORTUS与任何疫苗或药物混合。
没有关于BEYFORTUS与其他免疫球蛋白产品合用的信息。Palivizumab不应用于在同一流行季已经接受BEYFORTUS治疗的婴儿。在呼吸道合胞病毒流行季,一旦开始使用帕利维珠单抗进行预防治疗,没有关于用BEYFORTUS替代帕利维珠单抗的数据。在第二个呼吸道合胞病毒感染流行季之前或期间,可对24个月以下易患严重呼吸道合胞病毒感染的儿童以及在第一个呼吸道合胞病毒感染流行季接受帕利韦单抗治疗的儿童使用BEYFORTUS【参见不良反应(6.1)和临床研究(14.3)】.
单剂量预填充注射器的给药说明
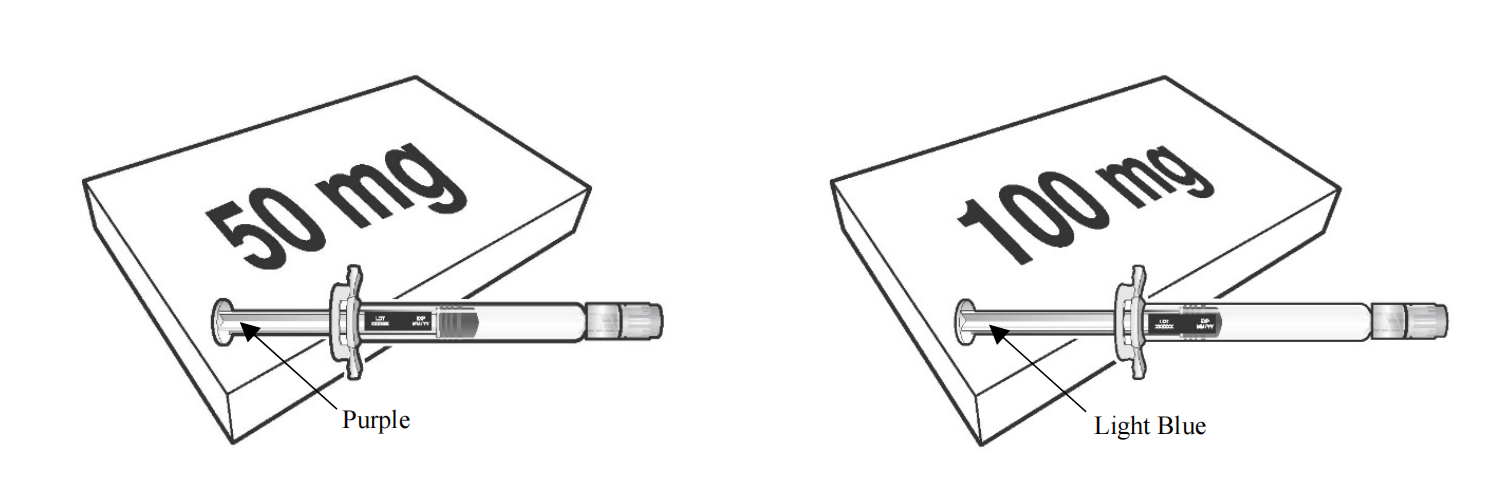
BEYFORTUS 50毫克(50毫克/0.5毫升)预装注射器,配有紫色柱塞杆。
BEYFORTUS 100毫克(100毫克/毫升)预装注射器,配有浅蓝色柱塞杆。
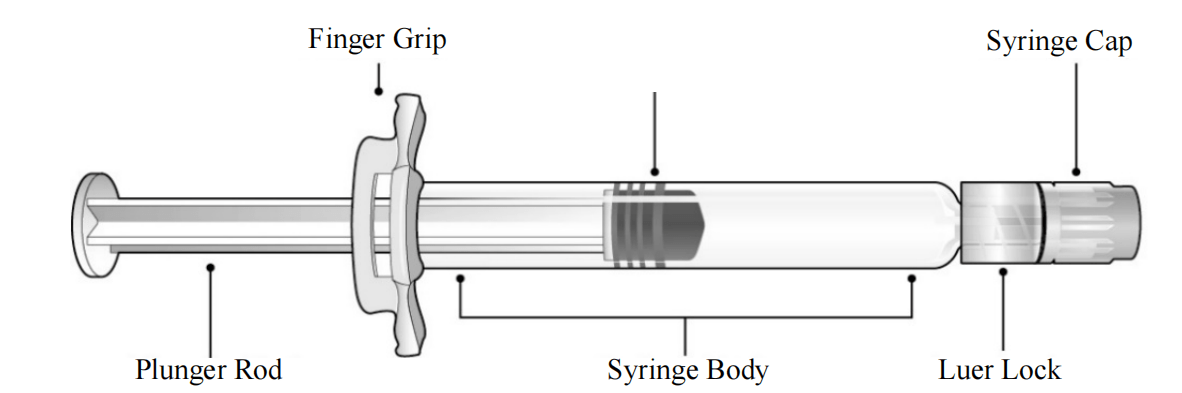
 请参考图1了解预装注射器组件。
请参考图1了解预装注射器组件。
图1鲁尔锁注射器组件
第一步:用一只手握住鲁尔锁(Luer lock)(避免握住柱塞杆( plunger rod)或注射器主体(syringe body)),用另一只手逆时针拧松注射器盖子。
第二步:将鲁尔锁定针轻轻顺时针拧到预充式注射器上,直至感觉到轻微阻力,从而将其连接到预充式注射器上。
第三步:用一只手握住注射器主体,用另一只手小心地将针头盖直接拉下。取下针头盖时不要握住柱塞杆,否则橡胶塞可能会移动。不要触摸针头或让它接触任何表面。不要重新盖上针头或将其从注射器上拆下。
第四步:将BEYFORTUS预填充注射器的全部内容物进行肌肉注射,最好在大腿的前外侧注射。臀肌不应用作注射部位,因为有损伤坐骨神经的风险。
第五步:将注射器丢弃到锐器容器中。
如果需要两次注射,请在不同的注射部位重复步骤1-5。
3剂型和强度
BEYFORTUS是一种透明至乳白色、无色至黄色的溶液,具体如下:
注射:50毫克/0.5毫升,单剂量预装注射器。
注射:100毫克/毫升,单剂量预装注射器。
4禁忌症
BEYFORTUS禁用于对nirsevimab-alip或任何辅料有严重过敏反应(包括过敏反应)史的婴儿和儿童【参见警告和注意事项(5.1)和说明(11)】.
5警告和注意事项
5.1过敏反应,包括过敏反应
在其他人免疫球蛋白G1(IgG 1)单克隆抗体中观察到了严重的超敏反应,包括过敏反应。如果出现具有临床意义的超敏反应或过敏反应的体征和症状,开始适当的药物治疗和/或支持治疗。
5.2用于患有临床显著出血疾病的个体
与任何其他肌内注射一样,患有血小板减少症、任何凝血障碍的婴儿和儿童或接受抗凝治疗的个人应慎用BEYFORTUS。
6不良反应
6.1临床试验经验
因为临床试验是在变化很大的条件下进行的,所以在一种药物的临床试验中观察到的不良反应率不能与另一种药物的临床试验中的不良反应率直接比较,并且可能不能反映实际观察到的不良反应率。
在2期和3期临床试验(试验03、04和05)中,共有3,224名儿科受试者接受了推荐剂量的BEYFORTUS,其中包括2,119名胎龄(GA)大于或等于35周的婴儿和1,105名胎龄小于35周的婴儿。在05号试验中,共有247名患有早产儿慢性肺病(CLD)或血流动力学显著先天性心脏病(CHD)的任何GA的婴儿接受了BEYFORTUS的推荐剂量。
新生儿和婴儿进入第一个呼吸道合胞病毒流行季(试验03和试验04)
03号试验是一项随机、双盲、安慰剂对照试验,在胎龄大于或等于29周至小于35周的早产儿中进行。受试者以2:1的比例随机接受肌肉注射BEYFORTUS(N = 968)或安慰剂(N=479)。无论体重如何,随机分配至BEYFORTUS的所有受试者均接受了单次50毫克肌注剂量。03号试验的安全性数据仅针对接受推荐剂量的BEYFORTUS组婴儿【体重低于5 kg且接受单剂量50mg BEYFORTUS IM(N = 572)或安慰剂(N=288)的婴儿】。
04号试验是一项3期随机双盲安慰剂对照试验,针对出生时间大于或等于35周的晚期早产儿和足月儿进行。试验04将受试者按顺序纳入两个队列:主要队列用于主要疗效分析【参见临床研究(14.3)】并且安全性群组主要用于安全性评估。04试验两个队列的所有受试者均被纳入安全性分析(BEYFORTUSN=1,998和安慰剂N=996)。04试验中体重小于5 kg的受试者接受单次50 mg肌注剂量的BEYFORTUS,体重大于或等于5 kg的婴儿接受单次100 mg肌注剂量。
将试验03中接受推荐剂量的婴儿和试验04中的婴儿进行汇总,以评估BEYFORTUS(N = 2,570)与安慰剂(N=1,284)相比的安全性。在随机分组时,在试验03和04队列的汇总安全性人群中,22%的婴儿出生时GA小于35周,10%的婴儿GA大于或等于35周且小于37周;68%的妊娠大于或等于37周;52%是男性;57%是白人;15%是黑人;4%是美国印第安人/阿拉斯加土著人;4%是亚洲人;1%是太平洋岛民;19%是其他种族或混血儿;30%是西班牙裔或拉丁裔;73%来自北半球;53%的人体重不到5公斤。中位年龄为2个月;65%少于或等于3个月;28%的婴儿大于3个月至小于或等于6个月,7%的婴儿大于6个月。(参见第14.2节和第14.3节“临床研究”,了解03号和04号试验的疗效人群说明)。在这两项试验中,婴儿在研究第1天接受单剂量IM BEYFORTUS或安慰剂,并在给药后至少监测60分钟。给药后对受试者随访360天以评估安全性。接受BEYFORTUS的受试者中有1.2%报告了不良反应;大多数(97%)不良反应的强度为轻度至中度。
表2总结了在试验03和试验04(安全性人群)中接受推荐剂量BEYFORTUS的受试者发生的不良反应。
表2安全性人群中报告的不良反应发生率高于安慰剂*(试验 03和04)
| 副反应 | BEYFORTUS N = 2,570 % | 安慰剂 N = 1,284 % |
| 皮疹†(给药后14天内出现) | 0.9 | 0.6 |
| 注射部位反应ǂ(在给药后7天内发生) | 0.3 | 0 |
*安全性人群包括在试验03和04中接受了推荐剂量的BEYFORTUS的所有受试者:来自试验04的主要和安全性队列;03号试验中体重小于5 kg且接受了推荐剂量的BEYFORTUS(单次50 mg肌注剂量)的婴儿。
†皮疹由以下分组首选术语定义:皮疹、斑疹、斑疹丘疹、丘疹丘疹。
ǂ注射部位反应由以下分组的优选术语定义:注射部位反应、注射部位疼痛、注射部位硬结、注射部位水肿、注射部位肿胀。
胎龄小于35周出生的婴儿以及患有早产儿CLD或血流动力学显著冠心病的婴儿和儿童(05号试验)
RSV第一季
BEYFORTUS的安全性在试验05中进行了评估,该试验是一项针对严重RSV疾病高危婴儿的随机、双盲、帕利珠单抗对照多中心试验。这些受试者以2:1的比例随机接受BEYFORTUS(N = 614)或palivizumab(N = 304)肌肉注射。接受BEYFORTUS治疗的614名婴儿包括128名出生时小于29周的早产儿、390名出生时大于或等于29周小于35周的早产儿以及96名出生时大于或等于35周的晚期早产儿和足月儿。在第一个RSV流行季登记的婴儿中,患有早产儿CLD或血流动力学显著冠心病的婴儿总数分别为214和103,与胎龄无关。其中,12名婴儿同时患有CLD和冠心病。
05号试验中体重小于5 kg的受试者接受单次50 mg肌注剂量的BEYFORTUS,体重大于或等于5 kg的婴儿接受单次100 mg肌注剂量。在研究第1天给予BEYFORTUS一次,随后给予4次每月肌注剂量的安慰剂;帕利维珠单抗每月肌注给药5个月。给药后对所有受试者进行至少60分钟的监测。给药后对受试者随访360天以评估安全性。
在第一个RSV流行季接受BEYFORTUS治疗的05号试验受试者中报告的不良反应与03号和04号试验中接受BEYFORTUS治疗的受试者中报告的不良反应相似。
RSV第二季(患有早产儿CLD和血流动力学显著冠心病的受试者)
患有早产儿CLD或血流动力学显著冠心病的受试者可继续参加05号试验,并在第二个RSV流行季前接受BEYFORTUS或帕利珠单抗治疗。所有在第一个RSV流行季接受BEYFORTUS的受试者也在第二个RSV流行季接受了BEYFORTUS(N = 180)。在第一个RSV流行季接受帕利珠单抗治疗的受试者被重新随机分配到第二个RSV流行季接受BEYFORTUS治疗(N=40)或帕利珠单抗治疗(N=42)。在第二个RSV流行季接受BEYFORTUS(N = 220)或palivizumab(N = 42)的CLD或冠心病儿童在给药后150天内的安全性数据可用。这些儿童在第二个呼吸道合胞病毒流行季期间的BEYFORTUS安全性与第一个呼吸道合胞病毒流行季期间观察到的BEYFORTUS安全性一致。
7药物相互作用
7.1对RT-PCR或快速抗原检测RSV诊断分析的干扰
nirsevimab-alip不干扰逆转录聚合酶链式反应(RT-PCR)或快速抗原检测RSV诊断试验,这些试验采用靶向RSV融合(F)蛋白上抗原位点I、II或IV的市售抗体。对于临床观察与RSV感染一致时为阴性的免疫学检测结果,建议使用基于RT-PCR的检测进行确认。
8在特定人群中使用
8.1怀孕
BEYFORTUS不适用于具有生殖潜力的女性。
8.2哺乳
BEYFORTUS不适用于具有生殖潜力的女性。
8.4儿科使用
BEYFORTUS的安全性和有效性已被证实可用于预防在第一个呼吸道合胞病毒流行季出生或进入第一个呼吸道合胞病毒流行季的新生儿和婴儿以及在第二个呼吸道合胞病毒流行季仍易患严重呼吸道合胞病毒疾病的24个月以下儿童的呼吸道合胞病毒下呼吸道疾病。在整个标签中讨论了BEYFORTUS对该适应症和人群的安全性和有效性。
在新生儿和12个月以下婴儿中进行的充分且对照良好的研究以及24个月以下儿童的额外药代动力学和安全性数据支持使用BEYFORTUS治疗该适应症【参见不良反应(6.1)、临床药理学(12.3)和临床研究(14)】。
BEYFORTUS在年龄超过24个月的儿童中的安全性和有效性尚未确定。
10用药过量
BEYFORTUS用药过量的经验有限。
BEYFORTUS用药过量没有特效疗法。如果用药过量,应监测患者是否出现不良反应,并酌情给予对症治疗。
11描述
nirsevimab-alip是一种呼吸道合胞病毒F蛋白定向融合抑制剂,是通过重组DNA技术在中国仓鼠卵巢(CHO)细胞中产生的人免疫球蛋白G1κ(IgG 1κ)单克隆抗体。分子量约为146.3 kDa。
BEYFORTUS(nirsevimab-alip)注射液是一种无菌、不含防腐剂、澄清至乳白色、无色至黄色的肌肉注射溶液。它装在单剂量硅化Luer lock型玻璃预装注射器中,配有氟涂层柱塞塞。
每0.5毫升含有50毫克nirsevimab-alip、盐酸精氨酸(8毫克)、组氨酸(1.1毫克)、盐酸L-组氨酸一水合物(1.6毫克)、聚山梨醇酯80(0.1毫克)、蔗糖(21毫克)和注射用水(USP)。pH值为6.0。
每1毫升含有100毫克nirsevimab-alip、盐酸精氨酸(17毫克)、组氨酸(2.2毫克)、盐酸L-组氨酸一水合物(3.3毫克)、聚山梨醇酯80(0.2毫克)、蔗糖(41毫克)和注射用水(USP)。pH值为6.0。
12临床药理学
12.1作用机制
BEYFORTUS是具有抗呼吸道合胞病毒活性的单克隆抗体【参见微生物学(12.4)】.
12.2药效学
血清nirsevimab-alip AUC(基于基线时的清除率)高于12.8 mg*天/mL与接受医疗护理的RSV下呼吸道感染(MA RSV LRTI)的较低发生率之间呈正相关。成人肌肉注射nirsevimab-alip后,nirsevimab-alip给药后8小时血清中的RSV中和抗体水平比基线高约4倍,成人肌肉注射nirsevimab-alip后第6天达到最高水平。BEYFORTUS在成人中的安全性和有效性尚未确定。
保护期限
根据临床数据,单剂BEYFORTUS提供的保护持续时间可长达5个月。
12.3药代动力学
儿童受试者单次肌肉注射25 mg(最低批准推荐剂量的0.5倍)至200 mg的nirsevimab-alip的药代动力学与剂量成比例。使用推荐剂量后,在第一个RSV流行季出生或进入第一个RSV流行季的新生儿和婴儿中的nirsevimab-alip血清暴露量相似(试验03和04),在第一个RSV流行季出生不足35周(包括出生不足29周)的新生儿和婴儿中的nirsevimab-alip血清暴露量相似(试验05),在第一个和第二个RSV流行季患有CLD或冠心病的儿童受试者中的nirsevimab-alip血清暴露量相似(试验05)。
吸收
估计nirsevimab-alip的绝对生物利用度为84%,达到最大浓度的中位时间(范围)为6(1 . 28)天。
分布
对于体重5公斤的婴儿,估计nirsevimab-alip的总分发量为477毫升。
半衰期
nirsevimab-alip的终末半衰期约为71天,体重为5公斤的婴儿的估计清除率为3.42毫升/天。
新陈代谢
nirsevimab-alip通过分解代谢途径降解为小肽。
特定人群
根据种族或对严重呼吸道合胞病毒疾病的易感性(即CLD病、冠心病、妊娠<29周或免疫缺陷状态),未观察到nirsevimab-alip的药代动力学存在临床显著差异。预计肾脏或肝脏损伤不会对nirsevimab-alip药代动力学产生影响。
药物相互作用研究
尚未对BEYFORTUS进行正式的药物相互作用研究。根据对单克隆抗体的机理理解,nirsevimab-alip预计不会成为细胞色素P450酶或转运系统的底物、抑制剂或诱导物。
临床研究
疫苗:BEYFORTUS与疫苗合用的经验有限。在临床试验中,当BEYFORTUS与常规儿童疫苗同时给药时,联合给药方案的安全性和反应原性与单独给药的儿童疫苗相似。
12.4微生物学
作用机理
nirsevimab-alip是一种重组人IgG1κ单克隆抗体,通过靶向RSV F蛋白的融合前构象提供被动免疫。nirsevimab-alip是长效的,因为Fc区的三重氨基酸取代(YTE)增加了与新生儿Fc受体的结合,从而延长了血清半衰期。nirsevimab-alip与融合前蛋白上抗原位点的保守表位结合,对于RSV亚型A和B株的解离常数分别为KD = 0.12 nM和KD = 1.22nM;它通过抑制病毒和细胞膜融合以及病毒进入所必需的F蛋白构象变化来中和RSV。
抗病毒活性
使用培养的Hep-2细胞在浓度-反应模型中测量nirsevimab-alip对RSV的细胞培养中和活性。nirsevimab-alip中和了2003年至2017年间从全球各地收集的临床RSV分离株,RSV A的中位EC50值为21pM(3.2 ng/mL)(n = 70;范围为下午3点【0.48纳克/毫升】至下午100点【15纳克/毫升】)和下午19点(2.9纳克/毫升)的呼吸道合胞病毒B(n = 49;范围从下午2点【0.3纳克/毫升】到下午398点【59.7纳克/毫升】)。
抗病毒耐药性
在细胞培养中
在存在nirsevimab-alip的情况下,在RSV A2和B9320株的细胞培养物中进行三次传代后选择逃逸变体。与参考毒株相比,重组RSV A变异株对nirsevimab-alip的易感性降低,包括N67I+N208Y取代的变异株(降低103倍)。对nirsevimab-alip的易感性降低的重组RSV B变异体包括N208D(》90,000倍变化)、N208S(》24,000倍变化)、K68N+N201S(》13,000倍变化)和K68N+N208S(》90,000倍变化)的变异体。在中和逃逸变异体中鉴定的所有抗性相关取代都位于nirsevimab-alip结合位点(氨基酸62-69和196-212),并显示降低了与RSV F蛋白的结合亲和力。
在监视审判中
在1956-2014年收集的分离株中,未观察到RSV A的多态性使对nirsevimab-alip的易感性大大降低,RSV B的多态性也很少(<1%),包括K65Q+K68N(1,239倍变化)、K65Q+S211N(36倍变化)和L203I(3,005倍变化)替换。在前瞻性、观察性、全球分子流行病学研究(OUTSMART-RSV和INFORM-RSV)中,RSV F蛋白序列的遗传多样性仍然较低(RSV A和RSV B中的大多数氨基酸》99%保守)。携带已知nirsevimab- alip抗性相关取代的变体很少见(<1%),包括RSV B取代N201T(》406倍变化)和N201T+I206M+Q209R(》418倍变化)。观察到的易感性降低的变体包括RSV A取代K68E(13倍变化)和S275F(6倍变化),以及RSV B取代K68N(30倍变化)、K68Q+I206M+Q209R(46倍变化)和N201S(127倍变化)。这些易感性降低的临床意义尚不清楚。从2015年到2021年,在RSV A的所有位置和RSV B的25个位置中的22个位置,nirsevimab-alip结合位点中的大多数氨基酸残基都是高度保守的(》99%)。自2017年以来在RSV B中流行的nirsevimab-alip结合位点中的共发生置换I206M+Q209R并没有降低对nirsevimab-alip的易感性(<5倍变化)。流行率增加的S211N替代也保留了对nirsevimab-alip的易感性,无论是单独使用还是与I206M+Q209R同时使用。
在临床试验中
在试验04和试验05中,在任何采样时间点均未发现频率≥25%的已知耐药相关替代。新型替代物的表型测试正在进行中。
在03号试验中(世卫组织接受了50毫克的单剂量BEYFORTUS),40名符合任何病例定义的RSV感染受试者中有2名具有包含nirsevimab-alip耐药性相关替代的变体。这两名受试者接受的nirsevimab-alip剂量低于推荐剂量,并且具有携带I64T+K68E+I206M+Q209R共现替换或N208S替换的RSV B变体。I64T、K68E和N208S取代分别降低了nirsevimab-alip的易感性(倍数变化分别为》496、》283和》387)。
在试验04中,在一名接受BEYFORTUS治疗150天的受试者中,以≥25%的频率检测到含有结合位点置换L204S(无表型数据)同时伴有I206M+Q209R+S211N置换(<5倍变化)的RSV B变异体。在第150天接受BEYFORTUS治疗的一名受试者中发现了一种出现I64T+K68E替换(》280倍变化)频率<25%的RSV B变异株。
交叉抗性
现有的有限数据显示,耐nirsevimab-alip的变异株可能对帕利韦单抗具有交叉耐药性。帕利维珠单抗保留了针对03号试验和04号试验中确定的耐药性相关替代的完全中和效力。nirsevimab-alip保留了对重组RSV的活性,该重组RSV含有在分子流行病学研究和帕利珠单抗中和逃逸变体中鉴定的帕利珠单抗抗性相关取代;S275F替代将易感性降低了6倍。
12.6免疫原性
观察到的抗药物抗体(ADA)的发生率高度依赖于检测的灵敏度和特异性。分析方法的差异排除了下述研究中ADA发病率与其他研究中ADA发病率的有意义比较,包括nirsevimab-alip或其他nirsevimab产品的研究。
在试验03中接受推荐剂量nirsevimab-alip的572名受试者中,3.3%(16/492)的受试者在第361天呈ADA阳性。在16名ADA阳性受试者中,94%(15/16)有抗YTE的ADA,无抗nirsevimab-alip中和抗体检测阳性者。
在试验04中,7%(55/830)的受试者在第361天呈ADA阳性,其中22%(12/55)的受试者具有中和抗体,96%(53/55)的受试者具有抗YTE的ADA。
在试验05中,在第一个RSV流行季登记的受试者中,在第361天,6%(32/534)的受试者ADA呈阳性。在32名ADA阳性受试者中,6%(2/32)具有针对nirsevimab-alip的中和抗体,97%(31/32)具有针对YTE置换的抗体。
在试验03、04和05中,无法确定ADA在第151天对nirsevimab-alip血清浓度的影响。接受产生抗nirsevimab-alip抗体的BEYFORTUS的受试者在第361天的nirsevimab-alip浓度降低(与接受未产生抗nirsevimab-alip抗体的BEYFORTUS的受试者相比,降低了50%至60%)。由于ADA和马呼吸道合胞病毒LRTI在临床试验中的发生率较低,因此尚不清楚这些ADA对BEYFORTUS疗效的影响。
13非临床毒理学
13.1致癌、诱变、生育能力受损
尚未对BEYFORTUS进行致癌、诱变和生殖毒性研究。
14项临床研究
14.1临床试验描述
在表3中总结的试验中,评估了BEYFORTUS在足月儿和早产儿中的疗效和安全性。
表3使用BEYFORTUS进行的预防LRTI马呼吸道合胞病毒的试验
| 试验 | 人口 | 研究武器 |
| D5290C00003(试验03) NCT02878330 | 出生≥29至<35周的婴儿进入第一个呼吸道合胞病毒流行季 | BEYFORTUS(N = 969)*安慰剂(N=484) |
| D5290 c 00004(04号试验) NCT03979313 | 出生≥35周的婴儿进入第一个呼吸道合胞病毒流行季 | 初级队列: BEYFORTUS(994例)安慰剂(496例) 安全队列ǂ: BEYFORTUS(N =1,015)安慰剂(N=507) |
| D5290C00005(试验05) NCT03959488 | 出生不足35周的婴儿和出生时患有CLD或冠心病的婴儿进入第一个呼吸道合胞病毒流行季 患有CLD或冠心病的婴儿仅进入第二个呼吸道合胞病毒流行季 | RSV第一季: BEYFORTUS(616例)帕利维珠单抗(304例) RSV第二季: BEYFORTUS(220例)帕利维珠单抗(42例) |
GA孕周;CLD慢性肺病;血液动力学显著的慢性心脏病
* 03号试验中的所有受试者均被纳入疗效分析。无论体重如何,03号试验中的所有受试者均接受50毫克的BEYFORTUS肌肉注射。对于体重<5 kg和≥5 kg的新生儿和婴儿,在第一个呼吸道合胞病毒流行季出生或进入第一个呼吸道合胞病毒流行季的新生儿和婴儿的推荐剂量分别为单次IM 50 mg和100 mg【参见剂量和给药(2.1)】.
†试验04的主要疗效分析基于主要队列中的受试者。对于试验04安全性人群【参见不良反应(6.1)】.
ǂ试验04安全性分析包括主要和安全性队列【参见不良反应(6.1)】.
14.2预防胎龄≥29至<35周出生的婴儿感染马呼吸道合胞病毒LRTI(03号试验)
03号试验是一项随机、双盲、安慰剂对照的多中心试验,旨在预防接受医疗护理的呼吸道合胞病毒下呼吸道感染(马呼吸道合胞病毒LRTI),试验对象为胎龄大于或等于29周且小于35周的早产儿。这些受试者以2:1的比例随机接受肌肉注射BEYFORTUS(N = 969)或安慰剂(N=484)。无论体重如何,BEYFORTUS组的所有受试者均接受50 mg肌注的BEYFORTUS。在第一个呼吸道合胞病毒流行季出生或进入第一个呼吸道合胞病毒流行季的新生儿和婴儿的推荐剂量分别为体重小于5公斤和大于或等于5公斤的人单次IM 50毫克或100毫克【参见剂量和给药(2.1)】.
随机分组时,20%的GA大于或等于29周且小于32周;80%的妊娠大于或等于32周且小于35周;52%是男性;72%是白人;18%是黑人;1%是亚洲人;1%是太平洋岛民,8%是其他种族或混血儿;22%是西班牙裔或拉丁裔;68%来自北半球。中位年龄为2.8个月(范围:0.1至11.9个月);53%小于或等于3个月;33%大于3个月至小于或等于6个月,14%大于6个月。
主要终点是给药后150天内由RT-PCR证实的RSV引起的主要为细支气管炎或肺炎的MA RSV LRTI的发生率。医疗护理(MA)包括所有
医疗保健提供者就诊,如医生诊室、急诊、急诊室就诊和住院。LRTI受累的症状包括干咳、罗音、爆裂声或喘息;和至少一种临床严重性恶化的迹象,包括以下至少一种:呼吸频率增加、低氧血症、急性低氧或通气衰竭、新发作的呼吸暂停、鼻胀、回缩、呼噜声或呼吸窘迫导致的脱水。住院期间RSV LRTI的发生率是预先指定的次要终点。RSV住院被定义为因RSV检测呈阳性的LRTI住院。
表4显示了试验03的主要疗效结果。
表4在≥29周至<35周至150天出生的婴儿中MA RSV LRTI的发生率(试验03)
| N | 发病率%(n) | 功效*(95%置信区间) | |
| BEYFORTUS | 969 | 2.6% (25) | 70.1% (52.3, 81.2)†ǂ |
| 安慰剂 | 484 | 9.5% (46) |
* MA RSV LRTI的疗效基于与安慰剂相比的相对风险降低,并根据随机化和半球的年龄进行了调整。p值=<0.001。
ǂ在一项对03试验中所有随机婴儿的事后分析中,这些婴儿在基线时体重小于5 kg,并接受了推荐剂量的BEYFORTUS,基于相对于安慰剂的相对风险降低,MA RSV LRTI的疗效为86.2%(95% ci 68.0,94.0);与安慰剂相比,基于相对风险降低的RSV LRTI住院治疗的疗效为86.5%(95%可信区间为53.5,96.1)。
在试验03中,根据相对风险降低率,BEYFORTUS对出生于孕龄大于或等于29周且小于35周的住院婴儿(接受单剂量50毫克BEYFORTUS治疗)的马呼吸道合胞病毒LRTI感染的疗效为78.4%(95%可信区间为51.9,90.3;p=0.0002),直到给药后150天。
14.3≥35周胎龄出生婴儿MA RSV LRTI的预防(试验04)
在一项3期随机、双盲、安慰剂对照多中心试验(试验04)中对BEYFORTUS进行了评估,以预防进入第一个RSV流行季的大于或等于35周的足月和晚期早产儿感染MA RSV LRTI。
主要分析人群(主要队列)包括1,490名足月和晚期早产儿(GA大于或等于35周)。受试者以2:1的比例随机接受单次肌注剂量的BEYFORTUS(N = 994)(给药时体重小于5 kg的受试者为50 mg,体重大于或等于5 kg的受试者为100 mg)或安慰剂(N=496)。随机分组时,14%的GA大于或等于35周且小于37周;86%的妊娠大于或等于37周;52%是男性;53%是白人;28%是黑人;6%是美洲印第安人/阿拉斯加土著人;4%是亚洲人;1%是太平洋岛民;8%为其他种族或混血儿;10%是西班牙裔或拉丁裔;69%来自北半球;40%的人体重不到5公斤。中位年龄为2.6个月(范围:0.03至11.10个月);58%小于或等于3个月;32%大于3个月至小于或等于6个月,10%大于6个月。
在试验04中,主要终点是由RT-PCR证实的RSV引起的MA RSV LRTI的发生率,如试验03中所定义。住院期间RSV LRTI的发生率是预先指定的次要终点。RSV住院被定义为因RSV检测呈阳性的LRTI住院。
表5显示了04号试验的主要疗效结果。
表5接种后≥35周至150天出生的婴儿中马呼吸道合胞病毒LRTI的发病率(04号试验)*
| N | 发病率%(n) | 功效† (95%置信区间) | |
| BEYFORTUS | 994 | 1.2% (12) | 74.9% (50.6, 87.3)ǂ |
| 安慰剂 | 496 | 5.0% (25) |
* 04号试验的主要疗效分析基于主要队列中的受试者。
†MA RSV LRTI的疗效基于相对于安慰剂的相对风险降低,并根据随机分组时的年龄进行了调整。
ǂ p值=<0.001。
在04号试验中,根据相对风险降低率,出生时大于或等于35周的婴儿(体重小于5 kg和大于或等于5 kg的婴儿分别接受单次肌注50 mg或100 mg剂量)接受BEYFORTUS治疗马呼吸道合胞病毒LRTI感染住院的疗效为60.2%(95% CI-14.6,86.2;p=0.09),直到给药后150天。
14.4在<35周胎龄出生的婴儿和CLD早产儿或血流动力学显著性冠心病患儿中MA RSV LRTI的预防(05号试验)
在一项2/3期随机、双盲、帕利珠单抗对照多中心试验(05号试验)中,对出生不足35周的儿童受试者和患有早产儿CLD或血流动力学显著冠心病的婴儿进行了BEYFORTUS的安全性和药代动力学评估。该试验未对疗效进行评估,但疗效被评估为次要终点。BEYFORTUS在早产儿(GA小于35周)第一个呼吸道合胞病毒感染流行季和24个月以下患有CLD或先心病的儿童受试者第一个和第二个呼吸道合胞病毒感染流行季的疗效通过将BEYFORTUS在03号试验和04号试验中的疗效外推到05号试验中的受试者人群来确定,该外推法基于04号试验和05号试验中受试者相似的nirsevimab-alip暴露【参见临床药理学(12.3)】.
审判05: RSV第一季
试验05将进入第一个呼吸道合胞病毒感染流行季的严重呼吸道合胞病毒感染高风险婴儿纳入两个队列之一:早产儿(出生小于35周)和患有早产儿CLD或血流动力学显著冠心病的婴儿。在早产儿(n=615)和CHD冠心病(n=310)队列中,共有925名婴儿按2:1随机接受BEYFORTUS或帕利维珠单抗治疗。婴儿接受单次肌注剂量的BEYFORTUS(给药时体重小于5 kg的为50 mg,体重大于5 kg的为100 mg),然后分别接受4次每月一次的安慰剂肌注剂量或5次每月一次的15 mg/kg帕利珠单抗肌注剂量。在随机分组时,在早产儿队列中,77名婴儿(13%)小于29周GA;其中499例(81%)的预产期大于或等于29至小于35周。在CHD冠心病队列中,70%患有早产CHD34%有血流动力学显著的冠心病;123名婴儿(40%)小于29周GA,28%大于或等于29周至小于35周GA;32%大于或等于35周。在这两个群体中,54%是男性;79%是白人;10%是黑人;5%是亚洲人;2%是美国印第安人/阿拉斯加土著人;15%是西班牙裔或拉丁裔;57%的人体重不到5公斤。中位年龄为3.5个月(范围:0.07至12.3个月);45%少于或等于3个月;34%大于3个月至小于或等于6个月,21%大于6个月。
在试验05的第一个RSV流行季中,BEYFORTUS组在给药后150天内的MA RSV LRTI发生率为0.6%(4/616),palivizumab组为1.0%(3/309)。
审判05: RSV第二季
在第二个RSV流行季的试验中,年龄不超过24个月的患有早产儿CLD或血流动力学显著冠心病的儿科受试者继续接受试验(n=262)。在第一个RSV流行季接受BEYFORTUS的受试者也接受了
进入第二个RSV流行季的BEYFORTUS单剂量200 mg,随后每月肌注4次安慰剂(n=180)。在第一个RSV流行季接受帕利珠单抗治疗的受试者以1:1的比例重新随机接受BEYFORTUS或帕利珠单抗治疗,进入第二个RSV流行季。在第一个RSV流行季接受帕利维珠单抗治疗的40名受试者在第二个RSV流行季接受了单次肌注剂量的BEYFORTUS治疗,随后接受了每月4次肌注剂量的安慰剂治疗;42名受试者在第一和第二个RSV流行季接受了帕利韦单抗治疗(每月5次肌肉注射15 mg/kg帕利韦单抗)。
在试验05的第二个RSV流行季中,在接受BEYFORTUS或palivizumab的受试者中,在给药后150天内没有出现MA RSV LRTI病例。
16如何供应/储存和搬运
如何供应
BEYFORTUS注射液是一种无菌、不含防腐剂、澄清至乳白色、无色至黄色的溶液,供应如下:
一个装在纸盒中的50毫克/0.5毫升单剂量预装注射器:NDC 49281-575-00
五支50毫克/0.5毫升单剂量预装注射器装在一个纸盒中:NDC 49281-575-15
一个装在纸盒中的100毫克/毫升单剂量预装注射器:NDC 49281-574-88
五支100毫克/毫升单剂量预装注射器装在一个纸箱中:NDC 49281-574-15
每个BEYFORTUS预填充注射器仅供一次性使用。储存和搬运
在36℉至46℉(2℃至8℃)之间冷藏储存。BEYFORTUS可在室温68℉至77℉(20℃至25℃)下保存最多8小时。从冰箱中取出后,BEYFORTUS必须在8小时内使用或丢弃。
将BEYFORTUS存放在原纸箱中,避免光照,直至使用。不要冻结。不要摇晃。不要暴露在高温下。
17患者咨询信息
建议儿童的护理人员阅读FDA批准的患者标签(患者信息)。剂量和用法
告知护理人员儿童将由医务人员通过肌肉注射接受一剂BEYFORTUS。如果儿童感染RSV的风险仍然增加,他们可以在第二个RSV流行季接种第二剂疫苗【参见剂量和
注射(2.1)】。
制造商:瑞典南达科他州阿斯利康公司SE-15185美国许可证号2059
经销商:赛诺菲巴斯德公司,宾夕法尼亚州斯威夫特沃特市,邮编:18370 USA BEYFORTUS是赛诺菲集团公司的商标。阿斯利康2023
| 患者信息 BEYFORTUS(图斯湾) (nirsevimab-alip) 注射液,肌肉注射用 |
| BEYFORTUS是什么? BEYFORTUS是一种处方药,用于帮助预防呼吸道合胞病毒(RSV)引起的严重肺部疾病: 在第一个呼吸道合胞病毒流行季出生或进入第一个呼吸道合胞病毒流行季的新生儿和1岁以下婴儿。 在第二个呼吸道合胞病毒流行季仍有患严重呼吸道合胞病毒疾病风险的24个月以下儿童。BEYFORTUS是一种含有nirsevimab-alip的抗体,用于帮助预防RSV疾病5个月。尚不清楚BEYFORTUS对年龄超过24个月的儿童是否安全有效。 |
| 如果你的孩子对nirsevimab-alip有严重过敏反应史或者BEYFORTUS的任何成分。有关BEYFORTUS的完整成分列表,请参见本患者信息手册的结尾部分。 |
| 在您的孩子接受BEYFORTUS之前,请告知您的医疗保健提供者您孩子的所有医疗状况,包括您的孩子是否: 对BEYFORTUS有过反应。 有出血或瘀伤问题。如果你的孩子有容易出血或擦伤的问题,注射可能会引起问题。 告诉您孩子的医疗保健提供者您孩子服用的所有药物,包括处方药和非处方药、维生素和草药补充剂。如果您的婴儿在同一呼吸道合胞病毒流行季已经接种了BEYFORTUS,则不应再接种一种名为palivizumab的药物。 |
| BEYFORTUS是如何赋予的? BEYFORTUS是由您孩子的医疗保健提供者以注射形式提供的,通常在大腿(腿部)肌肉注射。 您的孩子应该在RSV流行季之前或期间接受BEYFORTUS。RSV流行季是一年中的时间 当呼吸道合胞病毒感染最常见时,通常发生在秋季至春季。您的医疗保健提供者可以告诉您您所在地区的呼吸道合胞病毒流行季何时开始。 您的孩子在接种BEYFORTUS疫苗后仍可能感染呼吸道合胞病毒。与您孩子的医疗保健提供者讨论要寻找哪些症状。 如果您的孩子进行了心脏手术,您孩子的医疗保健提供者可能需要在手术后不久给孩子进行额外的BEYFORTUS注射。 |
| BEYFORTUS可能有哪些副作用? .严重的过敏反应在其他药物如BEYFORTUS中也发生过。如果您的孩子出现以下任何严重过敏反应的迹象或症状,请立即寻求医疗帮助: 脸、嘴或舌头肿胀 皮肤、嘴唇或指甲下呈蓝色 吞咽或呼吸困难 肌肉无力 对严重皮疹、荨麻疹或瘙痒无反应 BEYFORTUS最常见的副作用包括儿童注射部位出现皮疹、疼痛、肿胀或硬度。 这些并不是BEYFORTUS所有可能的副作用。 打电话给你的医生询问关于副作用的医疗建议。您可以拨打1-800-FDA-1088向FDA报告副作用。 |
| 关于安全有效使用BEYFORTUS的一般信息。 有时开药的目的并非患者信息单中所列的目的。您可以向药剂师或医疗保健提供者咨询专为医疗专业人员编写的BEYFORTUS相关信息。 |
| BEYFORTUS的成分是什么?活性成分:nirsevimab-alip 非活性成分:精氨酸盐酸盐、组氨酸、L-组氨酸盐酸盐一水合物、聚山梨醇酯80、蔗糖和注射用水。 制造商:瑞典南达科他州阿斯利康公司SE-15185美国许可证号2059 经销商:赛诺菲巴斯德公司,宾夕法尼亚州斯威夫特沃特市,邮编:18370 USA BEYFORTUS是赛诺菲集团公司的商标。阿斯利康2023 有关更多信息,请访问https://www.Beyfortus.com或致电1-855-239-3678(1-855-BEYFORTUS)。 |
此患者信息已获美国美国食品药品监督注射局批准。发布日期:2023年7月
Reference ID: 5203445
Hits: 165
