Contents
第27a章:呼吸道合胞体病毒
呼吸道合胞体病毒 2015年9月
疾病
呼吸道合胞病毒(RSV)是一种包膜RNA病毒,属于肺炎病毒属中的副粘病毒科。该病毒具有编码11种蛋白质的非节段单链负向基因组。病毒上的两种表面糖蛋白(G和F)具有帮助病毒结合和融合到细胞的重要功能。糖蛋白G将病毒与宿主细胞结合,F将病毒包膜与宿主细胞的质膜融合,因此病毒可以进入宿主细胞。F蛋白还刺激感染细胞的质膜融合,导致在组织培养中观察到的特征性“合胞体”模式。基于G蛋白的结构变异,RSV的两个主要亚型(A和B)已被确定。每种亚型的优势随着季节的变化而变化,并且与疾病的严重程度无关。该病毒缺乏流感病毒中存在的神经氨酸酶和血凝素表面糖蛋白(Black,2003)。
RSV是呼吸道感染的常见原因。它通常会在成人和儿童中引起轻度自限性呼吸道感染,但在急性下呼吸道感染风险增加的婴儿中可能会很严重。RSV最著名的原因是引起婴儿细支气管炎。
RSV具有高度传染性,但人类是唯一已知的宿主。潜伏期从两天到八天不等。病毒通过呼吸道飞沫或接触受污染的表面或物体,从呼吸道分泌物中传播。到两岁时,几乎所有的儿童都至少感染过一次RSV(Henderson et al.,1979)。以前被RSV感染可能仅赋予RSV部分免疫力,因此个体可能被相同或不同的RSV毒株重复感染(Oshansky et al.,2009)。
RSV感染的诱发因素包括早产、心肺疾病、免疫缺陷,也可能包括其他因素,如烟草暴露、日托护理、过度拥挤、缺乏母乳喂养和在RSV季节住院。被呼吸道合胞病毒感染的人
出现一系列症状,如鼻炎(流鼻涕、打喷嚏或鼻塞)、咳嗽、气短、发烧、嗜睡和食欲下降。症状可进展为哮吼、细支气管炎和急性下呼吸道感染。儿童也可能发生耳部感染(Black,2003)。
有人认为,RSV感染可能与短期或长期并发症有关,包括呼吸系统并发症,如呼吸暂停和低氧血症、心血管异常和细菌感染(Leung et al.,2005)。早期患有呼吸道合胞病毒毛细支气管炎的儿童在儿童期后期发展为哮喘的风险增加,并且复发性喘息的风险增加(Sigurs et al.,2005)。那些最有可能发展为严重且有时致命的RSV感染的是早产的非常年幼的婴儿,他们具有诸如慢性肺病(CLD)、先天性心脏病(CHD)的易患病条件或免疫缺陷的儿童(Wang et al.,2008)。
疾病的历史和流行病学
RSV感染是一种明确识别的冬季病毒(健康保护局,2005),通常在英国10月至3月期间发生,大多数感染发生在大约6周的相对较短的流行期。虽然仲冬高峰的出现是可以预测的,但其规模每年都有所不同(图1和图2)。
健康保护局监测英格兰和威尔士的RSV活动水平,并在整个RSV季节发布信息。流行病学数据包含在HPA每周流感报告中(www . HPA . org . uk/Topics/infectious diseases/infection az/seasonal fluid/epidemiological data/)这些数据也刊登在《健康保护》周刊上报告(www.hpa.org.uk/hpr/)。
RSV监测数据从基于医院的微生物实验室报告中收集。接受RSV检测的绝大多数样本来自1岁以下的儿童,其次是1至4岁的儿童(图3)(健康保护局,2010年)。作为基于社区的皇家全科医师学会流感样疾病监测计划的一部分,也收集了一些关于RSV的数据。
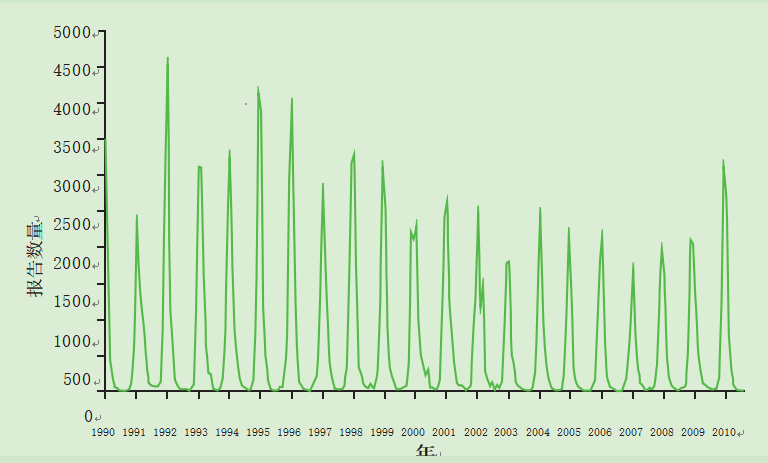
图1 RSV感染的季节性分布——1990年至2010年英格兰和威尔士各年所有鉴定的实验室报告(健康保护局,2010年)。
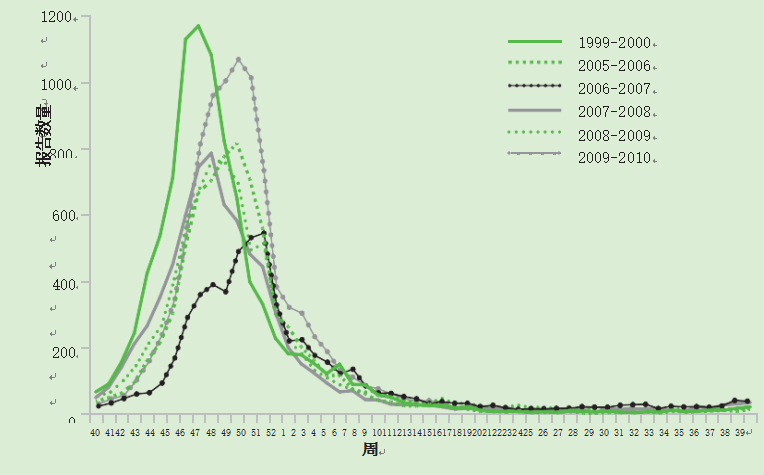
图2 RSV感染的季节性分布-1999-2010年英格兰和威尔士每周所有鉴定的实验室报告(健康保护局,2010年)。
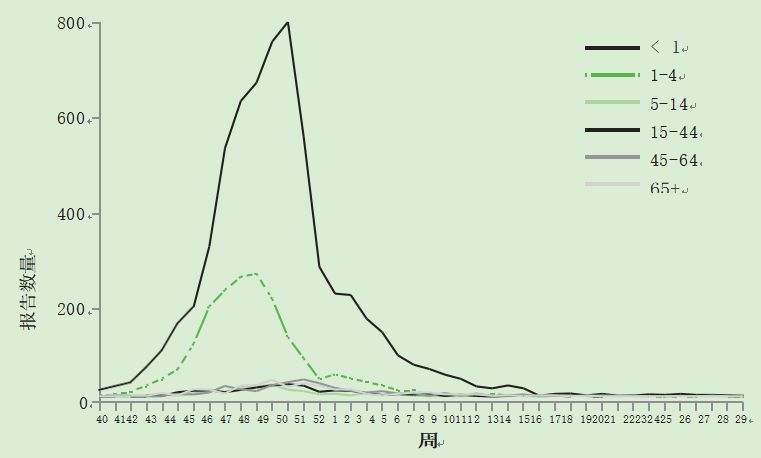
图3 2009年按样本日期(周)和年龄分列的呼吸道合胞病毒实验室报告
–2010年(健康保护局,2010年)。
毛细支气管炎是一岁以下儿童住院的常见原因;大约1%到3%的RSV感染儿童需要住院治疗。“高危”儿童的死亡率约为3%(Müller-Pebody et al., 2002)。先存疾病,尤其是心脏异常和多种并存疾病,与严重RSV感染导致的死亡风险显著增加相关(Thorburn,2009)。RSV相关的死亡率在发展中国家最高,但RSV可能对所有国家的护理成本和经济造成重大负担(Greenough et al., 2004; Nair et al., 2010)。
RSV免疫接种
Synagis®
Synagis® (Palivizumab)是一种人源化单克隆抗体(IgG11K ),使用重组DNA技术在小鼠骨髓瘤宿主细胞中产生。它提供对RSV的被动免疫。帕利单抗针对呼吸道合胞病毒(RSV)F蛋白A抗原位点的表位。因此,抗体靶向负责融合病毒和宿主细胞的RSV的F蛋白,并因此抑制病毒进入宿主细胞(Johnson et al.,1997,Harkensee et al.,2006)。这种被动免疫已被证明在降低高危儿童RSV住院率和严重并发症方面是安全有效的(Impact-RSV Study Group, 1998; Feltes et al., 2003)。Palivizumab在体内的半衰期为18至21天。在RSV季节需要每月给药以维持其浓度在保护水平(Johnson,1997)。
Synagis®是Palivizumab的唯一许可形式(欧洲药品管理局,2010年)。产品特性概要(SPC)(电子药品概要,2010年)指出,本品适用于预防因呼吸道合胞病毒(RSV)引起的需要住院治疗的严重下呼吸道疾病,适用于以下呼吸道合胞病毒疾病高危儿童,即:
- 妊娠35周或更短时间内出生且在RSV季节开始时年龄不足6个月的儿童
- 在过去六个月内因支气管肺发育不良需要治疗的两岁以下儿童
- 两岁以下患有严重先天性心脏病的儿童。
JCVI的建议在“被动免疫的使用建议”一节中。
储存
Synagis®应储存在原包装中,温度为+2℃至+8℃,并避光保存。它需要以类似于疫苗的方式处理,所有疫苗在某种程度上都对热和冷敏感。高温加速了大多数疫苗效力的下降,从而缩短了它们的保质期。除非储存在正确的温度下,否则无法保证疫苗的有效性。冷冻可能导致效力损失,也可能导致容器出现细微裂缝,导致内容物污染。
剂型
Synagis®提供50毫克或100毫克粉末和注射用溶剂(安瓿[I型玻璃]中的1毫升水)。
- 50毫克粉末装在4毫升小瓶(I型玻璃)中,带塞子(溴化丁基橡胶)
- 100毫克粉末装在10毫升带塞子(溴化丁基橡胶)的小瓶(I型玻璃)中
SPC中给出了混合Synagis®的说明如下(电子药品简编,2010)(图4):
1.对于50毫克小瓶,Synagis®从沿小瓶内壁提供的安瓿中缓慢加入0.6毫升水,以尽量减少起泡。那儿有每个小瓶中的剩余量(额外粉末),允许从50毫克小瓶中抽取0.5毫升,只要它们已按照说明重新配制。对于100毫克的小瓶Synagis®,从沿小瓶内壁提供的安瓿中缓慢加入1.0毫升水,以尽量减少起泡。两种制剂的最终复溶浓度均为100毫克/毫升。
2.加水后,稍微倾斜小瓶并轻轻旋转小瓶30秒。不要摇动小瓶。
3.溶液应在室温下静置至少20分钟,直到溶液澄清。该溶液不含防腐剂,应在制备后三小时内服用。任何剩余的内容物应在使用后丢弃。
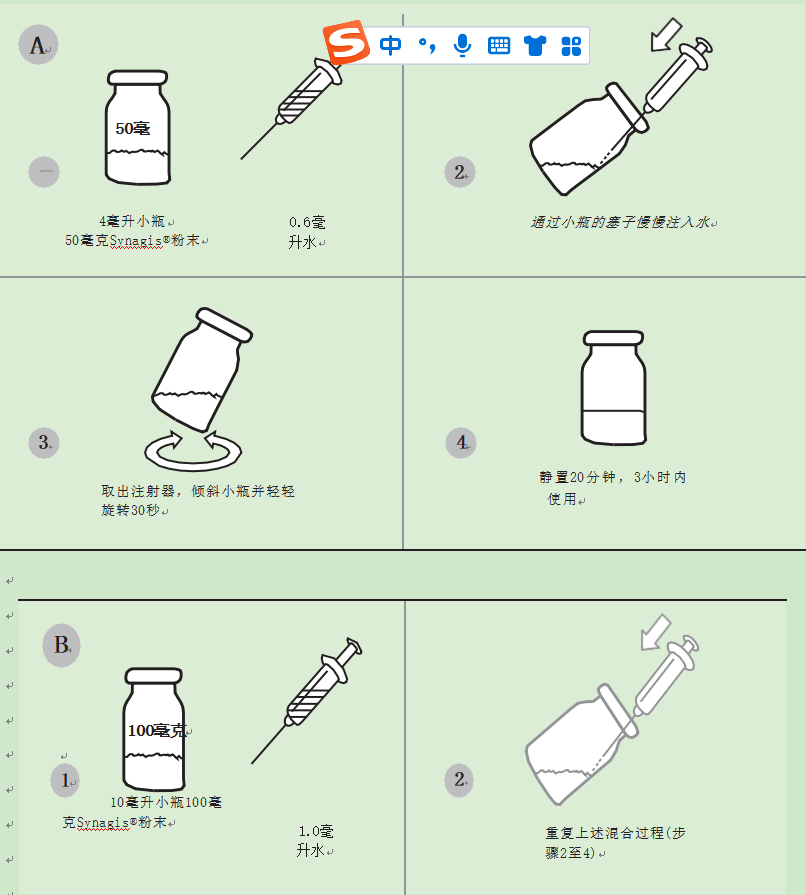
图4混合Synagis®疫苗的程序
剂量和时间表
Synagis®的推荐剂量为15mg/kg体重,每月给药一次。在可能的情况下,应在RSV季节开始时(第40个日历周)注射首剂。后续剂量应在整个RSV季节每月给药一次,最多五次。
注射
Synagis®通过肌肉注射给药,优选在大腿的前外侧。它可以与作为常规儿童免疫计划一部分的疫苗同时接种。疫苗应该在不同的部位注射,最好是在不同的肢体。如果给药在同一个肢体,它们应该至少分开2.5厘米(美国儿科学会,2003)。每次注射的地点和免疫接种的批号应记录在个人记录中。
Synagis®的产品特性总结称,“未进行与其他药品的正式相互作用研究,但迄今为止未描述任何相互作用。在早产儿和支气管肺发育不良儿童人群的III期IMpact-RSV研究中,安慰剂组和帕利单抗组中接受常规儿童疫苗、流感疫苗、支气管扩张剂或皮质类固醇的患者比例相似,并且在接受这些药物的患者中未观察到不良反应增加。”
处理
根据地方当局法规和技术备忘录07-01(卫生部,2006年)中的指导,用于预防的设备,包括用过的小瓶、安瓿或部分排出的产品,应在疗程结束时通过密封在适当的防刺穿“锐器”盒中进行处置。
被动免疫的使用建议
被动免疫的目的是保护处于危险中的早产儿,对于这些早产儿,RSV感染可能导致严重疾病或死亡。Synagis®推荐用于以下人群的所有婴儿。这是基于对帕利单抗预防的成本效益分析(Wang et al., 2008)。
- 在RSV季节开始时的实足年龄和出生时的孕龄患有慢性肺病(CLD)的早产儿包括在表1图5的阴影区域内。
CLD的定义,婴儿从出生起至少28天内需要依赖氧气。因此,一个月以下的婴儿被排除在表1(图5)之外。
- 在RSV季节开始时的实足年龄和图5表2阴影区域中的孕龄,患有血流动力学显著的非先天性心脏病(CHD)的早产儿。
卫生部网站上提供了一种评估何时建议上述婴儿群体使用本品的工具,网址为www . DH . gov . uk/en/public health/immunization/Keyvaccineinformation/DH _ 120246
在呼吸道合胞病毒感染季节,以下婴儿群体应考虑使用本品:
- 所有24个月以下患有严重联合免疫缺陷综合征(SCID)的儿童,直到免疫重建和;
- 在呼吸道合胞病毒季节开始时年龄小于12个月的所有长期通气(LTV)儿童,
- 在RSV季节开始时年龄在24个月以下的LTV上的所有儿童,具有额外的共同病理(心脏病/肺动脉高压、内在肺病(如氧气依赖所反映的)。
SCID是遗传性免疫缺陷的最严重形式。受感染的婴儿既不能产生T细胞反应,也不能产生抗感染因子的抗体。LTV的定义是“任何一个病情稳定的儿童,在接受机械通气治疗三个月后,公认的断奶失败后,继续需要机械辅助呼吸”(Jardine and Wallis, 1998)。
如果对其他个别患者情况的临床判断强烈表明,预防可防止处于RSV并发症特殊风险中的婴儿出现严重RSV感染,则可考虑在RSV季节使用Synagis®。
应在RSV季节开始之外的一个月(第40周开始,即10月初)给予最多五剂Synagis®。但是,如果治疗过程在RSV季节后期开始(例如,婴儿在RSV季节出生),则最多应间隔一个月给药五次,直到第8个日历周结束(即2月底)。
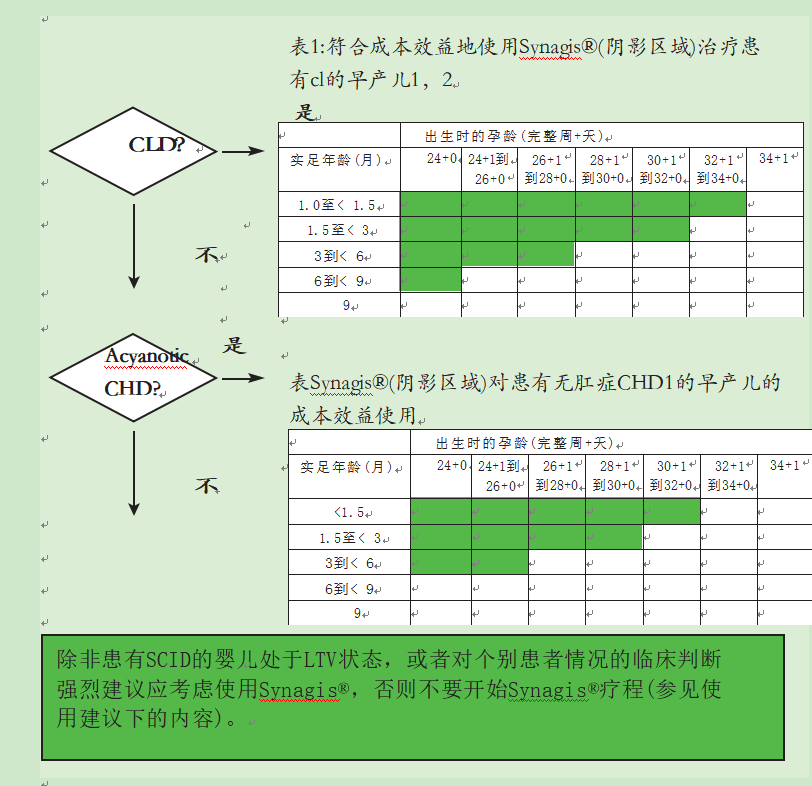
注意事项:
LTV =长期通风;SCID =严重联合免疫缺陷综合征;CLD =慢性肺病;先天性心脏病
1表格显示RSV季节开始时(10月初)的实际年龄(月)和出生时的孕龄(完整周+天)。
CLD的定义是从出生起至少28天的氧气依赖。因此,1个月以下的婴儿将被排除在外
图5建议使用Synagis®时
因为感染呼吸道合胞病毒的风险,新生儿病房极低,新生儿病房中属于适当风险群体的婴儿仅应在出院前24至48小时开始Synagis®治疗。已开始Synagis®治疗疗程但随后住院的婴儿应在住院期间继续接受Synagis®治疗。
Synagis®提供针对RSV的短期保护,并在每个新的RSV季节开始时推荐给所有新的高危婴儿(如上所述)。如果在RSV季节期间,确定婴儿有风险,但在该季节内没有可靠的既往Synagis®预防史,则应在RSV季节的剩余时间内开始给药并每月给药,但不需要在第8周结束后给药。如果疗程中断,应重新开始给药,并在RSV季节的剩余时间内每月给药,但不需要在第8周结束后给药。
禁忌症
很少有婴儿和儿童不能接受Synagis®。如有疑问,应向专家寻求适当的建议。
本品不应用于患有以下疾病的婴儿或儿童:
- 对之前剂量的Synagis®的过敏反应
- 对Synagis®的任何成分产生过敏反应
- 对另一种人源化单克隆抗体的确认过敏反应。
预防措施
没有发烧或全身不适的小病不是推迟免疫接种的正当理由。如果个人急性不适,免疫接种可能会推迟,直到他们完全康复。
不良反应
Synagis®带有一个黑三角符号(▼)。这是在药品上市的早期阶段添加到产品信息中的标准符号,以鼓励报告所有可疑的不良反应。任何人都可以使用黄卡报告计划向人类药物委员会(CHM)报告可疑的不良反应(www.yellowcard.gov.uk)。
服用本品后,在对照临床研究中评估了本品的安全性。报告的常见反应包括注射部位发红或肿胀、发烧、腹泻和紧张。大多数反应是短暂的,严重程度为轻度至中度。上市后经验期间自愿报告的事件包括血小板减少症、
过敏反应、惊厥、呼吸暂停和荨麻疹;但在这些情况下,很难确定综合症的发生频率和因果关系。所有不良反应的报告均可在Synagis®的产品特性总结中找到(Electronic Medicines Compendium, 2010)。
病例、接触和暴发的管理
任何高危婴儿或儿童的RSV感染病例都应提示对患者的病史进行审查,以确定他们是否属于公认的危险人群,以及他们是否接受了预防治疗。具有危险因素且之前未接种过疫苗的患者应开始预防Synagis®。
供应
Synagis®由雅培SRL公司生产,在英格兰、威尔士和苏格兰可从雅培英国公司(电话:01795 580303)购买。
在北爱尔兰,可以从Movianto NI(电话:028 90 795799)处获得供应。
信息材料
一个开Synagis®处方的决策工具可从以下部门获得健康网站:
www.dh.gov.uk/en/Publichealth/Immunisation/ Keyvaccineinformation/DH_120246
疫苗接种和免疫联合委员会关于呼吸道合胞病毒免疫的声明可在以下网址获得:www.dh.gov.uk/ab/JCVI/DH_094744
参考
American Academy of Pediatrics (2003) Active immunization. In: Pickering LK (ed.)
Red Book: 2003 Report of the Committee on Infectious Diseases, 26th edition. Elk
Grove Village, IL: American Academy of Pediatrics, p 33.
Black CP (2003) Systematic review of the biology and medical management of
respiratory syncytial virus infection. Respir Care. 48 (3):209-31.
Department of Health (2006) Health Technical Memorandum 07-01: Safe Management
of Healthcare Waste. www.dh.gov.uk/en/Publicationsandstatistics/Publications/
PublicationsPolicyAndGuidance/DH_063274. Accessed September 2010.
Electronic Medicines Compendium (2010) Summary of Product Characteristics,
Synagis www.medicines.org.uk/EMC/medicine/5676/SPC/Synagis/. Accessed
September 2010.
European Medicines Agency (2010) European Public Assessment Report: Synagis.
www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000257/
human_med_001070.jsp&mid=WC0b01ac058001d124&murl=menus/medicines/
medicines.jsp&jsenabled=true. Accessed September 2010.
Feltes TF, Cabalka AK, Meissner HC et al. (2003) Palivizumab prophylaxis reduces
hospitalization due to respiratory syncytial virus in young children with
hemodynamically significant congenital heart disease. J Pediatr 143 (4): 532-40.
Greenough A, Alexander J, Burgess S et al. (2004) Health care utilisation of
prematurely born, preschool children related to hospitalisation for RSV infection. Arch
Dis Child 89 (7):673-8
Harkensee C, Brodlie M, Embleton ND and Mckean M (2006) Passive immunisation of
preterm infants with palivizumab against RSV infection. J Infect 52 (1): 2-8.
Henderson FW, Collier AM, Clyde WA Jr and Denny FW (1979) Respiratory-syncytialvirus infections, reinfections and immunity. A prospective, longitudinal study in young
children. N Engl J Med. 300 (10):530-4.
Health Protection Agency (2005) A winter’s tale: coming to terms with winter
respiratory illness. www.hpa.org.uk/Publications/InfectiousDiseases/RespiratoryDisease
s/0501WintersTale/ Accessed September 2010.
Health Protection Agency (2010) Epidemiological graphs for Respiratory Syncytial
Virus. www.hpa.org.uk/web/HPAweb&HPAwebStandard/HPAweb_C/1223971255821.
Accessed September 2010.
IMpact-RSV Study Group (1998) Palivizumab, a humanized respiratory syncytial virus
monoclonal antibody, reduces hospitalization from respiratory syncytial virus infection
in high-risk infants. Pediatrics 102 (3 pt 1): 531–7.
Jardine E and Wallis C (1998) Core guidelines for the discharge home of the child on
long-term assisted ventilation in the United Kingdom. UK Working Party on Paediatric
Long Term Ventilation. Thorax 53 (9):762-7.
Johnson S, Oliver C, Prince GA et al. (1997) Development of a humanized monoclonal
antibody (MEDI-493) with potent in vitro and in vivo activity against respiratory
syncytial virus (RSV). J Infect Dis. 176: 1215–24
Leung AK, Kellner JD and Davies HD (2005) Respiratory syncytial virus bronchiolitis.
J Natl Med Assoc 97 (12):1708-13.
Müller-Pebody B, Edmunds WJ, Zambon MC et al. (2002) Contribution of RSV to
bronchiolitis and pneumonia-associated hospitalizations in English children, April
1995-March 1998. Epidemiol Infect. 129 (1):99-106.
Nair H, Nokes DJ, Gessner BD et al. (2010) Global burden of acute lower respiratory
infections due to respiratory syncytial virus in young children: a systematic review and
meta-analysis. Lancet 375 (9725):1545-55.
Oshansky CM, Zhang W, Moore E and Tripp RA (2009) The host response and
molecular pathogenesis associated with respiratory syncytial virus infection. Future
Microbiol 4:279-97.
Sigurs N, Gustafsson PM, Bjarnason R et al. (2005) Severe respiratory syncytial virus
bronchiolitis in infancy and asthma and allergy at age 13. Am J Respir Crit Care Med.
171 (2):137-41.
Thorburn K (2009) Pre-existing disease is associated with a significantly higher risk of
death in severe respiratory syncytial virus infection. Arch Dis Child. 94 (2):99-103.
Wang D, Cummins C, Bayliss S et al. (2008) Immunoprophylaxis against Respiratory
Syncytial Virus (RSV) with palivizumab in children: a systematic review and economic
evaluation. Health Technology Assessment 12 (36): i–x, 1– 86. www.hta.ac.uk/1596
Wang D, Bayliss S and Meads C (2011) Palivizumab for immunoprophylaxis of
respiratory syncytial virus (RSV) bronchiolitis in high-risk infants and young children:
a systematic review and additional economic modelling of subgroup analyses. Health
Technol Assess 15(5) 1-124 www.hta.ac.uk/project/2056.asp
Hits: 28


