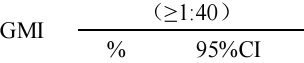| 药品信息 | |||
| 受理号: | CXSS1900016 | 药品名称: | 四价流感病毒裂解疫苗 |
| 药品类型: | 预防用生物制品 | 注册分类: | 15 |
| 承办日期: | 2019-04-02 | 公示日期: | 2022-05-12 |
| 企业名称: | 北京科兴生物制品有限公司;北京科兴生物制品有限公司 | ||
| 相关附件信息 | |||
| 附件1:四价流感病毒裂解疫苗(CXSS1900016)-申请上市技术审评报告.pdf | |||
| 附件2:四价流感病毒裂解疫苗(CXSS1900016)-说明书.pdf | |||
核准日期:2020 年 XX 月 XX 日 修订日期:
四价流感病毒裂解疫苗说明书
请仔细阅读说明书并在医师指导下使用
【药品名称】
通用名称:四价流感病毒裂解疫苗
英文名称:Influenza Vaccine (Split Virion), Inactivated, Quadrivalent
汉语拼音:Sijia Liugan Bingdu Liejie Yimiao
【成分和性状】
本品系用世界卫生组织(WHO)推荐的甲型和乙型流行性感冒(简称流感) 病毒株,分别接种鸡胚,经培养、收获病毒液、病毒灭活、纯化、裂解后制成, 为微乳白色液体。
有效成分:当年使用的各型流感病毒株血凝素,本品每 0.5ml 含:
A/Michigan/45/2015 (H1N1)pdm09-like virus … … 15μg 血凝素
A/Hong Kong/4801/2014 (H3N2)-like virus …… … …15μg 血凝素
B/Brisbane/60/2008-like virus (B/Victoria/2/87 lineage) …….15μg 血凝素
B/Phuket/3073/2013-like virus (B/Yamagata/16/88 lineage) 15μg 血凝素
辅料:氯化钠、磷酸氢二钠、磷酸二氢钠。
【接种对象】
本品适用于 3 岁及以上人群;尤其推荐易发生相关并发症的人群,如儿童、 老年人、体弱者、流感流行地区人员等。
【作用与用途】
接种本品后,可刺激机体产生抗流感病毒的免疫力。用于预防疫苗相关型别 的流感病毒引起的流行性感冒。
【规格】
每支 0.5ml。每 1 次人用剂量为 0.5ml,含各型流感病毒株血凝素应为 15μg。
【免疫程序和剂量】
1.于上臂外侧三角肌肌内注射。
2.于流感流行季节前或期间进行预防接种。3 岁及以上人群接种 l 针,每次 接种剂量为 0.5ml,使用前摇匀。
【不良反应】
1.本品临床试验
本疫苗在中国境内完成的 Ⅰ 、Ⅲ期临床试验受试者总数为 2380 名(3 岁及 以上人群),其中 1220 名受试者接种了一剂本品。对本品系统的安全性观察自疫 苗接种开始至全程接种后 28 天,对大部分受试者的长期安全性观察自全程接种 后 29 天至 180 天。
按照国际医学科学组织委员会(CIOMS)推荐的不良反应发生率的分类:十 分常见 (≥10%),常见(1%-10% ,含 1%),偶见(0.1%-1% ,含 0.1%),罕见 (0.01%-0.1%,含 0.01%),十分罕见(<0.01%),进行如下描述:
全身不良反应
常见:发热;
偶见:头痛、恶心呕吐、肌肉痛、疲劳乏力、咳嗽;
罕见:腹泻、心悸。
局部不良反应
常见:疼痛、红;
偶见:硬结、肿、瘙痒;
以上不良反应 80.16%为轻度。未发现与本品相关的严重不良事件。
2.同类产品境内外临床试验
除上述不良反应外,在同类产品境内外临床试验中还观察到如下不良反应:
全身不良反应:过敏反应(超敏反应)、关节痛、腹部疼痛或不适、嗜睡、 易激惹、食欲下降、寒颤;
局部不良反应:皮疹、瘀斑。
3.同类产品上市后监测
境外同类产品上市后监测获得的额外安全性数据(由规模不详人群自发报告 产生,难以准确估计症状的发生率或有效评估症状发生与疫苗使用的相关性)汇 总如下:
消化系统:口腔、喉部和/舌头肿胀;
血液及淋巴系统:淋巴结肿大、血小板减少; 感染和侵袭性疾病:咽炎、鼻炎、扁桃体炎;
全身性疾病及给药部位各种反应:注射部位脓肿、注射部位蜂窝组织炎、注
射部位发热、胸痛、流感样疾病、全身酸痛;
神经系统:惊厥、脊髓炎(包括脑脊髓炎和横贯性脊髓炎)、面神经麻痹、格 林-巴利综合征、神经炎、感觉异常、头晕、晕厥;
呼吸系统、胸及纵膈疾病: 哮喘、支气管痉挛、呼吸困难、呼吸窘迫、鼻漏、 喘鸣;
心血管系统:心动过速、血管炎; 内耳前庭系统:眩晕;
皮肤系统:血管性水肿、红斑、多形红斑、 面部肿胀、瘙痒、 Stevens-Johnson 综合征、出汗、荨麻疹;
眼部:结膜炎、眼睛疼痛、眼睛发红、眼睛肿胀、眼睑肿胀; 免疫系统:过敏性休克、过敏性紫癜、血清病。
【禁忌】
如有以下任一情况,禁用本品,并及时告知医生:
1.已知对本品所含任何成分,包括辅料、甲醛、 Triton X-100、硫酸庆大霉素 过敏者。
2.患急性疾病、严重慢性疾病、慢性疾病的急性发作期、感冒和发热者。
3.未控制的癫痫和患其他进行性神经系统疾病者,有格林-巴利综合征病史者。
【注意事项】
1. 以下情况者慎用本品:家族和个人有惊厥史者、患慢性疾病者、有癫痫史 者、过敏体质者。
2. 本品针管有裂纹、标签不清或失效者、疫苗出现浑浊、疫苗变质或有摇不 散的块状絮状物等外观异常者均不得使用。
3. 应备有肾上腺素等药物,以备偶有发生严重过敏反应时急救用。接受注射 者在注射后应在现场观察至少 30 分钟。
4. 免疫抑制剂的应用可降低或抑制疫苗接种后的免疫应答,注射免疫球蛋 白者,应间隔 1 个月以上再接种本疫苗,以免影响免疫效果。
5. 注射后出现任何神经系统反应者,禁止再次使用。
6. 本品严禁冻结。
7. 本品严禁静脉注射。
8.请放在儿童不易触及处。
9. 注射前充分摇匀。
10. 本品不得与其他医疗产品在同一容器内混合后使用。 11.有下列情况请向医生咨询:
(1)免疫功能低下;
(2)对本品有其它疑问。
【孕妇及哺乳期妇女用药】
目前尚未获得孕妇及哺乳期妇女使用本品的临床试验数据。若该人群需使用 本品,建议与医生共同进行获益/风险评估后决定。
【药物相互作用】
1.与其它疫苗同时接种:本品尚未联合接种其它疫苗对本品免疫原性影响的 临床研究。目前尚无数据可以评价本品与其它疫苗联合接种的影响。
2.与其它药物伴随使用:具有免疫抑制作用药物包括免疫抑制剂、化疗药物、 抗代谢药物、烷化剂、细胞毒素类药物、皮质类固醇类药物,以及免疫球蛋白等, 可能会降低机体对本品的免疫应答。
如正在或近期曾使用过任何其它疫苗或药物,为避免可能的药物间相互作用, 接种本品前建议咨询专业医师。
【临床试验】
在中国境内完成的一项随机、双盲、对照的Ⅲ期临床试验中,共入组 2320 名 3 岁及以上受试者。受试者按 2:1:1 的比例随机接种本品或两种三价季节性流感 对照疫苗。
采集受试者免前和全程免后 28 天的血样,采用微量血凝抑制试验方法测定 疫苗免疫后血清的流感病毒 HI 抗体滴度。试验组全研究人群流感病毒 HI 抗体 GMT 分别为 H1N1 型 1:523.91,H3N2 型 1:274.13,Bv 型 1:115.35,By 型 1:257.81 (详见表 1),免后抗体阳转率 H1N1 型 77.15%,H3N2 型 81.93%,Bv 型 60.14% , By 型 64.57%(详见表 2),且血清抗体保护率 H1N1 型 97.87%,H3N2 型 98.49% , Bv 型 90.79%,By 型 99.38%(详见表 3)。易感人群与全研究人群结果基本一致。
表 1. 全研究人群免后抗体 GMT 分析(PPS)
| 抗体类型 | 组别 | 检测数 | 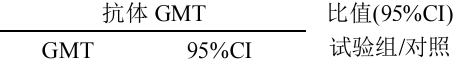 组 |
| H1N1 | 试验组 | 1129 | 523.91 (487.47,563.07) – |
| 合并对照组 | 1115 | 549.93 (512.87,589.66) 0.95(0.87,1.05) | |
| H3N2 | 试验组 | 1129 | 274.13 (256.51,292.96) – |
| 合并对照组 | 1115 | 280.31 (261.21,300.81) 0.98(0.89,1.07) | |
| Bv | 试验组 | 1129 | 115.35 (108.21,122.95) – |
| Bv 对照组 | 559 | 118.67 (108.33,129.99) 1.00(0.89,1.12) | |
| By 对照组 | 556 | 45.54 (42.16,49.19) 2.57(2.24,2.88) | |
| By | 试验组 | 1129 | 257.81 (244.08,272.30) – |
| Bv 对照组 | 559 | 128.79 (117.97,140.60) 2.04(1.82,2.24) | |
| By 对照组 | 556 | 239.63 (220.43,260.50) 1.10(0.98,1.20) |
注:By 以 B/Phuket/3073/2013 标准抗原测定(NIBSC 编号 16/158 ,Yamagata 系),对照组 By 不含 Bv 抗原。 Bv 以 B/Brisbane/60/2008 标准抗原测定(NIBSC 编号 13/234 ,Victoria 系),对照组 Bv 不含 By 抗原。 抗体 GMT 比值(试验组/对照组)95% CI 下限不低于 0.67 则非劣效检验成立。
表 2. 全研究人群免后抗体阳转率分析(PPS)
| 抗体类型 | 组别 | 检测数 | 抗体阳转率 | 率差%(95%CI) 试验组-对照组 | ||
| 阳转数 | % | 95%CI | ||||
| H1N1 | 试验组 | 1129 | 871 | 77.15 | (74.59,79.57) | – |
| 合并对照组 | 1115 | 864 | 77.49 | (74.92,79.91) | -0.34(-3.81,3.12) | |
| H3N2 | 试验组 | 1129 | 925 | 81.93 | (79.56,84.13) | – |
| 合并对照组 | 1115 | 896 | 80.36 | (77.90,82.65) | 1.57(-1.66,4.81) | |
| Bv | 试验组 | 1129 | 679 | 60.14 | (57.22,63.01) | – |
| Bv 对照组 | 559 | 329 | 58.86 | (54.65,62.97) | 1.29(-3.69,6.27) | |
| By 对照组 | 556 | 104 | 18.71 | (15.55,22.20) | 41.44(37.12,45.76) | |
| By | 试验组 | 1129 | 729 | 64.57 | (61.70,67.36) | – |
| Bv 对照组 | 559 | 188 | 33.63 | (29.72,37.72) | 30.94(26.13,35.75) | |
| By 对照组 | 556 | 317 | 57.01 | (52.78,61.17) | 7.56(2.58,12.53) | |
注:By 以 B/Phuket/3073/2013 标准抗原测定(NIBSC 编号 16/158 ,Yamagata 系),对照组 By 不含 Bv 抗原。 Bv 以 B/Brisbane/60/2008 标准抗原测定(NIBSC 编号 13/234 ,Victoria 系),对照组 Bv 不含 By 抗原。
免前 HI 抗体滴度<1:10 ,免后 HI 抗体滴度≥1:40 为阳转;或免前 HI 抗体滴度≥1:10 ,免后 HI 抗体滴度 4 倍增 长为阳转。
抗体阳转率的率差(试验组减去对照组) 95%CI 下限>-10%则非劣效检验成立。
表 3. 全研究人群免后抗体 GMI、血清保护率分析(PPS)
| 抗 体 类 型 | 组别 | 检测 数 | 血清保护率
抗体 | 率差%(95%CI) 试验组-对照组 |
| H1N1 | 试验组 | 1129 | 15.26 97.87 (96.85,98.63) | – |
| 合并对照 组 | 1115 | 15.72 97.40 (96.29,98.25) | 0.48(-0.78,1.73) | |
| H3N2 | 试验组 | 1129 | 10.12 98.49 (97.60,99.12) | – |
| 合并对照 组 | 1115 | 10.50 96.86 (95.66,97.80) | 1.63(0.39,2.88) | |
| Bv | 试验组 | 1129 | 4.54 90.79 (88.95,92.41) | – |
| Bv 对照组 | 559 | 4.46 91.41 (88.78,93.60) | -0.62(-3.50,2.25) | |
| By 对照组 | 556 | 1.78 69.24 (65.22,73.06) | 21.54(17.35,25.73) | |
| By | 试验组 | 1129 | 4.68 99.38 (98.73,99.75) | – |
| Bv 对照组 | 559 | 2.26 94.28 (92.01,96.05) | 5.10(3.13,7.08) | |
| By 对照组 | 556 | 4.22 98.56 (97.18,99.38) | 0.82(-0.27,1.91) |
注:By 以 B/Phuket/3073/2013 标准抗原测定(NIBSC 编号 16/158 ,Yamagata 系),对照组 By 不含 Bv 抗原。 Bv 以 B/Brisbane/60/2008 标准抗原测定(NIBSC 编号 13/234 ,Victoria 系),对照组 Bv 不含 By 抗原。
免后 HI 抗体滴度≥1:40 即视为具有抗体保护。
血清保护率的率差(试验组减去对照组) 95%CI 下限>-10%则非劣效检验成立。 在以上试验中获得的安全性数据请参见【不良反应】。
【贮藏】于 2~8℃避光保存和运输。 【包装】预充式注射器包装,1 支/盒。
【有效期】12 个月。
【执行标准】 【批准文号】
【上市许可持有人】
名称:北京科兴生物制品有限公司 地址:北京市海淀区上地西路 39 号
【生产企业】
企业名称:北京科兴生物制品有限公司
生产地址:北京市海淀区上地西路 39 号北大生物城(原液);
北京市昌平区中关村科技园区昌平园智通路 15 号(半成品、成品)
邮政编码:100085 ,102200 电话号码:86-10-82890088 传真号码:86-10-62966910 企业网址:www.sinovac.com
Hits: 1443