生物材料疫苗增强疫苗接种后淋巴结扩张,增强抗肿瘤免疫力
我们每个人都有大约 600 个淋巴结 (LN)——小的豆形器官,容纳各种类型的血细胞和过滤淋巴液——散布在我们的全身。我们中的许多人也经历过在感染病毒或其他病原体期间暂时肿胀的一些 LN。
这种LN扩张和随后的收缩也可能是由附近注射的疫苗引起的,实际上被认为反映了正在进行的疫苗免疫反应。虽然研究人员研究了接种疫苗后LN的早期扩增,但他们还没有研究长时间的LN扩增是否会影响疫苗结果。
现在,来自哈佛大学Wyss生物启发工程研究所,哈佛大学约翰·保尔森工程与应用科学学院(SEAS)和罗氏集团成员基因泰克的研究人员首次找到了一种增强和扩展LN扩增的方法,并研究这种现象如何影响免疫系统和肿瘤疫苗接种的功效。
他们方法的关键是生物材料疫苗配方,与标准对照疫苗相比,该配方能够实现更大、更持久的LN扩增。
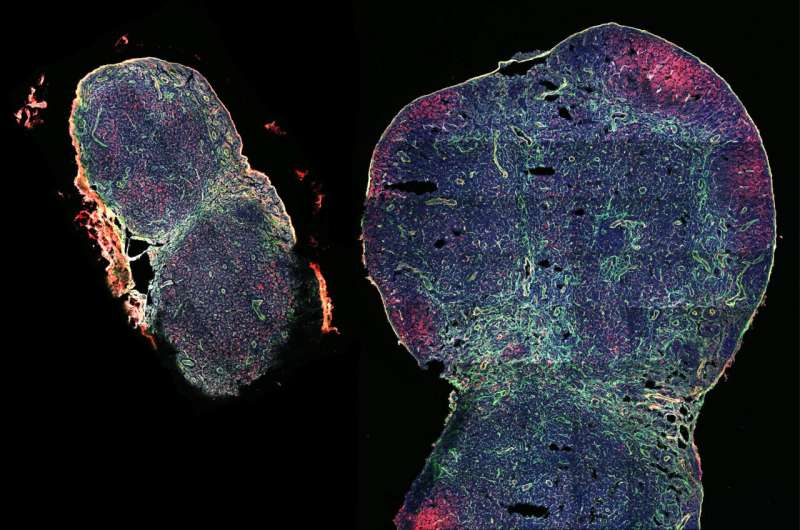
虽然超大的LNs保持了正常的组织组织,但它们显示出改变的机械特征,并承载了更多数量的各种免疫细胞类型,这些细胞类型通常参与针对病原体和癌症的免疫反应。重要的是,在施用针对黑色素瘤特异性模型抗原的传统疫苗之前,“快速启动”淋巴结扩张导致小鼠产生更有效和持续的抗肿瘤反应。研究结果发表在《自然生物医学工程》杂志上。
“通过用生物材料支架增强LN的初始和持续扩增,在很长一段时间内对它们进行非侵入性监测,并深入探究它们的组织结构和免疫细胞群,我们将持续的LN扩增与更强大的免疫和疫苗接种反应紧密相关,”Wyss研究所创始核心教员David Mooney博士说,他领导了这项研究。
“这为免疫学家开辟了一条新的研究战线,并可能对未来的疫苗开发产生深远的影响。Mooney还是SEAS的Robert P. Pinkas家族生物工程教授,以及Wyss协调的免疫工程改善免疫治疗(i3)中心的联合首席研究员。
Mooney在Wyss研究所和SEAS的团队之前已经开发了不同的生物材料支架作为癌症和感染疫苗的基质。
研究人员在临床前动物模型中进行了广泛的工作,并在癌症患者的首次临床试验中证明了生物材料疫苗制剂成功对抗肿瘤生长的潜力。但他们还没有研究他们的疫苗和其他人开发的疫苗如何影响LNs在疫苗注射部位排流泄漏的组织液的反应,并对LNs的组织组织组织、不同的细胞类型及其基因表达产生影响,这反过来又可能影响疫苗的功效。
在他们的新研究中,他们测试了一种先前开发的疫苗配方,该配方基于微尺度介孔二氧化硅(MPS)棒,可以注射到肿瘤附近,并在皮肤下形成细胞渗透的3D支架结构。
MPS疫苗经过工程设计,可释放免疫细胞吸引细胞因子(GM-CSF)、免疫细胞活化佐剂(CpG)和肿瘤抗原分子,能够重新编程募集的所谓抗原呈递细胞,这些细胞在迁移到附近的LN时,协调复杂的肿瘤细胞杀伤免疫反应。他们的新研究表明,这个概念还有更多方面。
“事实证明,基本MPS疫苗的免疫增强功能通过持续扩大其整个器官结构以及改变其组织力学和免疫细胞群和功能来积极改变LNs的状态,”第一作者Alexander Najibi博士说,他与Mooney一起完成了博士论文。
使用超声波和纳米器件探测 LN
为了了解LNs对MPS疫苗的反应,该团队应用了一种称为高频超声(HFUS)的超声成像技术。与通过临床超声监测母亲子宫内发育的小胎儿类似,HFUS的规模要小得多,可以无创和无损地监测小动物(如小鼠)的组织和器官的解剖细节。使用HFUS,研究小组在100天内追踪了MPS疫苗接种小鼠的单个LN。
他们确定了持续到第20天的初始高峰扩张期,其中LN体积增加了约7倍,明显大于接受传统疫苗配方的动物。重要的是,在100天的时间过程中,接种MPS疫苗的小鼠的LN虽然在峰值扩张后体积减少,但仍然明显比传统接种的小鼠的LN扩增更多。
当Najibi和团队使用纳米压痕装置研究LN的机械反应时,他们发现MPS疫苗接种动物中的LN虽然保持整体正常结构,但在某些位置的硬度较低且粘性较强。这伴随着一种蛋白质的重组,该蛋白质组装和控制细胞的机械活性细胞骨架。
有趣的是,Mooney的团队在早期的生物材料研究中表明,免疫细胞环境的机械特征变化,特别是它们的粘弹性,会影响免疫细胞的发育和功能。
“很有可能,为了适应MPS疫苗诱导的显着生长,LN需要变得更柔软、更粘稠,然后进一步影响前馈过程中的免疫细胞募集、增殖和分化,”Najibi说。
从免疫细胞参与到疫苗反应
有趣的是,在接种MPS疫苗后,“先天免疫细胞”的数量,包括单核细胞、中性粒细胞、巨噬细胞和其他细胞类型,它们建立了针对病原体和有害细胞的第一波免疫防御,首先在扩增的LN中达到峰值。
树突状细胞(DCs)的峰值延迟,它们通常以抗原的形式将信息从入侵的病原体和癌细胞转移到“适应性免疫细胞”,然后针对产生抗原的入侵者发起随后的高度特异性免疫反应。事实上,随着DCs的出现,适应性免疫系统的T细胞和B细胞类型也开始达到最高数量。
Najibi评论说:“令人着迷的是,随着时间的推移,我们在扩增的LN中检测到的免疫细胞群的明显变化如何响应MPS疫苗,重新对传染性病原体产生了典型的免疫反应。
先天免疫细胞和 DC 也称为“髓样细胞”,已知它们在早期扩增过程中与 LN 组织相互作用。为了进一步确定髓样细胞对LN扩增的影响,Mooney的团队与Genentech免疫学和再生医学副总裁、淋巴结生物学和肿瘤免疫学专家Shannon Turley博士合作。
“MPS疫苗导致淋巴结内非凡的结构和细胞变化,支持有效的抗原特异性免疫,”Turley说。
通过从LN中分离髓样细胞并分析单个细胞的基因表达谱(单细胞RNA-seq),这些小组能够重建LN扩增过程中髓样细胞群的明显变化,并在持久扩增的LN中鉴定出不同的DC群,其基因表达的变化与LN扩增有关。
此外,合作者发现,在MPS疫苗接种后,单核细胞的数量增加了80倍 – 这是所有髓系细胞类型中最高的增加 – 并指出“炎症和抗原呈递单核细胞”的亚群是促进LN扩增的有希望的候选者。事实上,当他们在接种疫苗后从小鼠的循环血液中耗尽这些类型单核细胞的特定亚群时,LN扩增的维持和T细胞对疫苗接种反应的时间发生了变化。
最后,该团队探讨了LN的扩展是否可以提高疫苗接种的有效性。与单独使用传统疫苗相比,使用无抗原 MPS 疫苗“启动”LN 中的免疫系统,然后以传统疫苗形式施用抗原显着提高了抗肿瘤免疫力并延长了黑色素瘤小鼠的存活时间。
“使用各种配方为后续疫苗接种启动淋巴结可能是未来疫苗开发的唾手可得的果实,”Mooney说。
“这种新发现的能力,使用设计巧妙且易于管理的生物材料,在更长的治疗过程中物理扩张淋巴结并增强其各种免疫活性,可以极大地推动患者的免疫疗法。这也是力学如何在生命系统的调节中发挥关键作用的另一个很好的例子,甚至是免疫反应,很少有人会认为物理线索很重要,“Wyss创始董事Donald Ingber博士说。
更多信息:持久的淋巴结扩张与治疗性疫苗接种的功效有关,Nature Biomedical Engineering (2024)。DOI: 10.1038/s41551-024-01209-3
Hits: 54
