Contents
- 0.1 炭疽疫苗在美国的使用:免疫实践咨询委员会的建议,2019 年
- 0.2 Use of Anthrax Vaccine in the United States: Recommendations of the Advisory Committee on Immunization Practices, 2019
- 0.3 总结
- 0.4 介绍
- 0.5 方法
- 0.6 暴露于炭疽的风险
- 0.7 主要调查结果摘要
- 0.8 有潜在接触风险人群预防炭疽的建议:PrEP
- 0.9 疑似或已知接触者预防炭疽的建议:PEP
- 0.10 疫苗不良事件报告和其他信息
- 0.11 未来方向
- 1 免疫实践咨询委员会
- 2 利益冲突
炭疽疫苗在美国的使用:免疫实践咨询委员会的建议,2019 年
Use of Anthrax Vaccine in the United States: Recommendations of the Advisory Committee on Immunization Practices, 2019
建议和报告 / 12月13日,0019 / 68(4);1–14
威廉·鲍尔(William A. Bower),医学博士1;贾拉德·希弗(Jarad Schiffer),理学硕士2;罗伯特·阿特马尔,医学博士3;温迪 A. 凯特尔,医学博士4;Arthur M. Friedlander,医学博士5;林迪·刘(Lindy Liu),公共卫生硕士1;Yon Yu,药学博士6;大卫·斯蒂芬斯,医学博士7;康拉德·奎因(Conrad P. Quinn)博士8;凯瑟琳·亨德里克斯,医学博士1 (查看作者隶属关系)
本页内容
表
总结
本报告更新了 CDC 免疫实践咨询委员会 (ACIP) 2009 年关于在美国使用炭疽疫苗的建议(Wright JG、Quinn CP、Shadomy S、Messonnier N. 在美国使用炭疽疫苗:免疫实践咨询委员会 [ACIP]的建议),2009 年。MMWR Recomm 代表 2010;59[编号.RR-6])。该报告 1) 使用保护模型和自上次 ACIP 审查以来发布的安全性数据总结了关于人类估计疗效的数据,2) 提供了使用炭疽疫苗吸附 (AVA) 进行暴露前预防 (PrEP) 和结合抗菌药物进行暴露后预防 (PEP) 的最新指南,3) 提供了有关急救人员和其他响应者接种 PrEP 疫苗的最新指南, 4) 总结了研究性炭疽疫苗 (AV7909) 的可用数据,以及 5) 讨论了炭疽抗毒素用于 PEP。
与本报告中先前指南相比,变化包括以下内容:1)对于之前接受过初始AVA 3剂启动和2剂加强系列并希望保持保护的无暴露于炭疽杆菌的高风险人群,可以每3年而不是每年给予一次加强剂量的PrEP加强剂量;2) 在大规模应急响应期间,如果皮下给药途径对可能延迟或排除疫苗接种的重大物资、人员或临床挑战,则可以使用肌肉注射途径给药 PEP 的 AVA;3)如果炭疽疫苗供应不足,无法为所有潜在暴露者接种疫苗,则建议采取节省剂量的AVA PEP方案;4)阐明与PEP疫苗联合使用时抗菌治疗的持续时间。
这些更新的建议可供卫生保健提供者使用,并指导正在制定提供炭疽疫苗计划的应急准备官员和规划人员,包括为炭疽杆菌孢子的大范围气溶胶释放做准备。这些建议还为必要时节省剂量的选择提供了指导,以扩大疫苗供应,以增加在大规模伤亡事件中接受暴露后预防的人数。
介绍
炭疽是一种由炭疽杆菌感染引起的急性发热性疾病。即使经过治疗,皮肤炭疽的死亡率<2%不等(1),吸入性炭疽(2)的死亡率为45%,炭疽性脑膜炎的死亡率为92%(3)。炭疽杆菌是一种人畜共患病原体,主要感染绵羊、山羊、牛和其他食草动物。人类在接触受感染的动物或受污染的动物产品后被感染,或者极少数情况下,作为注射吸毒的并发症(4)。炭疽杆菌也是一种 1 级精选病原体,被认为是最有可能使用的生物恐怖主义病原体之一,因为它相对容易从自然环境中获得、大规模生产并通过气溶胶作为孢子传播 (5)。
炭疽吸附疫苗 (AVA) (BioThrax) 已获准用于 18-65 岁暴露于炭疽杆菌高风险的成年人的暴露前预防 (PrEP) (6)。美国食品和药物管理局 (FDA) 批准的剂量为 0.5 mL,在第 0、1 和 6 个月时肌肉注射 (IM),在完成初级系列后 6 个月和 12 个月以及之后每隔 12 个月进行加强注射。AVA 还被许可用于 18-65 岁疑似或已知暴露于雾化炭疽杆菌孢子的成年人的暴露后预防 (PEP) 和抗菌药物。FDA 批准的剂量为 0.5 mL,在第 0、2 和 4 周时皮下 (SC) 给药。对于未列入 FDA 批准的 PEP 适应症的人,根据适当的紧急使用监管规定,AVA 将可用于儿童、孕妇、哺乳母亲和老年人(即 ≥66 岁)的 PEP。尽管缺乏关于混合IM和SC给药途径的免疫影响的数据,就像从PrEP切换到PEP时可能发生的那样,但途径之间的转换不太可能对免疫产生不利影响,因为两种途径都提供了足够的免疫力。
AV7909(AVA 加 CpG 7909 佐剂)是 Emergent BioSolutions 生产的第二代炭疽疫苗,目前正处于 3 期试验(https://clinicaltrials.gov)。CpG 7909 佐剂与 Toll 样受体 9 结合,以增强对共给药抗原(主要是炭疽杆菌保护性抗原)的免疫应答 (7,8)。根据 AV7909 的临床评估,PEP 方案为 0.5 mL AVA 和 0.25 mg CpG 7909 佐剂,在暴露后 0 周和 2 周肌内注射,并结合抗菌药物。
自 2010 年免疫实践咨询委员会 (ACIP) 发布关于在美国使用炭疽疫苗的建议 (9) 以来,已发表的研究有 1) 解决了 AVA 推荐和替代剂量节约方案的功效、免疫原性和反应原性;2)使用保护相关模型,根据动物疗效和人类抗体水平的数据估计AVA对人类的疗效;3) 评估发展慢性疾病或有不良妊娠结局是否与先前的 AVA 接收有关。此外,AV7909 的 1 期和 2 期临床试验证明了 AV7909 作为 PEP (PEP-Vx) 疫苗组分的潜力 (10–12)。
鉴于这些新获得的数据,CDC要求ACIP修改在美国使用炭疽疫苗的建议。这些修订后的建议涉及肌内注射 AVA 与 SC 给药治疗 PEP,以及在突发公共卫生事件期间使用缩短方案和半剂量 AVA 的问题,缩短与 PEP-Vx 联合使用的抗菌药物的持续时间,以及延长 AVA PrEP 在初始启动和加强系列后的加强剂量间隔。本报告提供了有关将AVA用于PrEP和PEP的建议和指导,并更新了2002年和2010年发布的ACIP炭疽疫苗接种建议。本报告还描述了 AV7909 的可用数据,因为如果 AVA 供应不足,它有可能在大规模炭疽公共卫生紧急情况下进行预授权紧急使用。该报告可供卫生保健提供者用来更新目前为PrEP和PEP提供炭疽疫苗的做法,并可供应急准备合作伙伴用于制定紧急疫苗响应计划,为炭疽杆菌孢子的大范围雾化释放做准备。
方法
2017 年 3 月至 2019 年 1 月期间,ACIP 炭疽疫苗工作组 (AVWG) 由来自学术医学(内科、儿科、产科和传染病专家)、联邦和州公共卫生实体以及医学会的专业人员组成,参加了由 CDC 主持的月度电话会议。在这些会议期间,AVWG审查了相关科学证据并评估了证据的质量,评估了以下证据:1)在非炭疽杆菌暴露高风险但未来可能有高暴露风险的人群中延长PrEP加强剂量间隔的免疫原性和安全性;2)PEP-Vx的IM与SC给药途径的利弊;3)如果在大面积炭疽杆菌孢子雾化释放后疫苗接种需求超过疫苗供应,则 PEP-Vx 的 AVA 剂量节省计划(即 2 剂全剂量或 3 剂半剂量)的利弊;4)根据现有数据,AV7909的免疫原性和安全性;5)炭疽抗毒素与炭疽疫苗联合使用。
通过系统评价对涉及人类受试者的研究或符合动物规则标准的动物研究进行科学文献检索(13,14),这些研究报告了2008年之后发表的与AVA或AV7909相关的重要健康结局的主要数据。上一次ACIP审查总结了截至2008年的数据(9)。2017年2月检索的数据库包括Medline(OVID)、Embase(OVID)、CAB文摘(OVID)、Global Health(OVID)、CINAHL(Ebsco)、Econlit(Ebsco)、Cochrane图书馆、临床 Trials.gov、FedRip(Ebsco)、美国国防部(DoD)技术信息中心、NTIS:NTRL、Scopus、WHOLIS和WorldCat。检索词包括炭疽疫苗、AVA、Biothrax、Nuthrax、AV7909、CpG DNA、CpG 7909、CpG 基序、CpG 寡脱氧核苷酸、Anthim、Anthrasil、obiltoxaximab 和 raxibacumab。此外,工作组还审查了CDC炭疽疫苗研究计划的未发表数据,疫苗制造商的未发表数据以及疫苗分析部门的研究结果,该部门由CDC领导,与国防部和FDA合作,评估了AVA与慢性病发展的潜在关联(15).疫苗安全性审查还包括2009年1月1日至2017年6月30日AVA给药后向疫苗不良事件报告系统(VAERS)报告的不良事件(16)。为了有资格纳入本综述,一项研究必须提供使用CpG 7909佐剂的AVA、AV7909或传染病疫苗的免疫原性或安全性数据。如果研究没有提及AVA或AV7909预防炭疽,缺乏原始数据,或者超出感兴趣的时间范围,则被排除在外。
对感兴趣的免疫原性结局进行提取和总结数据,包括血清转化、抗保护抗原免疫球蛋白 G(抗 PA IgG,通过酶联免疫吸附测定法测定)的几何平均浓度 (GMC)、毒素中和活性 (TNA) 的几何平均滴度 (GMT)、有效剂量 50 (ED50)水平和TNA中和因子50(NF50) 水平。还提取并总结了感兴趣的安全结局的数据,包括注射部位不良事件、全身不良事件和严重不良事件。使用建议分级评估、开发和评价(Grading of Recommendations Assessment, Development and Evaluation, GRADE)方法对证据质量进行评估并以表格形式呈现(17)。
AVWG总结和审查的证据在2017年6月、2017年10月、2018年2月、2018年6月、2018年10月和2019年2月的ACIP会议上公开提交(18)。经过公众意见征询期后,ACIP 投票成员在 2018 年 6 月和 2019 年 2 月的会议上一致批准了拟议的建议。
暴露于炭疽的风险
在美国,暴露于雾化炭疽杆菌孢子的风险非常低(19)。炭疽病仅在美国西部少数人口稀少的地区流行(20)。某些职业和其他活动使人们面临更高的暴露风险(21)。这些工作包括涉及大量、大量或高浓度炭疽芽孢杆菌孢子的生物生产的实验室工作,以及极有可能暴露于气溶胶炭疽杆菌孢子的活动,例如在国防部指定的炭疽暴露高风险地区进行军事部署,以及炭疽芽孢杆菌孢子释放后的应急响应活动(9)。
在美国人口稠密地区,炭疽杆菌孢子有可能被故意大面积气溶胶释放。2001年,通过美国邮政服务发送的含有炭疽芽孢杆菌孢子的信件导致了22例炭疽病例,其中5例是致命的(22例)。此外,某些国家和恐怖组织已经探索使用炭疽作为生物武器(23-25)。炭疽芽孢杆菌孢子在人口稠密地区上空的气溶胶释放可能成为大规模伤亡事件(26)。然而,先前制定的、公开的临床建议仅涉及使用传统护理标准的临床管理[27]。为了应对可能发生的炭疽大规模伤亡事件,当患者人数可能超过医疗保健基础设施提供常规护理标准的能力并且用品可能无法满足需求时,美国政府储备了炭疽预防和治疗的设备和治疗方法(即医疗对策),并提供了使用建议(28).美国政府的“国家战略储备”(Strategic National Stockpile)储存炭疽疫苗,用于与已知或潜在接触炭疽杆菌孢子的人的抗微生物药物一起用于暴露后预防,以及用于炭疽治疗的治疗药物和用品。动物模型表明,尽管单次暴露或再次暴露于炭疽杆菌孢子后,5-30天的抗菌药物可能不足以预防炭疽病,但添加疫苗可显著提高疗效(29-31)。如果炭疽杆菌孢子大规模释放,国家战略储备将向受影响的州分发医疗对策,然后州和地方公共卫生机构将向许多高危人群分发抗微生物药物并接种疫苗。抗菌药物的给予时间足够长(长达60天)以防止感染,直到疫苗能够引起保护性免疫反应(29)。
主要调查结果摘要
炭疽疫苗吸附
由于吸入性炭疽的人体疗效研究是不道德的,因此无法直接在人体中评估 AVA 对 PEP 的有效性。对于这种情况,FDA允许使用动物规则,这是一套法规,允许仅基于动物的功效数据以及动物和人类的免疫原性和安全性数据,批准对保护公共卫生和国家安全至关重要的产品(32)。根据动物规则,AVA疫苗诱导的抗体水平是从在动物中进行的疫苗功效研究中推断出来的,以预测疫苗对人类的有效性(33)。使用统计模型来建立用炭疽芽孢杆菌孢子攻击的AVA疫苗接种动物的存活率与其在感染攻击时的抗体水平之间的关系。这种关系应用于人类疫苗接种后的抗体水平,以估计人类在选定时间点的生存概率 (34)。
AVA 用于 PEP 的给药途径和免疫原性
成人首选 SC 给药途径,因为 SC 给药导致第 4 周时抗体浓度高于 IM 途径:男性 SC,40.8 μg/mL(95% 置信区间 [CI]:34.0-49.1);男性 IM,26.3 μg/mL(95% CI:21.9–31.2);女性 SC,60.2 μg/mL,(95% CI:50.1–72.3),女性 IM,36.0 μg/ml(95% CI:30.0–43.1 (35)。使用这些抗体浓度,在第 4 周给药时,基于保护相关性模型的生存估计值 (92.4%) 比 IM 途径 (88.6%) 高 3.8% (36)。然而,到第 9 周,IM 途径 (95.6%) 和 SC 途径 (96.1%) 的抗体浓度和预测生存率不再显着差异 (35)。
在人口稠密地区大面积雾化释放炭疽芽孢杆菌孢子时,可能有数十万暴露者需要PEP-Vx来预防吸入性炭疽。在这种情况下,快速有效地为大量人员接种疫苗将是公共卫生应急响应的关键组成部分。与SC途径相比,医务人员通常具有更多的IM途径接种疫苗的经验。此外,在与州和地方管辖区的电话会议上,许多公共卫生官员表示,他们计划在炭疽杆菌孢子大面积雾化释放期间对响应疫苗接种人员进行及时培训。官员们在这次电话会议中还表示,培训疫苗接种人员使用IM途径是最容易的(州和地方公共卫生准备官员,个人通讯,2018年)。此外,一项比较 AVA 给药的 IM 和 SC 途径的研究发现,在第 0、2 和 4 周时,IM 途径的反应原性(注射部位发热、瘙痒、红斑、硬结、肿胀和结节形成较少)明显低于 SC 途径。在同一项研究中,IM AVA接受者中只有两种不良事件比SC AVA接受者更常见:手臂运动受限和全身性肌痛(35)。由于注射部位不良事件的优势与 SC 途径相关,因此有人担心使用该途径可能会降低患者完成第二剂和第三剂 AVA 的可能性。
PEP-Vx 的剂量节约策略
如果根据PEP-Vx适应症的许可方案(0、2和4周时0.5毫升)进行AVA接种,则炭疽芽孢杆菌孢子在人口稠密地区大面积的雾化释放可能需要比国家战略储备中现有AVA供应的疫苗接种人数更多的人。如果需求超过供应,可能需要替代的AVA剂量节省方案,向所有疑似或已知接触过雾化炭疽杆菌孢子的人提供PEP-Vx。为了解决这个问题,对根据许可的 PEP-Vx 方案(0、2 和 4 周时 3 次全剂量 [0.5 毫升]剂量)给药的 AVA 估计生存率与备用剂量节约方案(即,0 周和 2 周时 2 次全剂量,0 周和 4 周时 2 次全剂量,0 周时 3 次半 [0.25 毫升] 剂量)给药的估计生存期。 2 周和 4 周)(图)。在第 2 周接受 AVA 剂量的三组在第 4 周的抗体浓度高于未接受剂量的一组。间隔 4 周施用 2 次全剂量的节剂量方案从第一次给药后第 6 周开始产生最高的抗体浓度。在第 1 周后的所有测量时间点,3 次全剂量方案产生的抗体浓度高于以 3 次半剂量接种疫苗时的抗体浓度。在最后一次给药后 2 周测量了许可和节省剂量的 PEP-Vx 方案的峰值反应,并且根据保护模型的相关性估计具有高度保护性 (37)。许可方案的预测生存率估计为 97.4%(95% CI:85.1-100),0 周和 2 周全剂量给药的预测生存率估计为 95.8%(95% CI:92.2-100),0 周和 4 周给药的全剂量预测生存率为 98.1%(95% CI:86.9-100),0 周给药的 3 个半剂量的预测生存率为 96.1%(95% CI:83.7-100)。 2 周和 4 周(表 1)。所有给药 PEP-Vx 方案在第 9 周之前都保持高水平的预测生存率 (36,38)。
抗菌药物与疫苗联合给药的持续时间
自 2000 年以来,FDA 已批准几种口服抗菌药物(2000 年环丙沙星、2001 年青霉素 G、2001 年多西环素和 2004 年左氧氟沙星)用于炭疽的抗菌暴露后预防 (PEP-Abx)。当不与疫苗联合使用时,每种 PEP-Abx 方案应给药 60 天。然而,对非人灵长类动物的研究表明,孢子可以在吸入暴露后持续存在许多天(一项动物研究中长达 100 天),并且在停用 PEP-Abx 后会发生炭疽 (29,30)。由于持久性孢子可能延迟感染,因此 PEP 建议要求将 AVA 与抗菌药物联合使用。通过这种策略,抗菌剂可以防止孢子萌发,直到疫苗能够引起保护性免疫反应。
利用当时可用的有限数据,2015 年,FDA 批准了 3 剂 AVA 方案,与推荐的 PEP 抗菌剂一起用于可能暴露于雾化炭疽杆菌孢子的人 (39)。来自AVA人体临床试验的最新数据表明,在同时接受AVA的情况下,抗菌药物的使用时间可以从推荐的60天缩短(38)。在试验中,受试者接受了四种 PEP-Vx 方案之一:许可的 3 剂方案、在 0 周和 2 周时接种 2 次全剂量的剂量节约方案、在 0 周和 4 周时接种 2 次全剂量的剂量节约方案,或在第 0、2 和 4 周时接种 3 次半剂量的剂量节约方案。预测对人类具有保护作用的抗体水平是从一项匹配的非人灵长类动物非临床试验中推断出来的,其中 48 只非人灵长类动物在 0 周和 2 周时给予 2 剂 AVA,并用 200 LD 进行攻击50第 4 周炭疽芽孢杆菌孢子的剂量。抗 PA IgG 提供的保护作用使用非人灵长类动物第 4 周测量的攻击前抗体水平与攻击存活率的逻辑回归进行建模 (36)。然后将非人灵长类动物预测曲线应用于人类抗体水平,以预测人类的保护作用 (38)。许可和剂量节省的 AVA PEP-Vx 方案的估计峰值保护发生在最后一次 AVA 剂量后 2 周。据估计,所有治疗方案都具有高度保护作用;保护作用维持到第60天,此时建议结束PEP的抗菌成分(表1)。
安全
自 2008 年以来,绝大多数 AVA 疫苗接种(约 800 万剂接种给约 190 万人)由国防部作为 PrEP 提供给其服务人员。在2008年12月FDA批准将PrEP给药途径改为IM之前,PrEP给药途径是SC。根据美国联邦法规的定义,如果报告了以下一种或多种情况,则事件被归类为严重事件:死亡、危及生命的疾病、住院或现有住院时间延长、永久性残疾或先天性异常或出生缺陷 (40)。从 2009 年 1 月 1 日到 2017 年 6 月 30 日,共有 2,439 例 AVA 相关不良事件报告给 VAERS (16);其中329例(13.5%)被认为是严重的。
在同一时期,根据《监管活动医学词典》中的编码术语,将10种最常见的不良事件编码为头痛(14.7%)、注射部位红斑(13.6%)、疼痛(12.6%)、发热(11.6%)、疲劳(11.5%)、关节痛(11.2%)、红斑(11.2%)、注射部位疼痛(9.9%)、注射部位肿胀(9.8%)和皮疹(9.4%)。VAERS具有许多优势,例如广泛的国家范围和早期发现可能的新的、罕见的或不寻常的不良事件模式。然而,VAERS是一个自发的报告系统,具有重要的局限性,包括报告不足,数据质量和报告完整性不一致,以及缺乏未公开的比较组。因此,这些数据通常不能用于评估疫苗是否引起不良事件(16)。
9项研究,包括临床疫苗试验和观察性研究(10,12,35,37,41-45),也评估了人类受试者服用AVA、AV7909或两者后的严重不良事件。三项研究报告了严重不良事件(12,35,43);然而,只有在炭疽疫苗审查计划研究(35)中,严重不良事件才被认为可能与AVA有关。在这项研究中,在大约 8,300 剂 AVA 的接受者中发现了 231 例不良事件。六种严重不良事件(均无致命)被认为可能与疫苗有关,包括乳腺导管癌、全身性过敏反应、与抗核抗体 (ANA) 阳性相关的新发双侧掌关节痛、双侧假性脑瘤、脊髓上肌腱撕裂以及与导水管狭窄相关的新发全身性癫痫发作 (35)。
在疫苗分析部门和其他小组自 2010 年以来发表的研究中,没有发现 AVA 接收与以下慢性健康状况之间存在关联:健康相关生活质量指标降低 (46)、多系统疾病 (47)、长期残疾 (48,49)、1 型糖尿病 (50)、心房颤动 (51) 和弥漫性结缔组织病 (52).在一项病例对照研究中,如果使用 3 个月的回顾期,则发现 AVA 接收与新发类风湿性关节炎之间存在关联(比值比 [OR]:3.93;95% CI:1.08–14.27)。然而,如果使用更长的 3 年回顾期(OR:1.03;95% CI:0.48–2.19),则未发现 AVA 与类风湿性关节炎之间的关联 (52),这表明 AVA 暴露可能引发类风湿性关节炎的发作,这些人最终会在以后的生活中发展类风湿性关节炎。
尽管 AVA 不打算在怀孕期间使用,但国防部维护着怀孕期间无意中接种疫苗的女性的登记册。使用该登记处的不良结局研究和出生缺陷队列研究未发现,与其他时间点接受AVA或未接受AVA相比,在妊娠早期接受AVA的妇女的胎儿或婴儿不良结局发生率增加[53,54]。最后,由于没有可用于青少年使用AVA的安全数据,总统伦理委员会提议比较18-20岁组(最年轻的组)和21-29岁组的AVA安全数据。如果两个年龄组之间没有发现显着的安全性差异,那么可以连续在更年轻的青少年中进行评估。在遵循这些建议方法的研究中,AVA 被认为在 18-20 岁的成年人中是安全的 (44);没有在较年轻的年龄组中进行额外的研究。AVWG审查了VAERS报告和已发表的文献,并向ACIP委员会提交了他们的研究结果。根据这些数据,委员会得出结论,自 2010 年以来,尚未发现与接受 AVA 相关的临床显着安全问题 (9)。
AV7909系列
AV7909是一种研究性的第二代炭疽疫苗,正在开发用于吸入性炭疽PEP和适当的抗菌药物。AV7909 由获得许可的 AVA 与一种新型佐剂 CpG 7909(一种合成免疫刺激寡脱氧核苷酸)相结合。CpG 7909 是一种 Toll 样受体 9 激动剂,已被证明可增强人体 Th1 反应并增强先天性和适应性免疫 (7,8)
AV7909拟被添加到国家战略储备中。CDC已向FDA提交了紧急使用前授权(EUA)请求,以允许在当前许可的AVA供应不足时,将AV7909与适当的PEP-Abx结合使用,用于吸入性炭疽的PEP。EUA 是授予 FDA 专员的权力,可以合法地允许使用未经批准的医疗产品或未经批准使用已批准的医疗产品 (55)。根据拟议的EUA,AV7909将通过IM途径作为间隔2周的2剂系列与PEP-Abx一起用于18-65岁的成年人。孕妇或哺乳期母亲、老年人(≥66 岁)和儿童(<18 岁)应接受 AVA,直到获得充分支持 AV7909 在 EUA 下这些额外人群中使用的数据。
现有数据表明,与AVA相比,AV7909可能具有以下优势:
间隔 2 周接种两剂 AV7909 肌内注射可能比获得许可的 3 剂 AVA PEP-Vx 方案早 1-2 周提供保护性免疫。
与获得许可的 3 剂 AVA PEP-Vx 方案相比,AV7909 PEP 的 2 剂方案在大规模疫苗接种反应中具有操作优势。
依从性可能更好,因为与 3 剂 AVA PEP 系列相比,完成 2 剂 AV7909 PEP 系列的人数可能更多。
免疫原性
最初的 1 期临床试验评估了 69 名 18-45 岁健康成年人中单独使用 AVA 和 AVA 加 CpG 7909 的免疫原性 (12)。在第 0、2 周(±1 天)和第 4 周(±2 天)进行肌内注射疫苗接种。CpG 组接受 AVA 加 1 mg CpG 7909。结果显示,AV7909组TNA的峰值GMT比单独使用AVA组高8.8倍;双臂的抗体在第 6 周达到峰值。到第 3 周,CpG 组的 GMT 超过了 AVA 组的峰值 GMT(在第 6 周达到)。TNA结果与抗PA IgG观察到的结果相似,在两种检测中,AVA和AV7909之间的差异具有统计学意义。对 AV7909 保护数据的 2 期 TNA 阈值分析表明,向 AVA 添加 CpG 7909 佐剂可改善免疫应答的动力学和幅度 (56)。与肌内注射 3 剂 AVA 方案相比,2 剂 AV7909 方案联合 0.25 mg CpG 7909 肌内注射导致第 9 周的血清学反应相似,并且在第 4 周与第 6 周相比,AVA 达到峰值反应。
安全
在本综述时,在三项临床试验中评估了不良事件,包括总共241名受试者,他们以不同的剂量组合给予至少1剂AVA加CpG 7909(10,12,45)。在这些临床试验中,≥20%接受AV7909治疗的患者报告的最常见的不良事件是注射部位反应(例如,轻度至中度疼痛、压痛和手臂运动受限);这些症状通常在给药后 48 小时内消退。全身反应原性主要表现为轻度至中度疲劳、肌肉酸痛和头痛。在AV7909临床研究中,没有报告被评估为因果相关的死亡或严重不良事件。
在 18-50 岁的健康成年人中,接受 0.25 mg 剂量的 CpG 7909 佐剂疟疾和乙型肝炎实验疫苗,该疫苗与 AV7909 中的 AVA 联合 (57,58),局部和全身反应与接受没有 CpG 7909 的疟疾和乙型肝炎疫苗的组相似,治疗组和对照组因不良事件而退出的受试者比例没有差异(58)。停药原因包括皮疹、ANA阳性、全身性瘙痒、荨麻疹和发热。这些临床试验报告表明,这些不良事件可能是注射部位促炎先天免疫反应激活的结果。从理论上讲,CpG 7909 可能引发自身免疫性疾病的发作,可能是由于非特异性 T 或 B 淋巴细胞活化。一些研究报告了抗双链 DNA 抗体、类风湿因子或阳性 ANA 结果的轻度至中度增加。然而,免疫标志物的这些增加通常是短暂的。在已发表的关于CpG 7909佐剂传染病疫苗试验的数据中,没有报告提示自身免疫性疾病的不良事件(57-61)。在特殊人群(例如儿童、>65 岁人群和孕妇)中,没有 CpG 7909 佐剂疫苗(包括 AV7909)的安全性数据。
有潜在接触风险人群预防炭疽的建议:PrEP
ACIP先前建议将AVA PrEP用于预防炭疽杆菌暴露高风险人群的炭疽病(例如,部署到国防部指定的高暴露风险地区的美国军人,与高浓度炭疽杆菌打交道的实验室工作人员,以及可能处理受感染动物或受污染动物产品的农民、兽医和牲畜处理人员等人员)(9)。在这份报告中,ACIP建议每3年给予一次AVA PrEP加强剂量,对于没有暴露于炭疽杆菌的高风险人群,他们之前已经完成了3剂初级和最初的2剂加强AVA系列,并希望保持保护。
对于暴露于炭疽杆菌的高危人群,PrEP的时间表是AVA在0、1和6个月时作为启动系列肌内注射,在12个月和18个月时进行加强剂量,此后每年一次。如果疫苗接种计划被打断,则无需重新启动该系列。在完成启动系列后,人们可以在高风险暴露区域工作,并采取适当的个人防护设备和生物安全措施。不需要血清转化文件。如果违反生物安全或呼吸防护措施,并且可能暴露于雾化的炭疽芽孢杆菌孢子,则建议进行为期 30 天的 PEP-Abx 疗程,无论 PrEP 是否已全部或部分完成。
由于缺乏可量化的风险,不建议急救人员和其他急救人员接受常规的PrEP疫苗接种。然而,由于职业的需要,紧急救援人员可能会接触到雾化的炭疽杆菌孢子,因此可能会选择在自愿的基础上接种疫苗。对于目前没有暴露于炭疽杆菌的高风险人群(例如,参与应急响应活动的人员),已发表的数据(35)支持加强剂量间隔为>1年。因此,对于之前接受过初始 AVA 启动和加强系列并希望保持保护的炭疽杆菌暴露风险不高的人,可以每 3 年给予一次 AVA 加强剂量。在完成最初的 3 剂启动和加强系列后,在过去 12 个月内未接种加强剂量且需要进入环境中疑似存在炭疽杆菌或正在使用的区域的人应给予肌内注射加强剂量,然后等待 2 周进入高风险区域,或者, 如果需要立即进入,请服用 PEP-Abx 2 周。在高风险地区,应在最后一次加强剂量后 1 年内接种加强剂量。
暴露于雾化炭疽芽孢杆菌孢子但尚未完成 AVA 初始启动和加强系列的人应接受额外的 AVA 剂量和 PEP-Abx。PEP-Abx的疫苗剂量和持续时间将与先前接受的剂量数量相称(表2)。
疑似或已知接触者预防炭疽的建议:PEP
ACIP建议将AVA用于18-65岁的成年人,与一个疗程的抗菌药物(表3)联合使用,以防止疑似或已知暴露于雾化炭疽芽孢杆菌后的感染。提供了抗菌持续时间的详细信息(表4)。疫苗在暴露后 0、2 和 4 周以 0.5 mL SC 的剂量给药,除非应急响应需要改变 IM 途径或使用节省剂量的方案。如果 PEP-Vx 计划中断,则无需重新启动该系列。相反,应尽快给药后续剂量,并完成该系列。
给药途径
ACIP 推荐 PEP 采用 SC 给药途径而不是 IM 途径,因为 AVA 疫苗接种后 4 周可达到更高的抗体浓度。然而,在大规模应急响应期间,如果 SC 给药途径对物资、人员或临床构成重大挑战,可能会延迟或排除疫苗接种,则可以使用 IM 途径对 PEP 进行 AVA。此外,在皮下注射 AVA 中经历不良事件的人可以在咨询医疗保健提供者后选择接受后续剂量的疫苗。IM 途径而不是 SC 途径无意中给予的 AVA 剂量不需要通过 SC 途径重复。
节省剂量的 PEP 方案
如果炭疽疫苗供应不足以为所有潜在暴露者接种疫苗,ACIP建议使用节省剂量的PEP方案。2 剂全剂量策略将使现有疫苗供应量扩大 50%,3 剂半剂策略将扩大 100% 的供应量。在大面积炭疽芽孢杆菌孢子雾化释放后,在确定事件规模之前,首选的节省剂量的 PEP 方案可能并不明显。据估计,所有节省剂量的 PEP-Vx 方案在最后一次给药后 2 周都能提供高水平的保护(表 5)。现有数据表明,间隔 2 周或间隔 4 周接种 2 剂是有效的;因此,两剂方案应间隔 ≥2 周,间隔 ≤4 周,认识到直到第二剂后 2 周才能实现全面保护 (37)。
抗菌持续时间与 FDA 许可或避免剂量的 AVA PEP 方案相结合
ACIP建议,在免疫功能正常的成年人(例如,18-65岁的健康、非妊娠成人)中,如果许可和节省剂量的PEP-Vx方案都按计划施用AVA,则可以在疫苗开始后42天停止用于许可和节省剂量的PEP-Vx方案的PEP-Abx(表4)。如果无法完成 AVA 系列,则抗菌治疗应持续 60 天。然而,第二剂 AVA 对于产生高浓度抗体至关重要。考虑到紧急情况可能导致的初始疫苗接种延迟,应尽快开始抗菌药物给药,并在接种第一剂疫苗后持续 42 天或接种最后一剂疫苗后 2 周,以最后者为准。没有关于人类的数据表明 PEP-Abx 应给予 >60 天,这是在没有接种疫苗的情况下给予 PEP-Abx 的推荐持续时间。因此,无论最后一次接种疫苗的时间如何,PEP-Abx 都不应在 >60 天内给予。
PEP-Abx 持续时间从 60 天缩短到 42 天,或最后一剂疫苗后 2 周,适用于 18-65 岁的健康成年人。免疫功能低下的人可能会干扰他们产生足够的免疫反应的能力,或者缺乏对 AVA 的免疫反应数据的人群(例如,儿童、孕妇和 ≥65 岁的成年人)应继续接受 PEP-Abx 治疗 60 天,同时进行 AVA。
AV7909的潜在紧急用途
由于供应问题和 AV7909 的研究状态,对于可能暴露于气溶胶炭疽杆菌孢子的 PEP-Vx,AVA 应优先于 AV7909。然而,有限的 2 期安全性和免疫原性数据表明 AV7909 似乎是安全有效的。一种有效的疫苗可以预防炭疽病,其益处超过了可能暴露于气溶胶炭疽杆菌孢子的人发生不良事件的已知潜在风险。因此,如果AVA供应耗尽或不可用,AV7909是暴露于雾化炭疽芽孢杆菌孢子的人根据FDA授予的EUA的PEP的一种选择。与AVA一样,抗菌药物(表3和表4)应与AV7909联合使用。ACIP将在AV7909关于安全性、免疫原性和抗菌药物生物相容性的其他数据可用时对其进行审查,并根据需要更新有关潜在优先使用的建议。
没有关于AV7909对儿童或其他特殊人群的免疫原性或安全性的数据。然而,正在进行一项 2 期临床试验,以评估 AVA 和 AV7909 在 >65 岁成人与 18-50 岁成人中的安全性和免疫原性 (62)。在缺乏此类数据的情况下,AVWG认为可以合理地预期PEP-Vx对儿童或特殊人群的风险和益处与一般成年人群的风险和益处相似。因此,如果AVA不可用,应考虑在适当的调节机制下紧急使用AV7909,用于所有已知或可能暴露于雾化炭疽杆菌孢子的人群。如果发生炭疽暴露事件,需要使用AV7909,而AV7909仍在开发中且尚未获得许可,ACIP将召开紧急会议,审查现有数据,以获取有关AV7909紧急使用的具体建议。
尚未对 AVA 和 AV7909 的互换性进行研究。在可行的情况下,应使用相同疫苗类型的剂量来完成一系列疫苗。但是,不应因为以前使用的疫苗类型不可用而推迟疫苗接种。当疫苗系列使用AVA和AV7909的组合时,应接种3剂炭疽疫苗,并与适当的抗菌药物结合使用(表3和表5)。
PEP的抗毒素用途
国家战略储备中提供了三种获得许可的炭疽抗毒素:静脉注射炭疽免疫球蛋白 (AIGIV) (63)、奥托沙单抗 (Anthim) (64) 和雷昔巴单抗 (ABthrax) (65)。AIGIV 是一种多克隆抗体,而 obiltoxaximab 和 raxibacumab 都是单克隆抗体。所有这些都通过与保护性抗原结合而起作用,从而阻止毒素进入细胞,从而阻止毒素在细胞内的作用。所有成人和儿童均需使用这三种抗毒素,用于治疗炭疽杆菌引起的吸入性炭疽,并结合适当的抗菌药物。
当替代疗法不可用或不合适时,Obiltoxaximab 和 raxibacumab 也适用于炭疽杆菌引起的吸入性炭疽的 PEP。在这些情况下,可以考虑使用奥比妥昔单抗或雷昔巴单抗来帮助预防吸入性炭疽。两种抗毒素对这一适应症的预测有效性完全基于在吸入性炭疽动物模型中进行的疗效研究 (66,67)。
数据表明,raxibacumab 可以与 AVA 联合用于 PEP,而不会影响疫苗免疫原性 (68)。尚无数据可评估奥托昔单抗与AVA联合给药是否会损害疫苗免疫原性。AIGIV 没有 PEP 适应症,因为在兔模型中联合给药 AIGIV 和 AVA 已被证明可显著降低对 AVA 的免疫应答的发展 (68)。
疫苗不良事件报告和其他信息
严重不良事件的监测对所有抗微生物药物、生物制剂和疫苗都很重要。在接受抗菌药物或炭疽抗毒素治疗 PEP 或治疗炭疽后,所有有临床意义的不良事件都应报告给 MedWatch 计划(https://www.fda.gov/safety/medwatch-fda-safety-information-and-adverse-event-reporting-program外部图标或888-463-6332)。接受 AVA 或 AV7909 后所有具有临床意义的不良事件都应报告给 VAERS(https://vaers.hhs.gov外部图标或 800-822-7967)。有关炭疽和炭疽疫苗的更多信息,请访问 https://www.cdc.gov/anthrax。
未来方向
未来炭疽疫苗研究的重点应包括评估儿童、老年人、孕妇和哺乳期母亲等特殊人群的免疫原性和安全性;对剂量节约方案的额外评估;评估AVA和AV7909的互换性;确定最佳加强计划,以在接种 PEP 疫苗计划后提供长期保护;AVA和AV7909在冷链外的稳定性测试;评估奥托昔单抗与 AVA 联合给药是否会损害疫苗免疫原性;以及暴露后环境中抗菌药物使用的最佳持续时间。计划进行研究,以评估PrEP加强针间隔较长对疫苗反应的影响。在AV7909被批准为许可疫苗后,ACIP将审查导致AV7909获得许可的额外数据,并根据需要更新建议。
确认
Marissa Persons,Modupe Osinubi,疾病预防控制中心国家新兴和人畜共患传染病中心高后果病原体和病理学部;阿曼达·科恩(Amanda Cohn),杰西卡·麦克尼尔(Jessica MacNeil),疾病预防控制中心国家免疫和呼吸系统疾病中心主任办公室。2017 年 3 月至 2019 年 1 月的免疫实践咨询委员会 (ACIP) 成员名册可在 https://www.cdc.gov/vaccines/acip/committee/members.html 上查阅。
免疫实践咨询委员会
通讯作者:William A. Bower,美国疾病预防控制中心国家新兴和人畜共患传染病中心高后果病原体和病理学部。电话:404-639-0376;电子邮件:wbower@cdc.gov。
1美国疾病预防控制中心国家新兴和人畜共患传染病中心高后果病原体和病理学部;2美国疾病预防控制中心国家免疫与呼吸系统疾病中心细菌性疾病科;3德克萨斯州休斯顿贝勒医学院医学系;4德克萨斯州休斯顿贝勒医学院分子病毒学与微生物学系和医学系;5美国陆军传染病医学研究所,马里兰州弗雷德里克;6美国疾病预防控制中心国家新发和人畜共患传染病中心防范和新发感染司;7佐治亚州亚特兰大埃默里大学医学系;8美国疾病预防控制中心实验室科学办公室
利益冲突
所有作者均已填写并提交了国际医学期刊编辑委员会表格,以披露潜在的利益冲突。没有披露潜在的利益冲突。
CDC采纳ACIP关于MMWR建议和报告、MMWR政策说明和免疫接种计划的建议(儿童/青少年、成人):
儿童、青少年和成人常规使用疫苗的建议由免疫实践咨询委员会 (ACIP) 制定。ACIP被特许为联邦咨询委员会,就使用疫苗和相关制剂控制美国平民的疫苗可预防疾病向疾病预防控制中心主任提供专家外部建议和指导。关于儿童和青少年常规使用疫苗的建议与美国儿科学会 (AAP)、美国家庭医生学会 (AAFP) 和美国妇产科医师学会 (ACOG) 的建议尽可能一致。成人常规使用疫苗的建议与 AAFP、ACOG 和美国内科医师学会 (ACP) 的建议相一致。CDC主任批准的ACIP建议在发病率和死亡率周报(MMWR)中公布之日成为机构指南。更多信息可在 https://www.cdc.gov/vaccines/acip 上找到。
引用
- 戴维斯JC。津巴布韦炭疽病的重大流行。在哈拉雷比阿特丽斯路传染病医院的经历。Cent Afr J Med 1985 年;31:176–80.
- Holty JE, Bravata DM, Liu H, Olshen RA, McDonald KM, Owens DK. 系统评价:1900 年至 2005 年一个世纪的吸入性炭疽病例。Ann Intern Med 2006 年;144:270–80.交叉参考外部图标 PubMed的外部图标
- Katharios-Lanwermeyer S、Holty JE、Person M 等人。在炭疽大规模伤亡事件中识别脑膜炎:自 1880 年以来全身性炭疽的系统评价。临床感染 Dis 2016;62:1537–45.交叉参考外部图标 PubMed的外部图标
- 展位 MG、Hood J、Brooks TJ、Hart A;苏格兰健康保护炭疽临床网络。吸毒者炭疽感染。柳叶刀 2010;375:1345–6.交叉参考外部图标 PubMed的外部图标
- 美国农业部;美国疾病预防控制中心(CDC)。 联邦选择代理计划:选择代理和毒素常见问题解答。华盛顿特区:美国农业部;佐治亚州亚特兰大:疾病预防控制中心。https://www.selectagents.gov/faq-general.html外部图标
- 美国食品和药物管理局。完整的处方信息:BioThrax(炭疽疫苗吸附)。马里兰州银泉市:美国食品和药物管理局。https://www.fda.gov/media/71954/download外部图标
- 克林曼 DM、谢 H、小 SF、库里 D、艾文斯 BE。CpG寡核苷酸可改善恒河猴炭疽疫苗接种诱导的保护性免疫反应。2004年疫苗;22:2881–6.交叉参考外部图标 PubMed的外部图标
- 克里格上午。Toll 样受体 9 激活的治疗潜力。Nat Rev Drug Discov 2006 年;5:471–84.交叉参考外部图标 PubMed的外部图标
- Wright JG, Quinn CP, Shadomy S, Messonnier N. 炭疽疫苗在美国的使用:免疫实践咨询委员会 (ACIP) 的建议,2009 年。MMWR Recomm 代表 2010;59(编号。RR-6)。PubMed的外部图标
- Hopkins RJ、Daczkowski NF、Kaptur PE 等。在健康成年志愿者中对吸附加 CPG 7909 (AV7909) 的 4 种炭疽疫苗制剂进行随机、双盲、安慰剂对照、安全性和免疫原性研究。2013年疫苗;31:3051–8.交叉参考外部图标 PubMed的外部图标
- Minang JT、Inglefield JR、Harris AM 等。在接种吸附加 CPG 7909 (AV7909) 炭疽疫苗的受试者中增强了早期先天和 T 细胞介导的反应。2014年疫苗;32:6847–54.交叉参考外部图标 PubMed的外部图标
- Rynkiewicz D、Rathkopf M、Sim I 等人。TLR9 激动剂 CPG 7909 在健康志愿者中显着增强了对 BioThrax®(炭疽疫苗吸附)的免疫反应。2011年疫苗;29:6313–20.交叉参考外部图标 PubMed的外部图标
- 伯恩斯 DL。使用动物规则获得疫苗许可。Curr Opin Virol 2012 年;2:353–6.交叉参考外部图标 PubMed的外部图标
- 美国食品和药物管理局。根据动物规则进行产品开发。马里兰州银泉市:美国食品和药物管理局。https://www.fda.gov/media/88625/download外部图标.
- Payne DC, Franzke LH, Stehr-Green PA, Schwartz B, McNeil MM. 制定疫苗分析部门的研究议程,以调查与炭疽疫苗吸附相关的潜在不良事件。药理表霉醇药物安全 2007;16:46–54.交叉参考外部图标 PubMed的外部图标
- Shimabukuro TT, Nguyen M, Martin D, DeStefano F. 疫苗不良事件报告系统 (VAERS) 中的安全监测。2015年疫苗;33:4398–405.交叉参考外部图标 PubMed的外部图标
- 疾病预防控制中心。 GRADE(建议、评估、开发和评估的分级)。佐治亚州亚特兰大:美国卫生与公众服务部,疾病预防控制中心。https://www.cdc.gov/vaccines/acip/recs/grade
- 疾病预防控制中心。 ACIP 会议信息。佐治亚州亚特兰大:美国卫生与公众服务部,疾病预防控制中心。https://www.cdc.gov/vaccines/acip/meetings/index.html
- 贝尔斯 ME、丹能伯格 AL、布拉赫曼 PS、考夫曼 AF、克拉茨基 PC、阿什福德 DA。炭疽疫情的流行病学反应:实地调查,1950-2001年。Emerg Infect Dis 2002;8:1163–74.交叉参考外部图标 PubMed的外部图标
- 布莱克本 JK、麦克尼塞特 KM、柯蒂斯 A、休-琼斯 ME。使用预测生态[校正]生态位建模对美国本土炭疽芽孢杆菌(炭疽病的病原体)的地理分布进行建模。Am J Trop Med Hyg 2007 年;77:1103–10.交叉参考外部图标 PubMed的外部图标
- 人类炭疽病。在:世界卫生组织。人类和动物炭疽病。第 4 版,瑞士日内瓦;世界卫生组织;2008:36–52.https://www.who.int/csr/resources/publications/anthrax_webs.pdfPDF 图标外部图标
- Jernigan DB、Raghunathan PL、Bell BP 等人;国家炭疽流行病学调查小组。2001年美国与生物恐怖主义有关的炭疽病调查:流行病学结果。Emerg Infect Dis 2002;8:1019–28.交叉参考外部图标 PubMed的外部图标
- 克里斯托弗 GW、西斯拉克 TJ、帕夫林 JA、艾岑 EM。生物战:历史视角。美国医学会 1997;278:412–7.
- 洛杉矶科尔。生物武器的幽灵。科学 Am 1996;275:60–5.
- Zilinskas RA.伊拉克的生物武器:过去就是未来?美国医学会 1997;278:418–24.
- 世界卫生组织。化学武器和生物武器的卫生问题,卫生组织顾问小组的报告。瑞士日内瓦;世界卫生组织;1970.
- Hendricks KA、Wright ME、Shadomy SV 等人;炭疽临床指南工作组。美国疾病控制与预防中心关于成人炭疽预防和治疗的专家小组会议。新兴感染 Dis 2014;20。交叉参考外部图标 PubMed的外部图标
- Bowere WA, Hendricks K, Pillai S, Guarnizo J, Meaney Delman D. 炭疽大规模伤亡事件期间的临床框架和医疗对策使用:CDC 建议。MMWR Recomm 代表 2015;64(编号。RR-4)。
- 亨德森 DW、孔雀 S、贝尔顿足球俱乐部。对猴子实验性肺炭疽预防的观察。J Hyg (Lond) 1956 年;54:28–36.交叉参考外部图标 PubMed的外部图标
- Friedlander AM、Welkos SL、Pitt ML 等。实验吸入性炭疽的暴露后预防。J Infect Dis 1993;167:1239–42.交叉参考外部图标 PubMed的外部图标
- 新泽西州维埃特里、Purcell BK、Lawler JV 等。短程暴露后抗生素预防与疫苗接种相结合可预防实验性吸入性炭疽。美国国家科学院院刊 2006;103:7813–6.交叉参考外部图标 PubMed的外部图标
- 美国食品和药物管理局。使用动物规则获得基于保护性抗原的炭疽疫苗用于暴露后预防适应症的许可途径:疫苗和相关生物制品咨询委员会会议的简报文件。马里兰州银泉市:美国食品和药物管理局;2010年11月16日。http://wayback.archive-it.org/7993/20170113080506/http:/www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/BloodVaccinesandOtherBiologics/VaccinesandRelatedBiologicalProductsAdvisoryCommittee/UCM232400.pdfPDF 图标外部图标
- Fay MP、Follmann DA、Lynn F 等人。炭疽疫苗诱导的抗体提供了对气溶胶攻击存活的跨物种预测。Sci Transl Med 2012年;4:151ra126。交叉参考外部图标 PubMed的外部图标
- Schiffer JM, Chen L, Dalton S, Niemuth NA, Sabourin CL, Quinn CP. 桥接非人灵长类动物的保护相关性,以重新评估人类炭疽疫苗吸附的加强时间表。2015年疫苗;33:3709–16.交叉参考外部图标 PubMed的外部图标
- Wright JG、Plikaytis BD、Rose CE 等。减少剂量方案和肌肉注射吸附炭疽疫苗对免疫反应和安全性的影响:一项随机试验。2014年疫苗;32:1019–28.交叉参考外部图标 PubMed的外部图标
- Sivko GS、Stark GV、Tordoff KP 等。炭疽疫苗吸附疫苗接种和炭疽芽孢杆菌孢子攻击后食蟹猴早期免疫应答-存活关系的评价。2016年疫苗;34:6518–28.交叉参考外部图标 PubMed的外部图标
- Bernstein DI、Jackson L、Patel SM 等。吸附炭疽疫苗四种不同给药方案的免疫原性和安全性,用于成人炭疽暴露后预防。2014年疫苗;32:6284–93.交叉参考外部图标 PubMed的外部图标
- Stark GV、Sivko GS、VanRaden M 等。加速炭疽疫苗吸附 (AVA) 方案的人类生存概率的跨物种预测以及疫苗和抗生素剂量节省的潜力。2016年疫苗;34:6512–7.交叉参考外部图标 PubMed的外部图标
- 美国食品和药物管理局。监管行动的简要依据——BioThrax(炭疽疫苗吸附)。马里兰州银泉市:美国食品和药物管理局;2015.https://www.fda.gov/media/94823/download外部图标
- 美国食品和药物管理局。21 CFR Sec. 310.305 有关未经批准的新药申请的已上市处方药的不良药物经历的记录和报告。联邦公报 2018;5。https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?fr=310.305外部图标
- Zhang Y, Martin SW, Rose CE Jr, et al.评估体重指数、疫苗接种前血清黄体酮水平和抗炭疽保护性抗原免疫球蛋白 G 对女性炭疽疫苗接种后注射部位不良事件的影响。Pharmacoepidemiol 药物安全 2008;17:1060–7.交叉参考外部图标 PubMed的外部图标
- Ionin B、Hopkins RJ、Pleune B 等人。评估吸附炭疽疫苗用于暴露后预防的免疫原性和有效性。临床疫苗免疫学 2013;20:1016–26.交叉参考外部图标 PubMed的外部图标
- 霍普金斯 RJ、霍华德 C、亨特-斯蒂特 E 等人。评估三剂 BioThrax® 方案用于健康成人暴露后预防的免疫原性和安全性的 3 期试验。2014年疫苗;32:2217–24.交叉参考外部图标 PubMed的外部图标
- King JC Jr、Gao Y、Quinn CP、Dreier TM、Vianney C、Espeland EM。18 至 20 岁炭疽疫苗安全性评估:青少年年龄降级研究的第一步。2015年疫苗;33:2470–6.交叉参考外部图标 PubMed的外部图标
- Hopkins RJ、Kalsi G、Montalvo-Lugo VM 等。一项随机、双盲、主动对照研究,评估三种疫苗接种方案和两种剂量水平的 AV7909 疫苗在健康成人炭疽暴露后预防中的安全性和免疫原性。2016年疫苗;34:2096–105.交叉参考外部图标 PubMed的外部图标
- Stewart B、Rose CE、Tokars JI 等。CDC炭疽疫苗吸附人体临床试验中与健康相关的生活质量。疫苗 2012;30:5875–9.交叉参考外部图标 PubMed的外部图标
- 菲利普斯 CJ、马蒂亚斯 GR、汉森 CJ、阿尔文 CR、史密斯 TC、瑞安 MA。患有慢性多症状疾病的美国海军波斯湾战争退伍军人的角鲨烯抗体。2009年疫苗;27:3921–6.交叉参考外部图标 PubMed的外部图标
- Sulsky SI、Luippold R、Garman P 等人。接种炭疽疫苗的美国陆军退伍军人的残疾情况。疫苗 2012;30:6150–6.交叉参考外部图标 PubMed的外部图标
- 苏尔斯基 SI、路易波德 RS、加曼 P、休斯 H、阿莫罗索 PJ。1998-2005年接种炭疽疫苗的美国陆军人员的残疾风险。2011年疫苗;29:6035–41.交叉参考外部图标 PubMed的外部图标
- Duderstadt SK、Rose CE Jr、Real TM 等。2002-2008 年美国军队现役军人的疫苗接种和 1 型糖尿病风险。疫苗 2012;30:813–9.交叉参考外部图标 PubMed的外部图标
- McNeil MM, Duderstadt SK, Sabatier JF, 马 GG, Duffy J. 疫苗接种和活跃成分美国军队中孤独心房颤动的风险。嗡嗡牛痘免疫剂 2019;15:669–76.交叉参考外部图标 PubMed的外部图标
- Bardenheier BH、Duffy J、Duderstadt SK 等。炭疽疫苗与美国军队类风湿性关节炎和系统性红斑狼疮的风险:一项病例对照研究。Mil Med 2016 年;181:1348–56.交叉参考外部图标 PubMed的外部图标
- 康林 AM、Bukowinski AT、Gumbs GR;国防部出生和婴儿健康登记小组。国家妊娠期天花疫苗登记处接受炭疽疫苗吸附的妇女的妊娠和婴儿健康结果分析。2015年疫苗;33:4387–90.交叉参考外部图标 PubMed的外部图标
- Conlin AMS、Sevick CJ、Gumbs GR、Khodr ZG、Bukowinski AT。怀孕期间意外接种炭疽疫苗的安全性:2003-2010 年美国军人出生缺陷分析。2017年疫苗;35:4414–20.交叉参考外部图标 PubMed的外部图标
- 美国食品和药物管理局。医疗产品紧急使用授权及相关主管部门。马里兰州银泉市:美国食品和药物管理局;2017.https://www.fda.gov/media/97321/download外部图标
- 美国国立卫生研究院。使用 3 个时间表和两个剂量水平的炭疽疫苗的 2 期安全性和免疫原性研究。华盛顿特区:美国国立卫生研究院;2015.https://clinicaltrials.gov/ct2/show/results/NCT01770743?view=results外部图标
- CPG 7909,一种免疫刺激性 TLR9 激动剂寡脱氧核苷酸,作为健康成人 Engerix-B HBV 疫苗的佐剂:一项双盲 I/II 期研究。临床免疫学杂志 2004;24:693–701.交叉参考外部图标 PubMed的外部图标
- Ellis RD、Martin LB、Shaffer D 等人。恶性疟原虫血期疫苗 MSP1(42)-C1/Alhydrogel 在未感染疟疾成人中的 1 期试验,含或不含 CPG 7909。PLoS One 2010;5:E8787.交叉参考外部图标 PubMed的外部图标
- Cooper CL、Davis HL、Morris ML 等。CPG 7909 注射液作为流感疫苗佐剂的安全性和免疫原性。2004年疫苗;22:3136–43.交叉参考外部图标 PubMed的外部图标
- CPG 7909 佐剂可改善抗逆转录病毒治疗的 HIV 感染成人的乙型肝炎病毒疫苗血清保护。艾滋病 2005;19:1473–9.交叉参考外部图标 PubMed的外部图标
- Mullen GE、Ellis RD、Miura K 等人。AMA1-C1/Alhydrogel 加 CPG 7909 的 1 期试验:一种用于恶性疟原虫疟疾的无性血液阶段疫苗。PLoS One 2008 年;3:E2940.交叉参考外部图标 PubMed的外部图标
- 美国国家医学图书馆。BARDA 确保老年人炭疽免疫力 (B-SAFE) 研究。马里兰州贝塞斯达:美国国家医学图书馆。https://clinicaltrials.gov/ct2/show/NCT03518125?cond=AV7909&draw=1&rank=3外部图标
- 安西姆。包装说明书。新泽西州派恩布鲁克:Elusys Therapeutics;2016.https://www.accessdata.fda.gov/drugsatfda_docs/label/2016/125509lbl.pdfPDF 图标外部图标
- 拉昔巴单抗。包装说明书。马里兰州罗克维尔:葛兰素史克;2012.https://www.accessdata.fda.gov/drugsatfda_docs/label/2012/125349s000lbl.pdfPDF 图标外部图标
- 炭疽。包装说明书。加拿大曼尼托巴省:Emergent BioSolutions;2015.https://www.fda.gov/media/91577/download外部图标.
- Migone TS, Subramanian GM, Zhong J, et al.Raxibacumab用于治疗吸入性炭疽。N Engl J Med 2009;361:135–44.交叉参考外部图标 PubMed的外部图标
- Yamamoto BJ、Shadiack AM、Carpenter S 等。Obiltoxaximab 可预防播散性炭疽杆菌感染,并提高吸入性炭疽动物模型暴露前和暴露后预防期间的生存率。抗菌剂 Chemother 2016;60:5796–805.交叉参考外部图标 PubMed的外部图标
- Malkevich NV、Basu S、Rudge TL Jr 等。炭疽免疫球蛋白对新西兰白兔BioThrax(炭疽疫苗吸附)反应的影响。抗菌剂 Chemother 2013;57:5693–6.交叉参考外部图标 PubMed的外部图标
图.酶联免疫吸附测定在炭疽疫苗吸附后随时间变化的抗保护性抗原免疫球蛋白 G的几何均值*
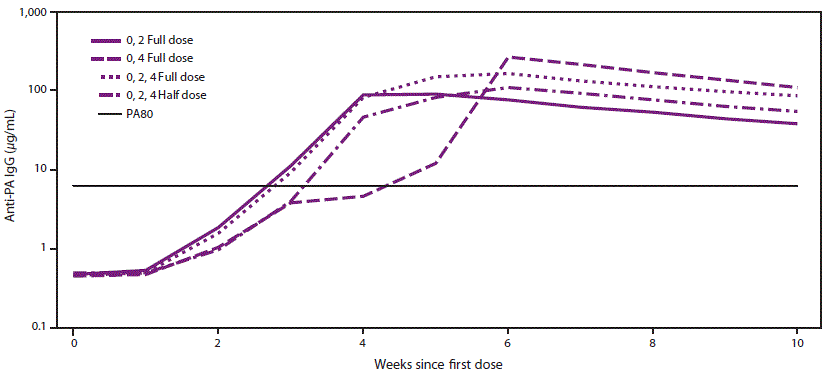
缩写:AVA = 炭疽疫苗吸附;IgG = 免疫球蛋白 G;PA = 保护性抗原。
* 0,2 全剂量 = 0.5 mL AVA,在 0 周和 2 周给药;0、4 全剂量 = 0.5 mL AVA 在 0 周和 4 周给药;0、2、4 全剂量 = 0.5 mL AVA 在第 0、2 和 4 周给药;0、2、4 半剂量 = 0.25 mL AVA 在第 0、2 和 4 周给药;PA80 = 80% 预测保护水平。
表 1.炭疽疫苗吸附暴露后预防计划和预测人类生存*
| 从第一次给药 PEP-Vx 开始的时间 | 通过 PEP-Vx 时间表预测人类生存 | |||
|---|---|---|---|---|
| 获得许可的疫苗接种方案 | 备用剂量节约方案 | |||
| 0、2 和 4 周时全剂量 | 全剂量†在第 0 周和第 2 周 | 0 周和 4 周时全剂量 | 0、2 和 4 周时半剂量§ | |
| % (95% CI) | % (95% CI) | % (95% CI) | % (95% CI) | |
| 第 4 周 | 95.8 (92.2–100) | 95.8 (82.6–100) | 72.6 (58.2–92.9)¶ | 91.1 (78.2–98.7) |
| 第 6 周 | 97.4 (85.1–100) | 95.5 (81.7–100) | 98.1 (86.9–100) | 96.1 (83.7–100) |
| 第 9 周 | 96.4 (83.1–100) | 93.3 (78.9–100) | 97.0 (84.4–100) | 94.2 (80.8–100) |
源:数据来自 Stark GV、Sivko GS、VanRaden M 等人。加速炭疽疫苗吸附 (AVA) 方案的人类生存概率的跨物种预测以及疫苗和抗生素剂量节省的潜力。2016年疫苗;34:6512–7.
缩写:AVA = 炭疽疫苗吸附;CI = 置信区间;PEP-Vx = AVA 暴露后预防。
* 基于非人灵长类动物的生存数据,这些灵长类动物在第 0 周和第 2 周接受 AVA 并接受 200 LD 目标剂量的挑战50第 4 周的雾化炭疽芽孢杆菌孢子。
†0.5 mL AVA。
0.25 mL AVA。
在第二剂疫苗前 4 周。§¶
表 2.对于尚未完成启动和初始加强系列的人,从暴露前预防*计划过渡到暴露后预防计划†并且必须立即进入炭疽杆菌暴露高风险区域§
| 既往接种PrEP剂量 | 自上次给药以来的间隔 | PEP的 | |
|---|---|---|---|
| PEP-VX系列 | PEP-ABX系列¶ | ||
| 0 | — | 剂量 1(第 0 周) | 给药至首次 AVA 给药后 42 天或最后一次给药后 14 天,以较晚者为准。 |
| 第 2 剂(第 2 周) | |||
| 第 3 剂(第 4 周) | |||
| 1 | — | 剂量 2(第 0 周) | 给药至第二剂 AVA 后 28 天或最后一次给药后 14 天,以较晚者为准。 |
| 第 3 剂(第 2 周) | |||
| 2 | — | 第 3 剂(第 0 周) | 给药至最后一次给药后 14 天。 |
| 3, 4 | >6 个月 | 加强剂量 | 给药至加强剂量后 14 天。 |
| 3, 4 | ≤6 个月 | 没有助推器 | 无需抗菌剂 |
缩写:AVA = 炭疽疫苗吸附;PEP = 暴露后预防;PEP-Abx = 抗菌 PEP;PEP-Vx = AVA PEP;PrEP = 暴露前预防。
*没有关于通过肌肉注射途径开始 PrEP 并切换到皮下途径加入 PEP 计划对免疫反应的影响的数据;然而,没有证据表明混合给药途径会对免疫反应产生不利影响。
†在 0、1 和 6 个月时启动剂量,在 12 个月和 18 个月时进行加强剂量。
高风险暴露的许可加强计划适用于高风险地区。
如果无法完成 AVA 系列,则抗菌治疗应持续 60 天。§¶
表 3.成人口服抗菌剂量与吸附炭疽疫苗结合用于暴露后预防
| 药物和剂量* | |
|---|---|
| 对于所有菌株,无论青霉素的敏感性或药敏性未知 | 环丙沙星,†每 12 小时 500 毫克 |
| 多西环素,†每 12 小时 100 毫克 | |
| 左氧氟沙星,每 24 小时 750 毫克 | |
| 莫西沙星,每 24 小时 400 毫克§ | |
| 克林霉素,每 8 小时 600 毫克§ | |
| 青霉素敏感菌株的替代品 | 阿莫西林,每 8 小时 1,000 毫克§ |
| 青霉素 VK,每 6 小时 500 毫克§ |
缩写:FDA = 食品和药物管理局;PEP-Abx = 抗菌药物暴露后预防。
* 这些药物治疗方案中的任何一种。
†一线药物;对于无法接受一线治疗或无法获得一线 PEP-Abx 的患者,按 PEP-Abx 的优先顺序列出替代药物。
未被 FDA 批准用于吸入性炭疽的 PEP-Abx。§
表 4.与食品和药物管理局许可或节省剂量的炭疽疫苗吸附暴露后预防方案结合使用时的抗菌持续时间*
| 疑似或已知暴露的人群 | 抗菌治疗方案的持续时间 |
|---|---|
| 18-65 岁免疫功能正常的成年人 | 与第一剂 AVA 同时开始的 42 天或最后一次 AVA 剂量后 14 天,以较晚者为准(不超过 60 天) |
| 年龄在 18-65 岁之间且免疫功能低下(例如癌症或 HIV 感染)或接受免疫抑制治疗(例如,>2 周大剂量皮质类固醇或放射治疗)的成年人† | 60天 |
| 所有老年人 (>65岁) | 60天 |
| 所有孕妇和哺乳期母亲 | 60天 |
| 所有孩童 (≤17岁) | 60天 |
缩写:AVA = 炭疽疫苗吸附。
* 如果 AVA 系列无法完成,则抗菌治疗应持续 60 天。
† 源: Löbermann M, Boršo D, Hilgendorf I, Fritzsche C, Zettl UK, Reisinger EC. 成人免疫功能低下宿主的免疫接种。Autoimmun 修订版 2012;11:212–8.
表 5.炭疽疫苗吸附剂量节约方案的暴露后预防
| 剂量 | 给药途径 | 给药时间表 |
|---|---|---|
| 0.5 mL(全剂量) | SC 或 IM* | 2 剂:0 周和 2-4 周 |
| 0.25 mL(半剂量) | SC 或 IM* | 3 剂:0、2 和 4 周 |
缩写:IM = 肌内注射;SC = 皮下。
*如果 SC 给药途径对材料、人员或临床造成重大挑战,可能会延迟或排除疫苗接种,则可以肌内注射。
建议引用本文:Bower WA、Schiffer J、Atmar RL 等。炭疽疫苗在美国的使用:免疫实践咨询委员会的建议,2019 年。MMWR 建议代表 0019;68(编号。RR-4):1-14。DOI:http://dx.doi.org/10.15585/mmwr.rr6804a1外部图标.
查看页面:PDF 图标PDF格式 [352K]
页面上次审核日期:2019 年 12 月 12 日
内容来源:美国疾病控制与预防中心
Hits: 13
