Contents
9价人乳头瘤病毒疫苗的10年随访:免疫原性、有效性和安全性
Ten-Year Follow-up of 9-Valent Human Papillomavirus Vaccine: Immunogenicity, Effectiveness, and Safety
Jaime Restrepo, MD;Teobaldo Herrera, MD;Rudiwilai Samakoses, MD;Julio C. Reina, MD;Punnee Pitisuttithum, MBBS, DTM&H;Angels Ulied, MD;Linda-Gail Bekker, MBChB, DTMH, DCH;Edson D. Moreira, Jr;Sven-Eric Olsson, MD;Stan L. Block, MD;Luciano S. Hammes, MD, PhD;Fabio Laginha, MD;Alex Ferenczy, MD;Robert Kurman, MD;Brigitte M. Ronnett, MD;Mark Stoler, MD;Oliver Bautista, PhD;Nancy E. Gallagher, BS;Gino Salituro, PhD;Min Ye, MS;Alain Luxembourg, MD, PhD
Address correspondence to Alain Luxembourg, MD, PhD, 126 E Lincoln Ave, Rahway, NJ 07065. E-mail: alain_luxembourg@merck.com
FUNDING: Funding for this research was provided by Merck Sharp and Dohme LLC, a subsidiary of Merck and Co, Inc., Rahway, NJ.
Pediatrics e2022060993.
https://doi.org/10.1542/peds.2022-060993
背景和目标:
在9至15岁男孩和女孩中进行的9价人乳头瘤病毒(9价HPV)疫苗三期免疫原性研究延长至最后一次疫苗剂量后10年,以评估免疫原性和有效性(NCT00943722)。
方法:
男生(n= 301)和女生(n= 971),他们在基础研究(第1天、第2个月和第6个月)中接受了三剂9价HPV疫苗,并参加了扩展研究。通过竞争性Luminex免疫测定和免疫球蛋白G-Luminex免疫测定收集第126个月的血清用于抗体评估。对于从16岁开始的有效性分析,收集生殖器拭子(通过聚合酶链反应评估人乳头瘤病毒DNA)并每6个月进行一次外部生殖器检查。主要分析在符合方案的人群中进行。
结果:
几何平均抗体滴度在第7个月左右达到峰值,在第7个月和第12个月之间急剧下降,然后在第126个月逐渐下降。在第126个月,每种9价HPV疫苗类型的血清阳性率通过竞争性Luminex免疫分析保持≥81%,通过免疫球蛋白G-Luminex免疫分析保持≥95%。在第3次接种后长达11.0年(平均10.0年)的随访后,男性或女性中未出现HPV6/11/16/18/31/33/45/52/58相关的高级别上皮内瘤形成或湿疣病例。根据以前的人乳头瘤病毒疫苗效力试验,男性和女性中与HPV6/11/16/18/31/33/45/52/58相关的6个月持续感染的发生率较低(分别为54.6和52.4/10000人-年),并且在接种队列的预期范围内。
结论:
9岁至15岁的男孩和女孩接种3剂9价HPV疫苗后,9价HPV疫苗显示了持续的免疫原性和有效性。
主题:
传染病, 性传播感染, 疫苗/免疫
话题:
人类乳头瘤病毒, 免疫原性, 持续感染, 疫苗, 替代端点, 人乳头瘤病毒疫苗, 接种疫苗
关于这个主题的已知信息:
根据免疫原性,9价HPV疫苗对HPV6/11/16/18/31/33/45/52/58相关疾病的效力在16至26岁的女性中确定,并在9至15岁的男孩和女孩中推断。在9至15岁的儿童中进行了为期8年的免疫原性和有效性试验。
这项研究补充道:
免疫原性、有效性和安全性在疫苗接种后10年得到了证明。与以前HPV疫苗效力研究中相似年龄的接种队列相比,与疫苗靶向人乳头瘤病毒型相关的持续感染率和疾病发生率在预期范围内。
9价人乳头瘤病毒(9价HPV)疫苗(最初于2014年获得许可,并在80多个国家注册1)靶向16、18、31、33、45、52和58型人乳头瘤病毒(人乳头瘤病毒),这些病毒导致90%的宫颈癌和人乳头瘤病毒相关的外阴、阴道、肛门和口咽癌,2以及6型和11型人乳头瘤病毒病毒,它们导致90%的生殖器疣和复发性呼吸道乳头状瘤病。3,4在一项关键研究V503-001中,在16至26岁的年轻女性中证明了9价HPV疫苗的功效。5,–7在V503-002研究中,从相对于年轻女性的非劣效抗体反应推断出9-15岁女孩和男孩的疗效。8其他获得许可的疫苗包括2种四价人乳头瘤病毒(qHPV6型、11型、16型和18型疫苗最初于2006年获得许可12022年,9和3种最初于2007年获得许可的二价人乳头瘤病毒(16型和18型)疫苗,1 2019,10还有2022年。11
人乳头瘤病毒病毒感染可能在初次性行为后不久获得。12因此,人乳头瘤病毒疫苗应该针对首次性交前的个体,以获得最大益处。由于人乳头瘤病毒感染的风险是终身的,人乳头瘤病毒疫苗应该提供持久的保护。因此,世界卫生组织建议在预防性人乳头瘤病毒疫苗的开发中纳入功效、安全性和免疫原性的长期随访(LTFU)。13临床研究证明了qHPV疫苗的免疫原性和有效性,以及接种后10年AS04-佐剂二价疫苗的免疫原性。14,15
实施了研究V503-002的扩展,以评估9价HPV疫苗接种后10年的长期免疫原性、安全性和有效性。长达8年随访的中期分析结果令人鼓舞。16在此,我们报告这项长期随访研究的最终10年数据。
方法
研究设计和参与者
基础研究(NCT00943722)8,179至15岁的登记女孩和男孩以及16至26岁的年轻妇女接受3剂9价HPV疫苗(第1天、第2个月、第6个月)。女孩和男孩的安全性和免疫原性随访至第36个月,而年轻女性在第12个月完成研究参与。8
在基础研究中接受3剂9价HPV疫苗的女孩和男孩有资格参加LTFU研究,以评估126个月(第3剂后10年)的免疫原性、有效性和安全性。在参与基础研究的72个研究点中,32个研究点无法承诺额外的7.5年随访。因此,LTFU研究在13个国家(比利时、巴西、哥伦比亚、哥斯达黎加、秘鲁、波兰、南非、韩国、西班牙、瑞典、台湾、泰国和美国)的40个地点进行。在LTFU期间没有注射其他HPV疫苗。
该研究是根据良好临床实践原则进行的,并获得了适当的机构审查委员会和监管机构的批准。所有参与者(或其父母或未成年人的法定监护人)在基础研究和LTFU研究开始时提供书面知情同意书;根据当地法规,达到法定年龄的参与者再次获得同意。
已采取措施将冠状病毒疾病2019疫情对研究执行的潜在影响降至最低。遵守相关指南并持续与研究中心协调,减轻了疫情对研究实施的影响。
终点和随访
LTFU研究的主要目的是评估第3次接种后10年内的抗HPV6、11、16、18、31、33、45、52和58抗体反应。在第1天和第7个月评估所有参与者的血清学反应,在第12个月、第24个月、第36个月、第66个月、第90个月和第126个月评估一个参与者子集的血清学反应,该子集包括所有男孩和600个随机样本的女孩(随机选择是在基础研究的数据库揭盲之前进行的,如先前报道的8,16)使用9价竞争性发光免疫分析(cLIA)18,19和人乳头瘤病毒-9 IgG Luminex免疫测定法(IgG-LIA)19,20分别作为初级和次级免疫测定。尽管在cLIA和IgG LIA分析中使用相同的术语(毫默克单位[mMU]/mL)作为测量单位,但“人乳头瘤病毒-9 cLIA mMU/mL”和“人乳头瘤病毒-9 IgG mMU/mL”是不同的测量单位,不能直接比较。
次要目标是根据HPV6/11/16/18/31/33/45/52/58相关持续感染(≥6个月持续时间1个月随访窗)和疾病的复合终点的发生率,评估疫苗的长期有效性。在女性参与者中,疾病包括宫颈上皮内瘤形成(CIN)、原位腺癌(AIS)、外阴上皮内瘤形成(VIN)、阴道上皮内瘤形成(VaIN)、生殖器疣(尖锐湿疣)以及宫颈癌、阴道癌和外阴癌。在男性参与者中,疾病包括阴茎上皮内瘤(PIN)、生殖器疣、阴茎癌、会阴癌和肛周癌。对于年龄≥16岁的参与者,每6个月进行一次有效性随访,包括收集性史、生殖器检查和生殖器临床标本收集(补充表4)。16HPV疫苗项目病理学小组的一致诊断用于临床疾病疗效终点;基于来自相同组织块的相邻切片中的聚合酶链式反应(PCR)检测来确定与给定人乳头瘤病毒类型的关系。人乳头瘤病毒相关持续感染的终点被定义为在至少相隔6个月(1个月的随访窗)的连续随访中采集的生殖器拭子或组织标本中相同人乳头瘤病毒型的PCR阳性;分别需要至少2份和3份阳性标本来确定6个月和12个月的持续感染病例。
LTFU期间的安全性评估包括报告所有疫苗相关的严重不良事件(SAE)和死亡。对妊娠结果进行随访。
统计分析
在符合方案的免疫原性(PPI)人群中进行免疫原性分析,该人群包括在第1天对适当的人乳头瘤病毒型呈血清阴性(通过cLIA)的参与者(或在分析HPV6-和HPV11相关终点时对HPV6/11呈血清阴性),在预先指定的日期范围内接受了所有3次疫苗接种,在第3次接种后21至49天内获得了第7个月的血清学结果,并且没有其他可能干扰免疫反应评估的方案违规行为。对每个时间点的几何平均滴度(GMT)和血清阳性率及其相关的95%置信区间(CI)进行了总结。
有效性分析是在符合方案的有效性(PPE)人群中进行的,该人群包括在接种第1剂9价HPV疫苗时(或在分析HPV6和HPV11相关终点时,HPV6和HPV11均为血清阴性),在1年内接受了所有3剂9价HPV疫苗,并且没有其他可能干扰疫苗有效性评估的方案违规行为的参与者。支持性分析在人乳头瘤病毒天真的特定型(HN-TS)人群中进行,该人群包括至少接种过1次9价HPV疫苗且在第1剂9价HPV疫苗时cLIA对特定人乳头瘤病毒型呈血清阴性的参与者(在HPV6和HPV11相关终点分析中,6型和11型均呈血清阴性)。持续感染的发生率(每10 000人-年的病例数)和疾病终点在研究结束时提供。基于泊松分布计算发病率的名义95%可信区间估计值。
总结了所有接受至少1次研究疫苗接种并有任何随访数据的参与者的安全性。
在LTFU研究中没有正式的假设检验。样本量基于继续参加LTFU的基础研究参与者人数。
结果
研究参与者
本研究从2009年8月27日(基础研究中的第一位受试者访视)至2021年4月22日(LTFU研究中的最后一位受试者,最后一次访视)进行。在基础研究中接受3剂疫苗的2553名男孩和女孩中,81272人同意参与,922人(72.5%)完成了研究(图1)。从LTFU中退出的最常见原因是参与者退出或失访。如前所述,16参加LTFU研究的参与者的基线特征(在第一剂疫苗注射前收集的)表1)与之前报道的参与基础研究的男孩和女孩的总体情况大致相似。8
图1

基础研究和LFTU中的参与者配置。不良事件。
表1
LTFU参与者的基线特征
| 女性(N = 971) | 男性(N = 301) | |
|---|---|---|
| 年龄 | ||
| 9到12岁,n (%) | 653 (67.3) | 207 (68.8) |
| 13至15岁,n (%) | 318 (32.7) | 94 (31.2) |
| 平均值(标准偏差),年 | 11.6 (1.9) | 11.5 (1.8) |
| 种族,n (%) | ||
| 美国印第安人或阿拉斯加土著 | 2 (0.2) | 1 (0.3) |
| 亚洲的 | 222 (22.9) | 74 (24.6) |
| 黑人或非裔美国人 | 129 (13.3) | 31 (10.3) |
| 多重 | 204 (21.0) | 114 (37.9) |
| 夏威夷土著或其他太平洋岛民 | 0 (0.0) | 3 (1.0) |
| 怀特(姓氏) | 414 (42.6) | 78 (25.9) |
| 种族划分 | ||
| 西班牙裔还是拉丁裔 | 372 (38.3) | 140 (46.5) |
| 不是西班牙裔或拉丁裔 | 599 (61.7) | 161 (53.5) |
| 身体质量指数,平均值(标准偏差)千克/米2 | 19.8 (4.1)a | 19.6 (4.0) |
| 地区 | ||
| 非洲 | 79 (8.1) | 28 (9.3) |
| 亚洲及太平洋地区 | 222 (22.9) | 74 (24.6) |
| 欧洲 | 256 (26.4) | 27 (9.0) |
| 拉丁美洲 | 297 (30.6) | 122 (40.5) |
| 北美洲 | 117 (12.0) | 50 (16.6) |
基线指第1剂疫苗注射前。
a
n = 970.
身体质量指数,体重指数。
标准差。
免疫原性
在9价HPV疫苗人乳头瘤病毒型中,抗人乳头瘤病毒cLIA GMTs在第7个月左右达到峰值,在第7个月和第12个月之间急剧下降,然后在第126个月逐渐下降(图2; 补充表格5和6)。这一趋势与9价HPV疫苗关键效力研究中对60个月年轻女性的观察结果一致5 (图2)。使用人乳头瘤病毒-9 IgG-LIA(补充表格7和8)。cLIA或IgG-LIA的GMT在女性和男性参与者中通常是相似的(补充表格6和8)。在基础研究中,9至12岁的受试者的抗人乳头瘤病毒GMT通常高于13至15岁的受试者(补充表格5和7)。
图2
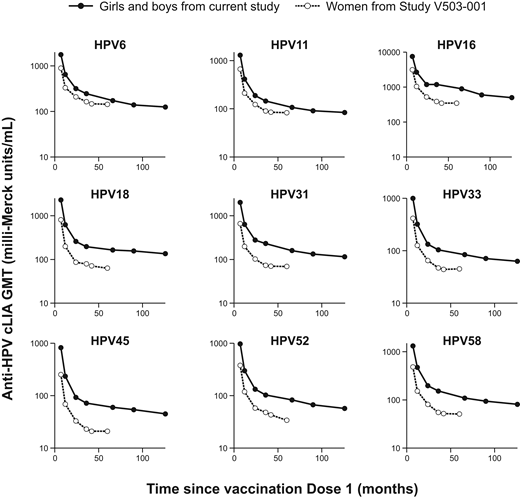
9价HPV疫苗LTFU(研究V503-002-20)中9-15岁的女孩和男孩以及研究V503-001中16-26岁的妇女接种疫苗后10年的抗人乳头瘤病毒cLIA GMTs。5
总体而言,99.6%至100%的参与者在第7个月时cLIA呈血清阳性,81.3%至97.7%的参与者在第126个月时仍呈血清阳性,这取决于人乳头瘤病毒类型(补充表格9和10)。基于更敏感的人乳头瘤病毒-9 IgG-LIA,94.9%至100%的参与者在第126个月时血清反应阳性(补充表格11和12)。
有效性
在第3次接种后,对参与者的有效性进行了长达11.0年的随访(中位数为10.0年)。在第3次接种后,对女性进行了长达11.0年的随访(中值为10.0年);在第3次接种后,对男性进行了长达10.6年的随访(中位时间为9.9年)。所有受试者在第90个月访视时都已年满16岁,大多数受试者(> 90%)在LTFU期间提供了评估有效性的样本(补充表13)。
在女性中,PPE分析中复合终点的HPV6/11/16/18/31/33/45/52/58相关的6个月持续感染和疾病的发生率为每10 000人-年52.4(持续感染:每10 000人-年52.4;疾病:每万人年2.2人;表2)。没有高等级CIN的病例,也没有与疫苗靶向的人乳头瘤病毒类型相关的VIN和VaIN的病例。1例宫颈上皮内瘤变1级(CIN1)患者在第84个月时通过PCR检测HPV16、HPV39和HPV59呈阳性(补充附录1);在随后的随访中,宫颈细胞学结果为阴性。
表2
女性和男性LTFU参与者(PPE人群)中与HPV6/11/16/18/31/33/45/52/58相关的持续感染和疾病终点的发生率
| 女性(N = 971) | 男性(N = 301) | |||||
|---|---|---|---|---|---|---|
| 案例/n | 人年随访a | 每10,0 00人-年的比率(95%置信区间) | 案例/n | 人年随访a | 每10,0 00人-年的比率(95%置信区间) | |
| HPV6/11/16/18/31/33/45/52/58相关的6-mo持续感染b或者疾病c | 24/872 | 4579.6 | 52.4 (33.6–78.0) | 7/261 | 1282.7 | 54.6 (21.9–112.4) |
| HPV6/11/16/18/31/33/45/52/58相关的6-mo持续感染b | 24/872 | 4579.6 | 52.4 (33.6–78.0) | 7/261 | 1282.7 | 54.6 (21.9–112.4) |
| HPV6/11/16/18相关 | 22/870 | 4580.4 | 48.0 (30.1–72.7) | 1/261 | 1296.1 | 7.7 (0.2–43.0) |
| HPV6相关 | 4/847 | 4520.4 | 8.8 (2.4–22.7) | 0/255 | 1273.4 | 0.0 (0.0–29.0) |
| HPV11相关 | 0/847 | 4530.1 | 0.0 (0.0–8.1) | 1/255 | 1270.9 | 7.9 (0.2–43.8) |
| HPV16相关 | 17/860 | 4541.3 | 37.4 (21.8–59.9) | 0/260 | 1293.0 | 0.0 (0.0–28.5) |
| HPV18相关 | 1/867 | 4627.2 | 2.2 (0.1–12.0) | 0/259 | 1285.9 | 0.0 (0.0–28.7) |
| HPV31/33/45/52/58相关 | 2/872 | 4649.5 | 4.3 (0.5–15.5) | 6/261 | 1285.2 | 46.7 (17.1–101.6) |
| HPV31相关 | 0/855 | 4657.1 | 0.0 (0.0–8.1) | 2/259 | 1287.6 | 15.5 (1.9–56.1) |
| HPV33相关 | 1/866 | 4625.7 | 2.2 (0.1–12.0) | 0/259 | 1294.0 | 0.0 (0.0–28.5) |
| HPV45相关 | 0/871 | 4652.5 | 0.0 (0.0–7.9) | 1/261 | 1292.6 | 7.7 (0.2–43.1) |
| HPV52相关 | 0/870 | 4645.5 | 0.0 (0.0–7.9) | 4/261 | 1286.8 | 31.1 (8.5–79.6) |
| HPV58相关 | 1/863 | 4611.5 | 2.2 (0.1–12.1) | 0/259 | 1293.2 | 0.0 (0.0–28.5) |
| HPV6/11/16/18/31/33/45/52/58相关的12月持续感染d | 9/872 | 4621.1 | 19.5 (8.9–37.0) | 2/261 | 1294.2 | 15.5 (1.9–55.8) |
| HPV6/11/16/18相关 | 8/870 | 4619.9 | 17.3 (7.5–34.1) | 0/261 | 1298.6 | 0.0 (0.0–28.4) |
| HPV6相关 | 2/847 | 4524.4 | 4.4 (0.5–16.0) | 0/255 | 1273.4 | 0.0 (0.0–29.0) |
| HPV11相关 | 0/847 | 4530.1 | 0.0 (0.0–8.1) | 0/255 | 1273.4 | 0.0 (0.0–29.0) |
| HPV16相关 | 5/860 | 4576.8 | 10.9 (3.5–25.5) | 0/260 | 1293.0 | 0.0 (0.0–28.5) |
| HPV18相关 | 1/867 | 4627.2 | 2.2 (0.1–12.0) | 0/259 | 1285.9 | 0.0 (0.0–28.7) |
| HPV31/33/45/52/58相关 | 1/872 | 4651.4 | 2.1 (0.1–12.0) | 2/261 | 1294.2 | 15.5 (1.9–55.8) |
| HPV31相关 | 0/855 | 4567.1 | 0.0 (0.0–8.1) | 0/259 | 1289.2 | 0.0 (0.0–28.6) |
| HPV33相关 | 1/866 | 4625.7 | 2.2 (0.1–12.0) | 0/259 | 1294.0 | 0.0 (0.0–28.5) |
| HPV45相关 | 0/871 | 4652.5 | 0.0 (0.0–7.9) | 0/261 | 1298.6 | 0.0 (0.0–28.4) |
| HPV52相关 | 0/870 | 4645.5 | 0.0 (0.0–7.9) | 2/261 | 1294.2 | 15.5 (1.9–55.8) |
| HPV58相关 | 0/863 | 4613.5 | 0.0 (0.0–8.0) | 0/259 | 1293.2 | 0.0 (0.0–28.5) |
| HPV6/11/16/18/31/33/45/52/58相关疾病c | 1/866 | 4576.1 | 2.2 (0.1–12.2) | 0/261 | 1278.6 | 0.0 (0.0–28.9) |
| CIN1f | 1/866e | 4573.9 | 2.2 (0.1–12.2) | — | — | — |
| CIN2或CIN3f | 0/866 | 4577.5 | 0.0 (0.0–8.1) | — | — | — |
| 先期情报(AdvancedInformationSheet)f | 0/866 | 4577.5 | 0.0 (0.0–8.1) | — | — | — |
| 宫颈癌f | 0/866 | 4577.5 | 0.0 (0.0–8.1) | — | — | — |
| 湿疣f,g | 0/866 | 4579.6 | 0.0 (0.0–8.1) | 0/261 | 1278.6 | 0.0 (0.0–28.9) |
| VIN1或更差f | 0/866 | 4579.6 | 0.0 (0.0–8.1) | — | — | — |
| VaIN1或更差f | 0/866 | 4579.6 | 0.0 (0.0–8.1) | — | — | — |
| PIN1或更差g | — | — | — | 0/261 | 1278.6 | 0.0 (0.0–28.9) |
——不适用;AIS,原位腺癌;CIN3,宫颈上皮内瘤变3级;N,接受至少1次9价HPV疫苗接种并同意接受LTFU的参与者人数;n参与分析的人数;PIN1,阴茎上皮内瘤变1级;VaIN1,阴道上皮内瘤变1级;VIN1,外阴上皮内瘤变1级。
a对于每个参与者,从LTFU研究开始(即第42个月随访)或参与者年满16岁时(以较晚者为准)开始计算人年随访。
b6个月持续感染的病例是在至少相隔6个月(1个月)的2次或更多次连续就诊中获得的2次或更多次宫颈阴道或外生殖器拭子、活检或最终治疗样本的HP V6/11/16/18/31/33/45/52/58 PCR检测中,同一人乳头瘤病毒类型的≥1个共同基因呈阳性的参与者。
c在女性中,疾病包括湿疣、CIN、AIS、VIN、VaIN和宫颈癌、外阴癌或阴道癌;在男性中,这包括湿疣、PIN和阴茎、会阴或肛周癌。
d持续感染12个月的病例是在至少间隔6个月(1个月)的3次或3次以上连续就诊中获得的3次或3次以上宫颈阴道或外生殖器拭子、活检或最终治疗样本的HP V6/11/16/18/31/33/45/52/58 PCR检测中,同一人乳头瘤病毒类型的1个以上共同基因呈阳性的参与者。
eHPV16相关的CIN1。
f女性参与者。
g在男性参与者中。
在男性中,PPE分析中复合终点的HPV6/11/16/18/31/33/45/52/58相关的6个月持续感染和疾病的发生率为54.6/10 000人-年(持续感染:54.6/10 000人-年;疾病:0/万人年;表2)。没有与疫苗靶向的人乳头瘤病毒型相关的病例。
当在HN-TS人群中分析有效性时,结果是相似的(补充表14)。在HN-TS人群中,没有其他女性或男性疾病终点病例。
LTFU研究中持续感染的发生率和疾病终点,包括HPV6/11/16/18-和HPV31/33/45/52/58相关持续感染的复合终点(图3A),与每种人乳头瘤病毒相关的持续感染终点(无花果3B),以及与疫苗人乳头瘤病毒类型相关的疾病终点,包括CIN,任何等级;CIN2级(CIN 2)或更差(无花果3C);和女性的外生殖器损伤(图3D)和男性(无花果3E)在基于先前9价HPV和qHPV疫苗研究的接种队列中的预期范围内。
图3

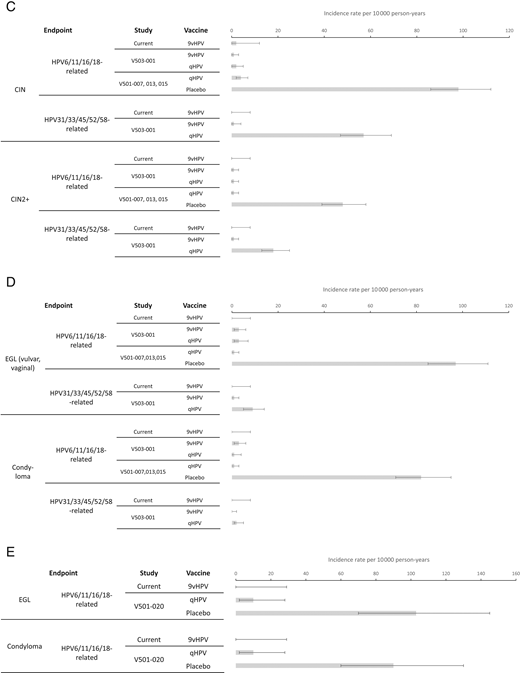
qHPV和9价HPV疫苗试验中疫苗人乳头瘤病毒型相关终点的发生率。a,在本研究和之前的9价HPV和qHPV疫苗功效研究中,女性和男性参与者中与HPV6/11/16/18和HPV31/33/45/52/58相关的持续感染的综合发病率。误差线显示95%置信区间。研究V503-001: NCT005435435;研究V501-007: NCT0036571621;研究V501-020 NCT00090285。22在本研究和先前的9价HPV和qHPV疫苗效力研究中,与单个疫苗靶向人乳头瘤病毒型相关的持续感染发生率。误差线显示95%置信区间。研究V503-001: NCT005435435;研究V501-007: NCT00365716。21c,在本研究和之前的9价HPV和qHPV疫苗功效研究中,与HPV6/11/16/18和HPV31/33/45/52/58相关的宫颈发育不良的发生率。误差线显示95%置信区间。研究V503-001: NCT005435435;研究V501-007: NCT0036571643;研究V501-013: NCT0009252123;研究V501-015: NCT00092534。44本研究中与HPV6/11/16/18和HPV31/33/45/52/58相关的女性外生殖器损伤和湿疣的发病率,以及先前的9价HPV和qHPV疫苗的功效研究。误差线显示95%置信区间。研究V503-001: NCT005435435;研究V501-007: NCT0036571643;研究V501-013: NCT0009252123;研究V501-015: NCT00092534。44在本研究和V501-020研究中,与HPV6/11/16/18相关的男性外生殖器损伤和湿疣的发病率。误差线显示95%置信区间。研究V501-020: NCT00090285。22
在对PPE人群进行LTFU研究期间,可归因于非疫苗人乳头瘤病毒型的持续感染和疾病持续累积(表3)。女性参与者和男性参与者中HPV35/39/51/56/59相关的6个月持续感染的发生率分别为927.4和261.5/10000人-年。在女性中,HPV35/39/51/56/59相关疾病的发病率为每10 000人-年68.8例。在男性参与者中没有观察到HPV35/39/51/56/59相关疾病的病例。
表3
女性和男性LTFU参与者(PPE人群)中HPV35/39/51/56/59相关持续感染和疾病终点的发生率
| 女性(N = 971) | 男性(N = 301) | |||||
|---|---|---|---|---|---|---|
| 案例/n | 人年随访b | 每10,0 00人-年的比率(95%置信区间) | 案例/n | 人年随访b | 每10,0 00人-年的比率(95%置信区间) | |
| HPV35/39/51/56/59相关a6-mo持续感染c或者疾病d | 305/807 | 3287.7 | 927.7 (826.5–1037.9) | 30/246 | 1147.3 | 261.5 (176.4–373.3) |
| HPV35/39/51/56/59相关的6-mo持续感染c | 305/807 | 3288.6 | 927.4 (826.3–1037.6) | 30/246 | 1147.3 | 261.5 (176.4–373.3) |
| HPV35相关 | 20/807 | 4266.8 | 46.9 (28.6–72.4) | 3/246 | 1227.2 | 24.4 (5.0–71.4) |
| HPV39相关 | 102/807 | 3984.4 | 256.0 (208.7–310.8) | 6/246 | 1224.4 | 49.0 (18.0–106.7) |
| HPV51相关 | 134/807 | 3908.8 | 342.8 (287.2–406.0) | 11/246 | 1212.3 | 90.7 (45.3–162.4) |
| HPV56相关 | 173/807 | 3755.6 | 460.6 (394.6–534.6) | 14/246 | 1183.4 | 118.3 (64.7–198.5) |
| HPV59相关 | 98/807 | 4023.6 | 243.6 (197.7–296.8) | 4/246 | 1221.9 | 32.7 (8.9–83.8) |
| HPV35/39/51/56/59相关的12个月持续感染e | 208/807 | 3605.4 | 576.9 (501.2–660.9) | 14/246 | 1186.1 | 118.0 (64.5–198.0) |
| HPV35相关 | 13/807 | 4282.3 | 30.4 (16.2–51.9) | 2/246 | 1228.9 | 16.3 (2.0–58.8) |
| HPV39相关 | 61/807 | 4100.5 | 148.8 (113.8–191.1) | 3/246 | 1229.6 | 24.4 (5.0–71.3) |
| HPV51相关 | 65/807 | 4126.0 | 157.5 (121.6–200.8) | 3/246 | 1227.0 | 24.4 (5.0–71.5) |
| HPV56相关 | 103/807 | 3973.6 | 259.2 (211.6–314.4) | 8/246 | 1205.0 | 66.4 (28.7–130.8) |
| HPV59相关 | 53/807 | 4155.0 | 127.6 (95.5–166.8) | 2/246 | 1227.6 | 16.3 (2.0–58.9) |
| HPV35/39/51/56/59相关疾病d | 29/802 | 4216.7 | 68.8 (46.1–98.8) | 0/246 | 1215.5 | 0.0 (0.0–30.3) |
| CIN1f | 24/802 | 4226.1 | 56.8 (36.4–84.5) | — | — | — |
| CIN2或CIN3f | 5/802 | 4264.5 | 11.7 (3.8–27.4) | — | — | — |
| 先期情报(AdvancedInformationSheet)f | 0/802 | 4268.6 | 0.0 (0.0–8.6) | — | — | — |
| 宫颈癌f | 0/802 | 4268.6 | 0.0 (0.0–8.6) | — | — | — |
| 湿疣f,g | 1/802 | 4269.3 | 2.3 (0.1–13.1) | 0/246 | 1215.5 | 0.0 (0.0–30.3) |
| VIN1或更差f | 1/802 | 4265.4 | 2.3 (0.1–13.1) | — | — | — |
| VaIN1或更差f | 1/802 | 4265.4 | 2.3 (0.1–13.1) | — | — | — |
| PIN1或更差g | — | — | — | 0/246 | 1215.5 | 0.0 (0.0–30.3) |
——不适用;AIS,原位腺癌;CIN3,宫颈上皮内瘤变3级;N,接受至少1次9价HPV疫苗接种并同意接受LTFU的参与者人数;n参与分析的人数;PIN1,阴茎上皮内瘤变1级;VaIN1,阴道上皮内瘤变1级;VIN1,外阴上皮内瘤变1级。
a由于缺乏关于这些非疫苗人乳头瘤病毒型的基线血清和PCR状态,本研究无法确定关于人乳头瘤病毒35/39/51/56/59型的基线人乳头瘤病毒-幼稚人群。因此,与这些人乳头瘤病毒型相关的基线人乳头瘤病毒天真人群由所有人乳头瘤病毒型6/11/16/18/31/33/45/52/58的天真参与者人群近似。非疫苗人乳头瘤病毒35/39/51/56/59型的PPE人群由符合所有人乳头瘤病毒6/11/16/18/31/33/45/52/58型PPE资格的参与者组成。
b对于每个参与者,从LTFU研究开始(即第42个月随访)或参与者年满16岁时(以较晚者为准)开始计算人年随访。
c6个月持续感染的病例是指参与者在至少相隔6个月(1个月)的2次或2次以上连续就诊中获得的2个或2个以上宫颈阴道或外生殖器拭子、活检或最终治疗样本中,相同人乳头瘤病毒类型的1个以上共同基因PCR阳性。
d在女性中,疾病包括湿疣、CIN、AIS、VIN、VaIN和宫颈癌、外阴癌或阴道癌;在男性中,这包括湿疣、PIN和阴茎、会阴或肛周癌。
e持续感染12个月的病例是指参与者在至少相隔6个月(1个月)的3次或3次以上连续就诊中获得的2个或更多宫颈阴道或外生殖器拭子、活检或最终治疗样本中,相同人乳头瘤病毒类型的1个以上共同基因PCR阳性。
f女性参与者。
g在男性参与者中。
PPE人群中的女性和男性获得新性伴侣的比率分别为0.76和1.12人/年随访(补充表15)。的发生率衣原体女性和男性分别为4.0和2.3/100人年,淋病的发病率分别为0.9和0.7。如所示补充表15在这项研究中,女性获得新性伴侣的比率略高,并且有相似或更高的比率衣原体和淋病的发病率。5,21男性获得新性伴侣的比率与之前在年轻男性中进行的qHPV疫苗效力试验相似。22
安全
接种疫苗后10年内,LTFU期间未报告疫苗相关的SAE。一名受试者在LTFU期间死亡,原因是在第3剂后8.6年出现播散性结核病的SAE(不认为与疫苗相关)。妊娠结局在中描述补充附录2和补充表16.
讨论
这些数据证明了9价HPV疫苗在施用10年后的长期免疫原性、有效性和安全性。这些研究结束时的结果扩展了之前8年中期分析的结果16通过提供关于9价HPV疫苗的长期免疫原性、有效性和安全性的进一步证据,以及其他分析,包括按年龄分层的长期免疫原性、疾病终点的发生率、本研究中由个体人乳头瘤病毒型引起的持续感染与之前qHPV和9价HPV疫苗的疗效试验以及妊娠结局。
9价HPV疫苗在9至15岁的女孩和男孩中在第3剂后的10年中引发了针对9种疫苗靶向人乳头瘤病毒型的持续抗体应答。GMT在第7个月达到峰值,在第12个月急剧下降,之后缓慢下降。在第126个月,绝大多数参与者对每种疫苗靶向的人乳头瘤病毒病毒类型保持血清阳性。
在LTFU结束时,女性受试者中未出现宫颈、外阴或阴道高级上皮内瘤变,男性受试者中未出现阴茎、会阴或肛周高级上皮内瘤变,所有受试者中未出现与疫苗靶向人乳头瘤病毒类型相关的生殖器疣。与9价HPV疫苗类型(与HPV16、HPV39和HPV59相关的CIN1)相关的低度上皮内瘤形成的单一病例可能是由HPV39和/或HPV59引起的,因为检测到这些类型的持续感染,并且不被认为是突破性病例,因为这两种类型不被9价HPV疫苗覆盖。
在没有对照组的情况下,本研究中有效性数据的解释是基于与多区域HPV疫苗临床试验的比较,包括qHPV疫苗在16-23岁女性中的II期有效性研究。21qHPV疫苗在16至24岁女性中的未来I关键功效研究,23qHPV疫苗在16至26岁男性中的关键功效研究,22以及在16至26岁女性中进行的关键的9价HPV疫苗功效、免疫原性和安全性研究。5本研究中观察到的6个月持续感染和疾病的发生率与之前9价HPV和qHPV疫苗疗效研究中报告的9价HPV和qHPV疫苗接受者的发生率一致,这些研究在与LTFU研究中年龄大致相同的个体中进行,且低于这些研究对照组中报告的发生率。综上所述,结果表明在这项研究中,男性和女性参与者的疫苗效力都很高。
在这项研究中观察到的与疫苗人乳头瘤病毒型相关的低感染率和疾病发生率不太可能是由于缺乏通过性活动接触人乳头瘤病毒病毒的结果。在LTFU期间,参与者继续增加与疫苗未覆盖的人乳头瘤病毒类型相关的感染和疾病。HPV35/39/51/56/59相关的6个月持续感染的发生率与9价HPV疫苗在年轻女性中的关键疗效研究中的发生率相似(800/10000人-年;O.B .,A.L .,未发表的观察结果)。此外,参与者在LTFU期间获得新性伴侣的比率与其他HPV疫苗临床试验相似或更高。5,21,22其他非人乳头瘤病毒相关的性传播疾病(衣原体和淋病)的检出率也与先前试验中观察到的性暴露率一致。5,21,22
LTFU期间未观察到疫苗相关的SAE。一名参与者死亡;该事件被认为与疫苗无关。在第42个月和第126个月之间退出研究的参与者比例(27.5%,或每年4%)与关键的9价HPV疫苗效力研究中观察到的比例相当5以及之前的qHPV疫苗功效研究。由于随访时间长,预计青少年时期参与研究的受试者会因生活阶段的变化而中断研究(如上学、工作或家庭努力)。事实上,LTFU期间的大多数中断是因为随访失败或参与者的决定。
这项研究有许多优点。它使用了与qHPV和9价HPV疫苗的关键疗效研究以及qHPV疫苗的LTFU有效性研究中使用的相同的研究终点的严格评估。15,24,25因此,先前9价HPV和qHPV疫苗研究的结果可以用作解释当前研究结果的基准。参与者在年满16岁后评估其有效性,该年龄与之前参加qHPV和9价HPV疫苗的有效性研究的参与者的年龄相似,5,21,–23,26允许在先前安慰剂对照疗效研究的背景下解释结果。这项研究包括了五大洲13个国家的不同人群,支持了这些发现的普遍性。
这项研究也有一些局限性。由于该研究不包括对照组,持续感染和疾病终点的发生率在先前qHPV和9价HPV疫苗效力研究的接种组和对照组中相同终点的发生率的背景下进行解释。尽管它涉及跨研究比较,但这种方法是合理的,因为所有研究都考虑了类似的资格标准,使用相同的疗效终点定义,并使用相同的实验室检测和相同的程序和病理学小组进行终点评估,从而最大限度地降低了偏倚风险。总体而言,持续有效性的证明是强有力的,因为没有观察到由疫苗靶向的人乳头瘤病毒型引起的疾病病例,由疫苗靶向的人乳头瘤病毒型引起的持续感染率与先前9价HPV和qHPV疫苗效力试验中接种队列中观察到的感染率一致,并且有证据表明在LTFU期间持续的性活动和暴露于非疫苗人乳头瘤病毒型。这项研究采用了3剂疫苗接种方案。两剂人乳头瘤病毒疫苗接种方案可能更容易实施,也更适应世界各地的疫苗接种计划,已被广泛许可并推荐给9至14岁的个人。27在以前的临床研究中,在接受2剂qHPV疫苗的9-13岁女孩中,在最后一剂后1个月进行抗人乳头瘤病毒GMT28,–309至14岁的女孩和男孩接种了2剂9价HPV疫苗31,32并不劣于接受3剂相同疫苗的16-26岁女性。此外,对于qHPV疫苗,已经观察到对2剂量方案的抗体反应持续10年309价HPV疫苗为3年,32与16至26岁的女性相比,非劣效性标准在整个随访期间仍然有效。28,30,32根据对16至26岁女性接种qHPV和9价HPV疫苗的长期有效性的证明,可以推断接受2剂疫苗的女孩和男孩的长期保护作用。24,33正如以前报道的,间隔12个月接受2剂HPV疫苗的女孩和男孩通常具有更高或相似的GMT趋势,间隔6个月接受2剂疫苗的女孩和男孩与接受3剂疫苗的女孩相比具有相似或更低的GMT趋势。30,32总的来说,在青少年和年轻成人中进行的qHPV和9价HPV疫苗的3剂方案的有效性和免疫原性结果来自这项研究和其他长期研究15,24,33提供基准以推断由2剂量方案引起的抗体反应也提供长期保护。
结论
在引入人乳头瘤病毒疫苗后,现实世界的研究表明,疫苗人乳头瘤病毒类型的流行率降低,以及高度宫颈病变的发生率降低34,–36和浸润性宫颈癌37,–41在接种疫苗的人群中。来自大型上市后监测研究和流行病学研究的累积安全性数据与临床试验中的安全性数据一致。42这些上市后结果,以及LTFU临床试验扩展的结果,包括本文所述的研究,继续支持人乳头瘤病毒疫苗接种的有利效益风险特征。
感谢
作者感谢所有研究参与者、研究者和现场人员的贡献。在作者的指导下,由CMC AFFINITY,McCann Health Medical communication s的Erin Bekes博士根据良好出版规范(GPP 2022)指南提供医学写作帮助。该援助由新泽西州拉威市默克公司的子公司默克夏普和多姆有限责任公司资助。
雷斯特雷波博士、埃雷拉博士、萨马科塞斯博士、雷纳博士、皮蒂苏蒂图姆博士、乌利德博士、贝克博士、小莫雷拉博士、奥尔松博士、布洛克博士、哈梅斯博士、拉金哈博士、费伦茨博士、库尔曼博士、罗内特博士、斯托勒博士、包蒂斯塔博士、、萨利图罗博士、叶博士和卢森堡博士对数据的获取、分析和解释做出了重大贡献;所有作者严格审查和修改了手稿,批准了提交的最终手稿,并同意对工作的所有方面负责。
此试用版已在注册www.clinicaltrials.gov(标识符NCT00943722)。
数据共享声明:将不会提供去身份化的个人参与者数据。
9价HPV:9价人乳头瘤病毒
CIN:宫颈上皮内瘤变
CIN1:宫颈上皮内瘤变1级
CIN2:宫颈上皮内瘤变2级
cLIA:竞争性Luminex免疫分析
GMT:几何平均滴度
HN-TS:人乳头瘤病毒-天真,类型特定
HPV:人类乳头瘤病毒
IgG-LIA:IgG发光免疫分析
LTFU:长期随访
mMU:毫默克单位
PCR:聚合酶链反应
PIN:阴茎上皮内瘤形成
PIN1:阴茎上皮内瘤形成1级
PPE:每个协议的有效性
PPI:符合方案的免疫原性
qHPV:四价人乳头瘤病毒
SAE:严重不良事件
VaIN:阴道上皮内瘤变
VaIN1:阴道上皮内瘤变1级
VIN:外阴上皮内瘤变
VIN1:外阴上皮内瘤变1级
竞争的利益
利益冲突披露:Herrera博士得到了新泽西州拉威市默克公司的子公司默克夏普和多姆有限责任公司的研究支持;Ulied博士从新泽西州拉威市Merck and Co,Inc .的子公司Merck Sharp and Dohme LLC处收取了开展该临床试验的个人费用,还从GSK处收取了费用(用于开展其他临床试验)和辉瑞公司的讲座资助;Moreira Jr博士获得了新泽西州拉威市默克公司的研究资助,并且是该公司发言人办公室的成员;根据合同,Olsson博士从默克公司获得资助,进行人乳头瘤病毒疫苗的研究;Block博士获得了新泽西州拉威市默克公司演讲人办公室的研究资助,是该办公室的成员,并担任默克公司的付费专家证人和顾问;Ferenczy博士作为病理学审查小组的成员,从新泽西州拉威市默克公司的子公司默克夏普和多姆有限责任公司收取咨询费;Kurman和Ronnett博士报告说,作为病理学审查小组的成员,他们从Merck Sharp and Dohme LLC(新泽西州拉威市Merck and Co,Inc .的子公司)收取咨询费;斯托勒博士从新泽西州拉威市默克公司的子公司默克夏普和多姆有限责任公司收取个人费用;罗氏;贝克顿·狄金森;和Inovio Pharmaceuticals作为顾问,所有这些都在提交的工作之外;Bautista、、Salituro、Ye和Luxembourg博士是新泽西州拉威默克公司的子公司Merck Sharp and Dohme LLC的雇员,可能拥有新泽西州拉威默克公司的股票或股票期权;所有其他作者都表示他们没有与本文相关的利益冲突需要披露。
参考
1Luxembourg A, Moeller E. 9-Valent human papillomavirus vaccine: a review of the clinical development program. Expert Rev Vaccines. 2017;16(11):1119–1139
Google ScholarCrossref
2de Sanjosé S, Serrano B, Tous S, et al; RIS HPV TT, VVAP and Head and Neck study groups. Burden of human papillomavirus (HPV)-related cancers attributable to HPVs 6/11/16/18/31/33/45/52 and 58. JNCI Cancer Spectr. 2019;2(4):pky045
Google ScholarCrossref
3Garland SM, Steben M, Sings HL, et al. Natural history of genital warts: analysis of the placebo arm of 2 randomized phase III trials of a quadrivalent human papillomavirus (types 6, 11, 16, and 18) vaccine. J Infect Dis. 2009;199(6):805–814
Google ScholarCrossref
4Fortes HR, von Ranke FM, Escuissato DL, et al. Recurrent respiratory papillomatosis: a state-of-the-art review. Respir Med. 2017;126:116–121
Google ScholarCrossref
5Huh WK, Joura EA, Giuliano AR, et al. Final efficacy, immunogenicity, and safety analyses of a nine-valent human papillomavirus vaccine in women aged 16-26 years: a randomised, double-blind trial. Lancet. 2017;390(10108):2143–2159
Google ScholarCrossref
6Joura EA, Giuliano AR, Iversen OE, et al; Broad Spectrum HPV Vaccine Study. A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women. N Engl J Med. 2015;372(8):711–723
Google ScholarCrossref
7Giuliano AR, Joura EA, Garland SM, et al. Nine-valent HPV vaccine efficacy against related diseases and definitive therapy: comparison with historic placebo population. Gynecol Oncol. 2019;154(1):110–117
Google ScholarCrossref
8Van Damme P, Olsson SE, Block S, et al. Immunogenicity and safety of a 9-valent HPV vaccine. Pediatrics. 2015;136(1):e28–e39
Google ScholarCrossref
9Zee Business. Cervical cancer vaccine CERVAVAC: India’s 1st indigenously developed vaccine – top things. Available at: https://www.msn.com/en-in/health/medical/cervical-cancer-vaccine-cervavac-india-s-1st-indigenously-developed-vaccine-top-things/ar-AA11mmVk. Accessed September 8, 2022
10PATH. New HPV vaccine from Innovax receives WHO prequalification. Available at: https://www.path.org/media-center/new-hpv-vaccine-innovax-receives-who-prequalification/. Accessed October 28, 2022
11Yushuo Y. Walvax’s cervical cancer vaccine gets greenlight to go to market in China. Available at: https://www.yicaiglobal.com/news/walvax-cervical-cancer-vaccine-gets-greenlight-to-go-to-market-in-china. Accessed November 24, 2022
12Castellsagué X, Paavonen J, Jaisamrarn U, et al; HPV PATRICIA Study Group. Risk of first cervical HPV infection and pre-cancerous lesions after onset of sexual activity: analysis of women in the control arm of the randomized, controlled PATRICIA trial. BMC Infect Dis. 2014;14:551
Google ScholarCrossref
13World Health Organization (WHO) Expert Committee on Biological Standardization. Guidelines to Assure the Quality, Safety, and Efficacy of Recombinant HPV Virus-like Particle Vaccines. Geneva, Switzerland: World Health Organization; 2006
14Schwarz TF, Huang L-M, Valencia A, et al. A ten-year study of immunogenicity and safety of the AS04-HPV-16/18 vaccine in adolescent girls aged 10-14 years. Hum Vaccin Immunother. 2019;15(7–8):1970–1979
Google Scholar
15Ferris DG, Samakoses R, Block SL, et al. 4-Valent human papillomavirus (4vHPV) vaccine in pre-adolescents and adolescents after 10 years. Pediatrics. 2017;140(6):e20163947
Google ScholarCrossref
16Olsson SE, Restrepo JA, Reina JC, et al. Long-term immunogenicity, effectiveness, and safety of nine-valent human papillomavirus vaccine in girls and boys 9 to 15 years of age: interim analysis after 8 years of follow-up. Papillomavirus Res. 2020;10:100203
Google ScholarCrossref
17Luxembourg A, Moreira EDJJr, Samakoses R, et al. Phase III, randomized controlled trial in girls 9-15 years old to evaluate lot consistency of a novel nine-valent human papillomavirus L1 virus-like particle vaccine. Hum Vaccin Immunother. 2015;11(6):1306–1312
Google ScholarCrossref
18Roberts C, Green T, Hess E, et al. Development of a human papillomavirus competitive luminex immunoassay for 9 HPV types. Hum Vaccin Immunother. 2014;10(8):2168–2174
Google ScholarCrossref
19Nolan KM, Seaton B, Antonello J, et al. Development and validation of two optimized multiplexed serologic assays for the 9-Valent Human Papillomavirus vaccine types. MSphere. 2023;8(2):e0096221
Google ScholarCrossref
20Opalka D, Matys K, Bojczuk P, et al. Multiplexed serologic assay for nine anogenital human papillomavirus types. Clin Vaccine Immunol. 2010;17(5):818–827
Google ScholarCrossref
21Villa LL, Costa RLR, Petta CA, et al. High sustained efficacy of a prophylactic quadrivalent human papillomavirus types 6/11/16/18 L1 virus-like particle vaccine through 5 years of follow-up. Br J Cancer. 2006;95(11):1459–1466
Google ScholarCrossref
22Giuliano AR, Palefsky JM, Goldstone S, et al. Efficacy of quadrivalent HPV vaccine against HPV infection and disease in males. N Engl J Med. 2011;364(5):401–411
Google ScholarCrossref
23Garland SM, Hernandez-Avila M, Wheeler CM, et al; Females United to Unilaterally Reduce Endo/Ectocervical Disease (FUTURE) I Investigators. Quadrivalent vaccine against human papillomavirus to prevent anogenital diseases. N Engl J Med. 2007;356(19):1928–1943
Google ScholarCrossref
24Kjaer SK, Nygård M, Sundström K, et al. Final analysis of a 14-year long-term follow-up study of the effectiveness and immunogenicity of the quadrivalent human papillomavirus vaccine in women from four Nordic countries. EClinicalMedicine. 2020;23:100401
Google ScholarCrossref
25Goldstone SE, Giuliano AR, Palefsky JM, et al. Efficacy, immunogenicity, and safety of a quadrivalent HPV vaccine in men: results of an open-label, long-term extension of a randomised, placebo-controlled, phase 3 trial. Lancet Infect Dis. 2022;22(3):413–425
Google ScholarCrossref
26Palefsky JM, Giuliano AR, Goldstone S, et al. HPV vaccine against anal HPV infection and anal intraepithelial neoplasia. N Engl J Med. 2011;365(17):1576–1585
Google ScholarCrossref
27World Health Organization (WHO). Human papillomavirus vaccines: WHO position paper, May 2017. Wkly Epidemiol Rec. 2017;92(19):241–268
28Dobson SRM, McNeil S, Dionne M, et al. Immunogenicity of 2 doses of HPV vaccine in younger adolescents vs 3 doses in young women: a randomized clinical trial. JAMA. 2013;309(17):1793–1802
Google ScholarCrossref
29Ogilvie G, Sauvageau C, Dionne M, et al. Immunogenicity of 2 vs 3 doses of the quadrivalent human papillomavirus vaccine in girls aged 9 to 13 years after 60 months. JAMA. 2017;317(16):1687–1688
Google ScholarCrossref
30Donken R, Dobson SRM, Marty KD, et al. Immunogenicity of 2 and 3 doses of the quadrivalent human papillomavirus vaccine up to 120 months postvaccination: follow-up of a randomized clinical trial. Clin Infect Dis. 2020;71(4):1022–1029
Google ScholarCrossref
31Iversen OE, Miranda MJ, Ulied A, et al. Immunogenicity of the 9-valent HPV vaccine using 2-dose regimens in girls and boys vs a 3-dose regimen in women. JAMA. 2016;316(22):2411–2421
Google ScholarCrossref
32Bornstein J, Roux S, Kjeld Petersen L, et al. Three-year follow-up of 2-dose vs 3-dose HPV vaccine. Pediatrics. 2021;147(1):e20194035
Google ScholarCrossref
33Kjaer SK, Nygård M, Sundström K, et al. Long-term effectiveness of the nine-valent human papillomavirus vaccine in Scandinavian women: interim analysis after 8 years of follow-up. Hum Vaccin Immunother. 2021;17(4):943–949
Google ScholarCrossref
34Garland SM, Kjaer SK, Muñoz N, et al. Impact and effectiveness of the quadrivalent human papillomavirus vaccine: a systematic review of 10 years of real-world experience. Clin Infect Dis. 2016;63(4):519–527
Google ScholarCrossref
35Markowitz LE, Liu G, Hariri S, Steinau M, Dunne EF, Unger ER. Prevalence of HPV after introduction of the vaccination program in the United States. Pediatrics. 2016;137(3):e20151968
Google ScholarCrossref
36Drolet M, Bénard É, Pérez N, Brisson M, Group HVIS; HPV Vaccination Impact Study Group. Population-level impact and herd effects following the introduction of human papillomavirus vaccination programmes: updated systematic review and meta-analysis. Lancet. 2019;394(10197):497–509
Google ScholarCrossref
37Falcaro M, Castañon A, Ndlela B, et al. The effects of the national HPV vaccination programme in England, UK, on cervical cancer and grade 3 cervical intraepithelial neoplasia incidence: a register-based observational study. Lancet. 2021;398(10316):2084–2092
Google ScholarCrossref
38Kjaer SK, Dehlendorff C, Belmonte F, Baandrup L. Real-world effectiveness of human papillomavirus vaccination against cervical cancer. J Natl Cancer Inst. 2021;113(10):1329–1335
Google ScholarCrossref
39Lei J, Ploner A, Elfström KM, et al. HPV vaccination and the risk of invasive cervical cancer. N Engl J Med. 2020;383(14):1340–1348
Google ScholarCrossref
40Luostarinen T, Apter D, Dillner J, et al. Vaccination protects against invasive HPV-associated cancers. Int J Cancer. 2018;142(10):2186–2187
Google ScholarCrossref
41Siegel RL, Miller KD, Wagle NS, Jemal A. Cancer statistics, 2023. CA Cancer J Clin. 2023;73(1):17–48
Google ScholarCrossref
42World Health Organization (WHO). Meeting of the Global Advisory Committee on Vaccine Safety, 7–June 8, 2017. Wkly Epidemiol Rec. 2017;92(28):393–402
43Villa LL, Costa RLR, Petta CA, et al. Prophylactic quadrivalent human papillomavirus (types 6, 11, 16, and 18) L1 virus-like particle vaccine in young women: a randomised double-blind placebo-controlled multicentre phase II efficacy trial. Lancet Oncol. 2005;6(5):271–278
Google ScholarCrossref
44FUTURE II Study Group. Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions. N Engl J Med. 2007;356(19):1915–1927
Crossref
45Moreira EDJr, Block SL, Ferris D, et al. Safety profile of the 9-valent HPV vaccine: a combined analysis of 7 Phase III clinical trials. Pediatrics. 2016;138(2):e20154387
Google ScholarCrossref
46Garland SM, Ault KA, Gall SA, et al; Quadrivalent Human Papillomavirus Vaccine Phase III Investigators. Pregnancy and infant outcomes in the clinical trials of a human papillomavirus type 6/11/16/18 vaccine: a combined analysis of five randomized controlled trials. Obstet Gynecol. 2009;114(6):1179–1188
Google ScholarCrossref
47Wilcox AJ, Weinberg CR, O’Connor JF, et al. Incidence of early loss of pregnancy. N Engl J Med. 1988;319(4):189–194
Google ScholarCrossref
48Wilcox AJ, Baird DD, Weinberg CR. Time of implantation of the conceptus and loss of pregnancy. N Engl J Med. 1999;340(23):1796–1799
Google ScholarCrossref
49Lohstroh PN, Overstreet JW, Stewart DR, et al. Secretion and excretion of human chorionic gonadotropin during early pregnancy. Fertil Steril. 2005;83(4):1000–1011
Google ScholarCrossref
50García-Enguídanos A, Calle ME, Valero J, Luna S, Domínguez-Rojas V. Risk factors in miscarriage: a review. Eur J Obstet Gynecol Reprod Biol. 2002;102(2):111–119
Google ScholarCrossref
51Ammon Avalos L, Galindo C, Li DK. A systematic review to calculate background miscarriage rates using life table analysis. Birth Defects Res A Clin Mol Teratol. 2012;94(6):417–423
Google ScholarCrossref
52Gregory ECW, MacDorman MF, Martin JA. Trends in Fetal and Perinatal Mortality in the United States, 2006–2012. NCHS Data Brief, No.169. Hyattsville, MD: National Center for Health Statistics; 2014
Google Scholar
53Woods R. Long-term trends in fetal mortality: implications for developing countries. Bull World Health Organ. 2008;86(6):460–466
Google ScholarCrossref
54Hobbs CA, Cleves MA, Simmons CJ. Genetic epidemiology and congenital malformations: from the chromosome to the crib. Arch Pediatr Adolesc Med. 2002;156(4):315–320
Google ScholarCrossref
55Hollier LM, Leveno KJ, Kelly MA, MCIntire DD, Cunningham FG. Maternal age and malformations in singleton births. Obstet Gynecol. 2000;96(5 Pt 1):701–706
Google Scholar
56Goldstone SE, Jessen H, Palefsky JM, et al. Quadrivalent HPV vaccine efficacy against disease related to vaccine and non-vaccine HPV types in males. Vaccine. 2013;31(37):3849–3855
Google ScholarCrossref
57Else EA, Swoyer R, Zhang Y, et al. Comparison of real-time multiplex human papillomavirus (HPV) PCR assays with INNO-LiPA HPV genotyping extra assay. J Clin Microbiol. 2011;49(5):1907–1912
Google ScholarCrossref
58Roberts CC, Swoyer R, Bryan JT, Taddeo FJ. Comparison of real-time multiplex human papillomavirus (HPV) PCR assays with the linear array HPV genotyping PCR assay and influence of DNA extraction method on HPV detection. J Clin Microbiol. 2011;49(5):1899–1906
Google ScholarCrossref
这是一篇在知识共享署名-非商业性使用-非专用4.0国际许可条款下发布的开放访问文章(http://creativecommons.org/licenses/by-nc-nd/4.0/),允许在任何媒体上进行非商业性、分发和复制,前提是注明原作者和来源。
Hits: 101
