Contents
带状疱疹疫苗Shingrix FDA
处方信息的重点
SHINGRIX (Zoster Vaccine Recombinant, Adjuvanted), suspension for intramuscular injection
Initial U.S. Approval: 2017
这些重点不包括使用所需的所有信息
安全有效地使用SHINGRIX。请参阅完整的处方信息
SHINGRIX。
SHINGRIX(重组带状疱疹疫苗,含佐剂),肌肉注射用混悬剂
美国首次批准日期:2017年
————适应症和用法————
SHINGRIX是一种用于预防带状疱疹(HZ)的疫苗:
•50岁及以上的成年人。
•18岁及以上的成年人,由于已知疾病或治疗导致的免疫缺陷或免疫抑制,其患HZ的风险将会增加。
使用限制(1):
•SHINGRIX不适用于预防原发性水痘感染(水痘)。
————剂量和用法————
仅用于肌肉注射。
根据以下方案肌肉注射两剂(每剂0.5毫升):
•第0个月注射第一剂,2到6个月后注射第二剂。(2.3)
•对于患有或将患有免疫缺陷或免疫抑制的个体以及将从较短的疫苗接种时间表中获益的个体:第0个月接种第一剂疫苗,1至2个月后接种第二剂疫苗。(2.3)
————剂型和强度————
注射用混悬剂以冻干水痘带状疱疹病毒糖蛋白E(gE)抗原成分的单剂量小瓶提供,与随附的AS01B佐剂混悬剂成分小瓶一起复溶。复溶后,单剂量SHINGRIX为0.5 mL。(3)
————禁忌症————
对疫苗的任何成分有严重过敏反应(如过敏反应)史,或在接种前一剂SHINGRIX后有过敏反应史。(4)
————警告和注意事项————
•在一项上市后观察性研究中,在接种SHINGRIX疫苗后的42天内观察到格林巴利综合征风险增加。(5.2, 6.2)
•晕厥可能与注射疫苗(包括SHINGRIX)有关。应制定程序以避免跌倒伤害并恢复晕厥后的脑灌注。(5.3)
————不良反应————
•在50岁及以上人群中报告的征集的局部不良反应包括疼痛(78%)、红肿(38%)和肿胀(26%)。(6.1)
•在50岁及以上的个体中报告的征集的一般不良反应有肌痛(45%)、疲劳(45%)、头痛(38%)、颤抖(27%)、发烧(21%)和胃肠道症状(17%)。(6.1)
•自体造血干细胞移植受者(18至49岁且≥50岁)报告的征集的局部不良反应包括疼痛(88%和83%)、发红(30%和35%)和肿胀(21%和18%)。(6.1)
•自体造血干细胞移植受者(18至49岁且≥50岁)报告的征集的一般不良反应包括疲劳(64%和54%)、肌痛(58%和52%)、头痛(44%和30%)、胃肠道症状(21%和28%)、颤抖(31%和25%)和发烧(28%和18%)。(6.1)
要报告疑似不良反应,请联系
葛兰素史克公司1-888-825-5249或VAERS公司1-800-822-7967或
有关患者咨询信息,请参见第17节。
修订日期:2023年5月
| 完整的处方信息:内容* | 11描述 14.5对18岁及以上免疫缺陷成人的疗效14.6 ZOSTAVAX疫苗接种后的再次接种(带状疱疹疫苗) *未列出完整处方信息中省略的章节或小节。 |
完整的处方信息
1适应症和用法
SHINGRIX是一种用于预防带状疱疹(HZ)的疫苗:
•50岁及以上的成年人。
•18岁及以上的成年人,由于以下原因而面临或将面临更高的带状疱疹风险由已知疾病或疗法引起的免疫缺陷或免疫抑制。使用限制:
•SHINGRIX不适用于预防原发性水痘感染(水痘)。
2剂量和给药
仅用于肌肉注射。
2.1复溶
SHINGRIX以2个小瓶提供,必须在给药前混合。准备SHINGRIX通过将冻干的水痘带状疱疹病毒糖蛋白E(gE)抗原组分(粉末)与伴随的AS01B佐剂混悬组分(液体)复溶。仅使用随附的佐剂悬浮液成分(液体)进行复溶。这复溶疫苗应为乳白色、无色至淡褐色液体。只要溶液和容器允许,给药前应目视检查颗粒和变色。如果存在这两种情况中的任何一种,则不应接种疫苗。
| 图1.清洗两个瓶塞。使用无菌针头和无菌注射器,通过轻微倾斜小瓶,将装有佐剂混悬剂组分(液体)的小瓶中的全部内容物抽出。第1瓶,共2瓶。 | 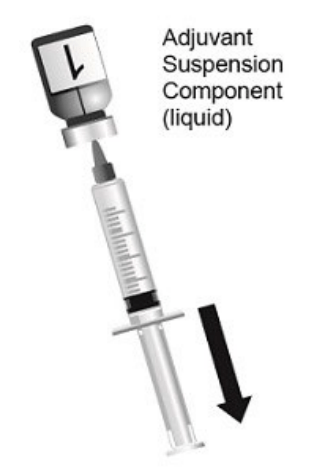 |
| 图2.将注射器的全部内容物缓慢转移到冻干的gE抗原成分小瓶(粉末)中。第2瓶,共2瓶。 | 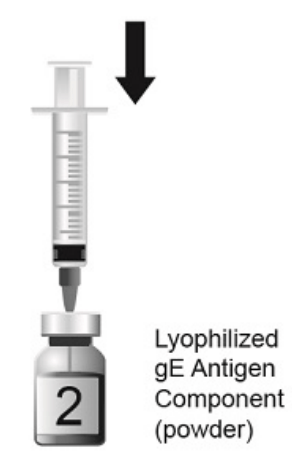 |
| 图3.轻轻旋转小瓶,直到粉末完全溶解。 不要剧烈摇晃。 | 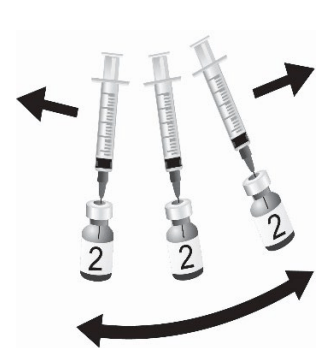 |
| 图4.复溶后,从装有复溶疫苗的小瓶中抽取0.5毫升并肌肉注射。 |  |
2.2仅用于肌肉注射的给药说明。
复溶后,立即接种SHINGRIX或在2至8℃(36至46℉)下冷藏保存,并在6小时内使用。如果未在6小时内使用,请丢弃重组疫苗。
对每个人使用单独的无菌针头和无菌注射器。肌肉注射的首选部位是上臂的三角肌区域。
2.3剂量和时间表
根据以下方案肌肉注射两剂(每剂0.5毫升):
第0个月注射第一剂,2至6个月后注射第二剂。
对于患有或将患有免疫缺陷或免疫抑制的个体以及将从较短的疫苗接种时间表中获益的个体:第0个月接种第一剂疫苗,1至2个月后接种第二剂疫苗。
3剂型和强度
SHINGRIX是一种注射用混悬剂,以单剂量冻干gE抗原成分小瓶提供,与随附的AS01B佐剂混悬剂成分小瓶一起复溶。复溶后的单次剂量为0.5毫升。
4禁忌症
请勿将SHINGRIX用于对疫苗的任何成分有严重过敏反应(如过敏反应)史的任何人或前一剂SHINGRIX后的任何人【参见说明(11)】.
5警告和注意事项
5.1预防和管理疫苗过敏反应
给药前,医疗保健提供者应审查免疫史,以了解可能的疫苗敏感性和先前的疫苗接种相关不良反应。必须提供适当的医疗治疗和监督,以管理接种SHINGRIX后可能出现的过敏反应。
5.2格林-巴利综合征(GBS)
在一项上市后观察性研究中,在接种新冠疫苗后的42天内观察到GBS风险增加【参见不良反应(6.2)】.
5.3晕厥
晕厥(昏厥)可能与注射疫苗有关,包括SHINGRIX。晕厥可伴有短暂的神经系统体征,如视觉障碍、感觉异常和强直阵挛性肢体运动。应制定程序以避免跌倒伤害并恢复晕厥后的脑灌注。
6不良反应
6.1临床试验经验
由于临床试验是在差异很大的条件下进行的,因此在一种疫苗的临床试验中观察到的不良反应率不能直接与另一种疫苗的临床试验中的不良反应率进行比较,并且可能不能反映实际观察到的不良反应率。SHINGRIX的广泛使用可能会揭示临床试验中未观察到的不良反应。
50岁及以上的成年人
总体而言,在17项临床研究中,17,041名50岁及以上的成年人至少接受了1剂SHINGRIX。
通过汇总2项安慰剂对照临床研究(研究1和研究2)的数据来评估SHINGRIX的安全性,这些研究涉及29,305名年龄在50岁及以上的受试者,他们至少接受了根据0个月和2个月的方案接种1剂SHINGRIX(n = 14,645)或生理盐水安慰剂(n = 14,660)。接种疫苗时,人口的平均年龄为69岁;7,286名(25%)受试者年龄在50至59岁之间,4,488名(15%)受试者年龄在60至69岁之间,17,531名(60%)受试者年龄在70岁及以上。这两项研究都在北美、拉丁美洲、欧洲、亚洲和澳大利亚进行。在总人口中,大多数受试者是白人(74%),其次是亚洲人(18%)、黑人(1.4%)和其他种族/民族团体(6%);58%是女性。
征集的不良反应:在研究1和2中,在受试者子集(n = 4,886接受SHINGRIX,n = 4,881接受至少1个记录剂量的安慰剂)中,在每次接种疫苗或安慰剂后的7天内(即接种当天和接下来的6天),使用标准化日记卡收集了关于征集的局部和全身不良反应的数据。在这两项研究中,报告在接种SHINGRIX(两种剂量合并)后出现局部和全身不良反应的50岁及以上受试者的百分比分别为疼痛(78%)、发红(38%)和肿胀(26%);以及肌痛(45%)、疲劳(45%)、头痛(38%)、发抖(27%)、发烧(21%)和胃肠道症状(17%)。
表1列出了2项研究中按年龄组划分的特定请求局部不良反应和一般不良反应的报告频率(每个受试者的总体频率)。
表1. 50至59岁、60至69岁和70岁及以上b的成年人接种疫苗后7天内a 出现局部和全身不良反应的受试者百分比(有7天日记卡的已接种队列总数)
| 不良反应 | 50-59岁 | 60-69岁 | 年龄≥70岁 | |||
| SHINGRIX | 安慰剂c | SHINGRIX | 安慰剂c | SHINGRIX | 安慰剂c | |
| 局部不良反应 | n = 1,315 % | n = 1,312 % | n = 1,311 % | n = 1,305 % | n = 2,258 % | n = 2,263 % |
| 疼痛 | 88 | 14 | 83 | 11 | 69 | 9 |
| 疼痛,3级d | 10 | 1 | 7 | 1 | 4 | 0.2 |
| 红色 | 39 | 1 | 38 | 2 | 38 | 1 |
| 发红度>100毫米 | 3 | 0 | 3 | 0 | 3 | 0 |
| 肿胀 | 31 | 1 | 27 | 1 | 23 | 1 |
| 肿胀,>100毫米 | 1 | 0 | 1 | 0 | 1 | 0 |
| 一般不良反应 | n = 1,315 % | n = 1,312 % | n = 1,309 % | n = 1,305 % | n = 2,252 % | n = 2,264 % |
| 肌痛 | 57 | 15 | 49 | 11 | 35 | 10 |
| 肌痛,3级e | 9 | 1 | 5 | 1 | 3 | 0.4 |
| 乏力 | 57 | 20 | 46 | 17 | 37 | 14 |
| 疲劳,3级e | 9 | 2 | 5 | 1 | 4 | 1 |
| 头痛 | 51 | 22 | 40 | 16 | 29 | 12 |
| 头痛,3级e | 6 | 2 | 4 | 0.2 | 2 | 0.4 |
| 颤抖 | 36 | 7 | 30 | 6 | 20 | 5 |
| 颤抖,3级e | 7 | 0.2 | 5 | 0.3 | 2 | 0.3 |
| 发烧 | 28 | 3 | 24 | 3 | 14 | 3 |
| 发烧,3级f | 0.4 | 0.2 | 1 | 0.2 | 0.1 | 0.1 |
| GIg | 24 | 11 | 17 | 9 | 14 | 8 |
| GI,3级e | 2 | 1 | 1 | 1 | 1 | 0.4 |
安全性接种疫苗的总队列包括至少接种了1剂疫苗的所有受试者。
a 7天包括疫苗接种日和随后的6天。
b50至59岁和60至69岁受试者的数据基于研究1。70岁及以上受试者的数据基于研究1的汇总数据:NCT01165177和研究2:NCT01165229。
c安慰剂是一种生理盐水。
d . 3级疼痛:定义为休息时明显疼痛;妨碍正常的日常活动。
e . 3级肌痛、疲劳、头痛、颤抖和胃肠:定义为妨碍正常活动。
f .发烧定义为口腔、腋窝或鼓室途径≥37.5℃/99.5℉,直肠途径≥38℃/100.4℉;3级发烧定义为>39.0℃/102.2℉。
g GI =胃肠道症状,包括恶心、呕吐、腹泻和/或腹痛。
与50至69岁的受试者相比,70岁及以上受试者的局部和全身反应发生率较低。
在SHINGRIX中观察到的局部和全身不良反应的中位持续时间为2至3天。
在剂量1和剂量2之间,报告任何或3级请求局部反应的受试者比例没有差异。与剂量1(分别为24%和14%)相比,剂量2后受试者报告头痛和寒战的频率更高(分别为28%和21%)。与剂量1相比(分别为1.4%、1.4%、2.3%和2.4%),剂量2后受试者报告的3级不良反应(头痛、颤抖、肌痛和疲劳)更频繁。
主动不良事件:所有受试者在日记卡上记录了每次接种后30天内(第0天至第29天)发生的主动不良事件。在这两项研究中,在接受SHINGRIX(n = 14,645)或安慰剂(n = 14,660)的受试者中,分别有51%和32%的受试者在接种疫苗后30天内报告了主动不良事件(总接种队列)。在≥1%的SHINGRIX接受者中发生且发生率至少比安慰剂高1.5倍的不良事件包括寒战(4%对0.2%)、注射部位瘙痒(2.2%对0.2%)、不适(1.7%对0.3%)、关节痛(1.7%对1.2%)、恶心(1.4%对0。5 %)和头晕(1。2 %对0。8 %)。
在接种疫苗后30天内,接受SHINGRIX或安慰剂的受试者分别有0.18%(n = 27)和0.05%(n = 8)报告痛风(包括痛风性关节炎);现有信息不足以确定与SHINGRIX的因果关系。
严重不良事件(SAE):在这两项研究中,在接受SHINGRIX(2.3%)或安慰剂(2.2%)的受试者中,从首次给药到最后一次疫苗接种后30天内报告的SAE发生率相似。据报告,在首次给药至末次疫苗接种后1年内,接受SHINGRIX的受试者中有10.1%出现SAE,接受安慰剂的受试者中有10.4%出现SAE。一名受试者(<0.01%)报告了淋巴结炎,一名受试者(<0.01%)报告了大于39℃的发烧;与SHINGRIX有因果关系是有根据的。
接受SHINGRIX(均在疫苗接种后50天内)的3名受试者(0.02%)和接受安慰剂的0名受试者报告了视神经缺血性神经病;现有信息不足以确定与SHINGRIX的因果关系。
死亡人数:在这两项研究中,从首次给药到最后一次疫苗接种后30天,接受SHINGRIX的受试者中有0.04%死亡,接受安慰剂的受试者中有0.05%死亡。从第一次给药到最后一次疫苗接种后1年,据报告接受SHINGRIX的受试者中有0.8%死亡,接受安慰剂的受试者中有0.9%死亡。受试者的死亡原因与成人和老年人群中普遍报告的死亡原因一致。
潜在的免疫介导疾病:在这两项研究中,据报告,从首次给药至最后一次疫苗接种后1年内,0.6%的接受SHINGRIX的受试者和0.7%的接受安慰剂的受试者出现了新发潜在免疫介导疾病(pIMDs)或现有pIMDs恶化。在接受SHINGRIX治疗的组和安慰剂组中,最常报告的pIMDs发生频率相当。
剂量安排:在一项开放标签的临床研究中,238名50岁及以上的受试者接受了0-2个月或0-6个月的SHINGRIX方案。当按照0-2个月或0-6个月的时间表给药时,SHINGRIX的安全性相似,并与研究1和2中观察到的结果一致。
18岁及以上免疫力低下的成年人
SHINGRIX的安全性在6项安慰剂对照临床研究中进行了评估,这些研究招募了来自5个不同免疫缺陷或免疫抑制(称为免疫低下)人群的3116名18岁及以上受试者,其中共有1587人接受了SHINGRIX。在所有研究中,受试者间隔1至2个月接受第1剂和第2剂SHINGRIX。这些研究的安全性监测与研究1和2相似。此外,对受试者的特定疾病或状况相关事件进行监测。
在接受SHINGRIX或安慰剂时,人群的平均年龄为55岁;28%的受试者年龄在18至49岁之间,72%的受试者年龄在50岁及以上。每项研究都在以下一个或多个地区进行:北美、拉丁美洲、欧洲、亚洲、非洲和澳大利亚/新西兰。大多数受试者是白人(77%),其次是亚洲人(17%)、黑人(2%)和其他种族群体(3%);4%是美国西班牙裔或拉丁裔;37%是女性。
表2.SHINGRIX用于18岁以上免疫功能低下成人的临床研究
| 临床研究 | 接种疫苗的受试者人数 | 研究人群 | 安全性随访期 | |
| SHINGRIX | 安慰剂 | |||
| auHSCT (NCT01610414) | 922 | 924 | 自体造血干细胞移植受者a | 29个月的中位安全性随访b |
| 血液恶性肿瘤 (NCT01767467) | 283 | 279 | 恶性血液病c | 最后一次接种疫苗后12个月 |
| 肾移植(NCT02058589) | 132 | 132 | 肾移植受者e | 最后一次接种疫苗后12个月 |
| 实体恶性肿瘤 (NCT01798056) | 117 | 115 | 接受化疗的实体瘤f,g | 最后一次接种疫苗后12个月 |
| 艾滋病病毒 (NCT01165203) | 74 | 49 | 艾滋病毒感染者 | 最后一次接种疫苗后12个月 |
| auHSCT (NCT00920218) | 59 | 30 | 自体造血干细胞移植受者a | 最后一次接种疫苗后12个月 |
a自体造血干细胞移植后50至70天内注射第一剂。
b安全性随访由HZ病例累积驱动,范围从最后一次疫苗接种后至少12个月到受试者水平的4年。
c对于在癌症治疗过程中接种疫苗的受试者,每剂疫苗在接种和癌症治疗周期之间至少间隔10天给药。
d对于在完整的癌症治疗疗程后接受疫苗接种的受试者,第一剂疫苗在癌症治疗结束后10天至6个月内接种。
e .肾移植后4至18个月之间接种第一剂疫苗。
f在预化疗组(TVC:SHINGRIX【n = 90】,安慰剂【n = 91】),在化疗周期开始前最多1个月至最少10天给予第一剂,在化疗周期的第一天给予第二剂。
g在OnChemo组(TVC:SHINGRIX【n = 27】,安慰剂【n = 24】),每剂在化疗周期的第一天给药。
在auHSCT研究(NCT01610414)中,在接受SHINGRIX或安慰剂时,人群的平均年龄为55岁;25%的受试者年龄在18至49岁之间,75%的受试者年龄在50岁及以上。大多数受试者是白人(78%),其次是亚洲人(16%)、黑人(2%)和其他种族群体(3%);3%是美国西班牙裔或拉丁裔;37%是女性。
征集的不良反应:auHSCT受者(年龄在18至49岁之间且≥50岁)在接种SHINGRIX(两种剂量合并)后7天内报告的征集到的局部不良反应包括疼痛(88%和83%)、发红(30%和35%)和肿胀(21%和18%)。auHSCT受者(年龄在18至49岁之间且≥50岁)在接种SHINGRIX(两种剂量合并)后7天内报告的征集到的一般不良反应包括疲劳(64%和54%)、肌痛(58%和52%)、头痛(44%和30%)、胃肠道症状(21%和28%)、颤抖(31%和25%)和发烧(2在auHSCT研究(NCT01610414)中,18岁及以上受试者报告在接种每剂SHINGRIX或安慰剂后出现局部和全身不良反应的百分比如表3所示。
表3.成人自体造血干细胞移植受者(NCT 01610414):18至49岁和50岁及以上人群成人接种疫苗后7天内a出现局部和全身不良反应的受试者百分比(接种人群总数)
| 不良反应 | 18-49岁 | 年龄≥50岁 | ||||||
| SHINGRIX | 安慰剂b | SHINGRIX | 安慰剂b | |||||
| 剂量1 | 剂量2 | 剂量1 | 剂量2 | 剂量1 | 剂量2 | 剂量1 | 剂量2 | |
| 局部不良反应 | n =223 % | n = 205 % | n = 217 % | n = 207 % | n = 673 % | n = 635 % | n = 673 % | n = 627 % |
| 疼痛 | 81 | 82 | 8 | 6 | 75 | 74 | 6 | 5 |
| 疼痛,3级c | 11 | 11 | 1 | 0 | 5 | 7 | 0.3 | 0 |
| 红色 | 20 | 25 | 0 | 0 | 21 | 28 | 1 | 1 |
| 发红,>100毫米 | 1 | 2 | 0 | 0 | 1 | 3 | 0 | 0 |
| 肿胀 | 14 | 17 | 0 | 0 | 10 | 15 | 1 | 1 |
| 肿胀,>100毫米 | 0 | 2 | 0 | 0 | 0.1 | 1 | 0 | 0 |
| 一般不良反应 | n = 222 % | n = 203 % | n = 218 % | n = 207 % | n = 674 % | n = 633 % | n = 674 % | n = 628 % |
| 肌痛 | 41 | 51 | 22 | 21 | 37 | 43 | 18 | 17 |
| 肌痛,3级d | 4 | 8 | 2 | 2 | 2 | 4 | 1 | 1 |
| 乏力 | 49 | 51 | 34 | 25 | 37 | 46 | 31 | 26 |
| 3级疲劳d | 6 | 10 | 1 | 2 | 3 | 4 | 2 | 3 |
| 头痛 | 23 | 38 | 17 | 17 | 15 | 25 | 13 | 8 |
| 3d级头痛 | 1 | 5 | 0 | 2 | 0.1 | 2 | 0.4 | 1 |
| 颤抖 | 20 | 26 | 12 | 6 | 11 | 21 | 7 | 7 |
| 颤抖,3级d | 1 | 6 | 0 | 0 | 0.4 | 3 | 1 | 0.2 |
| 发烧,≥37.5℃/99.5℉ | 9 | 28 | 4 | 2 | 6 | 15 | 3 | 4 |
| 发烧,3级>39.5℃/103.1℉ | 0 | 1 | 0 | 0 | 0.1 | 0.2 | 0 | 0.2 |
| GIe | 14 | 13 | 13 | 12 | 18 | 18 | 16 | 12 |
| GI,3级d | 1 | 1 | 0 | 1 | 1 | 2 | 1 | 2 |
安全性方面,接种疫苗的总队列(TVC)包括至少接种了1剂疫苗的所有受试者。
% =至少报告一次症状的受试者百分比。
a 7天包括疫苗接种日和随后的6天。
b安慰剂是用盐水溶液重新配制的蔗糖。
c . 3级疼痛:定义为休息时妨碍正常日常活动的明显疼痛。
d . 3级肌痛、疲劳、头痛、颤抖和胃肠:定义为妨碍正常活动。
e GI =胃肠道症状,包括恶心、呕吐、腹泻和/或腹痛。
总的来说,在免疫功能低下人群中进行的其他研究中报告的局部和全身不良反应的频率与auHSCT研究中的频率相似(NCT01610414)。在所有招募免疫缺陷受试者的研究中,SHINGRIX的局部和全身不良反应的中位持续时间为1至3天。
主动不良事件:在纳入免疫功能低下受试者的所有6项研究中,接受SHINGRIX或安慰剂的受试者中分别有46%和44%报告了每次接种后30天内发生的主动不良事件,包括严重和非严重事件。在SHINGRIX的接受者中,关节痛、感染性肺炎和流感样疾病的不良事件发生率≥1%,至少是安慰剂的1.5倍(分别为1.5%比1.0%、1.5%比0.9%和1.3%比0.6%)。
严重不良事件:在纳入免疫功能低下受试者的所有6项研究中,从首次给药至最后一次疫苗接种后30天内接受SHINGRIX(7%)或安慰剂(8%)的受试者报告的SAE发生率相似。据报告,在首次给药至末次疫苗接种后1年内,接受SHINGRIX的受试者中有26%出现SAE,接受安慰剂的受试者中有27%出现SAE。在最后一次疫苗接种后30天内,有21名接受SHINGRIX疫苗的受试者(1.3%)和11名接受安慰剂的受试者(0.7%)报告了感染性肺炎的SAE。现有信息不足以确定与疫苗接种的因果关系。
死亡人数:在纳入免疫功能低下受试者的所有6项研究中,从首次给药到最后一次疫苗接种后30天,有2名接受SHINGRIX的受试者(0.1%)和7名接受安慰剂的受试者(0.5%)报告死亡。从第一次给药到最后一次疫苗接种后1年,接受SHINGRIX的受试者中有6%和接受安慰剂的受试者中有6%报告了死亡。受试者的死亡原因与评估人群的预期一致。
潜在的免疫介导疾病:在纳入免疫功能低下受试者的所有6项研究中,据报告,从首次给药至最后一次疫苗接种后1年内,1.3%的接受SHINGRIX的受试者和1.0%的接受安慰剂的受试者出现新发pIMDs或现有pIMDs恶化。治疗组之间的特定pIMDs没有明显的不平衡。
其他医学相关事件:在auHSCT研究(NCT01610414)中,从第一次接种疫苗到研究结束,接受至少一剂SHINGRIX的922名受试者中有315名(34%)和接受安慰剂的924名受试者中有331名(36%)报告了复发或进展。
在auHSCT研究(NCT00920218)中,从第一次接种疫苗到研究结束,接受至少一剂SHINGRIX的59名受试者中有17名(29%)和接受安慰剂的30名受试者中有8名(27%)报告了复发或进展。
在血液恶性肿瘤研究中,从首次接种疫苗到研究结束,283名接受至少一剂SHINGRIX的受试者中有45名(16%)和279名接受安慰剂的受试者中有58名(21%)报告了复发或进展。
在肾移植研究中,从第一次接种疫苗到研究结束(大约13个月后),接受SHINGRIX的132名受试者中有4名(3%)报告了活检证实的同种异体移植排斥反应,接受安慰剂的132名受试者中有7名(5%)报告了这种排斥反应。肌酐作为移植物功能的指标和疫苗接种后同种免疫的变化没有得到系统评估。
在HIV研究中,从第一次接种疫苗到研究结束,74名接受SHINGRIX疫苗的受试者中有9名(12%)和49名接受安慰剂的受试者中有5名(10%)报告了至少1起HIV病情恶化事件。
与23价肺炎球菌多糖疫苗同时给药
在一项针对50岁及以上受试者的开放性临床研究(NCT02045836)中,使用日记卡收集了7天(即接种当天和接下来的6天)的局部和全身不良反应信息。与单独给予第一剂SHINGRIX相比,在与第一剂SHINGRIX共同给予PNEUMOVAX 23时,报告发烧(定义为≥37.5℃/99.5℉)和颤抖(分别为16%和7%)的受试者比例更高【参见临床研究(14.7)】.
6.2上市后体验
在SHINGRIX的上市后使用过程中发现了以下不良反应。由于这些反应是由规模不确定的人群自愿报告的,因此并不总是能够可靠地估计其频率或建立与疫苗的因果关系。
全身疾病和给药部位条件
注射手臂的活动能力下降,可能持续1周或更长时间。
免疫系统疾病
过敏反应,包括血管性水肿、皮疹和荨麻疹。
神经系统疾病
格林-巴利综合征。
SHINGRIX疫苗接种后格林巴利综合征风险的上市后观察研究
在65岁或以上的医疗保险受益人中评估了接种新冠疫苗和GBS疫苗之间的关系。使用医疗保险索赔数据,从2017年10月到2020年2月,通过国家药品代码识别受益人中的SHINGRIX疫苗接种,并通过国际疾病分类代码识别SHINGRIX接受者中的潜在住院GBS病例。
使用接种后1至42天的风险窗口和接种后43至183天的控制窗口,在自身对照病例系列分析中评估了接种新冠疫苗后GBS的风险。主要分析(基于索赔的所有剂量)发现,在接种SHINGRIX疫苗后的42天内,GBS风险增加,估计65岁或以上的成年人每百万剂中有3例GBS病例超标。在二次分析中,在第一剂SHINGRIX后的42天内观察到GBS风险增加,估计65岁或以上的成年人每百万剂中有6例GBS过量病例,在第二剂SHINGRIX后没有观察到GBS风险增加。对索赔数据中GBS诊断的这些分析得到了病历审查确认的GBS病例分析的支持。虽然这项观察性研究的结果表明GBS与SHINGRIX之间存在因果关系,但现有证据不足以建立因果关系。
8在特定人群中使用
8.1怀孕
风险总结
所有怀孕都有出生缺陷、流产或其他不良后果的风险。在美国普通人群中,临床认可的妊娠中主要出生缺陷和流产的估计背景风险分别为2%至4%和15%至20%。数据不足以确定孕妇中是否存在与SHINGRIX疫苗相关的风险。
在交配前、妊娠期和哺乳期单独给予SHINGRIX或AS01B佐剂的雌性大鼠中进行了发育毒性研究。每次总剂量为0.2毫升(SHINGRIX的单次人体剂量为0.5毫升)。这项研究表明,SHINGRIX对胎儿或断奶前发育没有不良影响(见数据).
数据
动物数据:在一项发育毒性研究中,雌性大鼠在交配前28天和14天、妊娠第3天、第8天、第11天和第15天以及哺乳第7天通过肌肉注射单独给予SHINGRIX或AS01B佐剂。每次总剂量为0.2毫升(SHINGRIX的单次人体剂量为0.5毫升)。未观察到对断奶前至产后第25天发育的不利影响。没有与疫苗相关的胎儿畸形或变化。
8.2哺乳
风险总结
尚不清楚SHINGRIX是否会在人乳中排泄。尚无数据可用于评估SHINGRIX对母乳喂养婴儿或乳汁生产/排泄的影响。
母乳喂养的发育和健康益处应与母亲对SHINGRIX的临床需求以及SHINGRIX或潜在母体疾病对母乳喂养的孩子的任何潜在不良影响一起考虑。对于预防性疫苗来说,潜在的母体状况是对疫苗预防的疾病的易感性。
8.4儿科使用
尚未确定对18岁以下个体的安全性和有效性。SHINGRIX不适用于预防原发性水痘感染(水痘)。
8.5老年用药
60岁及以上的成年人
在研究1和2中接受至少1剂SHINGRIX的受试者总数中(n = 14,645),其中2,243人(15%)年龄在60至69岁之间,6,837人(47%)年龄在70至79岁之间,1,921人(13%)年龄在80岁及以上。各年龄组之间的疗效没有临床意义上的差异。【参见临床研究(14.1、14.2、14.3)。]
70岁及以上受试者出现局部和全身不良反应的频率低于年轻人(50至69岁)。【参见不良反应(6.1)。]
65岁及以上免疫功能低下的成年人
在auHSCT研究中接受至少1剂SHINGRIX的受试者总数(n = 922)中,172名(18.7%)年龄在65岁及以上【参见临床研究(14.5)】。这些受试者与年轻人(18至64岁)之间的疗效没有临床意义上的差异。
在6项研究中接受至少1剂SHINGRIX的受试者总数中在免疫功能低下的受试者(n = 1,587)中,337例(21.2%)年龄在65岁及以上。65岁及以上受试者出现局部和全身不良反应的频率通常与年轻人(18至64岁)报告的频率相似或更低。
11描述
SHINGRIX(重组带状疱疹疫苗,含佐剂)是一种用于肌肉注射的无菌混悬液。该疫苗以冻干重组水痘带状疱疹病毒小瓶的形式提供表面糖蛋白E(gE)抗原成分,使用时必须与随附的AS01B佐剂混悬剂成分小瓶一起复溶。冻干的gE抗原成分以无菌白色粉末的形式存在。AS01B佐剂混悬剂是一种乳白色、无色至淡褐色液体,装在小瓶中。gE抗原是通过在含有氨基酸、不含白蛋白、抗生素或动物源性蛋白质的培养基中培养携带截短的gE基因的基因工程中国仓鼠卵巢细胞获得的。gE蛋白通过几个色谱步骤纯化,与赋形剂一起配制,装入小瓶并冻干。
佐剂混悬组分是AS01B,由3-组成O-去酰基-4’-单磷酰基脂质A(MPL)来自明尼苏达沙门氏菌和QS-21,一种从植物提取物中纯化的皂苷皂树莫利纳,结合在一个脂质体配方。脂质体由二油酰磷脂酰胆碱(DOPC)和胆固醇在含有无水磷酸二钠、磷酸二氢钾、氯化钠和注射用水的磷酸盐缓冲盐水溶液中组成。
复溶后,每0.5毫升剂量被配制成含有50微克重组gE抗原、50微克MPL和50微克QS-21。每剂还含有20毫克蔗糖(作为稳定剂)、4.385毫克氯化钠、1毫克DOPC、0.54毫克磷酸二氢钾、0.25毫克胆固醇、0.160毫克磷酸二氢钠二水合物、0.15毫克无水磷酸二钠、0.116毫克磷酸二钾和0.08毫克聚山梨醇酯80。复溶后,SHINGRIX是一种无菌、乳白色、无色至浅棕色液体。
SHINGRIX不含防腐剂。每剂还可能含有制造过程中残留的宿主细胞蛋白质(≤3.0%)和DNA(≤2.1皮克)。瓶塞不是由天然橡胶乳胶制成的。
12临床药理学
12.1作用机制
患带状疱疹的风险随着年龄的增长以及疾病和/或治疗引起的免疫抑制而增加,似乎与水痘带状疱疹病毒(VZV)特异性免疫力下降有关。SHINGRIX被证明可以增强VZV特异性免疫反应,这被认为是其预防带状疱疹疾病的机制【参见临床研究(14)】.
13非临床毒理学
13.1致癌、诱变、生育能力受损
尚未对SHINGRIX的致癌性或致突变性进行评估。对雌性大鼠接种SHINGRIX疫苗对生育能力没有影响【参见特定人群的使用(8.1)】。在一项男性生育力研究中,大鼠接种了0.1毫升SHINGRIX疫苗(单次人体剂量为0.5毫升)在交配前的第42天、第28天和第14天。对男性生育能力没有影响。
14临床研究
14.1 50岁及以上受试者的疗效
研究1是一项在18个国家开展的随机、安慰剂对照、观察者盲法临床研究。随机分组按年龄分层(8:5:3:1):50至59岁、60至69岁、70至79岁和≥80岁。该研究排除了免疫功能低下、既往有HZ病史、接种过水痘或HZ疫苗的受试者,以及预计至少不能存活4年或患有可能干扰研究评估的疾病的患者。受试者接受了中位时间为3.1年(范围:0至3.7年)的带状疱疹和带状疱疹后神经痛(PHN)的随访。对疑似HZ病例进行前瞻性随访,以了解PHN的发展情况,这是一种HZ相关并发症,定义为HZ相关疼痛(研究受试者在0-10分范围内将其评定为3级或以上),在确诊的HZ病例中出现皮疹后至少持续90天。
主要疗效分析人群(称为修正的总疫苗接种队列【mTVC】)包括14,759名年龄在50岁及以上的受试者,他们接种了2剂疫苗(0剂和2剂)SHINGRIX(n = 7,344)或安慰剂(n = 7,415)治疗10个月,并且在第二剂治疗后1个月内未出现确诊病例。在mTVC人群中,61%为女性;72%为白人,19%为亚洲人,1.7%为黑人,7%为其他种族/民族。受试者的平均年龄为62.3岁。
确诊的HZ病例由聚合酶链反应(PCR)(89.4%)或临床评估委员会(10.6%)确定。
对带状疱疹的疗效
与安慰剂相比,在50岁及以上的受试者中,SHINGRIX使患HZ的风险显著降低了97.2%(95% CI:93.7,99.0)(表4)。
表4.与安慰剂相比,SHINGRIX对以下人群带状疱疹发病率的疗效 研究1a(mTVCb)
| 年龄组(岁) | SHINGRIX | 安慰剂 | 功效百分比 (95% CI) | ||||
| N | n | 带疱发病率/千人/年 | N | n | 带疱发病率/千人/年 | ||
| 总体(≥50)c | 7,344 | 6 | 0.3 | 7,415 | 210 | 9.1 | 97.2 (93.7, 99.0) |
| 50-59 | 3,492 | 3 | 0.3 | 3,525 | 87 | 7.8 | 96.6 (89.6, 99.3) |
| 60-69 | 2, 141 | 2 | 0.3 | 2, 166 | 75 | 10.8 | 97.4 (90.1, 99.7) |
| ≥70 | 1,711 | 1 | 0.2 | 1,724 | 48 | 9.4 | 97.9 (87.9, 100.0) |
N =每组中包括的受试者人数;n =至少有1次确诊带状疱疹发作的受试者人数;HZ =带状疱疹;CI =置信区间。
a研究1: NCT01165177。
b mTVC =修正的总疫苗接种队列,定义为接受2剂(0和2个月)SHINGRIX或安慰剂且在第二剂后1个月内未出现确诊病例的受试者。
c主要研究终点基于50岁及以上受试者中确诊的HZ病例。
在一项描述性分析中,在接种疫苗后第四年,50岁及以上受试者中针对HZ的疫苗有效性为93.1%(95% CI:81.3,98.2)。
带状疱疹后神经痛的发生
在mTVC中所有50岁或以上的受试者中,疫苗组没有报告PHN病例,而安慰剂组报告了18例病例。
14.2 70岁及以上受试者的疗效
研究2是一项在18个国家开展的随机、安慰剂对照、观察者盲法临床研究。随机分组按年龄分层(3:1 ): 70至79岁和≥80岁。除年龄外,研究排除标准与研究1相同。受试者接受了中位时间为3.9年(范围:0至4.5年)的HZ和PHN发展随访。与研究1一样,对疑似HZ病例进行前瞻性随访,以了解PHN的发展情况。
主要疗效分析人群(mTVC)包括13,163名年龄为70岁的受试者接受2剂(0和2个月)SHINGRIX(n = 6,541)或安慰剂(n = 6,622)且在第二剂后1个月内未出现HZ确诊病例的老年人。在mTVC人群中,55%为女性;78%是白人,17%是亚洲人,1%是黑人,4%是其他种族/民族。受试者的平均年龄为75.5岁。
确诊的HZ病例通过PCR(92.3%)或临床评估确定委员会(7.7%)。
对带状疱疹的疗效
表5显示了70岁及以上受试者中针对HZ的疫苗效力结果。
表5.与安慰剂相比,SHINGRIX对以下人群带状疱疹发病率的疗效 研究2a(mTVCb)
| 年龄组(岁) | SHINGRIX | 安慰剂 | 功效百分比 (95% CI) | ||||
| N | n | 带疱发病率/千人/年 | N | n | 带疱发病率/千人/年 | ||
| 总体(≥70)c | 6,541 | 23 | 0.9 | 6,622 | 223 | 9.2 | 89.8 (84.3, 93.7) |
| 70-79 | 5,114 | 17 | 0.9 | 5,189 | 169 | 8.8 | 90.0 (83.5, 94.3) |
| ≥80 | 1,427 | 6 | 1.2 | 1,433 | 54 | 11.0 | 89.1 (74.7, 96.2) |
N =每组中包括的受试者人数;n =至少有1次确诊带状疱疹发作的受试者人数;HZ =带状疱疹;CI =置信区间。
a研究2: NCT01165229。
b mTVC =修正的总疫苗接种队列,定义为接受2剂(0和2个月)SHINGRIX或安慰剂且在第二剂后1个月内未出现确诊病例的受试者。
c主要研究终点基于70岁及以上受试者的确诊HZ病例。
在一项描述性分析中,在70岁及以上受试者中,疫苗接种后第四年针对HZ的疫苗有效性为85.1%(95% CI:64.5,94.8)。
对带状疱疹后神经痛的疗效
在mTVC中所有70岁或以上的受试者中,疫苗组报告了4例PHN,而安慰剂组报告了28例。针对PHN病毒的疫苗有效性为85.5%(95% CI:【58.5;96.3]).SHINGRIX在预防PHN方面的益处可归因于该疫苗对预防带状疱疹的效果。
减少止痛药的使用
在确诊为HZ的受试者中,接受SHINGRIX治疗的23名受试者中有10名(43.5%)和接受安慰剂治疗的223名受试者中有160名(71.7%)报告使用了HZ相关止痛药。
14.3研究1和研究2的汇总疗效分析
SHINGRIX在70岁及以上受试者中预防带状疱疹和PHN的功效为
通过在mTVC中预先指定的混合分析,结合研究1和2的结果进行评估。总共有8,250名和8,346名分别接受SHINGRIX和安慰剂的受试者被纳入合并的mTVC分析。
对带状疱疹的疗效
与安慰剂相比,在70岁及以上的受试者中,SHINGRIX使患HZ的风险显著降低了91.3%(95% CI:86.9,94.5)(表6)。
表6.与安慰剂相比,SHINGRIX对以下人群带状疱疹发病率的疗效研究1和2(汇总数据a)(mTVCb)
| 年龄组(岁) | SHINGRIX | 安慰剂 | 功效百分比 (95% CI) | ||||
| N | n | 带疱发病率/千人/年 | N | n | 带疱发病率/千人/年 | ||
| 总体(≥70)c | 8,250 | 25 | 0.8 | 8,346 | 284 | 9.3 | 91.3 (86.9, 94.5) |
| 70-79 | 6,468 | 19 | 0.8 | 6,554 | 216 | 8.9 | 91.3 (86.0, 94.9) |
| ≥80 | 1,782 | 6 | 1.0 | 1,792 | 68 | 11.1 | 91.4 (80.2, 96.9) |
N =每组中包括的受试者人数;n =至少有1次确诊带状疱疹发作的受试者人数;HZ =带状疱疹;CI =置信区间。
a研究1的汇总数据:NCT01165177(受试者≥50岁)和研究2的汇总数据:NCT01165229(受试者≥70岁)。
b mTVC =修正的总疫苗接种队列,定义为接受2剂(0和2个月)SHINGRIX或安慰剂且在第二剂后1个月内未出现确诊病例的受试者。
c合并分析的主要终点是基于70岁及以上的确诊HZ病例。
对带状疱疹后神经痛的疗效
表7比较了两项研究中疫苗组和安慰剂组的PHN总体发生率。
表7.SHINGRIX对带状疱疹后神经痛总发病率的疗效比较 研究1和2中的安慰剂(合并数据a)(mTVCb)
| 年龄组(岁) | SHINGRIX | 安慰剂 | 功效百分比(95% CI) | ||||
| N | n | PHNc发病率/千人/年 | N | n | PHN发病率/千人/年 | ||
| 总体(≥70) | 8,250 | 4 | 0.1 | 8,346 | 36 | 1.2 | 88.8 (68.7, 97.1) |
| 70-79 | 6,468 | 2 | 0.1 | 6,554 | 29 | 1.2 | 93.0 (72.5, 99.2) |
| ≥80 | 1,782 | 2 | 0.3 | 1,792 | 7 | 1.1 | 71.2 (-51.5, 97.1) |
N =每组中包括的受试者人数;n =具有至少1个PHN的受试者人数;CI =置信区间。
a研究1的汇总数据:NCT01165177(受试者≥50岁)和研究2的汇总数据:NCT01165229(受试者≥70岁)。
b mTVC =修正的总疫苗接种队列,定义为接受2剂(0和2个月)SHINGRIX或安慰剂且在第二剂后1个月内未出现确诊病例的受试者。
c PHN =带状疱疹后神经痛,定义为使用带状疱疹简要疼痛调查表在皮疹发作后至少90天内出现或持续3级或以上(0-10级)的带状疱疹相关疼痛。
SHINGRIX在预防PHN方面的益处可归因于该疫苗对预防带状疱疹的效果。尚无法证明SHINGRIX在预防确诊HZ受试者的PHN方面的功效。
14.4支持给药方案的免疫学评估
一种针对HZ的免疫反应措施尚不清楚。通过抗gE酶联免疫吸附试验(gE ELISA)测量抗gE抗体水平,并用于支持给药方案。
在一项开放性临床研究中,238名50岁及以上的受试者接受了0-2个月或0-6个月的SHINGRIX治疗。基于第二剂后1个月的抗gE ELISA GMCs,证明了0和6个月方案与0和2个月方案相比的非劣效性。
14.5对18岁及以上免疫缺陷成人的疗效
在一项3期随机、安慰剂对照、观察者盲临床研究中评估了SHINGRIX的疗效,该研究针对年龄≥18岁的免疫缺陷成年人,这些人在第1剂前50至70天接受了auHSCT,并有望接受预防性抗病毒治疗
移植后≤6个月的治疗。在另一项随机、安慰剂对照、观察者盲法研究中计算了SHINGRIX的疗效,该研究针对在完成免疫抑制化疗期间或6个月内接受1剂SHINGRIX或安慰剂治疗的恶性血液病受试者。这些研究分别在以下地区进行:北美、拉丁美洲、欧洲、亚洲、非洲(仅限auHSCT研究)和澳大利亚/新西兰。
在18岁及以上受试者中的疗效:自体造血干细胞移植受者
在auHSCT研究中,对受试者进行了中位21个月(范围:0至49.4个月)的HZ和PHN发展随访。与研究1和2一样,对疑似HZ病例进行前瞻性随访,以了解PHN的发展情况。
auHSCT研究的主要疗效分析人群(mTVC)包括1,721名受试者,他们接受了2剂SHINGRIX或安慰剂,并且在第二剂后1个月内没有出现确诊的HZ病例。确诊的HZ病例由PCR(83.7%)或临床评估委员会(16.3%)确定。
对带状疱疹的疗效:与安慰剂相比,SHINGRIX显著降低了18岁及以上auHSCT受者发生HZ的风险(表8)。
表8.与安慰剂相比,SHINGRIX对年龄≥18岁的免疫功能低下成年人带状疱疹发病率的疗效(mTVCa)
| 临床研究 | 年龄组(岁) | SHINGRIX | 安慰剂 | 功效百分比(95% CI) | ||||
| N | n | 带疱发病率/千人/年 | N | n | 带疱发病率/千人/年 | |||
| auHSCTb | 总体(≥18)c | 870 | 49 | 30.0 | 851 | 135 | 94.3 | 68.2 (55.5, 77.6) |
| 18-49 | 213 | 9 | 21.5 | 212 | 29 | 76.0 | 71.8 (38.7, 88.3) | |
| ≥50 | 657 | 40 | 33.0 | 639 | 106 | 100.9 | 67.3 (52.6, 77.9) | |
auHSCT =自体造血干细胞移植。
N =每组中包括的受试者人数;n =至少有1次确诊带状疱疹发作的受试者人数;HZ =带状疱疹;CI =置信区间。
a mTVC =修正的总疫苗接种队列,定义为接受2剂(0和1至2个月)SHINGRIX或安慰剂且在第二剂后1个月内未出现确诊病例的受试者。在治疗复发时对随访进行审查。
b NCT01610414。
c主要研究终点基于年龄≥18岁的受试者中确诊的HZ病例。
对18岁及以上恶性血液病受试者的疗效
在血液恶性肿瘤的研究中,平均年龄为57岁。大多数受试者是白人(71%),其次是亚洲人(25%)、黑人(0.4%)和其他种族群体(4%);5%是美国西班牙裔或拉丁裔;41%是女性。受试者接受了中位时间为11.1个月(范围:0至15.6个月)的HZ发展随访。PHN未被评估为研究终点。
在恶性血液病研究中,进行事后疗效分析的人群包括515名受试者,他们接受了2剂SHINGRIX或安慰剂治疗,并且在第二剂治疗后1个月内未出现确诊病例。确诊的HZ病例由PCR(81.3%)或临床评估委员会(18.7%)确定。事后分析显示SHINGRIX为87.2%(95% CI【44.2;98.6】)有效对抗HZ的发展。在SHINGRIX组和安慰剂组中,每1000人年的HZ发生率分别为8.5和66.2。
auHSCT研究中评估的其他疗效终点
对带状疱疹后神经痛的疗效:在一项描述性分析中,包括mTVC中年龄≥18岁的所有受试者,疫苗组报告了1例PHN,而安慰剂组报告了9例。针对PHN病毒的疫苗有效性为89.3%(95% CI:【22.5;99.8]).SHINGRIX在预防PHN方面的益处可归因于该疫苗对预防带状疱疹的效果。
带状疱疹相关疼痛:患有疑似HZ的受试者以10分制对其“最严重”的HZ相关疼痛进行评级。在确诊HZ的受试者中,接受SHINGRIX治疗的49名受试者中有37名(75.5%)和接受安慰剂治疗的135名受试者中有120名(88.9%)将其“最严重”HZ相关疼痛评定为3级或更高。在这组受试者中,SHINGRIX和安慰剂接受者的“最严重”HZ相关疼痛的中位持续时间分别为14天和24天。
14.6接种ZOSTAVAX(带状疱疹活疫苗)后的再次接种
在一项开放性临床研究(NCT02581410)中,年龄在65岁及以上的受试者在研究登记前5年以上接种过ZOSTAVAX疫苗(n = 215)或从未接种过ZOSTAVAX疫苗(n = 215)的患者在第0个月和第2个月接种了1剂SHINGRIX疫苗。根据年龄(65至69岁、70至79岁和≥80岁)、性别、种族/民族和医疗状况(免疫介导的疾病、糖尿病、抑郁症、肺病或心脏病)的预定义变量,将从未接种过ZOSTAVAX疫苗的受试者与先前接种过ZOSTAVAX疫苗的受试者进行匹配。平均年龄为71岁;51%是女性。所有受试者都是白人,不是西班牙裔或拉丁裔。
先前接种过ZOSTAVAX疫苗的受试者在接种2剂SHINGRIX后1个月通过ELISA测得的抗gE抗体(Ab)浓度不劣于从未接种过ZOSTAVAX疫苗的受试者。从未接种过ZOSTAVAX疫苗的受试者与之前接种过ZOSTAVAX疫苗的受试者之间的抗gE Ab调整几何平均浓度(GMC)比值的95% CI(CI)的上限(UL)为1.17(成功标准<1.5)。没有证据表明之前接种过ZOSTAVAX的受试者对SHINGRIX的免疫反应受到干扰。
14.7与其他疫苗同时使用
与流感疫苗同时给药
在一项开放标签临床研究(NCT01954251)中,50岁及以上的受试者在以下时间分别接种了1剂SHINGRIX和四价流感疫苗(FLUARIX四价)第0个月和第2个月第1剂SHINGRIX(n = 413),或第0个月第1剂四价FLUARIX和第2个月和第4个月第1剂SHINGRIX(n = 415)。人口的平均年龄为63岁;52%是女性。大多数受试者是白人(92%),其次是亚洲人(6%)和黑人(2%);0.4%是美国西班牙裔或拉丁裔种族。没有证据表明对SHINGRIX或联合疫苗中所含任何抗原的免疫反应会受到干扰。
与肺炎疫苗23(多价肺炎球菌疫苗)同时给药
在一项开放性临床研究(NCT02045836)中,50岁及以上的受试者在第0个月接受1剂SHINGRIX和PNEUMOVAX 23,在第2个月接受1剂SHINGRIX(n = 432),或在第0个月接受1剂PNEUMOVAX 23,在第2个月和第4个月接受1剂SHINGRIX(n = 433)。人口的平均年龄为63岁;60%是女性。大多数受试者是白人(94%),其次是黑人(2%)、亚洲人(2%)和其他种族群体(2%);1%是美国西班牙裔或拉丁裔。
在施用第二剂SHINGRIX后1个月,通过ELISA测量基于抗gE抗体的对SHINGRIX的免疫反应。在施用单剂量肺炎球菌23后1个月,通过多重调理吞噬试验(MOPA)测量了对肺炎球菌23型中23种肺炎球菌血清型中12种的免疫反应。两种疫苗同时接种时,没有证据表明对SHINGRIX中所含抗原的免疫反应或对PNEUMOVAX 23中所含12种评估抗原的免疫反应有干扰。
与PREVNAR 13(肺炎球菌13价结合疫苗【白喉CRM197蛋白】)同时接种
在一项开放标签临床研究(NCT03439657)中,50岁及以上受试者在第0个月接受1剂SHINGRIX和PREVNAR 13,在第2个月接受1剂SHINGRIX(n = 449),或在第0个月接受1剂PREVNAR 13,在第2个月和第4个月接受1剂SHINGRIX(n = 463)。人口的平均年龄为63岁;60%是女性。大多数受试者是白人(98%),其次是黑人(2%);0.4%是美国西班牙裔或拉丁裔。
在施用第二剂SHINGRIX后1个月,通过ELISA测量基于抗gE抗体的对SHINGRIX的免疫反应。在施用单剂量PREVNAR 13后1个月,通过MOPA测量对PREVNAR 13中所含肺炎球菌血清型的免疫反应。当两种疫苗同时接种时,没有证据表明对SHINGRIX或PREVNAR 13中所含抗原的免疫反应受到干扰。
与BOOSTRIX(吸附破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗)同时给药
在一项开放标签临床研究(NCT02052596)中,年龄在50岁及以上的受试者在第0个月接受了1剂SHINGRIX和BOOSTRIX疫苗,并在第2个月接受了1剂SHINGRIX疫苗(n = 412合并给药组),或在第0个月接种1剂BOOSTRIX,在第2个月和第4个月接种1剂SHINGRIX(n = 418;顺序给药组)。人口的平均年龄为63岁;54%是女性。大多数受试者是白人(87%),
其次是黑人(11%),以及其他种族群体;2%是美国西班牙裔或拉丁裔。
在施用第二剂SHINGRIX后1个月,通过ELISA测量基于抗gE抗体的对SHINGRIX的免疫反应。在施用单剂量BOOSTRIX疫苗1个月后,测量对BOOSTRIX疫苗的免疫反应(抗D、抗T和百日咳抗原抗体)。伴随给药没有证据表明对SHINGRIX中所含抗原或BOOSTRIX中所含抗原的免疫反应产生干扰,但百日咳抗原之一(pertactin)除外,该抗原不符合非劣效性标准:抗pertactin抗体的调整后GMC比率(序贯给药组/伴随给药组)的95% CI为1.58(非劣效性标准<1.5)。对pertactin的免疫反应降低的临床意义尚不清楚。
16如何供应/储存和搬运
SHINGRIX以2种成分提供:单剂量瓶装冻干gE抗原成分(粉末)和单剂量瓶装佐剂悬浮液成分(液体)(包装中无注射器或针头)。
表9.SHINGRIX的产品包装剂型
| 包装 | 卡尔顿NDC数 | 成分 | |
| 佐剂悬浮液组分(液体) | 冻干gE抗原成分(粉末) | ||
| 一盒1剂的外盒 一外盒10剂 | 58160-819-12 58160-823-11 | 第1瓶,共2瓶 NDC 58160-829-01 10瓶 NDC 58160-829-03 | 第2瓶,共2瓶 NDC 58160-828-01 10瓶 NDC 58160-828-03 |
16.1复溶前的储存
佐剂悬浮液成分小瓶:在2至8℃(36至46℉)的温度下冷藏储存。保护小瓶免受光照。不要冻结。如果佐剂悬浮液已经冷冻,则丢弃。
冻干gE抗原成分小瓶:在2至8℃(36至46℉)下冷藏储存。保护小瓶免受光照。不要冻结。如果抗原成分已被冷冻,则丢弃。
16.2复溶后的储存
立即接种或在2至8℃(36至46℉)下冷藏储存最多
使用前6小时。
如果未在6小时内使用,丢弃重组疫苗。
不要冻结。如果疫苗已被冷冻,请丢弃。
17患者咨询信息
告知患者使用SHINGRIX进行免疫接种的潜在益处和风险,以及根据时间表完成2剂免疫接种系列的重要性。
告知患者与接种SHINGRIX暂时相关的潜在不良反应。
提供疫苗信息声明,可在美国疾病控制和预防中心网站(www.cdc.gov/vaccines)上免费获取。
BOOSTRIX和flu arix quadrative是GSK集团公司拥有或许可使用的商标。列出的其他品牌是其所有者拥有或许可使用的商标,不属于GSK公司集团所有或许可使用。这些品牌的制造商不隶属于GSK集团,也不认可该集团的公司或其产品。
制造商葛兰素史克生物制品公司比利时Rixensart美国许可证1617和
分发人葛兰素史克公司
北卡罗来纳州达勒姆,邮编27701
2023 GSK集团公司或其许可方。
SHX:7PI
Hits: 336
