| 药品信息 | |||
| 受理号: | CXSS1700035 | 药品名称: | 鼻喷冻干流感减毒活疫苗 |
| 药品类型: | 预防用生物制品 | 注册分类: | 6 |
| 承办日期: | 2018-05-07 | 公示日期: | 2022-04-28 |
| 企业名称: | 长春百克生物科技股份公司;长春百克生物科技股份公司 | ||
| 相关附件信息 | |||
| 附件1:鼻喷冻干流感减毒活疫苗(CXSS1700035)-申请上市技术审评报告.pdf | |||
| 附件2:鼻喷冻干流感减毒活疫苗(CXSS1700035)-说明书.pdf | |||
核准日期: 修订日期:
冻干鼻喷流感减毒活疫苗说明书
请仔细阅读说明书并在医师指导下使用
【药品名称】
通用名称:冻干鼻喷流感减毒活疫苗
英文名称:Influenza Vaccine ,Live ,Nasal,Freeze-dried
汉语拼音:Donggan Bipen Liugan Jiandu Huoyimiao
【成分和性状】
本品系用世界卫生组织(WHO)推荐的甲型和乙型流行性感冒(简称流感) 病毒制成的减毒株,分别接种SPF鸡胚,经培养、收获病毒液、纯化后,按比例 混合配制,加入适宜稳定剂冻干制成。为白色疏松体,复溶后为微乳白色液体,
| 无异物。 本品为鼻用制剂,鼻内喷雾给药。每剂(0.2ml)含有: | ||
| A/Brisbane/02/2018 (H1N1)pdm09-like重配减毒株 | 不低于6.9 | lg |
| EID50 | ||
| A/Kansas/14/2017 (H3N2)-like重配减毒株 | 不低于6.9 | lg |
| EID50 | ||
| B/Colorado/06/2017-like重配减毒株 | 不低于6.4 | lg |
| EID50 |
辅料:蔗糖、右旋糖酐70、海藻糖、谷氨酸钠、尿素、精氨酸、无水葡萄糖、 人血白蛋白。
疫苗稀释剂:吸入用无菌水。
【接种对象】
本品适用于3(36月龄)~17岁人群。
【作用与用途】
接种本疫苗后,可刺激机体产生抗流感病毒的免疫力,用于预防由疫苗相关 型别的流感病毒引起的流行性感冒。
【规格】
复溶后每瓶0.2 ml。每1次人用剂量为0.2 ml,含A(H1N1)型和A(H3N2) 型流感减毒活病毒滴度均应不低于6.9 lg EID50 ,B型流感减毒活病毒滴度应不低于 6.4 lg EID50。
【免疫程序和剂量】
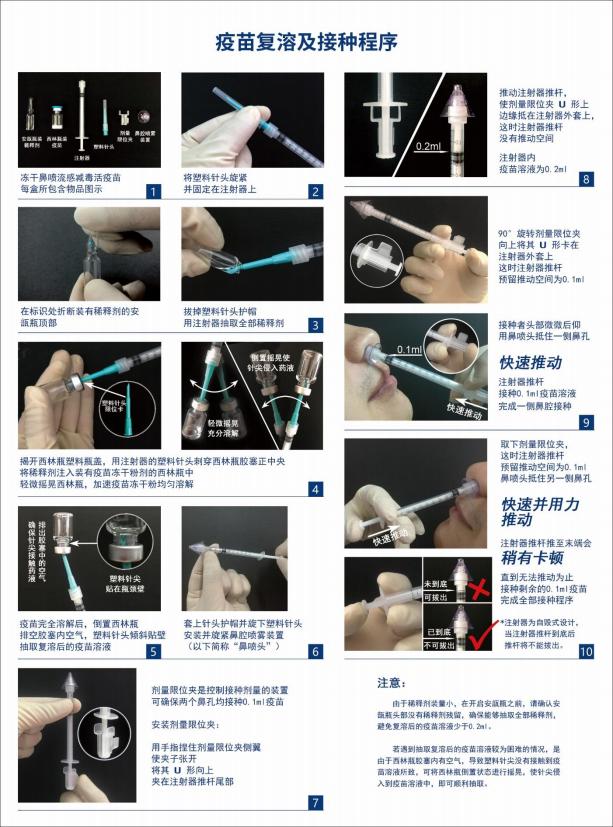
(1)按标示量加入疫苗稀释剂,待疫苗溶解并摇匀后使用。详见图示(附 后)。
(2)用注射器抽取至少0.2 ml复溶后疫苗,取下针头,安装鼻喷装置。
(3)受种者采取头部向后仰的坐姿,将鼻喷装置放置受种者鼻内约0.5 cm处 喷雾接种,每侧鼻孔内喷0.1ml。
(4)接种后,受种者应头部向后仰坐姿至少1分钟。
(5)建议于每年流感流行季节前进行预防接种,接种1剂次。
【不良反应】
本品在中国境内开展的Ⅲ期临床试验中,共有4500名3(36月龄)~17岁受 试者接种1剂本品。系统的安全性观察自疫苗接种开始至接种后30天,对全部受 试者的长期安全性观察自接种后31天至不低于6个月。
按照国际医学科学组织委员会(CIOMS)推荐的不良反应发生率的分类:十 分常见(≥10%),常见(≥1%和<10%),偶见(≥0.1%和<1%),罕见(≥ 0.01%和<0.1%),十分罕见(<0.01%),描述如下:
(1)本品临床试验
十分常见:发热(≥37.1℃)、流涕/鼻塞;
常见:咽痛、头痛、乏力或嗜睡、呕吐、食欲下降、咳嗽、上呼吸道感染、 肌肉痛、恶心、易激惹或烦躁;
偶见:变态反应、关节痛、鼻咽炎、寒颤。
(2)同类产品国外临床试验
除上述不良反应外,同类产品国外临床试验还观察到:喉痛、喉咙沙哑、咳 嗽、腹痛、中耳炎、打喷嚏、疲劳/虚弱、鼻充血、鼻窦炎、鼻腔不适, 嗅觉丧失, 红眼、面部肿胀、气喘等不良反应。
(3)同类产品国外上市后监测
参考国外同类产品上市后监测获得安全性数据(这些数据是由不确定的人群
自愿报告的,并不能有效地评估它们的发生率或确定与使用疫苗有关)汇总如下: 心血管系统:心包炎;
消化系统:恶心、呕吐、腹泻;
免疫系统:超敏反应(包括过敏性反应、面部水肿和荨麻疹);
神经系统:格林-巴利综合征,贝尔氏麻痹,脑膜炎,嗜伊红细胞脑膜炎,疫 苗相关脑炎;
呼吸系统:鼻出血; 皮肤系统:皮疹;
遗传性疾病:Leigh综合征症状的加重。
【禁忌】
(1)已知对本品所含任何成分,包括鸡蛋、辅料、硫酸庆大霉素过敏者。
(2)患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者。
(3)妊娠期妇女。
(4)使用阿司匹林或含阿司匹林药品治疗的Leigh综合征患者。
(5)免疫缺陷、免疫功能低下或正在接受免疫抑制治疗者。
(6)患未控制的癫痫和其他进行性神经系统疾病者,有格林-巴利综合征病 史者。
(7)鼻炎患者。
【注意事项】
(1)本品为鼻内喷雾接种,严禁注射!
(2)以下情况者慎用:家族和个人有惊厥史者、患慢性疾病者、有癫痫史 者、过敏体质者。
(3)国外同类产品显示哮喘患者(任何年龄)、活动性喘息或反复喘息发 作的儿童(5岁以下)接种后喘息发作的风险增高,本品国内临床试验没有此类 受试者的数据,建议慎用。
(4)开启疫苗瓶和接种时,切勿使消毒剂接触疫苗。
(5)疫苗瓶有裂纹、标签不清或失效者、疫苗复溶后出现浑浊等外观异常 者均不得使用。
(6)疫苗瓶开启后应立即使用,如需放置,应置2~8℃,并于30分钟内用
完,剩余均应废弃。
(7)应备有肾上腺素等药物,以备偶有发生严重过敏反应时急救用。接受 接种者在接种后应在现场观察至少30分钟。
(8)注射免疫球蛋白者应至少间隔3个月以上接种本疫苗,以免影响免疫效 果。
(9)使用其他减毒活疫苗与接种本疫苗应至少间隔1个月。
(10)接种后出现任何神经系统反应者,禁止再次使用。
(11)接种前48小时或接种后2周内使用抗流感药物可能影响本品保护效果。
(12)接种后2天内,最好不要使用任何其它鼻内给药制剂。
(13)严禁冻结。
【孕妇及哺乳期妇女用药】
目前尚未获得孕妇及哺乳期妇女使用本品的临床试验数据。
【药物相互作用】
如正在或近期曾使用过任何其它疫苗或药物,请告知医生。 使用免疫抑制剂可能会削弱机体的免疫应答。
【临床试验】
在中国境内一项完成的多中心、随机、双盲、安慰剂对照的Ⅲ期临床试验中, 共入组9000名3(36月龄)~17岁受试者,按照1:1比例随机接种1剂本品或1剂安 慰剂,随后观察接种本品14天后的保护效力。研究中通过信息平台收集受试者主 动报告的SAE和流感样病例(ILIs)。流感样病例定义:发热(腋温≥38℃), 伴有咳嗽或咽痛之一者。采集流感样病例7天内的鼻咽拭子样本进行rRT-PCR检 测,其中阳性者接种MDCK细胞分离病毒后将血凝滴度≥1:8的病毒培养收获物 采用血凝抑制试验(HI)进行检测。同时采用RT-PCR和基因测序方法对所有现 场初检rRT-PCR阳性者的鼻咽拭子样本和所有细胞培养收获物样本进行检测。研 究中实验室确认的流感病例定义:rRT-PCR检测阳性后经RT-PCR或病毒培养法 检测流感病毒阳性的具有流感样病例症状的病例。本研究保护效力主要终点为接 种1剂本品至少2周后预防实验室确诊的所有流感病例的保护效力。详见下表。
本品对所有实验室确认的流感病例的保护效力(PPS集)
| 试验组(N=4477) 病例数 发生率 | 安慰剂组(N=4482) | 保护效力 (%) | 95%CI(%) |
| 病例数 发生率 |
| (%) | (%) | |||
| rRT-PCR确诊(经RT-PCR确定分型)a | ||||
| 所有型别 62 1.38 97 | 2.16 | 36.0 | 12.2~53.3 | |
| A(H1N1)型 19 0.42 22 | 0.49 | 13.5 | -59.5~53.1 | |
| A(H3N2)型 41 0.92 75 | 1.67 | 45.3 | 20.1~62.5 | |
| B型 2 0.04 0 | 0.00 | – | – | |
| 红细胞凝集试验(HA)确诊(经RT-PCR分型)b | ||||
| 所有型别 35 0.76 60 | 1.34 | 41.6 | 11.6~61.4 | |
| A(H1N1)型 12 0.25 18 | 0.40 | 33.3 | -38.4~67.8 | |
| A(H3N2)型 21 0.47 42 | 0.94 | 49.9 | 15.6~70.3 | |
| B型 2 0.04 0 | 0.00 | – | – | |
| 红细胞凝集抑制试验(HI)确诊及分型c | ||||
| 所有型别 23 0.45 35 | 0.63 | 34.2 | -11.2~61.1 | |
| A(H1N1)疫苗相 似株 | 12 0.27 16 | 0.36 | 24.9 | -58.5~64.4 |
| A(H3N2)疫苗相 似株 | 3 0.07 12 | 0.27 | 75.0 | 11.4~92.9 |
| B型疫苗相似株 2 0.04 0 | 0.00 | – | – | |
| 非疫苗相似株 6 0.13 7 | 0.16 | 14.2 | -155.1~71.1 | |
a:经鼻咽拭子rRT-PCR检测阳性的病例,依据鼻咽拭子或细胞培养物RT-PCR分型;
b:鼻咽拭子rRT-PCR检测阳性后其细胞培养物经红细胞凝集试验检测HA≥1:8的病例, 依据鼻咽拭子或细胞培养物RT-PCR分型;
c:鼻咽拭子rRT-PCR检测阳性后其细胞培养物经红细胞凝集试验检测HA≥1:8且红细胞凝集抑制试验HI效价≥20的病例,通过HI进 行抗原性分析;
PPS集:保护效果评价符合方案集(Per Protocol Set ,PPS),包括所有符合入选/排除标准、进入随机化且完成疫苗接种的所有受试 者。
在以上试验中获得的安全性数据请参见【不良反应】。 【贮藏】 于2~8℃避光保存和运输。
【包装】 西林瓶,1瓶/人份 × 1人份/盒(附疫苗稀释剂1支、说明书1份、一次
性
 有效期】 10个月。
有效期】 10个月。
 执行标准】
执行标准】  批准文号】
批准文号】
 药品上市许可持有人】
药品上市许可持有人】
 位名称:长春百克生物科技股份公司
位名称:长春百克生物科技股份公司
 册地址:长春市高新开发区火炬路1260号
册地址:长春市高新开发区火炬路1260号  系电话:0431-87078417
系电话:0431-87078417
 生产企业】
生产企业】
5 / 7 装
置
套)。
企业名称:长春百克生物科技股份公司
生产地址:长春市高新开发区卓越大街138号
邮政编码:130103
电话号码:0431-81871541 400-8845-777
传真号码:0431-81871542
Hits: 836
