Contents
- 1 第23章:腮腺炎
- 1.1 疾病
- 1.2 疾病的历史和流行病学
- 1.3 MMR疫苗
- 1.4 储存
- 1.5 剂型
- 1.6 剂量和时间表
- 1.7 接种
- 1.8 处理
- 1.9 疫苗使用建议
- 1.10 十岁以下的儿童
- 1.11 十岁或十岁以上的儿童和成人
- 1.12 有未知或不完整疫苗接种史的个人
- 1.13 医护人员
- 1.14 禁忌症
- 1.15 预防措施
- 1.16 特发性血小板减少性紫癜
- 1.17 鸡蛋过敏
- 1.18 怀孕和母乳喂养
- 1.19 早产儿
- 1.20 免疫抑制和艾滋病毒
- 1.21 神经疾病
- 1.22 不良反应
- 1.23 常见事件
- 1.24 罕见和更严重的事件
- 1.25 接种含麻疹、腮腺炎和风疹的疫苗后报告的其他情况
- 1.26 病例、接触和暴发的管理
- 1.27 供应
- 1.28 参考
第23章:腮腺炎
2013年1月
须呈报
疾病
腮腺炎是一种由副粘病毒引起的急性病毒性疾病。通常表现为双侧腮腺肿胀,尽管也可能表现为单侧肿胀。腮腺炎之前可能有几天的非特异性症状,如发热、头痛、不适、肌痛和厌食。无症状腮腺炎感染很常见,尤其是在儿童中(Plotkin and Orenstein, 2004)。
腮腺炎通过空气传播或飞沫传播。潜伏期在17天左右,从14天到25天不等。腮腺炎患者在腮腺肿大前几天到肿大出现后几天都具有传染性。
腮腺炎病毒经常影响神经系统,可能有症状或无症状。多达15%的病例会出现脑膜炎症(头痛、畏光、颈部僵硬),并且经常在脑脊液中发现腮腺炎病毒。神经系统并发症,包括脑膜炎和脑炎,可能发生在腮腺炎之前或之后,也可能在没有腮腺炎时发生。
其他常见的并发症包括胰腺炎(4%)、卵巢炎(5%的青春期后女性)和睾丸炎(约25%的青春期后男性)(Falk et al., 1989; Plotkin and Orenstein, 2004; Philip et al., 1959)。双侧睾丸炎后的低生育力很少被报道(Bjorvatn et al., 1973;Dejucq and Jegou, 2001)。感音神经性耳聋(双侧或单侧)是流行性腮腺炎的一种众所周知的并发症,估计其发生率从3400例中有一例到20000例中有一例不等(Garty et al., 1988)。肾炎、关节病、心脏异常和罕见的死亡均有报道。
疾病的历史和流行病学
在1988年引入麻疹、流行性腮腺炎和风疹(MMR)疫苗之前,流行性腮腺炎通常发生在学龄儿童中,超过85%的成人有既往流行性腮腺炎感染的证据(Morgan Capner et al.,1988)。流行性腮腺炎是导致1200例住院的原因
并且是儿童病毒性脑膜炎的最常见原因(Galbraith et al., 1984; Communicable Disease Surveillance Centre, 1985)。
1988年10月,在引入MMR疫苗时,流行性腮腺炎被列为英国的法定传染病。MMR疫苗的高覆盖率导致了英国流行性腮腺炎传播的大幅减少,并且所有年龄组的发病率都下降了,包括那些年龄太大而无法免疫的人。从1989年起,临床诊断和实验室确认的腮腺炎病例报告大幅下降。1994年11月,为了防止预计的麻疹流行,5至16岁的儿童接种了麻疹-风疹疫苗。当时,MMR库存不足,无法为所有这些儿童接种腮腺炎疫苗。然而,这个年龄组的年轻成员不太可能暴露于腮腺炎感染,许多人在成年早期仍然易感。
1996年10月,引入了两剂MMR方案。在英国使用的单剂量含腮腺炎疫苗可提供61%至91%的腮腺炎保护作用(Plotkin and Orenstein, 2004)。因此,个人和群体保护都需要两个剂量。
在芬兰,1982年引入了两剂MMR方案;每剂药物的高覆盖率始终如一。自1994年以来,本土麻疹、腮腺炎和风疹已被消灭(Peltola et al., 1994)。美国于1989年引入了两剂方案,并于2000年宣布已经阻断了地方性传播(Plotkin and Orenstein,2004)。目前,包括欧盟、北美和澳大拉西亚在内的100多个国家例行提供MMR。
自1999年以来,确诊的腮腺炎病例大幅增加。这些病例中的大多数发生在青少年或年轻人中,他们在1988年引入MMR时年龄太大,无法提供MMR,或在1996年引入MMR时无法接受第二剂MMR。他们在童年时没有接触过自然流行性腮腺炎感染,因此仍然易感。2004年底,观察到临床诊断和确诊的流行性腮腺炎感染进一步增加。绝大多数确诊病例发生在1980年至1987年出生的人身上,疫情主要发生在高等教育机构。
最近受流行性腮腺炎感染的人群中的许多人认为他们过去曾接种过含流行性腮腺炎的疫苗。
然而,在1988年之前,英国没有针对流行性腮腺炎的常规免疫接种,1994年的运动使用了MR疫苗,因为没有足够数量的MMR疫苗。因此,年轻人可能接种了两剂含麻疹成分的疫苗和一剂风疹疫苗,但没有接种腮腺炎疫苗。其他人只接种了一剂MMR腮腺炎疫苗(见图23.1)。
MMR疫苗
MMR疫苗是冻干制剂,含有麻疹、腮腺炎和风疹病毒的减毒活毒株。将三种减毒病毒株在合适的培养基中分别培养,并在冻干前混合。这些疫苗包含以下成分:
Priorix®
每0.5毫升剂量的复溶疫苗含有:
不低于103.0Schwarz麻疹病毒的细胞培养感染剂量50 (CCID50)
不少于103.7 CCID50的RIT 4385腮腺炎病毒
不少于103.0 CCID50的Wistar RA 27/3风疹病毒株。
MMRVaxPRO®
每0.5毫升剂量在复溶时含有不少于相当于:
1000组织培养感染剂量50 (TCID50)的更减毒的麻疹病毒埃德蒙斯顿株恩德斯系
20,000 TCID50的腮腺炎病毒(Jeryl Lynn级毒株)
1000 TCID50的风疹病毒(Wistar RA 27/3株)。
MMR疫苗不含硫柳汞或任何其他防腐剂。该疫苗含有已经减毒(修饰)的活生物体。当需要预防麻疹、腮腺炎和/或风疹时,建议使用MMR。
储存
未配制的疫苗及其稀释液应储存在+2℃至+8℃的原包装中,并避光保存。所有疫苗在某种程度上都对冷热敏感。高温加速了大多数疫苗效力的下降,从而缩短了它们的保质期。除非储存在正确的温度下,否则无法保证疫苗的有效性。冷冻可能导致某些疫苗的反应原性增加和效力丧失。它还会在容器中产生细小的裂纹,导致内容物被污染。
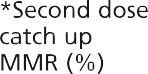 | ||||||||||||||||||||||||||
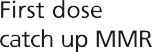 | ||||||||||||||||||||||||||
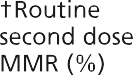 | ||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||
图23.1英国免疫规划中通过接种疫苗预防流行性腮腺炎的机会

![]()
疫苗应使用制造商提供的稀释剂复溶,并在一小时内使用或丢弃。
剂型
腮腺炎疫苗仅作为联合产品(MMR)的一部分提供。
Priorix以白色至淡粉色冻干疫苗颗粒的形式提供,用于与所提供的稀释剂复溶。必须充分摇动重组疫苗,直到颗粒完全溶解在稀释剂中。
MMRVaxPRO以冻干粉的形式提供,可与所提供的稀释剂复溶。必须轻轻摇动复溶疫苗,以确保充分混合。重组疫苗为黄色,只有在透明且无颗粒物质的情况下才能使用。
剂量和时间表
在推荐的时间间隔内接种两剂0.5毫升(见下文)。
接种
疫苗通常通过上臂或大腿前外侧肌肉注射。然而,对于患有出血性疾病的个体,应通过深层皮下注射来接种疫苗,以降低出血的风险。
MMR疫苗可与其他疫苗同时接种,如DTaP/ IPV、Hib/MenC、PCV和乙型肝炎疫苗。疫苗应在单独的部位接种,最好是在不同的肢体。如果给药在同一个肢体,它们应该至少分开2.5厘米(美国儿科学会,2003)。参见第11章常规儿童免疫接种计划。如果MMR不能与灭活疫苗同时注射,可以在之前或之后的任何间隔时间注射。应该在孩子的记录中注明接种每种疫苗的地点。
MMR最好与其他活疫苗(如卡介苗)同时接种。如果同时给予活疫苗,那么每种疫苗病毒将开始复制,并对每种疫苗产生适当的免疫反应。接种活疫苗后,会产生天然干扰素作为对疫苗的反应。如果在这种反应期间给予第二种活疫苗,干扰素可以防止第二种疫苗病毒的复制。这可能会减弱对第二种疫苗的反应。基于MMR疫苗可导致水痘疫苗反应减弱的证据(Mullooly and Black, 2001),目前推荐的活疫苗间隔为4周。因此,如果不能同时接种活疫苗,建议间隔四周。
在接种MMR疫苗和进行结核菌素试验之间应间隔四周。MMR的麻疹疫苗成分可以降低迟发型超敏反应。由于这是阳性结核菌素试验的基础,这可能会产生假阴性反应。
当在接受血液制品(如免疫球蛋白)后的三个月内给予MMR时,对麻疹成分的反应可能会降低。这是因为这种血液制品可能含有大量的麻疹特异性抗体,这可能会阻止疫苗病毒的复制。在可能的情况下,MMR应推迟到收到此类产品后的三个月。如果最近接受过血液制品的人需要立即获得麻疹保护,仍应接种MMR疫苗。为了提供更长期的保护,MMR应该在三个月后重复。
处理
用于接种疫苗的设备,包括用过的小瓶或安瓿,应在每次接种结束后,密封在一个合适的防刺穿“锐器”盒中进行处置(未批准,BS 7320)。
疫苗使用建议
免疫接种计划的目标是在适当的时间间隔为所有符合条件的个人提供两剂MMR疫苗。
在英国目前使用的MMR疫苗的第一剂后,超过90%的个体将血清转化为麻疹、腮腺炎和风疹抗体(Tischer and Gerike, 2000)。然而,许可前研究的抗体反应可能高于常规使用下的临床保护。有证据表明,单剂量的含麻疹的疫苗在约90%的个体中提供麻疹保护(Morse et al., 1994; Medical Research Council, 1977)。单剂含风疹的疫苗可提供约95%至100%的保护(Plotkin and Orenstein, 2004)。在英国使用的单剂量含腮腺炎疫苗可提供61%至91%的腮腺炎保护作用(Plotkin and Orenstein, 2004)。最近在英国进行的一项研究表明,单剂量MMR对流行性腮腺炎的有效性约为64%(Harling et al., 2005)。因此,需要两剂MMR才能对麻疹、腮腺炎和风疹产生令人满意的保护作用。
当需要预防麻疹、腮腺炎和/或风疹时,建议使用MMR。不管是否有麻疹、腮腺炎或风疹感染史,都可以接种MMR疫苗。对这些人进行免疫接种不会产生不良影响,因为他们已经具有抑制疫苗病毒复制的免疫力。
十岁以下的儿童
第一剂MMR应在12至13个月大时(即第一个生日的一个月内)注射。一岁前的免疫接种在麻疹风险较高的地区提供了早期保护,但残留的母体抗体可能会降低对疫苗的反应率。因此,为计划生育选择的最佳年龄是疾病风险和保护水平之间的折衷。
如果在第一个生日之前注射了一剂MMR,无论是因为去流行国家旅行,还是因为当地疫情爆发,都应忽略该剂量,并在12至13个月大(即第一个生日的一个月内)和3岁4个月至5岁大(见第11章)的推荐时间再注射两剂。
第二次注射通常在入学前进行,但也可以在第一次注射后三个月内的任何时间进行常规注射。允许两次给药之间间隔三个月可能使应答率最大化,特别是在18个月以下的幼儿中,其中母体抗体可能降低对疫苗接种的应答(Orenstein et al., 1986; Redd et al., 2004; de Serres et al., 1995)。当迫切需要麻疹疫苗时,可在第一剂疫苗注射后一个月注射第二剂疫苗(ACIP,1998)。如果儿童在第一剂疫苗接种后不到三个月且不到18个月时接种第二剂疫苗,则应接种常规学龄前疫苗(第三剂)以确保充分保护。
十岁或十岁以上的儿童和成人
所有儿童在离开学校前都应接种两剂MMR疫苗。青少年(离校)强化课程或预约是确保未免疫或部分免疫儿童获得MMR的机会。如果需要两剂MMR,则应在第一剂后一个月注射第二剂。
MMR疫苗可以给任何年龄的人接种。进入学院、大学或其他高等教育机构、监狱或军队服役提供了检查个人免疫史的机会。应该为那些没有接受过MMR的人提供适当的MMR免疫。
决定何时给成年人接种疫苗需要考虑过去的疫苗接种史、个体保持易感的可能性以及未来的暴露和疾病风险:
- 1980年至1990年间出生的人可能无法预防腮腺炎,但有可能接种麻疹和风疹疫苗。他们可能从未接种过含腮腺炎成分的疫苗或仅接种一剂MMR,暴露于天然腮腺炎的机会有限。他们应该被召回并接种MMR疫苗。如果这是他们的第一剂,一个月后应该再给一剂MMR
- 1970年至1979年间出生的人可能已经接种了麻疹疫苗,许多人在童年时期会接触到腮腺炎和风疹。然而,只要可行,这个年龄组应该提供MMR,特别是如果他们被认为有高暴露风险。如果这些成年人因为被证明对至少一种疫苗成分易感而接受疫苗接种,则应给予两剂疫苗,或者应该是血清转化为相关抗原的证据
- 1970年之前出生的人很可能已经感染了所有三种自然感染,并且不太可能易感。MMR疫苗应根据请求提供给这些人,或者如果他们被认为具有高暴露风险。如果这些成年人因为被证明对至少一种疫苗成分易感而接受疫苗接种,则应给予两剂疫苗或应存在相关抗原血清转化的证据。
有未知或不完整疫苗接种史的个人
来自发展中国家的儿童可能在其原籍国接种过含麻疹成分的疫苗,但可能没有接种过腮腺炎或风疹疫苗(www-nt.who.int/immunization_monitoring/ en/global summary/country profile select . cfm)。除非有可靠的适当免疫史,否则应假定个人未免疫,并应遵循上述建议。18个月及以上未接受MMR的个体应至少间隔一个月接受两剂。已经接受一剂MMR的个体应该接受第二剂以确保他们受到保护。
医护人员
鉴于医护人员有能力将麻疹或风疹传染给弱势群体,对他们的保护尤为重要。虽然他们可能出于自身利益需要接种MMR疫苗,但基于上述原因,他们也应该对麻疹和风疹免疫,以保护他们的患者。
令人满意的保护证据将包括以下文件:
- 接受了两剂MMR,或
- 麻疹和风疹抗体检测呈阳性。
正在国外旅行或将要在国外居住的个人所有前往流行病或地方病地区的旅行者应确保根据英国计划(见上文)进行全面免疫。六个月以上的婴儿
到流行性腮腺炎流行区或目前正在爆发流行性腮腺炎的地区旅行的10岁以下儿童应接受MMR。由于在一岁前接种疫苗的婴儿对MMR的反应是次优的,因此应在推荐的年龄再接种两剂MMR。旅行中的儿童在常规年龄接种了一剂MMR后,应在第一剂疫苗接种后至少一个月接种第二剂疫苗。如果儿童在接种第二剂疫苗时年龄不足18个月,则应接种常规学前疫苗(第三剂)以确保充分保护。
禁忌症
极少数人不能接种MMR疫苗。如有疑问,应向儿科顾问、免疫协调员或传染病控制顾问寻求适当的建议,而不是拒绝接种疫苗。
疫苗不应用于:
- 免疫抑制者(详见第6章)
- 对先前剂量的麻疹、腮腺炎或风疹疫苗有过敏反应的人
- 对新霉素或明胶有过敏反应的人
- 孕妇。
MMR后的过敏反应极为罕见(每百万剂量3.5至14.4)(Bohlke et al., 2003; Patja et al., 2000; Pool et al., 2002; D’Souza et al., 2000)。
可能会出现轻微的过敏症状,但不是MMR或其他疫苗进一步免疫的禁忌症。对这些事件的详细病史通常会区分过敏反应和其他不是由疫苗引起的或不危及生命的事件。在后一种情况下,有可能继续免疫过程。必须寻求专家对疫苗和接种环境的建议。必须考虑到不免疫对个人的终身风险。
预防措施
没有发烧或全身不适的小病不是推迟免疫接种的正当理由。如果个人急性不适,应推迟免疫接种,直到他们完全康复。这是为了避免由于错误地将任何体征或症状归因于疫苗的副作用而混淆任何急性疾病的鉴别诊断。
特发性血小板减少性紫癜
接种MMR疫苗后,特发性血小板减少性紫癜(ITP)很少发生,通常在首剂疫苗接种后6周内。接种MMR疫苗后发生ITP的风险比感染麻疹或风疹病毒后发生的风险小得多。
如果在接种第一剂MMR后的六周内出现ITP,则应在接种第二剂MMR前采集血液并检测麻疹、腮腺炎和风疹抗体。血清应送至健康保护局(HPA)病毒参考实验室(Colindale),该实验室为此类儿童提供免费的专业血清学检测。如果结果表明对麻疹、腮腺炎或风疹的免疫力不完全,则建议接种第二剂MMR。
鸡蛋过敏
所有鸡蛋过敏的儿童都应该接受MMR疫苗接种,作为初级保健的常规程序(Clark et al., 2010)。最近的数据表明,对MMR疫苗的过敏反应与对鸡蛋抗原的超敏反应无关,而是与疫苗的其他成分(如明胶)的超敏反应有关(Fox and Lack, 2003)。在总共超过1000名鸡蛋过敏患者的三项大型研究中,在MMR疫苗接种后没有报道严重的心肺反应(Fasano et al., 1992; Freigang et al.,1994; Aickin et al., 1994; Khakoo and Lack, 2000)。对疫苗本身有过敏反应记录的儿童应由过敏症专科医生进行评估(Clark et al .,2010)。
怀孕和母乳喂养
没有证据表明含风疹的疫苗是致畸的。在美国、英国和德国,对661名妇女进行了积极监测,其中293名妇女在高危期(即末次月经后6周)接种了疫苗(主要是单一风疹疫苗)。只有16名婴儿有感染的证据,没有一名婴儿有符合先天性风疹综合征的永久性异常(Best et al., 2004)。然而,作为预防措施,MMR疫苗不应用于已知怀孕的妇女。如果给成年妇女接种MMR疫苗,应建议她们避孕一个月。
不建议在意外接种疫苗后终止妊娠(Tookey et al., 1991)。应向潜在父母提供怀孕期间接种疫苗无风险证据的信息。HPA免疫部门正在对怀孕期间意外接种MMR进行监测,并应向其报告此类情况(电话:020 8200 4400)。
母乳喂养不是MMR免疫接种的禁忌症,MMR疫苗可以给母乳喂养的母亲,对她们的婴儿没有任何风险。极少数情况下,在母乳中发现风疹疫苗病毒,但这并未导致婴儿出现任何症状(Buimovici-Klein et al., 1997; Landes et al., 1980; Losonsky et al., 1982)。口服疫苗不起作用。没有证据表明在母乳中发现腮腺炎和麻疹疫苗病毒。
早产儿
根据时间表,早产儿在适当的年龄接种疫苗是很重要的(见第11章)。
免疫抑制和艾滋病毒
MMR疫苗不推荐用于严重免疫抑制的患者(见第6章)(Angel et al., 1996)。MMR疫苗可用于无或中度免疫抑制的HIV阳性患者(定义见表23.1)。
表23.1 CD4计数/微升(占淋巴细胞总数的%)
| 年龄 | 少于12月龄 | 1-5岁 | 6至12岁 | 超过12岁 |
| 无抑制 | ≥1500 (≥25%) | ≥1000 (15–24%) | ≥500 (≥25%) | ≥500 (≥25%) |
| 中度抑制 | 750–1499 | 500–999 | 200–499 | 200–499 |
| (15–24%) | (15–24%) | (15–24%) | (15–24%) | |
| 严重抑制 | <750 | <500 | <200 | <200 |
| (<15%) | (<15%) | (<15%) | (<15%) |
皇家儿科和儿童健康学院(www.rcpch.ac.uk)、英国艾滋病毒协会(BHIVA)艾滋病毒感染成人免疫指南(BHIVA,2006)和英国和爱尔兰儿童艾滋病毒协会(CHIVA)免疫指南提供了进一步的指导www.bhiva.org/chiva)。
神经疾病
神经疾病的存在不是免疫接种的禁忌症。如果有证据表明目前的神经恶化,包括控制不良的癫痫,应推迟免疫接种,直到病情稳定。有癫痫发作个人或密切家族史的儿童应接种MMR疫苗。应给出关于任何发热的可能时间和发热管理的建议。医生和护士应该寻求儿科专家的建议,而不是拒绝免疫接种。
不良反应
MMR疫苗后的不良反应(过敏反应除外)是由于疫苗病毒的有效复制以及随后的轻微疾病。这种情况在某些人身上是可以预料的。麻疹成分引起的事件发生在接种疫苗后6至11天。腮腺炎和风疹成分引起的事件通常发生在疫苗接种后2-3周,但也可能发生在疫苗接种后6周。这些事件仅发生在对该成分易感的个体中,因此在第二次和后续剂量后不太常见。出现疫苗相关症状的个体不会传染给他人。
常见事件
接种第一剂MMR疫苗后,可能会出现不适、发热和/或皮疹,最常见的是在免疫接种后约一周,持续约两到三天。在一项对6000多名1至2岁儿童的研究中,报告的症状在性质、频率、发病时间和死亡率方
面相似,持续时间与单独接种麻疹疫苗后通常报告的持续时间相同(Miller et al., 1989)。大约1%的4岁以下儿童出现腮腺肿大,通常发生在第三周。
接种第二剂MMR疫苗后的不良反应比接种第一剂疫苗后少得多。一项研究表明,与未接种疫苗的对照组相比,大学生再次接种疫苗后,发热或皮疹没有增加(Chen et al., 1991)。对1991-1993年通过美国疫苗不良事件报告系统报告的过敏反应进行的分析表明,6-19岁儿童(被认为是第二剂受试者)的过敏反应少于1-4岁儿童(被认为是第一剂受试者)(Chen et al., 1991)。在一项超过8000名儿童的研究中,在4至6岁之间接种第二剂MMR疫苗后的几个月内,惊厥、皮疹或关节痛的风险没有增加(Davis et al., 1997)。
罕见和更严重的事件
热性惊厥是麻疹免疫接种后最常报告的神经系统事件。接种MMR疫苗的1000名儿童中有1名在第6-11天发生癫痫发作——这一比率与接种麻疹疫苗后同期报告的比率相似。MMR后的热性惊厥率低于麻疹感染后的热性惊厥率(Plotkin and Orenstein, 2004)。有充分证据表明,与其他原因引起的热性惊厥相比,MMR免疫接种后的热性惊厥不会增加继发癫痫的风险(Vestergaard et al., 2004)。
先前在英国使用的MMR疫苗中的一株腮腺炎病毒(Urabe)与无菌性脑膜炎的风险增加有关(Miller et al., 1993)。该疫苗于1992年被替换(卫生部,1992年),并且不再在英国获得许可。在芬兰进行的一项研究使用了含有不同流行性腮腺炎毒株(Jeryl Lynn)的MMR,该毒株类似于目前在英国MMR中使用的毒株,该研究未发现MMR和无菌性脑膜炎之间有任何联系(Makela et al., 2002)。
因为MMR疫苗含有减毒活病毒,所以从生物学角度看,它可能导致脑炎。最近在芬兰进行的一项大型记录关联研究观察了50多万1至7岁的儿童,没有发现MMR和脑炎之间有任何联系(Makela et al., 2002)。
ITP是MMR后可能出现的一种情况,很可能是由风疹成分引起的。这通常发生在六周内,并自行解决。在出生后第二年接受第一剂MMR的儿童中,大约每22,300名儿童中有一名发生ITP(Miller et al., 2001)。如果在接种第一剂MMR后6周内出现ITP,则应在接种第二剂疫苗前采血检测麻疹、腮腺炎和风疹抗体(见上文)。
关节病(关节痛或关节炎)也很少在MMR免疫接种后发生,可能是由于风疹成分。如果是由疫苗引起的,应在免疫接种后14至21天出现。如果它发生在其他时间,它极不可能是由疫苗接种引起的。几项对照流行病学研究表明,女性没有患慢性关节炎的额外风险(Slater,1997)。
所有疑似疫苗不良反应发生在儿童身上,或任何年龄的人在接种了标有黑三角(▼)的疫苗后,应使用黄卡计划向人类药物委员会报告。成人对疫苗的严重、可疑不良反应应通过黄卡计划报告。
接种含麻疹、腮腺炎和风疹的疫苗后报告的其他情况
在1994年11月MR免疫接种运动之后,只报告了三例格林-巴利综合征(GBS)。从背景率来看,在此期间该人群中预计会出现1-8例病例。因此,这三个病例很可能是巧合,不是由疫苗引起的。对美洲世卫组织地区急性弛缓性麻痹监测中的GBS报告率进行的分析表明,在开展麻疹免疫接种运动后,8000万儿童接受了免疫接种,GBS发病率没有增加(da Silveira et al., 1997)。在接受900,000剂MMR的人群中,在接种疫苗后的任何时间,GBS的风险都没有增加(Patja et al., 2001)。这一证据驳斥了MMR导致GBS的说法。
尽管有报道称MMR后出现步态障碍,但最近的一项流行病学研究显示,没有证据表明MMR和步态障碍之间存在因果关系(Miller et al., 2005)。
近年来,麻疹疫苗和肠道疾病之间的假设联系已得到调查。炎症的发生率没有增加
与对照组相比,接种含麻疹疫苗者出现肠道疾病(Gilat et al., 1987; Feeney et al., 1997)。自从芬兰(Pebody et al., 1998)或英国(Seagroatt,2005)引入MMR疫苗接种以来,炎症性肠病的发病率没有增加。
有压倒性的证据表明MMR不会导致自闭症(www.iom. edu/report.asp?id=20155)。在过去的七年里,已经发表了大量关于这个问题的研究。这些研究表明:
- 与未接种MMR的儿童相比,接种MMR的儿童患自闭症的风险没有增加(Farrington et al., 2001; Madsen and Vestergaard, 2004)
- 在接种MMR疫苗后的时期内,自闭症症状的发作没有聚集性(Taylor et al., 1999; De Wilde et al., 2001; Makela et al., 2002)
- 在英国,报告的自闭症发病率的增加先于MMR的使用(Taylor et al., 1999)
- 1993年后,尽管日本撤销了MMR,自闭症的发病率仍持续上升(Honda et al., 2005)
- 在英国或美国,自闭症发病率和MMR疫苗覆盖率之间没有相关性(Kaye et al., 2001; Dales et al., 2001)
- 接种MMR后出现退化形式的儿童与未接种疫苗而出现自闭症的儿童比例没有差异(Fombonne, 2001; Taylor et al., 2002; Gillberg and Heijbel, 1998)
- MMR后出现相关肠道症状的儿童与未接种疫苗的儿童相比,出现自闭症的比例没有差异((Fombonne, 1998; Fombonne, 2001;Taylor et al., 2002)
- 使用最敏感的方法也无法在自闭症儿童中检测到疫苗病毒(Afzal et al., 2006)。
最新的证据见卫生部网站www.dh.gov.uk/en/Publichealth/Healthprotection/Immunisation/Keyvaccineinformation/DH_103952
有人认为,MMR联合疫苗可能会使免疫系统超负荷。从出生的那一刻起,人类就在日常生活环境中暴露于无数的外来抗原和传染因子。应对MMR中的三种病毒只需要
占婴儿免疫系统总容量的一个微小的比例(Offit et al., 2002)。MMR中的三种病毒以彼此不同的速率复制,并且预期在不同的时间达到高水平。
一项检查免疫超负荷问题的研究发现,与其他时间段相比,MMR疫苗接种后不久,严重细菌感染的入院率较低。这表明MMR不会引起免疫系统的任何普遍抑制(Miller et al., 2003)。
病例、接触和暴发的管理
诊断
需要将麻疹、腮腺炎和风疹迅速通知当地卫生保护单位(HPU ),以确保能够迅速采取公共卫生行动。通知应基于临床怀疑,不应等待实验室确认。自1994年以来,很少有临床诊断病例随后被证实为真正的麻疹、腮腺炎或风疹。然而,在疾病爆发和流行期间,确诊率确实会增加。
麻疹、流行性腮腺炎和风疹的诊断可以通过无创手段得到确认。理想地,在皮疹或腮腺肿胀发作后的1-6周内检测口腔液(唾液)样品中的特异性IgM,已经显示出对于确认这些感染是高度敏感和特异的(Brown et al., 1994; Ramsay et al., 1991; Ramsay et al., 1998)。建议从所有已通报的病例中获取口腔液样本,大规模流行期间除外。可以从当地的HPU获得有关该程序的建议。
用MMR保护
暴露于疑似腮腺炎后,对MMR疫苗中腮腺炎成分的抗体反应发展得不够快,不足以提供有效的预防。即使在为MMR提供有效的暴露后预防为时已晚的情况下,疫苗也可以为未来暴露于所有三种感染提供保护。因此,与疑似麻疹、腮腺炎或风疹的接触为以前未接种过MMR疫苗的个体提供了一个很好的机会。如果个人已经在潜伏麻疹、腮腺炎或风疹,接种MMR疫苗不会加剧症状。在这些情况下,应告知个人,接种疫苗后不久发生的腮腺炎样疾病可能是由于自然感染。如果对一个人的疫苗接种状况有疑问,MMR仍然应该进行,因为对已经免疫的人进行疫苗接种不会产生不良影响。
用免疫球蛋白对接触提供保护
人类正常免疫球蛋白通常不用于腮腺炎的暴露后保护,因为没有证据表明其有效。
供应
- MMRVaxPRO®–由赛诺菲巴斯德MSD公司制造。
- Priorix由葛兰素史克公司生产。
这些疫苗由医疗物流(电话:0870 871 1890)提供,作为国家儿童免疫规划的一部分。
在苏格兰,应该从当地的儿童疫苗储备中心获得供应。这些细节可从苏格兰保健用品公司获得
(电话:0131 275 6154)。
在北爱尔兰,应该从当地的儿童疫苗储备中心获得供应。详情可从区域药品采购处获得
(电话:02890 552368)。
参考
MMWR 47(RR-8):1–57。www.cdc.gov/mmwr/preview/mmwrhtml/00053391.htm(1998年5月22日)。
ACIP (1998) Measles, mumps, and rubella – vaccine use and strategies for elimination of
measles, rubella, and congenital rubella syndrome and control of mumps: recommendations
of the Advisory Committee on Immunization Practices (ACIP). MMWR 47(RR-8):1–57.
www.cdc.gov/mmwr/preview/mmwrhtml/00053391.htm (22 May 1998).
Afzal MA, Ozoemena LC, O’Hare A et al. (2006) Absence of detectable measles virus
genome sequence in blood of autistic children who have had their MMR vaccination during
the routine childhood immunisation schedule of the UK. J Med Virol 78: 623–30.
Aickin R, Hill D and Kemp A (1994) Measles immunisation in children with allergy to egg.
BMJ 308: 223–5
American Academy of Pediatrics (2003) Active immunization. In: Pickering LK (ed.) Red
Book: 2003 Report of the Committee on Infectious Diseases, 26th edition. Elk Grove
Village, IL: American Academy of Pediatrics.
Angel JB, Udem SA, Snydman DR et al. (1996) Measles pneumonitis following measlesmumps-rubella vaccination of patients with HIV infection, 1993. MMWR 45: 603–6.
Best JM, Cooray S and Banatvala JE (2004) Rubella. In: Mahy BMJ and ter Meulen V (eds)
Topley and Wilson’s Virology, 10th edition. London: Hodder Arnold.
Bjorvatn B et al. (1973) Mumps virus recovered from testicles by fine-needle aspiration
biopsy in cases of mumps orchitis. Scand J Infect Dis 5: 3–5.
Bohlke K, Davis RL, Moray SH et al. (2003) Risk of anaphylaxis after vaccination of
children and adolescents. Pediatrics 112: 815–20.
British HIV Association (2006) Immunisation guidelines for HIV-infected adults. BHIVA.
www.bhiva.org/pdf/2006/Immunisation506.pdf
Brown DW, Ramsay ME, Richards AF and Miller E (1994) Salivary diagnosis of measles:
a study of notified cases in the United Kingdom, 1991–3. BMJ 308(6935): 1015–17.
Buimovici-Klein E, Hite RL, Byrne T and Cooper LR (1997) Isolation of rubella virus in
milk after postpartum immunization. J Pediatr 91: 939–43.
Chen RT, Moses JM, Markowitz LE and Orenstein WA (1991) Adverse events following
measles-mumps-rubella and measles vaccinations in college students. Vaccine 9: 297–9.
Clark AT, Skypala I, Leech SC, et al. (2010). British Society for Allergy and Clinical
Immunology guidelines for the management of egg allergy. Clin Exp Allergy
40(8):1116-29.
Communicable Disease Surveillance Centre (1985) Virus meningitis and encephalitis. BMJ
290: 921–2.
da Silveira CM, Salisbury DM and de Quadros CA (1997) Measles vaccination and
Guillain-Barré syndrome. Lancet 349(9044): 14–16.
Dales L, Hammer SJ and Smith NJ (2001) Time trends in autism and in MMR immunization
coverage in California. JAMA 285(22): 2852–3.
Davis RL, Marcuse E, Black S et al. (1997) MMR2 immunization at 4 to 5 years and 10 to
12 years of age: a comparison of adverse clinical events after immunization in the Vaccine
Safety Datalink project. Pediatrics 100: 767–71.
de Serres G, Boulianne N, Meyer F and Ward BJ (1995) Measles vaccine efficacy during
an outbreak in a highly vaccinated population: incremental increase in protection with age
at vaccination up to 18 months. Epidemiol Infect 115: 315–23
De Wilde S, Carey IM, Richards N et al. (2001) Do children who become autistic consult
more often after MMR vaccination? Br J General Practice 51: 226–7.
Dejucq N and Jegou B (2001) Viruses in the mammalian male genital tract and their effects
on the reproductive system. Microbiol Mol Biol Rev 65: 208–31.
Department of Health (1992) Changes in supply of vaccine. Circular (PL/CMO(92)11).
D’Souza RM, Campbell-Lloyd S, Isaacs D et al. (2000) Adverse events following
immunisation associated with the 1998 Australian Measles Control Campaign. Commun
Dis Intell 24: 27–33.
Feeney M, Gregg A, Winwood P and Snook J (1997) A case-control study of measles
vaccination and inflammatory bowel disease. The East Dorset Gastroenterology Group.
Lancet 350: 764–6.
Falk WA , Buchan K, Dow M et al. (1989) The epidemiology of mumps in southern Alberta,
1980–1982. Am J Epidemiol 130(4): 736–49.
Farrington CP, Miller E and Taylor B (2001) MMR and autism: further evidence against a
causal association. Vaccine 19: 3632–5.
Fasano MB, Wood RA, Cooke SK and Sampson HA (1992) Egg hypersensitivity and
adverse reactions to measles, mumps and rubella vaccine. J Pediatr 120: 878–81.
Fombonne E (1998) Inflammatory bowel disease and autism. Lancet 351: 955.
Fombonne E (2001) Is there an epidemic of autism? Pediatrics 107: 411–12.
Fox A and Lack G (2003) Egg allergy and MMR vaccination. Br J Gen Pract 53: 801–2.
Freigang B, Jadavji TP and Freigang DW (1994) Lack of adverse reactions to measles,
mumps and rubella vaccine in egg-allergic children. Ann Allergy 73: 486–8.
Galbraith NS, Young SEJ, Pusey JJ et al. (1984) Mumps surveillance in England and Wales
1962–1981. Lancet 14: 91–4.
Garty BBZ, Danon YL and Nitzan M (1988) Hearing loss due to mumps. Arch Dis Child
63(1): 105–6. Correspondence on Hall paper.
Gilat T, Hacohen D, Lilos P and Langman MJ (1987) Childhood factors in ulcerative
colitis and Crohn’s disease. An international co-operative study. Scan J Gastroenterology
22: 1009–24.
Gillberg C and Heijbel H (1998) MMR and autism. Autism 2: 423–4.
Harling R, White JM, Ramsay ME, Macsween KF and van den Bosch C (2005) The
effectiveness of the mumps component of the MMR vaccine: a case control study. Vaccine
23(31): 4070–4.
Kaye JA, del Mar Melero-Montes M and Jick H (2001) Mumps, measles and rubella
vaccine and the incidence of autism recorded by general practitioners: a time trend
analysis. BMJ 322(7284): 460–3.
Khakoo GA and Lack G (2000) Recommendations for using MMR vaccine in children
allergic to eggs. BMJ 320: 929–32.
Landes RD, Bass JW, Millunchick EW and Oetgen WJ (1980) Neonatal rubella following
postpartum maternal immunisation. J Pediatr 97: 465–7.
Losonsky GA, Fishaut JM, Strussenberg J and Ogra PL (1982) Effect of immunization
against rubella on lactation products. Development and characterization of specific
immunologic reactivity in breast milk. J Infect Dis 145: 654–60.
Madsen KM and Vestergaard M (2004) MMR vaccination and autism: what is the evidence
for a causal association? Drug Saf 27: 831–40.
Makela A, Nuorti JP and Peltola H (2002) Neurologic disorders after measles-mumpsrubella vaccination. Pediatrics 110: 957–63.
Medical Research Council (1977) Clinical trial of live vaccine given alone and live vaccine
preceded by killed vaccine. Fourth report of the Medical Research Council by the measles
sub-committee on development of vaccines and immunisation procedures. Lancet ii: 571–5.
Miller C, Miller E, Rowe K et al. (1989) Surveillance of symptoms following MMR
vaccine in children. Practitioner 233(1461): 69–73.
Miller E, Goldacre M, Pugh S et al. (1993) Risk of aseptic meningitis after measles,
mumps, and rubella vaccine in UK children. Lancet 341(8851): 979–82.
Miller E, Waight P, Farrington P et al. (2001) Idiopathic thrombocytopenic purpura and
MMR vaccine. Arch Dis Child 84: 227–9.
Miller E, Andrews N, Waight P and Taylor B (2003) Bacterial infections, immune overload,
and MMR vaccine. Measles, mumps, and rubella. Arch Dis Child 88(3): 222–3.
Miller E, Andrews N, Grant A et al. (2005) No evidence of an association between MMR
vaccine and gait disturbance. Arch Dis Child, 88(3): 292–6.
Morgan Capner P, Wright J, Miller CL and Miller E (1988) Surveillance of antibody to
measles, mumps and rubella by age. BMJ 297: 770–2.
Morse D, O’Shea M, Hamilton G et al. (1994) Outbreak of measles in a teenage school
population: the need to immunize susceptible adolescents. Epidemiol Infect 113: 355–65.
Mullooly J and Black S (2001) Simultaneous administration of varicella vaccine and other
recommended childhood vaccines – United States, 1995–1999. MMWR 50(47): 1058–61.
Offit PA, Quarles J, Gerber MA et al. (2002) Addressing parents’ concerns: do multiple
vaccines overwhelm or weaken the infant’s immune system? Pediatrics 109(1): 124–9.
Orenstein WA, Markowitz L, Preblud SR et al. (1986) Appropriate age for measles
vaccination in the United States. Dev Biol Stand 65: 13–21.
Patja A, Davidkin I, Kurki T et al. (2000) Serious adverse events after measles-mumpsrubella vaccination during a fourteen-year prospective follow-up. Pediatr Infect Dis J.
19: 1127–34.
Patja A, Paunio M, Kinnunen E et al. (2001) Risk of Guillain-Barré syndrome after
measles-mumps-rubella vaccination. J Pediatr 138: 250–4.
Pebody RG, Paunio M and Ruutu P (1998) Measles, measles vaccination, and Crohn’s
disease has not increased in Finland. BMJ 316(7146): 1745–6.
Peltola H, Heinonen OP and Valle M (1994) The elimination of indigenous measles, mumps
and rubella from Finland by a 12-year two-dose vaccination program. NEJM 331(21):
1397–402.
Philip RN, Reinhard KR and Lackman DB (1959) Observations on a mumps epidemic in a
‘virgin’ population. Am J Hyg 69: 91–111.
Plotkin SA and Orenstein WA (eds) (2004) Vaccines, 4th edition. Philadelphia: WB
Saunders Company, Chapters 19, 20 and 26.
Pool V, Braun MM, Kelso JM et al. (2002) Prevalence of anti-gelatin IgE antibodies in
people with anaphylaxis after measles-mumps-rubella vaccine in the United States.
Pediatrics 110(6):e71. www.pediatrics.org/cgi/content/full/110/6/e71
Ramsay ME, Brown DW, Eastcott HR and Begg NT (1991) Saliva antibody testing and
vaccination in a mumps outbreak. CDR (Lond Engl Rev) 1(9): R96–8.
Ramsay ME, Brugha R, Brown DW et al. (1998) Salivary diagnosis of rubella: a study of
notified cases in the United Kingdom, 1991–4. Epidemiol Infect 120(3): 315–19.
Redd SC, King GE, Heath JL et al. (2004) Comparison of vaccination with measlesmumps-rubella at 9, 12 and 15 months of age. J Infect Dis 189: S116–22
Schlegel M, Osterwalder JJ, Galeazzi RL and Vernazza PL (1999) Comparative efficacy of
three mumps vaccines during disease outbreak in eastern Switzerland: cohort study. BMJ
319: 352–3.
Seagroatt V (2005) MMR vaccine and Crohn’s disease: ecological study of hospital
admissions in England, 1991 to 2002. BMJ 330: 1120–1.
Slater PE (1997) Chronic arthropathy after rubella vaccination in women. False alarm?
JAMA 278: 594–5.
Taylor B, Miller E, Farrington CP et al. (1999) Autism and measles, mumps and rubella: no
epidemiological evidence for a causal association. Lancet 353(9169): 2026–9.
Taylor B, Miller E, Langman R et al. (2002) Measles, mumps and rubella vaccination and
bowel problems or developmental regression in children with autism: population study.
BMJ 324(7334): 393–6.
Tischer A and Gerike E (2000) Immune response after primary and re-vaccination with
different combined vaccines against measles, mumps, rubella. Vaccine 18(14): 1382–92.
Tookey PA, Jones G, Miller BH and Peckham CS (1991) Rubella vaccination in pregnancy.
CDR 1(8): R86–8.
Vestergaard M, Hviid A, Madsen KM et al. (2004) MMR vaccination and febrile seizures.
Evaluation of susceptible subgroups and long-term prognosis. JAMA 292: 351–7.
WHO (2003) Eliminating measles and rubella and preventing congenital rubella infection.
www.euro.who.int/vaccine/20030808_4
WHO (2005) Vaccine Preventable Disease Monitoring System. Global summary.
www-nt.who.int/immunization_monitoring/en/globalsummary/countryprofileselect.cfm)
Hits: 206
