Contents
mRNA vaccines for infectious diseases — advances, challenges and opportunities
传染病mRNA疫苗——进展、挑战和机遇
自然评论药物发现 卷 23, 页838–861 (2024)
摘要
基于mRNA的疫苗的概念出现于三十多年前。过去20年的突破性发现和技术进步已经解决了最初延迟这种新疫苗模式应用的主要障碍。核苷修饰的新冠肺炎mRNA疫苗的快速发展表明,这种免疫平台易于开发,具有可接受的安全性,并且可以大规模生产。抗原设计的灵活性和简易性使得mRNA疫苗能够开发用于多种病毒以及各种细菌和寄生虫。然而,我们的知识差距限制了具有更高效力和安全性的下一代mRNA疫苗的开发。对mRNA疫苗作用机制的更深入了解、能够进行合理抗原设计的新技术的应用以及创新的疫苗递送策略和疫苗接种方案将有可能产生针对广泛病原体的有效新型疫苗。
其他人正在查看类似的内容
介绍
疫苗对降低各种病原体引起的发病率和死亡率产生了重大影响1。20世纪下半叶,许多国家引入了全面的疫苗方案,这预示着与致命病原体的斗争出现了转折点,几乎完全根除了几种严重的儿童疾病,并缓解了一些其他危险的病毒或细菌疾病2。然而,一些目前获得许可的疫苗不能诱导强有力的、广泛保护性的、持久的免疫反应,耗时且难以生产,或者具有次优的安全性,突出了改进的需要2。此外,目前缺乏针对多种相关的难以靶向的病原体的人类疫苗,例如人类免疫缺陷病毒1型(HIV-1)或丙型肝炎病毒,以及大量其他病毒和人类致病细菌、真菌和寄生虫,这些病毒和寄生虫合起来每年导致全球数百万人死亡。
mRNA疫苗是疫苗学领域的新人。几十年的工作现已解决了体外转录(IVT) mRNA的基本障碍,包括其高度炎症性质以及安全有效的体内递送和大规模生产的困难。关键进展包括将修饰的核苷引入mRNA,利用可电离的脂质纳米粒(LNPs)进行mRNA递送,以及优化IVT反应,从而实现无细胞、快速和可规模化的mRNA疫苗生产。值得注意的是,这种疫苗平台与其他模式相比有几个关键优势。首先,抗原设计的灵活性(mRNA序列可以被快速修改)使mRNA疫苗成为针对快速进化的病原体的理想选择,如流感病毒和严重急性呼吸综合征冠状病毒2(新型冠状病毒)。第II,mRNA生产的容易性允许快速的反复筛选过程来鉴定针对病原体的优化的免疫原。第三,多组分(联合)mRNA疫苗可以针对单一病原体的几种不同抗原3,4,5,6,7。例如,临床前流感病毒疫苗中包含了同一抗原的不同版本8和II价许可的新冠肺炎疫苗9和其他人用一种疫苗制剂针对一种以上的病原体10,11。第四,mRNA疫苗可以在短时间内大规模生产,这对于季节性(例如流感)疫苗或在疫情情况下是非常理想的12。第五,mRNA疫苗代表了针对具有多跨膜结构域的复杂蛋白质的疫苗设计的理想平台。mRNA疫苗的一些关键特征使其成为有效应对新冠肺炎疫情的理想选择。事实上,核苷修饰的mRNA-LNP疫苗很快就被Moderna和辉瑞BioNTech开发出来,并在短时间内生产了数十亿剂13。最重要的是,这两种制剂被证明在预防死亡和严重新冠肺炎方面非常有效,并在新型冠状病毒疫情期间拯救了全球数百万人的生命(方框1)。
在过去的10-15年中,疫苗研究取得了巨大的进步,产生了新的免疫平台,对多种病原体的生物学有了更深入的了解,对人类免疫学有了新的认识,针对登革热、呼吸道合胞病毒(RSV)和疟疾(除新冠肺炎病毒外)等疾病的新疫苗,更重要的是,新技术的发展使合理的抗原设计能够诱导最佳免疫反应。
这篇综述概述了基于mRNA的疫苗平台,包括mRNA设计和递送技术的原理,评估了目前对mRNA疫苗作用机制的理解,并强调了新的临床前和临床传染病疫苗制剂。讨论了mRNA疫苗研究中最重要的挑战、限制和机遇,以及将mRNA平台技术与反向疫苗学相结合以实现针对多种病原体的新型、安全和有效的人类疫苗的潜力。
mRNA疫苗技术概述
大多数临床前和所有可直接注射的临床mRNA疫苗具有两个主要成分:抗原编码mRNA和递送平台,该递送平台保护其免受RNA酶的快速降解,并促进细胞对带负电荷的大RNA分子的摄取。mRNA疫苗的两种成分都会影响引发的免疫反应的质量和程度。
RNA格式和RNA设计的原则
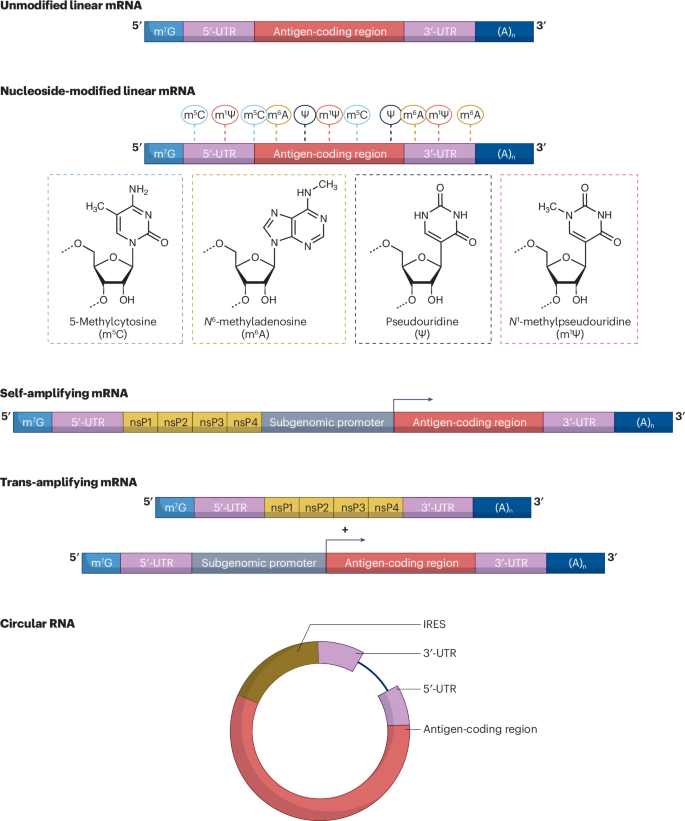
在过去的25年中,已经开发了几种RNA形式,并在临床前和临床研究中进行了评估(图。1)。具有或不具有修饰核苷的非复制(线性)mRNA和自我扩增mRNA (saRNAs)代表了已经被最广泛研究和改进的主要平台14,15。其他新兴的RNA平台包括反式扩增mRNA和环状RNA(框2)。
非复制型mRNA疫苗
非复制型(线性)IVT mRNA已经在疫苗研究中测试了几十年,可以在使用或不使用修饰的核苷的情况下制备。未经修饰的形式主要由CureVac AG首创,并在临床前研究中证明是一种有效的传染病mRNA疫苗形式16,17,18。然而,该平台的表现不如其核苷修饰的(N1-含甲基假哌啶)在新冠肺炎mRNA疫苗临床试验中的对应物,并且未被许可用于人类19,20,21。未改良的CureVac新冠肺炎疫苗(CVnCoV)的次优表现的一个潜在解释是,即使在相对低的人体剂量(12.5 µg)下,它也具有高度炎症性19。这种未经修饰的mRNA的较高反应原性阻止了30 g和100 g高剂量CVnCoV mRNA的测试(分别用于辉瑞-BioNTech(BNT162b2)和Moderna (mRNA-1273)制剂),并且12.5 g剂量在IIb–III期试验中没有诱导足够强的保护性免疫反应19。在开创性的研究中,2023年诺贝尔奖获得者Karikó和Weissman证明了在mRNA序列中引入某些修饰的核苷增加了IVT mRNA的蛋白质产量,更重要的是,降低了其先天免疫感应22,23。核苷修饰mRNA的后一个特征使得BNT162b2和mRNA-1273能够以足够高的剂量用于诱导针对新冠肺炎的保护,同时将疫苗诱导的不良事件保持在可接受的水平。
对IVT mRNA的关键考虑是它的半衰期、稳定性、可翻译性和炎症能力;影响mRNA疫苗效力和安全性的特征,并且可以通过优化mRNA的结构元件(5’帽、5’-非翻译区(UTR)、编码区、3’-UTR、聚腺苷酸尾)和/或通过利用适当的mRNA化学和生产程序进行微调24,25,26,27。5′帽和poly(A)尾都有助于mRNA的稳定性,并在翻译起始中起关键作用25。到目前为止,cap1 (m7GpppNm)是最广泛使用的修饰,可以使用cap1类似物共转录或使用病毒加帽酶转录后添加到IVT mRNA中28,29。使用cap1代替cap0 (m7GpppN)通过 µg服干扰素诱导的蛋白与四肽重复序列1 (IFIT1)诱导的翻译抑制来增加蛋白产量30。多年来,来自哺乳动物或病毒序列的UTR也被包括在内,以增加mRNA的稳定性和翻译25。最近,高通量报道基因分析和计算机指导的方法已经能够选择优化的UTRs和密码子组成,以获得更高的mRNA稳定性和翻译31,32,33,34,35,36。基因中鸟嘌呤和胞嘧啶含量的增加通常伴随着更高水平的表达37但是最近的发现表明,mRNA的II级结构也是mRNA稳定性和可译性的重要预测因子。有趣的是,最高度结构化的mRNA通常(但不总是)具有最高的鸟嘌呤和胞嘧啶含量,密码子用法和II级结构通过增强溶液中的稳定性明显调节IVT mRNA的翻译能力34,35,36。某些修饰的核苷,如假尿苷或N1-甲基假哌啶,可以通过抑制取代残基处的mRNA水解来增加溶液中的稳定性34. N1-甲基假哌啶取代促进真核翻译起始因子2A (eIF2a)磷酸化的降低,从而增加mRNA的蛋白质产量38。这些发现解释了,至少部分解释了,为什么在早期研究中发现,与未经修饰的IVT mRNA相比,含有假尿苷的mRNA的蛋白质产量增加23.
降低IVT mRNA的免疫激活能力是开发安全传染病疫苗的关键。这至少可以通过四种方法来实现。首先,用假尿苷或其衍生物取代尿苷,N1-甲基假尿苷,降低IVT mRNA的尿苷依赖性免疫感应22,39,40,41。第II,RNA聚合酶产生的短流产转录物可在IVT mRNA制品中形成强免疫刺激性双链RNA(dsRNAs ),其可通过多种细胞区室中的多种传感器(例如,TLR3、OAS、PKR、RIG-1和MDA5)的识别诱导炎症和翻译阻断27。因此,通过纯化或RNase III处理从IVT mRNA制备物中去除dsRNA污染物进一步增加了其可翻译性并降低了炎症能力42,43,44。在转录过程中产生较少dsRNA的RNA聚合酶的发展有可能在“一锅”反应中产生IVT mRNA,从而简化疫苗生产45。第三,cap0被诱导炎症反应的细胞内RNA传感器RIG-I识别46。因此,使用在第一个帽近端核苷酸上含有甲基的5’cap 1(高等真核生物中“自身”的标记)是减少IVT mRNA诱导的免疫识别的关键。第四,某些密码子优化策略增加了IVT mRNA中dsRNA的形成36因此,可能增加其被细胞dsRNA传感器的识别。尽管已经在一系列体外和体内实验中检验了上述最佳IVT mRNA生产的许多考虑因素,但是缺乏关于它们在临床前模型中对疫苗免疫原性的影响的足够细节47.
自我扩增mRNA疫苗
使用IVT mRNA的saRNAs疫苗已经被研究了十多年。这种模式通常使用来源于甲病毒的序列,其中非结构蛋白(编码RNA依赖的RNA聚合酶的复制酶基因)是完整的,而结构蛋白被感兴趣的抗原取代15。与非复制型mRNA疫苗相比,saRNAs疫苗可能以更低的剂量给予人类,以诱导保护性免疫反应,减少疫苗诱导的不良事件和成本。与非复制型mRNA相似,saRNAs也包含5’帽、5’-UTR、编码区、3’-UTR和一个poly(A)尾(图。1);因此,这些元件的病毒骨架特异性优化可以产生改进的疫苗设计。在摄取saRNAs后,病毒复制酶产生编码抗原的RNA的多个拷贝,导致持续的抗原产生。在RNA自扩增过程中,通常产生dsRNA中间体,其通过各种细胞RNA传感器的激活引发强烈的免疫激活,特别是I型干扰素应答15。强烈的炎症反应有利于免疫细胞的激活,但限制了saRNAs的蛋白质生产,并降低了耐受性。saRNAs疫苗在临床前模型中显示出早期的前景,即使在低疫苗剂量下也能诱导强大的抗体和T细胞反应48。相反,在早期的新冠肺炎疫苗试验中,它们在人类身上表现不佳49,50。然而,最近的一项临床研究报道,与BNT162b2核苷修饰的mRNA制剂相比,ARCT-154(大角星)新冠肺炎saRNAs-LNP疫苗并不劣于BNT162b2核苷修饰的mRNA制剂,BNT162b2核苷修饰的mRNA制剂用作先前用两种批准的新冠肺炎mRNA疫苗中的任何一种接种三次的个体的加强剂量51。ARCT-154和BNT162b2诱发的不良事件具有可比性。值得注意的是,ARCT-154的使用剂量(5 µg)比BNT162b2 (30 µg)低得多。由于这些有希望的发现,ARCT-154在日本获得许可,成为第三个获得批准的基于mRNA的药物52.
由于不相容性的考虑,用常规的未修饰的核苷生产saRNAs,但是最近的开创性出版物报道了用修饰的核苷完全取代某些未修饰的核苷导致功能性saRNAs具有增加的翻译能力和显著降低的炎症能力53。具体来说,具有5-羟甲基胞苷、5-甲基胞苷和5-甲基尿苷修饰的saRNAss优于它们的N1-甲基假哌啶修饰的线性mRNA对应物的体外细胞转染效率。最重要的是,当以低剂量(10 ng RNA)使用时,含有5-甲基胞苷的新型冠状病毒saRNAs-LNP疫苗诱导了更高的刺突抗原特异性IgG滴度和更高的保护水平N1小鼠中的-甲基假尿苷修饰的线性mRNA-LNP疫苗。如果这些发现转化为人类,这可能在saRNAs疫苗领域开辟新的途径。最近对saRNAs疫苗的研究工作产生了创新的II分载体系统,其中感兴趣的抗原和复制酶在不同的mRNAs上编码54,55(图。1)。分裂载体系统是有利的,因为可以减少saRNAs的长度,减轻RNA不稳定的问题,简化疫苗生产,并允许对II分平台的两个组件进行单独优化56。值得注意的是,与成功使用这种模式相关的挑战是两种RNA组分应该存在于同一细胞中,否则载体系统将不起作用。到目前为止,两种成分的saRNAs模式只在老鼠身上测试过;因此,对更高级物种的研究是有保证的。
mRNA疫苗的递送材料
最近对mRNA疫苗递送的主题进行了综述24,57;因此,下面只讨论最关键的考虑因素和最新发现。
由于mRNA是一个带负电荷的大分子,其通过细胞膜的被动转移是一个低效的过程。早期的mRNA疫苗研究利用物理方法(例如,基因枪和电穿孔)、鱼精蛋白或聚合物复合的mRNA,或施用装载RNA的树突细胞来诱导保护性免疫26。尽管这些方法在临床前研究中显示出一些前景,但它们没有显示出足够的功效和/或在更高级的临床前和人体试验中被证明是不切实际的。永久带正电的脂质已经用于体外mRNA递送几十年了,但是由于与带负电的血清蛋白的广泛相互作用,它们对于体内使用来说大多是次优的;然而,这主要是在静脉内纳米颗粒递送的背景下研究的,其可能与肌内施用的感染性疾病mRNA疫苗的相关性有限58。2010年代,通过开发含有“可电离”脂质的LNP,解决了输送问题48,59,60,通常由四种成分组成:磷脂(辅助脂质)、胆固醇、聚乙II醇(PEG)共轭脂质和阳离子可电离氨基脂质(pKa通常为6.0-6.8),它们与封装的核酸一起,可以形成通常为50-150nm的稳定颗粒。可电离脂质在生理pH下不带电荷,这使得它们比永久带正电荷的替代品更安全。它们促进mRNA的细胞摄取,并在酸化的内体中带正电荷后,通过破坏内体膜将核酸货物从内体释放到胞质溶胶中58。此外,它们为mRNA疫苗提供了强的佐剂活性61,62。mRNA-LNP疫苗固有的免疫刺激活性允许在不添加其他佐剂的情况下诱导强有力的保护性免疫应答。可电离的LNP作为有效的核酸载体和有效的免疫佐剂的发现是一个偶然发现和突破性的创新,使得成功的新冠肺炎mRNA疫苗mRNA-1273和BNT162b2的开发成为可能。核苷修饰的mRNA-LNP疫苗平台的成功在于使用最小免疫原性的mRNA来最大化蛋白质(抗原)的产生,结合LNPs有效递送货物和促进诱导强抗原特异性免疫反应的能力。
可电离的LNP的高度炎症性质可以被认为是一把双刃剑:虽然它对于诱导强烈的免疫反应是至关重要的,但它也可以限制它们的给药方式。鼻内疫苗给药以诱导粘膜免疫反应尤其具有挑战性。然而,Moderna的一项研究最近证明了鼻内递送的新型冠状病毒mRNA-LNP疫苗在仓鼠中的有效性63,表明优化可以 µg服鼻内给药的低耐受性和安全性。虽然可电离的LNP是最先进的制剂,但其他材料也用于实验性RNA疫苗,并可能为给药途径提供更大的灵活性。一种称为脂质无机纳米颗粒(LION,一种阳离子水包油乳液)的新型纳米载体被优化用于传递saRNAs64,然后用于mRNA疫苗开发的临床前和临床研究(NCT04844268,NCT05132907)64,65,66,67,68.
阳离子聚合物与mRNA形成复合物,该复合物可被靶细胞通过内吞作用吸收69。早期研究使用聚乙烯亚胺saRNAs复合物在小鼠中诱导针对流感病毒的免疫反应70。因为聚乙烯亚胺可能显示高水平的毒性71它不是广泛使用的RNA递送材料。树枝状聚合物(超支化聚合物树状结构)也在针对埃博拉病毒、流感病毒、寨卡病毒(ZIKV)和埃博拉病毒的临床前saRNAs疫苗研究中证明了功效弓形虫但是还没有在大型动物或人类中使用该平台的研究报道72,73。最近的一项开创性研究表明,阳离子生物可降解聚合物纳米颗粒(聚(胺-总裁-酯)(PACE))可用于在啮齿动物中通过鼻内途径用新型冠状病毒mRNA疫苗进行粘膜(肺)接种,以引发保护性免疫74。含胺端基的优化增强了mRNA从内吞颗粒的内体逃逸75和PEG含量的修饰进一步增加了PACE颗粒的mRNA递送76。该平台证明是安全的,因为在将PACE-mRNA递送给小鼠后,没有发现肝酶升高或肺部有任何损伤。最重要的是,作者证明了气管内递送的PACE-mRNA复合物被小鼠肺中的上皮细胞和抗原呈递细胞吸收,并表明他们的新型冠状病毒刺突编码疫苗可以在仓鼠中诱导保护性免疫。总的来说,新的PACE-mRNA平台对于诱导粘膜免疫反应是有价值的,这是限制呼吸道病原体传播的关键。大型动物研究和临床试验对于确认啮齿类动物中PACE-mRNA的令人印象深刻的发现是否适用于更高级别的物种非常重要。
mRNA疫苗的作用机制
在高水平上,传染病mRNA疫苗的作用机制相当简单:肌肉注射(在大多数情况下)编码一种或多种外源抗原的mRNA-LNP,由表达编码抗原的各种细胞类型吸收,然后被免疫系统识别并引发免疫反应。然而,许多关键问题仍然没有答案。哪些细胞表达抗原?它是如何到达淋巴器官的?先天免疫受体是如何触发的?mRNA疫苗接种后,LNPs在诱导免疫反应中的作用是什么?这些话题已经得到了广泛的讨论27;因此,下文将只简要概述最重要的发现。
抗原表达和转运的位置
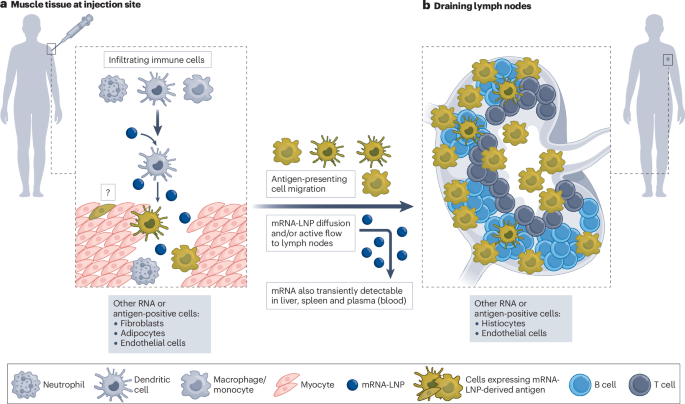
肌内注射mRNA-LNPs后,如临床前模型(包括非人灵长类动物(NHPs ))所示,可在脾脏、淋巴结和血浆中发现编码抗原的mRNA77,而在人类中78,79。mRNA在体内持续几天或更长时间,这取决于LNP的剂量和类型59,77。更重要的是,来自肌内递送的mRNA-LNPs的蛋白质表达发生在注射部位,但是在血浆(血液)、肝脏以及潜在的其它器官(包括次级淋巴器官)中也检测到一些蛋白质。对NHPs的研究发现,许多浸润性免疫细胞以及成纤维细胞和脂肪细胞在注射部位翻译蛋白质77,80,81。虽然在一些研究中已经报道了肌细胞中mRNA-LNP的摄取和蛋白质的表达,但其他研究显示肌细胞不参与。对saRNAs的早期研究确定肌肉细胞是表达和呈递抗原的主要细胞类型82。观察到的差异可能是由于LNP配方、细胞分析方案或mRNA平台的差异(非复制型mRNA对saRNAs)(图。2)。基于这些主要在NHPs中进行的研究,表达疫苗抗原的巨噬细胞和单核细胞可能迁移至引流淋巴结(dLN)以将抗原呈递至适应性免疫细胞77,80,81;然而,其他情况也是可能的。使用saRNAs疫苗的小鼠研究报道了骨髓来源的浸润性抗原呈递细胞,包括树突细胞,可能从转染的肌肉细胞获得抗原,然后将其呈递至适应性免疫细胞,包括CD8+t细胞83。LNPs也很可能通过淋巴系统被动运输到达dLNs(图。2)。NHPs经肌内或皮内免疫后,可在巨噬细胞、单核细胞和树突状细胞以及dLN中的组织细胞、网状细胞和内皮细胞中检测到抗原(蛋白)和mRNA77,80,81。在NHPs的dLN中的B细胞和T细胞中也观察到mRNA或抗原的存在,但水平较低77,81。在人类中,mRNA和/或抗原有效地运输到淋巴结并启动长达一个月的生发中心反应84,85,86.
a mRNA和抗原(由mRNA表达)被浸润的巨噬细胞、单核细胞、树突细胞、成纤维细胞和邻近的脂肪细胞以及内皮细胞吸收。mRNA疫苗接种后,肌细胞吸收mRNA或表达抗原的程度尚不完全清楚。b,抗原(可能通过迁移的巨噬细胞、单核细胞和树突细胞)和mRNA脂质纳米粒(LNPs)然后被运输到淋巴结,在那里巨噬细胞、单核细胞、组织细胞、不同的树突细胞亚群和与皮质窦、髓质窦、包膜下窦和小梁相关的内皮细胞表达抗原。引流淋巴结中的B细胞和T细胞也表达低水平的抗原(未示出)。尽管大多数疫苗抗原和/或mRNA在免疫后几天内变得检测不到,但在生发中心检测到疫苗mRNA已超过1个月,并且在人体中生发中心反应可维持数月。根据LNP的配方,也可以在血浆、肝脏、脾脏和潜在的其它地方瞬时发现mRNA。这个数字是基于在非人类灵长类动物和人类身上的发现77,78,80,81.
抗原表达的位置是高度相关的,因为它可能直接影响适应性免疫反应。例如,在新型冠状病毒血清反应阳性的个体中,肌肉注射新冠肺炎mRNA疫苗后,也观察到上呼吸道粘膜分泌型IgA的诱导,尽管这种反应并不强烈87。据认为,只有当抗原局部存在于粘膜表面时,才能诱导这种反应88。有可能少量的mRNA和/或抗原通过血液被转运到上呼吸道的表面,这得到了证明在血浆中存在抗原编码mRNA的研究的支持77,78.
mRNA和LNP的先天感知
需要疫苗成分的先天免疫信号来启动强大的适应性免疫反应。然而,非常强烈的免疫激活(特别是I型干扰素的产生)可能是有害的,因为它可以关闭mRNA的抗原表达并引起副作用。如上所述,未修饰和未纯化的IVT mRNA可以激活许多免疫传感器N1-甲基假哌啶和去除dsRNA的纯化显著降低了mRNA感应27,89.
除了编码抗原的mRNA,LNP载体的成分,尤其是可电离的脂质,也触发先天免疫反应。结果表明,含有重组蛋白的空的、可电离的LNP比含有重组蛋白的商品MF59样佐剂具有更强的佐剂活性,并且佐剂活性高度依赖于可电离的脂质61。在一项独立的研究中,用含有可电离脂质SM-102和核苷修饰mRNA的LNPs处理的人外周血单核细胞产生许多炎症细胞因子,包括IL-1β、IL-6、TNF、CCL5、VEGFA和G-CSF62。IL-1β特别令人感兴趣,因为它是宿主对感染或损伤的防御反应的关键介质,它的释放意味着炎症体的形成。虽然还不完全清楚LNP中的脂质是如何触发先天免疫激活的,但一个新的假设是内体膜的破坏可能起了作用。核内体逃逸是mRNA进入胞质溶胶的重要步骤,并由LNP内的脂质促进。然而,最近发现,这种内体损伤也通过半乳糖凝集素的识别和结合直接引发炎症。抑制半乳凝素或利用更可生物降解的可电离脂质结构可能提供未来降低免疫激活的策略90.
对小鼠BNT162b2的评估显示,它通过激活自然杀伤细胞和CD8来触发干扰素反应+根据基因敲除小鼠的研究,这种反应依赖于MDA5信号91。由于RIG-I和MDA5都通过线粒体抗病毒信号蛋白(MAVS)发出信号,这一发现与已报道的mRNA-LNPs的MAVS非依赖性免疫激活相反61。一项在人类中评估对BNT162b2的先天免疫反应的开创性研究发现了先天免疫的强烈激活,包括强大的抗病毒信号,特别是I型干扰素反应和RIG-I样信号的上调92。人类干扰素途径的诱导与观察到的这些疫苗的反应原性是一致的,该反应原性被认为是由干扰素反应触发的。这些研究的部分不同发现可能反映了疫苗制备(mRNA设计和生产,不同的LNP)和小鼠模型与人类之间免疫反应激活的可变性。
临床前和临床mRNA疫苗
由于新冠肺炎mRNA疫苗的成功,近年来关于mRNA疫苗的已发表研究的数量显著增加93。临床前mRNA疫苗不仅针对多种病毒,还针对某些细菌和寄生虫,包括蜱,其中一些疫苗已进入临床研究阶段(表1)。下面总结了mRNA疫苗最近的临床前和临床工作。随着新型冠状病毒mRNA疫苗被广泛研究24,93,94,将仅突出显示新冠肺炎疫苗报告中与临床高度相关的方面(方框1并在下面讨论)。“主动”免疫的努力将集中在,而mRNA编码的单克隆抗体的最新发现总结在方框中3和表2.
流感病毒
季节性流感病毒疫苗通常表现出次优的保护水平;因此,基于mRNA的流感病毒疫苗受到了极大的关注。与广泛使用的鸡蛋生产的疫苗相比,mRNA-LNP平台技术有两个重要的优势。首先,基于mRNA的季节性流感病毒疫苗可以快速设计和大量生产。与基于鸡蛋的疫苗不同,在mRNA疫苗生产过程中没有引入有害突变的风险95。此外,在疫情的情况下,易于制造和大规模生产是至关重要的。多价mRNA疫苗(靶向多种抗原)可以诱导广泛的免疫。早期的流感mRNA疫苗研究,经常使用单一抗原作为疫苗靶点95,展示了令人信服的临床前研究结果。在过去的5年中,下一代流感病毒mRNA疫苗已经使用合理设计的抗原和/或多种抗原来增加保护性免疫反应的广度3,5,6,8,96重要的是,临床试验的结果已经公布。Moderna于2015年开始进行I期试验,使用单价核苷修饰的mRNA-LNP疫苗,编码H10N8和H7N9流感病毒的血凝素97。当以50 µg或100 µg的剂量进行肌肉注射时,疫苗具有中等的免疫原性和良好的耐受性,但抗体滴度下降相当快。在过去的几年中,Moderna和其他公司已经开始了临床试验——也使用了多价方法(表1)而且一些发现最近已经公之于众。例如,在I-II期试验中,肌肉注射单剂量mRNA-1010(一种编码四种全长血凝素的四价季节性mRNA-LNP疫苗候选物,由世卫组织推荐用于2020-2021流感季节的流感疫苗)后,在所有试验剂量(20 µg、50 µg和100 µg)下,与灭活的季节性流感疫苗相比,诱导了更高的针对疫苗匹配的甲型流感病毒株的血凝素抑制(HAI)滴度和针对乙型流感病毒株的可比滴度98。有趣的是,mRNA-1010的III期试验的中期结果不太令人鼓舞;与季节性流感病毒疫苗相比,mRNA疫苗诱导了更多的不良事件(分别为70%对48%),并证明了对甲型流感病毒的相似免疫原性和对乙型流感病毒株的较差免疫原性99。这些结果表明,可能需要改进的mRNA平台技术和/或合理设计的免疫原来诱导优于目前许可的流感病毒疫苗诱导的免疫。此外,加入其他抗原如神经氨酸酶可能有助于提高诱导免疫的效力和广度。神经氨酸酶免疫原包括在mRNA-1020和mRNA-1030 (Moderna)以及正在进行人体试验的其他几种mRNA疫苗中(表1)。最后,值得一提的是,使用组合制剂的mRNA-LNP疫苗试验(例如,NCT05375838、NCT05596734、NCT05585632)正在进行中,不仅针对流感病毒,还针对新型冠状病毒病毒和RSV,并在人体中显示出前景(表1)。
呼吸道合胞体病毒
RSV在婴儿、幼儿、老年人和免疫功能低下的个体中引起严重的呼吸系统疾病100。RSV疫苗开发面临的一个主要障碍是无法诱导针对RSV融合(F)糖蛋白的强大中和抗体(nab ),融合(F)糖蛋白介导病毒和靶细胞膜的融合101。随着对RSV F的原子结构、构象变化和免疫原性的更好理解,有可能合理地设计靶向F的融合前构象并诱导强有力的nAb应答的抗原101。FDA于2023年批准了针对老年人和孕妇的基于蛋白质的疫苗(用于保护新生儿)(参考文献。102)。Moderna有几种RSV mRNA-LNP疫苗候选物处于临床开发阶段(表1)并且已经发表了一些结果。mRNA-1777的临床前评估成功后(参考文献。103),一种融合前稳定的RSV F-编码核苷修饰的mRNA-LNP疫苗,在I期临床研究中对其进行了评估104。该疫苗在所有疫苗剂量下(18-49岁成人25-200g,60-79岁成人25-300g)单次肌肉注射后耐受性良好,并以剂量依赖性方式诱导针对RSV A和B型的nab。此外,mRNA-1777引发了可测量的抗原特异性CD4+t细胞反应。一种被称为mRNA-1345的改进版本在一项大型III期试验中进行了测试,共有35,541名60岁或以上的参与者105。总的来说,在单剂量50 g mRNA-LNP后,该疫苗具有良好的耐受性,并证明了对具有至少两种体征或症状的RSV相关下呼吸道疾病的83.7%的功效,以及对具有至少三种体征或症状的疾病的82.4%的功效。其对RSV相关急性呼吸道疾病的有效率为68.4%。重要的是,mRNA-1345(名称为mRESVIA)最近获得了FDA的批准,成为Moderna的第II个批准产品106。该疫苗目前正在5-24个月的儿童(NCT05743881)和12-59个月的RSV血清阳性儿童(NCT04528719)中进行I期试验。
其他呼吸道病毒
人类偏肺病毒(hMPV)和副流感病毒(PIV)都引起呼吸道疾病,主要在婴儿、幼儿、老年人和免疫功能低下的个体中,并且没有许可的疫苗可用。Moderna开发了一种双价疫苗候选物mRNA-1653,它编码hMPV和PIV3的全长膜结合融合蛋白。在一项I期研究(NCT03392389)中,使用相对较高的疫苗剂量(75 µg、150 µg和300 µg)进行的两次肌内免疫接种(间隔4周)诱导了针对两种疫苗靶标的强有力的nAb反应107。有趣的是,在施用较高剂量的疫苗后,检测到相似的nAb滴度,但是不良事件是剂量依赖性的。在大多数初免-加强剂量组中,在施用首剂疫苗后13个月,针对hMPV A和B的nAb滴度仍高于基线,而这仅在针对PIV3的300 g组中观察到。还进行了另一项mRNA-1653 (NCT04144348)试验,包括12-59个月的成人和儿童,但结果未公布。
总的来说,mRNA-LNP平台可以成功地用于靶向呼吸道病毒,因为这种疫苗可以快速开发和生产,并且基于大量的临床经验(表1)—它们通常具有良好的耐受性,可以诱导强有力的nAb反应,并且可以针对快速变化的病毒进行调整(如果需要)。然而,需要 µg服几个限制,例如在人体中缺乏足够的抗体持久性或保护性粘膜免疫。
人类免疫缺陷病毒1
HIV-1感染影响了数千万人,每年登记的新感染人数约为150万108。HIV-1是最具挑战性的疫苗靶标之一,因为其遗传多样性、复杂的免疫逃避机制和包膜糖蛋白(抗HIV-1抗体的唯一靶标)的低免疫原性109。因此,即使经过40年的积极研究,也没有HIV-1疫苗可用于人类。最近发表的使用mRNA-LNP编码的合理设计的免疫原的研究在各种动物模型中显示了一些前景110,111,112,113,114,115。这些报告证明了使用嵌合免疫原在小鼠中引发针对HIV-1蛋白质组保守区域的多功能T细胞反应112使用saRNAs编码的纳米颗粒免疫原在转基因小鼠中诱导体细胞高度突变为广泛中和抗体谱系110以及使用各种工程化的Env mRNA-LNP在nhp中产生多功能抗体114。此外,在转基因小鼠模型中的研究表明,铁蛋白纳米颗粒mRNA-LNP疫苗可以诱导具有中和异源HIV-1分离物能力的抗体113和种系抗体靶向mRNA-LNP编码的免疫原成功引发了广泛中和的抗体前体111。一项开创性的NHP研究表明,共表达膜结合Env和猿猴免疫缺陷病毒gag蛋白的mRNA-LNP疫苗产生病毒样颗粒,刺激针对tier-2异源猿猴-人类免疫缺陷病毒的nab115.
总的来说,合理设计的免疫原的有希望的临床前发现为临床开发铺平了道路。事实上,Moderna正在进行一期临床研究(NCT05001373 ),评估上述纳米颗粒免疫原(mRNA-1644)110编码为mRNA-LNP以及第II个纳米颗粒构建体mRNA-1644 v2-核心。第II项试验(NCT05217641)使用mRNA编码的(mRNA-1574)合理设计的Env三聚体116在健康个体中(表1),美国国立卫生研究院也开始了一项I期研究(NCT05903339),利用mRNA编码的铁蛋白纳米颗粒为基础的免疫原。
黄病毒
黄病毒代表了主要由节肢动物传播的病原体的不同家族,具有显著的流行潜力。已经开发了使用减毒活病毒、化学灭活病毒或病毒载体的许可疫苗来对抗某些类型的黄病毒,例如日本脑炎病毒、蜱传脑炎病毒、黄热病毒和登革热病毒(DENV)117。人类疫苗还需要针对可能在人群中快速传播的黄病毒的其他成员进行开发118。新型疫苗将需要解决现有疫苗的一些缺点,例如缺乏保护性免疫(DENV)的广度或诱导不良事件(例如抗体依赖性增强)的可能性。能够诱导针对几种黄病毒的保护性免疫的多组分疫苗也是非常需要的。疫苗的持久性也很关键,因为nAbs水平的下降会加剧疾病。
有趣的是,首次发表的使用核苷修饰的mRNA-LNP疫苗的突破性研究(2017年)证明了该平台在小鼠和NHPs中诱导针对ZIKV的保护性免疫反应的能力119,120。在随后的几年中,基于mRNA或saRNAs的针对黄病毒抗原的平台在针对一系列靶标如ZIKV病毒、登革病毒、波瓦桑病毒和黄热病毒的临床前研究中显示出了前景121,122。Moderna开发了第一代和第II代ZIKV mRNA-LNP疫苗,分别命名为mRNA-1325和mRNA-1893。两种疫苗都编码ZIKV的前膜和包膜糖蛋白,它们仅在编码序列中有五个氨基酸不同,并且使用不同的前导序列123。在1/20的剂量下,mRNA-1893引发了与mRNA-1325相当的nAb滴度,可能是由于mRNA-1893形成病毒样颗粒的能力,并在NHPs中提供了对ZIKV攻击的完全保护。在黄病毒血清阴性或血清阳性健康个体的I期临床试验(NCT03014089和NCT04064905)中,在初免-加强设置(两次注射之间的4周)中测试了这两种疫苗124。总的来说,这些试验的发现与其他I期安全性和免疫原性mRNA疫苗试验相似;疫苗在较宽的剂量范围(10-250g)内耐受性良好,在较高剂量和第II次免疫后发现更多不良事件。尽管mRNA-1325诱导了较差的nAb反应,但mRNA-1893表现良好,并且所有剂量在黄病毒血清阴性和血清阳性个体中均诱导了长期(> 13个月的致敏后)nAb反应。
其他病毒
已经开发了针对多种其他相关人类致病病毒的候选mRNA疫苗。
几个RNA病毒家族的成员可以引起人类病毒性出血热,如沙粒病毒、布尼亚病毒、丝状病毒和黄病毒,并且没有针对这些病原体的疫苗。虽然大多数出血热病毒被认为是被忽视的热带疾病,但所有这些病原体对公共卫生的综合影响是巨大的。2014-2016年西非埃博拉病毒的更大爆发和潜在的大流行是主要关切。因为这些病毒群中的一些潜在疫苗抗原(例如,布尼亚病毒糖蛋白)具有复杂的折叠,并且难以使用标准方法表达,所以mRNA平台非常适合于针对这些病原体的疫苗开发。虽然有两种基于病毒载体的疫苗可用于对抗最相关的埃博拉病毒之一,扎伊尔埃博拉病毒,但人们对载体平台的安全性仍有担忧125证明使用替代技术开发新型埃博拉病毒疫苗的合理性。针对埃博拉病毒糖蛋白的自我复制和非复制mRNA疫苗在啮齿动物中诱导保护性免疫73,126,保证了未来在大型动物和潜在的人类身上的研究。用针对其它hfv(如拉沙病毒)的mRNA疫苗获得了类似的有希望的结果127, µg里米亚–刚果HFV67,128和严重发热伴血小板减少综合征病毒129,在啮齿动物疫苗研究中。
已经开发了针对具有疫情潜能的其他病毒如尼帕病毒和mpox病毒(MPXV)的候选mRNA疫苗。两项临床前尼帕研究——针对可溶性亨德拉病毒糖蛋白或与尼帕病毒糖蛋白单体共价连接的融合前稳定融合蛋白——分别在叙利亚仓鼠和小鼠中证明了保护性免疫130,131。Moderna正在对后一种候选疫苗(mRNA-1215)进行I期临床试验(NCT05398796)。针对2022年的病毒爆发,mRNA疫苗迅速产生并针对MPXV进行了测试。Moderna开发了一种疫苗候选物,针对与病毒附着有关的四种高度保守的MPXV表面蛋白(M1、A29、A35和B6 ),并在小鼠中证明了对相关痘苗病毒(VACV)感染的保护作用132。该公司已经开始对其MPXV mRNA疫苗候选物mRNA-1769进行一期试验(NCT05995275)。一种类似的方法——靶向病毒融合蛋白——证明了小鼠对VACV攻击的保护性免疫133。BioNTech还开发了MPXV候选疫苗,针对M1、A35、B6和H3的四价BNT166a,以及不含H3成分的三价疫苗BNT166c134。两种疫苗都保护小鼠免受VACV、进化枝I和进化枝IIb MPXV感染,并且BNT166a保护NHPs免受致命的进化枝I MPXV感染。BNT166a已经进入临床试验(NCT05988203)。
在过去的几十年里,使用灭活病原体的许可的狂犬病病毒疫苗是可用的,并且已经拯救了许多生命。然而,现有制剂的局限性包括生产成本相对较高,以及在流行地区需要多剂量。针对病毒糖蛋白的多种mRNA疫苗候选物已经在小型和大型动物中显示出前景16,135,136。CureVac测试了其未修饰的mRNA-LNP候选疫苗CV7202(参考文献。137),在I期试验(NCT03713086)中发现,该疫苗在人类中诱导nAbs,但在初免-加强方案中只有低剂量疫苗(1 g和2 g)具有良好的耐受性。改用这种疫苗的核苷修饰版本可能允许使用更高的疫苗剂量来增加引发的免疫反应,而不会诱导更多的不良事件。
人巨细胞病毒(HCMV)导致常见的先天性感染,在免疫功能低下的个体中尤其危险。在开发安全有效的HCMV疫苗方面已经投入了巨大的努力。几种临床前mRNA疫苗候选物使用核苷修饰的mRNA-LNP来靶向病毒融合糖蛋白B和/或五聚体复合物,所述五聚体复合物是进入和诱导小鼠、兔和NHPs中的nab和细胞免疫反应所必需的4,138,139,140。Moderna测试了mRNA-1647(一种多价HCMV mRNA-LNP疫苗,靶向糖蛋白B和五聚体复合物),在第0、2和6个月以180 g的剂量进行肌肉注射,在I期试验中141,在血清阴性和血清阳性试验参与者中发现了多功能和持久的HCMV特异性抗体应答,与比较物(一种MF59佐剂化的糖蛋白B蛋白疫苗)相比,具有较低的糖蛋白B特异性IgG应答,但总体nAb和抗体依赖性细胞毒性应答较高。
针对生殖器疱疹(一种由1型单纯疱疹病毒(HSV-1)和HSV-2引起的非常常见的性传播疾病)的核苷修饰的mRNA-LNP疫苗的开发也有报道142,143,144,145。一种理想的抗单纯疱疹病毒疫苗可以防止疼痛的生殖器损伤,减少或消除病毒传播,这种病毒传播有传播给伴侣和新生儿的风险。一种三价HSV-2 mRNA-LNP疫苗,靶向进入分子糖蛋白gD2和两种免疫逃避分子糖蛋白gC2和gE2(参考文献。142),保护小鼠和豚鼠免受生殖器损伤,并减少病毒脱落。在后续研究中,疫苗保护小鼠免受HSV-1生殖器损伤和潜伏感染144,并为新生小鼠提供保护145。该配方名为BNT163,目前正在由BioNTech (NCT05432583)进行I期剂量递增、免疫原性和安全性试验。Moderna也在进行一期试验(NCT06033261 ),使用HSV-2 mRNA-LNP候选物mRNA-1608作为肌肉注射的初次加强疫苗。
靶向重要人类病毒病原体的其他几种有前景的mRNA疫苗候选物正处于临床前或临床开发中,只有有限的或没有可用的公开数据,例如抗乙型肝炎病毒的候选制剂146,丙型肝炎病毒147,爱泼斯坦-巴尔病毒(EBV)148水痘带状疱疹病毒149,150和诺如病毒。Moderna正在I期试验中研究临床EBV疫苗候选物mRNA-1189(针对gp42、gp220、gH和gL糖蛋白,NCT05164094)和mRNA-1195 (NCT05831111 ),以防止传染性单核细胞增多症和EBV感染的罕见但有时危及生命的后果或长期后遗症,如多发性硬化151。Moderna还在I期试验中研究针对诺如病毒感染的mRNA疫苗mRNA-1403(三价)和mRNA-1405(五价)(NCT05992935)。最后,Moderna (mRNA-1468,靶向糖蛋白E)和BioNTech–Pfizer(bnt 167,靶向糖蛋白E)都有针对水痘带状疱疹病毒的I期临床候选疫苗(NCT05701800和NCT05703607)。
细菌
鉴于许多人类病原性细菌中抗微生物剂耐药性的增加,开发安全有效的细菌疫苗是有保证的。然而,疫苗开发对细菌比对病毒更具挑战性,因为潜在的疫苗靶标(细菌基因组通常比病毒基因组大得多)、非蛋白疫苗靶标(糖;mRNA疫苗不能用于靶向碳水化合物)和高抗原性变异152。此外,与病毒疫苗相比,细菌疫苗所需的疫苗诱导的免疫反应通常在性质上有所不同。nab的诱导通常足以抵抗病毒,肺炎链球菌, 大肠杆菌, 金黄色葡萄球菌和抗体介导的吞噬作用等免疫机制有效靶向153。此外,虽然不是大多数病毒靶所绝对需要的,但诱导强大的CD8+t细胞反应对于有效靶向胞内细菌通常是至关重要的153.
研究表明,mRNA疫苗可能适合于靶向细菌。鼻内递送的未修饰的裸mRNA已被用于诱导针对结核分枝杆菌(肺结核)154,其感染影响全世界超过10亿人。目前可用的结核病疫苗卡介苗有效性低,持久性差,并经常诱发不良事件155;因此,生产更安全和更有效的结核病疫苗是尚未满足的临床需求。saRNAs–脂质无机纳米粒子平台编码四种结核抗原(esxV、RpfD、PPE60和Ag85B)的融合蛋白,显示了一定程度的保护作用米(meter的缩写))肺结核小鼠感染66。saRNAs平台也被用来开发临床前疫苗链球菌A组和B组156.
最近,一种核苷修饰的mRNA-LNP疫苗编码环状置换F1的工程版本(cp-caf1)鼠疫耶尔森菌在小鼠中施用单剂量后,抗原显示出诱导强烈的体液反应和针对致死性鼠疫感染的保护157。一个优雅的基于免疫肽组学的方法被应用于确定理想的疫苗靶点和开发mRNA疫苗李斯特氏菌,一种食源性细胞内细菌158。通过在mRNA-LNPs中编码高度呈递的抗原(选自多种细菌蛋白),强大的CD8+t细胞反应和保护性免疫利斯特氏杆菌属实现了小鼠攻击研究中的感染。铜绿假单胞菌是一种关键的人类病原体,具有多重耐药菌株,是呼吸机相关性肺炎的重要原因,也已成为目标159。一种组合mRNA-LNP疫苗,包含融合蛋白膜孔蛋白F(OprF)-脂蛋白I (OprI)和V-抗原(PcrV的一部分页(page的缩写) 铜绿假单胞菌I型分泌系统),在全身感染小鼠模型中诱导保护性免疫反应。此外,一种针对莱姆病(美国最常见的媒介传播疾病)的mRNA-LNP疫苗,是利用布氏疏螺旋体作为疫苗靶,在小鼠中证明了诱导强有力的细胞和体液免疫应答以及保护免于细菌攻击160。还在啮齿动物中研究了针对蜱唾液蛋白的mRNA-LNP疫苗,以预防蜱传疾病,如莱姆病7,161,162。Moderna和BioNTech正在进行临床试验,分别开发针对莱姆病和结核病的mRNA疫苗。mRNA-1975(一种七价制剂)和mRNA-1982(一种单价疫苗),均由Moderna公司生产,以OspA为目标,正处于I-II期开发阶段(NCT05975099)。BNT164a1和BNT164b1是BioNTech的结核疫苗候选物,处于I期试验中(NCT05547464)。
寄生虫
致病性寄生虫是一组不同的真核生物,影响着数亿人,每年造成100多万人死亡163。然而,众所周知,针对这些病原体的疫苗开发非常困难,这主要是由于作为疫苗靶标的真核细胞的复杂性以及它们逃避先天和适应性杀菌免疫反应的能力。越来越多的临床前研究证明了mRNA疫苗提供抗寄生虫病保护的能力。例如,开发了针对专性细胞内寄生虫的保护性临床前mRNA疫苗T.贡迪弓形体病的病原体利什曼原虫利什曼病的原生动物病原体73,164。抗疟疾的候选mRNA疫苗也已产生,并已进入临床开发。
疟疾感染是世界上最主要的健康问题之一,每年造成数亿例临床病例和数十万例死亡165。疟疾疫苗可分为三类:针对子孢子或肝期寄生虫的红细胞前疫苗,针对裂殖子或受感染红细胞的血液期疫苗,以及针对配子体和蚊子期寄生虫的传播阻断疫苗166。一种以蛋白为基础的佐剂性红细胞前疟疾疫苗,针对恶性疟原虫(PfCSP)已被批准用于人类,但尽管它明显有利于公众健康,但仍有提高其有效性的空间166。近年来,多项临床前研究为核苷修饰的mRNA疫苗引发疟疾保护的能力提供了概念证明恶性疟原虫和间日疟原虫。疫苗抗原包括PfCSP167,168富含谷氨酸的蛋白质页(page的缩写) 恶性疟(PfGARP)169,以及恶性疟原虫okinete表面(Pfs) 25和230D1蛋白167,170针对恶性疟病原体分别处于红细胞前期、血液和传播阶段。重要的是,BioNTech (NCT05581641)于2022年开始了mRNA编码的PfCSP疫苗候选物BNT165b1的临床开发。
一种saRNAs疫苗,编码疟原虫巨噬细胞移动抑制因子(PMIF),调节宿主对疟疾的炎症反应171改善肝期和血期的控制疟原虫并且在致死的鼠模型中提供了完全的保护以免再次感染。在一项机理研究中,静脉注射编码核糖体蛋白L6 (RPL6)疟疾抗原的修饰的自然杀伤T细胞激动剂α-半乳糖神经酰胺佐剂的基于脂复合物的mRNA疫苗,诱导小鼠肝脏内存在记忆T细胞并诱导保护作用172.
恶性疟原虫与疟疾相比,疟疾造成了更多的死亡恶性疟原虫(指引起疟疾的单细胞动物)后者影响全世界更多的人(超过30亿),并且目前没有批准的疫苗173. 恶性疟原虫(指引起疟疾的单细胞动物)疟疾也更难控制和消灭,因为它处于休眠状态,在重新激活之前会潜伏数月到数年174。最近的一项小鼠研究使用Pvs25作为疫苗抗原开发了传播阻断疫苗,并证明了优化的全长Pvs25编码核苷修饰mRNA-LNP疫苗候选物优于对比佐剂Pvs25蛋白疫苗,并引发了更强和更持久的功能性免疫175.
总体而言,最近在基于mRNA的疟疾疫苗领域取得了重大进展,这为在可预见的未来人类可以获得这种疫苗带来了希望。
挑战、局限和机遇
尽管核苷修饰的mRNA-LNP平台技术在新冠肺炎疫情期间被证明是非常有效的,并且是我们为疫情做准备的医疗设备的一个重要部分,但是目前这一代的mRNA疫苗具有局限性,需要 µg服这些局限性以进一步增加这种疫苗形式的价值。值得注意的是,这些挑战中的许多并不是mRNA疫苗所特有的,也适用于其他疫苗平台。
临床前模型的局限性
免疫原性
疫苗开发(包括mRNA-LNP疫苗)的一个普遍问题是临床前模型对人类免疫原性的次优预测值。一个明显的例子是Moderna开发的H10流感病毒候选疫苗。基于血凝素的H10疫苗在雪貂中诱导了非常高的HAI滴度,达到约1:3,000,这通常很难用传统的疫苗平台诱导97,176。同样的疫苗在人体内诱导了大约1:100的短暂的HAI滴度,该滴度在6个月内减弱97,176。类似地,基于mRNA-LNP的季节性流感病毒疫苗在不同的动物模型中诱导非常高的中和抗体滴度177但似乎与人类常规季节性流感病毒疫苗(具有更好的耐受性)相当,在某些情况下甚至更差98。新冠肺炎mRNA-LNP疫苗也报道了类似的发现;它们在小鼠体内诱导强烈而持久的免疫反应178但人类的免疫反应和动力学却不那么令人印象深刻179。NHP模型似乎更好地反映了疫苗诱导的人类免疫反应;然而,它们很昂贵,它们的使用引起了伦理问题,并且在某些情况下,疫苗诱导的保护作用无法评估,因为nhp对某些感染(包括季节性流感病毒)是难治的。
安全性和反应性
在人类中,mRNA-LNP疫苗引发全身性炎症反应,这是小鼠和其他动物模型研究没有预测到的。这一发现至少部分是由于IL-1受体信号传导的种间差异62。这些不良事件(称为反应原性)有时相对强烈,包括发热、不适、头痛、身体疼痛等。反应原性在年轻个体中更普遍180并且通常在施用第2剂mRNA疫苗后更强180,表明不仅涉及先天免疫反应,还涉及适应性免疫的作用。有趣的是,据报道,与BNT162b2相比,mRNA-1273诱导了更强的反应原性。180),可能是由于剂量、mRNA生产程序和LNP配方的差异。疫苗引发的不良事件可能严重到导致工作时间损失181这不仅会对个人未来接种疫苗的意愿产生负面影响,还会造成经济负担。一些非常罕见的副作用,包括过敏反应(也见于其他疫苗)182和心肌炎,多见于12至24岁的男性183,就更成问题了。在mRNA-1273中也观察到延迟的大的局部反应(参考文献。184)和皮疹最近在HIV-1 mRNA-LNP疫苗(Moderna)的临床试验中被报道185。为了使mRNA-LNP疫苗在常规的非疫情环境中更容易被接受,这种模式的安全性和反应原性应该得到改善。修改LNP配方和改进mRNA的设计和生产可能会抑制mRNA的先天免疫识别186。然而,必须注意的是,反应原性和免疫原性通常是密切相关的187安全性更高的疫苗可能会导致更弱的免疫反应。
一个关键的挑战是缺乏相关的动物模型来评估疫苗诱导的副作用。物种之间的先天免疫受体存在细微差异,这使得很难根据动物模型中获得的数据预测人类的反应原性。此外,对许多病原体的预先存在的免疫和人类免疫激活的各种状态可能影响反应原性,并且在动物中模拟这些条件是具有挑战性的。确定和调查非常罕见的副作用(如心肌炎或过敏反应)甚至更加复杂,因为它们的发生率通常非常低(每100,000剂疫苗中很少发生事件)188。因此,即使是III期临床试验也不足以获得这方面的相关信息。
诱导所需的免疫反应
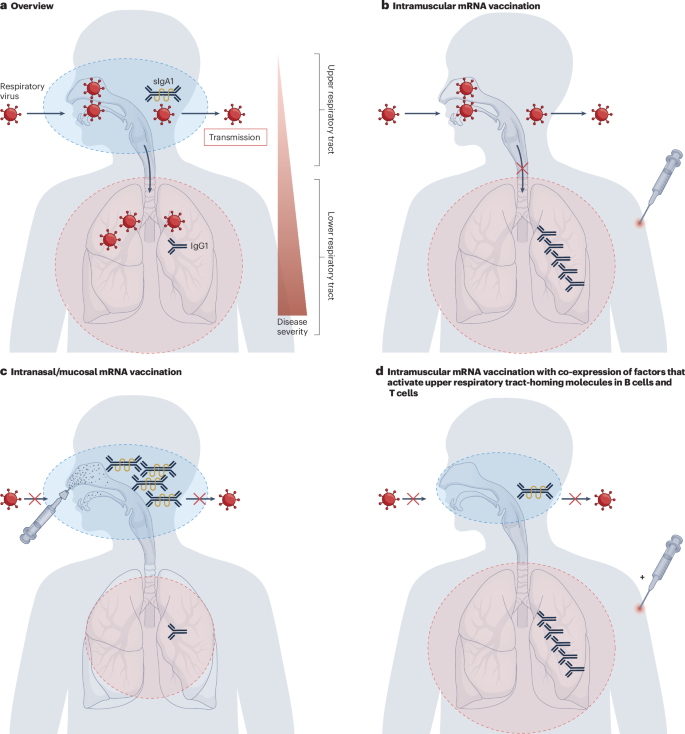
粘膜免疫
肌内或皮内注射疫苗通常是上呼吸道(URT)粘膜免疫的不良诱导剂189。然而,URT中的局部免疫对于对抗呼吸道病毒感染是重要的,因为该部位是这些病原体的入口以及传播部位(图。3)。在新冠肺炎疫苗开发的早期,人们注意到注射的mRNA疫苗可能对人类有症状的疾病有很好的保护作用,但对感染本身可能没有强有力的保护作用,这在这些疫苗的临床前开发期间已经在动物模型中观察到190。现在很清楚,这个预测是准确的。虽然新冠肺炎mRNA疫苗可以在以前感染过新型冠状病毒的个体中引发一定水平的粘膜免疫(参考文献。87),与新型冠状病毒感染相比,它们通常不会在URT中诱导强烈的抗体反应191。这是有问题的,因为URT中的粘膜免疫与防止新型冠状病毒感染有关(参考文献。192,193,194)等呼吸道病毒。一个关键的挑战是通过诱导分泌型IgA和常驻记忆T细胞,在URT中安全诱导强粘膜免疫反应的mRNA疫苗的配制195,196(图。3)。解决这一问题的一个策略是开发能够通过鼻内或口服给药安全有效地递送至粘膜表面的mRNA制剂。目前大多数基于LNP的mRNA制剂由于吸收差和毒性而不适用于这种递送途径197。其他类型的mRNA递送分子,如聚合物,可能更适合于此目的74。事实上,已经通过递送的各种改变进行了粘膜mRNA疫苗制剂的首次成功尝试,这些有希望的研究将有望为这一重要的疫苗接种途径提供一条前进的道路63,74,198,199。第II种策略可以是使用注射的mRNA疫苗,除了抗原之外,该疫苗还编码驱动B细胞和T细胞对粘膜部位反应的因子或甚至归巢分子。然而,这种方法首先需要阐明城市轨道交通的归位机制200。在对粘膜表面细菌感染免疫的情况下,驱动T辅助17 T细胞应答的细胞因子或转录因子的共表达也可能是有益的。
a上呼吸道的表面是呼吸道病毒的主要进入点,而下呼吸道中的病毒复制通常与严重疾病有关。局部产生的分泌型IgA1 (sIgA1)被认为是保护上呼吸道的主要抗体种类,而血清IgG1被认为是保护下呼吸道的主要抗体种类。b肌肉注射mRNA脂质纳米粒疫苗可诱导强烈的全身性IgG反应;这种IgG中的一些也短暂地存在于上呼吸道中。然而,局部sIgA1反应没有被强烈诱导,因此病毒传播没有被有效阻断。c粘膜mRNA疫苗的开发,例如,使用新的递送载体如聚合物或较少炎症的脂质纳米颗粒,可以允许在上呼吸道中安全地诱导局部抗体和细胞免疫反应。d在B细胞和T细胞中表达的编码上呼吸道归巢分子的mRNA的共递送甚至在肌内mRNA接种后也可能引发有效的粘膜免疫应答。部分免疫反应c和d在突破性感染的情况下也有可能阻断进一步的传播。
预存免疫和印记
新冠肺炎mRNA-LNP疫苗在大多数免疫个体中引发了强烈的保护性免疫应答201。给完全无免疫的人群接种疫苗是一种罕见的情况,大多与新的疫情病原体的出现有关。人类通常对病原体(包括流感病毒、呼吸道合胞病毒和现在的新型冠状病毒病毒)具有广泛而复杂的预存免疫,这种预存免疫会以积极和消极的方式影响对疫苗接种的免疫反应。在对新型冠状病毒刺突蛋白具有广泛预存免疫力的个体中,额外的mRNA疫苗加强剂量具有小得多的加强效果179(在流感中也描述了预先存在的抗体对疫苗接种的免疫反应的这些抑制作用189)。此外,预先存在的免疫可能影响免疫反应的质量和特征。基于新型冠状病毒变异的mRNA疫苗于2022年推出,因为该病毒的抗原性发生了变化。当更新的疫苗用于先前暴露于祖先新型冠状病毒刺突的个体时,大多数反应与新型冠状病毒的祖先毒株的刺突蛋白交叉反应(参考文献。202,203,204,205,206),几乎没有诱导出变异体特异性的新生免疫202,203,204,205,206。这让人想起backboost207或原始抗原sin型208针对流感病毒描述的现象,其中暴露于新的变异病毒诱导针对新毒株和生命早期遇到的毒株的交叉反应性反应,代价是对新毒株的全新毒株特异性反应。虽然预先存在的免疫和缺乏强有力的从头应答的这些问题是所有疫苗平台的普遍现象和问题,但是在具有预先存在的免疫的动物模型中测试mRNA疫苗以刺激它们的成功部署将是有帮助的。此外,由于mRNA制剂也可以设计为共表达细胞因子和趋化因子,该平台可以独特地适合于开发疫苗,该疫苗特异性地结合初始B细胞而不是记忆B细胞,以驱动更好的从头变体特异性反应。这不仅对新型冠状病毒很重要,对流感病毒疫苗也很重要189.
疫苗诱导的免疫反应的持久性
mRNA-LNP疫苗引发的免疫反应的持久性一直是争论的重要问题。新型冠状病毒mRNA疫苗诱导强烈的成浆细胞反应,导致首次感染新型冠状病毒病毒个体的抗体滴度显著增加84。成浆细胞是在外周循环并产生抗体的短命B细胞,但它们仅活跃约2周209。抗体水平随后开始下降,IgG半衰期约为30天210。由于初始mRNA疫苗诱导的抗新型冠状病毒抗体水平较高,这种下降似乎很明显,免疫后6个月内滴度通常下降10-20倍179。用腺病毒载体疫苗平台观察到较慢的抗体衰减211;然而,这些不会诱导最初的高抗体峰值211。事实上,虽然由新冠肺炎mRNA疫苗诱导的刺突特异性抗体滴度开始下降,但它们最终变得稳定。这些稳定的长期滴度是由骨髓中不同的B细胞亚群产生的,称为长寿浆细胞,通常持续终生179。还观察到,mRNA-LNP疫苗接种在接种人的淋巴结中引发了令人惊讶的长时间(几个月)的生发中心反应84,86。这些可能有助于增加长寿浆细胞的频率,但这些持续的生发中心反应的意义仍不清楚。总的来说,虽然mRNA疫苗诱导的抗体应答在最初有明显的减弱,但这可能更多的是最初诱导的高抗体峰值的影响,而不是mRNA疫苗实际上不能诱导持久的免疫。然而,在mRNA疫苗接种后维持高抗体水平以保证长期保护是可取的。通过优化疫苗配方,将更多的B细胞从生发中心反应导向骨髓,这可能是可行的。例如,下一代合理设计的LNP可以精确靶向关键免疫细胞类型,并最终诱导所需的免疫反应。其他可能性是将具有额外佐剂活性的分子掺入LNP以进一步增加其效力212或指导B细胞成为长寿骨髓浆细胞的转录激活剂、细胞因子或归巢分子的共表达。
CD8+t细胞反应
虽然中和抗体和结合抗体与许多病毒疫苗的保护作用相关,但细胞毒性T细胞反应也可能与保护作用相关(例如,对于流感病毒213)。据信CD8+在抗体反应不能中和病毒的情况下,t细胞反应保护免受新型冠状病毒诱发的严重新冠肺炎的进展214(通常见于抗原性漂移的变体)。因此,核苷修饰的mRNA疫苗的另一个重要目标是诱导强大的CD8+人类的t细胞反应。流感病毒核苷修饰的mRNA疫苗诱导强大的CD4+t细胞(和抗体)反应,但中等CD8+小鼠的t细胞反应215。这些观察结果在一定程度上适用于人类基于mRNA的新冠肺炎疫苗,在这些疫苗中,通常较弱的刺突特异性CD8+与强健的CD4相比,t细胞反应被激发+t细胞诱导216(虽然CD8+t细胞似乎被充分激发以被突破性感染强烈激活)217。这与未经修饰的非复制型mRNA和saRNAs疫苗形成对比,后者已知能驱动强大的CD8+t细胞反应,可能是因为它们能够诱导更高水平的I型干扰素,这有助于诱导更强的细胞免疫反应218。CD8如何仍有待探索+核苷修饰的mRNA疫苗可以更好地参与t细胞,无论是特定细胞因子的共表达还是mRNA设计和生产或LNP化学的变化219可能是解决这个限制的关键。
针对递送载体的抗体生成
mRNA-1273和BNT162b2不仅诱导针对编码疫苗抗原的适应性免疫反应,而且还诱导针对LNP携带者的适应性免疫反应,这有点令人惊讶。LNPs表面上的PEG成分已被鉴定为脱靶抗体反应的主要原因220,221,222,223。与BNT162b2制剂相比,用mRNA-1273制剂诱导了更高水平的抗PEG抗体水平,这可能是由于疫苗制剂的不同组成220。虽然尚不清楚这些反应是否总是有害的,但进一步监测这一现象并探索潜在的后果是重要的。针对LNP的抗体可能通过去除LNP或将其导向不同的Fc受体携带细胞类型来影响LNP的摄取223;这可能导致使用相同的LNP平台重复给药的效率问题。此外,抗PEG抗体水平的增加可能会导致某些患者群中使用的其他聚乙II醇化药物的更快清除(并因此降低有效性)224。总之,LNP不是免疫惰性分子,可以成为适应性免疫反应的目标。然而,存在PEG的替代物,其可能具有较低的免疫原性。
疫苗配方和选择
多组分疫苗制剂
多价mRNA-LNP疫苗的一个有趣的方面是mRNA编码的抗原的异源多聚化的潜在问题,这个方面还没有被彻底检查。例如,当mRNA疫苗在同一细胞中表达两种(或多种)不同的新型冠状病毒变体刺突蛋白时,可以形成由来自不同变体的单体组成的三聚体。在含有四种不同类型的血凝素(H1、H3和两种B型血凝素)的基于mRNA-LNP的流感病毒疫苗中,可能会出现类似的问题。异源三聚体的形成可能导致所得蛋白质的错误折叠,从而可能不能如实反映糖蛋白表面的中和或保护性表位。这种理论上的担忧尚未经过实验研究,但可能是祖传的BA.5II价新冠肺炎mRNA疫苗与XBB.1.5单价疫苗相比性能较差的原因之一225,并且也可能在临床测试的基于mRNA的流感疫苗的B型流感病毒成分的较低免疫原性中起作用98。此外,多价或多组分疫苗的一种组分可能比其他组分发挥免疫优势。这已在其他疫苗类型中有所描述,并可能通过调整疫苗中各种mRNA的比例来 µg服,例如,降低编码主要成分的mRNA的量和/或增加亚主要成分的量。
剂量选择
mRNA疫苗临床开发的一个重要方面是剂量选择。最初的新型冠状病毒mRNA疫苗临床试验包括100 µg mRNA或以上的剂量226,227。第一个版本的mRNA-1273的剂量为100 µg mRNA20,但用于加强剂量的较新版本的剂量减少至50 µg(参考。228),有可能减少不良事件。50 µg mRNA剂量似乎是目前人类预防性疫苗耐受性的上限(然而,改变mRNA和LNP化学可能有助于改善它),这代表了多价mRNA-LNP疫苗中包含的抗原成分的最大数量的限制。例如,用于流感病毒的八价mRNA-LNP疫苗候选物,包括四种血凝素和四种神经氨酸酶构建体,目前正在开发中(NCT05333289)。假设使用相同量的不同组分,为了不超过50 µg疫苗总剂量,每个构建体仅可使用6.25g mRNA。尚不清楚这些低剂量是否能在人体内诱导足够强大和持久的免疫反应。在未用药人群中,10 µg新型冠状病毒mRNA剂量诱导的免疫反应明显低于30 µg剂量227,表明临床使用的mRNA疫苗存在效价限制,至少对于目前的制剂是如此。 克服这些障碍对于开发泛呼吸道病毒疫苗至关重要,这种疫苗可能含有来自流感病毒、RSV、新型冠状病毒、hMPV和不同副流感病毒以及季节性冠状病毒的抗原。更简单的多价制剂,例如含有流感病毒和新型冠状病毒(或甚至RSV)抗原的mRNA-LNP疫苗,已经在开发中(表1)。
对抗原变化的反应
mRNA疫苗的一个关键优势是其灵活性,特别是对于需要频繁更新的疫苗,如流感病毒疫苗和新型冠状病毒疫苗。基于灭活病毒的流感疫苗每年更新一次,以反映流行毒株229。根据监测和预测,每年2月选择北半球下一个季节的疫苗配方成分(为南半球生产的疫苗也有类似的过程)229。更新疫苗的生产需要大约6个月的时间,在此期间,有时很明显选择的疫苗毒株不是最佳的,可能与流通毒株不匹配,对疫苗效力有显著的负面影响230,231。新型冠状病毒mRNA疫苗已在大约2个月内更新和生产。因此,季节性流感病毒疫苗的mRNA平台的使用将潜在地允许更晚的毒株选择,并且能够开发比使用传统平台生产的疫苗更好地匹配流通毒株的疫苗。
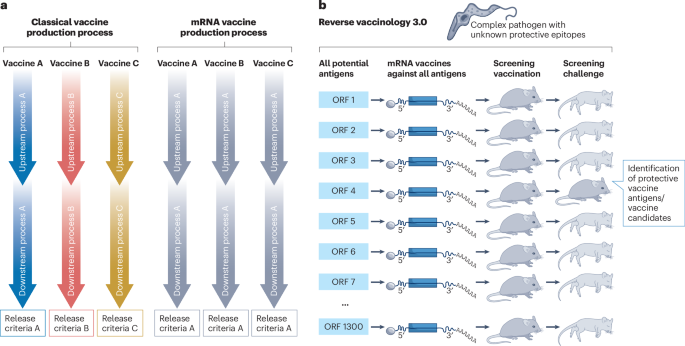
反向疫苗学3.0
当新疫苗进入临床开发时,通常只测试一种疫苗抗原,这是由于良好生产规范生产过程的高成本和复杂性,通常需要针对所选抗原进行专门设计232(方框4)。这种抗原可以以不同的剂量或与不同的佐剂组合进行测试,但是包括抗原的额外版本通常成本过高。mRNA疫苗 µg服了这一限制,因为即使抗原序列不同,也可以使用相同的方法进行生产(方框4)。mRNA疫苗技术还允许靶向大的多亚单位抗原或病毒表面抗原,由于存在几个跨膜结构域(例如,布尼亚病毒GnGc蛋白),这些抗原很难作为重组蛋白产生。在临床前试验中测试抗原的许多不同版本或病原体的许多不同抗原,同时对几种候选抗原进行临床测试,对于mRNA疫苗来说也是现实的。然后可以根据在人体试验中获得的数据选择最佳候选疫苗。辉瑞-生物科技新冠肺炎疫苗的选择过程中采用了这一流程,在对多个不同版本进行临床测试后,BNT162b2被选为主要候选疫苗227。在未来,mRNA疫苗的这一显著优势可能会导致针对表达许多不同蛋白质的病原体的疫苗开发的突破,其中最佳疫苗靶标未知,包括结核病,不同的单细胞和多细胞寄生虫,包括疟原虫和锥虫物种,甚至像非洲猪瘟病毒那样基因组庞大、保护性抗原未知的DNA病毒。这个“逆向疫苗学3.0”过程(图4)的工作原理类似于“反向疫苗学”过程脑膜炎奈瑟球菌B型疫苗233,但会明显更快,并具有更高的通量(“反向疫苗学2.0”被定义为基于免疫系统和抗原之间相互作用的结构分析的合理疫苗设计234)。重要的是,一旦使用mRNA技术鉴定出正确的保护性靶抗原,最终的疫苗制剂可能基于另一种疫苗平台(例如,重组蛋白疫苗)。
疫苗公平和全球获取
mRNA疫苗的一个重要挑战是全球疫苗公平性。在新冠肺炎疫情期间,低收入和中等收入国家获得mRNA疫苗的机会不是最理想的,而且被推迟了235,236。低收入国家经常获得病毒载体和灭活的基于病毒的新型冠状病毒疫苗(或者根本没有疫苗)237;这是由于定价、获取、超低温储存配送网络的可用性、疫苗民族主义和疫苗外交238。即使在高收入国家,mRNA疫苗冷冻长期储存的要求对疫苗的推广也是一个问题。在4℃甚至室温下稳定的mRNA疫苗的开发正在进行中,这种热稳定的mRNA疫苗可以进一步增加mRNA疫苗技术的全球影响239,240,241,242,243.
对于全球可用的mRNA疫苗技术来说,在全球范围内建立区域性的开发和制造能力也很重要。令人鼓舞的是,许多传统疫苗生产商和低收入国家的新公司已经开始开发自己的mRNA疫苗配方和设施244。已经开始采取措施加强这一努力245,246但是一些mRNA疫苗制造商已经缩减了向LMICs转移技术的努力247。关于mRNA和LNP技术的潜在知识产权问题能否得到解决,以促进LMIC疫苗生产商的准入,还有待观察。mRNA疫苗研发者和生产者的全球分布无疑将提高疫情的防范能力,并使低收入国家能够依靠自己的疫苗,而不是依赖高收入国家及其疫苗外交。
结论和展望
虽然基于RNA的疫苗,特别是核苷修饰的mRNA-LNP制剂,多年来显示出巨大的前景,但正是新冠肺炎·疫情将它们推向聚光灯下,并导致了第一个获得许可的mRNA疫苗(方框1)。然而,我们远未实现RNA疫苗的全部潜力,需要进一步优化以解决当前的限制。在这方面,有机会开发新的RNA疫苗制剂,其具有增强的免疫原性和降低的反应原性,更大的稳定性,并具有诱导粘膜免疫反应的能力。除了病毒,还需要针对人类病原性细菌、真菌和寄生虫的mRNA疫苗,以及能够同时针对几种不同病原体进行保护的疫苗。mRNA疫苗设计和制造的灵活性和简易性可能会彻底改变抗原选择和疫苗开发,并可能为以前难以捉摸的病原体设计疫苗。对mRNA疫苗作用机制的深入理解将指导下一代mRNA疫苗的设计。
mRNA疫苗技术为疫苗开发、免疫接种和疫情病毒预防的未来带来了巨大的希望,并且已经为疫苗学的新黄金时代做出了贡献。
参考
Shattock,A. J .等,《疫苗接种对改善生存和健康的贡献:扩大免疫方案50年的模拟》。柳叶刀 403, 2307–2316 (2024)。
疫苗学指南:从基本原理到新发展。纳特。免疫Rev。 21, 83–100 (2021)。
一种多靶向、核苷修饰的mRNA流感病毒疫苗为小鼠提供了广泛的保护。摩尔。Ther。 28, 1569–1584 (2020)。
引发有效体液免疫和细胞免疫的多抗原人类巨细胞病毒mRNA疫苗。疫苗 36, 1689–1699 (2018)。
评估一种四价核苷修饰的mRNA疫苗对2型流感病毒的保护作用。继续。国家科学院。Sci。美国 119,e2206333119 (2022)。
抗乙型流感病毒的五价广泛保护性核苷修饰mRNA疫苗的开发。纳特。Commun。 13, 4677 (2022)。
赛义德等人的mRNA疫苗诱导蜱的抵抗力,防止莱姆病病原体的传播。Sci。Transl。医学。 13,eabj9827 (2021)。
一种针对所有已知流感病毒亚型的多价核苷修饰mRNA疫苗。科学 378, 899–904 (2022)。
Tseng,H. F .等. mRNA-1273II价(原始和 克隆)新冠肺炎疫苗在美国对抗新冠肺炎的效果。纳特。Commun。 14, 5851 (2023)。
新冠肺炎联合流感疫苗候选人进入3期试验。睡衣裤 330, 2044 (2023)。
叶,庆,等。新冠肺炎和流感病毒mRNA联合疫苗的合理研制。NPJ疫苗 7, 84 (2022)。
Daniel,s .,Kis,z .,Kontoravdi,c .和Shah,n.《RNA平台生产过程的质量设计》。趋势生物技术。 40, 1213–1228 (2022)。
Warne,n .等人在2021年输送30亿剂Comirnaty。纳特。生物技术。 41, 183–188 (2023)。
基于信使RNA的传染病疫苗。Curr。顶端。微生物群。免疫学。 440, 111–145 (2022)。
自我扩增mRNA疫苗开发的最新进展。疫苗 9, 97 (2021)。
LNPs中未修饰的mRNA构成了预防性疫苗的竞争性技术。NPJ疫苗 2, 29 (2017)。
体外合成的特异性mRNA疫苗对甲型流感病毒感染的保护效力。纳特。生物技术。 30, 1210–1216 (2012)。 第一篇发表的论文证明了直接注射的非复制型mRNA疫苗可以诱导针对病毒病原体的保护性免疫反应。
基于mRNA的新型冠状病毒疫苗候选物CVnCoV在啮齿动物中诱导高水平的病毒中和抗体并介导保护作用。NPJ疫苗 6, 57 (2021)。
欧洲和拉丁美洲十个国家CVnCoV新型冠状病毒mRNA候选疫苗的有效性和安全性(HERALD):一项随机、观察者盲法、安慰剂对照的2b/3期试验。柳叶刀感染。Dis。 22, 329–340 (2022)。
mRNA-1273新型冠状病毒疫苗的有效性和安全性。名词(noun的缩写)英国医学博士。 384, 403–416 (2021)。 与Polack等人(2020年)一起,第一次报告了关于mRNA疫苗的大型III期临床试验的结果。
BNT162b2 mRNA新冠肺炎疫苗的安全性和有效性。名词(noun的缩写)英国医学博士。 383, 2603–2615 (2020)。 与Baden等人(2021年)一起,第一次报告了关于mRNA疫苗的大型III期临床试验的结果。
Kariko,k .,Buckstein,m .,Ni,H. & Weissman,d . Toll样受体对RNA识别的抑制:核苷修饰的影响和RNA的进化起源。免疫 23, 165–175 (2005)。 首次报道显示IVT mRNA的核苷修饰降低了其炎症能力。
Kariko,k .等人将假尿苷掺入mRNA产生了具有增加的翻译能力和生物稳定性的优良的非免疫原性载体。摩尔。Ther。 16, 1833–1840 (2008)。 第一份报告表明,将修饰的核苷引入IVT mRNA增加了其可翻译性。
传染病的mRNA疫苗:原理、递送和临床翻译。纳特。Rev .药物发现。 20, 817–838 (2021)。
《量身定做:治疗性mRNA设计的艺术》。纳特。Rev .药物发现。 23, 67–83 (2024)。
Pardi,n .,Hogan,M. J .,Porter,F. W .和Weissman,D. mRNA疫苗——疫苗学的新时代。纳特。Rev .药物发现。 17, 261–279 (2018)。
Verbeke,r .,Hogan,M. J .,Lore,k .和Pardi,n . mRNA疫苗的先天免疫机制。免疫 55, 1993–2005 (2022)。
用共转录CleanCap合成Cap 1信使RNA(R)体外转录的类似物。Curr。协议。 1,e39 (2021)。
Pardi,n .,Muramatsu,h .,Weissman,d .和Kariko,k.《含有修饰核苷的长RNA的体外转录》.方法Mol。生物。 969, 29–42 (2013)。
具有加帽RNA的人IFIT1的结构揭示了适应性mRNA结合和感知N1和N2核糖2′-O甲基化的机制。继续。国家科学院。Sci。美国 114,e 2106–e 2115(2017)。
用于设计下一代mRNA疗法的机器学习。Acc。化学。水库。 55, 24–34 (2022)。
Chu,y .等.一个用于mRNA非翻译区解码和功能预测的5′UTR语言模型。纳特。马赫。智能。 6, 449–460 (2024)。
贾,l .等。从5′UTR解码mRNA的可译性和稳定性。纳特。结构。摩尔。生物。 27, 814–821 (2020)。
基于RNA疗法的mRNA结构、稳定性和翻译的组合优化。纳特。Commun。 13, 1536 (2022)。
mRNA结构通过功能半衰期的变化来调节蛋白质表达。继续。国家科学院。Sci。美国 116, 24075–24083 (2019)。
优化mRNA设计算法提高稳定性和免疫原性。自然 621, 396–403 (2023)。
高鸟嘌呤和胞嘧啶含量增加了哺乳动物细胞中的mRNA水平。公共科学图书馆生物学。 4,e180 (2006)。
Svitkin,Y. V .等人1mRNA中的-甲基假尿苷通过增加核糖体密度,通过eIF2α依赖性和非依赖性机制增强翻译。核酸研究 45, 6023–6036 (2017)。
Andries,o .等人1通过在哺乳动物细胞系和小鼠中提供增强的蛋白质表达和降低的免疫原性,掺入-甲基假尿苷的mRNA优于掺入假尿苷的mRNA。J.控制。Rel。 217, 337–344 (2015)。 第一项研究评估了广泛使用的 N1体外和体内含-甲基假哌啶的mRNA。
Toll样受体8感知单链RNA的降解产物。纳特。结构。摩尔。生物。 22, 109–115 (2015)。
结构分析表明toll样受体7是鸟苷和单链RNA的双重受体。免疫 45, 737–748 (2016)。
一种从体外转录的mRNA中去除dsRNA污染物的简便方法。摩尔。Ther。核酸 15, 26–35 (2019)。
编码嵌合抗原受体的mRNA的纯化对于产生强有力的T细胞反应是至关重要的。哼。基因疗法。 30, 168–178 (2019)。
Kariko,k .,Muramatsu,h .,Ludwig,j .和Weissman,d .产生用于治疗的最佳mRNA:HPLC纯化消除了免疫激活并提高了核苷修饰的蛋白质编码mRNA的翻译。核酸研究 39,e142 (2011)。
Dousis,a .,Ravichandran,k .,Hobert,E. M .,Moore,M. J .和Rabideau,A. E .,一种工程化的T7 RNA聚合酶,其产生无免疫刺激副产物的mRNA。纳特。生物技术。 41, 560–568 (2023)。
先天免疫受体RIG-I对加帽RNA中m7G识别和2′-O-甲基辨别的结构基础。继续。国家科学院。Sci。美国 113, 596–601 (2016)。
mRNA化学和制造过程对先天免疫激活的影响。Sci。副词 6,eaaz6893 (2020)。
自扩增RNA疫苗的非病毒递送。继续。国家科学院。Sci。美国 109, 14604–14609 (2012)。 这是首次使用LNPs进行RNA疫苗递送的研究。
一项自我扩增新冠肺炎mRNA疫苗的I/II期随机双盲安慰剂对照试验。NPJ疫苗 7, 161 (2022)。
抗新冠肺炎病毒自扩增RNA疫苗的安全性和免疫原性:COVAC1,一项I期剂量范围试验。临床医学 44, 101262 (2022)。
自扩增RNA新冠肺炎疫苗(ARCT-154)与BNT162b2 mRNA新冠肺炎疫苗加强剂量的免疫原性和安全性:一项双盲、多中心、随机、对照、3期、非劣效性试验。柳叶刀感染。Dis。 24, 351–360 (2024)。
自我复制RNA疫苗首次获得完全批准:下一步是什么?自然 624, 236–237 (2023)。
在自扩增RNA中用修饰的核苷酸完全取代抑制干扰素反应并增加效力。纳特。生物技术。 https://doi.org/10.1038/s41587-024-02306-z (2024)。 第一项研究提供了核苷修饰的saRNAs疫苗的比较数据。
诱导有效保护性免疫的反式扩增RNA疫苗策略。摩尔。Ther。 28, 119–128 (2020)。
Blakney,A. K .,McKay,P. F .和Shattock,R. J.《用于扩增正负链VEEV分裂子的结构成分》。前面。摩尔。Biosci。 5, 71 (2018)。 第一项研究描述了基于II分RNA的递送平台。
简化为必需元件的反式扩增RNA在小鼠中具有高度复制性和强免疫原性。摩尔。Ther。 31, 1636–1646 (2023)。
用于mRNA递送的脂质纳米粒。纳特。脱线牧师。 6, 1078–1094 (2021)。
用于基因治疗的脂质纳米粒系统。摩尔。Ther。 25, 1467–1475 (2017)。
通过不同途径在脂质纳米粒中递送给小鼠的核苷修饰的mRNA的表达动力学。J.控制。Rel。 217, 345–351 (2015)。 第一个使用LNPs进行核苷修饰mRNA递送的研究。
森普尔,S. C .等:《用于siRNA传递的阳离子脂质的合理设计》。纳特。生物技术。 28, 172–176 (2010)。 第一个使用LNPs进行体内RNA递送的详细研究。
脂质纳米粒通过诱导强大的T滤泡辅助细胞和体液反应增强mRNA和蛋白质亚单位疫苗的效力。免疫 54, 2877–2892 (2021)。
IL-1和IL-1Ra是RNA疫苗炎症反应的关键调节因子。纳特。免疫学。 23, 532–542 (2022)。
鼻内mRNA-LNP疫苗接种保护仓鼠免受新型冠状病毒感染。Sci。副词 9,eadh1655 (2023)。
一种用于递送复制型病毒RNA的纳米结构脂质载体提供了针对寨卡病毒的单一、低剂量保护。摩尔。Ther。 26, 2507–2522 (2018)。
一种甲病毒衍生的复制子RNA疫苗在小鼠和非人灵长类动物中诱导新型冠状病毒中和抗体和T细胞应答。Sci。Transl。医学。 12,eabc9396 (2020)。
一种用于抗结核分枝杆菌的基于RNA的疫苗平台。疫苗 11, 130 (2023)。
复制RNA疫苗引发了意想不到的免疫反应,有效地保护小鼠免受致命的 µg里米亚-刚果出血热病毒的攻击。埃比奥米辛 82, 104188 (2022)。
MacMillen,z .等人使用基于repRNA的CSP疟疾疫苗在小鼠中加速启动和诱捕疫苗方案。NPJ疫苗 9, 12 (2024)。
《大逃亡:阳离子复合物如何 µg服核内体屏障》。J.脱线。化学。 B6, 6904 6918 (2018)。
Démoulins,t .等,《基于聚乙烯亚胺的自我复制RNA疫苗的多重递送》。纳米医学。纳米技术。 12, 711–722 (2016)。
Moghimi,S. M .等,《两步聚(乙烯亚胺)介导的细胞毒性:基因转移/治疗的意义》。摩尔。Ther。 11, 990–995 (2005)。
一种针对寨卡病毒的RNA纳米颗粒疫苗引发抗体和CD8+小鼠模型中的t细胞反应。Sci。有代表性的 7, 252 (2017)。
树状大分子RNA纳米粒子产生针对致命的埃博拉病毒、H1N1流感病毒弓形虫单一剂量的挑战。继续。国家科学院。Sci。美国 113,e 4133–e 4142(2016)。
Suberi,a .等人的聚合物纳米颗粒将mRNA递送到肺部用于粘膜接种。Sci。Transl。医学。 15,eabq0603 (2023)。
用于mRNA递送的聚合物文库的内体逃逸的定量分析。纳米列特。 20, 1117–1123 (2020)。
用于可调基因递送的聚(胺-共-酯)聚复合物的聚乙II醇化。生物材料 272, 120780 (2021)。
肌肉注射后mRNA疫苗运输和产生的蛋白表达。摩尔。Ther。核酸 35, 102083 (2024)。 一项进行良好的研究,描述了NHPs体内mRNA的生物分布和基于mRNA的表达。
人类新型冠状病毒感染和疫苗接种中的免疫印记、变异识别的广度和生发中心反应。细胞 185, 1025–1040 (2022)。 一项很好的研究,包括人类新冠肺炎mRNA疫苗接种后生发中心形成的特征。
新型冠状病毒病毒感染或连续疫苗接种后人类对mRNA疫苗接种的先天免疫反应的调节。JCI洞察 9,e175401 (2024)。
改良mRNA疫苗对恒河猴体内抗原提呈细胞的有效靶向和激活。摩尔。Ther。 25, 2635–2647 (2017)。
Lindsay,K. E .等人通过PET-CT和近红外成像对非人灵长类动物mRNA疫苗递送早期事件的可视化。纳特。生物医学。英语。 3, 371–380 (2019)。
用于递送下一代RNA疫苗的阳离子纳米乳剂。摩尔。Ther。 22, 2118–2129 (2014)。
mRNA疫苗接种后的CD8 T细胞启动仅限于骨髓来源的抗原呈递细胞,并可能涉及来自肌细胞的抗原转移。免疫学 146, 312–326 (2015)。
新型冠状病毒mRNA疫苗诱导持续的人类生发中心反应。自然 596, 109–113 (2021)。 一项重要的研究表明,mRNA疫苗接种后,人类存在长期的生发中心。
莱德劳,B. J .和艾尔贝迪,A. H .生发中心B细胞对新型冠状病毒的反应。纳特。免疫Rev。 22, 7–18 (2022)。
生发中心驱动的B细胞成熟对mRNA疫苗接种的反应。自然 604, 141–145 (2022)。
Sano,k .等人新型冠状病毒疫苗接种在先前感染的个体中诱导粘膜抗体反应。纳特。Commun。 13, 5135 (2022)。
诱导粘膜IgA:对疫苗佐剂和给药系统的挑战。J.免疫学。 199, 9–16 (2017)。
mRNA脂质纳米粒的免疫刺激性质。药物输送。《启示录》 205, 115175 (2024)。
脂质纳米颗粒相关的炎症是由内体损伤的感觉触发的:无副作用的工程内体逃逸。预印本在bioRxiv https://doi.org/10.1101/2024.04.16.589801 (2024)。
李,c。等。辉瑞-BioNTech BNT162b2疫苗的天然免疫和获得性免疫机制。纳特。免疫学。 23, 543–555 (2022)。
人体BNT162b2 mRNA疫苗的系统疫苗学。自然 596, 410–416 (2021)。
新冠肺炎疫情及更远地区的mRNA疫苗。安奴。医学博士。 73, 17–39 (2022)。
Szabo,G. T .,Mahiny,A. J .和Vlatkovic,I .新冠肺炎mRNA疫苗:平台和当前发展。摩尔。Ther。 30, 1850–1868 (2022)。
基于RNA的流感病毒疫苗。疫苗 6, 20 (2018)。
表达流感血凝素干和核蛋白的mRNA疫苗在小鼠和非人灵长类动物中诱导的体液和细胞介导免疫的特征。疫苗 40, 4412–4423 (2022)。
在1期随机临床试验中,抗H10N8和H7N9疫情潜在流感病毒的mRNA疫苗在健康成人中具有免疫原性且耐受性良好。疫苗 37, 3326–3334 (2019)。
一项基于mRNA的四价季节性流感疫苗(mRNA-1010)在健康成人中1/2期随机临床试验的安全性和免疫原性:中期分析。纳特。Commun。 14, 3631 (2023)。
莫德娜。Moderna宣布了季节性流感疫苗候选物mRNA-1010的中期3期安全性和免疫原性结果。 Moderna https://investors . modernatx . com/news/news-details/2023/Moderna-Announces-Interim-Phase-3-Safety-and-immunity-Results-for-mRNA-1010-a-季节性流感疫苗-Candidate/default.aspx (2023)。
呼吸道合胞病毒感染和新的干预措施。纳特。微生物学修订版。 21, 734–749 (2023)。
针对人类RSV的基于结构的疫苗设计的概念证明。科学 365, 505–509 (2019)。
食品药品管理局。呼吸道合胞病毒。FDA.gov https://www . FDA . gov/consumers/新冠肺炎-流感-和-rsv/呼吸道合胞病毒-RSV (2024)。
表达呼吸道合胞病毒F蛋白变体的基于修饰的mRNA/脂质纳米颗粒的疫苗在RSV感染的啮齿动物模型中具有免疫原性和保护性。NPJ疫苗 5, 16 (2020)。
Aliprantis,A. O .等人的一项1期随机安慰剂对照研究,旨在评估基于mRNA的RSV融合F蛋白疫苗在健康年轻人和老年人中的安全性和免疫原性。哼。疫苗。免疫疗法。 17, 1248–1261 (2021)。
基于mRNA RSV PreF疫苗在老年人中的有效性和安全性。名词(noun的缩写)英国医学博士。 389, 2233–2244 (2023)。
FDA批准基于mRNA的RSV疫苗。纳特。Rev .药物发现。 23, 487 (2024)。
基于mRNA的人类偏肺病毒和副流感病毒3型联合疫苗在健康成人中的安全性和免疫原性。开放论坛感染。Dis。 9,ofac206 (2022)。
UNAIDS。概况介绍。UNAIDS.org https://www . UNAIDS . org/sites/default/files/media _ asset/UNAIDS _ fact sheet _ en . pdf (2024)。
诱导广泛中和抗体的HIV-1疫苗策略。纳特。免疫Rev。 23, 142–158 (2023)。
编码HIV包膜免疫原的RNA复制子的免疫原性,其被设计用于自组装成纳米颗粒。摩尔。Ther。 27, 2080–2090 (2019)。
在人源化小鼠中,膜结合的mRNA免疫原降低了激活HIV包膜V2 apex定向的广泛中和B细胞前体的阈值。免疫 55,2168–2186 . E6(2022)。
从HIV-1的保守区域组装并作为mRNA递送的四价免疫原证明了有效的临床前T细胞免疫原性和广度。疫苗 8, 360 (2020)。
Mu,Z. K .等mRNA编码的HIV-1 Env三聚体铁蛋白纳米颗粒诱导中和小鼠异源HIV-1分离物的单克隆抗体。细胞代表 38, 110514 (2022)。
Saunders,K. O .等人脂质纳米粒包封的核苷修饰的mRNA疫苗引发了与非人灵长类动物中的蛋白质相当的多功能HIV-1抗体。NPJ疫苗 6, 50 (2021)。
多瓣env-gag mRNA疫苗诱导tier-2中和抗体并降低猕猴异源SHIV感染的风险。纳特。医学。 27, 2234–2245 (2021)。
Steichen,J. M .等人设计的HIV疫苗靶向依赖聚糖的广泛中和抗体的种系前体。免疫 45, 483–496 (2016)。
当前黄病毒疫苗开发的前景:简要回顾。病毒 15, 860 (2023)。
新兴黄病毒的持续威胁。纳特。微生物群。 5, 796–812 (2020)。
单一低剂量核苷修饰mRNA疫苗对寨卡病毒的保护作用。自然 543, 248–251 (2017)。 与Richner等人(2017)一起,在动物模型中评估核苷修饰的mRNA-LNP疫苗的免疫原性和保护效力的第一项研究。
改良的mRNA疫苗可以预防寨卡病毒感染。细胞 168,1114–1125 . E10(2017)。连同Pardi等人(自然,2017),这是第一项评估核苷修饰的mRNA-LNP疫苗在动物中的免疫原性和保护效力的研究。
黄热病病毒候选mRNA疫苗在动物模型中的免疫原性和保护活性。NPJ疫苗 8, 31 (2023)。
抗黄病毒的mRNA疫苗。疫苗 9, 148 (2021)。
一种优化的信使RNA疫苗候选物保护非人灵长类动物免受寨卡病毒感染。NPJ疫苗 8, 58 (2023)。
两种寨卡病毒mRNA疫苗候选物在健康黄病毒基线血清阳性和血清阴性成人中的安全性和免疫原性:两项随机、安慰剂对照、剂量范围、1期临床试验的结果。柳叶刀感染。Dis。 23, 621–633 (2023)。
一例与水泡性口炎病毒(印第安纳血清型)感染相关的人类脑炎病例。我是。j .特罗普。医学。Hyg。 39, 312–314 (1988)。
Meyer,m .等人改良的基于mRNA的疫苗引发强烈的免疫反应,保护豚鼠免受埃博拉病毒疾病的感染。J.传染。Dis。 217, 451–455 (2018)。
在感染的豚鼠模型中,拉沙病毒mRNA疫苗提供保护,但不需要中和抗体。纳特。Commun。 14, 5603 (2023)。
核苷修饰的mRNA疫苗保护干扰素受体−/−小鼠抗 µg里米亚-刚果出血热病毒感染。J.病毒唑。 96,e0156821 (2022)。
SFTSV Gn-Head mRNA疫苗提供了抵抗致命病毒攻击的有效保护。J.医学。病毒唑。 95,e29203 (2023)。
Lo,M. K .等人对编码亨德拉病毒可溶性糖蛋白的单剂量核苷修饰的信使RNA疫苗在叙利亚仓鼠中对抗致死性尼帕病毒攻击的评价。J.传染。Dis。 221,S493–S498(2020)。
Loomis,R. J .等人通过mRNA递送嵌合融合(F)和附着(G)糖蛋白抗原作为候选尼帕疫苗。前面。免疫学。 12, 772864 (2021)。
一种mpox病毒mRNA-脂质纳米粒疫苗提供了对致死性正痘病毒攻击的保护。Sci。Transl。医学。 15,eadg3540 (2023)。
编码猴痘病毒抗原融合蛋白的mRNA疫苗保护小鼠免受痘苗病毒攻击。纳特。Commun。 14, 5925 (2023)。
一种多价mRNA猴痘病毒疫苗(BNT166)保护小鼠和猕猴免受正痘病毒疾病。细胞 187, 1363–1373 (2024)。
单次接种核苷修饰的狂犬病mRNA疫苗诱导小鼠产生长期的高度保护性免疫应答。前面。免疫学。 13, 1099991 (2022)。
未修饰的狂犬病mRNA疫苗引发高交叉中和抗体滴度和不同的B细胞记忆反应。纳特。Commun。 14, 3713 (2023)。
在人类志愿者中用脂质纳米粒配制的低剂量未经修饰的基于mRNA的狂犬病疫苗的概念验证:一项1期试验。疫苗 39, 1310–1318 (2021)。
人巨细胞病毒糖蛋白B核苷修饰的mRNA疫苗比MF59佐剂的gB蛋白免疫诱导的抗体反应具有更强的持久性和广度。J.病毒唑。 94,e00186-20 (2020)。
多价巨细胞病毒糖蛋白B核苷修饰的mRNA疫苗没有显示更大的抗体宽度。NPJ疫苗 9, 38 (2024)。
在临床前模型中,猕猴对巨细胞病毒预先存在的免疫力影响人类巨细胞病毒疫苗应答。疫苗 39, 5358–5367 (2021)。
与gB/MF59疫苗相比,人巨细胞病毒mRNA-1647候选疫苗引起有效和广泛的中和以及更高的抗体依赖性细胞毒性反应。J.传染。Dis。 7,嘉593 (2024)。
编码HSV-2糖蛋白C、D和E的核苷修饰mRNA可预防临床和亚临床生殖器疱疹。Sci。免疫学。 4,aaw7083 (2019)。
在临床前模型中,三价核苷修饰的mRNA疫苗产生针对生殖器疱疹的持久记忆B细胞保护。J.Clin。投资。 131,e152310 (2021)。
一种含有糖蛋白gC、gD和gE的HSV-2核苷修饰的mRNA生殖器疱疹疫苗保护小鼠免受HSV-1生殖器损伤和潜伏感染。公共科学图书馆Pathog。 16,e1008795 (2020)。
LaTourette,P. C. 2nd等.在脂质纳米粒疫苗中使用三价核苷修饰的mRNA在新生鼠模型中预防单纯疱疹病毒2型感染。疫苗 38, 7409–7413 (2020)。
一种具有强免疫原性和持续病毒学抑制的治疗性乙型肝炎基因疫苗。NPJ疫苗 9, 22 (2024)。
丙型肝炎病毒E1和由mRNA疫苗递送的修饰E2诱导保护性免疫。NPJ疫苗 8, 42 (2023)。
以EB病毒潜伏蛋白富含T细胞表位的结构域为靶点的mRNA疫苗在小鼠体内引发强大的抗肿瘤免疫。高级科学。 10,e2302116 (2023)。
包裹mRNA带状疱疹疫苗的协同脂质纳米粒诱导有效的免疫反应并保护豚鼠免受病毒攻击。脱线。 36,e2310886 (2024)。
黄,l。等。带状疱疹mRNA疫苗在小鼠和恒河猴中诱导了优于许可疫苗的疫苗免疫。紧急情况。微生物会感染。 13, 2309985 (2024)。
Bjornevik,k .等:纵向分析揭示多发性硬化相关的爱泼斯坦-巴尔病毒的高患病率。科学 375, 296–301 (2022)。
细菌基因组变异及其对疫苗设计的影响。细胞宿主微生物 3, 408–416 (2008)。
针对细菌感染的疫苗接种:挑战、进展和新方法,重点关注细胞内细菌。疫苗 10, 751 (2022)。
用信使RNA鼻内接种作为基因治疗的新方法:用于抗结核。BMC生物技术。 10, 77 (2010)。
用卡介苗疫苗预防结核病:文献的荟萃分析。Clin。传染。Dis。 31(补编第3号),第64至67条(2000年)。
编码细菌抗原的自扩增mRNA疫苗诱导的免疫原性和保护效力。疫苗 35, 361–368 (2017)。
一种单剂量的基于F1的mRNA-LNP疫苗提供了针对致命鼠疫细菌的保护。Sci。副词 9,eadg1036 (2023)。
基于免疫肽组学的mRNA疫苗制剂设计李斯特氏菌. 纳特。Commun。 13, 6075 (2022)。
PcrV和OprF-I mRNA候选疫苗的强免疫应答和保护作用铜绿假单胞菌. NPJ疫苗 8, 76 (2023)。
针对莱姆病的mRNA-脂质纳米颗粒疫苗的开发。摩尔。Ther。 31, 2702–2714 (2023)。
兔子的mRNA接种改变了生殖力,但不改变成虫的附着肩胛硬蜱. Sci。有代表性的 14, 496 (2024)。
特异性mRNA脂质纳米粒和获得性蜱抗性。疫苗 41, 4996–5002 (2023)。
Hotez,p .和Herricks,j .寄生虫造成的一百万人死亡。PLOS https://speakingofmedicine . PLoS . org/2015/01/16/一百万-死亡-寄生虫/ (2015)。
用确定的RNA和亚单位疫苗进行异源免疫增强了T细胞的反应杜氏利什曼虫. 前面。免疫学。 9, 2420 (2018)。
Beeson,J. G .等,《开发有效和长效疟疾疫苗的挑战和策略》。Sci。Transl。医学。 11,eaau1458 (2019)。
疟疾疫苗的当前方法。Curr。Opin。微生物群。 70, 102227 (2022)。
Hayashi,C. T. H .等表达LNP mRNA的PfCSP和Pfs25疫苗候选物靶向恶性疟原虫. NPJ疫苗 7, 155 (2022)。
表达PfCSP的信使RNA诱导小鼠对疟疾的功能性保护性免疫反应。NPJ疫苗 6, 84 (2021)。
抗PfGARP激活寄生虫程序性细胞死亡并减少严重疟疾。自然 582, 104–108 (2020)。
表达疟疾传播阻断抗原Pfs25和Pfs230D1的mRNA疫苗诱导功能性免疫反应。NPJ疫苗 9, 9 (2024)。
疟原虫编码的MIF直向同源物的中和赋予了抗疟疾感染的保护性免疫。纳特。Commun。 9, 2714 (2018)。
为肝内记忆T细胞特制的抗疟疾mRNA疫苗。纳特。免疫学。 24, 1487–1498 (2023)。
Battle,K. E .等人绘制的全球流行病和临床负担图间日疟原虫,2000-17:空间和时间模型研究。柳叶刀 394, 332–343 (2019)。
Krotoski,W. A .等.子孢子传播的子孢子的证明间日疟原虫感染。我是。j .特罗普。医学。Hyg。 31, 1291–1293 (1982)。
Pvs25 mRNA疫苗诱导完全和持久的传播阻断免疫间日疟原虫. NPJ疫苗 8, 187 (2023)。
抗H10N8和H7N9流感病毒mRNA疫苗免疫原性的临床前和临床证明。摩尔。Ther。 25, 1316–1327 (2017)。
核苷修饰的mRNA免疫引发流感病毒血凝素柄特异性抗体。纳特。Commun。 9, 3361 (2018)。
用核苷修饰的mRNA疫苗进行的单次免疫在小鼠中引发了针对新型冠状病毒的强烈的细胞和体液免疫应答。免疫 53, 724–732 (2020)。
新型冠状病毒——感染和疫苗诱导的抗体反应持续时间很长,有一个最初的减弱阶段,然后是一个稳定阶段。免疫 57, 587–599 (2024)。 一项纵向研究描述了新冠肺炎mRNA疫苗接种后通过诱导、减弱和稳定阶段的新型冠状病毒峰抗体动力学。
接受基于mRNA的新冠肺炎疫苗后的反应原性。睡衣裤 325, 2201–2202 (2021)。
新冠肺炎疫苗接种后不能工作——未来加强疫苗接种的一个相关方面。公共卫生 222, 186–195 (2023)。
新冠肺炎疫苗过敏反应:流行病学、危险因素和评估。Curr。过敏哮喘代表。 23, 195–200 (2023)。
2020年12月至2021年8月美国基于mRNA的新冠肺炎疫苗接种后报告的心肌炎病例。睡衣裤 327, 331–340 (2022)。
Blumenthal,K. G .等人延缓了对抗新型冠状病毒mRNA-1273疫苗的大量局部反应。名词(noun的缩写)英国医学博士。 384, 1273–1277 (2021)。
皮肤副作用阻碍HIV疫苗的发展。科学 383, 1044 (2024)。
降低mRNA药物和疫苗毒性风险的策略。纳特。Rev .药物发现。 23, 281–300 (2024)。
接种BNT162b2 mRNA新冠肺炎疫苗的医护人员中不良事件和抗体滴度之间的相关性。疫苗 10, 1220 (2022)。
Elizalde,M. U .,Eguinoa,F. J. G .,de Las Huertas,A. G. L .,Jimenez-Gonzalez,m .和Ramirez,e . mRNA新冠肺炎疫苗接种与未接种个体相比的心肌炎和心包炎风险:一项西班牙三级医院的回顾性队列研究。生物医学。药理学家。 171, 116181 (2024)。
人类对甲型流感病毒感染和疫苗接种的抗体反应。纳特。免疫Rev。 19, 383–397 (2019)。
研发中的新型冠状病毒疫苗。自然 586, 516–527 (2020)。
对新型冠状病毒加强疫苗接种和突破性感染的粘膜抗体反应。mBio 14,e0228023 (2023)。
Havervall,s .等,《针对新型冠状病毒感染的抗尖峰粘膜IgA保护》。名词(noun的缩写)英国医学博士。 387, 1333–1336 (2022)。
新型冠状病毒粘膜免疫球蛋白-A反应和保护的7个月持续时间。柳叶刀感染。Dis。 23, 150–152 (2023)。
Sheikh-Mohamed,s .等:新型冠状病毒mRNA疫苗接种可诱导不同程度的全身和粘膜IgA反应,并与预防后续感染相关。粘膜免疫。 15, 799–808 (2022)。
组织驻留记忆性T细胞对流感病毒的保护性免疫。Curr。Opin。病毒唑。 65, 101397 (2024)。
郑,郑明敏& Wakim,L. M。呼吸道中的组织驻留记忆T细胞。粘膜免疫。 15, 379–388 (2022)。
临床前疫苗研究中使用的mRNA-LNP平台的脂质纳米颗粒成分具有高度的炎症性。科学 24, 103479 (2021)。
通过添加可离子化的脂质和mRNA来增强脂质纳米粒mRNA疫苗的免疫原性。纳特。生物医学。英语。 https://doi.org/10.1038/s41551-023-01082-6 (2023)。
自我扩增mRNA疫苗接种途径调节肺驻留记忆CD8和CD4 T细胞的建立。Sci。免疫学。 7,eadd3075 (2022)。
B淋巴细胞谱系细胞与呼吸系统。J.过敏临床。免疫学。 131, 933–957 (2013)。
单剂新型冠状病毒mRNA疫苗后血清反应阳性者的抗体反应。名词(noun的缩写)英国医学博士。 384, 1372–1374 (2021)。
卡雷尼奥、辛格、西蒙和 µg拉默;PVI学习小组。II价新冠肺炎加强疫苗和BA.5特异性抗体的缺乏。柳叶刀微生物 4,e569 (2023)。
原型mRNA疫苗在Omicron变异体匹配的加强免疫后印记广泛中和的人血清抗体。预印本在bioRxiv https://doi.org/10.1101/2024.01.03.574018 (2024)。
Alsoussi,W. B .等新型冠状病毒奥米 克隆加强诱导人类新生B细胞反应。自然 617, 592–598 (2023)。
变异适应的新冠肺炎加强疫苗。科学 382, 157–159 (2023)。
在人类中用新冠肺炎XBB.1.5 mRNA加强剂接种后,会出现持久的免疫印记。免疫 57, 904–911 (2024)。
流感病毒感染或疫苗接种后的抗体景观。科学 346, 996–1000 (2014)。
弗朗西斯,t。论原始抗原罪的学说。继续。国家科学院。Sci。美国 104, 572–578 (1960)。
快速 克隆抗流感病毒的高亲和力人类单克隆抗体。自然 453, 667–671 (2008)。
接受静脉注射免疫球蛋白的原发性免疫缺陷患者中IgG亚类和特异性抗体的半衰期。J.实验室。Clin。医学。 112, 634–640 (1988)。
在荷兰普通人群中进行基于mRNA或载体的疫苗接种后,新型冠状病毒·登·霍根等人的S1特异性IgG动力学曲线表现出不同的动力学。Sci。有代表性的 12, 5935 (2022)。
佐剂类脂取代的脂质纳米粒增强新型冠状病毒mRNA疫苗的免疫原性。纳特。纳米技术。 18, 1105–1114 (2023)。
基线先天和T细胞群是独立于血清学的抵抗症状性流感病毒感染的相关因素。纳特。免疫学。 24, 1511–1526 (2023)。
Sette,a .,Sidney,j .和Crotty,S. T细胞对新型冠状病毒的反应。安奴。免疫Rev。 41, 343–373 (2023)。
核苷修饰的mRNA疫苗诱导有效的T滤泡辅助细胞和生发中心B细胞反应。J.Exp。医学。 215, 1571–1588 (2018)。
张,张,等。四种疫苗的体液免疫和细胞免疫记忆。细胞 185, 2434–2451 (2022)。
在新型冠状病毒突破性感染期间,预先接种促进记忆T细胞的早期活化并增强免疫反应。纳特。免疫学。 24, 1711–1724 (2023)。
Palmer,C. D .等GRT-R910:一种自我扩增的mRNA新型冠状病毒疫苗可在以前接种过疫苗的老年人中增强免疫≥6个月。纳特。Commun。 14, 3274 (2023)。
Miao,l .等。递送含杂环脂质的mRNA疫苗通过STING介导的免疫细胞活化增加抗肿瘤功效。纳特。生物技术。 37, 1174–1185 (2019)。
卡雷诺,J. M .等人mRNA-1273而不是BNT162b2诱导了针对基于mRNA的疫苗制剂中所含聚乙II醇(PEG)的抗体。疫苗 40, 6114–6124 (2022)。
新型冠状病毒mRNA疫苗诱导的抗聚乙II醇抗体的影响。纳特。免疫Rev。 23, 135–136 (2022)。
新型冠状病毒脂质纳米粒mRNA疫苗在人体内增强的抗聚乙II醇抗体。ACS纳米 16, 11769–11780 (2022)。
临床相关脂质纳米粒在大鼠体内引发的聚乙II醇(PEG)相关免疫反应。NPJ疫苗 8, 169 (2023)。
抗聚乙II醇抗体亲和力对聚乙II醇化促红细胞生成素β在小鼠体内加速血液清除的影响。生物医学。药理学家。 146, 112502 (2022)。
1.5单价mRNA疫苗加强剂引发针对XBB亚变异体和JN.1的强大中和抗体。细胞宿主微生物 32, 315–321 (2024)。
抗新型冠状病毒mRNA疫苗——初步报告。名词(noun的缩写)英国医学博士。 383, 1920–1931 (2020)。
两种基于RNA的新冠肺炎疫苗候选物的安全性和免疫原性。名词(noun的缩写)英国医学博士。 383, 2439–2450 (2020)。
健康成人中新型冠状病毒变体mRNA疫苗加强剂的安全性和免疫原性:一项中期分析。纳特。医学。 27, 2025–2031 (2021)。
流感疫苗的年度生产周期。疫苗 21, 1776–1779 (2003)。
de Jong,j . c ,, Beyer,w . e ,, pa lache,A . m ,, Rimmelzwaan,G. F .和Osterhaus,A. D .认为1997/1998年流感疫苗与主要流行性A(H3N2)病毒毒株之间的错配是老年人对该毒株疫苗诱导的抗体反应不足的原因。J.医学。病毒唑。 61, 94–99 (2000)。
2014-15北半球流感疫苗H3N2错配及人和雪貂抗血清衍生抗原图谱的头对头比较。Sci。有代表性的 5, 15279 (2015)。
Plotkin,s .,Robinson,J. M .,Cunningham,g .,Iqbal,r .和Larsen,s.《疫苗生产的复杂性和成本——概述》。疫苗 35, 4064–4071 (2017)。
反向疫苗学和血清群B的疫苗脑膜炎奈瑟菌. 高级Exp。医学。生物。 568, 217–223 (2005)。
Rappuoli,r .,Bottomley,M. J .,D’Oro,u .,Finco,O. & De Gregorio,e .反向疫苗学2.0:人类免疫学指导疫苗抗原设计。J.Exp。医学。 213, 469–481 (2016)。
《缩小全球疫苗公平差距:公平分配的生产》。柳叶刀 399, 1924–1926 (2022)。
《疫苗获取、公平与公正:新冠肺炎疫苗和疫苗接种》。BMJ环球。健康 8 https://doi.org/10.1136/bmjgh-2023-011881 (2023)。
疫苗在新冠肺炎疫情的作用:我们学到了什么?塞明。免疫病理。 45, 451–468 (2024)。
新冠肺炎时期中国疫苗外交在菲律宾和越南的影响:从软实力角度的多案例研究。哼。社会主义者Sci。Commun。 10, 687 (2023)。
用于疫苗的mRNA-LNPs冻干工艺优化及分子动力学模拟。NPJ疫苗 8, 153 (2023)。
冻干为脂质纳米粒制剂、核苷修饰的mRNA疫苗提供了长期稳定性。摩尔。Ther。 30, 1941–1951 (2022)。
Shirane,d .等人开发了一种酒精稀释-冷冻干燥法,用于制备具有改善的储存稳定性的mRNA-LNPs。制药学 15, 1819 (2023)。
Vander Straeten,A .等人的用于热稳定新冠肺炎mRNA疫苗的微针疫苗打印机。纳特。生物技术。 42, 510–517 (2024)。
Voigt,E. A .等.一种抗新冠肺炎病毒的自扩增RNA疫苗,具有长期室温稳定性。NPJ疫苗 7, 136 (2022)。
推翻大型制药公司:疫苗权益的激进计划。自然 607, 226–233 (2022)。
Sparrow,e .等人利用mRNA平台技术,通过本地疫苗生产,加速一些新兴和被忽视的热带疾病疫苗的开发。前面。Trop。Dis。 3, 844039 (2022)。
医疗保健中的mRNA技术转移计划和经济可持续性。公牛。世界卫生组织。 102, 344–351 (2024)。
Adepoju,P. Moderna搁置非洲疫苗生产计划。柳叶刀 403, 1617 (2024)。
施用编码广泛中和抗体的核苷修饰的mRNA保护人源化小鼠免受HIV-1攻击。纳特。Commun。 8, 14630 (2017)。 第一项研究表明,核苷修饰的mRNA-LNP平台可用于临床前研究中的被动免疫治疗。
mRNA介导针对感染因子、毒素和肿瘤的被动疫苗接种。EMBO摩尔。医学。 9, 1434–1447 (2017)。
基因工程mRNA表达的抗体预防呼吸道合胞病毒感染。纳特。Commun。 9, 3999 (2018)。
美谛高丝等脂质包裹的编码有效中和的人单克隆抗体的mRNA可以预防基孔肯雅感染。Sci。免疫学。 4,eaaw6647 (2019)。
August,A .等人对编码具有抗基孔肯雅病毒中和活性的单克隆抗体的脂质包裹的mRNA进行了1期试验。纳特。医学。 27, 2224–2233 (2021)。 第一项研究证明核苷修饰的mRNA-LNP平台可成功用于人类的被动免疫治疗。
编码双特异性单结构域抗体构建体的mRNA保护小鼠免受甲型流感病毒感染。摩尔。Ther。努 µg。酸 20, 777–787 (2020)。
肌内递送编码ZIKV-117人单克隆抗体的复制子RNA可防止寨卡病毒感染。摩尔。Ther。方法临床。戴夫。 18, 402–414 (2020)。
编码抗感染中和抗体的复制型mRNA在小鼠中的鼻内递送。信号。换能器。目标。Ther。 6, 369 (2021)。
编码hACE2靶向抗体的复制型mRNA在仓鼠中的鼻内递送。红伞。水库。 209, 105507 (2023)。
单剂量抗-HBsAg抗体编码的mRNA-LNPs抑制HBsAg表达:慢性乙型肝炎病毒感染的潜在治愈方法。mBio 13,e0161222 (2022)。
脂质纳米粒包裹的mRNA抗体在小鼠和仓鼠中提供了对新型冠状病毒的长期保护。单元格区域 32, 375–382 (2022)。
Mucker,E. M .,Thiele-Suess,c .,Baumhof,p .和Hooper,J. W .编码靶向兔痘病毒的多种单克隆抗体的未修饰mRNAs的脂质纳米粒递送。摩尔。Ther。核酸 28, 847–858 (2022)。
mRNA编码的抗HIV-1广泛中和抗体组合的合理设计和体内表征。抗体 11, 67 (2022)。
雾化的mRNA编码的抗体保护仓鼠免受新型冠状病毒感染。高级科学。 9,e2202771 (2022)。
Deal,C. E .等基于mRNA的平台,用于将病原体特异性IgA递送到粘膜分泌物中。细胞代表医学。 4, 101253 (2023)。
Thran,m .等人共同施用效应抗体增强了RNA编码的纳米抗体的半衰期和治疗潜力。Sci。有代表性的 13, 14632 (2023)。
环状RNA:RNA治疗靶点、RNA治疗学和mRNA疫苗的新兴前沿。J.控制。Rel。 348, 84–94 (2022)。
Wesselhoeft,R. A .,Kowalski,P. S .和Anderson,D. G.《工程环状RNA在真核细胞中的有效和稳定翻译》。纳特。Commun。 9, 2629 (2018)。
RNA环化减少了免疫原性并能延长体内翻译持续时间。摩尔。细胞 74, 508–520 (2019)。
陈,r。等。工程环状RNA提高蛋白质产量。纳特。生物技术。 41, 262–272 (2023)。
抗和新出现变异体的环状RNA疫苗。细胞 185, 1728–1744 (2022)。
Esposito,s .等,《用于预防和治疗呼吸道合胞病毒、新型冠状病毒、人类免疫缺陷病毒、狂犬病和细菌感染的单克隆抗体:来自世界传染病和免疫疾病协会和意大利抗感染治疗学会的更新》。前面。免疫学。 14, 1162342 (2023)。
扩大单克隆抗体的范围:免疫疗法中合成核酸递送的综述。抗体 12, 46 (2023)。
疫苗和治疗学mRNA生产的发展:mRNA平台要求和支持早期临床试验的可扩展生产过程的发展。Transl。水库。 242, 38–55 (2022)。
用于早期临床试验的编码新抗原的信使RNA的小规模生产。细胞疗法 24, 213–222 (2022)。
挑战与瓶颈。疫苗 39, 2190–2200 (2021)。
MRNA药物制造的现状和未来展望。摩尔。制药。 19, 1047–1058 (2022)。
承认
Pardi实验室由美国国立卫生研究院(NIH)的国家过敏和传染病研究所(NIAID)提供支持,授予编号为R01AI146101、R01AI153064、P01AI158571和P01AI172531。Krammer实验室从NIAID流感研究和响应卓越中心(CEIRR,75N93021C00014)和合作流感疫苗创新中心(CIVICs,75N93019C00051)合同以及NIAID拨款和合同U19 AI168631、R01 AI154470、U19 AI162130、U01 AI144616、75n 9331获得免疫学、病毒学、治疗学和疫苗领域的工作支持额外的支持来自FluLab和比尔及梅林达盖茨基金会。最后,该实验室还得到了NCI U54 CA260560和血清学科学网络(SeroNet)的支持,部分资金来自NIH美国国家癌症研究所的联邦基金,合同号为75N91019D00024,任务订单号为75N91021F00001。本出版物的内容不一定反映卫生与公众服务部的观点或政策,提及的商品名称、商业产品或组织也不意味着美国政府的认可。作者感谢Michael J. Hogan、Emily F. Daley和andrásárkzy对手稿的宝贵反馈。作者向所有同事道歉,由于篇幅限制,他们的伟大研究未能在此引用。
道德宣言
竞争的利益
N.P .是以描述脂质纳米粒中核苷修饰的mRNA作为疫苗平台的专利命名的。他已经向宾夕法尼亚大学充分披露了这些利益,并制定了一个已获批准的计划来管理因这些专利的许可而产生的任何潜在冲突。N.P .于2022年和2023-2024年分别在赛诺菲巴斯德和辉瑞的mRNA战略顾问委员会任职。N.P .是AldexChem和BioNet科学顾问委员会的成员,并为疫苗公司和牧场生物公司提供咨询。西奈山伊坎医学院已经提交了与新型冠状病毒血清学试验、NDV新型冠状病毒疫苗、流感病毒疫苗和流感病毒疗法相关的专利申请,将F.K .列为共同发明人,其中一些专利已经获得许可,使F.K .有权获得专利使用费。西奈山已经分拆出一家名为Kantaro的公司,为新型冠状病毒销售血清学检测,另一家名为CastleVax的公司,开发新型冠状病毒疫苗。F.K .是CastleVax的联合创始人和科学顾问委员会成员。F.K .曾为默 µg公司、Curevac公司、葛兰素史 µg公司、Seqirus公司和辉瑞公司提供咨询服务,目前正在为第三岩石风险投资公司、Gritstone Bio公司、赛诺菲公司和Avimex公司提供咨询服务。Krammer实验室正在与Dynavax合作开发流感疫苗,并与Vir Biotechnology合作开发流感疗法。
同行审查
同行评审信息
自然评论药物发现感谢Anna Blakney、Karin Lore和Philip Dormitzer对本书同行评审的贡献。
附加说明
出版商的说明Springer Nature在已发布地图和机构关联的管辖权主张方面保持中立。
权利和权限
Springer Nature或其许可方(例如一个协会或其他合作伙伴)根据与作者或其他权利持有人的出版协议,拥有本文的专有权;作者对本文被接受的手稿版本的自我存档仅受此类出版协议和适用法律的条款约束。
Hits: 404