Contents
Modeling Insights into Haemophilus influenzae Type b Disease, Transmission, and Vaccine Programs
对 b 型流感嗜血杆菌疾病、传播和疫苗计划的建模见解
摘要
为了应对美国 2007-2009 年b型流感嗜血杆菌 (Hib) 疫苗短缺,我们开发了一种灵活的 Hib 传播和疾病模型,用于优化不同人群和情况下的 Hib 疫苗计划。该模型按年龄、定植/疾病状态和抗体水平对人群成员进行分类,并由微分方程定义跨类别移动。我们为整个美国、英格兰和威尔士以及阿拉斯加原住民实施了该模型。该模型准确模拟了所有 3 个人群的 Hib 发病率,包括 1999 年开始英格兰/威尔士发病率的增加以及 1996 年更换 Hib 疫苗后阿拉斯加原住民 Hib 发病率的变化。该模型表明,在美国,需要推迟加强剂量的疫苗短缺可能会持续 3 年,然后失去群体免疫力将导致 <5 岁儿童侵袭性 Hib 疾病的发病率增加。
在许多人群中,常规使用 b 型流感嗜血杆菌 (Hib) 结合疫苗可显著降低 <5 岁儿童的 Hib 病发病率 (1-4)。疫苗接种计划还通过减少 Hib 传播而实现群体免疫,如接种疫苗的儿童和未接种疫苗的儿童和成人口咽 Hib 定植患病率的下降所示 (2,4–6)。然而,即使是成功的疫苗接种计划也没有消除 Hib 定植 (7,8)。因此,Hib控制计划的持续成功取决于保持与年龄相适应的Hib疫苗覆盖率。然而,这种覆盖率可能会受到疫苗供应变化的威胁,正如美国2007-2009年Hib疫苗短缺所表明的那样(9,10)。
为了应对这种短缺,美国疾病控制与预防中心(Centers for Disease Control and Prevention)和合作伙伴组织建议提供者推迟向所有儿童提供12-15个月的加强剂量,但侵袭性Hib病高风险儿童除外(9)。该建议基于专家对最初预计持续 <9 个月的短缺的预测影响的意见 (9)。当短缺明显会持续更长时间时,我们试图开发一个 Hib 传播和疾病模型,以预测继续推迟加强剂量的影响并指导疫苗政策。这种模式也可用于优化将Hib疫苗引入新人群。此外,它可以提供对 Hib 传播和定植动态的见解,这将为最适合侵袭性 Hib 疾病高风险人群(如阿拉斯加原住民)的 Hib 疫苗类型的不确定性提供信息 (11)。我们介绍了该模型,并展示了其在各种人群和疫苗接种场景中的应用。
模型结构、参数和起始条件

图 1.b型流感嗜血杆菌(Hib)模拟模型的结构。人出生时处于无抗体、易感疾病的状态,并可能在任何模式状态下死亡。Hib 易感人群根据感染力 (FOI) 定植,通过保护低 (VEL,C)或高(VEH,C) 抗体水平。Hib 定植的人会发展为侵袭性疾病,通过保护低 (VEL,D)或高(VEH,D) 抗体水平。定植和患病的人恢复到高抗体、易感疾病的状态。随着免疫力的减弱,易感人群的抗体从高到低,从低抗体到无抗体。有些人接种了疫苗,从无抗体状态或低抗体状态转变为高抗体状态。对于阿拉斯加原住民,从出生开始使用细菌多糖免疫球蛋白 (BPIG) 会暂时使人进入免疫状态;随着BPIG的减弱,免疫者会恢复到易感状态。有关模型结构的正式描述,请参阅技术附录 1。
我们开发了一个年龄结构的数学模型来描述Hib的传播、定植和疾病(图1)。该模型假设可以根据年龄、Hib 抗体水平(高、低和无)和 Hib 感染状态(易感、定植和患病)将人群划分为相互排斥的状态,而被动免疫细菌多糖免疫球蛋白的婴儿则为另一种状态(免疫)。该模型可以表示为一组偏微分方程(技术附录 1),其速率参数控制着模型状态之间的总体移动。例如,特定年龄的感染力(λ(a))是年龄a的易感人群定植的速率。我们使用已发表和未发表的出生率和死亡率、Hib 定植和发病率以及 Hib 疫苗的吸收和有效性数据来设置发病率参数值(技术附录 2)。
我们在 3 个人群中测试了该模型:整个美国的人;英格兰和威尔士;和阿拉斯加原住民(定义为阿拉斯加的原住民)。这些人群反映了 Hib 流行病学和疫苗政策的主要多样性 (1,3,4)。在美国,Hib 结合疫苗于 1988 年首次被推荐作为 18 月龄儿童的单剂,并于 1991 年被推荐作为 2 个月大开始的初级系列疫苗,并在 12-15 个月时加强剂量。在英格兰和威尔士,1992 年引入了 Hib 结合疫苗,作为从 2 个月大开始的初级系列疫苗,以及针对 <4 岁儿童的 1 次补种运动。
我们于 1980 年开始对美国和阿拉斯加原住民种群进行模拟,并于 1985 年开始对英格兰和威尔士种群进行模拟。我们使用人口普查数据来确定每个人口的规模和年龄结构。在开始的一年中,我们将人群划分为模型状态,使Hib传播处于或接近平衡状态。建模和后续分析均使用 SAS 9.2 版(SAS Institute Inc.,Cary NC,USA)实现。
评估模型拟合
我们使用 pseudo-R 验证了模型拟合度2将模型中 Hib 定植的年龄特异性点患病率与疫苗引入前一段时间内观察到的患病率数据进行比较 (4,12–14)。以类似的方式,我们将模拟人群 <5 岁儿童侵袭性 Hib 的年发病率与观察到的发病率数据 (1,3,4,15–23) 进行了比较。
美国疫苗短缺的影响
在2007-2009年疫苗短缺之前,默克公司(美国新泽西州怀特豪斯站)和赛诺菲巴斯德公司(美国新泽西州布里奇沃特)获得了为美国生产Hib疫苗的许可。当默克公司召回某些批次的Hib疫苗并暂停疫苗生产时,就引发了短缺。在默克公司的 Hib 疫苗中,Hib 聚核糖基核糖醇磷酸 (PRP) 多糖与脑膜炎奈瑟菌外膜蛋白 (OMP) 偶联。PRP-OMP 结合疫苗在 2 个月大时接种第一剂可诱导强烈的免疫反应,并作为 2 剂初级系列接种 (24)。在赛诺菲巴斯德的疫苗中,PRP与破伤风类毒素(T)偶联。对于初级系列,PRP-T疫苗的抗体滴度与PRP-OMP疫苗相当,但PRP-T疫苗需要3剂初级系列(24)。b嗜血杆菌结合(HbOC)疫苗是以前在美国使用的第三种Hib疫苗,可将PRP低聚糖与CRM偶联197(交叉反应材料197,白喉毒素的无毒突变体)。HbOC 疫苗具有与 PRP-T 相似的免疫原性,需要 3 剂初级系列疫苗 (24)。
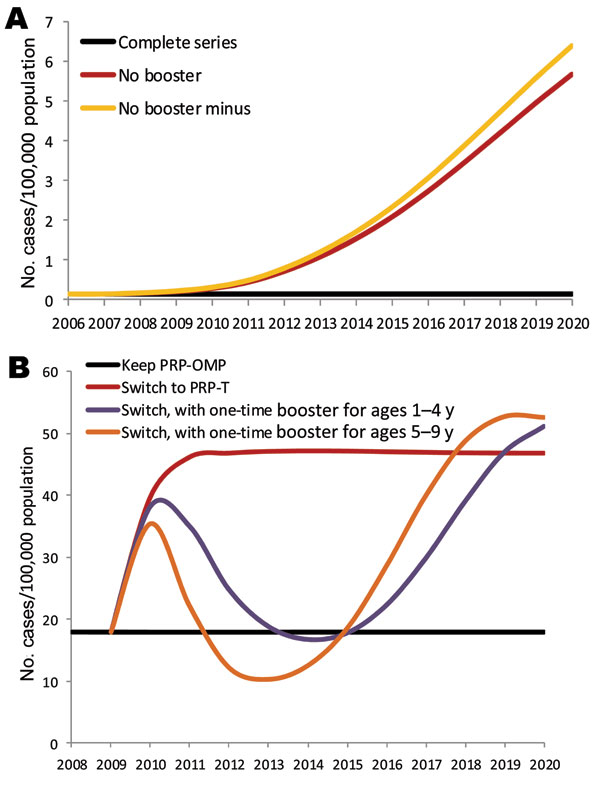
对于美国人口,我们模拟了疫苗长期短缺的影响,以探讨如果短缺持续 >18 个月会发生什么 (10)。我们首先运行该模型,假设 2008 年以后的疫苗覆盖率与 2007 年相同(一个完整的系列情景)。在这种情况下,假设 50% 的接种疫苗的儿童接种了 PRP-OMP 疫苗和 50% 的 PRP-T 疫苗,这是由默克和赛诺菲巴斯德的短缺前 Hib 疫苗市场份额确定的。然后,我们运行该模型,假设从2008年开始,所有儿童的加强剂量都被推迟(无加强剂的情况),并且所有接种疫苗的儿童都接受了PRP-T。最后,我们运行该模型时假设从2008年开始推迟加强剂量,并且初级系列覆盖率下降了10个百分点,正如短缺期间的一些覆盖率调查所表明的那样(25)(无加强剂减去情景)。同样,假设所有儿童都接受PRP-T。我们比较了这 3 种情况下 <5 岁儿童侵袭性 Hib 的年发病率。
对于阿拉斯加原住民,我们从2010年开始模拟了转换Hib疫苗的效果。在1991-1995年6月和1997年7月期间,阿拉斯加原住民接受了PRP-OMP;在 1996 年 1 月至 1997 年 6 月期间,他们接种了 HbOC 疫苗。1996-1997 年,当使用 HbOC 时,阿拉斯加原住民儿童的 Hib 发病率上升,促使改用 PRP-OMP (4)。在 2007-2009 年短缺期间,国家战略储备中的 PRP-OMP 疫苗被用于阿拉斯加原住民 (9)。如果默克公司没有按预期将其疫苗重新投放市场,阿拉斯加原住民最终将不得不改用PRP-T疫苗。为了预测这种转换的影响,我们比较了 2 个模型对 5 岁儿童<预测发病率:1 个模型假设从 2010 年开始继续使用 PRP-OMP,另一个模型假设从 2010 年开始使用 PRP-T。我们还模拟了与转向PRP-T同时发生的1次PRP-T加强运动对所有1-4岁或5-10岁儿童的影响。
引入疫苗的替代方法
该模型还可用于探索将 Hib 结合疫苗引入新人群的策略。为了说明这一策略,我们在 2 个人群中模拟了假设的疫苗接种计划,这些人群具有美国或阿拉斯加原住民的年龄分布和传播模式。
我们比较了假设人群中 4 种疫苗接种情景中 <5 岁儿童的预测 Hib 发病率:1) 从 2 个月大开始的初级系列和 12-15 个月大的加强剂量;2) 仅从 2 个月大开始进行初级系列;3)在12-15个月大时仅接种单剂;4) 2 个月大时的初级系列和 1 次针对 <5 岁儿童的补习运动。我们假设所有疫苗剂量都使用PRP-T的策略,在疫苗实施后3年内达到90%的疫苗覆盖率。
敏感性分析
从文献中获取的所有模型参数都是基于总体样本的估计值,这些估计值具有一定程度的不确定性。我们进行了详细的敏感性分析,以确定如果我们使用不同的参数值,我们的模型结论是否会有所不同(技术附录 3)。我们运行了 10,000 次模型,每次随机改变 3 个参数,并寻找导致 5 岁儿童观察到的发病率和模拟发病率之间存在重大差异的单个参数和参数组合<。为了测试从定植中恢复率的影响,我们还重新调整了模型,并在该参数的极端值下运行了几种疫苗接种场景。
模型拟合

图2.观察和模拟 3 个人群中 <5 岁儿童 b 型侵袭性流感嗜血杆菌的发病率:(A) 美国;(B) 英格兰和威尔士;(c) 阿拉斯加原住民。PRP-OMP,Hib聚核糖基核糖醇磷酸多糖偶联脑膜炎奈瑟菌外膜蛋白;HbOC、b嗜血杆菌结合疫苗;PRP-T,与破伤风类毒素偶联的聚核糖基磷酸核糖醇。
该模型准确地再现了整个美国在引入疫苗之前按年龄组观察到的携带率(伪 R)20.74)和阿拉斯加原住民(伪R)20.98),有运输数据的 2 个种群。该模型还准确再现了在美国 <5 岁儿童中观察到的侵袭性 Hib 年发病率(伪 R)20.97),在英格兰和威尔士(伪R)20.91)和阿拉斯加原住民(伪R)20.90)(图2)。值得注意的是,该模型捕捉到了从1999年开始英国Hib发病率的上升,以及与1996/1997年改用HbOC疫苗有关的阿拉斯加原住民侵袭性疾病的增加。
感染力
对于美国以及英格兰和威尔士,最合适的感染力表明,在引入疫苗之前,Hib的传播是由2-4岁的儿童驱动的(表)。这两个人群中所有年龄段的人都主要通过与该年龄组的儿童接触而定居。例如,在美国人口中,2岁儿童的年感染力为36.3例/1000<儿童,其中24.3例(66.9%)是由2至4岁年龄组的儿童引起的。
此外,该模型表明,阿拉斯加原住民人群的 Hib 传播动态与其他 2 个建模人群不同。在阿拉斯加原住民人群中,在引入疫苗之前,大多数Hib传播是通过与5-9岁儿童接触的,而不是2-4岁的儿童(表)。此外,还存在更强的分类混合因素,因为<2岁的儿童从其他<2岁的儿童获得感染,>10岁的儿童从其他>10岁的儿童获得感染。
Hib疫苗短缺可能影响的模型预测
如果美国 Hib 疫苗短缺和 12-15 个月加强剂量的推迟无限期延长,该模型预测在任一短缺情景下,前 3 年<5 岁儿童侵袭性 Hib 发病率的变化相对较小(图 3,图 A)。从2011年开始,该模型预测,在无加强针短缺的情况下,Hib发病率将大幅增加(从2007年的0.14例/100,000名儿童增加到2012年的0.72例/100,000例,到2020年为5.7例/100,000例),在无加强针减去短缺的情况下,增幅略大。
如果阿拉斯加原住民不得不从PRP-OMP疫苗转向PRP-T疫苗,该模型预测5<岁儿童的Hib发病率将增加一倍以上(从2009年的17.9例/100,000名儿童增加到2011年的46.2例/100,000名)(图3,图B)。鉴于 5-9 岁的儿童似乎推动了阿拉斯加原住民人群的传播,我们模拟了 2010 年为 5-9 岁儿童增加 1 次疫苗接种活动对从 PRP-OMP 到 PRP-T 疫苗的转换的影响。该模型预测,这样的疫苗接种活动将使 Hib 的发病率在 8 年内保持在 PRP-T 疫苗情景的以下(图 3,图 B)。对 1-4 岁儿童进行 1 次加强针运动的效果相似(图 3,图 B)。
引入疫苗的替代方法
在具有美国年龄分布和传播模式的假设人群中,引入疫苗的最有效策略是在 12-15 个月大时将疫苗作为初级系列和加强剂引入(图 4,图 A)。使用PRP-T疫苗,我们发现这种策略导致发病率迅速下降,平衡发病率最低,即0.22例/100,000名<5岁儿童。在 12-15 个月大时仅提供 1 剂疫苗的策略,没有初级系列,预计对 Hib 发病率的影响几乎同样大,均衡发病率为 0.47 例/100,000 名 <5 岁儿童。仅使用初级系列或具有 1 次补种运动的初级系列的策略效果要差得多,导致均衡发病率为 11.0 例/100,000 名 <5 岁儿童。
在具有阿拉斯加原住民年龄分布和传播模式的假设人群中,PRP-T疫苗最有效的策略是接种初级系列疫苗,并在12-15个月时接种加强剂量,其均衡发病率为50.4例/100,000名儿童<5岁)(图4,图B)。仅进行初级系列研究和进行 1 次补种的初级系列均衡发病率为 136.2 例/100,000 名 <5 岁儿童。与美国人群一样,在 12-15 月龄时接种单剂疫苗的策略优于单独的初级系列疫苗,无论是否进行 1 次补种。然而,101.7例/100,000例<5岁儿童的均衡发病率明显高于初级加加强针策略。
敏感性分析
我们发现,该模型对除定植恢复率(技术附录3)以外的所有参数的变化都是稳健的。为了了解我们的模型中关于Hib流行病学的结论是否会因该恢复率的值而有所不同,我们尝试在快速和慢速恢复率的情况下拟合模型。结果表明,即使在携带的平均恢复率值极为不同的情况下,我们关于Hib动力学和疫苗接种计划效果的结论也不会改变。
我们开发了一种灵活的Hib传播和疾病模型,可以应用于多种情况。该模型可以解释 Hib 流行病学的许多基本特征,包括引入疫苗后美国 Hib 发病率迅速下降;追赶运动 7 年后英国 Hib 发病率的上升;以及 1996 年疫苗从 PRP-OMP 改为 HbOC 后阿拉斯加原住民人群中 Hib 发病率的增加。
我们的模型提出了对 Hib 流行病学和 Hib 疫苗接种计划设计的几个重要见解。首先,我们的模型表明,在美国、英格兰和威尔士,Hib的传播是由2-4岁的儿童驱动的。这与先前的Hib模拟模型形成鲜明对比,该模型表明,向特定年龄组的人传播主要来自同一年龄组的其他人(分类混合)(26-28)。一个模型表明,成年人在各个年龄组中也发挥着重要作用(27)。然而,这些传播模式并不能解释1988-1990年美国Hib发病率的迅速下降,当时Hib结合疫苗只提供给18-24个月大的儿童。在此期间,即使在 1 <岁儿童中,发病率也有所下降,只有当 >18 个月大的儿童是 Hib 传播的主要驱动因素时,才有可能产生这种影响。
其次,我们的模型表明,Hib传播动态因人群而异。与美国、英格兰和威尔士的最佳拟合模型的结果不同,阿拉斯加原住民的最佳拟合模型表明,传播主要由5-9岁的儿童驱动,并带有一些分类混合因素。这些差异对Hib疫苗接种计划的设计有重大影响。例如,我们的模型表明,在美国、英格兰和威尔士,在 12-15 个月大时接种 1 剂疫苗在人群水平上几乎与 12-15 个月大时的完整初级系列和加强剂一样有效。相比之下,在 12-15 个月时仅提供单剂疫苗对阿拉斯加原住民的效果要差得多。此外,预计 PRP-T 疫苗对阿拉斯加原住民的有效性远低于 PRP-OMP 疫苗,因为在阿拉斯加原住民中,即使对于年幼的婴儿,感染力也很高,并且 PRP-OMP 在 2 个月大时首次接种后会刺激保护性抗体。阿拉斯加原住民婴儿的高感染力与1996-1997年阿拉斯加原住民中观察到的Hib发病率的跳跃一致,当时改用HbOC疫苗,直到6个月大时接种第三剂才诱导保护性抗体(11)。规划最佳疫苗接种计划应包括对目标人群中Hib传播动态的一些评估。我们的模型可用于从特定年龄的定植患病率和侵袭性 Hib 的特定年龄发病率来估计这些动态。
世界卫生组织建议所有常规婴儿疫苗接种计划都包括婴儿期的结合Hib疫苗,无论是否在以后的生活中接种加强剂(29)。大多数有Hib疫苗接种计划的国家都符合这些指南(30)。我们的研究提出了 Hib 疫苗接种计划设计的 2 个潜在实际应用。首先,对于某些人群,在 12-15 个月大时接种单剂疫苗的政策将减少侵袭性 Hib,几乎与 3 剂初级系列加加强剂一样多。此外,在某些人群中,12-15 个月的单剂可能比没有加强剂的 3 剂初级系列更能减少 Hib 疾病。需要进一步探索在 12-15 月龄时接种单剂 Hib 结合疫苗作为完整的常规免疫计划的潜在效用。其次,计划将Hib疫苗纳入其常规免疫规划的国家可以将该模型应用于有关Hib疾病和定植的当地或区域数据,以描述正在考虑的疫苗接种方案的潜在效果。
我们的研究有一些值得强调的局限性。首先,与所有模型一样,我们的模型必然简化了基本现实。我们将所有 10 >的人合并为一个组,因为 Hib 定植和发病率数据不足以可靠地模拟这一广泛类别中的更多年龄组。因此,该年龄组的估计传播动态代表了青少年和成人的平均值,并可能掩盖了这些群体之间的异质性。其次,模型的好坏取决于源数据;如果文献中对模型参数的估计不准确,我们的模型可能不准确。我们进行了广泛的敏感性分析来探索这一点(技术附录 3),并发现该模型对大多数参数的变化具有鲁棒性。例外是从Hib定植中恢复的速度。这一发现是有道理的,因为传染性持续时间是疾病传播的主要决定因素。然而,我们确信这种敏感性不会影响我们的结论,因为对这个比率使用差异很大的值不会改变基本模型的结论。第三,我们假设自然感染后的免疫力与接种疫苗后的免疫力相同,而实际上,自然感染可能会诱导更持久的保护。我们的模型可以更准确地再现英格兰和威尔士的 Hib 发病率,而不是使用不同参数进行疫苗诱导与自然免疫的模型 (28)。这表明疫苗接种和自然感染之间的保护差异可能不是流行病学上的必要条件;然而,探索这一点是未来研究的主题。
我们研究的一个优势是,我们的模型足够复杂,可以成功地在各种人群中对Hib进行建模,但又足够简单,可以从相对有限的携带和发病率数据中估计传播参数。第二个优势是,与Leino等人(27)一样,我们使用迭代过程来完善传输参数的初始估计。与将矩阵限制为某些参数组合(26)或手动选择初始值而无需进一步细化(28)时相比,此过程具有更大的灵活性。
我们的 Hib 模拟模型对于正在考虑实施 Hib 疫苗接种计划的国家的公共卫生规划人员以及必须应对 Hib 疫苗短缺的国家来说是一个有用的工具。该模型表明了幼儿在 Hib 传播中的重要性,需要在 12-15 个月大时接种一剂疫苗以维持对 Hib 疾病的群体免疫力,以及评估 Hib 传播动力学对优化疫苗计划的重要性。
杰克逊博士是美国华盛顿州西雅图集团健康研究所的助理科学研究员。他是一名传染病流行病学家,研究兴趣是估计疫苗可预防疾病的发病率和死亡率的方法以及疫苗接种计划的有效性。
确认
我们感谢 Ros Singleton、Dana Bruden 和 Debra Parks 对手稿的有益贡献。
引用
- Adams WG、Deaver KA、Cochi SL、Plikaytis BD、Zell ER、Broome CV,Hib 疫苗时代儿童 B 型流感嗜血杆菌 (Hib) 疾病的下降。 贾马。1993年;269:221-6。DOI外部链接PubMed的外部链接Google 学术搜索外部链接
- Adegbola RA、Secka O、Lahai G、Lloyd-Evans N、Njie A、Usen S,在引入 Hib 结合疫苗进行常规免疫后,冈比亚消除 B 型流感嗜血杆菌 (Hib) 疾病:一项前瞻性研究。 柳叶刀。2005年;366:144-50。DOI外部链接PubMed的外部链接Google 学术搜索外部链接
- 拉姆齐 ME、麦克弗农 J、新泽西州安德鲁斯 、希思 PT、Slack 议员。通过使用筛选方法估计英格兰和威尔士的 b 型流感嗜血杆菌疫苗有效性。 J 感染 Dis.2003年;188:481-5。DOI外部链接PubMed的外部链接Google 学术搜索外部链接
- 辛格尔顿 R、哈米特 L、轩尼诗 T、布尔科夫 L、德拜尔 C、帕金森 A、 阿拉斯加 B 型流感嗜血杆菌经验:控制疫苗可预防疾病的经验教训。 儿科。2006年;118:E421-9。DOI外部链接PubMed的外部链接Google 学术搜索外部链接
- 麦克弗农 J、霍华德 AJ、Slack MPE、拉姆齐 ME。疫苗接种对英国乙型流感嗜血杆菌 (Hib) 携带的长期影响。 流行病学感染。2004年;132:765-7。DOI外部链接PubMed的外部链接Google 学术搜索外部链接
- Mohle-Boetani JC、Ajello G、Breneman E、Deaver KA、Harvey C、Plikaytis BD,广泛接种结合型流感嗜血杆菌 b 型疫苗后儿童携带 b 型流感嗜血杆菌。 Pediatr Infect Dis J.1993年;12:589-93。DOI外部链接PubMed的外部链接Google 学术搜索外部链接
- Galil K、Singleton R、Levine OS、Fitzgerald MA、Bulkow L、Getty M,侵袭性 b 型流感嗜血杆菌疾病在阿拉斯加偏远地区接种疫苗的人群中重新出现。 J 感染 Dis.1999年;179:101-6。DOI外部链接PubMed的外部链接Google 学术搜索外部链接
- Oh SY、Griffiths D、John T、Lee YC、Yu LM、McCarthy N, 学龄儿童:英国乙型流感嗜血杆菌持续循环的宿主。 J 感染 Dis.2008年;197:1275-81。DOI外部链接PubMed的外部链接Google 学术搜索外部链接
- 美国疾病控制与预防中心。使用乙型流感嗜血杆菌 (Hib) 结合疫苗的临时建议与召回某些批次的含 Hib 疫苗(PedvaxHIB 和 Comvax)有关。 MMWR Morb Mortal Wkly 代表。2007年;56:1318-20。PubMed的外部链接Google 学术搜索外部链接
- 美国疾病控制与预防中心。乙型流感嗜血杆菌 (Hib) 疫苗 (Hiberix) 的许可和更新的 Hib 疫苗使用建议。 MMWR Morb Mortal Wkly 代表。2009年;58:1008-9。PubMed的外部链接Google 学术搜索外部链接
- 布鲁斯 M、辛格尔顿 R、莱姆 M、祖尔茨 T、温格 J、轩尼诗 T.阿拉斯加和加拿大儿童的嗜血杆菌病 [作者回复]。Pediatr Infect Dis J.2010年;29:186-7。DOI外部链接PubMed的外部链接Google 学术搜索外部链接
- 汉普顿 CM、巴伦坎普 SJ、格兰诺夫 DM。b型流感嗜血杆菌分离株与普通人群健康儿童和患病患者的外膜蛋白亚型比较。 临床微生物学杂志。1983年;18:596-600。PubMed的外部链接Google 学术搜索外部链接
- 迈克尔斯 RH、Poziviak CS、Stonebraker FE、Norden CW。影响儿童咽部b型流感嗜血杆菌定植率的因素。 临床微生物学杂志。1976年;4:413-7。PubMed的外部链接Google 学术搜索外部链接
- 美国疾病控制与预防中心。1987-1995年美国在婴儿和儿童中消除乙型流感嗜血杆菌疾病的进展。 MMWR Morb Mortal Wkly 代表。1996年;45:901-6。PubMed的外部链接Google 学术搜索外部链接
- 美国疾病控制与预防中心。1998-2000年美国在婴儿和儿童中消除b型流感嗜血杆菌侵袭性疾病的进展。 MMWR Morb Mortal Wkly 代表。2002年;51:234-7。PubMed的外部链接Google 学术搜索外部链接
- 美国疾病控制与预防中心。2001年,主动细菌核心监测(ABCs)报告,新发感染计划网络流感嗜血杆菌。2002 [引自 2009 年 11 月 15 日]。http://www.cdc.gov/abcs/reports-findings/survreports/hib01.pdf
- 美国疾病控制与预防中心。2002年流感嗜血杆菌(Haemophilus influenzae)新发感染计划网络(Active Bacterial Core Surveillance (ABCs)报告。2003 [引自 2009 年 11 月 15 日]。http://www.cdc.gov/abcs/reports-findings/survreports/hib02.pdf
- 美国疾病控制与预防中心。主动细菌核心监测 (ABC) 报告新发感染计划网络,2003 年流感嗜血杆菌。2004 [引自 2009 年 11 月 15 日]。http://www.cdc.gov/abcs/reports-findings/survreports/hib03.pdf
- 美国疾病控制与预防中心。主动细菌核心监测 (ABC) 报告新发感染计划网络,流感嗜血杆菌 2004 年。2005 [引自 2009 年 11 月 15 日]。http://www.cdc.gov/abcs/reports-findings/survreports/hib04.pdf
- 美国疾病控制与预防中心。主动细菌核心监测 (ABC) 报告新发感染计划网络,2005 年流感嗜血杆菌。2006 [引自 2009 年 11 月 15 日]。http://www.cdc.gov/abcs/reports-findings/survreports/hib05.pdf
- 美国疾病控制与预防中心。主动细菌核心监测 (ABC) 报告新发感染计划网络,流感嗜血杆菌 2006 年。2007 [引自 2009 年 11 月 15 日]。http://www.cdc.gov/abcs/reports-findings/survreports/hib06.pdf
- 美国疾病控制与预防中心。主动细菌核心监测 (ABC) 报告新发感染计划网络,流感嗜血杆菌 2007 年。2008 [引自 2009 年 11 月 15 日]。http://www.cdc.gov/abcs/reports-findings/survreports/hib07.pdf
- Granoff DM、Anderson EL、Osterholm MT、Holmes SJ、McHugh JE、Belshe RB,三种 b 型流感嗜血杆菌结合疫苗在婴儿中的免疫原性差异。 J 儿科。1992年;121:187-94。DOI外部链接PubMed的外部链接Google 学术搜索外部链接
- 怀特 KE、帕布斯特 LJ、卡伦 KA。在疫苗短缺期间,最新的乙型流感嗜血杆菌疫苗接种覆盖率。 儿科。2011年;127:E707-12。DOI外部链接PubMed的外部链接Google 学术搜索外部链接
- 科恩 PG、希思 PT、加内特 GP。牛津地区的Hib免疫规划:疫苗接种对疾病发病率影响的分析。 流行病学感染。1999年;123:389-402。DOI外部链接PubMed的外部链接Google 学术搜索外部链接
- 莱诺 T、塔卡拉 T、奥拉宁 K、马克拉 PH、塔卡拉 AK。通过乙型流感嗜血杆菌疫苗接种获得的间接保护:结构化人群模型分析。 流行病学感染。2004年;132:959-66。DOI外部链接PubMed的外部链接Google 学术搜索外部链接
- 麦克弗农 J、拉姆齐 ME、麦克莱恩 AR。了解Hib结合疫苗对英国传播、免疫和疾病的影响。 流行病学感染。2008年;136:800-12。DOI外部链接PubMed的外部链接Google 学术搜索外部链接
- 世界卫生组织。世卫组织关于b型流感嗜血杆菌结合疫苗的立场文件。(取代世卫组织先前在《流行病学周刊》上发表的关于Hib疫苗的立场文件。Wkly Epidemiol Rec.2006年;81:445-52。PubMed的外部链接Google 学术搜索外部链接
- 世界卫生组织。世卫组织疫苗可预防疾病监测系统。2010 [引自 2010 年 6 月 18 日]。http://apps.who.int/immunization_monitoring/en/globalsummary/scheduleselect.cfm外部链接
数字
桌子
Hits: 57