Contents
Interim guidance on the use of Imvamune® in the context of a routine immunization program
序文
国家免疫咨询委员会(NACI)是一个外部咨询机构,为加拿大公共卫生局(PHAC)提供独立、持续和及时的医疗、科学和公共卫生建议,以回答PHAC提出的与免疫有关的问题。
除了疾病负担和疫苗特性之外,PHAC还扩大了NACI的权限,使其包括在制定循证建议时系统考虑方案因素,以促进省和地区两级公共资助疫苗计划的及时决策。
NACI系统考虑的其他因素包括:经济、伦理、公平、可行性和可接受性。并非所有NACI声明都需要对所有方案因素进行深入分析。虽然将使用循证工具对方案因素进行系统考虑,以确定可能影响建议制定决策的独特问题,但将只包括被确定为特定于疫苗或疫苗可预防疾病的独特问题。
本声明包含NACI的独立意见和建议,这些意见和建议是基于现有的最佳科学知识。该文件正在分发,以供参考。接种疫苗的人也应该知道相关产品专论的内容。此处列出的使用建议和其他信息可能与加拿大疫苗制造商的产品专论中列出的不同。只有当疫苗按照产品专论使用时,制造商才寻求疫苗的批准并提供其安全性和有效性的证据。NACI成员和联络成员在PHAC关于利益冲突的政策范围内行事,包括每年申报潜在的利益冲突。
信息概要
以下强调了免疫提供者的关键信息。详情请参阅声明的其余部分。
什么
- Mpox疾病:Mpox是由哺乳动物猴痘病毒(MPXV)引起的正痘病毒属与牛痘、牛痘以及天花病毒有关。临床表现包括通常位于口腔和/或肛门生殖器区域的痘样病变、发热、身体疼痛、背痛和淋巴结肿大。自2022年以来,mpox已在包括加拿大在内的多个先前非MPXV流行的国家得到报告。有关加拿大mpox的更多信息,请访问猴痘.
- Imvamune®疫苗:Imvamune®是一种非复制型第三代天花疫苗,由巴伐利亚Nordic公司生产,在加拿大获得授权,用于主动免疫接种天花疫苗mpox及相关疫苗正痘病毒属年龄在18岁及以上的成人感染和疾病被确定为mpox暴露的高风险人群。Imvamune®上的证据针对mpox的疫苗效力(VE)持续累积;自2022年以来,在活跃的mpox疫情期间启动的大量观察性研究报告了针对症状性mpox的高ve。Imvamune®上可用的临床和上市后安全性监测数据证明疫苗具有良好的耐受性。成人在注射1剂和/或2剂后报告的最常见不良事件(AE)为不严重的注射部位反应(如肿胀、疼痛)和全身反应(如疲劳、头痛)。
谁
NACI对公共卫生计划和个人决策提出以下建议:
- mpox高危人群应接受两剂Imvamune®至少间隔28天(4周)给药。
- Imvamune®疫苗接种可以同时(即同一天)或在其他活疫苗或非活疫苗之前或之后的任何时间进行。
- 剂量应通过皮下注射给药。在常规免疫接种中,不推荐使用皮内给药的剂量节约策略。
- 那些用Imvamune®开始初选的人已经超过28天没有接受第二次剂量的患者,应当接受第二次剂量,而不考虑自第一次剂量以来的时间。
- 曾接种过天花疫苗(例如上一代活复制疫苗)的人,建议接受免疫接种®基于mpox的风险因素,还应接受2剂系列,间隔至少28天。
- NACI Imvamune使用指南®在常规免疫接种的情况下,计划应被认为是临时性的,一旦有新的证据出现,将对其进行重新评估。基于mpox风险增加的疫苗合格性应由可用的临床证据和正在进行的流行病学提供信息。风险因素可能会随着时间的推移而变化,应由当地和/或省/地区公共卫生部门进行评估。
- 目前,加拿大被认为具有mpox高风险的个人包括:
- 符合以下一项或多项标准的男男性行为者:
- 有不止一个伴侣
- 在一段关系中,至少有一方有其他性伴侣
- 在过去一年中被确诊为性传播感染
- 在性场所有过性接触。
- 符合上述标准的个人的性伴侣。
- 性工作者(不考虑性别、出生时指定的性别或性取向)。
- 在工作人员可能接触可能被mpox污染的污染物的场所发生性行为的员工或志愿者。
- 从事性旅游的人(不论性别、出生时指定的性别或性取向)。
- 预期会经历上述任何情况的个人。
- 符合以下一项或多项标准的男男性行为者:
- NACI继续推荐使用Imvamune®作为暴露后疫苗接种(也称为暴露后预防),用于对可能或确诊的mpox病例有高风险暴露的个人,或在发生传播的环境中,如果他们没有接受两剂暴露前疫苗接种。
- 应尽快提供暴露后疫苗剂量,最好是在最后一次暴露后4天内,但也可以考虑在最后一次暴露后14天内。
- 28天后,如果MPVX感染没有发展,不管持续暴露状态如何,都应提供第二剂。
- 既往有或正在感染MPXV的个体不应给予Imvamune®免疫
- 对于那些符合暴露后疫苗接种标准的人群,建议在儿科人群中使用标签外药物,并可由临床医生酌情提供。
- Imvamune®疫苗接种可以同时(即同一天)或在其他活疫苗或非活疫苗之前或之后的任何时间进行。
男男性接触者:男人或双性认同与另一个认同为男人的人发生性关系的个体,包括但不限于自我认同为跨性别、顺性别、双性、性别酷儿、双性人和非二元的个体。
为什么
- 虽然自2022年秋季以来,mpox在加拿大的发病率显著下降,但mpox仍然是一个重要的公共卫生问题,有可能在未来死灰复燃。
- 在NACI为Imvamune®提供指导后暴露前疫苗接种,大多数加拿大管辖区按照NACI指南向人口/群体提供疫苗。在整个加拿大,自我认定为同性恋、双性恋或其他男男性行为者(gbMSM)的个人被认为具有暴露于mpox的高风险(例如,多个性伴侣、最近的性传播感染;STI)符合Imvamune®的资格暴露前接种疫苗;然而,其他群体(如性工作者)的特定风险因素和资格因管辖区域而异。
- 截至2023年12月10日,加拿大实施了约143,471剂疫苗,主要在安大略省(52,747人)、魁北克省(46,870人)和不列颠哥伦比亚省(30,168人)。具体来说,103,572人接种了至少一剂Imvamune的mpox疫苗®为应对此次疫情,39,631人接种了两剂疫苗脚注1.
- 由于加拿大mpox流行病学的发展和新出现的关于病毒性脑炎的证据,加拿大各省和地区,以及几个利益相关者,已经表明需要在正在发生的mpox疫情之外的暴露前疫苗接种方面的国家指导。这包括确定暴露前接种疫苗的优先人群,并在重点常规免疫计划的背景下指导推荐的疫苗接种时间表。
背景
Mpox病
Mpox是由哺乳动物猴痘病毒(MPXV)引起的正痘病毒属与牛痘、牛痘以及天花病毒有关。MPXV在非洲中部和西部的多个地区流行脚注2。在2022年多国爆发之前,mpox被认为是一种罕见的人畜共患病。它通过接触体液、皮肤或内部粘膜表面(如口腔、咽喉、肛门生殖器区域)的损伤、被污染的物体和呼吸道飞沫传播。MPXV被细分为两个分支:分支I和分支II(以前分别为中非和西非分支),前者与更严重的疾病相关脚注3。进化枝II有两个子条目,其中进化枝IIb是2022年全球爆发的原因脚注4.
Mpox通常是一种温和的自限性疾病,大多数受感染的个体在两到四周内康复。症状在接触后7到21天内出现,包括皮疹、发烧、身体疼痛、背痛和淋巴结肿大。2022年爆发的临床表现通常包括口腔和/或肛门生殖器病变,以及面部、口腔、咽喉、手掌和脚底的病变。mpox的潜在并发症包括皮肤感染、肺炎、败血症、吞咽疼痛或困难、视力丧失、脑炎、心肌炎和死亡脚注5。在2022年mpox爆发期间,报告表明,未受控制的人类免疫缺陷病毒(艾滋病毒)感染的个人患严重疾病的风险更高脚注6脚注7脚注8。幼儿、孕妇和孕妇以及免疫功能低下的人患严重mpox疾病的风险也更高脚注5
mpox疫苗在加拿大的历史:以前的NACI指南和省/地区免疫规划
Imvamune®(改良安卡拉-巴伐利亚北欧痘苗[MVA-BN])在加拿大所有省份和地区均有供应。NACI首先发布了Imvamune®的使用指南2022年6月10日,在以前非mpox流行的国家中mpox疫情迅速发展的背景下。NACI提供了关于Imvamune®的初步临时建议针对mpox的暴露后疫苗接种,以及从事复制工作的人员指南正痘病毒在研究实验室环境中脚注9脚注10。NACI随后更新了Imvamune®的使用指南2022年9月23日,建议暴露前接种mpox疫苗脚注11。当时,NACI基于流行病学数据和可能增加风险的特定因素(例如,主流媒体符合高风险标准的人、性工作者、在性场所工作的个人)。
虽然自2022年秋季以来,mpox在加拿大的发病率显著下降,但mpox仍然是一个重要的公共卫生问题,有可能在未来死灰复燃。在NACI为Imvamune®提供指导后暴露前疫苗接种,大多数加拿大管辖区向符合该指南的人口/群体提供疫苗。在整个加拿大,自我认定为gbMSM且被认为具有mpox暴露高风险的个人(例如,多个性伴侣、最近的性传播感染)有资格获得Imvamune®暴露前接种疫苗;然而,其他群体(如性工作者)的特定风险因素和资格因管辖区域而异。截至2023年12月10日,加拿大实施了约143,471剂疫苗,主要在安大略省(52,747人)、魁北克省(46,870人)和不列颠哥伦比亚省(30,168人)。具体而言,103,572人接种了至少一剂疫苗,39,631人接种了两剂Imvamune®疫苗脚注1
由于加拿大mpox流行病学的发展和Imvamune®疫苗有效性的新证据,加拿大各省和地区,以及几个利益相关者,已经表明需要在正在发生的mpox疫情之外的暴露前疫苗接种方面的国家指导。这包括确定暴露前接种疫苗的优先人群,并在重点常规免疫计划的背景下指导推荐的疫苗接种时间表。
目标
本NACI声明的目的是审查现有证据,并就Imvamune®的使用提供临时指导在针对高危人群的集中临时常规免疫计划中预防mpox。
方法
简而言之,本《NACI临时指南》声明的准备阶段大致如下:
- 自2022年多国爆发以来加拿大和全球mpox疾病负担分析。
- 知识综合(检索和总结单个研究,使用Cochrane 2.0或ROBINS-I方法评估VE单个研究的证据质量-在疫苗有效性数字中总结)
- 综合利弊证据,考虑综合证据的质量和跨研究观察到的影响程度。
- 使用已公布的同行评审框架和循证工具,确保与伦理、公平、可行性和可接受性相关的问题得到系统评估并纳入指南(EEFA)。
- 经济评价:在对常规Imvamune®免疫进行经济评价的同时,加拿大没有开展免疫计划,该指南被认为是临时性的,将在获得更多证据后进行重新评估。将来可能会考虑成本效益分析。
- 利用NACI证据到决策框架,将证据和方案考虑转化为建议。
有关更多信息,请参见以下内容:
制定了一个框架,以便在为及时、透明的决策制定明确、基于证据的建议时,系统地考虑方案因素(现已纳入NACI的任务规定,包括道德、公平、可行性、可接受性)脚注12。该框架提供了一个清晰的轮廓,并附有循证工具,以考虑可能对NACI建议的执行产生影响的每个方案因素的相关方面。这一框架已被纳入声明。
对于该临时指南,NACI审查了NACI mpox工作组(WG)提出的关键问题,包括要预防的疾病负担和疾病负担最重的人群、疫苗安全性、疫苗功效/有效性、疫苗供应以及整体免疫策略的其他方面。知识综合由NACI秘书处进行,并由NACI mpox工作组监督。在对单个研究进行严格评估后,根据情况编制了Cochrane 2.0和ROBINS-I提供的偏倚风险评级汇总表(见附录)。NACI秘书处使用决策证据(EtD)框架向NACI mpox工作组提供了对证据主体的评估,并提出了工作组意见建议。
NACI考虑了在2022年审议期间从利益相关者团体获得的反馈,这些利益相关者团体代表被认为具有mpox暴露高风险的社区和团体。公共卫生伦理咨询小组(PHECG)在2022年的咨询中也提供了意见,加拿大免疫委员会(CIC2023年8月)和PHAC。Imvamune®的使用指南在国际旅行的背景下是与加拿大热带医学和旅游咨询委员会(CATMAT)合作开发的。描述相关考虑事项、具体决策的基本原理和知识差距。NACI审查了现有证据,并于2024年3月26日批准了更新指南。
本声明涉及的政策问题是:
- 考虑到以前、现在和预计的流行病学,应该推荐哪些人群定期接受免疫接种®为了预防mpox?
- 在持续充足疫苗供应的情况下,推荐的免疫时间表是什么Imvamune®用于预防mpox,包括主要系列和附加剂量?
- 建议(包括疫苗使用/时间表)是否基于临床考虑因素(如免疫缺陷、mpox病史)或既往天花疫苗接种史而有所不同?
流行病学
加拿大的mpox负担
2022年,在多国疫情开始期间,加拿大于2022年5月19日向加拿大公共卫生局(PHAC)报告了首例病例,当时是在先前非流行地区的多国疫情开始期间。在2022年5月19日至2023年12月31日期间,9个省和1个地区共报告了1,541例病例(1,465例确诊病例和76例可能病例)、46例住院治疗和无死亡病例。病例数最高的是安大略省(737例)、魁北克省(531例)和不列颠哥伦比亚省(213例)。与全球趋势一致,加拿大的mpox病例主要在gbMSM中报告(96%;年龄中位数:36岁),性接触是报告的主要传播方式脚注13。根据2022年5月19日至2023年12月31日的可用数据,一小部分病例报告了可能的非性接触,包括通过呼吸道分泌物的人际传播、与已知或疑似病例的家庭接触、职业接触、大型聚会和共用药物设备。在加拿大有艾滋病毒状况信息的mpox病例总数中(1541例中的884例;截至2023年12月31日),30%是艾滋病毒携带者。加拿大没有医院获得性mpox的报告(即没有医院内传播的报告)。截至2023年12月31日,加拿大卫生保健工作者中已有92例mpox病例(85例确诊;7可能)。根据现有信息,医务工作者中的病例可能是通过性接触感染的。自2022年疫情高峰期以来,mpox病例大幅下降。在2023年1月1日至12月31日期间,加拿大报告了70例确诊的mpox病例脚注1.
自2022年多国爆发以来mpox的全球负担
与2022年相比,2023年全球mpox发病率大幅下降脚注14。然而,东南亚和刚果民主共和国(DRC2023年的进化枝I特异性爆发),美洲和欧洲最近报告了mpox病例的增加脚注14脚注15。在2022年1月1日至2023年12月31日期间,所有六个世卫组织地区的117个国家报告了93,030例确诊病例,652例可能病例和176例死亡。在2022年之前该疾病尚未流行的国家中,包括加拿大,mpox主要通过性接触(83.2%)和男男性行为者(85.3%)传播。大多数病例发生在18-44岁(79.4%)的男性(96.4%),平均年龄为34岁。非性暴露环境包括家庭接触、大型活动/聚会、纹身店和工作场所脚注14脚注16。在已知感染艾滋病毒的病例中,52.1%是艾滋病毒携带者。向世卫组织报告的病例中约有4.1%是卫生工作者,其中大多数暴露于社区环境(即非医疗保健暴露)脚注14。虽然关于性工作者mpox的数据有限,但在一个多国病例系列中,在顺性别和变性妇女以及出生时被指定为女性的非二元个体中报告了35例mpox病例(在15个国家中有136例确认的mpox病例,病例报告发生在2022年5月11日至2022年10月4日之间)脚注17.
目前在欧洲、美国和加拿大流行的MPXV分支属于分支II,特别是亚分支IIb,与分支I相比,它与较轻的疾病有关。从历史上看,分支I感染与性接触传播无关。然而,2023年3月,刚果民主共和国确认了一组性传播clade I mpox病例。主要病例患者是一名来自刚果民主共和国的男子,他报告在欧洲和刚果民主共和国有多次性接触,这导致了另外5例PCR阳性的MPXV病例。这一发现表明,mpox通过性接触的传播超出了进化枝IIb,并强调了在mpox流行和非流行地区进行更多常规筛查的必要性脚注18.
mpox的临床表现
最常报告的mpox症状包括皮疹(任何皮疹- 89.8%,全身皮疹- 54.7%,生殖器皮疹- 49.4%),发热(58.4%),淋巴结病(29.8%)和头痛(29.2%)脚注14。自2022年以来,生殖器皮疹在病例中更为常见(例如,进化枝IIb通过性接触传播的主要来源)与mpox流行地区的病例相比(例如,进化枝I或进化枝II)。虽然罕见(占总病例的0.7%),但仍有无症状病例被描述世卫组织,2023年)脚注14。虽然大多数mpox患者仅出现轻微症状,但有些人会发展为严重疾病。现有证据表明,未接种疫苗的艾滋病毒感染未得到控制的人面临更大的严重感染、住院和死亡风险脚注6脚注7脚注8.
疫苗
获准在加拿大使用的制剂
Imvamune®(也叫MVA-BN,Jynneos®,Imvanex®)是由巴伐利亚北欧公司制造的非复制型第三代天花疫苗。Imvamune®于2013年11月21日在加拿大首次获准使用,作为政府紧急使用的特殊用途新药申请(EUNDS ),用于对18岁及以上有第一代或第二代天花疫苗禁忌症的人进行主动免疫接种,以预防天花感染和疾病。Imvamune®随后于2020年11月5日在EUNDS的补充下获得批准,用于主动预防天花、mpox和相关疾病正痘病毒属18岁及18岁以上的成年人的感染和疾病被确定为暴露的高风险。
有关Imvamune的更多信息包含在加拿大卫生部的产品专论中药品数据库。
| 产品品牌名称和配方 | Imvamune®(天花和mpox疫苗) |
|---|---|
| 疫苗类型 | 改良安卡拉-巴伐利亚北欧痘苗病毒®(MVA-国阵) (减毒活菌,非复制型) |
| 在加拿大的授权日期 | 首次批准日期:2013年11月21日 Mpox作为扩展适应症的授权日期:2020年11月5日 最新修订日期:2023年8月3日 |
| 授权使用年龄 | 18岁及以上的成年人被确定为高暴露风险 |
| 剂量 | 每剂0.5毫升(至少0.5×108MVA传染科-BN) |
| 给药途径 | 皮下注射 |
| 推荐时间表脚注a对于主要系列 | 两剂,至少间隔28天给药 |
| 非药用成分 | 氨丁三醇脚注b(氨丁三醇,三) 氯化钠 注射用水 盐酸 痕迹: |
| 佐剂/防腐剂 | 该疫苗不含佐剂或防腐剂 |
| |
暴露前接种mpox疫苗Imvamune®免疫的功效/效果
NACI审查了关于Imvamune®的功效/有效性和安全性的现有证据作为预防mpox的暴露前疫苗接种,利用evergreen PHAC数据库中与Imvamune®相关的已出版和预印研究还有mpox。研究详情可在中找到附录A.
报告一剂或多剂Imvamune®的功效/效果的任何已发表或预印研究对于暴露前预防mpox和mpox相关疾病,分析中包括。可用的证据仅限于真实世界的疫苗有效性(VE)观察研究。迄今为止,已有10项研究报道了单剂量Imvamune®免疫的效果,抗mpox感染,其中五个还评估了2个剂量系列的效果。单剂量VE的范围从36% (95%可信区间(CI):22至47%)到86% (95% CI: 59至95%),而两剂量VE的范围从66% (95% CI: 47至78%)到89% (95% CI: 44至98%)。所有评估的单个研究总结如下(图1和图2).值得注意的是,应谨慎解释证据,因为研究被评估为具有严重偏倚风险(主要是由于对混杂和结果测量的关注)或中度偏倚风险(图1和图2).
抗mpox感染的有效性
两项加拿大研究报道了1剂量VE对抗症状性mpox感染(图1):
- 魁北克的一项试验阴性病例对照研究使用了通过自报问卷收集的管理/监测数据。研究期为2022年6月19日至9月24日,包括年龄≥18岁且无mpox感染史的男性。总共有532名男性被纳入研究(231名病例和301名对照)。在对年龄、日历时间和问卷中确定的更详细的暴露风险指标进行调整后,单剂量VE估计为65%(95% CI:1-87%)。仅使用管理数据的调整后VE (aVE)较低,为35% (95% CI: – 2至59%)脚注19.
- 在2022年6月12日至11月26日在安大略省进行的一项研究中,在target试验仿真中使用了关联的管理数据来估计18岁及以上男性的1剂ve。在3204名接种疫苗的男性样本中,他们与具有相似风险特征的未接种疫苗的男性1:1匹配,估计1剂VE为59%(95% CI:31-76%)脚注20.
- 在加拿大的两项研究中,如果接种第一剂疫苗后至少14天,则被归类为已接种。加拿大的研究没有报告2剂量VE的估计值,也没有特别针对被认为免疫低下的个体的VE(任何剂量)的估计值。
- 来自英国、西班牙和以色列的其他观察性研究也提供了Imvamune®的1剂量VE估计值对抗男性mpox感染。所有三项研究报告了相似的VE估计值,范围从78% (95%可信区间:54-89%)到86% (95%可信区间:59-95%)脚注21脚注22脚注23
- 美国的三项病例对照研究和一项回顾性队列研究提供了1剂和2剂ve对mpox感染的估计值(图1):
- 在最大的研究中(n=360人接受两剂Jynneos®),全国范围内的健康记录被用于评估2022年8月至11月期间18岁及以上成人中接受医学治疗的mpox疾病的1剂和2剂VE。病例与最多四名对照进行匹配,这些对照要么是新的HIV诊断,要么是HIV暴露前预防(PrEP)的新处方或重新处方。在调整了几个潜在的混杂变量后,单剂量的aVE估计为36%(95% CI:22-47%),而完整的2剂量方案的aVE估计为66%(95% CI:47-78%)。在免疫活性个体中,一剂和二剂VE分别为41% (95%可信区间:25-53%)和76% (95%可信区间:58-87%)。然而,由于疫苗覆盖率低,无法估计免疫低下个体的VE脚注24.
- 在2022年8月至2023年3月进行的另一项美国病例对照研究中获得了更高的VE估计值(n=206名接受两剂Jynneos®的个体).参与者年龄在18到49岁之间,性活跃,被确定为男男性行为者或跨性别者。病例与最近去过性健康、HIV护理或HIV暴露前预防(PrEP)诊所的多达四个对照进行匹配。在这里,1剂和2剂平均剂量分别估计为75% (95%可信区间:61-84%)和86% (95%可信区间:74-92%)。该研究还提供了按免疫低下状态分层的平均剂量估计值,免疫低下个体接受1剂和2剂平均剂量估计值分别为51% (95%可信区间:-28-81%)和70% (95%可信区间:-38-94%)脚注25.
- 第三项使用系统监测报告的美国病例对照研究于2022年7月至10月在纽约进行,对象为≥18岁的男性。这项研究使用同期对照,这些对照是被诊断为直肠淋病或一期梅毒的男性,并且假定有与男性或变性人的性接触史。该研究的结果(n=21个接受两剂Jynneos®的个体)与其他美国研究相似,估计1剂和2剂的平均相对危险度分别为68% (95%可信区间:25-87%)和89% (95%可信区间:44-98%)脚注26.
- 在西雅图的一项回顾性队列研究中,电子健康记录数据用于评估所有男男性行为者中的1剂和2剂ve,这些男性在2020年1月至2022年12月期间至少有一次健康诊所就诊(n=4,230)。结果与其他研究的估计一致,一剂和两剂的aVE估计值分别为81%(95% CI:64-90%)和83%(28-96%)脚注27.
- 与1剂和2剂方案中观察到的VE数据一致,美国最近的一项观察性研究发现,与单剂Jynneos®相比,两剂后的抗体滴度明显更高在以前没有接种过天花疫苗的患者中,在第1剂后33天和第2剂后21天测量的中位数。这项研究还报道了在第二次疫苗接种后约2.5至3个月,在那些以前没有接种天花疫苗的人(无论HIV感染状况如何)中,在2次剂量系列后的类似抗体滴度脚注28。然而,应该注意的是,其他研究没有显示ve和免疫原性之间的相关性,免疫疫苗的保护相关性仍然未知。
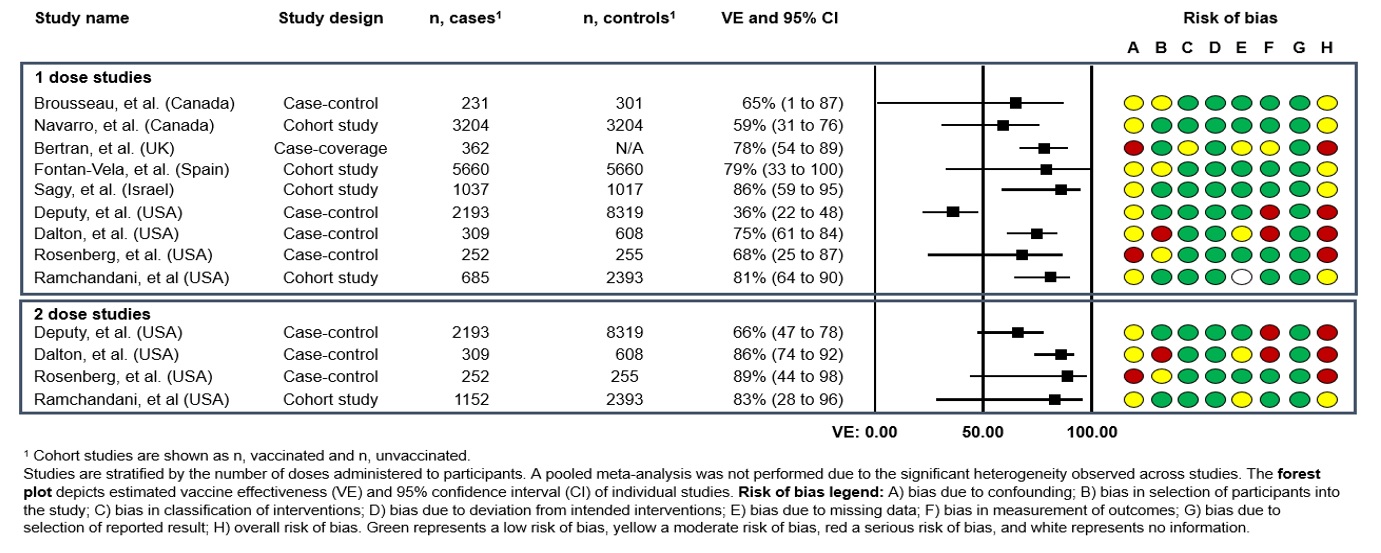
图1:描述性文本
对中度/重度mpox感染的有效性
两项研究提供了对Jynneos®免疫效果的估计,对抗中度至重度mpox感染(图2):
- 一项使用魁北克疫苗管理数据的试验阴性病例对照研究估计,1剂aVE对中度/重度mpox感染的预防率为82%(95% CI:-50-98%)。在本研究中,中度至重度mpox疾病被定义为mpox疾病相关的住院治疗、出现并发症或接受tecovirimat治疗。在研究期间,12名个体患有中度至重度mpox疾病,其中3名住院治疗。这12个人中只有一个人收到了Imvamune®脚注19.
- 美国的一项研究使用了加利福尼亚州2022年5月至2023年5月的监测数据,以估计接受和未接受Jynneos®的人因mpox住院的几率。Mpox相关住院定义为因mpox疾病住院,不包括急诊。在接受mpox治疗的住院患者中,4人(1.7%)接受了一剂,而只有1人(1.3%)接受了两剂。与未接种疫苗的个体相比,接受1或2剂Jynneos®的mpox患者的住院几率分别为0.27 (95%可信区间:0.08至0.65)和0.20 (95%可信区间:0.01至0.90)。在患有mpox和HIV感染的个体中,那些符合接受1剂Jynneos®定义的人的住院几率为0.28(95% CI:0.05-0.91),与未接种疫苗的人相比。接受2剂Imvamune®治疗的19名mpox和HIV感染者中无一人被送进了医院。基于这项研究的局限性,由于感染mpox的HIV个体数量有限,因此还不清楚CD4计数和HIV疾病进展的其他标志如何影响对疫苗接种和mpox感染的免疫反应脚注29.
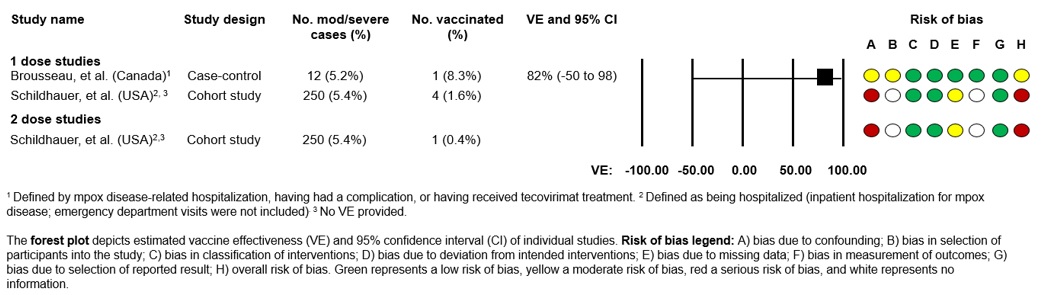
图2:描述性文本
相对于其他临床结果的有效性
目前没有关于Imvamune®预防因mpox或mpox传播导致的死亡的数据,也不包括既往感染过mpox的患者。
疫苗安全
许可前和许可后的安全性数据都支持Imvamune®的安全性。根据Imvamune®临床试验数据7,414名参与者接受了约13,700剂药物,成人报告的最常见不良事件(AE)是注射部位反应,如疼痛、发红、肿胀和全身反应,包括疲劳、头痛和肌痛。大多数为轻度至中度,在接种疫苗后7天内无需干预即可解决,未发现意外AE。此外,接种疫苗后未出现心肌炎和/或心包炎等心脏事件的确诊病例。Imvamune®的安全配置文件在免疫正常和免疫受损的个体中是相似的。
Imvamune®上可用的上市后安全性监测数据也表明疫苗耐受性良好。成人在注射一剂和/或两剂后报告的最常见AE为不严重的注射部位和全身反应,与临床试验结果一致脚注30脚注31脚注32脚注33脚注34。第二剂通常比第一剂耐受性稍好脚注31脚注32脚注33。很少报告严重不良事件。具体来说,没有迹象表明接种疫苗后心肌炎或过敏反应的风险增加,也没有发现新的或意外的安全问题脚注30脚注34脚注35。在加拿大,来自加拿大国家疫苗安全网络(CANVAS)的数据显示®耐受性良好,大多数报告的AE为轻度或中度。与未接种疫苗的对照组相比,干预工作/学校或需要医疗评估的健康事件在接种疫苗的个体中较少见(3.3%比7.1%,p < 0.010)。没有参与者在接种疫苗后的7天或30天内住院。此外,未发现严重的神经系统疾病、皮肤病或心肌炎病例脚注34.
与其他疫苗同时给药
Imvamune®疫苗接种可以同时(即同一天)或在其他活疫苗或非活疫苗之前或之后的任何时间进行。目前,关于Imvamune®同时给药的数据有限其他疫苗。现有证据表明可以同时给药,但未提供相关AE的频率和/或类型的详细信息脚注31脚注32。因为Imvamune®是基于一种不可复制的正痘病毒属,它可以不考虑其他疫苗的接种时间。如果指示与另一种疫苗同时给药,则每种疫苗的免疫应当在不同的解剖部位(例如,不同的肢体)用单独的注射设备进行。
道德、公平、可行性和可接受性考虑
道德考量
NACI从承认任何不确定性或知识差距的角度考虑了透明度在促进和维持公众信任方面的重要性。此外,由于mpox传播通常需要密切和长期的接触(包括但不限于性接触),NACI的建议是基于需求和风险,而不仅仅是性别或性取向等其他标准。
公平考虑
在加拿大,gbMSM社区继续受到mpox的最大影响。对gbMSM群体的羞辱和歧视会导致健康不平等,这是免疫规划发展中必须考虑的问题。虽然加拿大尚未报告女性性工作者和/或在性场所工作/志愿服务的个人发生mpox的病例,但自2022年以来,在以前非该疾病流行的其他国家报告了病例;性工作者和男男性行为者群体之间存在重叠的性网络,这些案例主要发生在加拿大脚注17。免疫政策决策者在确定疫苗合格性时应考虑这种潜在的情境风险。
现有证据表明,慢性病患者(如未受控制的艾滋病毒、免疫抑制)患严重mpox的风险更高,并且很可能降低疫苗反应和保护持续时间有限脚注6脚注7脚注8。因此,应优先对mpox暴露高风险的未控制HIV感染个体进行疫苗接种。
加拿大mpox免疫规划具有全球影响。人际传播活跃的大多数低收入和中等收入国家无法获得Imvamune®或其他批准用于mpox预防的疫苗。
可行性考虑
加拿大司法管辖区继续提供Imvamune®被认为有mpox高风险的个人。与2022年mpox爆发期间采用的临时弹出诊所相比,作为常规计划实施可能具有更高的可行性。
可接受性考虑
2022年夏季,PHAC咨询了代表受影响社区的利益主体组织。总体而言,gbMSM社区传达了对mpox疫苗接种的积极态度。然而,自2022年以来,大多数Imvamune®受试者只接种了第一剂疫苗,这可能是由于一些因素,如与2022年春夏相比感染风险较低,当时许多加拿大城市中心的病例数较高,或免疫接种后出现不良事件的风险(AEFI)。因此,在更新免疫建议时,强调2剂方案的有效性将是重要的。
经济学
虽然疫苗供应已经购买,目前由联邦政府管理,但各省和地区继续承担与管理疫苗接种计划相关的费用。目前尚未对本临时指南进行成本效益分析,但将来可能会考虑。在加拿大建立重点常规免疫规划后,对mpox流行病学的了解对于未来的成本效益分析至关重要。
推荐
请看表3有关强NACI和自由选择的推荐的解释。
NACI关于Imvamune®免疫的建议,在重点常规免疫计划的背景下
1.NACI建议mpox高危人群应接受两剂Imvamune®至少间隔28天(4周)给药。
- 剂量应通过皮下注射给药。在常规免疫接种中,不推荐使用皮内给药的剂量节约策略。
- 那些用Imvamune®开始初选的人已经超过28天没有接受第二次剂量的患者应该接受第二次剂量,而不管自第一次剂量以来的时间。
- 曾接种过天花疫苗(例如上一代活复制疫苗)的人,建议接受免疫接种Imvamune®基于mpox的风险因素,还应接受2剂系列,间隔至少28天。
- Imvamune®疫苗接种可以同时(即同一天)或在其他活疫苗或非活疫苗之前或之后的任何时间进行。
- 这时,Imvamune®不建议医护人员常规使用,包括为mpox高危人群服务的医护人员,但暴露后疫苗接种除外。
- NACI关于在常规免疫项目中使用Imvamune®的指南应被视为临时指南,一旦有新的证据出现,将对其进行重新评估。
(强烈NACI推荐)
证据和其他考虑因素概述
- 基于mpox风险增加的疫苗合格性应由可用的临床证据和正在进行的流行病学提供信息。风险因素可能会随着时间的推移而变化,应由当地和/或省/地区公共卫生部门进行评估。
- 目前,加拿大被认为具有mpox高风险的个人包括:
- 男男性行为者(MSM)谁:
- 有不止一个伴侣;或者
- 在一段关系中,至少有一方有其他性伴侣;或者
- 在过去一年中被确诊患有性传播感染;或者
- 在性场所有过性接触。
- 符合上述标准的个人的性伴侣。
- 性工作者,不论性别、出生时指定的性别或性取向。
- 在工作人员可能接触可能被mpox污染的污染物的场所发生性行为的员工或志愿者。
- 那些从事性旅游的人,不论性别、出生时指定的性别或性取向。
- 预期会经历上述任何情况的个人。
- 男男性行为者(MSM)谁:
- 根据现有证据(对其他免疫缺陷人群而言是有限的),未接种疫苗的HIV感染未受控制的个体(例如,CD4计数< 200 x10^6细胞/升)被认为有较高的严重mpox风险。大量研究表明两剂免疫®可有效预防mpox及相关后果,包括艾滋病毒感染者。临床医生应该讨论免疫®以及艾滋病毒携带者接触mpox的风险。
- 鉴于缺乏关于益处和风险的证据,NACI不发布关于Imvamune®额外剂量(例如> 2)的建议®在这一次的常规项目中。到目前为止,没有证据表明额外剂量的免疫®需要用于社区环境中的高风险个体,包括免疫缺陷人群。将继续审查这方面的证据。
- NACI继续建议从事复制工作的人员正痘病毒在实验室环境中,如果他们仍然有职业接触的风险,则在2年后应给予额外剂量。
- 证据仅限于18岁以下的儿童人群,且目前Imvamune®的免疫指征适用于18岁及以上的个人。对于符合高风险标准的人群,可根据临床医生的判断,在暴露前或暴露后考虑在儿科人群中的适应症外使用。
- 不建议患有mpox的人接种疫苗。医务人员在考虑对有mpox感染史的个体进行疫苗接种时,应进行临床判断。
- 尽管关于在特定人群中使用Imvamune®免疫的数据有限(例如,由于疾病或治疗而免疫低下;怀孕或哺乳),这些人应该提供Imvamune®免疫,如果基于高风险标准建议接种疫苗。
- 具有mpox高风险并计划进行国际旅行的个人应在旅行前至少4至6周向其医疗保健提供者咨询疫苗接种事宜,尤其是前往mpox持续传播的国家的人。医疗服务提供者在推荐接种疫苗时,应考虑旅行者有责任防止mpox在国际上的引入和传播。
- NACI将继续监测新出现的证据,并更新关于Imvamune®的指南用于暴露前和暴露后接种mpox疫苗。这将包括监测2剂Imvamune®后的保护持续时间、或MPXV感染,以分别告知先前感染的人需要加强剂量或疫苗接种。
- NACI先前建议了预防Imvamune的最低等待期®在mRNA新冠肺炎疫苗之后或之前至少4周施用。Imvamune®上的上市后安全监测数据现已上市,表明疫苗耐受性良好,接种后无心肌炎或过敏反应风险增加的迹象,也未发现新的或意外的安全性问题。因此,NACI现在推荐Imvamune®疫苗接种可以同时(即同一天)或在其他活疫苗或非活疫苗之前或之后的任何时间进行。
2.NACI继续推荐使用Imvamune®作为暴露后疫苗接种(也称为暴露后预防),用于对可能或确诊的mpox病例有高风险暴露的个人,或在发生传播的环境中,如果他们没有接受两剂暴露前疫苗接种。
(强烈NACI推荐)
- 应尽快提供暴露后疫苗剂量,最好是在最后一次暴露后4天内,但也可以考虑在最后一次暴露后14天内。
- 28天后,如果MPVX感染没有发展,不管持续暴露状态如何,都应提供第二剂。
- 既往有或正在感染MPXV的个体不应给予免Imvamune疫®
- 对于那些符合暴露后疫苗接种标准的人群,建议在儿科人群中使用标签外药物,并可由临床医生酌情提供。
- Imvamune®疫苗接种可以同时(即同一天)或在其他活疫苗或非活疫苗之前或之后的任何时间进行。
定义
男男性接触者:男人或双性认同与另一个认同为男人的人发生性关系的个体,包括但不限于自我认同为跨性别、顺性别、双性、性别酷儿、双性人和非二元的个体。
暴露前疫苗接种:在潜在暴露于mpox之前,接种预防mpox的疫苗剂量;有时也称为暴露前免疫或预防。
暴露后疫苗接种:在已知或推测暴露于mpox或正在发生传播的环境之后,在出现任何症状之前,立即施用预防mpox的疫苗剂量;有时也称为暴露后预防。
| 剂量数 | 暴露前疫苗接种脚注a脚注b | 暴露后疫苗接种脚注a脚注b |
|---|---|---|
| 剂量1 | 0.5毫升,皮下注射 | 暴露后4天内口服0.5毫升,最多可达14天 |
| 剂量2 | 0.5毫升,SC,如果MPXV感染没有发展,在第1次给药后≥ 28天给药 | |
| NACI建议的力度脚注a | 强烈的 | 任意的 |
|---|---|---|
| 讲话 | “应该/不应该提供” | “可能是/可能不是提供” |
| 基本原理 | 已知/预期的优点超过已知/预期的缺点(“应该”),或者已知/预期的缺点超过已知/预期的优点(“不应该”) | 已知/预期的优势与已知/预期的劣势紧密平衡,或者存在优势和劣势证据的不确定性 |
| 含义 | 强烈建议适用于大多数人群/个人,除非有替代方法的明确和令人信服的理由,否则应遵循该建议。 | 在某些情况下,可能会考虑对某些人群/个人酌情推荐。替代方法可能是合理的。 |
| ||
研究重点
- 进一步研究Imvamune®提供的保护针对mpox感染和疾病的疫苗(在暴露前和暴露后预防方案中),包括:
- 了解保护免受感染和疾病的免疫反应,并定义保护阈值。
- 了解以前正痘病毒属感染或接种疫苗会影响Imvamune®提供的保护.
- 关于Imvamune®对抗mpox的VE的真实世界证据,包括保护持续时间。
- 了解随着时间的推移,MPXV感染引起的保护作用,以确定既往感染过MPXV的人是否需要接种疫苗。
- 免疫安全性的进一步研究®疫苗包括临床试验和上市后安全性监测。
- Imvamune®的靶向临床试验特殊人群的安全性,包括怀孕或哺乳的人、18岁以下的儿童和免疫缺陷者。
- 进一步研究mpox流行病学,以更好地了解疾病表现和传播方式,并识别严重疾病的高风险人群,最终为疾病预防策略提供信息和优化策略。
- 进一步研究mpox高危人群的疫苗可接受性,为有效的疫苗接种规划提供信息。
缩写
- ACS
- 咨询委员会声明
- AEs
- 不良事件
- AEFI
- 免疫接种后的不良事件
- aVE
- 调整后的疫苗效力
- CANVAS
- 加拿大国家疫苗安全网络
- CATMAT
- 加拿大热带医学和旅游咨询委员会
- CD4
- 分化群4
- CI
- 置信区间
- CIG
- 加拿大免疫指南
- DNA
- 脱氧核糖核酸
- DRC
- 刚果民主共和国
- EEFA
- 道德、公平、可行性、可接受性
- EtD
- 从证据到决策
- EUNDS
- 特殊用途新药提交
- HIV
- 人类免疫缺陷病毒
- GbMSM
- 同性恋、双性恋和其他男男性行为者
- MPXV
- 猴痘病毒
- MSM
- 男男性行为者
- MVA-BN
- 改良安卡拉-巴伐利亚北欧痘苗病毒
- NACI
- 国家免疫咨询委员会
- PCR
- 聚合酶链反应
- PHAC
- 加拿大公共卫生局
- PHECG
- 公共卫生伦理咨询小组
- PrEP
- 暴露前预防
- RNA
- 核糖核酸
- SC
- 皮下注射
- STI
- 性传播感染
- US
- 美国
- UK
- 联合王国
- VE
- 疫苗效力
- WG
- 工作组
- WHO
- 世界卫生组织
致谢
本声明由以下人员编写:N Forbes、K . Klein、J . Montroy、M . Salvadori、K . Gusic和X Yiao、V . Dubey、R . Harrison、MC突尼斯(代表NACI)。
NACI感谢以下人员的贡献:m突尼斯,K杨,A图伊特,A豪沃思,L科沃德,J丹尼尔。
NACI成员:r .哈里森(主席)、维尼塔·杜贝(副主席)、A .布坎、M .安德鲁、J .贝廷格、N .布鲁索、H .德卡卢韦、P .德瓦尔斯、E .杜贝、K .希尔德布兰德、K .克莱因、M .奥德里斯科尔、J .帕彭堡、A .范胡伊、B .桑德和S .威尔逊。
联络代表:l . Bill/M . Nowgesic(加拿大土著护士协会)、LM Bucci(加拿大公共卫生协会)、S .布坎(加拿大免疫研究和评估协会)、E . Castillo(加拿大产科医生和妇科医生协会)、J . Comeau(加拿大医学微生物学和传染病协会)、M . la voie(卫生首席医官理事会)、J . MAC Neil(美国疾病控制和预防中心)、D . Moore(加拿大儿科学会)、M . Naus(加拿大免疫委员会)、M . OS Mack(加拿大土著医生协会)、J . Potter(加拿大家庭医生学院)
当然代表:v . Beswick-escan lar(国防和加拿大武装部队)、E . Henry(免疫方案中心,PHAC)、M . Lacroix(公共卫生伦理咨询小组,PHAC)、P . fan dja(加拿大卫生部营销保健产品局)、M . Su(PHAC流行病学和监测局)、S . Ogunnaike-Cooke(免疫监测中心,PHAC)、C . Pham(加拿大卫生部生物和放射性药物局)、M . Routledge(PHAC国家微生物实验室)和T Wong(加拿大土著服务部原住民和因努伊特人卫生处)。
NACI Mpox工作组
成员:克莱因(主席)、布鲁索、布坎、YG·布依、卡斯蒂略、哈里森、希尔德布兰德、利伯曼、谭、穆尔蒂、拉奥、夸奇和彼得森。
PHAC/人道主义协调员参与者:阿南德、巴克利奇、巴尔塞洛斯、贝尔、曹、、科沃德、多永-普卢德、福布斯、戈登、古希奇、豪沃思、延森、卡瓦什、拉罗什、蒙特罗伊、帕特尔、皮纳特、普拉蒙东、普勒、萨尔瓦多里、突尼斯、瓦尔肖斯基、颜、维努戈帕尔和西门尼斯。
附录A:疫苗效力研究
| 作者、日期、国家 | 研究设计、周期、数据来源 | 研究人群、样本量 | 疫苗 | 结果 | 价值工程分析,结果脚注a | 偏倚的总体风险脚注b |
|---|---|---|---|---|---|---|
| Bertran等人(2023年) 英国 | 病例覆盖(筛查方法) 2022年7月4日至10月9日 公共卫生监测数据(英格兰),自我报告调查,实验室报告 | 性健康诊所的高危男男性行为者 N=363例 | 1剂MVA-BN | 实验室确认的症状性mpox感染 | VE = 1-病例/人群中接种疫苗的几率 ≥14天后的VE:78%(95%可信区间:54%至89%) | 高的 |
| 布鲁索等人(2023年) 加拿大 | 测试阴性病例对照 2022年6月19日至9月24日 公共卫生监测数据(魁北克),行政数据,自我报告调查 | 蒙特利尔收集的mpox标本年龄≥18岁的男性 所有管理人员: N=231例 N=301个对照 子问卷人群: N=91例 N=108个控制 | 1剂MVA-BN | 实验室确认的症状性mpox感染和中度至重度mpox疾病(即mpox相关住院、并发症、tecovirimat治疗) | VE = 1-病例/人群中接种疫苗的几率 所有管理人员: 抗mpox感染的aVE:35%(95%可信区间:-2至59%) 预防中度至重度疾病的平均死亡率:82% (95%可信区间:-50至98%) 子问卷人群: 平均(仅行政指标):30% (95%置信区间:-38%至64%) 行政指标和问卷:65% (95%可信区间:1至87%) | 温和的 |
| 道尔顿等人(2023年) 美国 | 病例对照 2022年8月19日至2023年3月31日 公共卫生监测数据(12个美国辖区)、自我报告调查、疫苗注册 | 18-49岁性活跃的男男性行为者或变性者 N=308例 N=608个对照 | 1或2剂MVA-BN | 实验室确认的症状性mpox感染 | VE = 1-病例/人群中接种疫苗的几率 总人口: 第1剂的aVE:75.2%(95%可信区间:61.2至84.2%) 两次剂量的aVE:85.9%(95%可信区间:73.8-92.4%) 免疫受损亚人群: 平均:70.2% (95%可信区间:-37.9至93.6%) 免疫活性亚群体: 平均:87.8% (95%可信区间:57.5至96.5%) | 高的 |
| 副手等人(2023年) 美国 | 病例对照 2022年8月15日至11月19日 Epic宇宙数据库(EHR) | 病例:患有mpox(病例)或偶发HIV感染或服用HIV PrEP(对照)的个体 N = 2,193例 N=8,319个控制 | 1或2剂MVA-BN | Mpox诊断代码或阳性正痘病毒属或mpox病毒实验室结果 | VE = 1-病例/对照中接种疫苗的几率 总人口: 第1剂的aVE:35.8%(95%可信区间:22.1至47.1%) 两种剂量的aVE:66%(95%可信区间:47.4至78.1%) 免疫活性亚群体: 第1剂的aVE:40.8%(95%可信区间:24.8至53.4%) 两种剂量的aVE:76.3%(95%可信区间:57.7至86.8%) | 高的 |
| 丰坦-贝拉等人(2023年) 西班牙 | 回顾性队列 2022年7月12日至12月12日 公共卫生监测数据(西班牙15/19个地区) | 接受HIV-PrEP的18岁以上男性 N = 5,660人接种疫苗 N=5,660人未接种疫苗 | 1剂MVA-BN | 实验室确认的症状性mpox感染 | VE = 1-接种疫苗/未接种疫苗人群中的感染风险 ≥7天后的VE:65%(95%可信区间:22.9至88.0%) ≥14天后的VE:79%(95%可信区间:33.3至100.0%) | 温和的 |
| 纳瓦罗等人(2023年) 加拿大 | 前瞻性队列 2022年6月12日至11月26日 公共健康监测数据(安大略省) | 年龄≥18岁的男性:(1)在前一年有梅毒测试史和实验室确认的细菌性性病;或(2)在前一年填写了HIV准备的处方 N=3,204人接种疫苗 N=3,204人未接种疫苗 | 1剂MVA-BN | PCR证实的mpox感染 | VE = 1-接种疫苗/未接种疫苗组的风险率 ≥14天后的VE:59%(95%可信区间:31%至76%) | 温和的 |
| Ramchandani等人(2023年) 美国 | 回顾性队列 2022年5月1日至12月31日 公共卫生监测数据和疫苗登记(华盛顿州) | 在2020年1月1日至2022年12月31日期间至少去过一次西雅图和金县性健康诊所的男男性行为者 N=4,230 (n=2,393人未接种,n=685人接种了1剂疫苗,n=1,152人接种了2剂疫苗) | 1或2剂MVA-BN | 实验室确认的症状性mpox感染 | VE = 1-接种疫苗/未接种疫苗组的风险率 1剂的aVE:81%(95%可信区间:64至90%) 两种剂量的aVE:83%(95%可信区间:28至96%) | 温和的 |
| 罗森伯格等人(2023年) 美国 | 病例对照 2020年1月1日至2022年12月31日 公共健康监测数据(纽约州,不包括纽约市) | 年龄≥18岁、经mpox诊断(病例)或经诊断患有直肠淋病或一期梅毒且有男性间性接触史的男性,无mpox(对照组) N=252例 N=255个控制 | 1或2剂MVA-BN | 实验室确认的症状性mpox感染 | VE = 1-病例/对照中接种疫苗的几率 1剂或2剂的aVE:76%(95%可信区间:49至89%) 1剂的aVE:68%(95%可信区间:25%至87%) 两种剂量的aVE:88%(95%可信区间:44至98%) | 高的 |
| Sagy等人(2023年) 以色列 | 回顾性队列 2022年7月31日至12月25日 克拉利特保健服务公司(EHR) | 自2022年1月1日起,18-42岁的男性接受艾滋病毒准备至少一个月,或被诊断患有艾滋病毒和一种或多种性传播感染 N=2,054 (n=1,037接种疫苗,n=1,017未接种疫苗) | 1剂MVA-BN | 实验室确认的症状性mpox感染 | VE = 1-接种疫苗/未接种疫苗组的风险率 平均:86% (95%可信区间:59至95%) | 温和的 |
| Schildhauer等人(2023年) 美国 | 回顾性队列 2022年5月12日至2023年5月18日 公共健康监测数据(加州) | 加州居民被诊断患有mpox N = 4,611 | 1或2剂MVA-BN | Mpox相关的住院治疗 | 接种疫苗与未接种疫苗的mpox患者的住院几率 总人口: 或1剂疫苗对未接种疫苗:0.27 (95%可信区间:0.08至0.65) 或两剂疫苗与未接种疫苗相比:0.20 (95%可信区间:0.01至0.90) 免疫受损亚人群: 或者在艾滋病毒携带者中1剂疫苗比未接种疫苗:0.28 (95%可信区间:0.05至0.91) | 高的 |
缩写
| ||||||
参考资料:
- 脚注1
- 加拿大公共卫生局(PHAC)。加拿大公共卫生署疫苗管理局和流行病学数据[未发表]。渥太华(ON):加拿大政府;2023.
- 脚注2
- Durski KN,McCollum AM,中泽友秀Y,Petersen BW,Reynolds MG,Briand S等,《猴痘的出现——西非和中非,1970-2017年》。MMWR莫尔布凡人周刊代表2018年3月16日;67(10):306-10.https://doi.org/10.15585/mmwr.mm6710a5.
- 脚注3
- 李克思,萨蒙斯,奥尔森,李,等。猴痘病毒两个分支的故事。J Gen Virol。2005年十月;86(第10章):2661-72。https://doi.org/10.1099/vir.0.81215-0.
- 脚注4
- Ulaeto D,Agafonov A,Burchfield J,Carter L,Happi C,Jakob R,等.猴痘和猴痘病毒分支的新命名法。柳叶刀感染疾病。2023年3月;23(3):273-5.https://doi . org/10.1016/s 1473-3099(23)00055-5。
- 脚注5
- 加拿大公共卫生局(PHAC)。Mpox(猴痘):卫生专业人员[互联网]。渥太华(ON):加拿大政府;2024年2月12日[引用于2024年3月7日]。可从以下网址获得:https://www . Canada . ca/en/public-health/services/diseases/mpox/health-professionals . html。
- 脚注6
- 埃纳奥-马丁内斯AF,奥尔金CM,蒂坦吉BK,罗德里格斯-莫拉莱斯AJ,萨利纳斯JL,弗朗哥-帕雷德斯C等:mpox感染患者的住院风险-倾向评分匹配分析。感染疾病。2023年8月30日;10:20499361231196683.https://doi.org/10.1177/20499361231196683.
- 脚注7
- Riser AP,Hanley A,Cima M,Lewis L,Saadeh K,Alarcón J,等. mpox相关死亡的流行病学和临床特征-美国,2022年5月10日-2023年3月7日。MMWR莫尔布凡人周代表2023年4月14日;72(15):404-10.https://doi.org/10.15585/mmwr.mm7215a5.
- 脚注8
- Triana-González S,Román-López C,Mauss S,Cano-Díaz AL,Mata-Marín JA,pérez-barra gan E,等,《猴痘死亡的危险因素和临床表现》。艾滋病。2023年11月1日;37(13):1979-85.https://doi.org/10.1097/QAD.0000000000003623.
- 脚注9
- 国家免疫咨询委员会(NACI)。NACI快速反应:在加拿大猴痘爆发情况下使用Imvamune的临时指南[互联网]。渥太华(ON):加拿大政府:加拿大政府;2022年11月9日【引用于2024年2月27日】。可查阅:https://www . Canada . ca/en/public-health/services/immunization/national-advisory-Committee-on-immunization-NaCI/guidance-imvamune-monkey pox . html。
- 脚注10
- 加拿大公共卫生局(PHAC)。工人的免疫:加拿大免疫指南-卫生专业人员[互联网]。渥太华(ON):加拿大政府;2023年9月[引用于2024年3月19日]。可查阅:https://www . Canada . ca/en/public-health/services/publications/health-living/Canadian-immunization-guide-part-3-vaccination-specific-populations/page-11-immunization-workers . html。
- 脚注11
- 加拿大公共卫生局(PHAC)。NACI快速反应:关于在加拿大猴痘爆发中使用Imvamune的最新临时指南:NACI快速反应,2022年9月23日[互联网]。渥太华(ON):加拿大政府;2022年11月9日【引用于2024年3月21日】。可从以下网址获得:https://www . Canada . ca/en/public-health/services/publications/vaccines-immunization/rapid-response-updated-interim-guidance-imvamune-monkey pox-outbreaks . html。
- 脚注12
- Ismail SJ,Hardy K,突尼斯MC,Young K,Sicard N,Quach C,《疫苗规划建议中伦理、公平、可行性和可接受性的系统考虑框架》。疫苗。2020年8月10日;38(36):5861-76.https://doi.org/10.1016/j.vaccine.2020.05.051.
- 脚注13
- 加拿大公共卫生局(PHAC)。流行病学总结报告:加拿大2022-23年mpox疫情。渥太华(ON):加拿大政府;2024.可从以下网址获得:https://www . Canada . ca/en/public-health/services/publications/diseases-conditions/epidemic-summary-report-2022-23-mpox-outbreak-Canada . html
- 脚注14
- 世界卫生组织(世卫组织)。2022-23 mpox(猴痘)爆发:全球趋势[互联网]。世界卫生组织;2024年2月23日[引用于2024年3月19日]。出发地:https://worldhealthorg.shinyapps.io/mpx_global/.
- 脚注15
- 世界卫生组织(世卫组织)。mpox多国爆发-外部形势报告31[互联网]。世界卫生组织;2023年12月22日[引用于2024年3月19日]。可从:https://www . who . int/docs/default-source/corona virus/situation-reports/2023 12 22 _ mpox _ external-sit rep-31 . pdf?sfvrsn=a48ccab5_3。
- 脚注16
- Viedma-Martinez M,Dominguez-Tosso FR,Jimenez-Gallo D,Garcia-Palacios J,Riera-Tur L,Montiel-Quezel N,等。在纹身店进行MPXV传播。英国医学博士。2023年1月5日;388(1):92-4.https://doi.org/10.1056/NEJMc2210823.
- 脚注17
- Thornhill JP,Palich R,Ghosn J,Walmsley S,Moschese D,Cortes CP,等,《2022年暴发期间妇女和非二元个体中人类猴痘病毒感染:全球病例系列》。柳叶刀。2022年12月3日;400(10367):1953-65.https://doi . org/10.1016/s 0140-6736(22)02187-0。
- 脚注18
- Kibungu EM,Vakaniaki EH,Kinganda-Lusamaki E,卡隆吉-Mukendi T,Pukuta E,Hoff NA等。急诊传染病。2024年1月;30(1):172-6.https://doi.org/10.3201/eid3001.231164.
- 脚注19
- Brousseau N,Carazo S,Febriani Y,Padet L,Hegg-Deloye S,Cadieux G,等:《mpox疫苗在加拿大魁北克的单剂有效性:对自我报告的暴露风险进行调整和不进行调整的试验阴性设计》。临床感染疾病。2024年2月17日;78(2):461-9.https://doi.org/10.1093/cid/ciad584.
- 脚注20
- 纳瓦罗C,刘C,布坎SA,波切尔安,纳斯林S,弗里德曼L,等。一剂MVA-BN疫苗对加拿大安大略省男性mpox感染的有效性:一项目标试验仿真。medRxiv。2023年10月6日:2023年10月4日296566。https://doi.org/10.1101/2023.10.04.23296566.
- 脚注21
- Bertran M,Andrews N,Davison C,Dugbazah B,Boateng J,Lunt R,等.在英国用病例覆盖法研究一剂MVA-BN天花疫苗对mpox的有效性:一项观察性研究柳叶刀感染疾病。2023年7月;23(7):828-35.https://doi . org/10.1016/s 1473-3099(23)00057-9。
- 脚注22
- Fontán-Vela M,Hernando V,Olmedo C,Coma E,Martínez M,Moreno-Perez D,等:《改良安卡拉-巴伐利亚北欧牛痘疫苗在mpox高危人群中的有效性:一项西班牙队列研究》。临床感染疾病。2024年2月17日;78(2):476-83.https://doi.org/10.1093/cid/ciad645.
- 脚注23
- Wolff Sagy,Zucker R,Hammerman A,Markovits H,Arieh NG,Abu Ahmad W,等,《男性单剂量mpox疫苗的实际效果》。国家医学中心。2023年3月;29(3):748-52.https://doi.org/10.1038/s41591-023-02229-3.
- 脚注24
- 副NP,Deckert J,Chard AN,Sandberg N,Moulia DL,Barkley E,等。JYNNEOS在美国对mpox疾病的疫苗效力。英国医学博士。2023年6月29日;388(26):2434-43.https://doi.org/10.1056/NEJMoa2215201.
- 脚注25
- Dalton AF,Diallo AO,Chard AN,Moulia DL,副NP,Fothergill A,等. JYNNEOS疫苗预防mpox的估计有效性:一项多辖区病例对照研究-美国,2022年8月19日-2023年3月31日。MMWR莫尔布凡人周刊代表2023年5月19日;72(20):553-8.https://doi.org/10.15585/mmwr.mm7220a3.
- 脚注26
- Rosenberg ES,Dorabawila V,Hart-Malloy R,Anderson BJ,Miranda W,安东内尔T等. JYNNEOS疫苗对确诊mpox感染的有效性-纽约,2022。MMWR莫尔布凡人周刊代表2023年5月19日;72(20):559-63.https://doi.org/10.15585/mmwr.mm7220a4.
- 脚注27
- Ramchandani MS,Berzkalns A,Cannon CA,Dombrowski JC,Brown E,Chow EJ等。改良安卡拉痘苗疫苗对男男性行为者mpox的有效性:回顾性队列分析,华盛顿州西雅图。公开论坛传染疾病。2023年10月24日;10(11):ofad528。https://doi.org/10.1093/ofid/ofad528.
- 脚注28
- Kottkamp AC,Samanovic MI,Duerr R,Oom AL,Belli HM,Zucker JR,等。接种后抗mpox病毒的抗体滴度。英国医学博士。2023年12月14日;389(24):2299-301.https://doi.org/10.1056/NEJMc2306239.
- 脚注29
- Schildhauer S,Saadeh K,Vance J,金特J,Salih T,Lo T,等,《降低接种JYNNEOS疫苗人群中mpox相关住院率——加利福尼亚州,2022年5月-2023年5月》。MMWR莫尔博凡人周代表2023年9月8日;72(36):992-6.https://doi.org/10.15585/mmwr.mm7236a4.
- 脚注30
- Duffy J,Marquez P,Moro P,Weintraub E,Yu Y,Boersma P,等. 2022年mpox爆发期间JYNNEOS疫苗的安全性监测-美国,2022年5月22日-10月21日。2009年12月22日,MMWR莫布·莫比尔·沃克代表;71(49):1555-9.https://doi.org/10.15585/mmwr.mm7149a4.
- 脚注31
- mpox(猴痘)疫苗接种后的不良反应:来自荷兰和全球不良事件报告系统的综述。临床药理学杂志。2023年11月;89(11):3302-10.https://doi.org/10.1111/bcp.15830.
- 脚注32
- Montalti M,Di Valerio Z,Angelini R,Bovolenta E,Castellazzi F,Cleva M,等。采用主动监测研究猴痘疫苗的安全性,意大利两中心观察研究。疫苗(巴塞尔)。2023年6月27日;11(7):1163.https://doi.org/10.3390/vaccines11071163.
- 脚注33
- Deng L,Lopez LK,Glover C,Cashman P,Reynolds R,Macartney K,等.接种改良安卡拉-巴伐利亚北欧(MVA-BN)mpox疫苗后的短期不良事件.贾马。2023年6月20日;329(23):2091-4.https://doi.org/10.1001/jama.2023.7683.
- 脚注34
- Muller MP、Navarro C、Wilson SE、Shulha HP、Naus M、Lim G等:对有mpox风险的加拿大人群接种改良安卡拉-巴伐利亚北欧痘苗(MVA-BN)后不良事件的前瞻性监测:一项加拿大免疫研究网络研究。疫苗。2024年1月25日;42(3):535-40.https://doi.org/10.1016/j.vaccine.2023.12.068.
- 脚注35
- 沙尔夫卡,坦迪TK,刘易斯PF,约翰逊ES。JYNNEOS疫苗预防mpox后的心脏事件。疫苗。2023年5月22日;41(22):3410-2.https://doi.org/10.1016/j.vaccine.2023.04.052.
页面详细信息
- 修改日期:
Hits: 27

