Contents
Diphtheria toxoid: Canadian Immunization Guide
针对卫生专业人员
上次部分内容更新(请参见更新表):2016年11月
最后一个完整章节修订(参见更新表):2014年12月
关键信息(有关详细信息,请参阅文本)
- 什么
- 白喉在加拿大很罕见。它发生在世界范围内,并在许多发展中国家流行。
- 病死率约为 5%-10%;死亡率最高的是非常年轻和老年人,以及非流行国家,因为诊断往往很晚。
- 含白喉类毒素的疫苗只能与联合疫苗一起使用。
- 含白喉类毒素的疫苗可用于易感人群的白喉暴露后免疫接种。
- 用于治疗白喉的白喉抗毒素可通过当地公共卫生官员紧急获得。
- 在完成初级系列(至少 3 剂)后,超过 97% 的疫苗接种者会产生对白喉有保护作用的抗体浓度。
- 注射部位发红、肿胀和疼痛是含白喉类毒素疫苗最常见的不良反应。
- 谁
- 建议将含白喉类毒素的疫苗用于:
- 婴儿和儿童的常规免疫接种
- 未按常规计划进行白喉免疫接种的儿童的免疫接种
- 既往未接种疫苗或未完全接种疫苗的成人的免疫接种
- 青少年和成人的常规加强免疫接种
- 建议将含白喉类毒素的疫苗用于:
- 如何
- 婴儿和儿童的常规白喉免疫接种:在 2、4、6 和 12 至 23 个月大时接种 DTaP-IPV-Hib 疫苗(通常在 18 个月大时接种)。如果进行婴儿乙型肝炎免疫接种,可以使用 DTaP-HB-IPV-Hib 疫苗。随后在 4 至 6 岁(入学)接种 DTaP-IPV 或 Tdap-IPV 疫苗加强剂,并在 10 年后在 14 至 16 岁时接种 Tdap 疫苗加强剂。
- 既往接种过含白喉类毒素疫苗的成人:如果患者在成年后(18 岁及以上)未接种过 Tdap 疫苗,则接种一剂 Tdap 疫苗,每 10 年接种一次 Td 疫苗加强剂。
- 含白喉类毒素的疫苗可以与常规疫苗同时在不同注射部位使用单独的针头和注射器进行接种。
- 为什么
- 白喉在世界范围内发生,在许多发展中国家流行。
- 免疫接种不足或未接种疫苗的旅行者前往白喉流行地区,患病风险更高。
- 在发达国家(如加拿大)偶尔发现输入性白喉病例。
- 5% 至 10% 的白喉病例会死亡。
流行病学
疾病描述
传染性病原体
白喉是由白喉棒状杆菌的产生外毒素引起的。
宿主
人
传播
白喉是通过呼吸道的人际传播,或者极少数情况下通过接触被感染者排泄物污染的物品传播。潜伏期约为 2 至 5 天 (范围为 1 至 10 天)。未经治疗的人的感染期通常为 2 周或更短,很少超过 4 周。慢性携带者在皮肤或鼻咽部无症状地定植白喉杆菌,并可能在 6 个月或更长时间内排出病原体。
风险因素
免疫接种不足或未接种疫苗的旅行者前往白喉流行地区,患病风险更高。美国疾病控制和预防中心 (CDC) 或当前版本的 CDC 国际旅行健康信息黄皮书提供了白喉流行的国家/地区列表。
季节性/时间模式
白喉最常见于温带气候的冬季和春季。
临床疾病范围
呼吸道白喉影响上呼吸道的粘膜。症状包括轻度发烧、喉咙痛、吞咽困难、不适和食欲不振。它可以发展为幼儿的急性呼吸窘迫、上气道阻塞和窒息。在扁桃体和口咽部可见一层粘附的、不对称的灰白色膜,通常在发病后 2 至 3 天内出现。白喉毒素的传播可导致全身并发症,例如心肌炎和中枢神经系统影响。病死率约为 5%-10%;发病率最高的是未接种疫苗的年轻人和未接种疫苗的老年人,以及非流行国家,因为诊断往往很晚。可能发生局部皮肤感染(皮肤白喉),但很少与全身并发症相关。
疾病分布
发病率/患病率
全球
白喉在世界范围内都有发生,在许多发展中国家以及阿尔巴尼亚、俄罗斯和前苏联的其他国家流行。在其他国家,偶尔会发现输入性白喉病例。据报道,在疫苗覆盖率低的国家/地区,白喉卷土重来。 2010年,世界卫生组织 (WHO) 共报告了4,187 例白喉病例。
全国性
婴儿和儿童白喉常规免疫接种导致白喉报告病例急剧下降(参见图 1)。每年检测到少量产毒的白喉杆菌菌株(0 至 5 株),但经典白喉很少见。对加拿大健康成年人群的血清调查表明,大约 20%(某些年龄组更高)没有白喉抗体的保护浓度;需要成人加强剂。
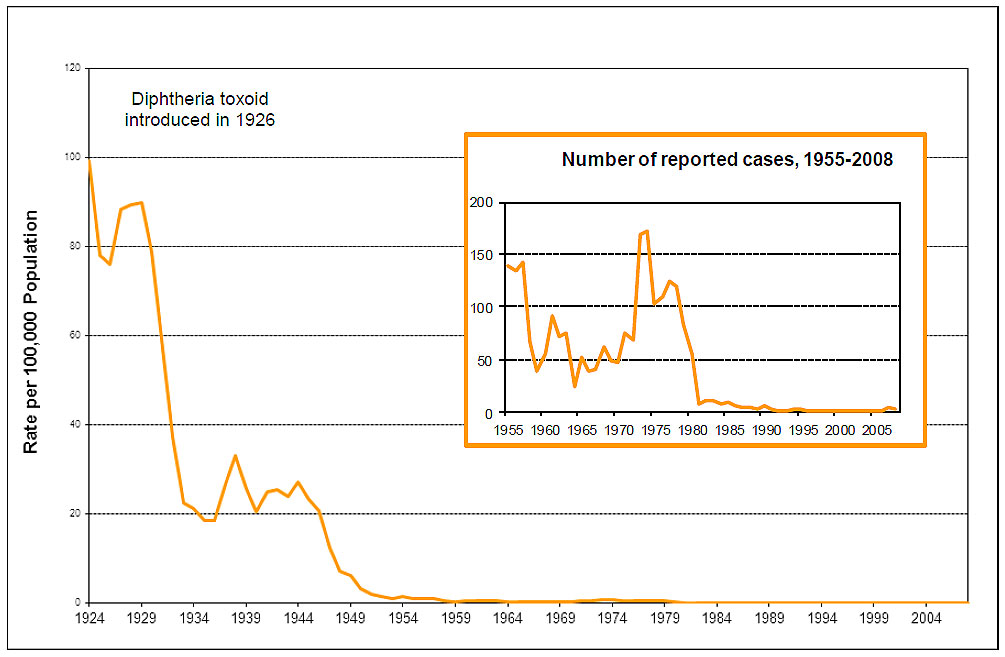
图 1 脚注
人口数据来源:加拿大统计局,《按性别和年龄划分的人口,1921 – 1971年,加拿大及各省份人口的修订年度估算》(目录号91 – 512);
加拿大统计局,《1971 – 2008年7月加拿大 – 各省份0 – 90岁以上人口估算.xls》
图 1:白喉 – 1924-2008 年加拿大报告病例和发病率 – 等效文本
这幅图包含两个图表,展示了加拿大的白喉报告病例数和发病率。较大的图表显示了多年来白喉发病率的趋势,x轴代表1924年至2004年之间的年份,y轴代表人口每10万人的发病率,底部从0开始,顶部到120结束。显示发病率的图表内部有一条橙色线,代表自1924年以来的趋势,当时发病率接近每10万人98例。尽管到1926年下降到约75例,但很快在1927年攀升至90例的峰值。很明显,1926年引入白喉类毒素后,从1929年左右开始发病率急剧下降。到1936年,发病率降至20以下。1938年左右又出现了一个约32的峰值,到1941年降至20。尽管到1944年发病率仍围绕25波动,但此后发病率开始下降,到1947年降至每10万人10例,到1969年接近0。发病率一直保持在0左右,直到1984年。自1984年以来没有发病率报告。
较小的图表描绘了1955年至2008年的白喉报告病例数,一条深橙色线显示了这一期间的趋势。该图的x轴代表1955年至2008年之间的年份,y轴代表报告病例数,底部从0开始,顶部到200结束。1955年左右开始约有137例,最初的峰值似乎出现在1957年左右,随后到1960年急剧下降到约37例。病例数到1962年增加到近90例。1965年左右可以注意到另一次短暂下降,病例数降至25例。接下来的十年里,病例数稳步增加,到1974年达到近175例的历史最高峰值。然后白喉病例数到1975年降至100例。除了1977年增加到125例外,病例数到1982年急剧下降到个位数。白喉病例数继续下降趋势,到1990年降至0,此后一直接近0。
底部的注释确认了人口数据来源,包括“加拿大统计局,1921 – 1971年按性别和年龄划分的人口,加拿大及各省人口的修订年度估计数(目录91 – 512);以及加拿大统计局,1971 – 2008年7月加拿大 – 各省0 – 90 + 人口估计数.xls”。
最近的爆发
1990年代,独立国家联合体(前苏联)报告了超过140 000例病例和4 000例死亡,表明如果免疫水平下降,白喉有可能再次出现。。
授权在加拿大使用的制剂
含白喉类毒素的疫苗
- ADACEL®(含有破伤风类毒素、减少白喉类毒素和减少无细胞百日咳疫苗的吸附疫苗),赛诺菲巴斯德有限公司 (Tdap)。
- ADACEL 脊髓灰质炎®(含有破伤风类毒素、减毒白喉类毒素和减细胞百日咳疫苗的吸附疫苗联合灭活脊髓灰质炎疫苗),赛诺菲巴斯德有限公司 (Tdap-IPV)。
- BOOSTRIX 公司®(含有破伤风类毒素、减少白喉类毒素和减少无细胞百日咳疫苗的吸附疫苗),葛兰素史克公司 (Tdap)。
- BOOSTRIX-脊髓灰质炎®(含有破伤风类毒素、减少白喉类毒素和减少无细胞百日咳疫苗的吸附疫苗联合灭活脊髓灰质炎疫苗),葛兰素史克公司 (Tdap-IPV)。
- INFANRIX-IPV/Hib®(含有白喉和破伤风类毒素、无细胞百日咳、灭活脊髓灰质炎和结合流感嗜血杆菌 B 型疫苗的吸附疫苗),葛兰素史克公司 (DTaP-IPV-Hib)。
- INFANRIX hexa™(含有白喉和破伤风类毒素、无细胞百日咳、乙型肝炎(重组)、灭活脊髓灰质炎和结合型流感嗜血杆菌 b 型疫苗的吸附疫苗)、葛兰素史克公司 (DTaP-HB-IPV-Hib)。
- PEDIACEL®(含有白喉和破伤风类毒素的吸附疫苗和无细胞百日咳疫苗联合灭活脊髓灰质炎疫苗和 B 型流感嗜血杆菌结合疫苗),赛诺菲巴斯德有限公司 (DTaP-IPV-Hib)。
- QUADRACEL®(含有白喉和破伤风类毒素的吸附疫苗和无细胞百日咳疫苗联合灭活脊髓灰质炎疫苗),赛诺菲巴斯德有限公司 (DTaP-IPV)。
- Td ADSORBED(含有破伤风和减少白喉类毒素的吸附疫苗),Sanofi Pasteur Ltd. (Td)。
白喉类毒素仅可用于联合疫苗。白喉类毒素的含量因产品而异。含有较高浓度白喉类毒素(指定为“D”)的制剂用于 7 岁以下婴幼儿的初级免疫(儿科配方)。含有较低浓度(指定为“d”和“还原”)的制剂可以作为加强剂量给予 4 岁至 7 岁以下的儿童,并且是推荐给年龄较大的儿童、青少年和成人的产品(青少年/成人配方)。
白喉抗毒素
- 抗白喉血清:从白喉类毒素高度免疫的马血浆中获得的纯化免疫球蛋白,Instituto Butantan,(DAtx)
DAtx 是一种用于 IM 或 IV 给药的特异性免疫球蛋白制剂,可通过当地公共卫生官员在紧急情况下获得。
有关完整的处方信息,请查阅产品说明书或加拿大卫生部授权产品专论中包含的信息,可通过药品数据库获得。请参阅第 1 部分授权在加拿大使用的免疫剂内容中的表 1 和表 2,了解授权在加拿大使用的所有疫苗和被动免疫剂及其内容的列表。
功效、有效性和免疫原性
白喉类毒素可防止白喉毒素的全身作用,但不能直接防止感染。白喉杆菌的携带可能发生在免疫接种的个体中,但在免疫接种人群中的携带率较低。在完成基础系列后,超过 97% 的疫苗接种者会产生对白喉毒素有保护作用的抗体浓度。在评估加强针反应的研究中,100% 的疫苗接种者在加强针后 1 个月具有保护性抗体滴度。据信,抗毒素在保护浓度下可以持续 10 年或更长时间。
使用建议
婴儿和儿童(2 个月至 17 岁)
含白喉类毒素的疫苗推荐用于从2月龄开始的常规婴儿免疫。DTaP – IPV(含或不含Hib)疫苗被批准用于小于7岁的儿童。DTaP – HB – IPV – Hib疫苗被批准用于6周龄至23月龄的儿童,并且在必要时可给予24月龄至小于7岁的儿童。DTaP – IPV或Tdap – IPV疫苗应作为4 – 6岁儿童的加强剂量。7岁及以上的儿童应接种青少年/成人剂型的含白喉 – 破伤风 – 百日咳(含或不含脊髓灰质炎)疫苗(Tdap或Tdap – IPV),因为其含有的白喉类毒素比给予年幼儿童的制剂少,不太可能在较大儿童中引起反应。Tdap疫苗应在14 – 16岁青少年中作为首次10年加强剂量接种;如果也需要接种脊髓灰质炎疫苗,则应使用Tdap – IPV疫苗。
成人 (18 岁及以上)
以前未接种过含白喉类毒素疫苗基础系列(至少 3 剂)的成人应接种含 Td 疫苗,包括一剂 Tdap-IPV 疫苗。有新的证据表明,可能不需要每 10 年接种一次 Td 疫苗加强剂。在完成对文献的全面审查之前,建议每 10 年接种一次 Td 疫苗加强剂。
请参阅计划剂量和加强剂量以及重新免疫接种。有关更多信息,请参阅第 4 部分中的破伤风类毒素、百日咳疫苗、脊髓灰质炎疫苗、b 型流感嗜血杆菌疫苗和乙型肝炎疫苗。
免疫接种记录不足的人
缺乏足够免疫接种记录的儿童和成人应被视为未接种疫苗,并按照适合其年龄和风险因素的免疫接种计划开始接种。如果条件允许,白喉和破伤风抗毒素浓度的血清学检测可以指导是否需要继续免疫接种。有关其他一般信息,请参阅第 3 部分中免疫接种记录不足者的免疫接种。
怀孕和母乳喂养
妊娠期 Tdap 免疫接种已被证明对预防新生儿和婴儿百日咳和破伤风感染是安全有效的。有关怀孕期间使用 Tdap 疫苗的信息,请参阅第 4 部分中的百日咳疫苗。有关更多信息,请参阅第 3 部分中的妊娠和母乳喂养免疫接种。
早产儿
临床状况稳定的早产儿应在与足月婴儿相同的实际年龄和时间表接种含白喉类毒素的疫苗。早产儿,尤其是出生时体重低于 1,500 克的婴儿,接种疫苗后患呼吸暂停和心动过缓的风险更高。住院早产儿在第一次免疫接种后应连续监测 48 小时。有关其他一般信息,请参阅第 3 部分中的早产儿免疫接种。
医疗机构人员/居民
长期护理机构的居民应接受适合其年龄和风险因素的所有常规免疫接种,包括含白喉类毒素的疫苗。有关其他一般信息,请参阅第 3 部分中的医疗保健机构患者免疫接种。
免疫功能低下人士
免疫功能低下的人可以接种含白喉破伤风百日咳-脊髓灰质炎-Hib 的疫苗。当考虑对免疫功能低下的人进行免疫接种时,咨询该个体的主治医生可能会有所帮助。对于复杂病例,建议转诊给具有免疫接种或免疫缺陷专业知识的医生。有关更多信息,请参阅第 3 部分中免疫功能低下人群的免疫接种。
慢性病患者
神经系统疾病
免疫接种前发病的神经系统疾病患者应接受所有常规推荐的免疫接种。有关含白喉类毒素联合疫苗中其他成分的信息,请参阅第 4 部分中的破伤风类毒素和百日咳疫苗。有关其他一般信息,请参阅第 3 部分中的慢性病患者免疫接种。
旅客
未免疫或未完全免疫的旅行者应接种适合年龄的含白喉-破伤风-百日咳-脊髓灰质炎-Hib 疫苗。对于开始旅行的婴儿,可以在 6 周大时接种第一剂 DTaP-IPV-Hib 或 DTaP-HB-IPV-Hib 疫苗(请参阅时间表)。既往免疫接种过的成年旅行者应每 10 年接种一次含破伤风-白喉类毒素的制剂加强剂。对于以前在成年后未接种过一剂无细胞百日咳疫苗的成年人,建议用 Tdap 疫苗代替 Td 疫苗加强剂。一些旅行者可能还需要脊髓灰质炎加强针。有关更多信息,请参阅第 4 部分中的脊髓灰质炎疫苗。请参阅第 3 部分中的旅行者免疫接种,了解更多一般信息。
新移民
医护人员看到新抵达加拿大的人时,应查看免疫接种状态并更新这些人的免疫接种情况。有关其他一般信息,请参阅第 3 部分中加拿大新移民的免疫接种。
工人
所有医护人员都应对白喉具有免疫力,并按照所有成人的建议每 10 年接种一次 Td 疫苗加强剂。所有医护人员和儿童保育工作者,无论年龄大小,如果以前在成年后没有接种过百日咳疫苗,都应该接种单剂 Tdap 疫苗以保护百日咳,即使他们不应该接种破伤风和白喉加强针。有关其他一般信息,请参阅第 3 部分中的工人免疫接种。
暴露后免疫
含白喉类毒素的疫苗
白喉病例的密切接触者(例如,家庭、教室)应接种一剂适合年龄的含白喉类毒素疫苗,除非已知接触者已完全免疫,并且最后一剂含白喉类毒素疫苗是在 10 年内接种的。对于先前未免疫或未完全免疫的接触者,应完成含白喉类毒素的疫苗系列。
白喉抗毒素(马)
白喉的预防
不建议将白喉抗毒素用于预防已免疫或未免疫的白喉病例密切接触者,因为对马血清过敏反应的风险很大,并且缺乏证据表明抗毒素对接受抗微生物药物预防的接触者有额外益处。
白喉的治疗
用于治疗白喉疾病的白喉抗毒素可通过当地公共卫生官员紧急获得。当临床怀疑白喉时,应在细菌学确诊之前给予抗毒素。检测马血清敏感性的方法以及剂量和给药途径在制造商的产品说明书中提供。如果药敏试验呈阳性,则必须根据制造商的建议进行脱敏治疗。肌内注射通常就足够了,但在某些情况下可能需要静脉注射。
白喉康复者应按照未患白喉者的建议接种含白喉类毒素的疫苗。由于白喉的症状主要通过白喉细菌产生的毒素而不是通过细菌本身介导,因此从白喉疾病中恢复并不一定赋予免疫力。
有关安全信息,请参阅疫苗和抗毒素安全性和不良事件。
有关完整的处方信息,请查阅产品说明书或加拿大卫生部授权产品专论中包含的信息,可通过药品数据库获得。
疫苗接种
剂量、给药途径和时间表
剂量
每剂含白喉类毒素的疫苗为 0.5 mL。
给药途径
含白喉类毒素的疫苗必须肌肉注射。有关更多信息,请参阅第 1 部分中的疫苗接种实践。
附表
婴儿和儿童(2 个月至 6 岁)
婴儿常规白喉免疫接种:DTaP-IPV-Hib 疫苗应在 2、4、6 和 12 至 23 个月大时接种(最后一次通常在 18 个月大时接种)。
如果进行婴儿乙型肝炎免疫接种,DTaP-HB-IPV-Hib 疫苗可用作单独接种乙型肝炎和 DTaP-IPV-Hib 疫苗的替代品。DTaP-HB-IPV-Hib 疫苗获准用于 6 周至 23 个月大的儿童,必要时可给予 24 个月至 7 岁以下的儿童。DTaP-HB-IPV-Hib 疫苗可以在 2、4、6 和 12 至 23 个月大时接种,但第四剂不太可能提供显着的额外乙型肝炎保护,并且会增加成本。可以使用以下替代时间表:
- DTaP-HB-IPV-Hib 疫苗(2、4 和 6 个月大)和 12 至 23 个月大的 DTaP-IPV-Hib 疫苗
- DTaP-HB-IPV-Hib 疫苗(2、4 和 12 至 23 个月大)和 DTaP-IPV-Hib 疫苗在 6 个月大时接种。
如果婴儿需要快速保护,可以在 6 周大时接种第一剂 DTaP-IPV-Hib 或 DTaP-HB-IPV-Hib 疫苗。前三剂可以间隔 4 周给药,最好在第三剂后 12 个月接种第四剂。在某些情况下(例如,旅行),可以在第三剂后至少 6 个月间隔接种第四剂,但必须在 12 个月大时或之后接种,以实现持续免疫力。
7岁以下未在婴儿期接种疫苗的儿童:应接种三剂DTaP – IPV(根据儿童年龄决定是否含Hib)疫苗,各剂之间间隔8周,然后在第三剂后的6至12个月接种一剂DTaP – IPV疫苗。在4至6岁(入学时)应接种一剂DTaP – IPV或Tdap – IPV疫苗作为加强针。如果在4岁生日之后接种了第四剂含破伤风类毒素的疫苗,则不需要在4至6岁时接种加强针。
如果7岁以下未在婴儿期接种疫苗的儿童需要快速获得保护,前三剂疫苗可以每4周接种一剂,并且理想情况下,在第三剂后的12个月接种第四剂。在某些情况下(例如旅行时),第四剂可以在第三剂后至少间隔6个月接种。
按照上述情况接种了一剂白喉类毒素疫苗的基础系列并在6 – 12个月后接种了加强针的儿童,应在4至6岁(入学时)接种一剂DTaP – IPV或Tdap – IPV疫苗作为加强针;并且在10年后,即14至16岁时接种一剂Tdap疫苗作为加强针。如果在4岁生日之后接种了第四剂含白喉类毒素的疫苗,则不需要在4至6岁时接种加强针。
儿童和青少年(7 岁至 17 岁)
以前未接种过疫苗的 7 岁及以上儿童应接种三剂 Tdap-IPV 疫苗,前两剂之间间隔 8 周,然后在第二剂后 6 至 12 个月接种第三剂。应在最后一剂后 10 年接种 Tdap 疫苗加强剂。
成人 (18 岁及以上)
以前未接种过含白喉类毒素疫苗基础系列(至少 3 剂)的成人应接种含 Td 疫苗,包括一剂 Tdap-IPV 疫苗。
加强剂量和重新免疫接种
学龄前儿童应于4 – 6岁接种一剂DTaP – IPV或Tdap – IPV疫苗加强针。青少年应在14 – 16岁常规接种一剂Tdap疫苗加强针。
有新的证据表明,可能不需要每10年接种一剂Td疫苗加强针。在对文献进行全面审查完成之前,仍建议每10年接种一剂Td疫苗加强针。未曾接种过成人剂量含百日咳疫苗的成年人应接种一剂Tdap疫苗,无论自上次接种含破伤风和白喉类毒素疫苗以来间隔了多久都可接种。请参阅 计划。
血清学检测
不建议在接种含白喉类毒素疫苗之前或之后进行血清学检测。
存储要求
含白喉类毒素的制剂应储存在 +2°C 至 +8°C 的冰箱中,不得冷冻。有关其他一般信息,请参阅第 1 部分中免疫剂的储存和处理。
与其他疫苗同时接种
含白喉类毒素的疫苗可以与常规疫苗同时在不同注射部位使用单独的针头和注射器进行接种。有关其他一般信息,请参阅第 1 部分中的疫苗接种时间。
疫苗和抗毒素的安全性和不良事件
有关其他一般信息,请参阅第 2 部分中免疫接种后的不良事件。有关含白喉类毒素联合疫苗中其他成分的更多信息请参阅第 4 部分中的破伤风类毒素、百日咳疫苗、脊髓灰质炎疫苗、b 型流感嗜血杆菌疫苗和乙型肝炎疫苗。
常见和局部不良事件
含白喉类毒素的疫苗
注射部位的红肿和疼痛是儿童含白喉类毒素联合疫苗最常见的不良反应。注射部位可摸到结节并可能持续数周。有报道称注射部位出现脓肿。
在临床试验中,在接种前3剂次含白喉类毒素疫苗后的每次接种,10% – 40%的儿童报告了注射部位不良反应,包括压痛、红斑、肿胀或这些症状的任意组合。轻微的全身反应如发热、烦躁哭闹或这些症状的任意组合较为常见(8% – 29%),嗜睡(40% – 52%)也较为常见。
在两项临床研究中,在接种第4剂或第5剂DTaP疫苗后,15% – 20%的接种者报告有肿胀(大于5厘米)和红斑。可能有部分儿童(2% – 6%)出现广泛的肢体肿胀(直径大于10厘米),可能累及整个近端肢体。虽然这些注射部位反应会产生明显的肿胀,但疼痛通常较轻微。有一些证据表明,在接种第4剂DTaP疫苗后出现广泛肢体肿胀的儿童,在接种第5剂时发生此类事件的风险增加。然而,之前剂次出现较大的注射部位反应并非继续按照推荐程序接种的禁忌。
在接受Tdap疫苗加强针的成人中,常见反应包括注射部位疼痛、红肿、头痛和疲劳。发热和寒战也是常见反应。Td疫苗接种后的不良反应与之相似。总体而言,成人的不良反应比青少年少见。儿童DTaP疫苗系列接种或Td疫苗接种与Tdap疫苗接种之间的间隔不影响注射部位或全身不良事件的发生率。
DAtx
白喉抗毒素可能引发不同严重程度的过敏反应,包括:皮肤瘙痒、疼痛、肿胀或发红;荨麻疹;干咳;声音 嘶哑;恶心;呕吐;和哮喘样危象。频率各不相同,反应发生在 DAtx 给药后的前 24 小时内。以前接受过马血清治疗的人可能有更高的反应风险。
不太常见和严重或严重的不良事件
含白喉类毒素的疫苗
使用含白喉类毒素的疫苗进行免疫接种后,严重不良事件很少见,并且在大多数情况下,数据不足以确定疫苗引起了反应。严重的全身反应,例如全身性荨麻疹、全身过敏反应或神经系统并发症,很少见报道。
在接种含白喉类毒素或破伤风类毒素的疫苗后,偶尔会报告严重的(Arthus 型)注射部位反应。注射部位周围可能有广泛、疼痛的肿胀,通常涉及从肩部到肘部的手臂,通常在注射后 2 至 8 小时开始。此类反应最常见于成人,尤其是那些经常接受白喉或破伤风类毒素或两者兼而有之的患者。经历严重注射部位反应的人通常具有非常高的血清抗毒素浓度,至少 10 年内不应进一步常规接种 Td 疫苗加强剂量。对于在过去 10 年内有 Arthus 型注射部位反应史的孕妇,应在再次接种 Tdap 疫苗前转诊给专科医生。
DAtx
严重反应不常见。据报道,在 1:50,000 接受 DAtx 的人中发生了致命的过敏性休克。大约 8% 的受者在施用 DAtx 后 5 至 24 天可能出现血清病(发热、荨麻疹、关节痛、腺样肥大,以及更罕见的神经或肾脏损害)。
其他报告的不良事件和病症
据报道,在接受含白喉类毒素的疫苗后,出现吉兰-巴利综合征 (GBS) 或多发性神经炎的病例。虽然证据支持破伤风类毒素和 GBS 之间存在因果关系,但几乎没有证据支持接受白喉类毒素与 GBS 之间存在独立关联。
免疫接种后不良事件报告指南 (AEFI)
要求疫苗提供者通过当地公共卫生官员报告任何被认为与疫苗接种暂时相关的严重或意外不良事件,以便进行全面调查。意外 AEFI 是指未在可用商品信息中列出的事件,但可能是由于免疫接种或已知 AEFI 频率增加造成的。有关 AEFI 报告的更多信息,请参阅加拿大免疫接种后不良事件报告 (AEFI) 和免疫接种后不良事件第 2 部分。
禁忌症和注意事项
含白喉类毒素疫苗禁用于既往接种疫苗后有过敏反应史的人,以及已证实对疫苗的任何成分或其容器的速发型或过敏性超敏反应的人。请参阅第 1 部分授权在加拿大使用的免疫剂内容中的表 1 和表 2,了解授权在加拿大使用的所有疫苗和被动免疫剂及其内容的列表。
对酵母菌过敏非常罕见,酵母菌过敏的个人史通常不可靠。在疑似对疫苗成分过敏或非过敏反应的情况下,需要进行检查,这可能涉及在受控环境中进行免疫接种。建议咨询过敏症专家。
对于中度或重度急性疾病患者,应推迟接种含白喉类毒素的疫苗。患有轻微急性疾病(伴有或不伴有发热)的人可以接种疫苗。
谨慎的做法是,不要为在接种疫苗后 6 周内患上 GBS 的含破伤风类毒素疫苗的人接种更多剂量的疫苗。那些在 6 周间隔之外患上 GBS 的人可以接受后续剂量的含破伤风类毒素的疫苗。如果在 GBS 发作前 6 周内有弯曲杆菌感染史(与 GBS 相关)并接种过含破伤风和白喉类毒素的疫苗,建议咨询传染病专科医生。
在接种一剂含破伤风类毒素疫苗后出现严重注射部位反应的人,至少 10 年内不应再接种一剂。
有关其他一般信息,请参阅第 2 部分中的禁忌症和注意事项。
其他注意事项
疫苗的互换性
三剂含白喉类毒素疫苗的基础系列应尽可能与同一制造商提供的适当疫苗一起完成。但是,如果原始疫苗未知或无法获得,则可以使用其他制造商的替代联合疫苗来完成基础系列。根据专家意见,任何制造商的合适产品都可用于所有加强剂量。有关其他一般信息,请参阅第 1 部分中的疫苗可互换性原则。
精选参考资料
- 疾病控制和预防中心。ACIP 为医护人员提供关于使用破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗 (Tdap) 以及使用暴露后抗菌药物的临时建议。
- 疾病控制和预防中心。读者须知:FDA 批准白喉和破伤风类毒素以及无细胞百日咳疫苗吸附 (INFANRIX) 连续第五剂 DTaP 疫苗®.MMWR Morb Mortal Wkly Rep. 2003 年 9 月 26 日;52(38):921.
- 疾病控制和预防中心。预防孕妇和产后妇女及其婴儿的百日咳、破伤风和白喉。免疫实践咨询委员会 (ACIP) 的建议。MMWR Morb Mortal Wkly 代表 2008 年;57(RR-4):1-49。
- 疾病控制和预防中心。粉红皮书:疫苗可预防疾病的流行病学和预防。更新第 11 版;2009 年 5 月。
- 疾病控制和预防中心。2012 年国际旅行健康信息。黄皮书。
- 疾病控制和预防中心。更新:Menactra 脑膜炎球菌结合疫苗接受者中的吉兰-巴雷综合征 – 美国®,2005 年 6 月至 2006 年 9 月。MMWR 2006 年;55:1120-24.
- 疾病控制和预防中心。2010 年免疫实践咨询委员会更新了使用破伤风类毒素、减少白喉类毒素和无细胞百日咳 (Tdap) 疫苗的建议。MMWR Morb Mortal Wkly 代表 2011;60(1):13-15.
- 疾病控制和预防中心。更新了 65 岁及以上成人使用破伤风类毒素、减毒白喉类毒素和无细胞百日咳 (Tdap) 疫苗的建议 — 免疫实践咨询委员会 (ACIP),2012 年。
- David S, Hemsley C, Pasquali P et al. 加强对疫苗相关不良事件的监测:育空地区高中生的 dTap 追赶。Can Commun Dis Rep 2005;31(11):117-26.
- Decker MD, Edwards KM, Steinhoff MC et al. 13 种无细胞百日咳疫苗的比较:不良反应。儿科 1995;96(l):557-66。
- Dittmann S, Wharton M, Vitek C et al. 前苏维埃社会主义共和国联盟各州成功控制流行性白喉:经验教训。J 感染疾病 2000;181(增刊 1):S10-22。
- Galazka A, Robertson S. 白喉免疫接种,特别强调成人免疫接种。疫苗 1996;14(9):845-57.
- Gautret P, Wilder-Smith A. 成年旅行者接种破伤风、白喉、百日咳和脊髓灰质炎疫苗。旅行医学感染疾病 2010;8:155-60。
- 葛兰素史克公司产品专论 – BOOSTRIX,®2009 年 10 月。
- 葛兰素史克公司产品专论 – BOOSTRIX-POLIO,®2008 年 6 月。
- 葛兰素史克公司产品专著 – INFANRIX hexa™.2008 年 7 月。
- Halperin S, Sweet L, Baxendale D et al. 在先前接种破伤风-白喉疫苗后多久可以接种成人配方的破伤风-白喉-无细胞百日咳疫苗?儿科感染疾病杂志 2006;25(3):195-200.
- Instituto Butantan.产品说明书 – 抗白喉血清,未注明日期。
- 医学研究所。与儿童疫苗相关的不良事件:影响因果关系的证据,华盛顿特区,国家科学院出版社,1994 年。
- Kretsinger K、Broder KR、Cortese MM 等人。疾病控制和预防中心;免疫实践咨询委员会;医疗保健感染控制实践咨询委员会。预防成人破伤风、白喉和百日咳:使用破伤风类毒素、减少白喉类毒素和无细胞百日咳疫苗免疫实践咨询委员会 (ACIP) 的建议,以及 ACIP 在医疗保健感染控制实践咨询委员会 (HICPAC) 的支持下的建议,供医护人员使用 Tdap。MMWR Recomm Rep 2006 年 12 月 15 日;55(RR-17):1-37。
- Langley JM, Predy G, Guasparina R, et al. 与儿科制剂脱细胞百日咳疫苗和白喉类毒素吸附联合灭活脊髓灰质炎疫苗相比,青少年-成人制剂破伤风和白喉类毒素吸附联合无细胞百日咳疫苗在 4-6 岁儿童中的免疫原性相当,但反应原性更低。疫苗 2007;25:1121-25.
- 国家免疫咨询委员会。接种白喉、破伤风和百日咳疫苗的间隔。Can Commun Dis Rep 2005;31(ACS-9)。
- 国家免疫咨询委员会。关于五价和六价疫苗推荐用途的声明。Can Comm Dis Rep 2007;33(ACS-1):1-15。
- Plotkin SA,华盛顿州奥伦斯坦。疫苗 4th版。费城:W.B Saunders Company,2003:211-228。
- 雷内尔斯 MB。加强剂量的白喉-破伤风-无细胞百日咳疫苗后发生的广泛肿胀反应。Semin pediatr Infect Dis. 2003 年 7 月;14(3):196-8.
- Rennels MB, Black S, Woo EJ et al. 第五剂白喉和破伤风类毒素和无细胞百日咳疫苗在对第四剂出现广泛局部反应的儿童中的安全性。儿科感染疾病杂志 2008 年 5 月;27(5):464-5.
- 赛诺菲巴斯德有限公司产品专著 – ADACEL®,2009 年 8 月。
- 赛诺菲巴斯德有限公司产品专论 – ADACEL-POLIO,®2010 年 10 月。
- 赛诺菲巴斯德有限公司产品专著 – PEDIACEL,®2009 年 1 月。
- 赛诺菲巴斯德有限公司产品专著 – QUADRACEL®,2008 年 7 月。
- Sanofi Pasteur Ltd. 产品专著 – Td ADSORBED,2010 年 7 月。
- 加拿大的 Varughese P. 白喉 – 监测摘要。Can Dis Wkly 代表 1978;4:65-8。
页面详细信息
修改日期:
Hits: 85
- 加拿大免疫指南:致谢
- 加拿大免疫指南:简介
- 加拿大免疫:加拿大免疫指南
- 免疫的好处:加拿大免疫指南
- 国家免疫实践指南:加拿大免疫指南
- 关于免疫接种的有效沟通 加拿大免疫接种指南
- 联合疫苗的原理 加拿大免疫指南
- 疫苗互换性原则:加拿大免疫指南
- 免疫制剂的储存和处理:加拿大免疫指南
- 接种疫苗的时机:加拿大免疫指南
- 血液制品、人免疫球蛋白和免疫时间:加拿大免疫指南
- 免疫记录:加拿大免疫指南
- 推荐的免疫接种时间表:加拿大免疫接种指南
- 基础免疫学和疫苗学:加拿大免疫指南
- 加拿大授权使用的免疫剂:加拿大免疫指南
- 加拿大免疫指南:第1部分-关键免疫信息
- 疫苗安全性和药物警戒:加拿大免疫指南
- 禁忌症和注意事项:加拿大免疫指南
- 接种疫苗后的过敏反应和其他急性反应:加拿大免疫指南
- 免疫接种后的不良事件(AEFI):加拿大免疫指南
- 加拿大免疫指南:第2部分 疫苗安全
- 成人免疫:加拿大免疫指南
- 免疫记录不充分的人的免疫:加拿大免疫指南
- 怀孕和哺乳期间的免疫:加拿大免疫指南
- 早产婴儿的免疫接种:加拿大免疫指南
- 卫生保健机构中病人的免疫接种:加拿大免疫指南
- 慢性病患者的免疫:加拿大免疫指南
- 免疫缺陷者的免疫:加拿大免疫指南
- 旅行者的免疫:加拿大免疫指南
- 加拿大新移民的免疫接种:加拿大免疫指南
- 工人免疫:加拿大免疫指南
- 麻疹疫苗:加拿大免疫指南
- 加拿大免疫指南:第3部分.特定人群的疫苗接种
- 卡介苗:加拿大免疫指南
- 霍乱和肠毒素大肠杆菌(ETEC)旅行者腹泻疫苗:加拿大免疫指南
- 新冠肺炎疫苗:加拿大免疫指南
- 白喉类毒素:加拿大免疫指南
- 埃博拉病毒疫苗:加拿大免疫指南
- b型流感嗜血杆菌 (Hib)疫苗:加拿大免疫指南
- 甲型肝炎疫苗:加拿大免疫指南
- 乙型肝炎疫苗:加拿大免疫指南
- 带状疱疹疫苗:加拿大免疫指南
- 疫苗接种实践:加拿大免疫指南
- 人乳头瘤病毒(HPV)疫苗:加拿大免疫指南
- 流感疫苗:加拿大免疫指南
- 日本脑炎疫苗:加拿大免疫指南
- 脑膜炎球菌疫苗:加拿大免疫指南
- 流行性腮腺炎疫苗:加拿大免疫指南
- 百日咳疫苗:加拿大免疫指南
- 肺炎球菌疫苗:加拿大免疫指南
- 脊髓灰质炎疫苗:加拿大免疫指南
- 狂犬病疫苗:加拿大免疫指南
- 呼吸道合胞病毒 (RSV) 疫苗:加拿大免疫接种指南
- 轮状病毒疫苗:加拿大免疫指南
- 风疹疫苗:加拿大免疫指南
- 天花和mpox疫苗:加拿大免疫指南
- 破伤风类毒素:加拿大免疫指南
- 伤寒疫苗:加拿大免疫指南
- 13. 免疫问题
- 水痘疫苗:加拿大免疫指南
- 黄热病疫苗:加拿大免疫指南
- 加拿大免疫指南:更新表
- 加拿大免疫指南
