Contents
- 1
- 1.0.1 出生至15个月
- 1.0.2 18个月到18岁
- 1.0.3 注释
- 1.0.4 附加说明
- 1.0.5 1.新冠肺炎疫苗接种 (最小年龄:6个月[Moderna和辉瑞-BioNTech新冠肺炎疫苗],12岁[Novavax新冠肺炎疫苗])
- 1.0.6
- 1.0.7 2.登革热疫苗接种 (最小年龄:9岁)
- 1.0.8
- 1.0.9 3.白喉、破伤风和百日咳疫苗接种 (最小年龄:6周[对 Kinrix® 和 Quadracel®是4岁])
- 1.0.10
- 1.0.11 4.b型流感嗜血杆菌疫苗接种 (最小年龄:6周)
- 1.0.12
- 1.0.13 5.甲型肝炎疫苗接种 (最低年龄:常规疫苗接种12月龄)
- 1.0.14
- 1.0.15 6.乙肝疫苗接种 (最低年龄:出生)
- 1.0.16
- 1.0.17 7.人乳头瘤病毒疫苗接种 (最小年龄:9岁)
- 1.0.18
- 1.0.19 8.流感疫苗接种 (最低年龄:6个月[IIV]、2岁[LAIV4]、18岁[重组流感疫苗,RIV4])
- 1.0.20
- 1.0.21 9.麻疹、腮腺炎和风疹疫苗接种 (最低年龄:常规疫苗接种12月龄)
- 1.0.22
- 1.0.23 10.脑膜炎球菌血清群A、C、W、Y疫苗接种(最低年龄:2月龄[MenACWY-CRM,Menveo],9月龄[MenACWY-D,Menactra],2岁[MenACWY-TT,MenQuadfi])
- 1.0.24
- 1.0.25 11.B群脑膜炎球菌疫苗接种 (最低年龄:10岁[MenB-4C,Bexsero®;MenB-FHbp,Trumenba®])
- 1.0.26
- 1.0.27 12.肺炎球菌疫苗接种 (最小年龄:6周[PCV13],[PCV15],2岁[PPSV23])
- 1.0.28
- 1.0.29 13.脊髓灰质炎疫苗接种 (最小年龄:6周)
- 1.0.30
- 1.0.31 14.轮状病毒疫苗接种 (最小年龄:6周)
- 1.0.32
- 1.0.33 15.破伤风、白喉和百日咳(Tdap)疫苗接种 (最低年龄:常规疫苗接种为11岁,补充疫苗接种为7岁)
- 1.0.34
- 1.0.35 16.水痘疫苗接种 (最小年龄:12个月)
- 2
- 3
- 4
按年龄分列的儿童和青少年免疫计划
美国2023年18岁及以下人群的建议
请查看最新的新冠肺炎疫苗建议和新的或更新的建议呼吸道合胞病毒 , 流行性感冒, 肺炎球菌、脊髓灰质炎和猴痘疫苗。这些已经被疾病预防控制中心的主任采纳,并且是正式的。
使用时间表
为了提出疫苗接种建议,医疗保健提供者应该:
确定所需的疫苗基于年龄
确定适当的时间间隔追赶,如果需要
评估医疗状况和其他适应症
回顾特殊情况(疫苗接种说明)
回顾禁忌症和注意事项 接种疫苗
给父母的
对父母友好的时间表
- 出生至6岁
- 7至18年
你的孩子可能需要的疫苗: 获取推荐疫苗的个性化列表
出生至15个月
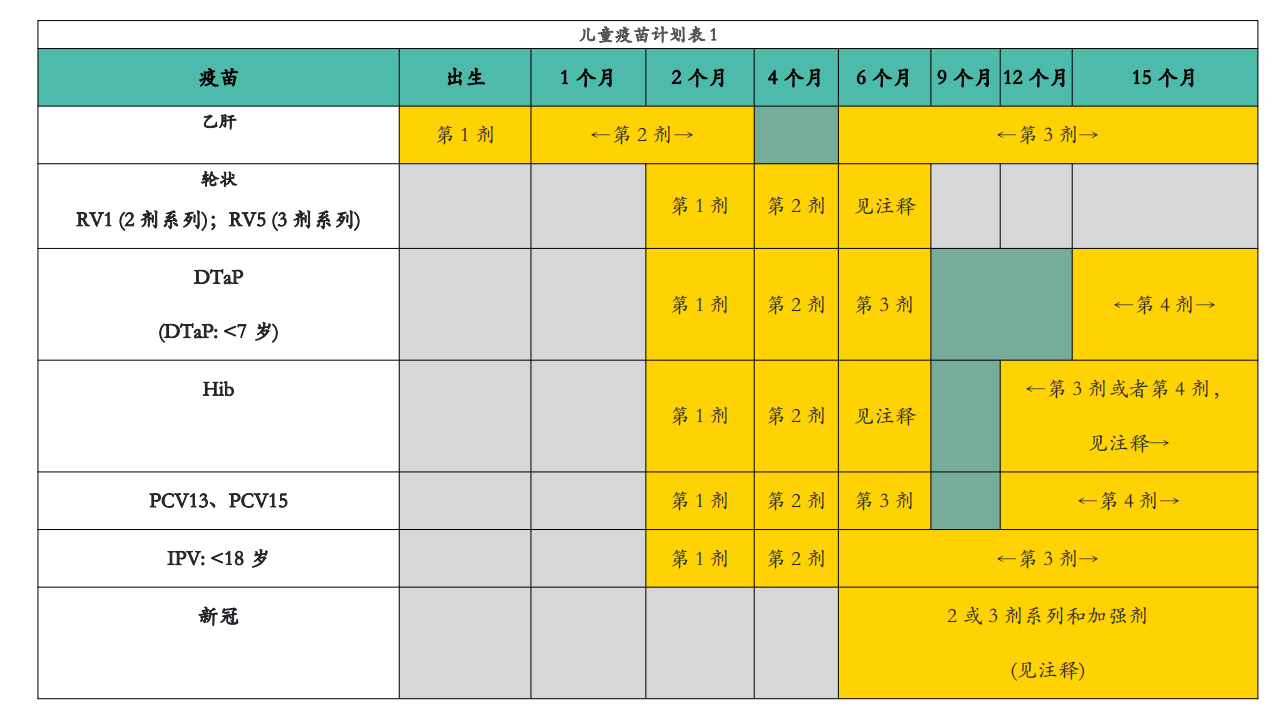
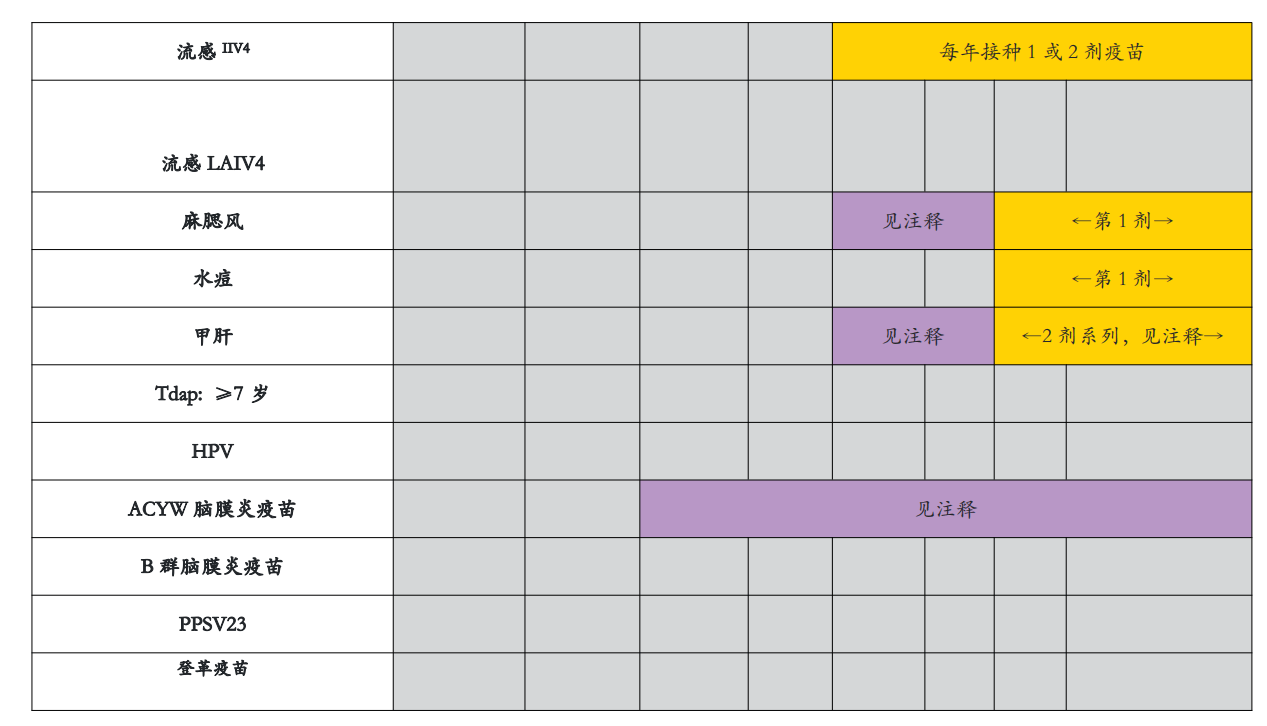
18个月到18岁

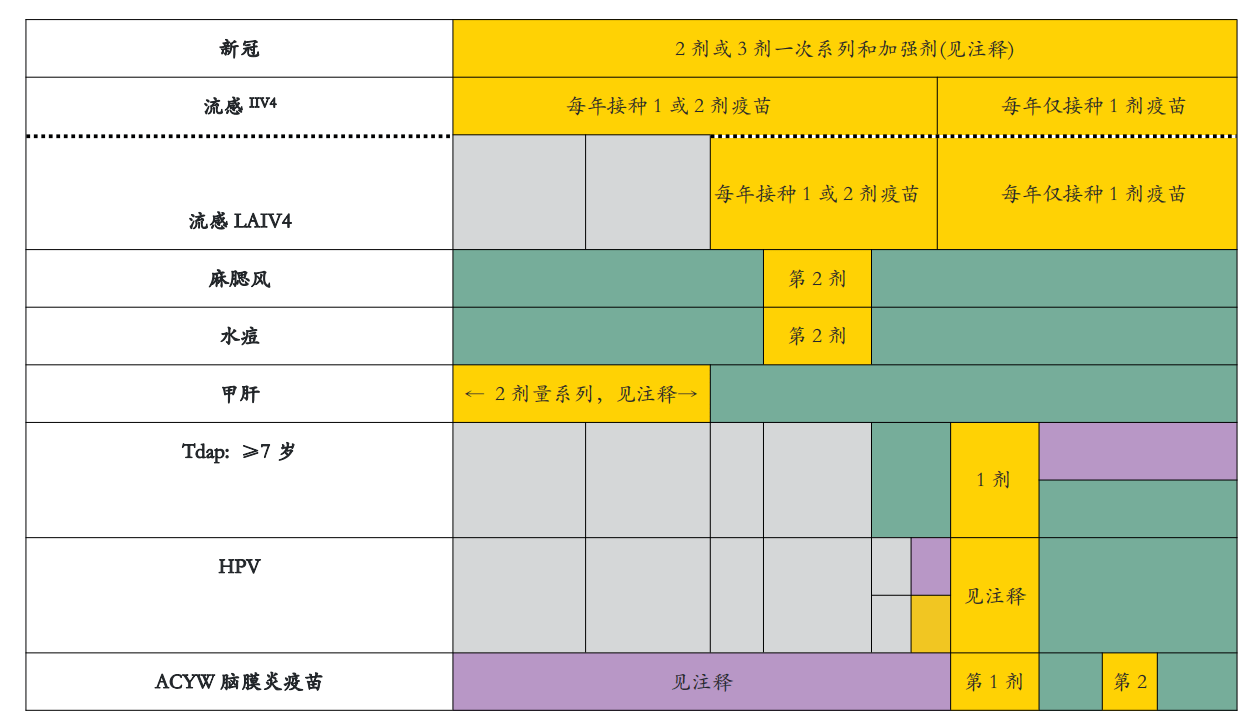
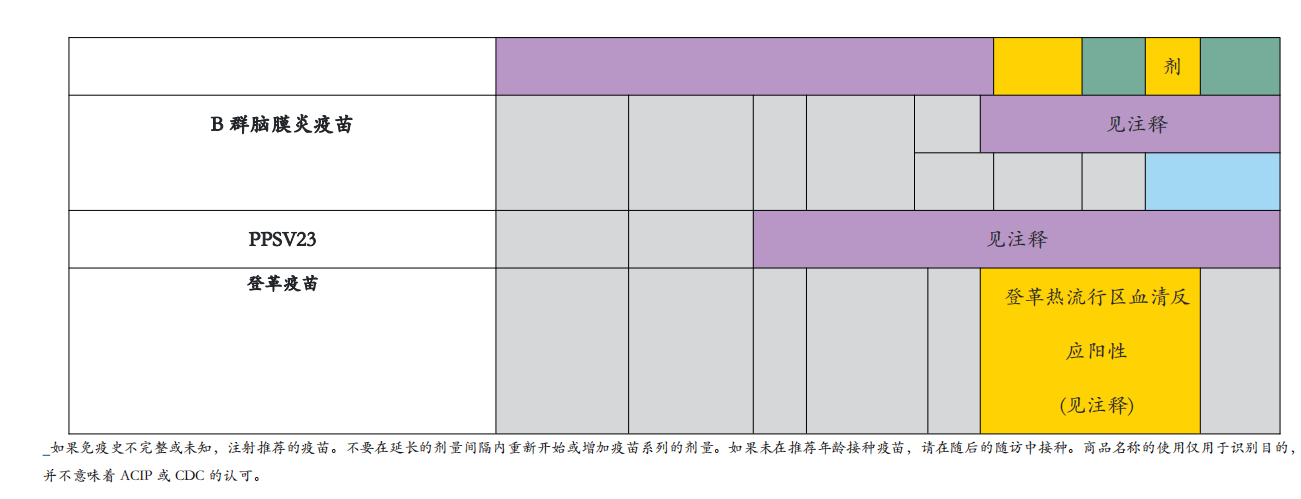
如果免疫史不完整或未知,注射推荐的疫苗。不要在延长的剂量间隔内重新开始或增加疫苗系列的剂量。如果未在推荐年龄接种疫苗,请在随后的随访中接种。商品名称的使用仅用于识别目的,并不意味着ACIP或CDC的认可。
注释
有关19岁或以上人群的疫苗接种建议,请参见推荐的成人免疫计划, 2023。
附加说明
- 有关详细信息,请参考相关的ACIP声明推荐.
- 为了计算剂量间隔,4周= 28天。间隔≥4个月由日历月决定。
- 在一个数字范围内(如12–18),破折号(–)应读作“到”
- 在最小年龄或间隔前≤4天注射的疫苗剂量被视为有效。在最小年龄或最小间隔时间前≥5天注射的任何疫苗剂量不应被视为有效,应根据年龄适当重复注射。无效剂量之后的重复剂量应间隔建议的最小间隔。有关更多详细信息,请参见表3-2,推荐和最小年龄以及疫苗剂量间隔,单位免疫的一般最佳实践指南.
- 有关旅行疫苗接种要求和建议的信息,请访问https://www.cdc.gov/travel/.
- 关于免疫缺陷者的疫苗接种,请参见表8-1为患有原发性和继发性免疫缺陷的人接种疫苗免疫的一般最佳实践指南特殊临床情况下的免疫接种(见:Kimberlin DW,Barnett ED,Lynfield Ruth,Sawyer MH,eds。红皮书:传染病委员会2021–2024年报告。第三十二版。伊利诺伊州伊塔斯卡:美国儿科学会;2021:72–86).
- 有关在疫苗可预防疾病爆发的情况下接种疫苗的信息,请联系您所在州或当地的卫生部门。
- 国家疫苗伤害赔偿计划(VICP)是解决疫苗伤害索赔的传统法律制度的无过错替代方案。除登革热、猪细小病毒23型和新冠肺炎疫苗外,儿童和青少年疫苗计划中的所有疫苗均由VICP承保。由FDA授权或批准的新冠肺炎疫苗由对抗伤害赔偿计划(CICP)承保。如需详细资讯,请参阅www.hrsa.gov/vaccinecompensation或者www.hrsa.gov/cicp.
1.新冠肺炎疫苗接种
(最小年龄:6个月[Moderna和辉瑞-BioNTech新冠肺炎疫苗],12岁[Novavax新冠肺炎疫苗])
新冠肺炎疫苗接种建议已经改变。查看最新推荐。
常规疫苗接种
- 主要系列:
- 年龄6个月至4岁:0、4-8周的2剂系列(Moderna)或0、3-8、11-16周的3剂系列(辉瑞-BioNTech)
- 年龄5-11岁:0、4-8周的2剂系列(Moderna)或0、3-8周的2剂系列(辉瑞-BioNTech)
- 12至18岁:0、4-8周的2剂系列(Moderna)或0、3-8周的2剂系列(Novavax,辉瑞-BioNTech)
- 为加强剂量建议看见see www.cdc.gov/vaccines/covid-19/clinical-considerations/interim-considerations-us.html
特殊情况
免疫功能中度或重度受损的人
- 主要系列
- 年龄6个月至4岁:0、4、8周的3剂系列(Moderna)或0、3、11周的3剂系列(辉瑞-BioNTech)
- 年龄5-11岁:0、4、8周的3剂系列(Moderna)或0、3、7周的3剂系列(辉瑞-BioNTech)
- 12至18岁:0、4、8周的3剂系列(Moderna)或0、3周的2剂系列(Novavax)或0、3、7周的3剂系列(辉瑞-BioNTech)
- 加强剂量:看见www.cdc.gov/vaccines/covid-19/clinical-considerations/interim-considerations-us.html
- 暴露前预防(单克隆抗体)可以被认为是新冠肺炎疫苗接种的补充。看见www.cdc.gov/vaccines/covid-19/clinical-considerations/interim-considerations-us.html#immunocompromised
对于强生新冠肺炎疫苗接种者参见新冠肺炎时间表www.cdc.gov/vaccines/covid-19/clinical-considerations/interim-considerations-us.html
注意:每剂注射一种适合年龄的疫苗。当前新冠肺炎时间表和剂量配方可从以下网址获得www.cdc.gov/vaccines/covid-19/downloads/COVID-19-immunization-schedule-ages-6months-older.pdf.。有关新冠肺炎疫苗紧急使用授权(EUA)适应症的更多信息,请参见www.fda.gov/emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/covid-19-vaccines..
禁忌症和注意事项
有关新冠肺炎疫苗接种的禁忌症和注意事项,请参见新冠肺炎附录
2.登革热疫苗接种
(最小年龄:9岁)
常规疫苗接种
- 居住在登革热流行地区的9-16岁儿童和对以前的登革热感染进行实验室确认
- 在0、6和12个月时进行3剂系列接种
- 流行地区包括波多黎各、美属萨摩亚、美属维尔京群岛、密克罗尼西亚联邦、马绍尔群岛共和国和帕劳共和国。有关登革热流行区和疫苗接种前实验室检测的最新指南,请参见https://www.cdc.gov/mmwr/volumes/70/rr/rr7006a1.htm和https://www.cdc.gov/dengue/vaccine/hcp/index.html.
- 前往或访问登革热流行地区的儿童不应接种登革热疫苗。
禁忌症和注意事项
有关登革热疫苗接种的禁忌症和注意事项,请参见登革热附录
3.白喉、破伤风和百日咳疫苗接种
(最小年龄:6周[对 Kinrix® 和 Quadracel®是4岁])
常规疫苗接种
- 2、4、6、15-18个月、4-6岁时的5剂系列
- 预期:如果自第3次接种后已过去至少6个月,则第4次接种可在12月龄时进行。
- 追溯:如果自第 3 次接种后至少已过去 4 个月,则 12 月龄时因疏忽而接种的第 4 次接种也可计算在内。
补充疫苗接种
- 如果第 4 剂是在 4 岁或 4 岁以上且在第 3 剂之后至少 6 个月注射的,则无需注射第 5 剂。
- 有关其他补充指导,请参见表2.
特殊情况
- 伤口管理:对于年龄小于7岁且接种过3剂或3剂以上含破伤风类毒素疫苗的儿童:对于除干净和轻微伤口之外的所有伤口,如果距离上次接种含破伤风类毒素疫苗已超过5年,则应接种DTaP。有关详细信息,请参见www.cdc.gov/mmwr/volumes/67/rr/rr6702a1.htm.
禁忌症和注意事项
有关白喉、破伤风、百日咳(DTaP)疫苗接种的禁忌症和注意事项,请参见DTaP附录
4.b型流感嗜血杆菌疫苗接种
(最小年龄:6周)
常规疫苗接种
- ActHIB®,Hiberix®,Pentacel®、或Vaxelis®:4个剂量系列(2、4和6月龄时的3个剂量初级系列,随后是12-15月龄大时的加强剂量*)
- *Vaxelis®不建议用作加强剂量。加强剂量应使用不同的含Hib疫苗。
- PedvaxHIB®:3剂系列(2-4月龄时的2剂初级系列,随后是12-15月龄大时的加强剂量)
补充疫苗接种
- 第1剂在7-11月龄接种:至少在4周后注射第2剂,在12-15月龄或第2剂后8周(以较晚者为准)注射第3剂(最终剂量)。
- 第1剂在12-14月龄接种:在第1次接种后至少8周,接种第2剂(最终剂量)。
- 12月龄前接种第1剂和15月龄前接种第2剂:在第2次接种后至少8周,接种第3剂(最终剂量)。
- 2剂PedvaxHIB®12个月之前:在12-59月龄大时或第2次接种后至少8周,接种第3剂(最终剂量)。
- 15月龄或以上时接种1剂:不需要更多的剂量
- 15-59月龄未接种疫苗:接种1剂。
- 60个月或以上以前未接种疫苗的儿童 不被视为高风险的人:不需要补种疫苗
有关其他补充指导,请参见表2。Vaxelis®可用于5岁以下儿童的补充疫苗接种。遵循赶上进度,即使Vaxelis®用于一次或多次剂量。有关Vaxelis®使用的详细信息看见www.cdc.gov/mmwr/volumes/69/wr/mm6905a5.htm.
特殊情况
- 化疗或放疗:
年龄12-59月龄
- 12月龄前未接种疫苗或仅接种1剂:2剂,间隔8周
- 12月龄前接种2剂或更多剂次:前一次接种后至少8周接种1次
开始治疗后14天内或治疗期间接种的剂量应在治疗结束后至少3个月重复。
- 造血干细胞移植(HSCT):
- 成功移植后6至12个月开始的3剂系列,间隔4周,不考虑Hib疫苗接种史
- 解剖或功能性无脾症(包括镰状细胞病):
年龄12-59月龄
- 12月龄前未接种疫苗或仅接种1剂:2剂,间隔8周
- 12月龄前接种2剂或更多剂次:前一次接种后至少8周再接种1剂
未接种疫苗* 5岁或以上的人
- 1剂
- 选择性脾切除术:
未接种疫苗* 15个月或以上的人
- 1剂(最好在手术前至少14天)
- 艾滋病毒感染:
年龄12-59月龄
- 12月龄前未接种疫苗或仅接种1剂:2剂,间隔8周
- 12个月龄前2剂或更多剂次:前一次接种后至少8周接种1次
未接种疫苗的* 5-18岁的人
- 1剂
- 免疫球蛋白缺乏,早期成分补体缺乏:
年龄12-59月龄
- 12月龄前未接种疫苗或仅接种1剂:2剂,间隔8周
- 12个月龄前2剂或更多剂次:前一次接种后至少8周接种1次
*未接种=少于常规系列(14个月龄)或无剂量(15个月龄或以上)
禁忌症和注意事项
有关b型流感嗜血杆菌(Hib)疫苗接种的禁忌症和注意事项,请参见Hib附录
5.甲型肝炎疫苗接种
(最低年龄:常规疫苗接种12月龄)
常规疫苗接种
- 12-23月龄时的2剂系列(最小间隔:6个月)
补充疫苗接种
- 18岁以下未接种疫苗者应完成2剂系列(最小间隔:6个月)。
- 在12个月龄或以上时接受过第1剂的人应在第1剂后至少6个月接受第2剂。
- 18岁或以上的青少年可以接种HepA和HepB联合疫苗,Twinrix®,分为3个剂量系列(0、1和6个月)或4个剂量系列(0、7和21–30天的3个剂量,随后是12个月的加强剂量)。
国际旅行
- 前往甲型肝炎高度或中度流行国家旅行或工作的人员
(http://www.cdc.gov/travel/)- 6–11月龄:出发前接种1剂;在12-23月龄之间接种2剂疫苗(间隔至少6个月)。
- 未接种疫苗年龄12个月或以上:一旦考虑旅行,立即施用剂量1。
禁忌症和注意事项
有关甲型肝炎(HepA)疫苗接种的禁忌症和注意事项,请参见HepA附录
6.乙肝疫苗接种
(最低年龄:出生)
常规疫苗接种
- 0岁、1-2月龄、6-18月龄的3剂系列(使用单价HepB疫苗在6周大之前注射)
- 出生体重≥2000克:如果医学上稳定,在出生后24小时内接种1剂
- 出生体重< 2000克:在实足年龄1个月或出院时(以较早者为准,即使体重仍< 2000克)接种1剂。
- 未接受出生剂量的婴儿应尽快开始该系列(参见表2对于最小间隔)。
- 当在出生剂量后使用含HepB的联合疫苗时,允许施用4剂。
- 最小间隔(参见表2): 当施用4剂时,在这些计算中用“剂量4”代替“剂量3”
- 最终(第3或第4次)剂量:6-18月龄(最小年龄24周)
- 母亲是HBsAg阳性
- 出生剂量(仅单价HepB疫苗):出生后12小时内接种HepB疫苗和注射乙型肝炎免疫球蛋白(HBIG)(四肢分开),无论出生体重。
- 出生体重< 2000克:从1月龄开始,额外注射3剂HepB疫苗(共4剂)
- 最终(第3或第4次)剂量:在6月龄时服用(最小年龄24周)
- 在9-12月龄时检测HBsAg和抗-HBs。如果HepB系列延迟,在最后一次接种后1-2个月进行测试。不要在9月龄之前测试。
- 母亲是乙肝表面抗原未知
如果存在其他提示母亲感染乙型肝炎的证据(例如,存在HBV DNA、HBeAg阳性或已知母亲患有慢性乙型肝炎感染),将婴儿视为母亲HBsAg阳性来管理- 出生剂量(仅单价HepB疫苗):
- 出生体重≥2000克:出生后12小时内接种HepB疫苗。尽快确定母亲的HBsAg状态。如果母亲被确定为HBsAg阳性,尽快(在单独的肢体中)注射HBIG,但不得晚于7日龄。
- 出生体重< 2000克:出生后12小时内接种HepB疫苗和注射HBIG(四肢分开)。从1月龄开始(共4剂)再注射3剂HepB疫苗
- 最终(第3或第4次)剂量:在6月龄时接种(最小年龄24周)
- 如果母亲被确定为HBsAg阳性或状态不明,在9-12月龄时检测HBsAg和抗-HBs。如果HepB系列延迟,在最后一次接种后1-2个月进行测试。不要在9月龄之前测试。
- 出生剂量(仅单价HepB疫苗):
补充疫苗接种
- 未接种疫苗的人应在0、1–2、6个月完成3剂系列。对于最小间隔看见表2
- 11-15岁的青少年可使用替代的2剂方案,两剂之间至少间隔4个月(仅限成人使用的Recombivax HB®)。
- 18岁或以上的青少年可以获得:
- Heplisav-B®:至少间隔4周的2剂系列
- PreHevbrio®:0、1和6个月时的3个剂量系列
- HepA和HepB联合疫苗,Twinrix®:3个剂量系列(0、1和6个月)或4个剂量系列(0、7和21-30天的3个剂量,随后是12个月的加强剂量)。
特殊情况
- 一般不建议在婴儿、儿童、青少年或成人时接种疫苗的免疫状态正常的人再次接种疫苗。
- 接种后血清学检测和(如果抗-HBs < 10mlU/mL)建议用于某些人群再接种,包括:
- HBsAg阳性母亲所生的婴儿
- 透析前或维持性透析患者
- 其他免疫缺陷者
- 有关详细的重新接种建议,请参见http://www . CDC . gov/vaccines/hcp/acip-RECs/vacc-specific/hepb . html.
注意:由于缺乏孕妇的安全性数据,不建议在怀孕期间使用Heplisav-B和PreHevbrio。
禁忌症和注意事项
有关乙型肝炎(HepB)疫苗接种的禁忌症和注意事项,请参见HepB附录
7.人乳头瘤病毒疫苗接种
(最小年龄:9岁)
常规和补充疫苗接种
- 人乳头瘤病毒疫苗接种常规建议在11-12岁(可以从9岁开始),如果没有充分接种,建议所有18岁以上的人接种人乳头瘤病毒疫苗
- 根据初次接种时的年龄,分2剂或3剂系列:
- 首次接种疫苗时年龄为9-14岁:0、6–12个月的2个剂量系列(最小间隔:5个月;如果接种太快,重复接种)
- 初次接种疫苗时年龄在15岁或以上:0、1-2个月、6个月的3个剂量系列(最小间隔:第1剂至第2剂:4周;第2剂至第3剂:12周;第1剂至第3剂:5个月;如果接种太快,重复接种)
- 中断的计划:如果疫苗接种计划中断,不需要重新启动系列。
- 当任何HPV疫苗系列已经使用推荐的剂量间隔完成时,不推荐额外剂量。
特殊情况
- 免疫缺陷疾病,包括艾滋病毒感染:3剂系列,甚至适用于那些从9岁到14岁开始接种疫苗的人。
- 性虐待或性侵犯史:从9岁开始。
- 怀孕:接种疫苗前不需要验孕;不建议在怀孕后接种人乳头瘤病毒疫苗;怀孕期间接种疫苗无需干预
禁忌症和注意事项
有关人类乳头瘤病毒(人乳头瘤病毒)疫苗接种的禁忌症和注意事项,请参见人乳头瘤病毒附录
8.流感疫苗接种
(最低年龄:6个月[IIV]、2岁[LAIV4]、18岁[重组流感疫苗,RIV4])
常规疫苗接种
- 每年使用适合年龄和健康状况的流感疫苗:
- 在2022年7月1日之前接种流感疫苗少于2剂,或其流感疫苗接种史未知的人(即使儿童在接种第1剂和第2剂之间年满9岁,也应接种第2剂)接种2剂,间隔至少4周,用于6个月至8岁的儿童
- 在2022年7月1日之前接种过至少2剂流感疫苗的人,接种1剂,用于6个月至8岁的儿童
- 接种1剂,用于所有9岁或以上的人
- 关于2022-2023流行季,请参见www.cdc.gov/mmwr/volumes/71/rr/rr7101a1.htm.
- 对于2023-24流行季,请参见2023-24 ACIP流感疫苗建议。
特殊情况
- 鸡蛋过敏,仅荨麻疹:每年接种任何适合年龄和健康状况的流感疫苗
- 鸡蛋过敏,有荨麻疹以外的症状(如血管性水肿、呼吸窘迫)或所需的肾上腺素或其他紧急医疗干预:可注射任何适合年龄和健康状况的流感疫苗。如果使用基于鸡蛋的IIV4或LAIV4,请在能够识别和处理严重过敏反应的医疗保健提供者的监督下在医疗环境中接种。
- 对疫苗成分或前一剂流感疫苗的严重过敏反应:看见附录列出禁忌症和注意事项
- 需要保护环境的严重免疫抑制患者的密切接触者(如护理人员、医护人员):这些人不应接受LAIV4。如果给予LAIV4,他们应在接种疫苗后7天内避免接触/照顾此类免疫抑制者。
禁忌症和注意事项
有关流感疫苗接种的禁忌症和注意事项,请参见IIV4附录, LAIV4附录, ccIIV4附录,以及RIV4附录.
9.麻疹、腮腺炎和风疹疫苗接种
(最低年龄:常规疫苗接种12月龄)
常规疫苗接种
- 12-15月龄大、4-6岁的2剂系列
- 可以施用MMR或MMRV
注意:对于12-47月龄儿童的第1剂,建议分别接种MMR和水痘疫苗。如果父母或看护者表示偏好,可以使用MMRV。
补充疫苗接种
- 未接种疫苗的儿童和青少年:间隔至少4周的2剂系列
- 使用MMRV的最大年龄是12岁。
- MMRV剂量的最小间隔:3个月
特殊情况
- 国际旅行
- 6–11月龄:出发前接种1剂;在12-15月龄(高风险地区的儿童为12个月)时接种2剂系列疫苗,并在4周后接种第2剂。
- 12月龄或以上未接种疫苗的儿童:出发前至少间隔4周的2剂系列
- 在腮腺炎爆发的情况下,有关MMR额外剂量(包括MMR第3剂)的信息,请参见www.cdc.gov/mmwr/volumes/67/wr/mm6701a7.htm
禁忌症和注意事项
有关麻疹、腮腺炎、风疹(MMR)的禁忌症和注意事项,请参见MMR附录
10.脑膜炎球菌血清群A、C、W、Y疫苗接种(最低年龄:2月龄[MenACWY-CRM,Menveo],9月龄[MenACWY-D,Menactra],2岁[MenACWY-TT,MenQuadfi])
常规疫苗接种
- 2剂系列;11-12岁和16岁
补充疫苗接种
- 13-15岁:现在1剂,16-18岁时加强1剂(最小间隔:8周)
- 16-18岁:1剂
特殊情况
解剖性或功能性无脾症(包括镰状细胞病)、艾滋病毒感染、持续性补体成分缺乏、补体抑制剂(如依库珠单抗、拉武单抗)用途:
- Menveo®
- 2月龄时的第1剂:4剂系列(4、6和12月龄时的额外3剂)
- 3-6月龄时的第1剂:3-或4-剂量系列(前一剂后至少8周接受第2剂[和第3剂,如果适用],直到7月龄或更大时接受第1剂,随后至少12周后和12月龄后接受第2剂)
- 7-23月龄时的第1剂:2剂系列(第1剂后至少12周和12月龄后的第2剂)
- 24月龄或以上时的第1剂:至少间隔8周的2剂系列
- Menactra®
- 持续性补体成分缺乏或使用补体抑制剂:
- 9-23月龄:至少间隔12周的2剂系列
- 24月龄或以上:2剂系列至少间隔8周
- 解剖或功能性无脾症、镰状细胞病或HIV感染:
- 9-23月龄:不推荐
- 24月龄或以上:2剂系列至少间隔8周
- Menactra®必须在PCV系列完成后至少4周接种。
- 持续性补体成分缺乏或使用补体抑制剂:
- MenQuadfi®
- 24月龄或以上时的第1剂:至少间隔8周的2剂系列
前往流行性或流行性脑膜炎球菌疾病的国家,包括非洲脑膜炎带国家或在朝圣期间
(www.cdc.gov/travel/):
- 小于24月龄的儿童:
- Menveo®(2-23月龄)
- 2月龄时的第1剂:4剂系列(4、6和12月龄时的额外3剂)
- 3-6月龄时的第1剂:3-或4-剂量系列(前一剂后至少8周接受第2剂[和第3剂,如果适用],直到7月龄或更大时接受第1剂,随后至少12周后和12月龄后接受第2剂)
- 7-23月龄时的第1剂:2剂系列(第1剂后至少12周和12月龄后的第2剂)
- Menactra®(9至23月龄)
- 2-剂量系列(第1剂后至少12周第2剂;旅行者可在第一次接种后8周开始接种第二次接种)
- Menveo®(2-23月龄)
- 2岁或以上儿童:1剂Menveo*Menactra®,或MenQuadfi®
居住在住宅区的大学一年级学生(如果之前未在16岁或以上接种过疫苗)或新兵:
- 1剂Menveo®, Menactra®,或者MenQuadfi®
10岁前接种MenACWY疫苗的儿童的青少年疫苗接种:
- 推荐使用加强剂的儿童由于脑膜炎球菌病的风险持续增加(例如,补体成分缺乏症、艾滋病毒或无脾症):对于风险增加的人,请遵循加强计划.
- 不推荐使用加强剂的儿童(例如,一名健康儿童在前往流行脑膜炎球菌疾病的国家旅行时接受了单剂注射):根据推荐的青少年用药时间表,在11-12岁时使用第1剂,在16岁时使用第2剂.
* Menveo有两种配方:冻干和液体。10岁前不应使用液体制剂。
注:Menactra®应在DTaP之前或同时接种。如果需要,MenACWY可以与MenB疫苗同时接种,但如果可行,可以在不同的解剖部位接种。
为了MenACWY加强剂量 推荐对于“特殊情况”和疫情环境中列出的群体以及脑膜炎球菌疫苗接种的其他信息,请参见www.cdc.gov/mmwr/volumes/69/rr/rr6909a1.htm.
禁忌症和注意事项
脑膜炎球菌ACWY(MenACWY)的禁忌症和注意事项
[MenACWY-CRM(Menveo®);MenACWY-D(Menactra®);MenACWY-TT®)],参见MenACWY附录
11.B群脑膜炎球菌疫苗接种
(最低年龄:10岁[MenB-4C,Bexsero®;MenB-FHbp,Trumenba®])
共享临床决策
- 基于共同临床决策的16-23岁(首选16-18岁)没有增加风险的青少年:
- Bexsero®:至少相隔1个月的2剂系列
- Trumenba®:间隔至少6个月的2剂系列(如果第2剂在6月龄之前接种,则第2次接种后至少4个月接种接种第3剂)
特殊情况
解剖性或功能性无脾症(包括镰状细胞病)、持续性补体成分缺乏、补体抑制剂(如:依库珠单抗、ravulizumab)用途:
- Bexsero®:至少相隔1个月的2剂系列
- Trumenba®:第0、1–2、6个月的3个剂量系列(如果第2剂在第1剂后至少6个月接种,则不需要第3剂;如果在第2次接种后4个月之前接种第3剂,则应在第3次接种后至少4个月接种第4剂)
注:Bexsero®和Trumenba®不可互换;同一产品应用于一个系列的所有剂量。
对于MenB加强剂量建议对于“特殊情况”和疫情环境中列出的群体以及脑膜炎球菌疫苗接种的其他信息,请参见www.cdc.gov/mmwr/volumes/69/rr/rr6909a1.htm.
禁忌症和注意事项
B群脑膜炎球菌(MenB)的禁忌症和注意事项
[MenB-4C (Bexsero®);MenB-FHbp (Trumenba®)],参见MenB附录
12.肺炎球菌疫苗接种
(最小年龄:6周[PCV13],[PCV15],2岁[PPSV23])
PCV常规疫苗接种
- 第2、4、6、12-15月龄的4剂系列
PCV的补充疫苗接种
- 24-59月龄的健康儿童,任何不完整* PCV系列:1剂PCV
- 有关其他补充指导,请参见表2.
注意:PCV13和PCV15可以互换用于健康或有潜在疾病的儿童。已接受4剂PCV13或另一个适合年龄的完整PCV13系列的儿童不适用PCV15。
特殊情况
潜在条件如下:当PCV和PPSV23都适用时,首先使用PCV。PCV和PPSV23不应在同一就诊期间接种。
慢性心脏病(特别是紫绀型先天性心脏病和心力衰竭);慢性肺病(包括用高剂量口服皮质类固醇治疗的哮喘);糖尿病:
2-5岁
- 任何不完整的*系列,包括:
- 已接种3剂次PCV:1剂PCV(在任何先前PCV剂量后至少8周)
- 已接种少于3剂PCV:2剂PCV(最近一次接种后8周,间隔8周接种)
- 无PPSV23接种史:1剂PPSV23(完成所有推荐的PCV剂量后至少8周)
6-18岁
- 任何有接种PCV的不完整*系列:不需要更多的PCV剂量
- 无PPSV23接种史:1剂PPSV23(完成所有推荐的PCV剂量后至少8周)
脑脊液漏,人工耳蜗:
2-5岁
- 任何不完整的*系列,包括:
- 已接种3剂PCV:1剂PCV(在任何先前PCV剂量后至少8周)
- 已接种少于3剂PCV:2剂PCV(最近一次接种后8周,间隔8周接种)
- 无PPSV23接种史:1剂PPSV23(完成所有推荐的PCV剂量后至少8周)
- 6-18岁
- 无PCV或PPSV23接种史:至少8周后注射1剂PCV和1剂PPSV23
- 任何PCV但无PPSV23:在最近一剂PCV后至少8周,服用1剂PPSV23
- PPSV23但无PCV:在最近一次注射PPSV23后至少8周注射1次PCV
镰状细胞病和其他血红蛋白病;解剖学或功能性无脾症;先天性或获得性免疫缺陷;艾滋病毒感染;慢性肾衰竭;肾病综合征;恶性肿瘤、白血病、淋巴瘤、霍奇金病和其他与免疫抑制药物或放射疗法治疗相关的疾病;实体器官移植;多发性骨髓瘤:
2-5岁
- 任何不完整的*系列,包括:
- 已接种3剂PCV:1剂PCV(在任何先前PCV剂量后至少8周)
- 已接种少于3剂PCV:2剂PCV(最近一次接种后8周,间隔8周接种)
- 无PPSV23接种史:1剂PPSV23(完成所有推荐的PCV剂量后至少8周), 5年后第2剂PPSV23
6-18岁
- 无PCV或PPSV23接种史:1剂PCV,2剂PPSV23(第1剂PPSV23在PCV后8周接种,第2剂PPSV23在第1剂PPSV23后至少5年接种)
- 任何PCV但无PPSV23: 2剂PPSV23(第1剂PPSV23在最近一剂PCV后8周接种,第2剂PPSV23在第1剂PPSV23后至少5年接种)
- PPSV23但无PCV:在最近一次PPSV23接种后至少8周接种1剂PCV,在第1剂PPSV23接种5年后且在第1剂PCV接种后至少8周接种2剂PPSV23
*不完整系列=未接受建议系列或适龄补充系列中的所有剂量,参见ACIP肺炎球菌建议中的表2www.cdc.gov/mmwr/volumes/71/wr/mm7137a3.htm
有关确定患者何时需要哪些肺炎球菌疫苗的指导,请参考移动应用程序,可从以下位置下载:www.cdc.gov/vaccines/vpd/pneumo/hcp/pneumoapp.html
禁忌症和注意事项
有关肺炎球菌结合疫苗(PCV)的禁忌症和注意事项,请参见PCV附录和肺炎球菌多糖(PPSV23),参见PPSV23附录
13.脊髓灰质炎疫苗接种
(最小年龄:6周)
常规疫苗接种
- 2、4、6-18月龄、4-6岁时的4剂系列;在4岁当天或之后以及前一次接种后至少6个月接种最后一剂。
- 当使用含IPV的联合疫苗时,在4岁之前可以施用4剂或更多剂的IPV。但是,仍建议在4岁或之后以及前一次剂量后至少6个月接种1剂。
补充疫苗接种
- 在出生后的前6个月,仅在前往脊髓灰质炎流行地区或在疫情爆发期间使用最低年龄和间隔。
- 18岁以上的美国居民通常不推荐使用IPV。
含口服脊髓灰质炎疫苗系列(OPV),OPV-IPV混合系列或仅OPV系列:
- 完成该系列所需的总剂量与美国IPV计划的建议剂量相同。看见www.cdc.gov/mmwr/volumes/66/wr/mm6601a6.htm.
- 只有三价OPV (tOPV)计入美国疫苗接种要求。
- 应计算2016年4月1日之前服用的OPV剂量(除非特别注明在活动期间服用)。
- 2016年4月1日或之后服用的OPV剂量不应计算在内。
- 有关评估记录为“OPV”的剂量的指南,请参见www.cdc.gov/mmwr/volumes/66/wr/mm6606a7.htm.
- 有关其他补充指导,请参见表2.
特殊情况
- 18岁以下青少年暴露于脊髓灰质炎病毒的风险增加:
- 没有证据表明完成了脊髓灰质炎疫苗接种系列(即至少3剂):施用剩余剂量(1、2或3剂)以完成3剂系列
- 已完成脊髓灰质炎疫苗接种系列(即至少3剂)的证明:可注射一剂终身IPV加强剂
有关详细信息,请参见:www.cdc.gov/vaccines/vpd/polio/hcp/recommendations.html
禁忌症和注意事项
有关脊髓灰质炎灭活疫苗(IPV)的禁忌症和注意事项,请参见附录
14.轮状病毒疫苗接种
(最小年龄:6周)
常规疫苗接种
- Rotarix®:2月龄和4月龄时的2剂系列
- RotaTeq®:2、4和6月龄时的3剂系列
- 如果系列中的任何剂量是RotaTeq®或未知,默认为3剂量系列。
补充疫苗接种
- 不要在15周零0天后开始该系列。
- 最终剂量的最大年龄为8个月零0天。
- 有关其他补充指导,请参见表2.
禁忌症和注意事项
有关轮状病毒[RV1 (Rotarix),RV5 (RotaTeq )]的禁忌症和注意事项,请参见轮状病毒附录
15.破伤风、白喉和百日咳(Tdap)疫苗接种
(最低年龄:常规疫苗接种为11岁,补充疫苗接种为7岁)
常规疫苗接种
- 11-12岁的青少年:1剂Tdap
- 怀孕:每次怀孕期间接种1剂Tdap,最好是在孕27-36周的早期。
- 无论最后一次接种含破伤风和白喉类毒素疫苗的时间间隔如何,均可接种Tdap。
补充疫苗接种
- 未接受过Tdap的13-18岁青少年:1剂Tdap,然后每10年注射Td或Tdap加强剂
- 7-18岁未完全接种DTaP疫苗*的人群:1剂Tdap作为补充系列的一部分(最好是第一剂);如果需要额外的剂量,使用Td或Tdap。
- Tdap在7-10岁时实施
- 7-9岁的儿童接受Tdap的儿童应在11-12岁时接受常规Tdap剂量。
- 10岁的儿童接受Tdap的儿童在11-12岁时不需要常规的Tdap剂量。
- 7岁时或之后不慎接种DTaP:
- 7-9岁的儿童:DTaP可算作追赶系列的一部分。在11-12岁时接种常规剂量的Tdap。
- 10-18岁的儿童:计算DTaP作为青少年Tdap增强剂的剂量。
- 有关其他补充指导,请参见表2.
*完全接种= 5个有效剂量的DTaP或4个有效剂量的DTaP(如果第4个剂量是在4岁或4岁以上注射的)。
特殊情况
- 伤口管理对于7岁或7岁以上,注射过3剂或3剂以上含破伤风类毒素疫苗的人:对于干净和轻微的伤口,使用Tdap如果距离最后一剂含破伤风类毒素的疫苗超过10年,则为Td;对于所有其他伤口,如果距离最后一剂含破伤风类毒素的疫苗超过5年,则施用Tdap或Td。Tdap是11岁或以上,以前没有接受过Tdap或其Tdap历史未知的人的首选。如果含有破伤风类毒素的疫苗适用于怀孕的青少年,使用Tdap。
- 有关详细信息,请参见www.cdc.gov/mmwr/volumes/69/wr/mm6903a5.htm.
禁忌症和注意事项
有关破伤风、白喉和无细胞百日咳(Tdap)以及破伤风、白喉(Td)的禁忌症和注意事项,请参见Tdap和Td附录
16.水痘疫苗接种
(最小年龄:12个月)
常规疫苗接种
- 12-15月龄、4-6岁时的2剂系列
- 可施用VAR或MMRV
- 第2次接种可在第1次接种后3个月开始接种(至少4周后无意中接种的剂量可视为有效)
*注意:对于12-47月龄儿童的第1剂,建议分别接种MMR和水痘疫苗。如果父母或看护者表示偏好,可以使用MMRV。
补充疫苗接种
- 确保7-18岁的人没有免疫证据(参见MMWR在www.cdc.gov/mmwr/pdf/rr/rr5604.pdf)有2个剂量系列:
- 7-12岁:常规间隔:3个月(至少4周后无意中服用的剂量可视为有效)
- 13岁及以上:常规间隔:4–8周(最小间隔:4周)
- 使用MMRV的最大年龄是12岁。
禁忌症和注意事项
有关水痘(VAR)的禁忌症和注意事项,请参见VAR附录
附录-常用疫苗禁忌症和注意事项指南
改编自中的表4-1免疫实践咨询委员会(ACIP)免疫最佳实践指南: 禁忌症和注意事项和ACIP关于用疫苗预防和控制2022-23年季节性流感的建议.
有关新冠肺炎疫苗的禁忌症和注意事项,请参见www.cdc.gov/vaccines/covid-19/clinical-considerations/interim-considerations-us.html#contraindications
| 疫苗 | 禁忌或不推荐1 | 预防措施2 |
| 灭活流感IIV4 |
|
|
| 细胞流感[(ccIIV4) Flucelvax®四价 |
|
|
| 重组流感 [(RIV4),Flublok®四价] |
|
|
| 减毒流感 [LAIV4,Flumist®四价] |
|
|
| 登革热疫苗 (DEN4CYD) |
|
|
| 白喉、破伤风、百日咳 (DTaP) 破伤风、白喉 (DT) |
|
|
| b型流感嗜血杆菌 (Hib) |
|
|
| 甲型肝炎疫苗 (HepA) |
|
|
| 乙型肝炎疫苗 (HepB) |
|
|
| 甲-乙肝联合疫苗 [HepA-HepB,(Twinrix®)] |
|
|
| HPV |
|
|
| 麻疹、腮腺炎、风疹 (MMR) (MMRV) |
|
|
| 脑膜炎球菌ACWY (MenACWY) [MenACWY-CRM(Menveo®);MenACWY-D(Menactra®);MenACWY-TT®)] |
|
|
| B群脑膜炎球菌疫苗 (MenB) |
|
|
| 肺炎球菌结合疫苗 (PCV) |
|
|
| 肺炎球菌多糖疫苗 (PPSV23) |
| |
| 脊髓灰质炎灭活疫苗 (IPV) |
|
|
| 轮状病毒疫苗 (RV) [RV1 (Rotarix®), RV5 (RotaTeq®)] |
|
|
| 破伤风、白喉和无细胞百日咳 (Tdap) 破伤风、白喉 (Td) |
|
|
| 水痘 (VAR) |
|
|
- 当出现禁忌症时,疫苗应该不被接种。Kroger A,Bahta L,Hunter P .ACIP免疫最佳实践指南.
- 当存在预防措施时,通常应推迟接种疫苗,但如果疫苗保护的益处超过不良反应的风险,则可能需要接种疫苗。Kroger A,Bahta L,Hunter P .ACIP免疫最佳实践指南.
- 疫苗接种提供者应检查FDA批准的处方信息,以获得最完整和最新的信息,包括禁忌症、警告和注意事项。看见美国许可疫苗的包装说明书.
- 有关怀孕期间意外接种乙型肝炎疫苗或乙型肝炎前病毒疫苗者的妊娠暴露登记信息,请访问heplisavbpregnancyregistry.com/或者www.prehevbrio.com/#safety.
儿童和青少年免疫计划中的疫苗*
| 疫苗 | 缩写 | 商品名称 |
| 新冠疫苗 | 1vCOV-mRNA | Comirnaty®/Pfizer- BioNTech COVID-19 Vaccine SPIKEVAX®/Moderna COVID-19 Vaccine |
| Comirnaty®/Pfizer- BioNTech COVID-19 Vaccine SPIKEVAX®/Moderna COVID-19 Vaccine | ||
| 2vCOV-mRNA | Pfizer-BioNTech COVID-19 Vaccine, Bivalent Moderna COVID-19 Vaccine, Bivalent | |
| Pfizer-BioNTech COVID-19 Vaccine, Bivalent Moderna COVID-19 Vaccine, Bivalent | ||
| 1vCOV-aPS | Novavax COVID-19 Vaccine | |
| 登革热疫苗 | DEN4CYD | Dengvaxia® |
| 白喉、破伤风和无细胞百日咳疫苗 | DTaP | Daptacel® Infanrix® |
| 白喉、破伤风疫苗 | DT | 没有商品 |
| b型流感嗜血杆菌疫苗 | Hib (PRP-T) | ActHIB® Hiberix® |
| Hib (PRP-OMP) | PedvaxHIB® | |
| 甲型肝炎疫苗 | HepA | Havrix® Vaqta® |
| 乙型肝炎疫苗 | HepB | Engerix-B® Recombivax HB® |
| 人乳头瘤病毒疫苗 | HPV | Gardasil 9® |
| 流感疫苗(灭活) | IIV4 | 多种 |
| 流感疫苗(减毒活疫苗) | LAIV4 | FluMist® Quadrivalent |
| 麻疹、腮腺炎和风疹疫苗 | MMR | M-M-R II® Priorix® |
| 脑膜炎球菌血清群A、C、W、Y疫苗 | MenACWY-D | Menactra® |
| MenACWY-CRM | Menveo® | |
| MenACWY-TT | MenQuadfi® | |
| B群脑膜炎球菌疫苗 | 菜单B-4C | Bexsero® |
| MenB-FHbp | Trumenba® | |
| 肺炎球菌结合疫苗 | PCV13 | Prevnar 13® |
| PCV15 | Vaxneuvance™ | |
| 肺炎球菌多糖疫苗 | PPSV23 | Pneumovax 23® |
| 脊髓灰质炎病毒疫苗(灭活) | IPV | IPOL® |
| 轮状病毒疫苗 | RV1 RV5 | Rotarix® RotaTeq® |
| 破伤风、白喉和无细胞百日咳疫苗 | Tdap | Adacel® Boostrix |
| 破伤风和白喉疫苗 | Td | Tenivac® TDvax™ |
| 水痘疫苗 | VAR | Varivax® |
联合疫苗
(在适当的情况下,使用联合疫苗代替单独注射)
| 疫苗 | 缩写 | 商品名称 |
| DTaP、乙型肝炎和灭活脊髓灰质炎病毒疫苗 | HepB-IPV | Pediarix® |
| 灭活脊髓灰质炎病毒b型流感嗜血杆菌疫苗 | DTaP-IPV/Hib | Pentacel® |
| DTaP和灭活脊髓灰质炎病毒疫苗 | DTaP-IPV | Kinrix® Quadracel® |
| 灭活脊髓灰质炎病毒,b型流感嗜血杆菌和乙型肝炎疫苗 | DTaP-IPV-Hib-HepB | Vaxelis® |
| 麻疹、腮腺炎、风疹和水痘疫苗 | MMRV | ProQuad® |
*如果免疫史不完整或未知,注射推荐的疫苗。不要在延长的剂量间隔内重新开始或增加疫苗系列的剂量。如果未在推荐年龄接种疫苗,请在随后的随访中接种。商品名称的使用仅用于识别目的,并不意味着ACIP或CDC的认可。
该时间表由免疫实践咨询委员会 (ACIP) 并经美国疾病控制和预防中心(CDC),美国儿科学会(APP),美国家庭医师学会(AAFP),美国妇产科医师学会(ACOG),美国护士助产士学会(ACNM),美国医师协会学会(AAPA),以及美国儿科护理从业者协会(NAPNAP).
自2023年2月以来,新的疫苗和其他免疫制剂被添加到时间表中(见附录)
| 疫苗和其他免疫制剂 | 缩写 | 商品名称 |
|---|---|---|
| RSV单克隆抗体(Nirsevimab) | RSV-单克隆抗体 | Beyfortus™ |
| 肺炎球菌结合疫苗 | PCV20 | Prevnar 20™ |
*如果免疫史不完整或未知,注射推荐的疫苗。不要在延长的剂量间隔内重新开始或增加疫苗系列的剂量。如果未在推荐年龄接种疫苗,请在随后的随访中接种。商品名称的使用仅用于识别目的,并不意味着ACIP或CDC的认可。
†新冠肺炎、脊髓灰质炎病毒、流感和肺炎球菌疫苗有新的或更新的ACIP建议。详情请见附录。
ACIP建议的儿童和青少年免疫规划变更的综合摘要可在2023年2月10日MMWR.
报告
- 向您所在的州或当地卫生部门报告可通过疫苗预防的疾病或疫情的疑似病例
- 疫苗不良事件报告系统(VAERS)的临床重大不良事件www.vaers.hhs.gov外部图标或(800-822-7967)
问题或意见
接触www.cdc.gov/cdc-info或800-CDC-INFO (800-232-4636),英语或西班牙语,美国东部时间周一至周五上午8点至下午8点,节假日除外。
有用的信息
上次审阅时间:2023年4月27日
来源:国家免疫和呼吸疾病中心
2023年10月4日 第1次更新
Hits: 50


